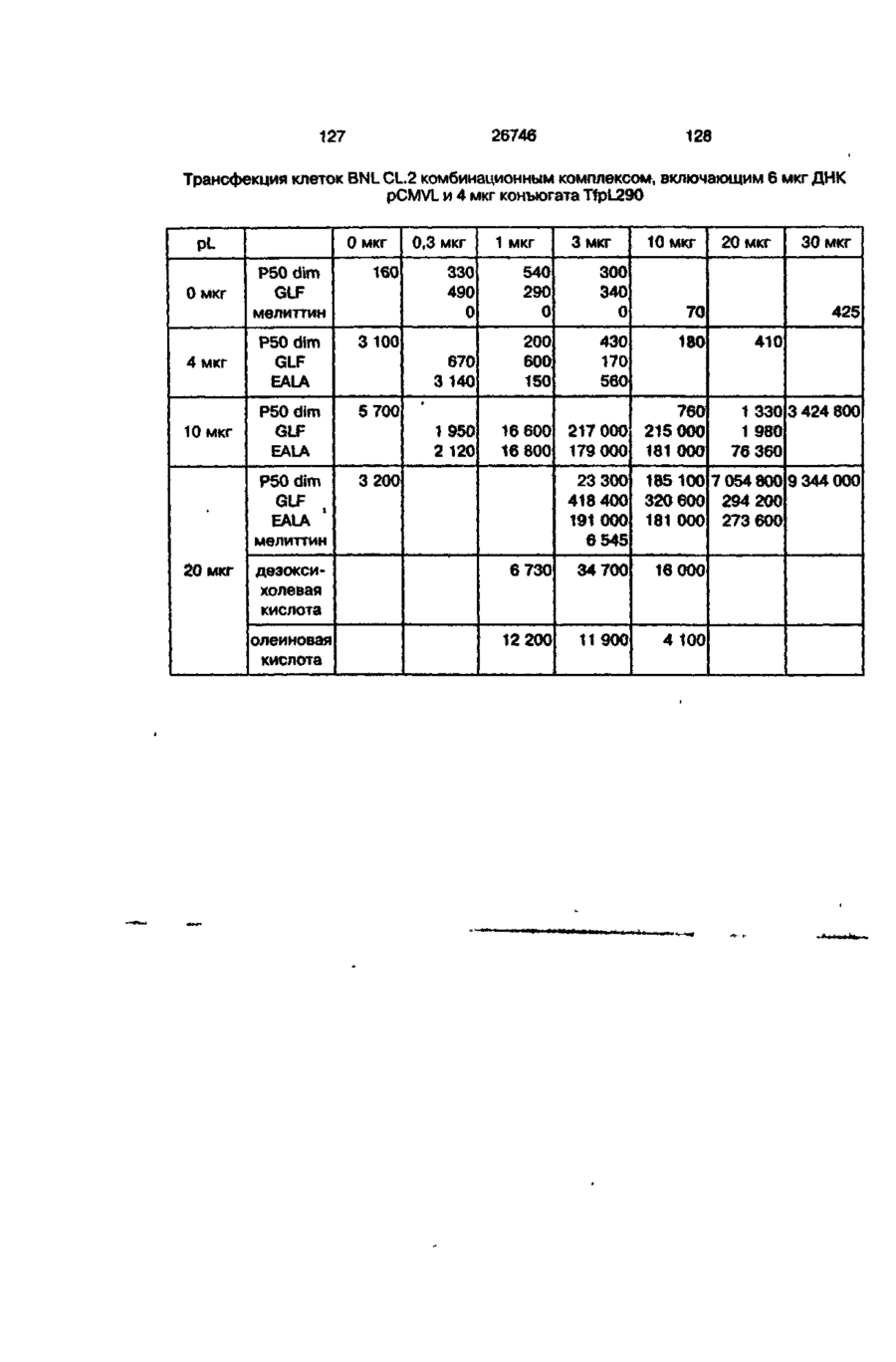
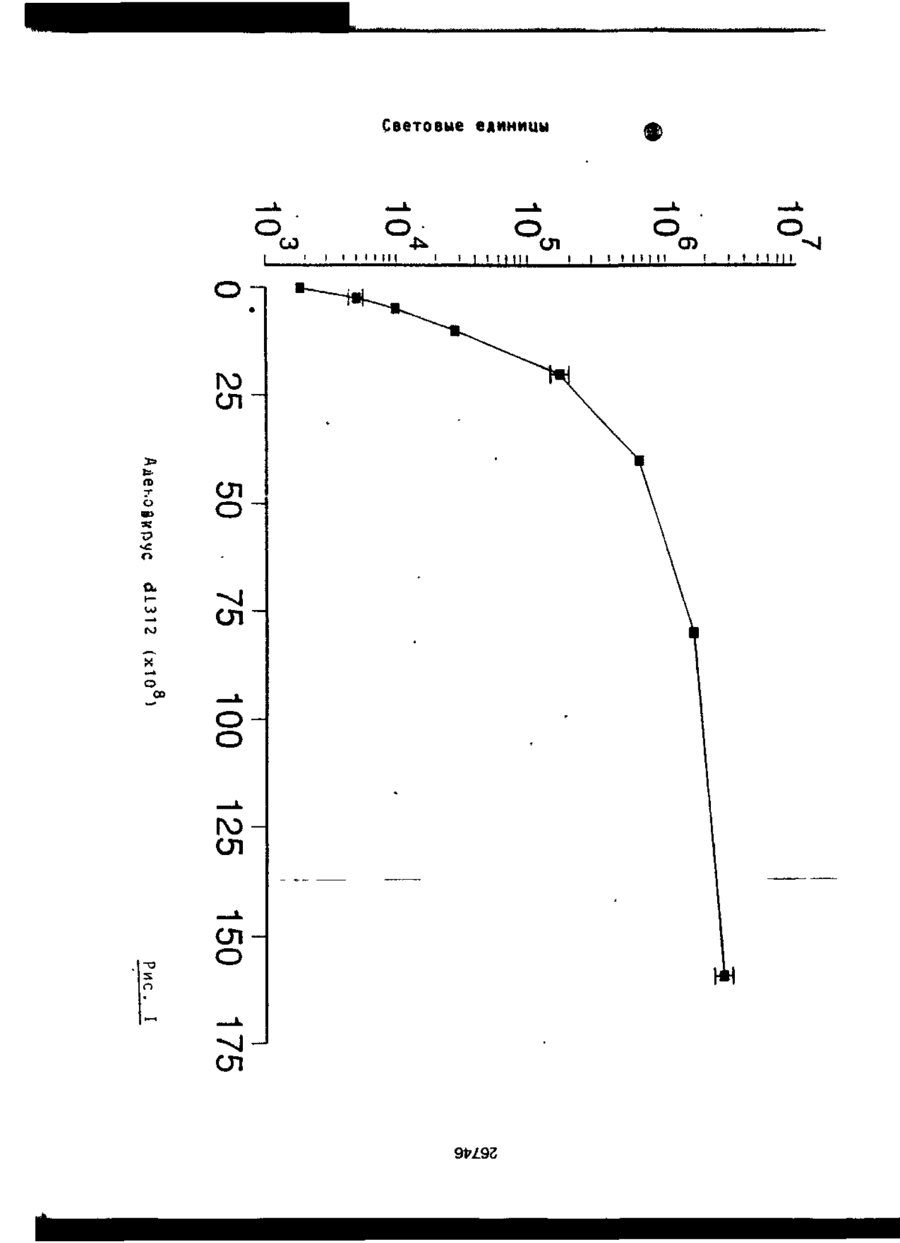
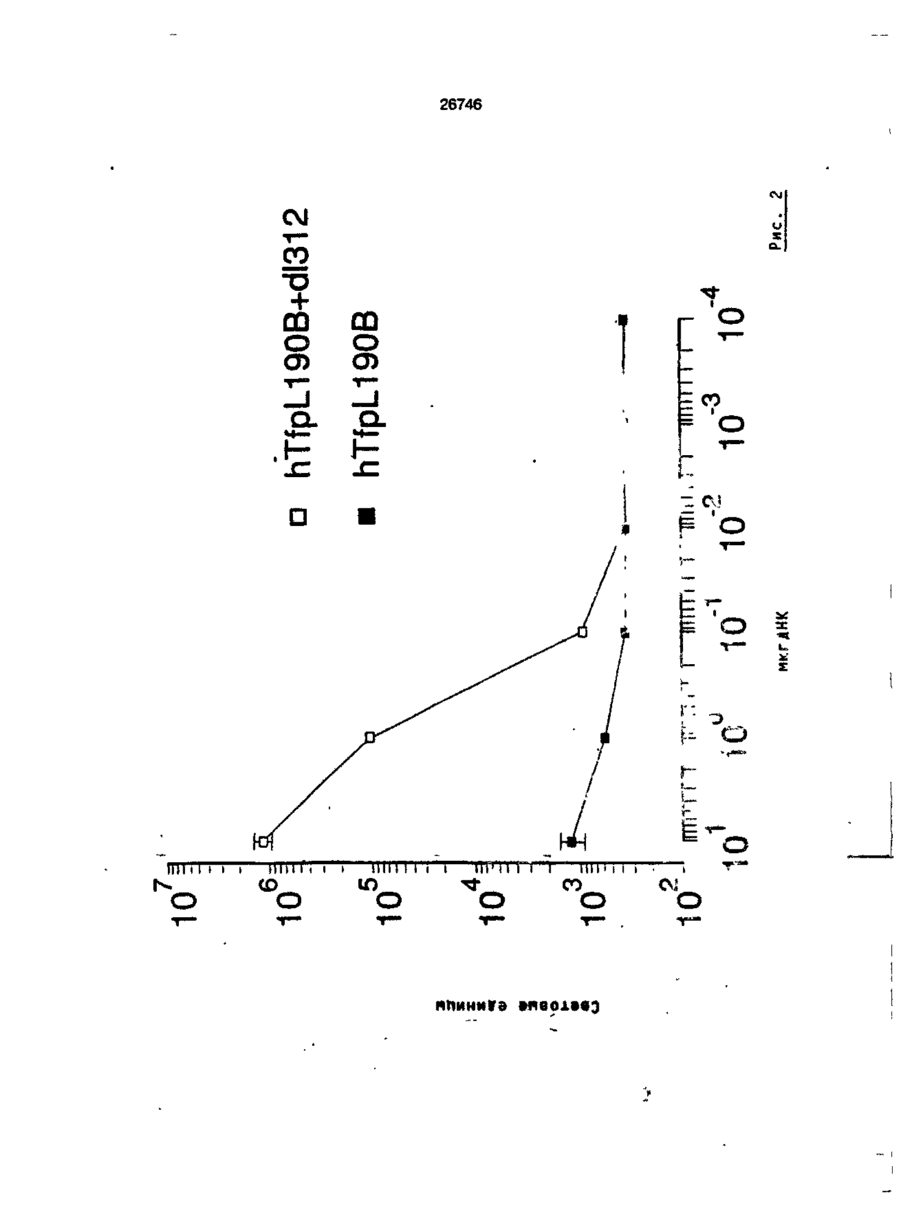
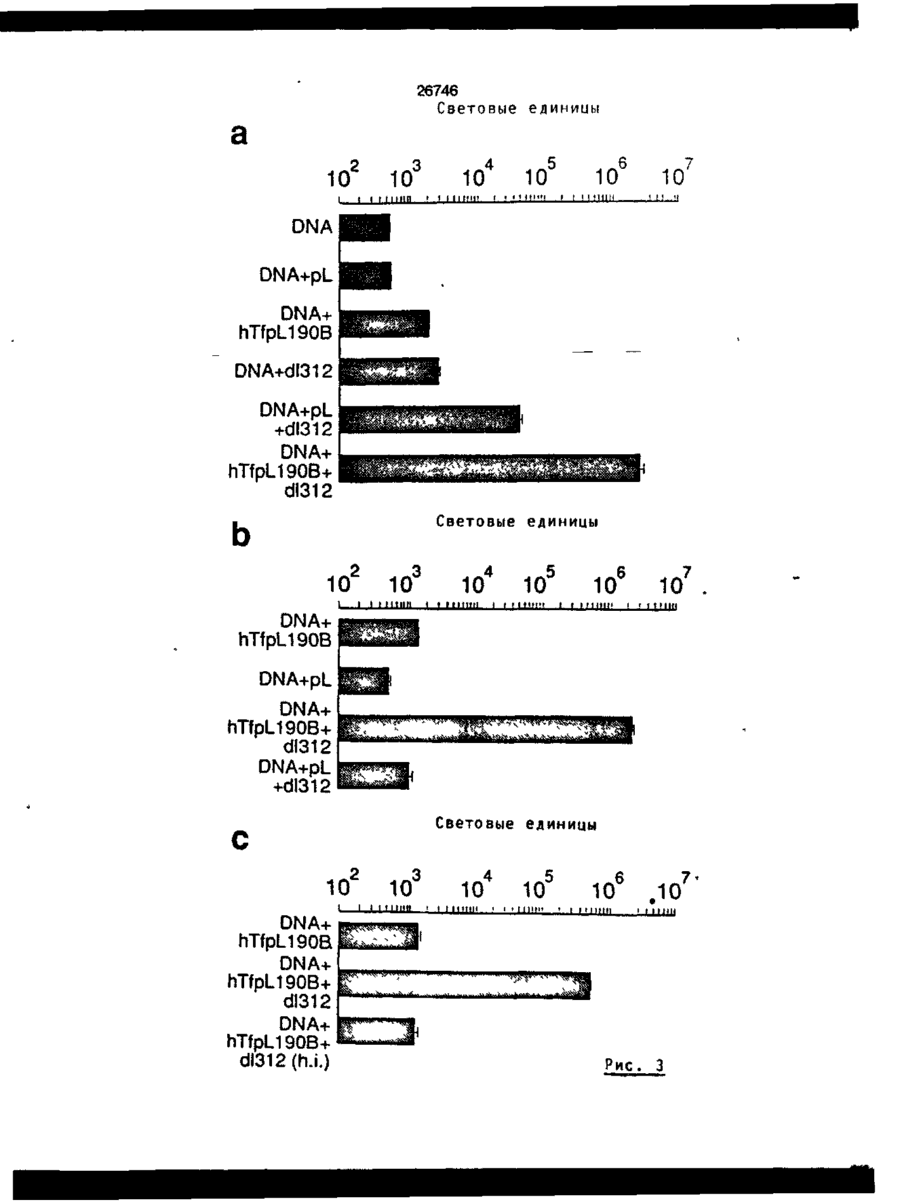
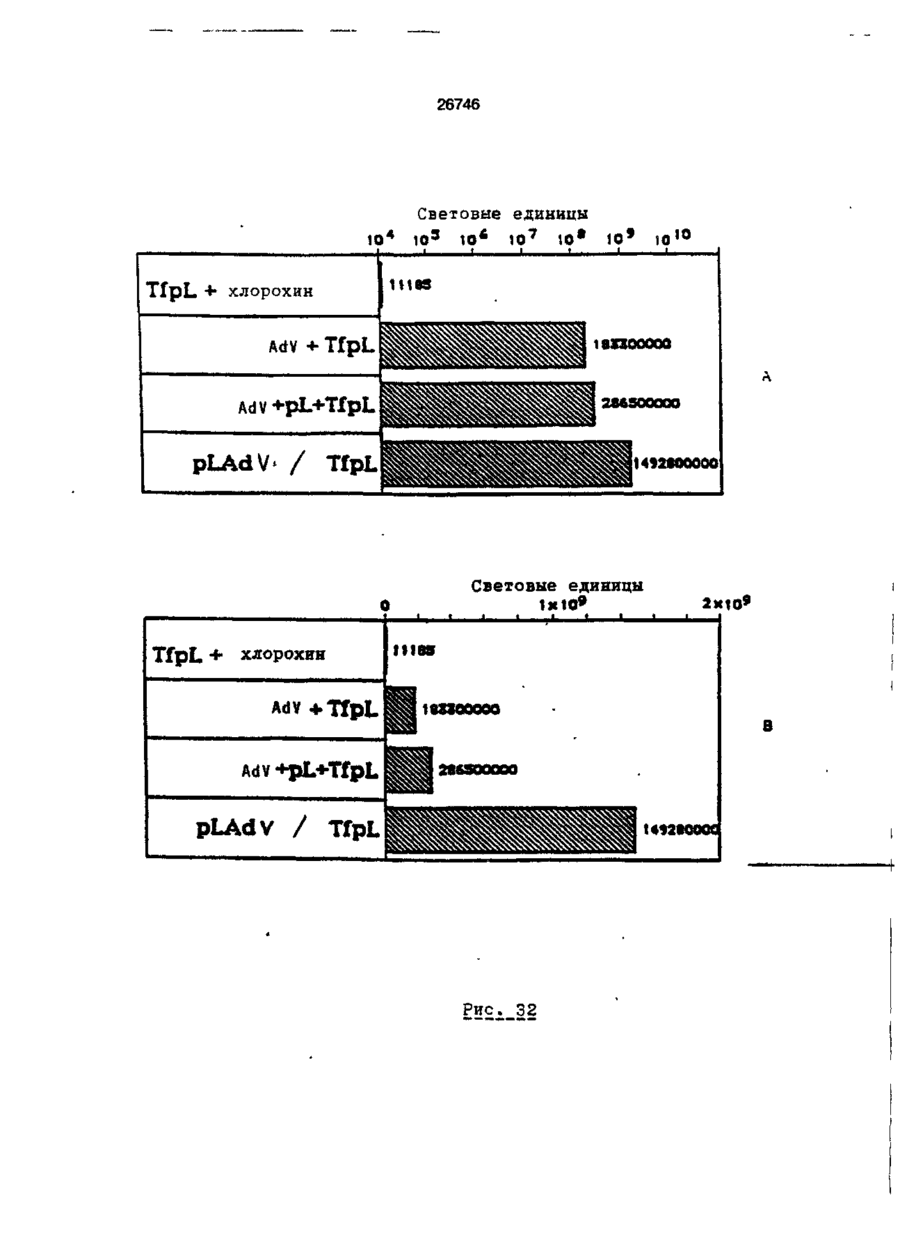
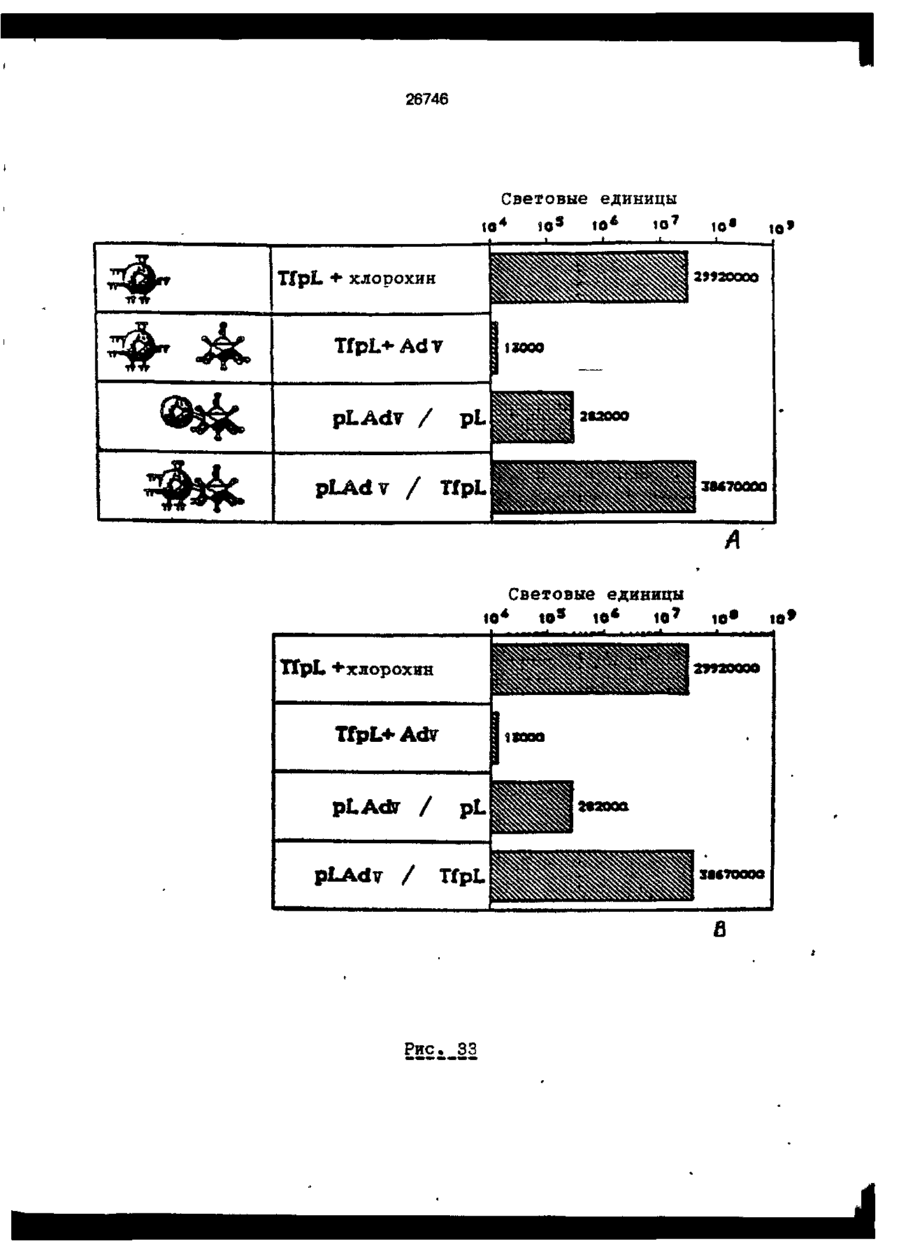
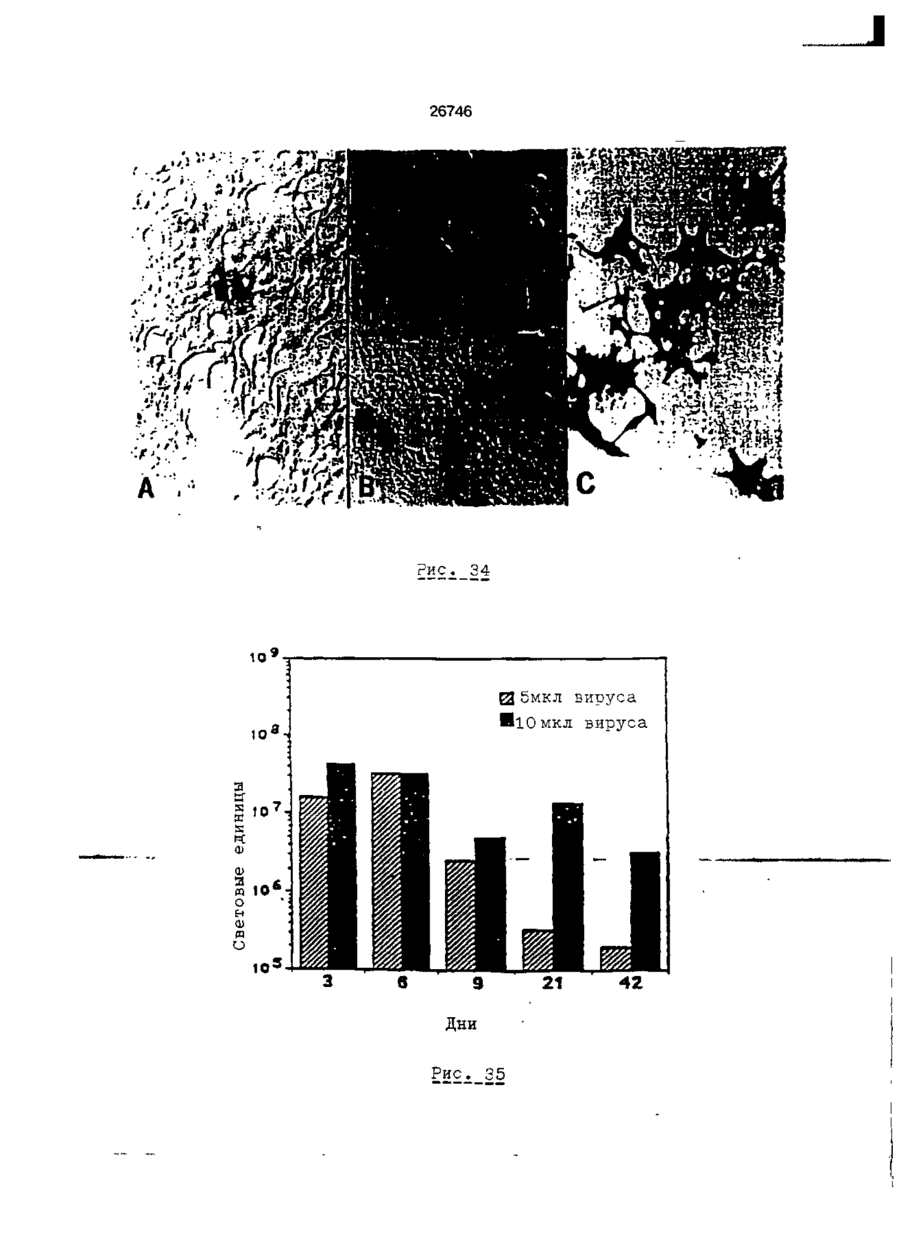
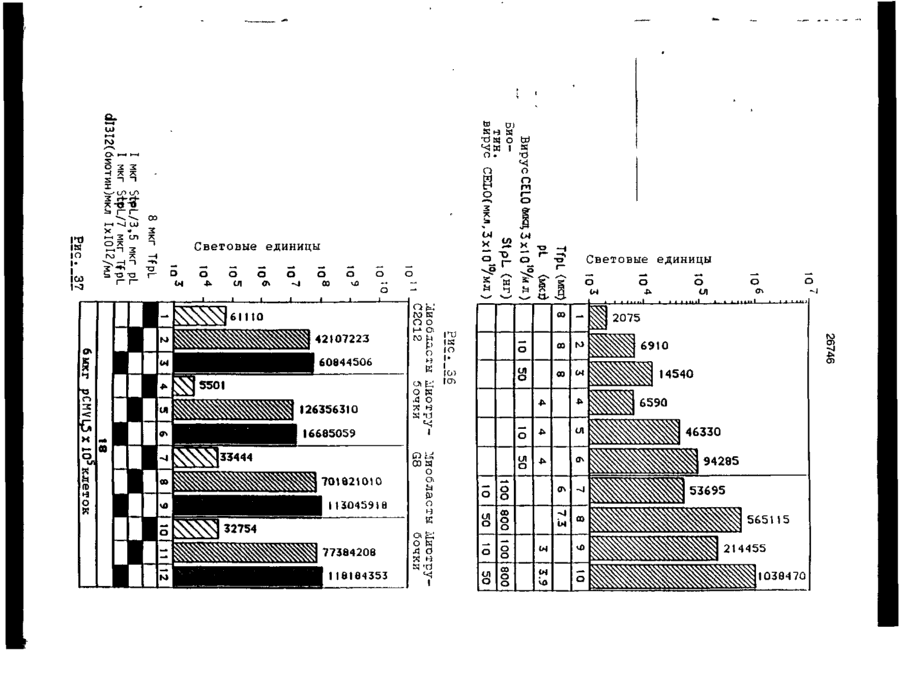
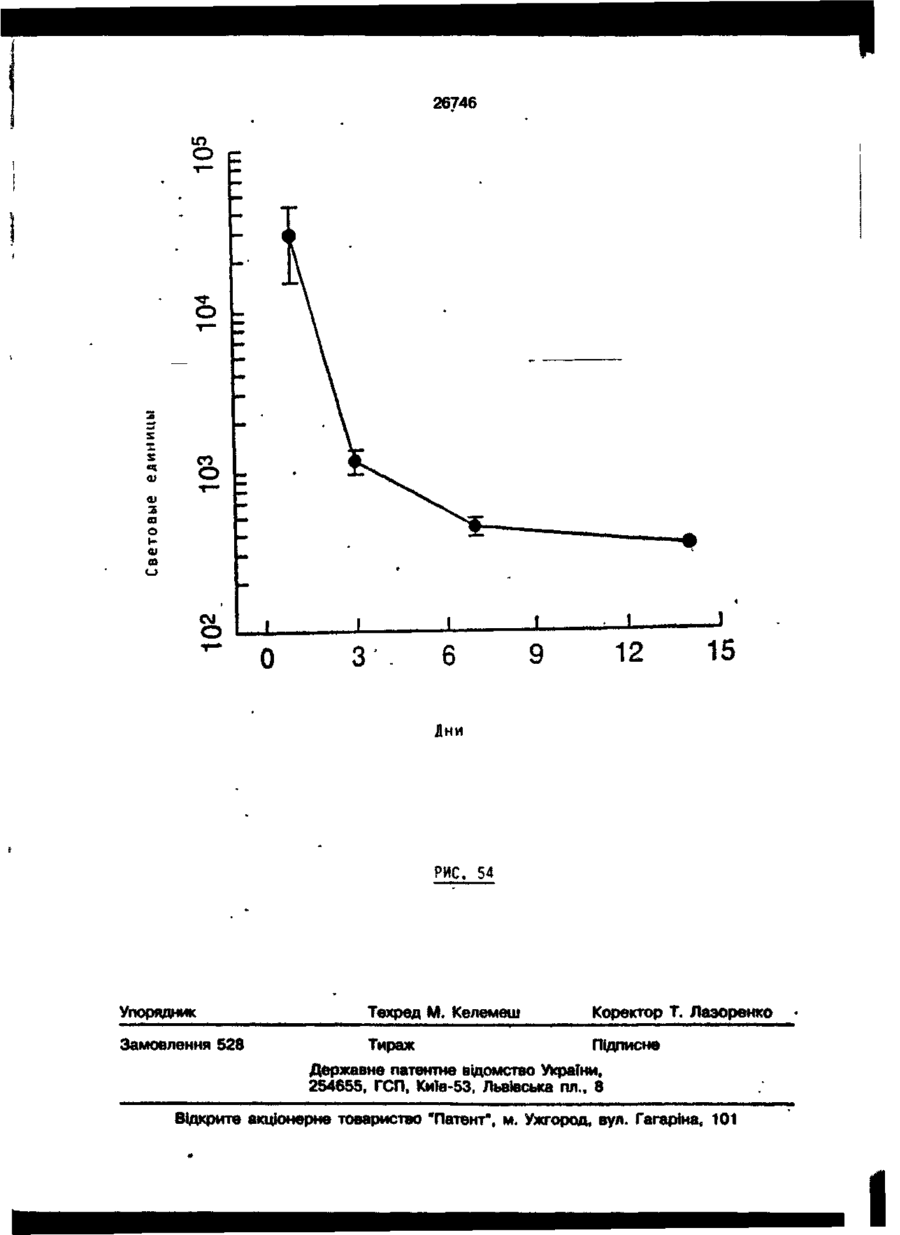
Трансфекційна композиція для вищих еукаріотичних клітин
Номер патенту: 26746
Опубліковано: 12.11.1999
Автори: ВІРНШТІЛЬ Макс, Оберхаузер Бернд, КОТТЕН Метт, Карієл Дейвід, Цатлоукал Курт, ВАГНЕР Ернст, ПЛАНК Крістіан
Формула / Реферат
1. Трансфекционная композиция для высших эукариотических клеток, включающая комплекс нуклеиновой кислоты и вещества со средством для нуклеиновой кислоты, отличающаяся тем, что она дополнительно содержит эндосомолитический агент в эффективном количестве.
2. Трансфекционная композиция для высших эукариотических клеток по п.1, отличающаяся тем, что вещество со сродством для нуклеиновой кислоты связано с содействующим поглощению клеткой фактором.
3. Трансфекционная композиция для высших эукариотических клеток по п.1, отличающаяся, тем, что эндосомолитический агент представляет собой вирус или компонент вируса.
4. Трансфекционная композиция для высших эукариотических клеток по п.1, отличающаяся тем, что эндосомолитический агент включает связывающий нуклеиновую кислоту домен.
5. Трансфекционная композиция для высших эукариотических клеток по п.1, отличающаяся тем, что эндосомолитический агент представляет собой компонент комплекса нуклеиновой кислоты и вещества со сродством для нуклеиновой кислоты.
6. Трансфекционная композиция для высших эукариотических клеток по п.5, отличающаяся тем, что комплекс включает содействующий поглощению клеткой фактор.
7. Трансфекционная композиция для высших эукариотических клеток по п.6, отличающаяся тем, что содействующий поглощению клеткой фактор связан с веществом со сродством для нуклеиновой кислоты.
8. Трансфекционная композиция для высших эукариотических клеток по п.5, отличающаяся тем, что эндосомолитический агент ковалентне связан с веществом со сродством для нуклеиновой кислоты.
9. Трансфекционная композиция для высших эукариотических клеток по п.5, отличающаяся тем, что эндосомолитический агент нековалентно связан с веществом со сродством для нуклеиновой кислоты.
10. Трансфекционная композиция для высших эукариотических клеток по п.9, отличающаяся тем, что эндосомолитический агент связан с веществом со сродством для нуклеиновой кислоты через биотиново-стрептавидиновый мостик.
11. Трансфекционная композиция для высших эукариотических клеток по п.9, отличающаяся тем, что эндосомолитический агент ионным путем связан с веществом со сродством для нуклеиновой кислоты.
12. Трансфекциониая композиция для высших эукариотических клеток по п.4, отличающаяся тем, что эндосомолитический агент связан с нуклеиновой кислотой непосредственно через связывающий нуклеиновую кислоту домен.
13. Трансфекционная композиция для высших эукариотических клеток по п.3, отличающаяся тем, что в качестве эндосомолитического агента содержит вирус, который является инфекционным для индивидуума, отличного от человека.
14 Трансфекционная композиция для высших эукариотических клеток по п.3, отличающаяся тем, что в качестве эндосомолитического агента содержит аденовирус.
15 Трансфекционная композиция для высших эукариотических клеток по п.14, отличающаяся тем, что аденовирус является птичьим.
16. Трансфекционная композиция для высших эукариотических клеток по п.15, отличающаяся тем, что аденовирус является куриным аденовирусом CELO.
17. Трансфекционная композиция для высших эукариотических клеток по п.14, отличающаяся тем, что аденовирус является мутантом.
18. Трансфекционная композиция для высших эукариотических клеток по п.17, отличающаяся тем, что аденовирус является неспособным к репликации мутантом.
19. Трансфекционная композиция для высших эукариотических клеток по п.18, отличающаяся тем, что аденовирус имеет по крайней мере одну мутацию и/или делецию в зоне E1A.
20. Трансфекционная композиция для высших эукариотических клеток по п.14, отличающаяся тем, что аденовирус является инактивированным.
21. Трансфекционная композиция для высших эукариотических клеток по п.20, отличающаяся тем, что аденовирус является инактивированным коротковолновыми УФ-лучами.
22. Трансфекционная композиция для высших эукариотических клеток по п.20, отличающаяся тем, что аденовирус является инактивированным обработкой УФ-лучами и псораленом.
23. Трансфекционная композиция для высших эукариотических клеток по п.20, отличающаяся тем, что аденовирус является инактивированным формальдегидом.
24. Трансфекционная композиция для высших эукариотических клеток по п.3, отличающаяся тем, что в качестве эндосомолитического агента содержит по крайней мере один протеин аденовируса.
25. Трансфекционная композиция для высших эукариотических клеток по п.3, отличающаяся тем, что в качестве эндосомолитического агента содержит пикорнавирус.
26. Трансфекционная композиция для высших эукариотических клеток по п.25, отличающаяся тем, что в качестве пикорнавируса содержит риновирус.
27. Трансфекционная композиция для высших эукариотических клеток по п.26, отличающаяся тем, что риновирус является инактивированным.
28. Трансфекционная композиция для высших эукариотических клеток по п.3, отличающаяся тем, что в качестве эндосомолитического агента содержит эндосомолитический вирусный пептид, который может быть модифицирован.
29. Трансфекционная композиция для высших эукариотических клеток по п.28, отличающаяся тем, что эндосомолитический вирусный пептид представляет собой пептид гемагглютинина HA2 гриппа.
30. Трансфекционная композиция для высших эукариотических клеток по п.29, отличающаяся тем, что пептид имеет последовательность Gly-Leu-Phe-Glu-Ala-Ile-Gly-Phe-Ile-Glu-Asn-Gly-Trp-Glu-Gly-Met-Ile-Asp-Gly-Gly-Gly-Cys.
31. Трансфекционная композиция для высших эукариотических клеток по п.29, отличающаяся тем, что пептид имеет последовательность Gly-Leu-Phe-Gly-Ala-Ile-Ala-Gly-Phe-Ile-Glu-Asn-G;y-Trp-Glu-Gly-Met-Ile-Asp-Gly-Gly-Gly-Cys.
32. Трансфекционная композиция для высших эукариотических клеток по п.1, отличающаяся тем, что эндосомолитический пептид представляет собой невирусный естественный или синтетический пептид, который может быть модифицирован.
33. Трансфекционная композиция для высших эукариотических клеток по п.28 или 32, отличающаяся тем, что пептид имеет связывающий нуклеиновую кислоту домен.
34. Трансфекционная композиция для высших эукариотических клеток по п.2 или 6, отличающаяся тем, что содействующим поглощению клеткой фактором является трансферин.
35. Трансфекционная композиция для высших эукариотических клеток по п.2 или 6, отличающаяся тем, что содействующим поглощению клеткой фактором является лиганд для гепатоцитов.
36. Трансфекционная композиция для высших эукариотических клеток по п.2 или 6, отличающаяся тем, что содействующим поглощению клеткой фактором является лиганд для рецептора азиалогликопротеина.
37. Трансфекционная композиция для высших эукариотических клеток по п.2 или 6, отличающаяся тем, что содействующим поглощению клеткой фактором является тетра-галактозированный полилизин.
38. Комплекс нуклеиновой кислоты, пригодный в качестве компонента трансфекционной композиции по любому из пп.4 - 37, отличающийся тем, что он включает по крайней мере одну нуклеиновую кислоту, подлежащую экспрессии в клетке, эндосомолитический агент, который первоначально имеет связывающий нуклеиновую кислоту домен или связан с веществом со сродством для нуклеиновой кислоты.
39. Комплекс по п.38, отличающийся тем, что он дополнительно содержит содействующий поглощению клеткой фактор, связанный с веществом со сродством для нуклеиновой кислоты.
40. Комплекс по п.38, отличающийся тем, что нуклеиновая кислота является терапевтически активной.
41. Комплекс по п.40, отличающийся тем, что нуклеиновая кислота включает по меньшей мере одну молекулу ДНК, активную в терапии генами.
42. Комплекс по п.41, отличающийся тем, что молекула ДНК кодирует цитокин.
43. Комплекс по п.40, отличающийся тем, что нуклеиновая кислота имеет нуклеотидную последовательность, позволяющую транскрипцию молекулы РНК, которая специфично тормозит функции клетки.
44. Комплекс по п.38, отличающийся тем, что вещество со сродством для нуклеиновой кислоты представляет собой органический поликатион.
45. Комплекс по п.44, отличающийся тем, что поликатионом является полилизин.
46. Комплекс по пп.38 и 39, отличающийся тем, что эндосомолитический агент и содействующий поглощению клеткой фактор связаны с тем же веществом со сродством для нуклеиновой кислоты.
47. Комплекс по п.46, отличающийся тем, что эндосомолитический агент и содействующий поглощению клеткой фактор связаны с полилизином.
48. Комплекс по п.47, отличающийся тем, что он дополнительно включает нековалентно связанный полилизин.
49. Конъюгат, пригодный в качестве компонента комплекса по любому из пп.38 - 48, отличающийся тем, что он включает эндосомолитический агент, связанный с веществом со сродством для нуклеиновой кислоты.
50. Конъюгат по п.49, отличающийся тем, что эндосомолитический агент ковалентно связан с веществом со сродством для нуклеиновой кислоты.
51. Конъюгат по п.49, отличающийся тем, что эндосомолитический агент нековалентно связан с веществом со сродством для нуклеиновой кислоты.
52. Конъюгат по п.51, отличающийся тем, что эндосомолитический агент связан с веществом через биотиново-стрептавидиновый мостик.
53. Конъюгат по п.51, отличающийся тем, что эндосомолитический агент ионным путем связан с веществом.
54. Конъюгат по п.49, отличающийся тем, что эндосомолитический агент представляет собой вирус или компонент вируса.
55. Конъюгат по п.54, отличающийся тем, что вирус является инфекционным для индивидуума, отличного от человека.
56. Конъюгат по п.54, отличающийся тем, что вирусомявляется аденовирус.
57. Конъюгат по п.54, отличающийся тем, что аденовирус является птичьим.
58. Конъюгат по п.57, отличающийся тем, что аденовирус является куриным аденовирусом CELO.
59. Конъюгат по п.56, отличающийся тем, что аденовирус представляет собой мутант.
60. Конъюгат по п.59, отличающийся тем, что аденовирус представляет собой неспособный к репликации мутант.
61. Конъюгат по п.60, отличающийся тем, что аденовирус имеет по меньшей мере одну мутацию и/или делецию в зоне E1A.
62. Конъюгат по п.56, отличающийся тем, что аденовирус является инактивированным.
63. Конъюгат по п.62, отличающийся тем, что аденовирус является инактивированным коротковолновыми УФ-лучами.
64. Конъюгат по п.62, отличающийся тем, что аденовирус является инактивированным обработкой ультрафиолетовым светом и псораленом.
65. Конъюгат по п.62, отличающийся тем, что аденовирус является инактивированным формальдегидом.
66. Конъюгат по п.54, отличающийся тем, что компонент вируса представляет, собой протеин аденовируса.
67. Конъюгат по п.54, отличающийся тем, что вирус представляет собой пикорнавирус.
68. Конъюгат по п.67, отличающийся тем, что в качестве пикорнавируса содержит риновирус.
69. Конъюгат по п.49, отличающийся тем, что эндосомолитический агент представляет собой эндосомолитический вирусный пептид, который может быть модифицирован.
70. Конъюгат по п.69, отличающийся тем, что эндосомолитический вирусный пептид представляет собой пептид гемагглютинина HA2 гриппа.
71. Конъюгат по п.70, отличающийся тем что пептид имеет последовательность Gly-Leu-Phe-Glu-Ala-Ile-Gly-Phe-Ile-Glu-Asn-Gly-Trp-Glu-Gly-Met-Ile-Asp-Gly-Gly-Gly-Cys.
72. Конъюгат по п.70, отличающийся тем, что пептид имеет последовательность Gly-Leu-Phe-Gly-Ala-Ile-Ala-Gly-Phe-Ile-Glu-Asn-Gly-Trp-Glu-Gly-Met-Ile-Asp-Gly-Gly-Gly-Cys.
73. Конъюгат по п.49, отличающийся тем, что эндосомолитический агент представляет собой невирусный естественный или синтетический пептид, который может быть модифицирован.
74. Эндосомолитический пептид, пригодный в качестве компонента трансфекционной композиции по п.33, отличающийся тем, что включает эндосомолитический домен и связывающий нуклеиновую кислоту домен.
75. Эндосомолитический пептид по п.74, отличающийся тем, что связывающий нуклеиновую кислоту домен представляет собой хвост олиголизина.
Приоритет по заявке установлен:
От 30.09.91 по пп.5, 8 - 10, 22, 39, 46 - 48, 50 - 52, 54, 56, 59 - 64, 69 - 71 по дате подачи заявки 07/767788.
От 30.09.91 по пп.2, 3, 6, 7, 14, 17 - 21, 23, 28 - 30, 34, 36, 40, 41, 43 - 45, 65, 66, 66 по дате подачи заявки 07/768039.
От 07.04.92 по пп.13, 15, 16, 37, 55, 57, 58, 72 по дате подачи заявки 07/864759.
От 02.09.92 по пп.1, 4, 11, 12, 24, 25 - 27, 31 - 33, 35, 38, 42, 49, 53, 68, 73 - 75 по дате подачи заявки 07/937788.
Текст
1. Трансфекционная композиция для высших зукариотических клеток, включающая комплекс нуклеиновой кислоты и вещества со средством для нуклеиновой кислоты, о т л и ч а ю щ а я с я тем, что она дополнительно содержит эндосомолитический агент в эффективном количестве. 2. Трансфекционная композиция для высших зукариотических клеток по п. 1, о т л и ч а ю щ а я с я тем, что вещество со сродством для нуклеиновой кислоты связано с содействующим поглощению клеткой фактором. 3. Трансфекционная композиция для высших зукариотических клеток по п. 1, о т л и ч а ю щ а я с я тем, что эндосомолитический агент представляет собой вирус или компонент вируса, 4. Трансфекционная композиция для высших зукариотических клеток по п. 1, о т л и ч а ю щ а я с я тем, что эндосомолитический агент включает связывающий нуклеиновую кислоту домен. 5. Трансфекционная композиция для высших зукариотических клеток по п. 1, о т л и ч а ю щ а я с я тем, что эндосомолитический агент представляет собой компонент комплекса нуклеиновой кислоты и вещества со сродством для нуклеиновой кислоты. 6. Трансфекционная композиция для высших зукариотических клеток по п. 5, о т л и ч а ю щ а я с я тем, что комплекс включает содействующий поглощению клеткой фактор. 7. Трансфекционная композиция для высших зукариотических клеток по п. 6, о т л и ч а ю щ а я с я тем, что содействующий поглощению клеткой фактор связан с веществом со сродством для нуклеиновой кислоты. 8. Трансфекционная композиция для высших зукариотических клеток по п. 5, о т л и ч а ю щ а я с я т е м , что эндосомолитический агент ковалентно связан с веществом со сродством для нуклеиновой кислоты. 9. Трансфекционная композиция для высших зукариотических клеток по п. 5, о т л и ч а ю щ а я с я тем, что эндосомолитический агент нековалентно связан с веществом со сродством для нуклеиновой кислоты. 10. Трансфекционная композиция для высших зукариотических клеток по п. 9, о т л и ч а ю щ а я с я тем, что эндосомолитический агент связан с веществомсо сродством для нуклеиновой кислоты через биотиново-стрегпгавидиновый мостик. 11. Трансфекционная композиция для высших зукариотических клеток по п. 9 , о т л и ч а ю щ а я с я тем, что эндосомолитический агент ионным путем связан с веществом со сродством для нуклеиновой кислоты. о 26746 24. Трансфекционная композиция для 12. Трансфекционная композиция для высших эукариотических клеток по п. 3, высших эукариотических клеток по п. 4, о т л и ч а ю щ а я с я тем, что в о т л и ч а ю щ а я с я тем, что качестве эндосомолитического агента соэндосомолитическии агент связан с нукдержит по крайней мере один протеин леиновой кислотой непосредственно через аденовируса. связывающий нуклеиновую кислоту домен. 25. Трансфекционная композиция для 13. Трансфекционная композиция для высших эукариотических клеток по п. 3, высших эукариотических клеток по п. 3, о т л и ч а ю щ а я с я тем, что в о т л и ч а ю щ а я с я тем, что в » качестве эндосомолитического агента сокачестве эндосомолитического агента содержит пикорнавирус. держит вирус, который является инфек26. Трансфекционная композиция^для ционным для индивидуума, отличного от высших эукариотических клеток по п. 25, человека. о т л и ч а ю щ а я с я тем, что в качестве 14. Трансфекционная композиция для пикорнавируса содержит риновирус. высших эукариотических клеток по п. 3, 27. Трансфекционная композиция для о т л и ч а ю щ а я с я тем, что в высших эукариотических клеток по п. 26, качестве эндосомолитического агента соо т л и ч а ю щ а я с я тем, что держит аденовирус. риновирус является инактивированным. 15. Трансфекционная композиция для 28. Трансфекционная композиция для высших эукариотических клеток по п. 14, высших эукариотических клеток по п. 3, о т л и ч а ю щ а я с я тем, что о т л и ч а ю щ а я с я тем, что в аденовирус является птичьим. качестве эндосомолитического агента со16. Трансфекционная композиция для держит эндосомолитическии вирусный пепвысших эукариотических клеток по п. 15, ' тид, который может быть модифицирован. о т л и ч а ю щ а я с я тем, что 29. Трансфекционная композиция для аденовирус является куриным аденовирувысших эукариотических клеток по п. 28, сом CELO. о т л и ч а ю щ а я с я тем, что 17. Трансфекционная композиция для эндосомолитическии вирусный пептид высших эукариотических клеток по п. 14, представляет собой п е т ид гемагглютио т л и ч а ю щ а я с я 4 тем, что . нина НА2 гриппа. аденовирус является мутантом. 18. Трансфекционная композиция для 30. Трансфекционная композиция для высших эукариотических клеток по п. 17, высших эукариотических клеток по п. 29, о т л и ч а ю щ ая с я тем, что о т л и ч а ю щ а я с я тем, что пептид аденовирус является неспособным к репимеет последовательность Gly-Leu-Pheликации мутантом. Gtu-Ala-He-Gly-Phe-lle-Glu-Asn-Gly-Trp-Glu19. Трансфекционная композиция для Gly-Met-lle-Asp-Gly-Gly-Gly-Cys. высших эукариотических клеток по п. 18, 31. Трансфекционная композиция для о т л и ч а ю щ а я с я тем, что высших эукариотических клеток по п. 29, аденовирус имеет по крайней мере одну о т л и ч а ю щ а я с я тем, что пептид мутацию и/или делецию в зоне ЕТА. имеет последовательность Gly-Leu-Phe20. Трансфекционная композиция для * G!y-Ala-lle-Ala-Gly-Phe-He-Glu-Asn-Gly-Trpвысших эукариотических клеток по п. 14, Gtu-Gty-Met-lle-Asp-Gly-Gly-Gly-Cys. о т л и ч а ю щ а я с я тем, что 32. Трансфекционная композиция для аденовирус является инактивированным. высших эукариотических клеток по п.1, 21. Трансфекционная композиция для - о т л и ч а ю щ а я с я тем, что высших эукариотических клеток по п. 20, эндосомолитическии пептид представляет о т л и ч а ю щ а я с я тем, что собой невирусный естественный или синаденовирус является инактивированным .тетический пептид, который может быть коротковолновыми УФ-лучами. модифицирован. 33. Трансфекционная композиция для 22. Трансфекционная композиция для высших эукариотических клеток по п. 28 высших эукариотических клеток по п. 20, или 32, о т л и ч а ю щ а я с я тем, о т л и ч а ю щ а я с я тем, что что пептид имеет связывающий нуклеиноаденовирус является инактивированным обвую кислоту домен. работкой Уф-лучами и псораленом. 34. Трансфекционная композиция для 23. Трансфекционная композиция для высших эукариотических клеток по п. 2 высших эукариотических клеток по п. 20, или 6, о т л и ч а ю щ а я с я тем, о т л и ч а ю щ а я с я тем, что что содействующим поглощению клеткой аденовирус является инактивированным фактором является трансферин. формальдегидом. ж 26746 35. Трансфекционная композиция для высших эукариотических клеток по п. 2 или 6, о т л и ч а ю щ а я с я тем, что содействующим поглощению клеткой фактором является лиганд для гепатоцитов. 36. Трансфекционная композиция для высших эукариотических клеток по п. 2 или 6, о т л и ч а ю щ а я с я тем, что содействующим поглощению клеткой фактором является лиганд для рецептора азиалогликопротеина. 37. Трансфекционная композиция для высших эукариотических клеток по п. 2 или 6» о т л и ч а ю щ а я с я тем, что содействующим поглощению клеткой фактором является тетра-галактозированный полилизин. 38. Комплекс нуклеиновой кислоты, пригодный в качестве компонента трансфекционной композиции по любому из пп. 4-37, о т л и ч а ю щ и й с я тем, что он включает по крайней мере одну нуклеиновую кислоту, подлежащую экспрессии в клетке, эндосомолитический агент, который первоначально имеет сея-* зывающий нуклеиновую кислоту домен или связан с веществом со сродством для нуклеиновой кислоты. 39. Комплекс по п. 38, о т л и ч а» ю щ и й с я тем, что он дополнительно содержит содействующий поглощению клеткой фактор, связанный с веществом со сродством для нуклеиновой кислоты. 40. Комплекс по п. 38, о т л и ч а ю щ и й с я тем, что нуклеиновая кислота является терапевтически активной. 4 1 . Комплекс по п. 40, о т л и ч аю щ и й с я тем, что нуклеиновая кислота включает по меньшей мере одну молекулу ДНК, активную в терапии генами. 42. Комплекс по п. 4 1 , о т л и ч а ю щ и й с я тем, что молекула ДНК кодирует цитокин. 43. Комплекс по п. 40, о т л и ч а ю щ и й с я тем, что нуклеиновая кислота имеет нуклеотидную последовательность, позволяющую транскрипцию молекулы РНК, которая специфично тормозит функции клетки. 44. Комплекс по п. 38, о т л и ч аю щ и й с я тем, что вещество со сродством для нуклеиновой кислоты представляет собой органический поликатион, 45. Комплекс по п. 44, о т л и ч а ю щ и й с я тем с что поликатионом является полилизин. 46. Комплекс по пп. 38 и 39 6 о т л и ч а ю щ и й с я тем, что эндосо молитический агент и содействующий поглощению клеткой фактор связаны с тем же веществом со сродством для нуклеиновой кислоты. 47. Комплекс по п. 46, о т л и ч а ю щ и й с я тем, что эндосомолитический агент и содействующий поглощению клеткой фактор связаны с полилизином. 48. Комплекс по п. 47, о т л и ч а ю щ и й с я тем, что он дополнительно включает нековалентно связанный полилизин. 49. Конъюгат, пригодный в качестве компонента комплекса по любому из пп. 38 - 48, о т л и ч а ю щ и й с я тем, что он включает эндосомолитический агент, связанный с веществом со сродством ддя нуклеиновой кислоты. 50. Конъюгат по п. 49, о т л и ч а ю щ и й с я тем, что эндосомолитический агент ковалентно связан с веществом со сродством для нуклеиновой кислоты. 51. Конъюгат по п. 49, о т л и ч а ю щ и й с я тем, что эндосомолитический агент нековалентносвязан с веществом со сродством для нуклеиновой кислоты. 52. Конъюгат по п. 5 1 , о т л и ч а ю щ и й с я тем, что эндосомолитический агент связан с веществом через биотиново-стрептавидиновый мостик. 53. Конъюгат по п. 5 1 , о т л и ч а ю щ и й с я тем, что эндосомолитический агент ионным путем связан с веществом. 54. Конъюгат по п. 49, о т л и ч а ю щ и й с я тем, что эндосомолитический агент представляет собой вирус или компонент вируса. 55. Конъюгат по п. 54, о т л и ч аю щ и й с я тем, что вирус является инфекционным для индивидуума, отличного от человека. 56. Конъюгат по п. 54, о т л и ч а ю щ и й с я тем, что вирусом является ' аденовирус. 57. Конъюгат по п. 54, о т л и ч а ю щ и й с я тем, что аденовирус является птичьим. 58. Конъюгат по п. 57„ о т л и ч аю щ и й с я тем, что аденовирус является куриным аденовирусом CELO. 59. Конъюгат по п. 56, о т л и ч а ю щ и й с я тем, что аденовирус представляет собой мутант. 60. Конъюгат по п. 59, о т л и ч а ю щ е й с я тем, что аденовирус представляет собой неспособный к репликации мутант. 26746 61. Конъюгат по п. 60, о т л и ч аю щ и й с я тем, что аденовирус имеет по меньшей мере одну мутацию и/или делецию в зоне Е1А. 62. Конъюгат по п. 56, о т л и ч аю щ и й с я тем, что аденовирусов ляется инактивированным. 63. Конъюгат по п. 62, о т л и ч аю щ и й с я тем, что аденовирус является инактивированным коротковолновыми УФлучами. # 64. Конъюгат по п. 62, о т л и ч аю щ и й с я тем, что аденовирус является инактивированным обработкой ультрафиолетовым светом и псораленом. 65. Конъюгат по п. 62, о т л и ч а ю щ и й с я тем, что аденовирус является инактивированным формальдегидом. 66. Конъюгат по п. 54, о т л и ч а ю щ и й с я тем, что компонент вируса представляет, собой протеин аденовируса. 67. Конъюгат по п. 54, о т л и ч а ю щ и й с я тем, что вирус представляет собой пикорнавирус. 68. Конъюгат по п. 67, о т л и ч а ю щ и й с я тем, что в качестве пикорнавируса содержит риновирус. 69. Конъюгат по п. 49, о т л и ч а ю щ и й с я тем, что эндосомолитический агент представляет собой эндосомолитический вирусный пептид, который может быть модифицирован. 70. Конъюгат по п. 69, о т л и ч а ю щ и й с я тем, что эндосомолитический вирусный пептид представляет собой пептид гемагглютинина НА2 гриппа. 71. Коны а 1 по п. 70 о т л и ч аю щ и й с я тем что ы т; ид имеет последовательность Gly-Leu-Иіь Glu-Ala-lleGly-Phc-lle-Glu-Asn-Gly-Trp-Glu-Gly-Met-lleAsp-Gly-Gly-Gly-Cys. 72. Конъюгат по п. 70, о т л и ч аю щ и й с я тем, что пептид имеет последовательность Gly-Leu-Phe-Gly-Ala-lleAla-Gly-Phe-lle-Glu-Asn-Gly-Trp-Glu-Gly-MetIle-Asp-Gly-Gly-Gty-Cys. 73. Конъюгат по п. 49, о т л и ч аю щ и й с я тем, что эндосомолитический агент представляет собой невирусный естественный или синтетический пептид, который может быть модифицирован. 74. Эндосомолитический пептид, пригодный в качестве компонента трансфекционной композиции по п. 33, о т л и ч а ю щ и й с я тем, что включает эндосомолитический домен и связывающий нуклеиновую кислоту домен. 75. Эндосомолитический пептид по п. 74, о т л и ч а ю щ и й с я тем, что связывающий нуклеиновую кислоту домен представляет собой хвост олиголизина. П р и о р и т е т п о з а я в к е установлен: От 30.09.91 по пп. 5, 8-10, 22, 39, 4648, 50-52, 54, 56, 59-64, 69-71 по дате подачи заявки 07/767788. От 30.09.91 по пп. 2, 3, 6, 7, 14, 1721, 23, 28-30, 34, 36, 40, 41, 43-45, 65, 66, 66 по дате подачи заявки 07/768039. От 07.04.92 по пп. 13, 15, 16, 37, 55, 57, 58, 72 по дате подачи заявки 07/864759. От 02.09.92 по пп. 1, 4, 11, 12, 24, 2527, 31-33, 35, 38, 42, 49, 53, 68, 73-75 по дате подачи заявки 07/937788. Изобретение относится к технологии единственного приема. Однако также суДНК, более конкретно к новой системе, ществует потребность в методах лечения, которую можно применять для переноса в которых терапевтически активную ДНК нуклеиновых кислот в высшие эукариат(или мРНК) дают в качестве лекарства ные клетки. 5 ("терапевтического генного агента") дают В особенности в терапии генами трераз или же, в случае необходимости повбуется эффективная система для введения торно. Примерами генетически вызываенуклеиновой кислоты в живые клетки. Гемых заболеваний, при которых терапия ны переводят в клетки с тем, чтобы досгенами представляет многообещающий тигнуть синтеза терапевтических активных 10 подход, являются гемофилия, р-талласегенетических продуктов в живом организмия и "серьезная комбинированная имме, например, с целью замены дефектномунная слабость", синдром, вызываемый го гена в случае генетического деффекта. генетически индуцированным отсутствием "Стандартные" терапии генами основаны энзима деаминазы аденозина. Другой обна принципе достижения длительного ле- IS ластью применения является иммунная ре* чения путем осуществления одного гуляция, при которой гуморальный или 26746 внутриклеточный иммунитет обеспечивается дачей функциональной нуклеиновой кислоты, кодирующей выделяемый протеиновый антиген или не выделяемый протеиновый антиген, который можно рассматривать как вакцинацию. Другими примерами генетических дефектов, при которых можно давать нуклеиновую кислоту, кодирующую дефектный ген, например, в согласованный в каждом конкретном случае форме, включают мышечную дистрофию (геи дистрофина) фиброзно-кистозную дегенерацию (регуляторный ген трансмембранной проводимости висцидозыЬ гиперолестиролемию (ген рецептора LDL). Терапия Генами также включает метод, согласно которому гормоны, факторы роста или белки цитотоксичной или проявляющей модуляцию иммунной системы активностью должны синтезироваться в теле. Терапия генами также рассматривается как многообещающий метод лечения рака путем дачи так называемых "раковых вакцин". Для повышения иммуногенности опухолевых клеток раковым вакцинам сообщают либо большую антигенность либо способность к производству определенных веществ, способных к модуляции иммуносистемы, например цитокинов, с тем, чтобы вызвать иммунную реакцию. Этот метод осуществляется путем трамсфекции клеток ДНК, кодирующей цитокин, например, IL—2, IL—4, у-интерферон, афактор опухолевого некроза. Вплоть до настоящего времени введение гена в аутогенные опухолевые клетки осуществлялось через ретровирусные векторы. Известна система для переноса нуклеиновых кислот в гепатоциты, представляющая собой конъюгат поликатиона, который может быть модифицирован, например, полилисина, и гликопротеина, который может быть модифицирован, причем конъюгат связывается рецепторами на поверхности гепатоцитов (см. By Г.И., By C.H. / / J . Bio!. Chem., 1988, 263, 29, стр. 14621 -14624). Недостаток известной системы заключается в том, что она может использоваться только для передачи нуклеиновых кислот в гепатоциты. Поэтому эксплуатационные возможности известной системы ограничены. Задачей изобретения является расширение эксплуатационных возможностей путем создания системы, позволяющей перенос нуклеиновых кислот в высшие эукариотные клетки. Под термином "перенос* понимается в рамках данного изобретения не только 5 10 15 20 25 30 35 40 45 $0 55 10 введение комплексов нуклеиновой кислоты в клетку через клеточную мембрану, но и транспорт выделяющихся из них комплексов или нуклеиновой кислоты внутри клетки до достижения подлежащего экспрессии подходящего сайта. Высшие эукариотные клетки общеизвестны. Они не включают дрожжей. Множество вирусов входят в эукариотный хозяин на основании механизмов, которые в принципе соответствуют механизму эндоцитоза, осуществляемого с участием рецептора. Основанная на этом механизме вирусная инфекция обычно начинается с того, что частицы вируса связываются с рецепторами на клеточной мембране, после чего вирус входит вовнутрь клетки. Процесс захода вовнутрь клетки осуществляется тем же образом, что и заход физиологических лигандов или макромолекул в клетку. Сначала рецепторы на поверхности клетки классифицируют себя по группам и мембрана инвертируется во внутрь и образует везикулу, снабженную сетчатым покрытием. После того, как везикула освободилась от сетчатого покрытия, в ней имеет место окисления при помощи протонного насоса в мембране. Это приводит к отделению вируса от ядрышка. В зависимости от того, снабжен ли вирус липидным покрытием или нет, возможны два вида отделения вируса от ядрышка. В случае так называемых "голых" вирусов (таких, как, например, аденовирус, полиовирус, риновирус) полагалось, что низкое значение рН вызывает изменение конфигурации белков вируса, что приводит к разделению гидрофобных доменов, которые не доступны при физиологическом значении рН. Таким образом эти домены приобретают способность к взаимодействию с мембраной ядрышка и тем самым обуславливают отделение генома вируса от ядрышка и его заход в цитоплазму. Для вирусов с липидным покрытием (таких, как, например, вирусы везикулярного стоматита, вирус Semliki Forest, вирус гриппа) предполагают, что низкая величина рН модифицирует структуру или конфигурацию некоторых белков вируса, в результате чего имеет место слияние мембраны вируса с мембраной ядрышка. Вирусы, которые проникают в клетку с. помощью этого механизма, имеют определенные молекулярные способности, которые сообщают им способность к разрушению мембраны ядрышка с тем, чтобы зайти в цитоплазму. Другие вирусы, как, например, покрытые вирусы Sendai, вирус СПИДа и меко 11 26746 торые штаммы вируса лейкоза Молонея, или непокрытые вирусы SV40 и полиомы, не требуют низкого значения рН дляпроникновения в клетку. Либо они могут вызывать слияние с мембраной непосредст- 5 венно на поверхности клетки (вирус Sendai, возможно вирус СПИДа), либо они способны к осуществлению механизмов по разложению мембраны клетки или прохода через нее. Предполагают, что вирусы, 10 которые не зависят от конкретней величины рН, могут также использовать механизм эндоцитоза. Исходной точкой решения проблемы изобретения являлось использование ме- 15 ханизма, по которому некоторые вирусы проникают в эукариотные клетки с тем, чтобы достичь эффективной передачи комплексов нуклеиновой кислоты в клетку и тем самым повышения экспрессии. 20 В рамках данного изобретения неожидано было найдено, что определенные агенты (например, вирусы, компоненты вирусов или другие соединения), которые проявляют способность определенных ви- 25 русов к заходу в эукариотные клети, обеспечивают существенное повышение степени экспрессии нуклеиновой кислоты, вводимой в клетку в качестве части комплекса. Решение по изобретению является 30 неожиданным из-за того, что ассортимент комплексов нуклеиновой кислоты, способных к проникновению в клетку, является очень широким. Таким образом, данное изобретение. 35 относится к системе для переноса комплекса нуклеиновой кислоты и вещества со сродством для нуклеиновой кислоты, связанного, в случае необходимости, с содействующим поглощению клеткой фак- 40 тором, в высшие эукариотные клетки, которая отличается тем, что содержит агент, способный к поглощению клеткой, либо как таковой, либо*в качестве компонента комплексов нуклеиновой кислоты, и к пе- 45 реносу в цитоплазму содержимого ядрышек, в которых комплекс находится после захода в клетку. » Агент указанной характеристики далее обозначается как "эндосомолитичес- 50 кий агент". Способность эндосомолитических агентов к поглощению клеткой и к переносу в цитоплазму содержимого ядрышек, в которых они находятся после захода в клетку, далее обозначается как 55 "поглотительная функция". Эта поглотительная функция включает способность к активному включению клеткой, то есть при помощи зависящего от рецептора механизма эндоцитоза, либо к пассивному вк 12 лючению клеткой, то есть при помощи жидкой фазы или в качестве компонента комплекса нуклеиновой кислоты, и способность к разрушению ядрышек, которая обычно обозначается как эндосомолиз ядрышка. Согласно, одному варианту изобретения в качестве эндосомолитического агента используют вирус или компонент вируса. Далее вирус или компонент вируса обозначается как "свободный" вирус (компонент). В рамках настоящего изобретения исследовалось действие повышающихся доз свободного аденовируса на степень передачи постоянного количества конъюгата-трансферина и полилизина в клетках HeLa с использованием в качестве репортерного гена люциферазы. Повышение степени передачи гена путем добавления свободного аденовируса достигло максимума 1 х 10 4 частиц вируса на клетку, то есть числа, которое соответствует примерному числу рецепторов аденовируса на клетку HeLa. Повышение экспресии люциферазы, которая составляет до 2000 раз по сравнению с экспрессией, достигаемой одним конъюгатом трансферина и полилизина, обусловлено большей дозой • вируса. Другая серия опытов была направлена на выявление действия ограничения количеств комплексов конъюгата и ДНК в присутствии постоянной дозы свободного аденовируса. Было найдено, что поглощение клеткой аденовирусов привело к повышению степени передачи гена с помощью трансферина/полилизина в широких пределах количества ДНК. Максимальная интенсивность экспрессии гена, достигаемая при помощи комплекса конъюгата и ДНК, соответствовала интенсивности, достигаемой при 100 раз мень* шем количестве ДНК в случае использования аденовируса для повышения эффективности трансфекции. Действие эндовирусной инфекции на передачу гена исследовалось с применением как некомплексированной ДНК, так и комплексов ДНК и полилизина или конъюгата трансферина и полилизина. В этих экспериментах установлено, что аденовирусная инфекция не привела к существенному увеличению передачи некомплексированной ДНК во время трансфекции. В противоположность этому, передача ДНК в виде комплекса с полилизином или в виде комплекса с конъюгатом трансферина и полилизина в значительной степени улучшалась аденовирусной инфекции. Максимальное действие 13 26746 достигается в случае применения конъюгата трансферина и полилизина Так как поликатионная часть конъюгата не только служит для связывания трансферина с ДНК, но и вызывает существенные структурные изменения внутри ДНК, эти эксперименты сначала не позволяли установить, являлось ли обнаруженное действие результатом улучшенного жидкостного транспорта конденсированной поликатионом ДНК или улучшенной вирусом доставки связанного с рецептором комплекса конъюгата и ДНК. Поэтому проводились опыты по связыванию и определению последовательности с тем, чтобы выявить причину обнаруженного действия. Связывание комплекса конъюгата трансфер рина и полилизина и ДНК или комплекса полилизина и ДНК при низкой температуре позволяло удаление избыточного комплекса в жидкой фазе перед инфекцией аденовирусом. Когда поступали указанным образом, отдача связанных с рецептором комплексов конъюгата трансферина и полилизина и ДНК значительно увеличивалась в результате добавления аденовируса. В случае применения комплексом полилизина и ДНК такого эффекта не наблюдалось. Таким образом то, что существенно улучшается, это заход ДНК с помощью способствующего рецептором механизма эндоцитоза. Кроме того, проводился анализ специфичной функции аденовируса, который вызывает улучшенный перенос гена при помощи рецептора. Слабая термообработка вирионов не меняет их способность к связыванию с соответствующими клеточными мембранами, но влияет на их свойство разрушать ядрышка после поглощения клеткой. Таким образом различные эффекты по связыванию вируса и заходу вируса в клетку можно было выявлять в отдельных экспериментах. При этом было также установлено, что термическая инактивация аденовирусов привела к полному уничтожению их способности к улучшению переноса гена при помощи рецептора в качестве посредника. Это позволяет предполагать, что вызываемое аденовирусами разрушение ядрышек является частью их механизма захода в клетку, который специфично обуславливав! улучшение отдачи гена при помощи конъюгата трансферина или полилизина. Тот факт, что штамм дефектного в отношении репликации вируса мог обеспечивать улучшение экспрессии р=»на, подтверждает предположение о том, что этот феномен обусловлен не функ 5 10 15 20 25 30 35 40 4S 50 55 14 цией репликацией, а поглотительной функ цией вириона Для выяснения того, что улучшение экспрессии гена можно приписывать к возможной трансактивации введеного гена вирусом, проводились опыты с применением клеточной линии, которая по своей структуре способна к экспрессии гена люциферазы RSV—LTR. В этой клеточной линии аденовирусы не проявляют действия, тогда как в родительской клеточной линии, в которой ген был введен при помощи конъюгата трансферина и полилизина, наблюдалось существенное повышение экспрессии гена. Результаты этих опытов показывают, что аденовирус влияет на событие, которое имеет место до транск.рипции, и что его улучшающее перенос гена действие проявляется не на уровне экспрессии гена, а на уровне переноса гена. В рамках данного изобретения также проводились исследования, направленные на выявление действия свободного аденовируса на перенос гена при помощи конъюгатов трансферина и полилизина в подобранных клеточных линиях. Было найдено, что присутствие рецепторов трансферина на целевой клетке является необходимым, но недостаточным в каждом случае с тем, чтобы обеспечить перенос гена при помощи конъюгата трансферина и полилизина. Предполагают, что специфичные у клетки факторы, относящиеся к результату находящихся в ядрышке комплексов конъюгата и ДНК, представлют собой крайне важный определяющий фактор для уровня передачи гена, достигаемого указанным путем. В этом отношении проводились опыты на подобранных клеточных линиях, направленные на исследование как переноса гена при помощи конъюгатов трансферина и полилизина, так и улучшение переноса гена при помощи аденовирусов. Клетки клеточной линии мукофисцидоза (CFT1) показывали небольшой уровень экспрессии гена люциферазы после обработки комплексами ДНК и конъюгата трансферина и полилизина. Этот уровень экспрессии существенно повысился в результате обработки аденовирусом dl312. В противоположность этому клетки KB, обработанные комплексами ДНК и конъюгата трансферина и полилизина, показывали уровень экспрессии гена люциферазы лишь немного выше уровня фона, несмотря на присутствие рецептора трансферина. Однако в результате обработки аденовирусом dl312 сразу же обнаруживалась активность люциферазы в 15 26746 этих клетках. Обработка аденовирусами клеток HeLa имела подобный эффект, хотя этот эффект был значительно сильнее в этих клетках. Так как клетки HeLa и KB обладают примерно тем же числом рецепторов для аденовируса, различие в улучшении переноса гена может быть обусловлено числом рецепторов для трансферина, характерным для каждого типа клеток. В явную противоположность этим результатам клеточные линии WI—38 и MRC—5, которые, как известно, лишь слабо поддерживают аденовирусную инфекцию, показывали в присутствии dl312 лишь незначительное улучшение экспрессии гена после обработки комплексом ДНК и конъюгата. Поэтому обработка свободным вирусом, например, аденовирусом, очевидно приводит к улучшению переноса гена при помощи комплексов ДНК и конъюгата в таких случаях, где перенос гена возможен за счет осуществляемого в присутствии рецептора в качестве посредника эндоцитоза, как, например, в случае клеток CFT1, а также в некоторых случаях, где перенос гена этим путем оказывается неэффективным, как, например, в случае клеток HeLa и КВ. Уровень достигаемого улучшения значительно меняется среди различных целевых клеток, так что можно предполагать, что этот эффект является функцией как числа рецепторов вируса, например, рецепторов аденовируса, у определенной клетки, так и числа рецепторов трансферина. В случае применения свободного вируса вещество со сродством для нуклеиновой кислоты, предпочтительно органический поликатион, предпочтительно связано с фактором, содействующим поглощению клеткой. Однако в рамках данного изобретения было также найдено, что ДНК в виде комплекса с одним веществом со сродством для нуклеиновой кислоты, то есть без содействующего поглощению клеткой фактора, в определенных условиях может вводиться в клетку в присутствии свободного вируса. Кроме того, было найдено, что в случае некоторых клеточных линий комплексы, состоящие из нуклеиновой кислоты и вещества со сродством для нуклеиновой кислоты, могут вводиться через жидкую фазу при условии достаточно высокой концентрации комплекса. Опыты, которые проводились в рамках данного изобретения, показывали, что существенным признаком для поглотительной способности комплексов нуклеиновой кислоты является их компактность, кото 16 рую можно приписывать к конденсации нуклеиновой кислоты веществом со сродством для нуклеиновой кислоты. Если вещество со сродством нуклеиновой 5 кислоты имеет достаточную способность к связыванию с поверхностью клетки с тем, чтобы проникнуть в клетку вместе с вирусом, а также к сообщению комплексу в основном больной электронейтральнос10 ти и конденсации нуклеиновой кислоты до компактной структуры, то может отпадать необходимость в улучшении способности к проникновению в клетку за счет - ковалентного связывания содействующеТ5~То поглощению клеткой фактора с веществом со сродством для нуклеиновой кислоты с тем, чтобы обеспечить перенос комплекса в клетку при помощи эндоцитоза, осуществляемого в присутствии ре20 цептора в качестве посредника. Много клеток проявляет относительно большое сродство для определенных веществ со сродством для нуклеиновой кислоты, так что конъюгаты нуклеиновой кислоты и 25 факторы связывания переносятся в клетку без потребности в наличии содействующего поглощению клеткой фактора. Это является действительным, например, для гепатоцитов, которые поглощают комплек30 сы ДНК и полилизина. Согласно предпочтительному варианту изобретения в качестве эндосомолитического агента используют вирус, связанный с веществом со сродством для нук35 леиновой кислоты и имеющий способность к заходу в клетку в качестве части комплекса конъюгата и нуклеиновой кислоты и к переносу в цитоплазму содержимого ядрышек, в котором комплекс находится 40 после захода в клетку. Согласно другому предпочтительному варианту изобретения в качестве эндосомолитического агента используют компонент вируса, связанный с веществом со 45 сродством для нуклеиновой кислоты, и имеющий способность к заходу в клетку в качестве части комплекса конъюгата и нуклеиновой кислоты и к переносу в цитоплазму содержимого ядрышек, в кото50 рых комплекс находится после захода в клетку. Вирусы и компоненты вирусов, которые связаны с доменом связывания нуклеиновой кислоты, далее обозначаются как "вирусные конъюгаты" (несмотря на тип 55 связывания). Вирусные конъюгаты, которые также являются объектом данного изобретения, содержат вирус или компоненты вируса в качестве интегральной части функционального конструкта. Они объединяют преиму 17 26746 щества векторных систем на основе конъюгатов содействующего поглощению клеткой фактора с преимуществами, которые вирусы вносят в эти системы. Кроме того, вирусные конъюгаты согласно изобретению имеют то преимущество, что в отличие от известных конъюгатов, которые можно применять для переноса генов при помощи эндоцитоза в присутствии рецепторов в качестве посредника, они обладают специфичным механизмом, обеспечивающим их выделение из системы везикул клетки. Векторная система, используемая вирусные конъюгаты, представляют собой качественно новый подход по сравнению с рекомбинантными вирусными векторами, который заключается в том, что транспортируемая чужеродная ДНК находится на наружной стороне вириона. Следовательно, вирусные конъюгаты согласно изобретению могут транспортировать в клетку очень большие генные конструкты без каких-либо ограничений в части последовательности. Пригодность вируса, который можно применять в качестве свободного или связанного вируса или части вируса в качестве вирусного компонента в рамках данного изобретения определено вышеупомянутой поглотительной функцией. Подходящими вирусами являются, например, такие вирусы, которые способны к заходу в клетку при помощи эндоцитоза в присутствии рецептора в качестве посредника во время трансфекции клеток комплексом нуклеиновой кислоты и к осуществлению своего выделения и тем самым выделения нуклеиновой кислоты из ядрышка в цитоплазму. Такими вирусами являются те вирусы, которые упоминаются в рамках данной заявки, а также другие вирусы, способные к поглощению определенной клеткой, и те вирусы, которые могут осуществлять выделение содержимого ядрышка в цитоплазму. Восприимчивость клеточной линии к трансформации вирусом в качестве средства содействия заходу конъюгата в качестве "свободного вируса" зависит от присутствия и числа рецепторов на поверхности целевой клетки. В число подходящих вирусов входят такие вирусы, которые способны к проникновению в клетку при помощи эндоцитоза в присутствии рецептора в качестве посредника во время трансфекции клеток комплексом нуклеиновой кислоты и к осуществлению своего выделения и тем самым выделения нуклеиновой кислоты из 5 10 15 20 25 30 35 40 45 S© 55 18 ядрышка в цитоплазму. Без претензий в части этой теории можно сказать, что в случае применения свободного вируса эта активность эндосомолиза могла бы оказать благотворное влияние на переносимый в клетку комплекс нуклеиновой кислоты, заключающееся в том, что эти комплексы транспортируются вместе с вирусами из ядрышка в цитоплазму, при этом предполагают, что они заходят в эти ядрышка, что и вирусы. Если комплексы содержат вирус в связанном виде, то они получают пользу от эндозомолитической активности вируса и транспортируются из ядрышек в цитоплазму. Этим достигается слияние между ядрышками и лизосомами и таким образом энзиматическая деградация, которая обычно имеет место в этих органеллах клетки. В частности вирусами, которые пригодны для осуществления изобретения и поглотительная функция которых в начале инфекции осуществляется за счет эндоцитоза в присутствии рецептора в качестве посредника, являются вирусы без липидного покрытия, такие, как, например, аденовирус, полиовирус, риновирус, а также вирусы с оболочкой, такие как, например, вирус везикулярного стоматита, вирус Semliki Forest, вирус гриппа. Подходящими являются также зависящие от рН штаммы вируса Молонея. В частности предпочитаются вирусы из группы, включающей аденовирус, подгруппу С, тип 5, вирус Semliki Forest, вирус везикулярного стоматита, полиовирус, риновирусы и вирус лейкоза Молонея. Применение в рамках данного изобретения вирусов РНК, которые не имеют обратную транскриптазу, имеет то преимущество, что трансфекция в присутствии такого вируса не приводит к образованию вирусной ДНК в трансфектированной клетке. В результате опытов по изобретению было выявлено, что риновирус HRV2, представитель групп пикорнавируса, проявляет повышенную экспрессию репортерного гена. Эффективность риновируса проявлялась как в свободной форме, так и в виде конъюгатов. В рамках данного изобретения под термином "вирус "(при условии, он поглощается клеткой и высвобождает содержимое ядрышек, в которые он заходит) понимаются в дополнение к диким типам мутанты, которые в результате одной или больше мутаций потеряли определенные функции дикого типа (отличные от поглотительной функции), в частности способность к репликации. 19 26746 Мутанты образуются в процессах обыч- . ного мутагенеза за счет мутаций в белковых областях, которые ответственны за репликационные функции и которые могут дополняться упаковочной линией. В случае аденовируса такимимутантами являются ts—мутанты (термочувствительные мутанты), мутанты Е1А и Е1В, мутанты, которые показывают мутации в стимилированных MLP генах, и мутанты, которые проявляю* мутаций в областях определенных капсидных белков. Также подходящими являются вирусные штаммы, которые имеют соответствующие естественные мутации. Способность вирусов к репликации можно исследовать известными из литературы методами. Так, например, на культуры клеток подают суспензии с различными концентрациями вируса и число растворенных клеток, которые можно видеть в виде пятен, регистрируют. Другими вирусами, которые можно применять в рамках данного изобретения, являются так называемые дефектные вирусы, то есть вирусы, которые не обладают функцией, требуемой для автономной репликации вируса в одном или больше генах, для которых они требуют наличие вируса-помощника. Примерами такого типа вируса являются дефектные интерферирующие частицы, которые являются производными инфекционного стандартного вируса, имеют те же структурные белки, что и стандартный вирус, имеют мутации и нуждаются в стандартном вирусе в качестве вируса-помощника для осуществления репликации. Примерами такой группы вируса также являются сателлитные вирусы. Другой группой является класс парвовирусов, которые обозначаются как аденоассоциированные вирусы. Так как циклы проникновения в клетки многих вирусов полностью не характеризованы, по-видимому есть и другие вирусы, которые будут проявлять эндозомолитическую активность, требуемую для их пригодности в рамках данного изобретения. В рамках данного изобретения также пригодны живые вакцины или вакцинальные штаммы. Под термином "вирус" понимаются в рамках данного изобретения и инактивированные вирусы, например, вирусы, инактивированные химической обработкой, такой, как, например, обработка формальдегидом, облучение УФ-лучами, химическая обработка в сочетании с облучением УФ-лучами, например, обработка псораленом и облучение УФ-лучами, облучение 20 у-лучами, бомбардировка нейтронами. Инактивированные вирусы, например, такие, которые также применяются для вакцин, можно получать известными из лите5 ратуры методами, после чего их можно исследовать на пригодность повышения переноса комплексов ДНК. В рамках данного изобретения проводились опыты, в которых препараты аденовируса инакти10 вировались при помощи стандартной УФстерилизационной лампы или обработкой формальдегидом. При этом неожиданно было найдено, что степень инактивации вирусов намного повышает степень сни15 жения переноса гена, который достигается при добавлении аденовируса к среде трансфекции. В этих опытах применялись препараты инактивированного обработкой псораленом и облучением УФ-лучами био20 тинированного аденовируса, связанного с полилизином, связанным с стрептавидином. Эти опыты показывали, что инактивация привела к снижению титра вируса, который значительно превышает сниже25 ние способности к переносу гена. Это является четким указанием на то, что ме* ханизмы, связанные с нормальной репликацией в активном вирусе, можно разрушать без отрицательного влияния на 30 эффект, необходимый для переноса гена. Под термином "компоненты вируса" подразумеваются части вирусов, например, белковая часть свободного от нуклеиновой кислоты {пустой капсид вируса, 35 который можно получать рекомбинантными способами), белки, получаемые фракционированием, или пептиды, которые имеют эндосомолитические функции интактного вируса. Эти компоненты вируса 40 можно получать синтетическим путем, либо пептидным синтезом, либо рекомбинантными способами в зависимости от их размеров. В результате опытов в рамках данного изобретения было установлено, 45 что белки аденовируса, связанные через биотин/стрептавидин с полилизином, позволяют улучшение переноса гена. Примером фрагментов или белков, отличных от аденовируса вирусов, которые являются 50 существенными для обеспечения включения клеткой, является гемагглютинин (НА) вируса гриппа. N-концевая последовательность подъединицы НА2 гемагтугинина вируса гриппа является ответственной для 55 выделения вируса из ядрышка. Было установлено, что пептиды, состоящие из 20 аминокислот этой последовательности, способны к слиянию липидных мембран и к их частичному разрушению. В рамках данного изобретения с успехом применя 21 26746 лись аутентичные и модифицированные пептиды вируса гриппа Другим примером являются белки оболочки ретровирусов, например, gp41 HIV или части таких белков. Применение вирусов, которые как таковые способны к проникновению в клетки и таким образом действуют в качестве содействующего поглощению клеткой фактора, является дальнейшим аспектом данного изобретения. Вирусы или компоненты вирусов, которые сами по себе не могут связаться с клеткой и проникать в нее, предпочтительно используются в качестве вирусных конъюгатов в соответствии с вышеприведенным определением В результате связывания с доменом, связывающим ДНК, например, с поликатионом, вирусу или компоненту вируса сообщается большое сродство к молекулам ДНК, так что он образует комплекс с ними и переносится в клетку в качестве компонента комплекса нуклеиновой кислоты, которая также содержит конъюгат содействующего поглощению клеткой фактора и связывающий ДНК домен Кроме достигаемого при этом эффекта переноса связывание вируса или компонента вируса со связывающим нуклеиновую кислоту доменом может также привести к улучшению его эндосомолитических свойств Путем подбора другого содействующего поглощению клеткой фактора практически любая высшая эукариотная клетка может трансфектироваться предлагаемой системой В результате простого скрининга можно определять, проявляет ли данный вирус или компонент вируса поглотительную функцию и можно ли ее применять для осуществления данного изобретения Такой анализ, например, для исследования вируса на его пригодность в качестве свободного вируса, целевые клетки приводят в контакт с комплексом ДНК в присутствии или отсутствии вируса Количество комплекса ДНК, которое переносится в цитоплазму, можно затем простым образом определять путем выявления маркерного генного продукта, например, люциферазы. Если присутствие вируса приводит к тому, что комплекс ДНК поглощается и вводится в цитоплазму на большем уровне чем без вируса, то это можно приписывать поглотительной функции вируса. Также возможно сравнивать уровень поглощения комплекса ДНК в присутствии исследуемого вируса с другим вирусом, о котором известно подходящая 22 поглотительная функция, например, с подгруппой С, типом 5, аденовируса. Таким опытам можно также подвергать вирусные конъюгаты. В этих опытах можно так5 же исследовать дополнительные параметры, такие, как, например, конъюгаты с различным содействующим поглощению клеткой фактором в различных количествах. Кроме того, специалист в данной об10 ласти может без труда проводить такого вида опыты, в случае необходимости в сочетании с другими опытами, например, с опытами по определению утечки липосома, с тем, чтобы исследовать компо15 ненты вируса и другие компоненты с потенциальной эндосомолитической активностью на их способность к улучшению экспрессии гена Если применяют интактные вирусы, то 20 проводят опыты, направленные на выявление способности вируса к репликации. Эти опыты предпочтительно проводят параллельно с предварительными опытами, направленными на выявление способнос25 ти вируса к улучшению переноса гена Исследование на способность к репликации проводят известными методами, такими как, например, метод с образованием пятен, метод по определению цитопато30 генного действия или метод по определению поздней экспрессии гена в случае цитопатогенных вирусов или вирусов, которые в значительной степени содействуют росту клеток-хозяев Для других ви35 русов применяют специфичные для данного вируса методы, например, метод по определению гемагглютинации, или химико-физические методы, например с применением электронного микроскопа. 40 В рамках данного изобретения в качестве предпочтительных вирусов, в частности таких, которые применяются в raff честве свободных вирусов, применяют вирусы, которые можно получать с высоким 4S- титром, которые устойчивы, имеют низкую патогенность в нативном состоянии и, в случае необходимости позволяют упразднение способности к репликации. В частности предпочитаются аденовирусы. Если 50 трансфекции подлежит специфичная клеточная популяция, то можно применять вирусы, которые проявляют специфичную способность к этой популяции Если трансфекции подлежат различного типа клетки, 55 то можно применять вирусы, которые яв' ляются инфекционными для широкого круга клеток. Требования к композициям свободного вируса в основном заключаются в том, что вирус должен иметь наибольшую чис 23 26746 тоту и что следует применять стабилизирующий буфер, выбираемый с учетом данного вируса. В любом случае согласно изобретению можно применять только такие вирусы или компоненты вирусов, у которых риск безопасности является как можно минимальным, в частности риск репликации вируса в целевой клетке и рекомбинации вирусной ДНК с ДНК хозяина. Преимущественно использовать механизм проникновения в клетки вирусов, инфецирующих животных по другому, чем людей, для улучшения поглощения и переноса ДНК в высшие эукариотные клетки, в частности людей, пока вирус проявляет активность по разрушению ядрышка в высших эукариотных клетках. Члены семейства аденовирусов были выделены из птиц, амфибий и ряда других животных. Аденовирусы из птиц, амфибий, крупного рогатого скота, собак, мышей, овец, свиней и обезьян, а также аденовирусы человека можно получать от американской коллекции типовых культур в городе Роквиль в штате Мариленд. Одно возможное преимущество применения вируса, например, аденовируса, из редкого вида может заключаться в уменьшенной токсичности в целевых клетках (например, от аденовируса куриц или лягушек нельзя ожидать репликации или раннего инициирования экспрессии гена в клетках млекопитающих), уменьшенной опасности для лица, занимающегося получением редкого аденовируса, по сравнению с аденовирусом человека, и уменьшенной интерференции в целевом организме от антител против аденовируса человека или мышей. Отсутствие интерференции антителами человека или мышей является особенно важным при применений вирусов в генной терапии на людях и мышах. Куриный аденовирус CELO не проявляет реактивности в отношении антител, которые распознают основную группу эпитопов аденовирусов, инфецирующих клетки млекопитающих. Кроме того, аденовирус CELO можно выращивать в оплодотворенных яйцах с получением высокого выхода (0,5 мг/яйцо). В экспериментальной части показывается, что конъюгаты CELO и полилизина улучшают перенос ДНК в клетки HeLa на уровне, который можно сравнивать с уровнем, достигаемым при применении аденовируса dl312 человека. Таким образом, применение конъюгатов CELO для улучшения транспорта ДНК можно рассматривать как многообещающий 5 10 15 20 25 30 35 40 45 50 55 24 подход в экспериментах по генной терапии на людях. Вирусы редких видов предпочтительно используются в качестве компонентов вирусных конъюгатов в комбинированных комплексах согласно изобретению. Связывание вируса со связывающим нуклеиновую кислоту доменом в вируссодержаших конъюгатах согласно изобретению может быть ковалентным или же нековалентным, например, при помощи биотино-стрептавидинового мостика. Возможно также ионное связывание в случае вируса с кислыми участками в поверхностных белках, что позволяет связь с поликатионом. В рамках данного изобретения образовались комплексы в условиях, позволяющих ионное взаимодействие между аденовирусом и полилизином до образования комплекса с ДНК. При этом также проводились контрольные опыты в условиях, в которых полилизин сначала нейтрализуют ДНК и поэтому он не может связывать аденовирус. Комплексы с ионным связыванием аденовируса показывали лучшие результаты. Примерами вирусных компонентов в эндосомолитических конъюгатах согласно изобретению являются пустые вирусные капсиды и вирусные пептиды. Связывание вирусного компонента со связывающим нуклеиновую кислоту доменом может быть ковалентным, например, путем химического связывания вирусного пептида с полилизином, или же нековалентным, например, ионным в случае вирусного компонента с кислотными остатками, которые связываются с поликатионом. Соотношение вируса или компонента вируса и вещества со сродством для нуклеиновой кислоты можно варьировать в широких пределах. В случае конъюгата пептида гемагглютинина гриппа и полилизина перенос гена можно улучшать в большем размере при высоком содержании в конъюгатах вирусного пептида. Конъюгаты вируса или вирусного компонента и вещества со* сродством нуклеиновой кислоты можно получать (также как и конъюгаты содействующего поглощению клеткой фактора и поликатиона) путем связывания компонентов или же при помощи рекомбинантного метода, если вирусные компоненты и связывающий нуклеиновую кислоту домен представляют собой полипептиды. Связывание вируса или вирусных белков или пептидов с полиаминами хими 25 26746 ческими методами можно осуществлять известным для связывания пептидов способом, причем, если требуется, отдельные компоненты перед реакцией связывания снабжают связывающими веществами (это мероприятие необходимо тогда, когда не имеется подходящей для связывания функциональной группы, например, меркаптогруппы или спиртовой группы). Связывающие вещества являются бифункциональными соединениями, которые сначала вступают в реакцию с функциональными группами отдельных компонентов, после чего осуществляют связывание модифицированных отдельных компонентов. Связывание можно осуществлять с помощью: а) дисульфидных мостиков, которые в восстанавливающих условиях могут снова расщепляться (например, при применении сукцинимидил-пиридилдитиопропионата); б) в основном стойких в биологических условиях соединений (например, простых тиоэфиров, реакцией малеимидо-связывающих веществ с сульфгидрильными группами связанного со вторым компонентом связывающего вещества); в) неустойчивых в биологических условиях мостиков, например, сложноэфирных связей, или неустойчивых в слабокислых условиях ацетальных или кетальных связей. В рамках данного изобретения эндосомолитические пептиды гемагглютинина НА2 гриппа связывались с полилизином химическим путем с применением сукцинимидил-пиридилдитиопропионата. Было установлено, что модификация пептида полилизином приводит к повышению эндосомолитической активности. Опыты по трансфекции показывали, что эффективность переноса гена в присутствии конъюгата трансферина и полилизина в качестве посредника значительно повышается, если комплекс ДНК кроме трансферина/полилизина содержит еще конъюгаты пептида вируса гриппа и полилизина. В рамках данного изобретения аденовирус связывался с полилизином самыми различными методами. Один метод образования конъюгата вируса и полилизина осуществлялся аналогично образованию конъюгатов трансферина и полилизина (см. Вагнер и др., Ргос. Natl. Acad. Sci., США 87, 1990, стр. 3410 - 3414) после модификации дефектного аденовируса dl312 с применением гетеробифункционального реагента. Несвязанный полилизин удалял 5 10 15 20 25 30 35 40 45 50 55 26 ся путем центрифугирования. Связывающая способность ДНК исследовалась с применением радиоактивно меченой ДНК (при применении клеток К562 было установлено, что в отсутствии хлорокрина значительно больший перенос гена достигается в присутствии комплексов, состоящих из ДНК, аденовируса, связанного с полилизином, и трансферина, связанного с полилизином, чем в присутствии немодифицированного аденовируса, который не связан с ДНК. Кроме того, было найдено, значительная экспрессия гена имела место уже в присутствии 0,0003 мкг/ДНК в 5 х хЮ 5 клеток HeLa с применением модифицированного полилизином аденовируса). Если вирус или вирусный компонент (или дополнительный, содействующий поглощению клеткой фактор, как, например, в случае трансферина) содержит подходящие углеводные цепи, их можно связывать с веществом, имеющим сродство для нуклеиновой кислоты, через одну или больше углеводных цепей гликопротеина. Другой предпочтительный метод получения вирусных конъюгатотв согласно изобретению заключается в энзиматическом связывании вируса или вирусного компонента с веществом со сродством для нуклеиновой кислоты, в особенности полиамина, при помощи трансглютаминазы. Категория трансглютаминаз включает ряд различных ферментов, которые имеются, например, в эпидермисе (эпидермальная трансглютаминаза), крови (фактор XIII) и в клетках различных тканей (тканевая трансглютаминаза, например, трансглутаминаз печени). Трансглютаминазы катализуют образование связей є-(у-глютамил)лизина в присутствии кальциевых ионов с расщеплением аммиака. Предпосылкой является наличие глютаминов и лизинов в белках, способных к взаимодействию с ферментом. Кроме є-аминогрупп лизина в качестве субстрата можно также применять (поли)амины, такие, как, например, этаноламин, путресцин, спермин и спермидин. До сих пор еще не ясно, какие факторы являются ответственными за то, что глютамин или лизин белка или полиамин вступает в реакцию с ферментом. Известно лишь то, что полиамины можно связывать с многочисленными клеточными белками, такими, как, например, цитокератины, тубулин, белками мембраны клеток, поверхностными белками вирусов гриппа при помощи трансглютаминазы. 27 26746 В рамках данного изобретения было установлено, что полилизин может связываться с аденовирусами при помощи трансглютаминазы. При этом процесс связывания можно проводить в присутствии глицерина, что имеет то преимущество, что препарат вируса, например аденовируса, можно подавать непосредственно на связывание, так как содержащийся в нем буфер включает глицерин. Применение конъюгатов аденовируса и полилизина, имеющихся в виде комплекса с плазмидной ДНК и конъюгатами трансферина и полилизина, позволяет экспрессию гена, которая во много раз превышает действие, достигаемое при применении конъюгатов трансферина и полилизина в присутствии не связанного с полилизином аденовируса. Другой предпочтительный метод получения конъюгатов согласно изобретению заключается в связывании вируса или его компонента с поликатионом через биотиново-белковый мостик, предпочтительно через биотиново-стрептавидиновый мостик. Известная сильная связь биотина со стрептавидином или авццином используется для связывания аденовируса с полилизином путем модификации аденовируса биотипом и химического связывания стрептавидина с полилизином. Комплексы, состоящие из ДНК и конъюгата стрептавидина и полилизина, с которыми связан модифицированный биотином вирус, и, в случае необходимости нековалентно связанного полилизина, проявляют очень высокую эффективность трансфекции, даже при низких концентрациях ДНК. Особенно эффективные комплексы образуются за счет того, что модифицированный биотином вирус сначала связывают с конъюгатом стрептавидина и полилизина, после чего осуществляют связывание ДНК. Связывание с биотином можно также осуществлять при помощи авидина. Связь между вирусом или его компонентом и полилизином можно также осуществлять следующим образом. Вирус биотинилируют, антитела против биотина связывают с полилизином и связь между биотином и антителом используют для связывания вируса и полилизина. При этом используют общедоступные стандартные поликлональные или моноклональные антитела против биотина." Связывание вируса с полилизином можно также осуществлять за счет связывания полилизина с лектином, имеющим 5 10 15 20 25 30 35 40 45 S0 55 28 сродство для поверхностного гликопротеина вируса, при этом процесс связывания в таком конъюгате осуществляют при помощи связи между лектином и гликопротеином. Если вирус на имеет подходящих боковых углеводных цепей, то его можно модифицировать соответствующим образом. Вирус можно также связывать с веществом со сродством для нуклеиновой кислоты за счет того, что поверхность вируса модифицируют антигеном, чужеродным для вируса (например дигоксигенином, продуктом инофирмы Бёрингер Маннхайм, DE, или биотином) и связь между модифицированным вирусом и веществом со сродством для нуклеиновой кислоты устанавливают через антитело, связывающееся с антигеном. Конкретное осуществление процесса образования конъюгатов согласно изобретению зависит от различных критериев. Так, например, связывание при помощи биотина представляет собой меньше всего специфичный и поэтому широко применяемый метод, при этом связывание при помощи биотина приводит к образованию очень сильной нековалентной связи. Энзиматическая реакция с трансглютаминазой имеет то преимущество, что его можно также проводить в очень малом масштабе. К химическому связыванию обычно прибегают тогда, когда необходимо синтезировать большие количества конъюгата. Этот метод обычно является и наилучшим для связывания протеинов или пептидов вируса. Если применять инактивированные вирусы, то инактивацию обычно осуществляют до связывания при условии, что инактивация отрицательно не сказывается на связывании. Если вирус, например, аденовирус, или его компонент с эндосомолитической активностью, имеет доступные связывающие домены, например кислые домены для связывания с поликатионом, то связывание вируса или его компонента с поликатионом можно также осуществлять ионным путем. В этом случае положительные заряды поликатиона, который может иметься в виде конъюгата с содействующим поглощению клеткой фактором, частично нейтрализуются кислым доменом вируса или его компонента, а остальные положительные заряды нейтрализуются нуклеиновой кислотой. Если вещество со сродством для нуклеиновой кислоты представляет собой вещество интеркаляции, то его модифицируют связывающим веществом, подходящим в процессе связывания конкретного 29 26746 вируса или его компонента. Так, например, в случае связывания при помощи трансглютаминазы его модифицируют спермином или бифункциональной группой, пригодной для осуществления химического связывания, например активной сложноэфирной группой. Соотношение вируса или его компонента и связывающих нуклеиновую кислоту веществ может колебаться в широких пределах. Обычно его определяют эмпирическим путем, например, связывания определенного количества вируса или его компонента с различным количеством полилизина. При этом оптимальный конъюгат используют для трансфекции. Согласно другому варианту изобретения компонент вируса, например вирусный пептид с эндосомолитической активностью, можно модифицировать с таким расчетом, что его можно непосредственно связывать с ДНК. В этом случае сам пептид может содержать связывающий ДИК домен, получаемый за счет синтеза пептида и включения в него, предпочтительно за счет удлинения, положительно зараженных аминокислот, предпочтительно на С-конце. Согласно другому варианту изобретения эндосомолитический агент представляет собой невирусный, в случае необходимости синтетический пептид. Если предлагаемая система содержит пептид такого типа, то он предпочтительно ионным путем связан с веществом со сродством для нуклеиновой кислоты, например с полилизином в случае наличия комплексов ДНК, содействующего поглощению клеткой фактора и полилизина. При этом включение эндосомолитического пептида в комплекс нуклеиновой кислоты осуществляют за счет связывания с положительно заряженным связывающим нуклеиновую кислоту доменом предпочтительно полилизином, через его кислые аминокислотные остатки. В зависимости от химической структуры пептида, в частности его концевой группы, связывание с полилизином можно также осуществлять методами, используемыми в рамках данного изобретения для связывания пептидов с полилизином. Если применять естественный пептид, то его можно модифицировать подходящей концевой аминогруппой с тем, чтобы еделать его пригодным для осуществления связывания. Другой метод включения невирусных эндосомолитических пептидов в комплексы нуклеиновой кислоты заключается в 5 10 15 20 25 30 35 40 45 50 $5 ЗО том, что их снабжают последовательностями, способными к связыванию с ДНК Такая последовательность должна находиться в том месте, где она отрицательно не влияет на эндосомолитическую активность пептида. Поэтому, например, пептиды, N-конец которых ответственен за эту активность, удлиняют связывающими ДНК последовательностями на С-конце. Такими последовательностями могут быть гомологовые или гетерогенные катионные олигопептиды, например, олиго—лизиновый хвост, или естественный связывающий ДНК домен, например пептид, производимый от гистона. Эти связывающие ДНК последовательности в качестве интегральной части эндосомолитического пептида предпочтительно содержат, примерно 10 — 40 аминокислот. Этот вариант изобретения позволяет повысить соотношение эндосомолитической последовательности и связывающей ДНК последовательности по сравнению с конъюгатами пептида с большим содержанием поликатиона с тем, чтобы достичь большей эффективности комплексов. Невирусные эндосомолитические пептиды должны отвечать следующим требованиям. В отношении эндосомолитической активности утечка липидных мембран, достигаемая пептидом, предпочтительно должна быть больше при низкой величине рН (5 — 6) чем при величине рН 7. Кроме того, разрушенные зоны мембраны должны иметь размер, достаточный для обеспечения прохода комплексов ДНК (небольшие поры являются недостаточными). Для определения того, отвечает ли конкретный пептид этим требованиям, можно яроводить опыты в пробирке за счет того, что пептиды применяют в свободном или связанном виде и/или в включенном в комплексе ДНК виде. В таких опытах с применением липосом, эритроцитов или клеточных культур определяют увеличением экспрессии гена. Такие опыты являются объектом примеров осуществления изобретения. Оптимальное количество пептида можно определять в рамках предварительных титрований путем анализа эффективности получаемого переноса гена. Следует учесть, что эффективность различ-. ных рептидов и оптимальный состав комплекса зависят от типа клетки. Разрушающие мембрану пептиды обычно содержат амфипатические последовательности, а именно гидрофобный участок, который может взаимодействовать с липидной мембраной, и гидрофиль 31 26746 ный участок стабилизирует водную фазу в сайте разрушения мембраны. В природе существуют некоторые примеры разрушающих мембрану пептидов, обычно небольших пептидов или пептидных доменов больших полипептидов. Такие пептиды можно классифицировать в соответствии с их функцией в природном контексте, а именно либо на разрушающие мембрану пептиды (например, пептиды обнаженных вирусов) и/или на вызывающий слияние мембран пептиды (например, вирусы с оболочкой). В случае синтетических пептидов для осуществления разрушения ядрышек пригодны оба класса пептидных последовательностей. Большинство естественных пептидов способно к образованию амфипатических осспиралей. Специфичность в отношении величины рН можно получать путем включения кислых остатков в гидрофильный участок предполагаемой амфипатической а-спирали с таким расчетом, что спираль может образоваться только при кислой величине рН, но не при нейтральной величине рН, при которой отталкивание между отрицательно зараженными кислыми остатками предотвращает образование спирали. Это свойство также обнаружено в случае имеющихся в природе последовательностей (например у N-конца вируса гриппа НА—2) Полностью синтетический амфипатический пептид со способностью к разрушению мембраны в зависимости от величины рН известный. Этот пептид (в свободном виде) обеспечивает образование только небольших пор в мембранах, которые позволяют только высвобождение соединений небольшой величины. В рамках варианта изобретения, согласно которому используют невирусные, в случае необходимости синтетические, пептиды, обычно осуществляют следующие операции. Амфипатическую пептидную последовательность выбирают из группы имеющихся естественных или искусственных пептидов, известных специалисту. В случае необходимости включают кислые остатки (Glu, Asp) с тем, чтобы сделать разрушающую мембрану активность пептида более специфичной в отношении величины рН (двойной кислый мутант гемагглютининового пептида гриппа согласно примеру 35, обозначенный р50). В случае необходимости кислые остатки можно также включать с тем, чтобы улучшить способность пептида к связыванию с полилизином. Такой связывающий с поликатионом домен 5 10 15 20 25 30 35 40 45 50 55 32 можно получать за счет включения С-концевых кислых удлинений, например, олиго—Glu—хвоста. Пригодные для осуществления данного изобретения эндосомолитические пептиды можно также получать за счет слияния имеющихся естественных и искусственных последовательностей. В рамках данного изобретения проводились опыты с применением различных пептидов, которые производились от синтетического пептида GALA. Некоторые производные, которые применялись в этих опытах, получались за счет сочетания пептида GALA или его модификаций с последовательностями пептида гриппа или его модификаций, например с пептидами, обозначенными EALA— Inf и EALA—P50 согласно примеру 35. Длина последовательности пептида может быть критической в отношении стабильности амфипатической спирали. Повышение стабильности коротких доменов, которые производятся от естественных белков, которым не хватает стабилизирующих белковых участков, можно обеспечивать за счет удлинения спирали. Эндосомолитическую активность пептидов можно повышать за счет образования гомодимеров, гетеродимеров или олигомеров. В результате проведения опытов по изобретению выявилось, что димер Р50 проявляет намного большую активность чем мономер. Кроме того, опыты также показывали действие синтетических пептидов на поглощение ДНК при помощи конъюгатов трансферина и полилизина. При этом синтезировались различные пептиды, которые исследовались на способность к утечке липосом и эритроцитов, а также на их действие на экспрессию люциферазы в клетках TIB 73 и NIH ЗТЗ. В качестве эндосомолитического агента можно также применять непептидное амфипатическое вещество. Требования к пригодности такого вещества для применения в рамках данного изобретения являются в основном теми же, что и в случае амфипатических пептидов, а именно способность включаться в комплекс нуклеиновой кислоты, специфичность в отношении рН и так далее. Другой вариант изобретения относится к комплексам, содержащим нуклеиновую кислоту и конъюгат, способный к об-' разованию комплекса с нуклеиновой кислотой, которые служат для переноса нуклеиновой кислоты в высшие эукариотные клетки. Комплексы характеризуются тем, 33 26746 что конъюгат состоит из вещества со сродством для нуклеиновой кислоты и эндосомолитического агента, связанного с веществом со сродством для нуклеиновой кислоты, причем эндосомолитическии 5 агент способен к включению в клетку в качестве части комплекса конъюгата и нуклеиновой кислоты и к высвобождению содержимого ядрышек, в которых комплекс находится после захода в клетку, в 10 цитоплазму. В рамках данного изобретения предпочтительно применяют такие комплексы, в которых нуклеиновая кислота связана с веществом со сродством для нуклеиновой 15 кислоты так, что комплексы являются в основном электронейтральными. Согласно предпочтительному варианту изобретения в качестве эндосомолитического агента используют вирус или его компонент, 20 ковалентно связанный с поликатионом. Используемые в рамках данного изобретения эндосомолитические конъюгаты также охватывают (дополнительно к конъюгатам, в которых эндосомолитические 25 агенты ионным путем связаны со связывающим ДНК доменом) эндосомолитические'агенты, которые непосредственно связываются с ДНК, например через их основное удлинение, хотя такого рода "ко- 30 нъюгат", строго говоря, не получается за счет сопряжения связи, то есть за счет связывания двух соединений друг с дру. гом. Функция такого типа эндосомолитических агентов в качестве компонента 35 предлагаемой системы является независимой от того, синтезированы ли они путем сопряжения эндосомолитического агента и связывающего ДНК домена или содержатся ли первоначально в нем сея- уЮ зывающий ДНК домен. Согласно другому предпочтительному варианту изобретения кроме эндосомолитического конъюгата комплексы содержат другой конъюгат, в котором вещество'со 45 сродством для нуклеиновой кислоты, в случае эндосомолитического конъюгата поликатиона обычно тот же поликатион что и в конъюгате, сопрягают с содействующим поглощению клеткой фактором, прояв- 50 ляющим сродство для целевой клетки. Этот вариант изобретения используют, в частности, тогда, когда целевая клетка не имеет или же имеет лишь немногие рецепторы для вируса, применяемого в 55 качестве части эндосомолитического конъюгата. Этот вариант изобретения употребляется и тогда, когда используют компонент вируса, например имеющийся в природе, возможно модифицированный 34 пептид, невирусный, в случае необходимости синтетический эндосомолитическии пептид или вирус несвойственного вида, которые не обладают способностью к проникновению в клетки, которые подлежат трансфекции. Присутствие дополнительного конъюгата содействующего поглощению клеткой фактора и связывающего фактора приводит к улучшению характеристики эндосомолитических конъюгатов за счет того, что они образуют комплексы с нуклеиновой кислотой вместе со вторым конъюгатом и переносятся в клетку в качестве части результирующего комплекса, который в нижеследующем обозначается как "комбинационный комплекс" или "тройной комплекс". Предполагается, что комбинационные комплексы поглощаются клетками либо за счет связывания с поверхностным рецептором, специфичным для дополнительного содействующего поглощению клеткой фактора или, например, в случае применения вируса или его компонента, за счет связывания с рецептором вируса или же за счет связывания с обоими рецепторами, причем поглощение имеет место в результате эндоцитоза, вызываемого рецептором. Когда эндосомолитические агенты высвобождаются из ядрышек, ДНК, которая содержится в комплексах, также выделяется в цитоплазму, при этом она избегает лизосомапьной деградации. В опытах, которые проводились в соответствии с данным изобретением, почти все клетки HeLa поддались трансфекции свободным аденовирусом. В случае гепатоцитов эффективность можно было еще далее улучшать за счет использования тройных комплексов ДНК, в которых репортерная ДНК имеется в виде комплекса с конъюгатами полилизина и трансферина и связана с аденовирусом. В этом случае обеспечивается наличие эндосомолитического вируса и комплекса лиганда и рецептора в ядрышке. При этом почти во всех клетках указанного типа, например BNL.-CL2 и HepG2, имеет место трансфекция. В этом случае имеющиеся на поверхности клетки рецепторы как для вируса, так и для трансферина, могут захватывать тройные комплексы ДНК. Однако также возможно, что тройные комплек-. сы ДНК могут проникать в клетку исключительно за счет действия совокупности клеточного лиганда и рецептора. Такая возможность исследовалась в опытах, в которых содержащие трансферин тройные комплексы ДНК проникали 8 клетки К562 в основном через рецептор транс 35 26746 ферина, нежели через рецептор аденовируса. Неожиданным образом было выявлено, что тройные комплексы переносили ДНК в клетку даже в случае очень низких концентраций ДНК. Так, например, в случае 30 пг ДНК/3 х 10 5 клеток получается 1,8 х 10 4 световых единиц (получаемых в результате экспрессии плазмиды, кодирующей люциферазу). Такая концентрация означает 60 молекул ДНК и 1 бляшкообразующую единицу вируса на клетку. Следовательно, данное изобретение обеспечивает эффективную трансформацию высших эукариотных клеток очень малыми количествами ДНК. Присутствие вирусов, их компонентов или невирусных эндосомолитических агентов в комплексах ДНК в качестве компонентов эндосомолитических конъюгатов имеет следующие преимущества. 1. Широкая применимость технологии переноса генов с применением комплексов нуклеиновой кислоты, так как сам эндосомолитический агент, вчастности в случае использования вируса или его компонента, может представлять собой содействующий поглощению клеткой фактор или же может также переводиться в комплекс с ДНК и с другим содействующим поглощению клеткой фактором, например, трансферином, асиалофетуином. Таким путем возможно использование положительного эффекта вирусов даже в случае таких клеток, которые не имеют рецептора данного вируса. 2. Улучшение эффективности переноса генов, так как связывание эндосомолитических конъюгатов с ДНК обеспечивает то, что они вместе проникают в клетки. Согласованный процесс поглощения и высвобождения вирусов и ДНК также позволяет снизить количества ДНК и вирусов, необходимые для эффективного переноса генов, что является крайне важным при применении предлагаемой системы в живом организме. Под термином "содействующий поглощению клеткой фактор" в рамках данного изобретения понимаются лиганды или их фрагменты, которые после связывания с клеткой проникают в нее в результате эндоцитоза, предпочтительно вызываемого рецептором, или же факторы, связывание и проникновение которых осуществляют путем слияния с элементами клеточной мембраны. Подходящими содействующими поглощению клеткой факторами являются лиганды трансферин, кональбумин, асиалог 5 10 15 20 25 30 35 40 45 50 55 36 ликопротеины (такие, как, например, асиалотрансферин, асиалорозомуцоид и асиалофетуин), лектины, вещества, которые содержат галактозу и проникают в клетки при помощи рецептора асиалогликопротеина, маннозилированные гликопротеины, лизосомальные энзимы, LDL, модифицированный LDL, липопротеины, которые проникают в клетки при помощи рецепторов (аро B100/LDL), вирусные протеины, такие, как, например протеин др120 СПИДа, антитела или их фрагменты против поверхностных антигенов клетки, как, например, анти— CD4, анти—CD7, цитокины, такие, как, например интерлейкин-1, интерлейкин-2, фактор опухолевого некроза, интерферон, стимулирующий колонии фактор, факторы роста, такие, как, например инсулин, фактор роста эпидермиса, выделяющийся из тромбоцитов фактор роста, фактор р трансформирующего роста, фактор роста нервов, подобный инсулину фактор t роста, пролай Б, пролай А, гормон роста, пролактин, глюкагон, тироидные гормоны, а-2-макроглобулиновая протеаза и "бесплечевые" токсины. Другими примерами являются иммуноглобулины или их фрагменты в качестве лигандов для рецептора Fc или же антитела против иммуноглобулинов, которые связываются с поверхностными иммуноглобулинами. Лиганды могут быть естественного или синтетического происхождения. Далее приводятся основные требования, предъявляемые к пригодности вышеприведенных факторов в рамках данного изобретения. а) Они могут поглощаться клеткой, в которую следует перенести нуклеиновую кислоту, причем их способность к проникновению не ухудшается или же лишь в незначительной степени ухудшается в случае сопряжения со связывающим фактором. б) Они способны к переносу нуклеиновой кислоты в клетку путем метода "ношения на спине" по любому пути, который они выбирают. Нижеследующая экспериментальная часть иллюстрирует широкие возможности применения содействующего поглощению клеткой фактора или дополнительного содействующего поглощения клеткой фактора в рамках осуществления данного изобретения на примере конъюгатов трансферина и полилизина, комплексов асиаяофетуина или галактозы и конъюгатов трансферина и полилизина, конъюгатов агглютинина пшеничного зачатка, комплексов конъюгата трансферина и полили 37 26746 зина и специфичного в отношении Т-клеток белка др!2О, комплексов конъюгатов трансферина и полилизина и анти—CD7, также на примере комплексов полилизина и ДНК, которые не содержат содействующего поглощению клеткой фактора. Кроме того, возможность осуществления изобретения при применении вирусных конъюгатов иллюстрируется на примере комплексов ДНК и сопряженного с полилизином вируса или его компонента, которые не содержат конъюгата дополнительного содейств'чощего поглощению клеткой фактор и сь бывающего фактора. Возможность или необходимость применения содействующего поглощению клеткой фактора в случае применения в качестве эндосомолитического агента свободного вируса или же дополнительного содействующего поглощению клеткой фактора в случае применения в качестве эндосомолитического агента вируса или компонента вируса или невирусного пептида, являющегося частью эндосомолитического конъюгата, для обеспечения или улучшения промесса поглощения клеткой комплексов нуклеиновой кислоты можно выявлять за счет проведения соответствующих предварительных опытов. В этих опытах осуществляют параллельные трансфекции комплексами нуклеиновой кислоты, в одном случае без (дополнительного) содействующего поглощению клеткой фактора, например в случае комплексов нуклеиновой кислоты и вирусного конъюгата, а в другом случае применяют комплексы нуклеиновой кислоты с другим конъюгатом, состоящим из дополнительного содействующего поглощению клеткой фактора, для которого целевые клетки имеют соответствующий рецептор, и вещества со сродством для нуклеиновой кислоты. 38 аминокислоты с различным положительным зарядом, при этом они могут также иметь различную длину цепи, а также непептидные синтетические поликатионы, та5 кие, как, например полиэтиленимин. Другими пригодными веществами со сродством для нуклеиновой кислоты являются естественные связывающие ДНК белки поликатионной природы, такие, как, например гис10 тоны, протамины или их аналоги или фрагменты, а также спермин или сперм иди н. Длина поликатиона не является критической при условии, что комплексы являются в основном электронейтральными. 15 Полилизин имеет предпочтительную длину цепи, составляющую примерно 20 — 1000 лизиновых мономеров. Однако для данной длины ДНК не существует критической длины поликатиона. Так, напри20 мер, если ДНК состоит из 6000 пар оснований (далее "п.о.") и 12000 отрицательных зарядов, то на моль ДНК применяют следующие количества поликатиона: 60 моль полилизина с молярным ве 25 сом 200 30 35 40 Применение содействующего поглощению клеткой фактора или дополнительного содействующего поглощению клет- 45 кой фактора (в случае применения комбинационного комплекса) определяется, в частности, целевой клеткой, например, специфичными для данной клетки поверхностными антигенами или рецепторами, 50 которые таким образом позволяют желаемый перенос нуклеиновой кислоты в данную клетку. Пригодными в рамках данного изобретения веществами со сродством для нук- 55 леиновой кислоты являются, например, гомологовые органические поликатионные, такие, как, например полилизин, полмаргинин, полиорнитин, гетерогенные поликатионы, имеющие по меньшей мере две 30 моль полилизина с молярным весом 400 120 моль полилизина с молярным весом 100, и так далее. Любой специалист может подобрать поликатион с подходящей длиной и в подходящем мольном количестве за счет проведения стандартных опытов с учетом вышесказанного. Другими подходящими веществами со сродством для нуклеиновой кислоты в качестве компонента конъюгатов являются проявляющие интеркаляцию вещества, такие, как, например этидиевые димеры, акридин, или же проявляющие интерколяцию пептиды, содержащие триптофан и/ или тирозин и/или фенилаланин. Для составления качественного состава комплексов нуклеиновой кислоты обычно сначала определяют нуклеиновую кислоту, которая подлежит переносу в клетку. В первую очередь нуклеиновую кислоту выбирают с учетом биологического действия, которое должно проявляться в клетке, а в случае использования изобретения для генной терапии, — с учетом гена или участка гена, который подлежит экспрессии, например для замены дефектного гена, или же с учетом последовательности гена, которая подлежит торможению. Нуклеиновые кислоты, которые должны переноситься в клетку, могут быть ДНК или РНК, так как при этом не существует ограничение в отношении нуклетидной последовательности. 39 26746 Если применять опухолевые клетки в качестве раковой вакцины, то подлежащая введению в клетку ДНК предпочтительно кодирует модулирующее иммунную систему вещество, например, цитокин, как 5 интерлейкин (далее* "ИЛ") -2, ИЛ-4, уинтерферон (далее* "ИФ") ос-фактор опухолевого некроза (далее: "ФОН"). Возможно также применять комбинации кодирующих цитокин ДНК, например ИЛ—2 10 и у-ИФ Другим полезным геном, который можно вводить в опухолевые клетки, может являться устойчивый ко многим лекарственным средствам ген (далее "mdr"). Также возможно вводить в клетку две 15 или больше различные последовательности нуклеиновой кислоты, например плазмидсодержащие кДНК, кодирующие два различных белка с управлением подходящими регуляторнымИ последовательностями, 20 или два различных плазмидных конструкта, которые содержат различные кДНК. Терапевтически активные ингибирую- * щие нуклеиновые кислоты, которые переносятся в клетки с тем, чтобы тормозить 25 специфичные генные последовательности, могут представлять собой генные конструкты, которые служат для транск- * рипции анти— мРНК или рибозимов. Кроме того, возможно также введение в клет- 30 ку олигонуклеотидов, например анти-молигонуклеотидов Анти-м-олигонуклеотиды включают предпочтительно по меньшей мере 15 нуклеотидов. Олигонуклеотиды могут также представлять собой 35 мультимеры Если вклк> ению в клетку подлежат рибозимы, то они предпочтительно применяются в качестве компонента генного конструкта, включающего стабилизирующие генные элементы, например 40 элементы гена т—РНК Кроме молекул нуклеиновой кислоты, которые тормозят гены, например вирусные гены, можно также применять гены, проявляющие различный образ тормозя- 45 щего действия. В качестве примеров можно назвать гены, кодирующие вирусные белки, которые имеют так называемые транс-доминантные мутации. В результате экспрессии генов в клет- §0 ке получаются белки, которые доминируют соответствующий белок такого типа и, таким образом, защищают клетки, которые приобретают "клеточную иммуность* путем торможения вирусной репликации. 55 Подходящими являются транс-доминантные мутации вирусных белков, которые требуются для репликации ія экспрессии, например Gag—, Tat—- и Rev—мутанты. Последние показывали торможе 40 ние репликации ретровируса СПИДа. Другой механизм достижения внутриклеточной иммуности заключается в экспрессии молекул РНК, включающих сайт связывания существенного вирусного белка, например, так называемые приманки TAR. Примерами генов, которые можно применять при соматической терапии и которые можно переносить в клетки в качестве компонента генных конструктов, являются фактор VIII (гемофилия А), фактор IX (гемофилия Б), деаминаза аденозина, ос1 антитрипсин (эмфиземия легких) или регуляторный ген трансмембранной проводимости муковисцидоза. Величина нуклеиновых кислот может колебаться в широких пределах. Так, например, генные конструкты размером примерно 0,15 кило пар оснований (далее: "к п о.") (в случае гена т—РНК, включающего рибозим) до примерно 50 к п.о. или больше можно с успехом переносить в клетки при помощи предлагаемой системы Небольшие молекулы нуклеиновой кислоты можно применять в качестве олигонуклеотидов. В связи с этим следует отметить, что применение предлагаемой системы не ограничено ни в отношении последовательности генов, ни в отношении их размера. После выбора нуклеиновой «кислоты подбирают вещество со сродством для нуклеиновой кислоты, предпочтительно органическое поликатионное вещество, с тем, чтобы обеспечить образование комплекса нуклеиновой кислоты, при этом получаемый комплекс должен быть предпочтительно в основном электронейтральным. Если комплексы включают конъюгат дополнительного содействующего поглощению клеткой фактора и вещества со сродством для нуклеиновой кислоты, то поликатионный компонент обоих конъюгатов подбирают с учетом вопроса электронейтральности. Известно, что оптимальный перенос нуклеиновой кислоты в клетку может достигаться тогда, когда соотношение конъюгата и нуклеиновой кислоты выбирают с таким расчетом, что комплексы содействующего поглощению клеткой фактора и поликатиона/нуклеиновой кислоты являются в основном электронейтральными. Было найдено, что количество поглощаемой клеткой нуклеиновой кислоты не снижается, если некоторое количество конъюгата трансферина и поликатиона заменяют на нековалентно связанный поликатион. Наоборот, в некоторых случаях можно даже существенно повысить поглощение ДНК. 41 26746 Было обнаружено, что ДНК комплексов имеется в виде тороидальных структур диаметром 80 — 100 нм Таким образом количество поликатиона подбирают с учетом электронейтральности и достижения компактной структуры. При этом количество поликатиона, получаемое в результате осуществления зарядки нуклеиновой кислоты с учетом обеспечения электронейтральности, обычно также обеспечивают компактную структуру ДНК Таким образом, согласно другому варианту изобретения комплексы также включают связывающие нуклеиновую кислоту вещества в нековалентно связанном виде, которые могут быть идентичны или отличны от связывающего фактора Если эндосомолитический агент представляет собой свободный вирус, то комплексы включают конъюгат нуклеиновой кислоты и содействующего поглощению клеткой фактора В случае применения эндосомолитического конъюгата, например, вирусного конъюгата, нуклеиновая кислота переводится в комплекс с этим конъюгатом, в случае необходимости в сочетании с конъюгатом дополнительного содействующего поглощению клеткой фактора Вид и количество нековалентно связанного "свободного" вещества со сродством для нуклеиновой кислоты также определяется конъюгатом или конъюгатами, в частности с учетом связывающего фактора в конъюгате. Так, например, если связывающий фактор представляет собой вещество, которое не обладает или же обладает лишь ограниченной способностью к конденсации ДНК, то в целях достижения высокой степени поглощения клеткой комплексов целесообразно применять вещества со сродством для ДНК, которое в значительной степени обладает этим свойством Но если же сам связывающий фактор представляет собой конденсирующее нуклеиновую кислоту вещество и позволяет получить компактную структуру нуклеиновой кислоты, достаточную для обеспечения эффективного поглощения клеткой, то целесообразно применять вещество со сродством для нуклеиновой кислоты, которое обеспечивает усиление экспрессии благодаря другим механизмам 5 10 15 20 25 30 35 40 45 50 Подходящими "свободными" веществами со сродством для нуклеиновой кислоты согласно изобретению являются, нап- 55 ример, соединения, способные к конденсации нуклеиновой кислоты и/или защите их от нежелательной деградации в клетках, в частности вышеупомянутые вещества поликатионного типа Другими подходя 42 щими веществами являются такие вещества, которые в результате связывания с нуклеиновой кислотой улучшают ее доступность для экспрессионной системы клетки, благодаря чему улучшается ее транскрипция/экспрессия Примером такого вещества является хромозомальный не—гистонный белок HMG1, который обладает способностью к сообщению ДНК компактной структуры и к содействию экспрессии в клетках. При определении молярного соотношения эндосомолитического агента и/или содействующего поглощению клеткой фактора и вещества со сродством для нуклеиновой кислоты или нуклеиновых кислот следует учесть, что имеет место комплексообразование нуклеиновой кислоты, образующийся комплекс может связаться с клеткой и поглощаться ею и что он выделяется из ядрышек либо с помощью эндосомолитического агента либо самим собой Соотношение содействующего поглощению клеткой фактора, связывающего фактора и нуклеиновой кислоты зависит, в частности, от размера молекул поликатиона и числа распределения положительно зараженных групп Поэтому эти критерии должны согласоваться с размером и структурой переносимой нуклеиновой кислотой Молярное оотношение содействующего поглощению клеткой фактора и вещества со сродством нуклеиновой кислоты предпочтительно составляет примерно 10 1 - 1 10 После конструкции и синтеза конъюгатов и определения оптимального в отношении эффективной трансфекции соотношения конъюгата и ДНК количество конъюгата, которое можно заменять свободным веществом со сродством нуклеиновой кислоты, можно определять путем титрования Если поликатионы применяют как в качестве связывающего фактора, так и в качестве свободного вещества со сродством для нуклеиновой кислоты, то поликатионы могут быть идентичными или же различными При получении предлагаемой системы, включающей конъюгаты вируса, целесообразно поступать следующим образом Сначала подбирают генный конструкт, который подлежит переносу в клетку, и вирус или его компонент, пригодный для данной трансфекции. Затем вирус или его компонент связывают с поликатионом и переводят в комплекс с генным конструктом. Исходя из определенного количества конъюгата вируса можно осуществ 43 26746 лять титрование путем обработки целевых клеток этим (постоянным) количеством конъюгата и уменьшения концентрации ДНК, или наоборот Таким образом определяют оптимальное соотношение ДНК и конъюгата вируса Если применять дополнительный содействующий поглощению клеткой фактор, то оптимальное соотношение конъюгата вируса и конъюгата содействующего поглощению клеткой фактора можно определить путем титрования с применением определенного количества ДНК. Комплексы можно получать путем смешивания нуклеиновой кислоты, конъюгата вируса и, в случае необходимоти, конъюгата содействующего поглощению клеткой фактора и связывающего фактора, а также нековалентно связанного вещества со сродством для нуклеиновой кислоты При этом все компоненты могут иметься в виде разбавленных растворов Если поликатионы применяют в качестве связывающего фактора и одновременно в качестве "свободных" поликатионов, то целесообразно сначала получать смесь конъюгатов со "свободными" поликатионами и затем объединять эту смесь с ДНК. Оптимальное соотношение ДНК и конъюгата или конъюгатов и поликатионов определяют путем многократного титрования, при этом осуществляют серию процессов трансфекции с применением постоянного количества ДНК и повышающихся количеств смеси конъюгата или конъюгатов и поликатиона. Оптимальное соотношние конъюгата или конъюгатов и поликатионов в смеси можно определять, например, путем сравнивания оптимальных составов смесей, применяемых в процессах многократного титрования. Комплексы ДНК можно получать при физиологических концентрациях солей. Другая возможность заключается в применении высоких концентраций солей (примерно 2М NaCI) и последующем до* ведении до физиологических условий путем медленного разбавления или диализа. Наиболее целесообразна последовательность смешения компонентов нуклеиновой кислоты, конъюгата или конъюгатов и, в случае необходимости, нековалентно связанного вещества со сродством для нуклеиновой кислоты предвари гельно определяют в рамках серии соответствующих опытов. В некоторых случаях может быть целесообразным предварительное образование комплекса нуклеиновой кислоты и конъюгата или конъюгатов^ последующим добавлением "свободного" ве 5 10 15 20 25 30 35 40 45 50 55 щества со сродством для нуклеиновой кислоты, например, поликатиона, например, в случае конъюгатов трансферина и димерного этидия и полилизина. Согласно предпочтительному варианту данного изобретения в качестве содействующего поглощению клеткой фактора и дополнительного содействующего поглощению клеткой фактора применяют трансферин, а в качестве связывающего фактора — поликатион. Под термином "трансферин" понимаются естественный и синтетический трансферины, а также модификации трансферина, которые связываются с рецептором и переносятся в клетку. Нуклеиновая кислота поглощается в виде комплексов, в которых конъюгаты содействующего поглощению клеткой факторы и поликатионы имеются в виде комплекса с нуклеиновой кислотой. Если комплексы еще включают нековалентно связанное вещество со сродством для нуклеиновой кислоты, то этим веществом является предпочтительно поликатион. Этот второй поликатион идентичен или же отличен от поликатиона, содержащегося в конъюгате или в обоих конъюгатах. В случае "комбинационных комплексов" нуклеиновая кислота поглощается клеткой в виде комплекса, в котором конъюгаты содействующего поглощению клеткой фактора и эндосомолитические конъюгаты комплексированы с нуклеиновой кислотой. Конъюгаты содействующего поглощению клеткой фактора и поликатиона, которые применяют вместе со свободным вирусом или же вместе с вирусными конъюгатами в комбинационных комплексах, можно получать химическим методом или же рекомбинантным методом в случае применения полипептида в качестве поликатиона. В рамках данного изобретения, предпочтительно применяют конъюгаты, в которых гликопротеин, например, трансферин, и связывающий фактор, связанный друг с другом по меньшей мере через одну углеводную цепь гликопротеина. В отличие от получаемых традиционными методами связывания конъюгатов получаемые данным методом конъюгаты свободны от модификаций, происходящих от применяемого связывающего агента. В случае применения гликопротеинов, по меньшей мере с одной углеводной группой, пригодной для связывания, например, трансферина, получаемые конъюгаты также имеют то преимущество, что их места связывания с гликопротеинами и 45 26746 ?_лщим фактором точно определе ны. Количество применяемого эндосомолитического агента и его концентрация зависят от целевой трансфекции. Целесообразно применять минимальное количество вируса или вирусного конъюгата, которое необходимо для обеспечения поглощения клеткой вируса или вирусного конъюгата и комплекса нуклеиновой кислоты и высвобождения из ядрышек. Количество вируса или вирусного конъюгата следует согласовать с данным типом клетки, причем в первую очередь следует учесть эффективность вируса для данного типа'клетки. Другим критерием является применяемый конъюгат содействующего поглощению клеткой фактора и связывающего фактора, в частности в отношении содействующего поглощению клеткой фактора, для которого целевая клетка имеет определенное число рецепторов. Кроме того, количество вируса или вирусного конъюгата зависит от количества переносимой ДНК. Обычно небольшое количество вируса достаточно для обеспечения устойчивой трансфекции, для которой требуется лишь небольшое количество ДНК. В противоположность этому в случае осуществления временной трансфекции, требующей большего количества ДНК, вирус должен применяться в большем количестве. В определенных случаях целесообразно проводить предварительные эксперименты с применением предназначенных для трансфекции целевых клеток, в случае необходимости в виде смешанной популяции, и предназначенной для трансфекции векторной системы с тем, чтобы определить оптимальную концентрацию вируса путем титрования. При этом в качестве ДНК целесообразно применять генный конструкт, который по размеру в основном совпадает с тем веществом, предназначенным для данного конкретного случая, и содержит репортерный ген для более простого определения эффективности переносагена. Подходящими репортерными генами для осуществления таких опытов являются люцифераза и (5галактосидаза. 5 10 15 20 25 30 35 40 ^& 50 46 короткого промежутка времени, чтобы обеспечить эффективный одновременный контакт компонентов. Если применять свободный вирус в виде отдельного препарата, то одновременная дача препарата свободного вируса и комплексов может обеспечиваться за счет того, что препараты вируса являются частью среды трансфекции, содержащей комплекс нуклеиновой кислоты. В случае одновременной аппликации свободного вируса комплексы нуклеиновой кислоты и препарат вируса предварительно смешивают друг с другом. Согласно предпочтительному варианту данного изобретения эндосомолитический агент является компонентом комбинационного комплекса. В определенных случаях может быть целесообразным применение лизосоматропного вещества дополнительно к эндосомолитическому агенту, например, если эндосомолитический агент представляет собой эндосомолитический конъюгат пептидов или ретровирус, эндосомолитическая активность которых не зависит от кислой величины рН. Известно, что лизосомотропные вещества тормозят активность протеаз и нуклеаз и поэтому могут тормозить деграцию нуклеиновых кислот. Такими веществами являются, например, хлорохин, моненсин, нигерицин и метиламин. Было найдено, что моненсин позволяет повысить экспрессию релортерного гена в случае применения ретровируса Молонея. Присутствие хлорохина приводит к экспрессии репортерного гена, завезенного переносом ДНК в присутствии трансферина, почти 100%-но в клетках К562. Клетки BNL.CL2 или гепатоциты HepG2 не реагируют на воздействие хлорохина, они могут трансфецироваться до уровня 5 — 1 0 % в случае использования эндосомолитических свойств дефектного повторной репликацией или химически инактивированного свободного аденовируса. Данное изобретение позволяет усилить преимущества биологических векторов. В результате распределения рецепторов получается тропизм для содействующего поглощению клеткой фактора и вируса. Согласование этих двух компонентов с применяемой популяцией клеток позволяет достичь более высокой селективности, что, в частности, имеет важное значение при применении изобретения для терапевтических целей. При осуществлении данного изобретения предпочитается одновременное применение комплекса нуклеиновой кислоты и эндосомолитического агента. Но вполне 55 возможно и их последовательное применение. В случае раздельного применения последовательность не является критичесДругим объектом данного изобретекой при условии, что мероприятия провония являются фармацевтические композидят друг за другом с соблюдением только • ции, которые содержат в качестве актив 47 26746 ного вещества комплекс терапевтически активной нуклеиновой кислоты, предпочтительно в качестве частей генного конструкта, эндосомолитический агент (в случае необходимости в виде конъюгата) и, в случае необходимости, конъюгат содействующего поглощению клеткой фактора При этом можно применять любой инертный фармацевтический приемлемый носитель такой как, например, солевой раствор, который может содержать фосфатный буфер, или же любой носитель, в котором комплексы ДНК являются растворимыми в требуемой степени. Способ приготовления фармацевтической композиции широко известен. Данное изобретение обеспечивает максимальную гибкость при его осуществлении, например, при его применении в виде фармацевтической композиции. Предлагаемая система может иметься в виде лиофилизата или же содержаться в подходящем буфере в глубоко замороженном состоянии. Ее можно также применять в качестве готового к применению реагента в растворе, предпочтительно в охлажденном виде. Необходимые для трансфекции компоненты, то есть ДНК, эндосомолитический агент, в случае необходимости в виде конъюгата или в готовом к образованию конъюгата с соответствующим партнером, связывающее ДНК вещество, в случае необходимости в виде конъюгата с содействующим поглощению клеткой фактором, в случае необходимости свободный поликатион, могут содержаться в подходящей буферной системе или же могут представлять собой градиенты трансфекционного комплекта. Если трансфекционный комплект применяют в качестве модульной системы, то он может содержать различные ДНК, например, ДНК, кодирующие различные антигены, и/или различные конъюгаты содействующего поглощению клеткой фактора. Решение вопроса применения компонентов в виде готового к применению препарата или же их смешение непосредственно перед применением зависит, между прочим, от устойчивости комплексов, которая может заранее определяться известными методами. Согласно предпоч тительному варианту изобретения в качестве ингредиента комплекта может применяться полученный с помощью трансглютаминазы конъюгат аденовируса и полилизина, который является устойчивым при хранении. Согласно другому предпочтительному варианту изобретения биотинилированный аденовирус и 48 стрептавидин/полилизин смешивают друг с другом перед применением. Предлагаемую систему можно апплицировать системно, предпочтительно внут5 ривенным путем, в качестве частей фармацевтической композиции. Целевыми органами, на которые направлена данная аппликация, могут быть печень, селезенка, легкие, костный мозг и опухоли. При10 мером местной аппликации является легочная ткань (применение предлагаемой системы в качестве частей фармацевтической композиции, представляющей собой жидкость для инстиляции или аэро15 золь для ингаляции). Кроме того фармацевтические композиции можно также апллицировать путем непосредственного впрыскивания в печень, мышечную ткань, опухоль или же путем местной дачи в 20 желудочно-кишечный тракт. Другим методом дачи фармацевтической композиции является введение через дренажную систему желчи. Этот метод обеспечивает непосредственный доступ к мембранам ге25 патоцитов на канальцах желчи, чем избегается взаимодействия композиции с компонентами крови. Известно, что миобласты (незрелые мышечные клетки) способны к транспорту 30 генов в мышечные волокна мышей. Так как миобласты могут выделять генный продукт в кровь, этот подход может получать более широкое применение, чем обработка генетических дефектов мышечных кле35 ток, как, например, дефекта, выраженно" го мышечной дистрофией. Следовательно, соответственно подготовленные миобласты можно применять для выделения генных продуктов, которые либо дейст40 вуют в крови либо транспортируются кровью. Эксперименты в соответствии с данным изобретением показывали, что культуры миобластов и мышечных трубочек, даже первичные, можно подвергать 45 высокоэффективной трансфекции. Наиболее пригодная среда трансфекции содержала комбинационные комплексы биотинилированного аденовируса, трансферина/ полилизина и стрептавидина/полилизина. 50 Кроме репортерных генов люциферазы и р-галактозидазы в мышечных клетках экспрессироаался фактор VW. Кроме того, куриный аденовирус CELO применялся в комбинационных комплексах, содержащих агг55 лютинин пшеничного зачатка в качестве дополнительного содействующего поглощению клеткой фактора. Терапевическое применение может также осуществляться ex vivo, причем обработанные клетки, например, клетки кост 49 26746 ного мозга, гепатоциты или миоблксты, возвращаются в тело. Другое применение ex vivo предлагаемой системы сводится к аппликации так называемых "раковых вакцин". Принцип этого терапевтического под-^ 5 хода заключается в выделении опухолевых клеток из пациента и трансфекции клеток ДНК, кодирующей цитокин. Следующий прием может заключаться в инактивации клеток, например, путем облуче- 10 ния, которое проводится с таким расчетом, что клетки больше не обладают способностью к репликации, но все еще способны к экспрессии цитокина. Затем генетически модифицированные клетки в ка- 15 честве вакцины дают пациенту, из которого клетки были изолированы. В зоне сайта вакцинации выделяемые цитокины активируют иммунную систему, например, за счет активации цитотоксичных Т-кле- 20 ток. Эти активированные клетки способны к проявлению своего действия в других частях тела и к воздействию на необработанные опухолевые клетки. Таким образом риск повторного образования опу- 25 холи и образования метастазов снижается. В экспериментах согласно данному изобретению первичные меланомные клетки успешно подвергались трансфекции ре- 30 портерным геном, который содержался в комбинационных комплексах связанного с полилизином аденовируса и трансферина/полилизина. Данное изобретение может также ис- 35 пользоваться для определения иммунореакции хозяина на заданный антиген. Такие испытания основаны на переносе гена в экспрессирующие антиген клетки. Специфичные в отношении антигена ци- 40 тотоксичные Т—лимфоциты (далее: "ЦТЛ"), которые разрушают инфицированные клетки, играют важную роль в защите хозяина от вирусных инфекций или опухолей. Взаимодействие между Т-клеткой и представ- 45 ляющей антиген клеткой (далее "ПАК") ограничено лимфоцитными антигенами человека (далее: "ЛАЧ"), которые являются молекулами большой тканевой совместимости. Для осуществления исследования 50 степени разрушения ЦТЛ экспрессирующих антиген клеток в рамках опыта in vitro необходимо представлять антиген ЦТЛ в правильном контексте ЛАЧ. Такое исследование можно осуществлять еле- 55 дующим образом. ПАК подвергают трансфекции конструктом ДНК, содержащим последовательность кодирующую антиген. Эпитропы антигена будут связываться с МНС класса I и будут иметься на поверх 50 ности клетки в качестве мишени для специфичной в отношении ЦТЛ реакции. После инкубации вместе с пробой сыворотки пациента, зависящей от присутствия специфичных ЦТЛ, СіАК будет подвергаться лизису. При этом лизис измеряют за счет определения выделения, например, радиоактивного хрома, который включился в ПАК перед добавлением к сыворотке. Индуцированные Б—лимфопластоидные клеточные линии можно применять для экспрессии генов антигена путем трансфекции рекомбинантными вирусами вакцинии. Однако клетки, которые эффективно экспрессируют антиген в течение примерно одного дня, умирают в результате литического эффекта вакцинии. Эти трудности можно преодолеть при применении предлагаемой системы для введения кодирующих антиген конструктов ДНК, например, конструктов, кодирующих антигены СПИДа или опухолевые антигены, в фибробласты с тем, чтобы сообщить им способность к экспрессии антигена. Первичные фибробласты можно легко получать путем биопсии, легко выращивать и поддаются высокоэффективной трансфекции (со степенью примерно 50 — 70%) предлагаемой системой. Такие анализы полезны для идентификации распознаваемых клетками-килерами эпитопов в отношении вакцин. Кроме того, они могут преимущественно применяться для определения ограниченной ЛАЧ иммуной реакции индивидуума на заданный антиген. Изобретение может использоваться для производства рекомбинантных белков, так как почти во всех клетках достигается высокая степень экспрессии переносимых генов. При этом в отношении последовательностей и молекулярного веса переносимой ДНК существуют лишь некоторые ограничения или же ограничений вообще не существует. Имеется широкий спектр различного рода клеток, которые поддаются трансфекции предлагаемыми конструктами ДНК. Так, например, клетки почти любого типа можно применять для производства рекомбиуантных белков с высокой биологической активностью. Перенос гена в клетки можно осуществлять тем же образом, что и показано для люциферазы и ос-интерферона, то есть практически любой генный конструкт, который обеспечивает получение желаемого белкового продукта, может транспортироваться указанным образом. Желаемый белковый продукт можно выделять из трансфецированной клеточной культуры (либо надосадочной жидкости 51 26746 культуры либо подходящего продукта ее гомогенизации) через 24 ч или же через одну неделю после трансфекции. Выделение возможно также по истечении более продолжительного периода после трансфекции. Использование предлагаемой системы для производства рекомбинантных белков имеет следующие преимущества. 1. Благодаря высокой эффективности трансфекции (более 90 % трансфецированных клеток способны к экспрессии соответствующего гена на высоком уровне), предварительный отбор положительно трансфецированных клеток не требуется и, кроме того, нет необходимости в подборе устойчивых клеточных линий. Небольшая клеточная культура может быть достаточной для производства белка в необходимом количестве. 2. Большие генные конструкты могут транспортироваться. До сих пор с успехом переносились в клетки конструкты размером до 48 к.п.о. 3. Экспрессия гена может осуществляться в клетках, которые обеспечивают подходящие пост-трансляционные переработку и модификацию (например, зависящее от витамина А карбоксилирование факторов свертывания крови или специфичного для данного типа клетки гликозилирования). 4. Возможен более широкий подбор типов целевых клеток для экспрессии гена. Изобретение далее описывается с помощью нижеследующих примеров, которые представлены в целях иллюстрации, а не какого-то ни было ограничения его объема. В этих примерах используют следующие материалы и методы, если иного не указано. Получение комплексов ДНК и конъюгата трансферина и полилизина. а) Конъюгаты трансферина и полилизина человека. Раствор 280 мг (3,5 мкмоль) человеческого, свободного от железа трансферина в 6 мл 30 мМ буфера ацетата натрия с рН 5 охлаждают до температуры 0*С и добавляют 750 мкл 30 мМ буфера ацетата натрия с рН 5, содержащего 11 мг (51 мкмоль) периодата натрия. Смесь оставляют стоять в темноте на ледяной бане в течение 90 минут. В целях удаления низкомолекулярных продуктов осуществляют гель-фильтрацию иа йонмте Sephadex G—25. Получают раствор, содержащий примерно 250 мг окисленного трансферина (определение при помощи 5 10 15 20 25 30 35 40 45 50 55 * 52 нингидрина). (Для доказательства окисленной формы, содержащей альдегиды и дающей цветную реакцию при окрашивании анисовым альдегидом, смесь каплями подают на тонкую слоистую пластину силикагеля, сушат, пластины погружают в смесь п-анисового альдегида, серной кислоты и этанола в соотношении 1 : 1 : 18, сушат и нагревают). Раствор модифицированного трансферина быстро добавляют (в течение 10—15 мин) к раствору, содержащему 1,5 мкмоль меченого флуоресцеином поли(1_)лизина со средней длиной 190 лизиновых мономеров, в 4,5 мл 100 мМ ацетата натрия с рН 5. рН раствора доводят до 7,5 путем добавления 1 М буфера бикарбоната натрия. С промежутком одного часа к смеси добавляют 4 раза 28,5 мг (450 мкмоль) цианоборгидрида натрия. Через 17 часов дляют 2 мл 5 М хлористого натрия с тем, чтобы довести раствор до общей концентрации 0,75 М. Реакционную смесь подают на катионнообменную колонку марки Mono S HR 10/10 фирмы Фармация, Швеция, после чего элюируют солевым градиентом 0,75 — 2,5 М хлористого натрия, имеющим постоянное содержание 25 м М HEPES, рН 7,3. Высокая солевая концентрация при подаче на колонку и в начале осуществления градиентной элюации является существенным для получения конъюгатов. Некоторые количества трансферина (примерно 30 %) со слабой флуоресценцией элюируют в начале процесса. Основное количество меченого флуоресценцией конъюгата элюируют при солевой концентрации 1,35 — 1,9 М и его собирают в виде 3 фракций. После двух серий диализа с применением 2 л 25 мМ буфера HEPES, рН 7,3, эти фракции (в порядке их элюации) дают фракцию А, содержащую 45 мг (0,56 мкмоль) трансферина, модифицированного 366 нмоль полилизина (далее этот конъюгат обозначается "TfpL190A"), фракцию Б, содержащую 72 мг (0,90 мкмоль) трансферина, модифицированного 557 нмоль полилизина (далее этот конъюгат обозначается "TfpL190B) и фракцию В, содержащую 7 мг (85 нмоль) трансферина, модифицированного 225 нмоль полилизина (далее этот конъюгат обозначается "TfpL190C"). Если конъюгаты сразу же не подаются на дальнейшее применение, то их замораживают в атмосфере жидкого азота и хранят при температуре —20'С в свободной от железа форме. Перед введением железа пробы (0,5 — 1 мг) доводят до физиологичес 53 26746 кой солевой концентрации (150 мМ) добавлением хлористого натрия. Включение железа осуществляется за счет добавления 4 мкл 10 мМ цитратного буфера железа (Ш) (содержащего 200 мМ цитрата; рН буфера доведен до 7,8 добавлением бикарбоната натрия) на мг содержащегося в конъюгате трансферина. Железосодержащие коныогаты подразделяют на небольшие аликвоты перед их применением для образования комплекса с ДНК, мгновенно замораживают в атмосфере жидкого азота или в сухой атмосфере льда и этанола и хранят при температуре —20*С (этот подход оправдал себя, так как найдено было, что повторяющиеся процессы оттаивания и замораживания приводят к потере активности конъюгатов). б) Конъюгаты мышиного трансферина и полилизина. Применяют подобный метод, что и в случае трансферина человека, при этом связывание осуществляют при помощи боковых углеводных цепей. Применяют 4,1 мг (51 нмоль) мышиного трансферина и 2,1 мг (34 нмоль) полилизина с молекулярным весом 290 {aaj\ee: upl 290"). Получают конъюгаты, состоящие из 15,5 нмоль мышиного трансферина и 13 нмоль pL 290. Плазмидная ДНК, а) ДНК pRSVL. Получение ллазмидной ДНК pRSVL (содержащей ген люциферазы Photinus pyralis под контролем вируса Rous Sarcoma LTR) осуществляют известными приемами с применением тритона X. Далее используют равновесное центрифугирование в градиенте плотности с применением хлорида цезия и бромида этидия, обесцвечивание бутанолом-1 и диализ с применением 10 мМ буфера Tris/HQ (рН 7,5, 1 мМ ЭДТК). Образование комплекса осуществляют за счет смешения 6 мкг плазмидной ДНК в 350 мкл буфера HBS (150 мМ хлористого натрия, 20 мМ HEPES, рН 7,3) с 12 мкг конъюгата трансферина и полилизина в 150 мкл буфера HBS. Комплексообразование осуществляют за 30 мин до добавления комплекса к клеткам. б) ДНК pCMVL Плазмиду pCMVL (репортерный генный конструкт, содержащий ген люциферазы Photinus pyralis под контролем промотера цитомегаловируса) получают за счет удаления вставки BamHI из плазмиды pSTCX556, обработки плазмиды фрагментом Кленова и введения обработанного Hindlll/Sspl и фрагментом Кленова фрагмента из плазмиды pRSVL, содержащего последовательность, кодирующую люци 5 10 15 20 25 30 35 40 45 50 55 54 феразу. ДНК получают аналогично получению ДНК pRSVL Получение препарата вируса. а) Препараты аденовируса. Используют штамм dJ312 аденовируса, имеющий делению в зоне Ela. Репликацию вируса осуществляют в Е1а-транскомплементирующей клеточной линии 293 с последующей очисткой известным приемом. Очищенный вирус подают в предназначенный для хранения буфер (100 мМ THs, рН 8,0, 100 мМ хлористого натрия, 0,1 % альбумина сыворотки крупного рогатого скота (далее: "АСС"), 50 % глицерина) или в буфер HBS с содержанием 40 % глицерина и аликвоты хранят при температуре —70*С. Концентрацию вирио.нов определяют УФ-спектрофотометрическом анализом экстрагированной геномной вирусной ДНК (формула: одна единица оптической плотности соответствует 10 1 2 вирусным частицам на мл). б) Препарат ретровируса. Ретровирус Молонея N2 мышиного лейкоза упаковывают в экотропную упаковочную линию. Надосадочные жидкости, получаемые от экспрессирующих вирус клеток, собирают, мгновенно замораживают в атмосфере жидкого азота и хранят при температуре —20'С. Применяемые в примерах надосадочные жидкости имеют титр примерно 10 6 колониеобразующих единиц на мл (далее: "кое/мл"), который определялся путем образования устойчивых к неомицину колоний с применением клеток NIH3T3. Надосадочные жидкости пропускают через мембрану марки FILTRON, находящуюся в перемешиваемом аппарате для концентрации клеток под давлением азота. При этом 10 — 3 0 мл надосадочной жидкости обычно сгущают в 10 раз. Клетки и среда. Клетки HeLa культивируют в среде DM ЕМ, дополненной 5 % инактивироваиной термообработкой тельячей эмбриональной сыворотки (далее: "ТЭС"), 100 единицами/мл пенициллина, 100 мкг на мл стрептомицина и 2 мМ глутамина. Клетки WI—38, MRC-5 и KB культивируют в среде ЕМЕМ (модифицированной Иглем основной среде), дополненной 10 % инактивированной термообработкой ТЭС, ан- т тибиотиками, содержащимися в среде DMEM, 10 мМ заменимых аминокислот и 2 мМ глутамина. Эпительную клеточную линию дыхательного муковисцитоза СПГ1 культивируют в среде F12—7Х. Для осуществления переноса генов клетки культивируют в снабженных ячейками диамет 55 26746 ром 6 см чашках до достижения степени 5 выращивания 5 х 10 клеток. Среду удаляют и добавляют 1 мл среды DMEM или ЕМЕМ/2 % ТЭС. Затем добавляют комплексы конъюгата и ДНК с последующей немедленной подачи аденовируса dl312 4 (0,05 — 3,2 х 10 частиц в клетку) или сравнимого объема буфера { 1 — 8 0 мкл). Чашки возвращают на инкубацию при температуре 37°С в присутствии 5 % двуокиси углерода в течение одного часа, после чего добавляют 3 мл полной среды. После дополнительной 24-часовой инкубации осуществляют сбор клеток с тем, чтобы определить экспрессию гена люциферазы. В случае клеток CFT1 осуществляют культивацию в среде F12—7Х в течение 4 ч без трансферина человека перед осуществлением переноса гена. Полученные от американской коллекции АТСС клетки имеют следующие регистрационные номера: клетки HeLa: CCL 2; клетки К562: CCL 243; клетки HepG2: НВ 8065; клетки TIB-73: TIB 73 (BNL CL.2); клетки NIH3T3: CRL 1658; клетки 293: CRL 1573; клетки KB: CCL 17; клетки WI-38: CCL 75; клетки MRC 5: CCL 171. Клетки Н9 с регистрационным номером 87 получены от американской организации AIDS Research and Reference Reagent Program, U.S. Department of Health and Human Services. Первичные лимфоциты получают путем подачи 25 мл пробы пуповинной крови в подопытной трубке, содержащей ЭДТК. Под аликвотами размещают нижний слой 4,.5 мл продукта Фиколл-гипак фирмы Фармация, Швеция, и центрифугируют при 2500 об/мин в течение- 15 минут. Коричневатый слой между верхним слоем плазмы и прозрачным слоем Фиколла удаляют (примерно 10 мл). Добавляют 40 мл среды IMDM плюс 10 % ТЭС, пробу центрифугируют при 1200 об/мин в течение 15 минут и клеточный материал суспендируют в 50 мл свежей среде IMDM плюс 10 % ТЭС (плотность клеток составляет примерно 2 х 106 клеток/мл). Добавляют 250 мкл аликвота фитогемагглютинина, культуру инкубируют при температуре 37°С в течение 48 часов в присутствии 5 % двуокиси углерода и добавляют рекомбинантный интерлейкин-2 (концентрация: 20 единиц на мл). Клетки разбавляют в отношении 1: 3 средой IMDM плюс 20 % ТЭС, содержащей 2 единицы интерлейкина-2 на мл. Аликвоты клеток подвергают глубокому замораживанию в атмосфере жидкого азота в присутствии 5 % метилсульфоксида. Перед применением 5 10 15 20 25 30 35 40 45 50 55 56 клетки выращивают в среде IMDM, содержащей 20 % ТЭС и 2 единицы интерлейкина-2 на мл. Для осуществления последующего процесса связывания клетки HeLa уравновешивают при температуре 4*С в 1 мл среды DMEM, дополненной 2 % ТЭС. Комплексы конъюгата и ДНК добавляют тем же образом, что и в других случаях и чашки инкубируют при температуре 4°С в течение 2 часов. Затем чашки интенсивно промывают холодной как лёд средой DMEM, содержащей 2 % ТЭС, после чего добавляют 2 мл этой среды. Добавляют аденовирус d!312 или буфер, клеткам дают медленно нагреваться, после чего их подают на 24-часовую инкубацию. После инкубации осуществляют сбор клеток и исследование на экспрессию гена люциферазы. Определение активности люциферазы. Приготовление клеточных экстрактов, стандартизацию содержания белка и определение активности люциферазы осуществляют широкоизвестными методами. П р и м е р 1. Определение действия аденовируса на перенос гена с применением конъюгатов трансферина и полилизина. Сначала исследуют действие повышающихся доз вируса на способность определенного количества комплекса конъюгата и ДНК к осуществлению переноса гена. В целях образования комплекса 6 мкг плазмиды pRSVL смешивают с 12 мкг конъюгата человеческого трансферина и полилизина (далее: "hTfpl_190B"). Комплекс конъюгата и ДНК, а также различные количества аденовируса d!312 (0,05 — 3,2 х 104 вирусных частиц на клетку) добавляют к клеткам HeLa. Результаты данного опьіта представлены на фиг 1. Активность люциферазы выражается в световых единицах 50 мкг общего клеточного белка. Согласно данному анализу повышающиеся количества добавляемого аденовируса приводят к соответствующему улучшению переноса гена. На рисунке представлены средние значения 2—4 отдельных опытов. Балки указывают стандартное отклонение. • П р и м е р 2. Действие, достигаемое в зависимости от количества комплекса конъюгата и ДНК. Комплексы конъюгата ДНК в виде полученных тем же образом, что и в примере 1 логарифмических разбавленных препаратов добавляют к клеткам HeLa вместе с постоянным количеством аденовиру 57 26746 ca df312 (1 x 10 4 вирусных частиц на клетку) или же без него. Активность люциферазы определяют тем же образом, что и в примере 1. Результаты опыта представлены на фиг. 2. П р и м е р З . Улучшение переноса гена, достигаемое конъюгатом трансферина и полилизина в присутствии аденовируса, имеет место через вызываемый рецептором эндоцитоз. а) Действие аденовируса на перенос имеющейся в виде комплекса ДНК. Для осуществления трансфекции используют следующие компоненты. 6 мкг ДНК pRSVL без конъюгата трансферина и полилизина (DNA); 6 мкг ДНК pRSVL и 6 мкг несопряженного полилизина с молекулярным весом 270 (ОНА + pl_y, 6 мкг ДНК pRSVL и 12 мкг конъюгата трансферина и полилизина с молекулярным весом 190, применяемого в предыдущих примерах (DNA + hTfpL190B). Указанные материалы добавляют к клеткам HeLa вместе с аденовирусом d!312 в концентрации 1 х 10* вирусных частиц на клетку (dl312) или без него. Получение клеточных экстрактов,стандартизация общего клеточного белка и определение активности люциферазы осуществляют вышеуказанным образом. Результаты опыта представлены на фиг. 3. б) Действие аденовируса на перенос связанной с рецептором ДНК. Комплексы конъюгата и ДНК (DNA + +hTfpl190B) или комплексы полилизина и ДНК (PNA + pL) связывают с клетками HeLa затечет инкубации при температуре 4*С. Несвязанный комплекс удаляют перед добавлением аденовируса dl312 в концентрации 1 х 10* вирусных частиц на клетку (dl312) или сравнимого количества буфера. Затем осуществляют инкубацию при температуре 37'С, направленную на обеспечение включения клеткой связанного комплекса ДНК и аденовируса. Активность люциферазы определяют вышеуказанным образом. Результаты представлены на фиг.ЗЬ. в) Действие аденовируса на перенос гена с применением конъю«~атов трансферина и полилизина. Комплексы конъюгата и ДНК, содержащие 6 мкг ДНК pRSVL и 12 мкг конъюгата трансферина и полилизина (DNA + hTfpL190B) добавляют к клеткам HeLa вместе с аденовирусом в концентрации 1 х 10 4 вирусных частиц на клетку
ДивитисяДодаткова інформація
Автори англійськоюCuriel David, Zatloukal Kurt, Oberhauser Berndt
Автори російськоюКариэл Девид, Цатлоукал Курт, Обэрхаузэр Бернд
МПК / Мітки
МПК: C12N 15/00, C12Q 1/06
Мітки: еукаріотичних, вищих, композиція, трансфекційна, клітин
Код посилання
<a href="https://ua.patents.su/100-26746-transfekcijjna-kompoziciya-dlya-vishhikh-eukariotichnikh-klitin.html" target="_blank" rel="follow" title="База патентів України">Трансфекційна композиція для вищих еукаріотичних клітин</a>
Наступний патент: Пристрій виводу тактильної інформації
Випадковий патент: Спосіб отримання літієвої батареї