Похідні азаіндазолу або діазаіндазолу як медикамент
Номер патенту: 109698
Опубліковано: 25.09.2015
Автори: Крюзінскі Анна, Райє Ніколя, Беджегелаль Карім, Перес Мішель, Калун Ель Бахір, Рабо Ремі, Шмітт Філіпп
Формула / Реферат
1. Сполука загальної формули (І)
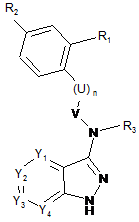 (І)
(І)
або її фармацевтично прийнятна сіль або сольват, або таутомер, або стереоізомер чи суміш стереоізомерів в будь-яких пропорціях, така як суміш енантіомерів, зокрема рацемічна суміш, де:
Υ1 та Y4 кожен незалежно один від одного позначають СН-групу або атом азоту,
Y2 позначає С-Х-Аr-групу, a Y3 позначає атом азоту чи C-W-групу, або
Y2 позначає атом азоту чи СН-групу, і Y3 позначає С-Х-Аr-групу,
за умови, що:
принаймні одна та не більше двох груп Υ1, Υ2, Y3 та Y4 позначають атом азоту, і
Y2 та Y4 не можуть бути атомами азоту одночасно,
Аr позначає арильну або гетероарильну групу, можливо заміщену однією чи декількома групами, вибраними з атома галогену, (С1-С6)-алкілу, (С1-С6)-галогеналкілу, (С1-С6)-галогеналкокси, (С1-С6)-галогентіоалкокси, CN, NO2, OR11, SR12, NR13R14, CO2R15, CONR16R17, SO2R18, SO2NR19R20, COR21, NR22COR23, NR24SO2R25 та R26NR27R28, та/або можливо конденсовану з гетероциклом,
X позначає двовалентну групу, вибрану з О, S, S(O), S(O)2, NR4, S(NR4), S(O)(NR4), S(O)2(NR4), NR4S, NR4S(O), NR4S(O)2, CH2, CH2S, CH2S(O), CH2S(O)2, SCH2, S(O)CH2, S(O)2CH2, CH2CH2, CH=CH, C=C, CH2O, OCH2, NR4CH2 та CH2NR4,
W представляет R5-, SR5-, OR5- або NR5R6-групу,
U позначає СН2- або NH-групу, один чи декілька атомів водню якої можуть бути заміщені (С1-С6)-алкільною групою,
V позначає С(О), C(S) або СН2,
n позначає 0 або 1,
R1 позначає атом водню або OR7- чи NR7R8-групу,
R2 позначає атом водню, можливо заміщений гетероцикл, NO2, OR9 або NR9R10,
R3, R4, R11-R25 та R27-R28 кожен незалежно один від одного позначають атом водню або (С1-С6)-алкільну групу,
R5 та R6 кожен незалежно один від одного позначають атом водню або (С1-С6)-алкіл, можливо заміщений арилом або бензильною групою,
R7, R8, R9 та R10 кожен незалежно один від одного позначають атом водню або можливо заміщений (С1-С6)-алкіл або (С3-С12)-циклоалкіл або можливо заміщений гетероцикл, і
R26 позначає (С1-С6)-алкільну групу.
2. Сполука за п. 1, в якій
Y1 та/або Υ4=Ν,
Y2=CH або С-Х-Аr, і
Y3=C-W або С-Х-Аr.
3. Сполука за п. 1 або 2, в якій X позначає двовалентну групу, вибрану з S, S(O), S(O)2, NR4, СН2, CH2S, CH2S(O), CH2S(O)2, СН2О, CH2NR4, NHS(O)2, SCH2, S(O)CH2, S(O)2CH2, S(O)2NH, OCH2, NR4CH2, CH2CH2, CH=CH та С=С; зокрема, вибрану з S, S(O), S(O)2, NR4, CH2, SCH2, S(O)CH2, S(O)2CH2, S(O)2NH, CH2CH2, C=C, OCH2 та NR4CH2; зокрема, вибрану з S, S(O)2, CH2, SCH2, S(O)2CH2, S(O)2NH, CH2CH2 та С=С, де перший атом цих груп зв'язаний з атомом С ланцюга С-Х-Аr.
4. Сполука за будь-яким з пп. 1-3, в якій Аr позначає арильну групу, таку як феніл, можливо заміщений однією чи декількома групами, вибраними з атома галогену, (С1-С6)-алкілу, (С1-С6)-галогеналкілу, (С1-С6)-галогеналкокси, (С1-С6)-галогентіоалкокси, CN, NO2, OR11, SR12, NR13R14, CO2R15 та CONR16R17, SO2R18, SO2NR,9R2o, COR21, NR22COR23 та NR24SO2R25, або піридинову групу.
5. Сполука за п. 4, в якій Аr позначає групу, вибрану з таких груп:
 ,
,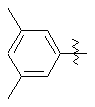 ,
, ,
, ,
, ,
,
 ,
, ,
, ,
, ,
,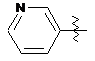 .
.
6. Сполука за будь-яким з пп. 1-5, в якій W позначає R5, SR5, OR5 або NR5R6, де R5 та R6 є, незалежно один від одного, атомом водню або (С1-С6)-алкільною групою.
7. Сполука за будь-яким з пп. 1-6, в якій -R3=H,
U=CH2 або NH,
V=C(O) або C(S), зокрема С(О), і
n=0 або 1, зокрема 0.
8. Сполука за будь-яким з пп. 1-7, в якій R1 позначає атом азоту або групу NR7R8, де R7 є атомом водню і R8 позначає можливо заміщену (С3-С12)-циклоалкільну групу або можливо заміщений гетероцикл.
9. Сполука за п. 8, в якій R1 позначає одну з таких груп:
Н, 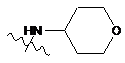 тa
тa  .
.
10. Сполука за будь-яким з пп. 1-9, в якій R2 позначає NO2, NR9R10 або гетероцикл, можливо заміщений (С1-С6)-алкілом або NH2.
11. Сполука за п. 10, в якій R2 позначає одну з таких груп:
NH2, NH(CH2)3NMe2, NMe(CH2)3NMe2, NO2, 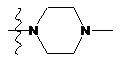 ,
, 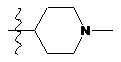 та
та 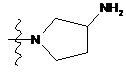 .
.
12. Сполука за будь-яким з пп. 1-11, де сполуку вибирають з групи, що включає:
14-2

14-10
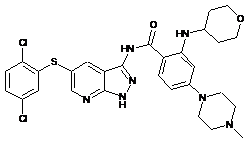
14-11

15

26-4
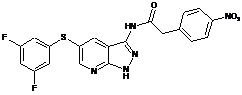
26-8

27

27-1

28

29

29-а

30
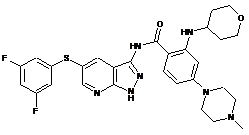
30-1

30-3
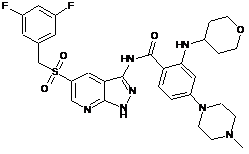
30-4
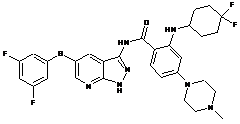
30-5
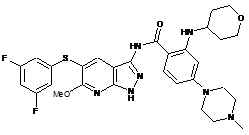
30-8

30-9
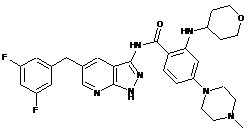
30-10

30-11
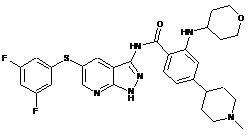
30-12

30-a

31

32

32-1
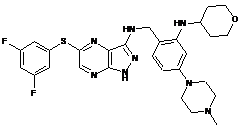
33

35

26-12
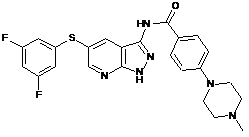
30-69

27-2

27-3

27-4

30-73

14bis

30-70

30-71

30-72

27-5

30-13

30-14

30-15

30-16

30-17

30-18

30-19

30-20

30-21

30-22

30-23

30-24

30-25
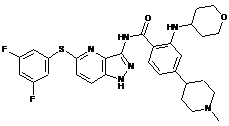
30-26

30-27

30-28
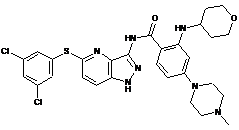
30-29
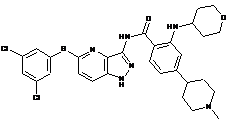
30-30

30-31

30-32

30-33

30-34

30-35
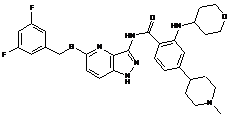
30-36

30-37

30-38

30-39
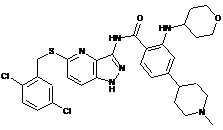
30-40

30-41

30-42

30-43

30-44

30-45

30-46
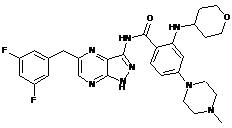
30-47
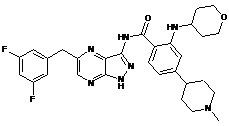
30-48
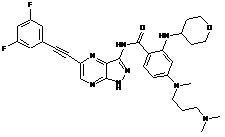
30-49
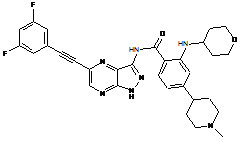
30-50
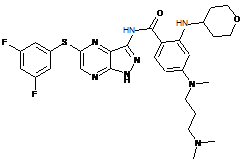
30-51
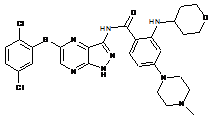
30-52
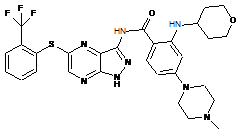
30-53
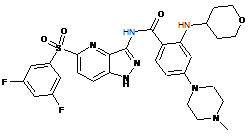
30-54
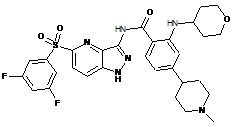
30-55
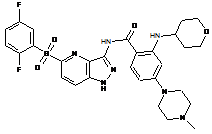
30-56
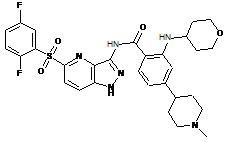
30-57
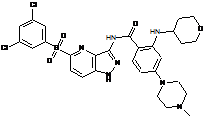
30-58
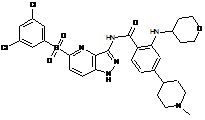
30-59
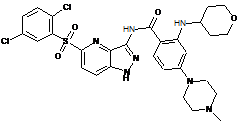
30-60
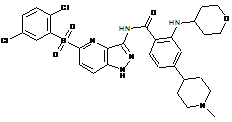
30-61
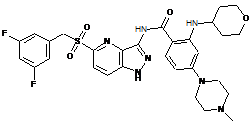
30-62
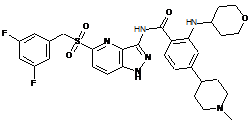
30-63
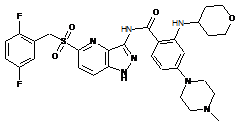
30-64
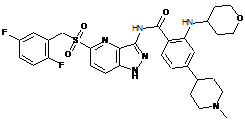
30-65
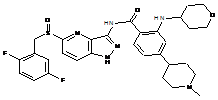
30-66

30-67
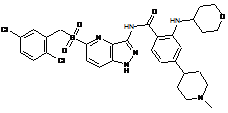
30-68

31-1
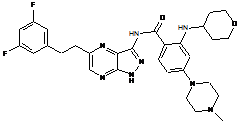
13. Застосування сполуки за будь-яким з пп. 1-12 як лікарського засобу.
14. Застосування за п. 13 як лікарського засобу, призначеного для лікування раку, запалення та нейродегенеративних захворювань, таких як хвороба Альцгеймера, особливо раку.
15. Застосування за п. 13 як лікарського засобу, призначеного для лікування хвороб, асоційованих з кіназою, такою як ALK, Abl та/або c-Src.
16. Застосування сполуки за будь-яким з пп. 1-12 як інгібітора кіназ, таких як ALK, Abl та/або c-Src.
17. Фармацевтична композиція, яка містить принаймні одну сполуку формули (І) за будь-яким з пп. 1-12 та принаймні один фармацевтично прийнятний ексципієнт.
18. Фармацевтична композиція за п. 17, яка додатково містить принаймні один активний інгредієнт, такий як антираковий агент.
19. Фармацевтична композиція, що містить
а) принаймні одну сполуку формули (І) за будь-яким з пп. 1-12, і
б) принаймні один інший активний інгредієнт, такий як антираковий агент,
як комбінований продукт для одночасного, роздільного або послідовного застосування.
20. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-12, де V=C(O) або C(S), краще С(О) і, зокрема, U=СН2, в якому здійснюють послідовні стадії, за якими:
(а1) проводять реакцію сполучення між сполукою формули (А):
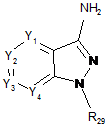 , (A)
, (A)
де Y1, Y2, Y3 та Y4 визначені в пункті 1, і R29 позначає атом водню або N-захисну групу,
та сполукою формули (В):
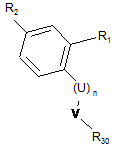 , (B)
, (B)
де R1, R2, U та n визначені в пункті 1, V=C(O) або C(S), і R30 позначає ОН або відхідну групу, таку як Сl,
з одержанням сполуки формули (С):
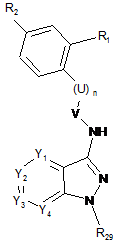 , (C)
, (C)
де Y1, Y2, Y3, Y4, R1, R2, U та n визначені в пункті 1, R29 визначений вище і V=C(O) або C(S),
(b1) при необхідності, вводять замісник до атома азоту, зв'язаного з V сполуки формули (С), одержаної на попередній стадії, R3-групою, що відрізняється від Н, та/або знімають захист атома азоту, що несе R29-групу, яка є N-захисною групою, з одержанням сполуки формули (І), де V=C(O) або C(S),
(с1) при необхідності, утворюють сіль сполуки формули (І), одержаної на попередній стадії, з одержанням фармацевтично прийнятної солі цієї сполуки.
21. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-12, де V=CH2, і, зокрема, U=СН2, в якому здійснюють послідовні стадії:
(а2) проводять реакцію відновного амінування між сполукою формули (А), визначеної в п. 20, та альдегідом такої формули (D):
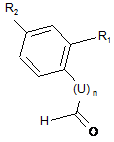 , (D)
, (D)
де R1, R2, U та n визначені в пункті 1,
з одержанням сполуки такої формули (Е):
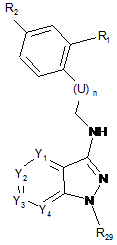 , (E)
, (E)
де Y1, Y2, Y3, Y4, R1, R2, U та n визначені в пункті 1, і R29 визначений в пункті 20,
(b2) при необхідності, знімають захист атома азоту, що несе R29-групу, яка є N-захисною групою, та/або вводять замісник до атома азоту, зв'язаного з V групи R3, що відрізняється від Н, сполуки формули (Е), одержаної на попередній стадії, з одержанням сполуки формули (І), де V=СН2, і
(с2) при необхідності, утворюють сіль сполуки формули (І), одержаної на попередній стадії, з одержанням фармацевтично прийнятної солі цієї сполуки.
22. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-12, де V=C(O) або C(S), n=1 і U=NH, в якому здійснюють такі послідовні стадії:
(а3) проводять реакцію сполучення між сполукою формули (А), такою, як визначено в пункті 1, та сполукою такої формули (F):
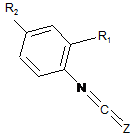 , (F)
, (F)
де R1 та R2 визначені вище і Z=O або S,
з одержанням сполуки такої формули (G):
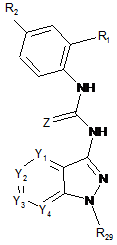 , (G)
, (G)
де Y1, Y2, Y3, Y4, R1 та R2 визначені в пункті 1, R29 визначений в п. 20 і Ζ визначений вище,
(b3) при необхідності, знімають захист атома азоту, що несе R29-групу, яка є N-захисною групою, та/або вводять замісник до атома азоту, зв'язаного з V групи R3, що відрізняється від Н, сполуки формули (G), одержаної на попередній стадії, з одержанням сполуки формули (І), де V=C(O) aбo C(S), n=1 тa U=NH, і
(с3) при необхідності, утворюють сіль сполуки формули (І), одержаної на попередній стадії, з одержанням фармацевтично прийнятної солі цієї сполуки.
Текст
Реферат: Винахід стосується сполуки такої загальної формули (І) UA 109698 C2 (12) UA 109698 C2 R2 R1 (U) n V R3 N Y1 Y2 Y3 N Y4 N H (І) або її фармацевтично прийнятної солі або сольвату, таутомеру, стереоізомера або суміші її стереоізомерів в будь-якій пропорції, такої як суміш енантіомерів, зокрема рацемічна суміш, її застосування як лікарського засобу, призначеного насамперед для лікування раку, запалень та нейродегенеративних захворювань, таких як хвороба Альцгеймера, її застосування як інгібітора кіназ, фармацевтичних композицій, що містять дану сполуку, та способів її одержання. UA 109698 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід стосується конденсованих біциклічних похідних азаіндазолу та діазаіндазолу, а також їх терапевтичного застосування, особливо при лікуванні раку, запалення та нейродегенеративних захворювань, таких як хвороба Альцгеймера, а також способів їх синтезу. Протеїнкінази є ензимами, які відіграють ключову роль в сигнальній трансдукції клітини. Вони залучені, наприклад, в такі фізіологічні процеси, як клітинна проліферація, мітоз, диференціація, клітинна інвазія та мобільність, а також апоптоз. Дерегуляція фізіологічних механізмів, контрольованих протеїнкіназами, є основною причиною появи та розвитку численних патологій, зокрема, ракових захворювань. Важливо відзначити, що багато онкогенів та протоонкогенів є протеїнкіназами. Таким чином, ці ензими, видимо, відіграють важливу роль в різних стадіях розвитку пухлини і, отже є важливою фармацевтичною мішенню при лікуванні раку. Рецептори тирозинкінази (TKR) складають особливий клас протеїнкіназ, поміж яких можна згадати ALK, EGFR, Her2, PDGFR, Kit, VEGFR, IGFR, FGFR, Trk, Axl, Mer, Met, Ron та Ret. В цій підгрупі ALK розглядається як особливо придатна мішень, оскільки вона генетично модифікується при певних пухлинних патологіях і таким чином набуває онкогенної природи. Точніше, хромосомні транслокації, що приводять до продукування злитих протеїнкіназ (ALK-X), які потім постійно активуються, є причиною розвитку певних ракових захворювань. ALK в онкогенній формі експресується в різноманітних пухлинних патологіях різних гістологічних типів. Таким чином, ці патології є ALK-зависимими. ALK в онкогенній формі існує тільки в пухлинних клітинах і не експресується в нормальних клітинах. Внаслідок цього ця протеїнкіназа забезпечує можливість специфічно діяти тільки на ALK-залежні пухлинні утворення, в той самий час зберігаючи здорові тканини від значних токсичних ефектів (Ott G.R. et al., Anticancer Agents Med. Chem., 2010, 10(3), 236-49). Декілька випадків хромосомних транслокацій, що включають ALK, які відносяться до ракових патологій, вже задокументовані. Наприклад, злитий протеїн NPM-ALK асоціюється с анапластичною великоклітинною лімфомою (АВКЛ), оптимальний спосіб лікування якої ще потребує розробки. Аналогічно, злитий протеїн EML4-ALK асоциійований з розвитком пухлини в підгрупі пацієнтів, хворих на недрібноклітинний рак легені. Мутовані форми ALK спостерігалися також в нейробластомах. C-Src також є протеїнкіназою, активований стан якої, як доведено, негативно корелює з виживанням пацієнтів, хворих на різноманітні форми раку, включаючи недрібноклітинний рак легені. (Byers L.A. et al., Clin. Cancer Res. 2009, 15(22), 6852-6861). З цієї причини та завдяки участі в багатьох ключових механізмах, таких як прогресія клітинного циклу, адгезія, проліферація, міграція та контроль апоптозу, цей протеїн також розглядається як важлива мішень в онкології. Зокрема показано, що інгібування цієї мішені, як біохімічними, так і фармакологічними засобами, індукувало такі ефекти, як редукція клітинної проліферації, зупинка мітотичного циклу та уповільнення росту пухлини in vivo. У випадку недрібноклітинного раку легені інгібуюча дія інгібітора c-Src (дазатинібу) привела до спостереження in vitro уповільнення міграції та інвазії зазначених клітин. Однак, з точки зору контролю проліферації пухлинних клітин, передбачається, що інгібуюча дія однієї лише c-Src викликає частковий та/або тимчасовий фармакологічний ефект. Отже, залишається необхідність одержання інгібітора з комплексною дією, здатного бути націленим на декілька мішеней, а саме на декілька мішеней одного сигнального шляху, гадано найбільш ефективних, з поліпшеним терапевтичним індексом та меншою вірогідністю виникнення феноменів компенсації, стійкості або уникнення терапії. Таким чином, сполуки за даним винаходом мають здатність інгібувати або знижувати ензиматичну активність протеїнкіназ в цілому, і ALK та c-Src зокрема. Отже, ці сполуки можуть бути використані як лікарські засоби при лікуванні проліферативних захворювань, таких як рак. Додатково можуть існувати показання до застосування при запаленні або ураженні центральної нервової системи. Більш детально, об’єктом даного винаходу є сполука такої загальної формули (I): 1 UA 109698 C2 R2 R1 U n V N Y2 Y3 5 10 15 20 25 30 35 40 45 R3 Y1 N Y4 N H (I) або її фармацевтично прийнятна сіль чи сольват, таутомер, стереоізомер або суміш стереоізомерів в будь-якій пропорції, наприклад, смеси енантіомерів, зокрема рацемічна суміш, де: - Y1 та Y4 кожен позначають, незалежно один від одного, групу CH або атом азоту, - Y2 позначає атом азоту або СН або CX-Ar групу, - Y3 позначає атом азоту або CX-Ar або CW групу, за умови, що: принаймні одна та не більше двох з Y1, Y2, Y3, та Y4 груп позначають атом азоту, - Y2 та Y4 не можуть бути атомами азоту одночасно, - коли Y2 = CX-Ar, тоді Y3 позначає атом азоту або групу CW, і - коли Y3 = CX-Ar, тоді Y2 позначає атом азоту або групу СН. - Ar позначає арильну або гетероарильну групу, можливо заміщену однією чи декількома групами, вибраними з атома галогену, (C1-C6) алкілу, (С1-С6)-галоалкілу, (С1-С6)-галоалкокси, (С1-С6) галотіоалкокси, CN,NO2, OR11, SR12, NR13R14, CO2R15, CONR16R17, SO2R18, SO2NR19R20, COR21, NR22COR23, NR24SO2R25 та R26NR27R28, та/або можливо конденсовані в гетероцикл. - Х позначає двовалентну групу, вибрану з O, S, S(O), S(O)2, NR4, S(NR4), S(O)(NR4), S(O)2(NR4), NR4S, NR4S(O), NR4S(O)2, CH2, CH2S, CH2S(O), CH2S(O)2, SCH2, S(O)CH2, S(O)2CH2, CH2CH2, CH=CH, CC, CH2O, OCH2, NR4CH2 та CH2NR4. - W позначає R5, SR5, OR5 або NR5R6 групу, - U позначає СН2 або NH групу, один чи декілька атомів водню якої можуть бути заміщені (С1-С6) алкільною групою, - V позначає С(O), C(S) або CH2, - n позначає 0 або 1; - R1 позначає атом водню або OR7 чи NR7R8 групу, - R2 позначає атом водню, можливо заміщений гетероцикл, NO 2, OR9 або NR9R10, - R3, R4, R11 до R25 та R27 до R28 кожен позначають, незалежно один від одного, атом водню або (С1-С6) алкільну групу, - R5 та R6 кожен незалежно один від одного позначають атом водню або (C 1-C6) алкіл, можливо заміщений арилом або бензильною групою, - R7, R8, R9 та R10 кожен позначають, незалежно один від одного, атом водню або можливо заміщений (С1-С6) алкіл або (С3-С12) циклоалкіл або можливо заміщений гетероцикл, і - R26 позначає (С1-С6) алкільну групу. В попередніх визначеннях можливі усі комбінації замісників або змінних, за умови, що вони приводять до утворення стабільних сполук. Термін "галоген" стосується фтору, хлору, брому або йоду. Термін “(C1-C6) алкіл” стосується насичених лінійних чи розгалужених вуглеводневих ланцюгів, що містять від 1 до 6 атомів. Це може бути метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил або гексил. Термін “(C1-C6) aлкокси” стосується (C1-C6) алкільного ланцюга, з’єднаного з рештою молекули через атом кисню. Як приклад можна згадати групи метокси, етокси, пропокси, ізопропокси, бутокси або трет-бутокси. Термін “(C1-C6)тіоaлкокси” стосується (C1-C6) алкільного ланцюга, з’єднаного з рештою молекули через атом сірки. Як приклад можна згадати групи тіометокси, тіоетокси, тіопропокси, тіоізопропокси, тіобутокси або тіо-трет-бутокси. Термін “(C1-C6)галоалкіл” стосується (C1-C6)алкільного ланцюга, такого як визначено вище, де один чи декілька атомів водню заміщаються атомами галогену. Це може бути, зокрема, трифторметильна група. 2 UA 109698 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін “(C1-C6)галоалкокси” стосується (C1-C6)алкокси ланцюга, такого як визначено вище, де один чи декілька атомів водню заміщаються атомами галогену. Це може бути, зокрема, трифторметоксигрупа. Термін “(C1-C6)галотіоалкокси” стосується (C1-C6)тіоалкокси ланцюга, такого як визначено вище, де один чи декілька атомів водню заміщаються атомами галогену. Це може бути, зокрема, трифтортіометокси група. Термін “(C3-C12)циклоалкіл” стосується циклічних вуглеводневих систем, що містять від 3 до 12 атомів вуглецю і мають одно чи декілька кілець, зокрема, сконденсованих кілець. Як приклад, згадана сполука може містити адамантильну або циклогексильну групи. Термін "арил" стосується ароматичної вуглеводневої групи, яка переважно містить від 6 до 14 атомів вуглецю та одно чи декілька сконденсованих кілець, таких як, наприклад, феніл або нафтил. Краще, це фенільна група. Термін "гетероарил" стосується циклічної ароматичної групи, що містить від 5 до 7 атомів у кільці, або біциклічної ароматичної групи, містить від 8 до 11 атомів у кільцях, де від 1 до 4 атомів у кільцях є гетероатомами, вибраними незалежно з атомів сірки, азоту та кисню, і де інші атоми у кільцях представлені атомами вуглецю. Прикладами гетероарилів є групи фурилу, тієнілу, піридинілу та бензотієнілу. Термін "гетероцикл" стосується або стабільного моноциклу, що містить від 4 до 7 циклічних атомів, або стабільного біциклу, що містить від 8 до 11 циклічних атомів, які можуть бути або насиченими, або ненасиченими, де від 1 до 4 циклічних атомів є гетероатомами, вибраними незалежно з атомів сірки, азоту та кисню, і де інші атоми представлені атомами вуглецю. Як приклад можна згадати фуран, пірол, тіофен, тіазол, ізотіазол, оксадіазол, імідазол, оксазол, ізоксазол, піридин, піперидин, піразин, піперазин, тетрагідропіран, піримідин, хіназолін, хінолін, хіноксалін, бензофуран, бензотіофен, індолін, індолізин, бензотіазол, бензотієніл, бензопіран, бензоксазол, бензо[1,3]діоксол, бензизоксазол, бензимідазол, хроман, хромен, дигідробензофуран, дигідробензотієніл, дигідроізоксазол, ізохінолін, дигідробензо[1,4]діоксан, імідазо[1,2-a]піридин, фуро[2,3-c]піридин, 2,3-дигідро-H-інден, [1,3]діоксоло[4,5-c]піридин, піроло[1,2-c]піримідин, піроло[1,2-а]піримідин, тетрагідронафталін, бензо[b][1,4]оксазин. В контексті даного винаходу "можливо заміщений" означає, що розглядана група може бути заміщена одним чи декількома замісниками, які можуть бути вибрані, зокрема, з атома галогену, (C1-C6)алкілу, (C1-C6)галоалкілу, (C1-C6)-галоалкокси, (C1-C6)галотіоалкокси, CN, NO2, OR11, SR12, NR13R14, CO2R15, CONR16R17, SO2R18, SO2NR19R20, COR21, NR22COR23, NR24SO2R25 та R26NR27R28, де R11 до R28 є такими, як було визначено вище. В даному винаході "фармацевтично прийнятний" означає використовуваний для приготування фармацевтичної композиції, безпечний, нетоксичний та прийнятний біологічно або за іншими параметрами, а також прийнятний для використання у ветеринарії та при лікуванні людей. "Фармацевтично прийнятна сіль або сольват" сполуки стосується фармацевтично прийнятних солей та сольватів, таких як визначено вище, що мають бажану фармакологічну активність вихідної сполуки. Прийнятні солі для терапевтичного використання сполук за даним винаходом включають нетоксичні солі сполук за винаходом, що відповідають вимогам, такі як сформовані з фармацевтично прийнятних органічних та неорганічних кислот або фармацевтично прийнятних органічних та неорганічних лугів. Як приклад можна згадати солі неорганічних кислот, таких як хлористоводнева кислота, бромистоводнева кислота, фосфорна та сірчана кислоти, і органічних кислот, таких як оцтова кислота, трифтороцтова кислота, пропіонова кислота, бурштинова кислота, фумарова кислота, яблучна кислота, винна кислота, лимонна кислота, аскорбінова кислота, малеїнова кислота, глютамінова кислота, бензойна кислота, саліцилова кислота, толуолсульфонова кислота, метансульфонова кислота, стеаринова кислота та молочна кислота. Як приклад можна згадати солі неорганічних лугів, таких як сода, поташ або гідроксид кальцію, та солі органічних лугів, таких як лізин та аргінін. Ці солі можуть бути синтезовані зі сполук за даним винаходом, що містять лужну або кислотну частину, та відповідних кислот або лугів, відповідно до звичайних хімічних способів, добре відомих фахівцям в цій області. Прийнятні сольвати для терапевтичного використання сполук за даним винаходом включають звичайні сольвати, такі як утворювані на останній стадії одержання сполук за винаходом завдяки присутності розчинників. Як приклад можна згадати сольвати в присутності води або етанолу. В контексті даного винаходу "стереоізомер" означає геометричний ізомер або оптичний ізомер. 3 UA 109698 C2 5 10 15 20 25 30 35 40 45 50 55 Геометричні ізомери виникають в результаті зміни позиції замісника на подвійному зв’язку, який може мати Z або Е конфігурацію. Оптичні ізомери виникають переважно в результаті різного просторового положення замісників на атомі вуглецю, який має чотири різних замісники. Цей атом вуглецю, таким чином, утворює хіральний або асиметричний центр. Оптичні ізомери включають діастереоізомери та енантіомери. Оптичні ізомери, які є дзеркальними відображеннями один одного, але не співпадають при накладенні, називаються енантіомерами. Оптичні ізомери, які не є дзеркальними відображеннями один одного, називаються діастереоізомерами. В контексті даного винаходу "таутомер" стосується структурного ізомеру сполуки, одержаного шляхом прототропії, тобто міграції атома водню та зміни дислокації подвійного зв’язку. Різні таутомери сполуки є звичайно взаємоперетворюваними та знаходяться в рівновазі у розчині в пропорціях, які могут варіювати в залежності від використовуваного розчинника, температури або рН. Згідно з першим варіантом здійснення винаходу Y4=N. Y2=C-X-Ar, і Y3 краще позначає С-W групу. Зокрема: - Y1 = CH або N, краще CH, - Y2 = C-X-Ar, - Y3 = C-W, і - Y4 = N. Згідно з другим варіантом здійснення винаходу Y1 та/або Y4 позначають атом азоту. В цьому випадку Y2 та Y3 звичайно не є атомами азоту. Зокрема: - Y1 та/або Y4 = N, - Y2=CH або C-X-Ar, і - Y3=C-W або C-X-Ar. Краще, Х позначає двовалентну групу, вибрану з O, S, S(O), S(O) 2, NR4, CH2, CH2S, CH2S(O), CH2S(O)2, NHS(O)2, SCH2, S(O)CH2, S(O)2CH2, S(O)2NH, CH2CH2, CH=CH, CC, CH2O, OCH2, NR4CH2 та CH2NR4. Зокрема, X позначає двовалентну групу, вибрану з S, S(O), S(O) 2, NR4, CH2, CH2S, CH2S(O), CH2S(O)2, NHS(O)2, SCH2, S(O)CH2, S(O)2CH2, S(O)2NH, CH2CH2, C C, CH2O, OCH2, NR4CH2 та CH2NR4. Зокрема, Х може бути вибраний з S, S(O), S(O) 2, CH2, CH2S, CH2S(O), CH2S(O)2, NHS(O)2, SCH2, S(O)CH2, S(O)2CH2, S(O)2NH, CH2CH2, CH=CH та C≡C. Зокрема, Х може бути вибраний з S, S(O)2, CH2, SCH2, S(O)2CH2, S(O)2NH, CH2S, CH2S(O)2, NHS(O)2, CH2CH2 та C≡C. Зокрема, Х може бути вибраний з S, S(O), S(O) 2, NR4, CH2, SCH2, S(O)CH2, S(O)2CH2, S(O)2NH, CH2CH2, C≡C, OCH2 та NR4CH2; зокрема з S, S(O)2, CH2, SCH2, S(O)2CH2, S(O)2NH, CH2CH2 та C≡C, де перший атом цих груп зв’язаний з атомом С ланцюга C-X-Ar. Зокрема, Х може бути вибраний з S, S(O)2, SCH2, S(O)2CH2, S(O)2NH, CH2S, CH2S(O)2, або NHS(O)2; і зокрема S, S(O)2, SCH2, S(O)2CH2, або S(O)2NH, де перший атом цих груп зв’язаний з атомом С ланцюга C-X-Ar. Краще, Ar позначає гетероарильну групу, таку як піридин, або арильну групу, таку як феніл, можливо заміщену однією чи декількома групами, вибраними з атомів галогену, (C 1-C6)алкілу, (C1-C6)галоалкілу, (C1-C6)галоалкокси, (C1-C6)галотіоалкокси, CN,NO2, OR11, SR12, NR13R14, CO2R15, CONR16R17, SO2R18, SO2NR19R20, COR21, NR22COR23 та NR24SO2R25; та/або можливо сконденсовану з гетероциклом. Зокрема, Ar може бути арильною групою, такою як феніл, можливо заміщеною однією чи декількома групами, вибраними з атомів галогену, (C 1-C6)алкілу, (C1-C6)галоалкілу, (C1C6)галоалкокси, (C1-C6)галотіоалкокси, CN,NO2, OR11, SR12, NR13R14, CO2R15, CONR16R17, SO2R18, SO2NR19R20, COR21, NR22COR23 та NR24SO2R25. Ar може зокрема бути арильною групою, такою як феніл, можливо заміщеною однією чи декількома групами, вибраними з атомів галогену, (C1-C6)алкілу, (C1-C6)галоалкілу та CONR16R17, зокрема, з атома галогену, такого як фтор, (C1-C6)алкілу, такого як метил, та CONR16R17, такого як CONH2. Ar може також бути групою піридину. Ar може бути вибраний, зокрема, з таких груп: 4 UA 109698 C2 Cl F F , , O CF3 , Cl N та , Cl F , Cl H 2N O F , , Cl H 2N , і особливо з таких груп: , Cl , , Cl CF3 , Cl , , та N 5 , зокрема, з таких груп: F Cl H 2N O , , Cl Ar може краще бути групою: F 10 15 20 25 та . W може краще позначати R5, SR5, OR5 або групу NR5R6, краще, R5, OR5 або NR5R6, де R5 та R6 позначають, незалежно один від одного, атом водню або (C1-C6)-алкільну групу. W може зокрема позначати H, OMe, Me, OH або NH2, особливо H. Краще, R3 є атомом водню. U може бути CH2 або NH групою. Краще, n позначає 0. V може більш конкретно бути C(O) або C(S) групою, краще, C(O) групою. Згідно з конкретним втіленням винаходу: - R3=H, - U=CH2 або NH, - V=C(O) або C (S) і особливо C(O) та - n=0 або 1 і особливо 0. Згідно з іншим конкретним втіленням винаходу: - V=C(O) або C(S) і особливо C (O), та - n=0. Згідно з ще одним конкретним втіленням винаходу: - R3=H, - V=C(O) або C(S) і особливо C (O), і - n=0. R1 може бути, зокрема, атомом водню або NR7R8 групою, де R7 в основному позначає атом 5 UA 109698 C2 водню і R8 в основному позначає можливо заміщену (C3-C12)-циклоалкільну групу або можливо заміщений гетероцикл. (C3-C12)-Циклоалкільна група може бути, зокрема, циклогексилом, і може бути заміщена одним чи декількома атомами галогену. Це може бути така група: 5 Гетероциклічна група може бути, зокрема, тетрагідропіраном, частіше незаміщеним. Це може бути така група: R1, таким чином, може бути, зокрема, однією з таких груп: 10 та H, переважно, 15 20 ; і особливо H та , . R2 може бути, зокрема, можливо заміщеним гетероциклом (частіше заміщеним (C1-C6)алкілом або NH2), NO2 або NR9R10, де зокрема. R9=R10=H або R9 та R10 кожен позначають H або опціонально заміщений (C1-C6)-алкіл. R2 може бути можливо заміщеним гетероциклом, частіше, заміщеним (C 1-C6)-алкілом або NH2. Гетероцикл може бути, зокрема, гетероциклом з 5 або 6 членами, що містять принаймні один атом азоту, звичайно один чи два. Гетероцикл може, таким чином, бути вибраний з піперазину, піперидину та піролідину. R2 може зокрема бути однією з таких груп: NH2, NH (CH2)3NMe2, NMe(CH2)3NMe2, NO2, , , та ; і особливо NH2, NO2, , та ; 25 і особливо , та ; особливо . Сполуки за даним винаходом можуть бути вибрані зі сполук, представлених в такій таблиці: 6 і UA 109698 C2 14-2 14-10 14-11 15 26-4 26-8 27 27-1 28 29 29-a 30 30-1 30-3 7 UA 109698 C2 O O HN HN 30-4 30-5 F S N MeO F F F O 30-8 O HN S O HN O HN 30-9 N N N H N N 30-10 30-11 30-12 30-a 31 32 32-1 33 35 26-12 8 N N H N N UA 109698 C2 30-69 27-2 27-3 27-4 30-73 14bis 30-70 30-71 30-72 27-5 30-13 30-14 30-15 30-16 9 UA 109698 C2 30-17 30-18 30-19 30-20 30-21 30-22 30-23 30-24 30-25 30-26 30-27 30-28 30-29 30-30 10 UA 109698 C2 30-31 30-32 30-33 30-34 30-35 30-36 30-37 30-38 30-39 30-40 30-41 30-42 30-43 30-44 11 UA 109698 C2 30-45 30-46 30-47 30-48 30-49 30-50 30-51 30-52 30-53 30-54 30-55 30-56 12 UA 109698 C2 30-57 30-58 30-59 30-60 30-61 30-62 30-63 30-64 30-65 30-66 30-67 30-68 31-1 Об’єктом даного винаходу є також сполука згідно з формулою (I), така як було визначено вище, призначена для використання як лікарський засіб насамперед для лікування раку, а також 13 UA 109698 C2 5 10 15 20 25 30 35 40 45 50 55 запалень та нейродегенеративних захворювань, таких як хвороба Альцгеймера. Даний винахід також передбачає використання сполуки формули (I), як визначено вище, для виробництва лікарських засобів, призначених насамперед для лікування раку, а також запалень та нейродегенеративних захворювань, таких як хвороба Альцгеймера. Даний винахід також стосується способу лікування раку, запалення та нейродегенеративних захворювань, таких як хвороба Альцгеймера, зокрема, раку, який включає введення особі, що потребує цього, ефективної дози сполуки формули (I), такої як описана вище. Зокрема, тут можна згадати такі різновиди раку, як рак товстої кишки, рак грудей, рак нирок, рак печінки, рак підшлункової залози, рак простати, гліобластома, недрібноклітинний рак легень, нейробластома, запальна міофібробластична пухлина, дифузна В-клітинна лімфома або анапластична великоклітинна лімфома. Даний винахід також розглядає сполуку згідно з формулою (I), як описано вище, для використання як засіб для лікування захворювань, зв’язаних з кіназою, зокрема, тирозинкіназою, такою як кінази ALK, Abl та/або c-Src, зокрема ALK та c-Src. Об’єктом даного винаходу також є сполука згідно з формулою (I), як визначено вище, призначена для використання як інгібітор кінази і особливо як інгібітор тирозинкінази, такої як ALK, Abl та/або c-Src, зокрема ALK. Сполука за даним винаходом може бути використана як інгібітор ALK та принаймні ще однієї кінази, наприклад, Abl або c-Src. Краще, сполуки за даним винаходом є інгібіторами ALK та c-Src. В контексті даного винаходу "захворювання, зв’язані з кіназою", або "кіназа-асоційовані захворювання", стосуються будь-яких захворювань, і особливо захворювань, зв’язаних з дерегуляцією клітинної проліферації, зокрема раку, що виникають в результаті дерегуляції експресії або активності вказаних кіназ у порівнянні з їх нормальним станом експресії або активності. Дерегуляція експресії кінази може бути модификацією експересованої кодуючої послідовності або модифікацією кількості експересованого білка. Така дерегуляція може призводити до змін у клітині, які можуть виявлятися, зокрема, в проліферативних порушеннях, включаючи різні види раку. Краще, згідно з винаходом, кіназа-асоційовані захворювання можуть бути видами раку, зв’язаними з дерегуляцією ALK та/або c-Src активності, як наприклад, рак товстої кишки, рак грудей, рак нирок, рак печінки, рак підшлункової залози, рак простати, гліобластома, недрібноклітинний рак легень, нейробластома, запальна міофібробластична пухлина, дифузна В-клітинна лімфома та анапластична великоклітинна лімфома. Згідно з винаходом, вираз "інгібітор кіназ" або "інгібітор кінази" означає молекули, здатні взаємодіяти з кіназами та зменшувати їх активність. Краще, використання інгібітора кінази згідно з винаходом робить можливим пригнічення активності згаданих кіназ. Даний винахід також поширюється на фармацевтичну композицію, що містить принаймні одну сполуку формули (I), описану вище, та принаймні один фармацевтично прийнятний ексипієнт. Фармацевтичні композиції згідно з винаходом можуть бути призначені для внутрішнього застосування або для ін’єкцій, де згадані композиції призначені для ссавців, включаючи людину. Активний інгредієнт може бути застосований для тварин або людини в стандартній лікарській формі в суміші зі стандартним фармацевтичним носієм. Сполуки за винаходом як активні речовини можуть бути використані в дозах від 0,01 мг до 1000 мг в день, призначувані або однією дозою в день або в декількох дозах на протязі дня, наприклад, двічі на день в рівних дозах. Доза, що вводиться за день, переважно складає від 5 мг до 500 мг, краще, від 10 мг до 200 мг. Фахівець в даній області може визначити необхідність використання дози поза вказаними межами. Фармацевтична композиція за даним винаходом може містити принаймні ще один активний інгредієнт, такий як антираковий агент. Об’єктом даного винаходу також є фармацевтична композиція, що містить: (i) принаймні одну сполуку формули (I), таку як визначено вище, і (ii) принаймні один інший активний інгредієнт, такий як антираковий агент, як комбінований продукт для одночасного, роздільного або послідовного застосування. Даний винахід також має відношення до використання вищезазначеної фармацевтичної композиції як лікарського засобу, застосовуваного в більшості випадків для лікування раку, запалення та нейродегенеративних захворювань, таких як хвороба Альцгеймера, зокрема раку. Об’єктом даного винаходу також є спосіб одержання сполук формули (I) згідно з винаходом. Згідно з першим втіленням, даний винахід має відношення до способу одержання сполуки формули (I) згідно з винаходом, де V=C(O) або C(S) і звичайно U=CH2, включає такі стадії: (a1) реакцію сполучення між сполукою такої формули (А): 14 UA 109698 C2 NH2 Y2 Y3 Y1 N N Y4 R29 (A) де Y1, Y2, Y3 та Y4 є такими, як визначено вище, і R29 позначає атом водню або N-захисну групу, зі сполукою такої формули (В): R2 R1 U n V R30 5 (B) де R1, R2, U та n є такими, як визначено вище, V=C(O) або C(S) і R30=OH або відхідна група, така як Cl, з одержанням сполуки такої формули (С): R2 R1 U n V NH Y2 Y3 Y1 N Y4 N R29 10 15 20 25 30 (C) де Y1, Y2, Y3, Y4, R1, R2, R29, U та n є такими, як визначено вище, і V=C(O) або C(S), (b1) при необхідності, заміщення атома азоту, зв’язаного з V сполуки формули (C), одержаної на попередній стадії з R3 групою, відмінною від Н та/або зняття захисту атома азоту, що несе R29 групу, яка є N-захисною групою, з одержанням сполуки формули (I) з V=C(O) або C(S), і (c1) при необхідності, формування солі сполуки формули (I), одержаної на попередній стадії, з одержанням фармацевтично прийнятної солі цієї сполуки. В контексті даного винаходу "N-захисна група" означає будь-який замісник, який захищає NH або NH2 групи від небажаних реакцій, такий як N-захисні групи, описані в Greene, “Protective Groups in Organic Synthesis” (John Wiley & Sons, New York (1981)), та Harrison et al., “Compendium of Synthetic Organic Methods”, Vols. 1 to 8 (J. Wiley & Sons, 1971 to 1996). N-захисні групи включають карбамати, аміди, N-алкіловані похідні, аміноацетальні похідні, N-бензиловані похідні, імінові похідні, енамінові похідні та N-гетероатомні похідні. Зокрема, N-захисна група включає форміл, ацетил, бензоїл, півалоїл, фенілсульфоніл, тритил (трифенілметил), третбутил, бензил (Bn), т-бутилоксикарбоніл (BOC), бензилоксикарбоніл (Cbz), пметоксибензилоксикарбоніл, п-нітробензилоксикарбоніл, трихлоретоксикарбоніл (TROC), алілоксикарбоніл (Alloc), 9-флуоренілметилоксикарбоніл (Fmoc), трифторацетил, бензилкарбамати (заміщені чи ні) тощо. Це може бути, зокрема, тритил, трет-бутил або BOC група. В контексті даного винаходу "відхідна група" означає хімічну групу, яка може бути легко заміщена нуклеофільним реагентом в реакції нуклеофільного заміщення, де нуклеофілом найчастіше є амін, переважно, первинний або вторинний амін. Такою відхідною групою може бути найчастіше атом галогену, такий як атом хлору, мезилат (CH 3-S(O2)O-), трифлат (CF3S(O)2O-) або тозилат (p-Me-C6H4-S(O)2O-). 15 UA 109698 C2 5 10 15 20 25 30 35 40 Стадія (a1): Реакція сполучення між (А) та (В) може бути виконана способами, добре відомими фахівцям в даній області. Коли R30=OH, реакція сполучення може бути здійснена в умовах, при яких відбувається сполучення пептидів. Вона може бути проведена в присутності агента сполучення, такого як діізопропілкарбодіімід (DIC), дициклогексилкарбодіімід (DCC), 1-(3-диметиламінопропіл)-3етилкарбодіімід (EDC), карбонілдіімідазол (CDI), 2-(1Н-бензотриазол-1-іл)-1,1,3,3тетраметилуронію (HBTU) гексафторфосфат, 2-(1Н-бензотриазол-1-іл)-1,1,3,3тетраметилуронію тетрафторборат (TBTU) або O-(7-азобензотриазол-1-іл)-1,1,3,3тетраметилуронію (HATU) гексафторфосфат, можливо, у поєднанні зі вторинним агентом сполучення, таким як N-гідроксисукцинімід (NHS), N-гідроксибензотриазол (HOBt), 3,4-дигідро-3гідрокси-4-оксо-1,2,3-бензотриазол (HOOBt), 1-гідрокси-7-азабензотриазол (HAt) або Nгідроксисульфосукцинімід (сульфо-NHS). Крім того, пептидне сполучення може бути проведене в апротонному розчиннику, такому як тетрагідрофуран, діоксан та дихлорметан. Коли R30 є відхідною групою, такою як Cl, реакція сполучення може бути проведена в присутності основи, такої як піридин, триетиламін или діізопропілетиламін (DIPEA). Реакція може бути проведена в апротонному розчиннику, такому як тетрагідрофуран, толуол або дихлорметан, або в основному розчиннику, такому як піридин. Сполуки формул (A) та (B) можуть бути одержані способами, детально описаними нижче. Стадія (b1): В контексті даного винаходу "зняття захисту" означає процес, в якому захисна група видаляється після завершення селективної реакції. Певним захисним групам може надаватися перевага завдяки їх зручності або відносної легкості елімінації. Депротекція може бути виконана в умовах, добре відомих фахівцям в цій області. Заміщення також може бути виконано способами, добре знайомими фахівцям в цій області. При необхідності, функціональності, які можуть бути чутливими до реакційних умов на стадії заміщення, можуть бути заміщені заздалегідь з подальшим видаленням захисту після проведення заміщення. Таким чином, якщо мають бути проведені стадія депротекції атома азоту, що несе R29 групу, яка є N-захисною групою, та стадія заміщення атома азоту, зв’язаного з V за допомогою групи R3, черговість виконання цих двох стадій залежить від умов реакції кожної з цих стадій. Крім того, може виникнути необхідність проведення додаткових стадій функціоналізації молекули відомими фахівцям способами. Стадія (c1): Ця стадія може бути проведена в присутності фармацевтично прийнятної органічної або неорганічної основи, як було описано вище. Згідно з другим варіантом втілення, винахід стосується способу одержання сполуки формули (I) згідно з винаходом, де V=CH2 і особливо U=CH2, який включає такі стадії: (a2) реакція відновного амінування між сполукою формули (А), описаною вище, та альдегідом такої формули (D): (D) де R1, R2, U та n визначені вище, з одержанням сполуки такої формули (Е): 16 UA 109698 C2 R2 R1 U n NH Y2 Y3 Y1 N Y4 N R29 5 10 15 20 (E) де Y1, Y2, Y3, Y4, R1, R2, R29, U та n визначені вище. (b2) при необхідності, зняття захисту атома азоту, що несе R29 групу, яка є N-захисною групою, та/або заміщення атома азоту, зв’язаного з V групою R3, відмінною від Н, сполуки формули (Е), одержаної на попередній стадії, з одержанням сполуки формули (I) з V=CH2, і (c2) при необхідності, утворення солі сполуки формули (I), одержаної на попередній стадії, з одержанням фармацевтично прийнятної солі цієї сполуки. Стадія (a2): Ця стадія проводиться в присутності відновного агента, такого як боргідрид, і особливо NaBH4, NaBH(OAc)3 або NaBH3CN. В основному, ця реакція проводиться при кімнатній температурі, тобто, при температурі в діапазоні від 15 °C до 40 °C, зокрема, від 20 °C до 30 °C. Ця реакція може бути зазвичай проведена в розчиннику, такому як дихлоретан (ДХЕ), тетрагідрофуран (ТГФ) або ацетонітрил, можливо, в присутності води, оцтової кислоти або трифтороцтової кислоти. Сполуки формули (А) та (D) можуть бути одержані способами, детально описаними нижче. Стадія (b2): див. стадію (b1) Стадія (c2): див. стадію (c1) Згідно з третім варіантом втілення, даний винахід стосується способу одержання сполуки формули (I), де V=C(O) або C(S), n=1 і U=NH, який включає такі стадії: (a3) реакція сполучення між сполукою формули (А), такою як визначено вище, та сполукою такої формули (F): (F) де R1 та R2 є такими, як визначено вище, і Z=O або S, з одержанням сполуки такої формули (G): R2 R1 NH Z NH Y2 Y3 25 Y1 N Y4 N R29 (G) де Y1, Y2, Y3, Y4, R1, R2, R29 та Z є такими, як визначено вище. 17 UA 109698 C2 5 10 15 20 (b3) при необхідності, зняття захисту атома азоту, що несе R29 групу, яка є N-захисною групою, та/або заміщення атома азоту, зв’язаного з V групою R3, відмінною від Н, сполуки формули (G), одержаної на попередній стадії, з одержанням сполуки формули (I), де V=C(O) або C(S), n=1 та U=NH, і (c3) при необхідності, утворення солі сполуки формули (I), одержаної на попередній стадії, з одержанням фармацевтично прийнятної солі цієї сполуки. Стадія (a3): Ця стадія може бути проведена в умовах, добре відомих фахівцям в даній області. Як полярний або неполярний протонний розчинник може бути використаний дихлорметан, ацетон, ацетонітрил, тетрагідрофуран або діоксан. Сполуки формули (А) та (F) можуть бути одержані способами, детально описаними нижче. Стадія (b3): див. стадію (b1) Стадія (c3): див. стадію (c1) Коли сполука формули (I) одержана будь-яким з вищезгаданих способів, вона може бути відокремлена від реакційного середовища способами, добре відомими фахівцям, в основному, шляхом випарювання розчинника, кристалізації, фільтрації і т.д. Одержана сполука може бути очищена, якщо необхідно, способами, добре відомими фахівцям, в основному, високоефективною рідинною хромотографією (ВЕРХ), хромотографією на силікагелі, перекристалізацією, для сполук кристалічної структури, тощо. Таким чином, сполуки формули (I) за даним винаходом, можуть бути одержані різноманітними способами, стисло викладеними на схемах 1a та 1b нижче. Схема 1a 18 UA 109698 C2 5 10 15 20 25 30 35 Ri = NO2, галоген, OH, OMe, SMe, S(O)Me, SO2Me, OMs, OTf or OTs Rj = H або N-захисна група Rn = Hal, OMs, OTs або OTf (Tf позначає -SO2CF3 групу, а Ts позначає тозил) Схема 1b Спосіб А: Згідно зі способом А, сполуки формули (I) одержують шляхом попереднього синтезу сполук загальної формули (V), які характеризуються галоїдованим гетеробіциклічним кільцем, яке має екзоциклічний первинний амін. Ці сполуки отримують шляхом синтезу проміжних продуктів загальної формули (II) або (III). Спосіб A1: Спосіб А1, представлений на схемі 2 (йодовані сполуки) або 3 (бромовані сполуки), описує загальний процес, який дає доступ до загальної формули (V) з W, визначеним у загальній формулі (I), і зокрема H, (C1-C6)-алкіл або арил, та Rj=H або N-захисна група. Схема 2 В контексті схеми 2 можливо заміщений 2-хлор-5-йодонікотинонітрил (IIa) одержують з відповідного гідроксинікотинонітрилу шляхом послідовного використання агента йодування, такого як N-йодсукцинімід (NIS) або молекулярний йод, з неорганічною основою, такою як, наприклад, K2CO3 або Na2CO3, частіше в полярному розчиннику, такому як гарячий ДМФ, з подальшою обробкою оксихлоридом фосфору, чистим або розчиненим в неполярному розчиннику з високою температурою кипіння, або будь-яким іншим еквівалентним агентом хлорування, добре відомим фахівцям. Температури реакцій між -20 °C та 200 °C. Одержану у такий спосіб сполуку (IIa) потім перетворюють на можливо заміщений 5-йодопіразоло[3,4b]піридин-3-амін (Va) реакцією, краще при нагріванні, в присутності гидразину, який може містити N-захисну групу, таку як тритил, трет-бутил або BOC. Бромовані аналоги загальної формули (V), як показано на схемі 1а, можуть бути одержані способом, описаним в таких джерелах: Witherington et al., Bioorg. Med. Chem. Lett., 2003, 13, 1577-1580, та Lijuan Chen et al., Bioorg. Med. Chem. Lett., 2010, 20, 4273-4278. Для зручності, ці молекули були одержані з використанням послідовності реакцій, представленої на схемі 3. Схема 3 При необхідності, функціоналізований 2-метоксинікотинонітрил може бути одержаний, для прикладу, реакцією метилату натрію в метанолі при температурі від -20 °C до температури кипіння суміші. Крім того, ця сполука може бути одержана шляхом метилування 2гідроксинікотинонітрилу або іншими способами, описаними вище. Бромування 2метоксинікотинонітрилу звичайно здійснюють з дибромом в оцтовій кислоті при температурі в інтервале від 20 °C до 110 °C. Утворення піразолу звичайно здійснюють шляхом реакції 19 UA 109698 C2 5 10 15 20 25 30 надлишку гідразину, функціоналізованого чи ні, при температурі в інтервале від 20 °C до 100 °C, в присутності полярного розчинника, такого як вода, етанол, тетрагідрофуран (ТГФ) або в будьякому іншому розчиннику з порівняними властивостями. Крім того, використання гідразину в сольовій або гідратованій формі, без розчинника, також є можливим. Спосіб A2: Спосіб A2 стосується синтезу функціоналізованих піразолопіразинів, представлених на схемі 4 нижче, де Rj = H або N-захисна група, Hal позначає галоген, і зокрема, W = Н, (С 1-С6)алкіл або арил. Схема 4 При необхідності, функціоналізовані 3-аміно-6-йодпіразин-2-карбоксаміди звичайно одержують у дві стадії з відповідного метилового ефіру 3-амінопіразин-2-карбонової кислоти шляхом йодування в присутності N-йодсукциніміду або молекулярного йоду, можливо в присутності кофактора, такого як KIO3, AgCO2CF3, Ag2SO4, AlCl3, CuCl2 або HgO, з подальшою реакцією конверсії функції складного метилового ефіру на карбоксамід, зокрема, з використанням аміаку в полярному розчиннику, такому як вода, метанол або ТГФ, при температурі у межах від 0 °C до 100 °C. Карбоксамідну функцію можливо функціоналізованого 3-аміно-6-йодпіразин-2-карбоксаміду потім перетворюють на нітрил з використанням агентів дегідратації, таких як, зокрема, CCl4/PPh3, SOCl2, PhSO2Cl, P2O5, TsCl, COCl2, DCC/py (N,N'дициклогексилкарбодіімід/піридин) або (COCl) 2, застосовуваних, в залежності від обставин, в присутності органічної основи, такої як піридин. Кращий спосіб включає використання оксихлориду фосфору в диметилформаміді (ДМФ). Видалення захисної групи диметилформамідної функції здійснюється шляхом обробки кислотою, такою як водний розчин соляної кислоти або будь-який інший реагент з еквівалентними властивостями. Формування кільця піразолу здійснюється шляхом реакції Зандмейера, добре відомої фахівцям в даній області, з подальшою реакцією в присутності гідразину, функціоналізованого чи ні, в умовах, описаних у способах вище. Крім того, сіль діазонію, проміжна сполука реакції Зандмейера, може бути відновлена шляхом використання, наприклад, хлориду олова в кислому середовищі, або будь-якого іншого еквівалентного засобу для того, щоб сформувати гідразинову функцію, яка може зазнавати внутрішньомолекулярної циклізації під впливом тепла. Спосіб A3: Спосіб A3 спрямований на одержання похідних загальної формули (V) зі змінною функцією в положенні 6 біциклу піразолопіридину. Він детально зображений на схемі 5 нижче. 20 UA 109698 C2 5 10 15 20 25 30 (Alk= (C1-C6)алкіл, Ar=арил, CH2Ar=бензил, Hal=галоген) Схема 5 Реакція ціанотіоацетаміду з різними способами заміщеним етил-3-етооксиакрилатом відповідно до способів, описаних, зокрема, Litrivnor et al. у Russ. Chem. Bull., 1999, 48 (1), 195196, і Tsann-Long Су та співавт. J. Med. Chem., 1988, 31, 1209-1215, дозволяють одержати доступ, в два етапи, до етил-5-ціано-6-(метилтіо)нікотинатів, що несуть змінну функціональність в положенні 2. Ці синтези звичайно проводять, на першій стадії, в безводному полярному розчиннику, такому як, наприклад, етанол, при температурі в інтервале від 0 °C до 70 °C, в присутності органічної основи, такої як метилморфолін, триетиламін, ДІПЕА (N,Nдіізопропілетиламін) та ДБУ (1,8-діазабіцикло[5,4,0]ундец-7-ен). На другому етапі внутрішньомолекулярну циклізацію та алкілування звичайно проводять шляхом нагрівання до температури в діапазоні між 20 °C та 100 °C розчину проміжного тіоамідату в полярному розчиннику, наприклад, етанолі, в присутності відповідного алкілуючого агента, такого як алкілгалогенід або діалкілсульфат. 5-Ціано-6-(метилтіо)нікотинові кислоти, заміщені в положенні 2, звичайно одержують омиленням відповідних етилових ефірів згідно зі способами, добре відомими фахівцю в даній області техніки, зокрема, шляхом використання гарячого гідроксиду літію. Декарбоксилування цих сполук здійснюється шляхом термічної обробки в розчиннику з високою температурою кипіння, такому як дифеніловий ефір, при температурі в діапазоні від 150 °C до 250 °C. Реакції галогенування головним чином спрямовані на одержання йодованих, бромованих та хлорованих похідних, зокрема йодованих похідних. Останні звичайно одержують шляхом дії молекулярного йоду в присутності солі срібла, такої як, наприклад, Ag 2SO4, в полярному розчиннику, такому як етанол, при температурі в інтервале від 0 °C до 70 °C. Також передбачаються альтернативні способи, зокрема, основані на інших солях, таких як KIO 3, AgCO2CF3, AlCl3, CuCl2 або HgO, або інших агентах йодування, таких як N-йодсукцинімід. Надійні способи бромування звичайно залежать від агентів, таких як N-бромсукцинімід або дибром, згідно зі способами, добре відомими фахівцю в даній області. У випадку, коли W = OH (як правило, одержувані при використанні діетил-2(етоксиметилен)малонату), відповідні сполуки захищають реакцією алкілування. Ця реакція проводиться, зокрема, з використанням йодистого метилу або бромметану та карбонату срібла в діоксані, ТГФ, ацетонітрилі або ацетоні, або будь-якому іншому еквівалентному агенті, такому як диметилсульфат. Одержані 5-галоген-2-(метилтіо)нікотинонітрили піддають окисненню їх тіометокси-функції, звичайно шляхом використання м-ХПБК (м-хлорпербензойної кислоти), 21 UA 109698 C2 5 10 15 20 25 30 35 оксону або будь-якого іншого еквівалентного агента, що приводить до утворення відповідного сульфоксиду. Ці сполуки, які можуть містити різні кількості відповідного сульфону, беруть участь у реакції, в присутності можливо заміщеного гідразину з утворенням відповідного 5галогенпіразоло[3,4-b]піридин-3-аміну, що несе змінну функціональність в позиції 6. Спосіб A4: Спосіб A4 спрямований на одержання похідних загальної формули (V) зі сполук загальної формули (III), через проміжне утворення сполук формули (IV). Ці сполуки звичайно одержують шляхом, представленим на схемі 6. Спосіб ілюструють такі посилання: Gueiffier та ін. Heterocycles, 1999, 51 (7), 1661-1667; Gui-Dong Zhu та ін. Bioorg. Med. Chem., 2007, 15, 24412452. Схема 6 Сполуки загальної формули (IIIa), ацетиловані заздалегідь одним чи іншим зі способів, добре відомих фахівцю в даній області техніки, піддають дії ізоамілнітриту, нітриту натрію, або будь-якого іншого еквівалентного органічного або неорганічного нітриту у воді або оцтовій кислоті, протягом звичайно від 1 до 3 днів при температурі від 0 °C до 40 °C. У сполук загальної формули (IVa), одержаних у такий спосіб, видаляють захисну групу в кислих умовах, наприклад, за допомогою соляної кислоти, після чого піддають дії агентів нітрування, таких як концентрована азотна кислота або нітрат калію у сірчаній кислоті при температурі від 0 °C до 25 °C. Слід відзначити, що загалом можливе пряме перетворення сполук загальної формули (IIIa) на незахищені сполуки (IVb). Нітропіразоли, одержані у такий спосіб, звичайно відновлюють до амінопіразолів загальної формули (Ve) з використанням SnCl2 в соляній кислоті. Альтернативні способи включають використання заліза, цинку або олова в кислому середовищі та способи каталітичної гідрогенізації в присутності комплексів платини, нікелю або Pd/C в атмосфері водню або в присутності еквівалентних агентів, таких як циклогексадієн, циклогексен, боргідрид натрію або гідразин. Спосіб B: Відповідно до способу В, сполуки формули (I) одержують шляхом попереднього синтезу сполук загальної формули (VI), які характеризуються наявністю функціоналізованого гетеробіциклічного кільця, яке містить екзоциклічний амін. Ці сполуки одержують шляхом синтезу проміжних сполук загальної формули (VI). Спосіб B1: Спосіб B1 представлений на схемі 7 нижче, зокрема, W означає Н, (С 1-С6)-алкіл, арил або бензил. 22 UA 109698 C2 5 10 15 20 25 30 35 40 Схема 7 Похідні 3-нітро-6-тіоксо-1,6-дигідропіридин-2-карбонітрилу та 3-нітро-6-тіоксо-1,6дигідропіразин-2-карбонітрилу, необов’язково функціоналізовані в позиції 5, як правило, одержують з відповідних 2,6-дихлор-3-нітропіридинів або 2,6-дихлор-3-нітропіразинів шляхом послідовних реакцій ціанідної солі, такої як ціанід міді, в полярному розчиннику з високою температурою кипіння, такому як N-метилпіролідон, при температурі в межах між 100 °C та 200 °C, з подальшою взаємодією водного бісульфіту натрію в полярному розчиннику. Ці речовини потім алкілують, наприклад, шляхом використання заміщеного бензилброміду, в лужному середовищі, згідно зі способами, добре відомими фахівцю в даній області. Кращий протокол включає використання апротонного та безводного полярного розчинника, такого як ацетон, внесеного при температурі кипіння, та органічної основи, такої як піридин, триетиламін або DIPEA, або неорганічної основи, такої як карбонат натрію, калію або кальцію. Реакції для відновлення функціональної нітрогрупи до аміну краще проводять з використанням SnCl 2 в соляній кислоті. Альтернативні способи включають використання заліза, цинку або олова в кислотному середовищі та способи каталітичної гідрогенізації в присутності комплексів платини, нікелю або Pd/C в атмосфері водню або в присутності еквівалентних агентів, таких як циклогексадієн, циклогексен, боргідрид натрію або гідразин. В деяких випадках продукт реакції відновлення, на додаток до первинного аміну має функцію карбоксаміду в результаті гідролізу нітрильної функції. В цьому випадку виділення відповідного 3-амінопіколінонітрилу або 3-амінопіразин-2-карбонітрилів може бути здійснене шляхом дегідратації карбоксаміду до нітрилу шляхом використання оксихлориду фосфору в присутності ДМФА або будь-яким іншим способом, добре відомим фахівцям в даній області. Зрештою, утворення кільця амінопіразолу здійснюється краще шляхом утворення діазонію, одержаного послідовною реакцією при низькій температурі ізоамілнітриту, нітриту натрію або будь-якого іншого еквівалентного органічного чи неорганічного нітриту у воді, соляній кислоті, оцтовій кислоті або сірчаній кислоті, при температурі від 0 °C до 20 °C, з подальшим його відновленням до гідразину та внутрішньомолекулярною циклізацією, активованою нагріванням реакційного середовища. Реакцію відновлення краще проводять хлоридом олова в кислому середовищі, але вона також може бути проведена шляхом каталітичного гідрування або будьяким іншим способом, добре відомим фахівцям в даній області. Як альтернативи цій останній стадії, можна передбачити, що проміжний діазоній піддають реакції Сандмейера, у якій ця функціональна група заміщається атомом галогену, таким як йод, реакцією відповідної солі, такої як NaI. Якщо ця опція є кращою, утворення кільця амінопіразолу здійснюється за рахунок використання гідразину, функціоналізованого чи ні, в полярному розчиннику, такому як етанол, при температурах від 25 °C до 150 °C. Спосіб B2: Крім того, можна скористуватися реакцією ароматичного нуклеофільного заміщення для функціоналізації кільця піридину або піразину в положенні 6. В цьому випадку як нуклеофили використовуються феноли, тіофеноли, бензилові спирти або тіобензилові спирти, а також аніліни або бензиламіни, функціоналізовані чи ні. Схема 8а загальної реакції представлена нижче, зокрема, з W = Н, (С1-С6) алкіл, арил або бензил: 23 UA 109698 C2 5 10 15 20 25 30 Схема 8а У випадку, коли X = O або S, 6-хлор-3-нітропіколінонітрили та 6-хлор-3-нітропіразин-2карбонітрили, можливо заміщені в положенні 5, піддають взаємодії в присутності придатного нуклеофіла, спирту або тіолу, в полярному розчиннику, такому як ацетонітрил, в присутності неорганічної основи, такої як карбонат калію або натрію. Розчинники, такі як ДМСО (диметилсульфоксид), ДМФ (диметилформамід), ацетон, ТГФ (тетрагідрофуран) або піридин, можуть бути також прийнятними. Якщо необхідно, ці реакції можуть бути каталізовані дією міді, а також можуть бути здійснені без розчинника. як правило, кращий протокол передбачає діапазон температур від 20 °C до 150 °C. Альтернативно, також можливе використання основ, таких як піридин, DIPEA, діізопропіламін, триетиламін, ДБУ, трет-бутилат калію, NEt3 або NaH. У випадку, коли X = N, толуол є кращим розчинником, а триетиламін (NEt 3) - кращою основою. Наступні стадії, аж до сполук загальної формули (VIIb), є ідентичними тим, що описані в способі B1 вище. Спосіб B3: Спосіб B3, представлений на схемі 8b нижче, є варіантом способу В2, який характеризується тим, що перша стадія є результатом каталітичної реакції сполуки між бензилборонатом, у формі кислоти або складного ефіру, та 6-хлор-3-нітропіколінонітрильного або 6-хлор-3-нітропіразин-2-карбонітрильного похідного. Фахівцям в даній області також добре відомо, що каталітичні реакції сполуки з використанням альтернативних каталізаторів та похідних бензила також є можливими. В їх числі можуть бути передбачені реакція Штилле (Stille), на основі комплексів олова, або реакції на основі цинкорганічних сполук. Схема 8b Необов’язково заміщений 2-бензил-4,4,5,5-тетраметил-1,3,2-діоксаборолан одержують заздалегідь, наприклад, з відповідного бензилхлориду та октаметилбідіоксаборолану в діоксані в присутності ацетату калію та Pt(dppf)Cl2 (dppf=1,1'-біс(дифенілфосфіно)фероцен). Цю сполуку вводять в контакт з 6-хлор-3-нітропіколінонітрилом, 6-хлор-3-нітропіразин-2-карбонітрилом, при необхідності заміщеним в положенні 5, або 5-хлор-2-нітропіколінонітрилом, при необхідності заміщеним в положенні 6, та паладієвим каталізатором, таким як Pd(dppf)Cl 2 або Pd(PPh3)4, органічною основою, такою як триетиламін або алкоголят, або неорганічною основою, такою як 24 UA 109698 C2 5 10 15 20 25 30 35 натрій, калій або карбонат цезію, в розчиннику, такому як толуол, бензол, ТГФ або діоксан. Кращими є температури реакції в діапазоні від 20 °C до 100 °C. Продукти цих реакцій відповідають заміщеним похідним 6-бензил-3-нітропіколінонітрилу, 6-бензил-3-нітропіразин-2карбонітрилу або 5-бензил-2-нітронікотинонітрилу, для яких наступні стадії перетворення відповідають вищеописаним у способі B1. Спосіб B4: Спосіб В4, представлений на схемі 9 нижче, дає доступ до біциклів піразолопіридину та піразолопіразину, при необхідності, функціоналізованих арилсульфонамідними функціями, з Rl = (C1-C6)-алкілом та, зокрема, W = Н, (С1-С6)-алкіл, арил або бензил. Схема 9 Похідні етил-2-хлор-5-(хлорсульфоніл)нікотинату, необхідні для цій послідовності реакцій, можуть бути одержані згідно зі способами, описаними Levett P.C. та ін., Org. Proc. Res. Dev, 2002, 6 (6), 767-772; WO 01/98284 та WO 2008/010964. Формування сульфонамідів звичайно здійснюють шляхом змішування 2-хлор-5(хлорсульфоніл)нікотинату відповідно з первинним або вторинним аніліном, при необхідності функціоналізованим, в апротонному розчиннику, такому як дихлорметан, тетрагідрофуран, ацетон або ацетонітрил, в присутності органічної основи, такої як триетиламін (NEt 3), піридин або DIPEA. Використання неорганічної основи, такої як карбонат натрію або калію, також може бути передбачене. Оптимальна температура реакції від 0 °C до 70 °C. Реакція омилення одержаного у такий спосіб продукту, зокрема, з використанням гідроксиду літію в ТГФ/воді, дає доступ до відповідних 2-хлор-5-(N-фенілсульфамоїл)нікотинових кислот. Відповідні хлорангідриди кислот одержують шляхом обробки тіонілхлоридом в толуолі при кип’ятінні зі зворотним холодильником або будь-яким іншим способом дегідрохлорування, добре відомим фахівцю в даній області. Реакція цих проміжних продуктів з водним розчином аміаку дозволяє одержувати при необхідності функціоналізовані 2-хлор-5-(Nфенілсульфамоїл)нікотинаміди, які потім беруть участь в реакції дегідратації, зокрема, з використанням POCl3, при температурі в діапазоні від 75 °C та 150 °C. Альтернативне використання агентів, таких як P2O5 або ангідриду трифтороцтової кислоти та піридину, також може бути передбачене. Зрештою, ці похідні загальної формули (VIh) піддають взаємодії в присутності гідразину, функціоналізованого чи ні, в полярному розчиннику, такому як етанол, при температурах, що змінюються від 25 °C до 150 °C, з утворенням відповідних похідних загальної формули (VIId). Спосіб B5: Спосіб B5, представлений на схемі 10 нижче, дає доступ до біциклів піразолопіридину за участі можливо функціоналізованих функцій бензилового ефіру, де, зокрема, W = Н, (С1-С6) алкіл, арил або бензил. 25 UA 109698 C2 5 10 15 20 25 30 35 40 Схема 10 Спосіб, описаний нижче, надихнутий роботою J. Baldwin та ін., J. Heterocyclic. Chem., 1980, 17 (3), 445-448. 5-Гідроксинікотинонітрильні похідні, додатково функціоналізовані в положенні 6, алкілують, звичайно шляхом використання при необхідності функціоналізованого бензилгалогеніду в присутності основи. Кращий спосіб потребує використання апротонного полярного розчинника, такого як ДМФ, та основи, такої як NaH. Оптимальні температури реакції знаходяться в межах від 20 °C до 100 °C. Альтернативно, можуть бути використані розчинники, які включають, наприклад, ТГФ, ДМСО, діоксан, ацетонітрил, дихлорметан або ацетон, та основи, такі як tBuOK, DIPEA, піридин, триетиламін, ДБУ або карбонат натрію, калію чи цезію. Окиснення піридинового кільця до піридин-N-оксиду звичайно здійснюють з використанням м-ХПБК в дихлорметані при кімнатній температурі. Тим не менш, багато альтернативних способів є можливими, зокрема, ті, що основані на використанні перкарбонату натрію, в присутності ренієвого каталізатора, перборату натрію в присутності оцтової кислоти або комплексу мочевина-пероксид водню. Обробка цих піридин-N-оксидних похідних оксихлоридом фосфору приводить до утворення відповідних 2-хлорнікотинонітрилів (VI). Їх реакція при нагріванні з гідразином, функціоналізованим чи ні, в полярному розчиннику, такому як ізопропанол чи етанол, приводить до утворення шуканих біциклів піразолопіридину (VIIe). Спосіб B6: Спосіб В6, представлений на схемі 10a нижче, дає доступ до при необхідності функціоналізованих біциклів піразолопіридину та піразолопіразину за участі обернених функцій сульфонаміду, зокрема, з W = Н, (С1-С6)-алкіл, арил або бензил. Схема 10а Спосіб, описаний нижче, полягає у формуванні сульфонамідної функціональної групи з ароматичного аміну та арилсульфонілгалогеніду або будь-якого іншого еквівалентного реагенту, в присутності основи, яка може бути при необхідності введена як розчинник або співрозчинник. Альтернативно, арилсульфонілгалогенід або його еквівалент можуть бути одержані безпосередньо в реакційній суміші. Їх реакція при нагріванні з гідразином, функціоналізованим чи ні, в полярному розчиннику, такому як ізопропанол або етанол, приводить до утворення бажаних біциклів піразолопіридину та піразолопіразину (VIIf). Спосіб C: Спосіб С спрямований на одержання сполук загальної формули (XI), як описано на схемі 1. Спосіб C1: Спосіб C1, представлений на схемі 11 нижче, призначений для одержання піразолопіридину та піразолопіразину, функціоналізованих в положенні 6, з Rn = галоген, мезилат, тозилат або трифлат, Х = O, S, NH, N-(C1-C-)-алкіл і, можливо, CH2 для (Xc), та (Xd) і Rj = H або N-захисна група. Цей спосіб може бути також використаний для проведення синтезу молекул, які містять 26 UA 109698 C2 двохатомну групу X, що відповідає, зокрема, групі ArX, представленій: -ArCH2NH-, -ArCH2N(R4)-, -ArCH2O-, -ArCH2S-, -ArCH2CH2-, -ArCHCH- або -ArCC-. 5 10 15 20 25 30 35 40 Схема 11 6-Гідрокси-2-(метилтіо)нікотинонітрили або 5-гідрокси-3-(метилтіо)піразин-2-карбонітрили піддають реакції дегідрохлорування, звичайно в присутності оксихлориду фосфору, з чи без розчинника, при температурі, що змінюється від 70 °C до 180 °C. Якщо використовують розчинник, то неполярний розчинник з високою температурою кипіння, такий як толуол або ксилол, буде кращим. Крім того, можна активувати 6-гідрокси-2-(метилтіо)нікотинонітрили та 5гідрокси-3-(метилтіо)піразин-2-карбонітрили їх виведенням в складні ефіри сульфокислот через утворення відповідних тозилатів, мезилатів або трифлатів. Якщо цей варіант є кращим, використання тозил-, мезил- або трифлілхлоридів в розчиннику, такому як толуол, дихлорметан, ТГФ, ацетонітрил, ацетон чи діоксан, в присутності органічної або неорганічної основи, дає доступ до цих похідних. 6-Хлор-2(метилтіо)нікотинонітрили та 5-хлор-3-(метилтіо)піразин-2- карбонітрили, одержані у вказаному порядку, або їх аналоги складні ефіри сульфонової кислоти, якщо цей варіант є кращим, потім піддають взаємодії з нуклеофілом, таким як фенол, анілін або тіофенол, в контексті ароматичного нуклеофільного заміщення. В цьому випадку реакцію проводять в полярному розчиннику, такому як ДМСО, ДМФ, ацетон, ТГФ або ацетонітрил, в присутності основи, такої як трет-бутилат калію або NaH. Якщо необхідно, ці реакції можуть бути каталізовані дією міді, а також можуть бути здійснені без розчинника. Як правило, кращий протокол включає діапазон температур від 20 °C до 150 °C. Крім того, використання органічних основ, таких як піридин, діізопропіламін, триетиламін або ДБУ, або неорганічних основ, таких як карбонат натрію або калію, також є можливим. Альтернативно, сполуки формули (IXb) можуть привести до каталітичної реакції сполучення, такої як реакція Сузукі. В цьому випадку, ці сполуки об’єднують з при необхідності заміщеним 2бензил-4,4,5,5-тетраметил-1,3,2-діоксабороланом, вже описаним в попередньому способі B3, паладієвим каталізатором, таким як Pd(dppf)Cl2 або Pd(PPh3)4, органічною основою, такою як триетиламін або алкоголят, або неорганічною основою, такою як карбонат натрію, калію або цезію, в розчиннику, такому як толуол, бензол, ТГФ або діоксан. Кращі температури реакції знаходяться в діапазоні від 20 °C до 100 °C. Похідні, одержані за допомогою одного з цих способів, потім окиснюють, звичайно шляхом використання м-ХПБК або оксону з утворенням відповідних сульфоксидів, метилу або метилсульфону. Ці сполуки інколи одержують у вигляді сумішей, які використовуються «як є» в реакції формування кільця амінопіразолу шляхом використання при необхідності заміщеного гідразину в полярному розчиннику, такому як етанол, при температурах, що змінюються від 25 °C до 150 °C. Крім того, можна змінити послідовність реакцій, зокрема, шляхом обернення стадій синтезу. Спосіб C2: Спосіб С2, представлений на схемі 12 нижче, призначений для одержання піразолопіридинів та піразолопіридазинів, функціоналізованих в положенні 6, з X = O, S, NH, N(C1-C-)-алкілом або СН2, і Rj = H або N-захисною групою. 27 UA 109698 C2 5 10 15 20 25 30 35 Схема 12 6-Гідрокси-4-(метилтіо)нікотинонітрильні або 6-гідрокси-4-(метилтіо)-піридазин-3карбонітрильні похідні окиснюють, звичайно, шляхом використання м-ХПБК або оксону з утворенням відповідних метилсульфоксидів або метилсульфонів. Ці сполуки, інколи одержувані у вигляді сумішей, використовуються як є в реакції формування кільця амінопіразолу з використанням при необхідності заміщеного гідразину в полярному розчиннику, такому як етанол, при температурах, що змінюються від 25 °C до 150 °C. Піразолопіридини та піразолопіридазини, одержані у такий спосіб, піддають реакції дегідрохлорування, звичайно в присутності оксихлориду фосфору, з розчинником чи без нього, при температурі, що змінюється від 70 °C до 180 °C. Якщо використовують розчинник, то неполярний розчинник з високою температурою кипіння, такий як толуол або ксилол, буде кращим. Можливо заміщений 6-хлорпіразоло[4,3-с]піридин-3-амін та 6-хлорпіразоло[4,3с]піридазин-3-амін, відповідно одержані, потім піддають взаимодії з нуклеофілом, таким як фенол, анілін або тіофенол, шляхом ароматичного нуклеофільного заміщення. В цьому випадку реакцію проводять в полярному розчиннику, такому як ДМСО, ДМФ, ацетон, ТГФ або ацетонітрил, в присутності основи, такої як трет-бутилат калію або NaH. Якщо необхідно, ці реакції можуть бути каталізовані дією міді, а також можуть бути здійснені без розчинника. Як правило, кращий протокол включає температуру в діапазоні від 20 °C до 150 °C. Крім того, також можливе використання органічних основ, таких як піридин, діізопропіламін, триетиламін або ДБУ, або неорганічних основ, таких як карбонат натрію або калію. Альтернативно, сполуки формули (XIVa) можуть привести до каталітичної реакції сполучення, такої як реакція Сузукі. В цьому випадку, ці сполуки поєднують з при необхідності заміщеним 2-бензил-4,4,5,5-тетраметил-1,3,2-діоксабороланом, як описано вище в попередньому способі B3, паладієвим каталізатором, таким як Pd(dppf)Cl2 або Pd(PPh3)4, органічною основою, такою як триетиламін або алкоголят, або неорганічною основою, такою як карбонат натрію, калію або цезію, в розчиннику, такому як толуол, бензол, ТГФ або діоксан. Кращі температури реакції находяться в діапазоні від 20 °C до 100 °C. Спосіб C3: Спосіб C3, представлений на схемі 12a нижче, є варіантом способу C1, основаного на регіоселективній функціоналізації 2,6-дихлорнікотинонітрилу чи то аніонними нуклеофілом, таким як фенол або тіофенол, або металоорганічною сполукою, такою як хлорид бензилцинку. В останньому випадку реакцію каталізують, наприклад, комплексом паладію(II). Перетворення хлорнікотинонітрилу, одержаного у такий спосіб, на відповідний піразолопіридин, у випадку, коли Y1 = CH, здійснюється, як описано вище в способі A1. Схема 12а 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of azaindazole or diazaindazole type as medicament
Автори англійськоюKaloun, El Bachir, Bedjeguelal, Karim, Rabot, Remi, Kruczynski, Anna, Schmitt, Philippe, Perez, Michel, Rahier, Nicolas
Автори російськоюКалун Эль Бахир, Беджегелаль Карим, Рабо Рэми, Крюзински Анна, Шмитт Филипп, Перес Мишель, Райе Николя
МПК / Мітки
МПК: A61P 35/00, C07D 471/04, A61K 31/4162
Мітки: діазаіндазолу, похідні, медикамент, азаіндазолу
Код посилання
<a href="https://ua.patents.su/102-109698-pokhidni-azaindazolu-abo-diazaindazolu-yak-medikament.html" target="_blank" rel="follow" title="База патентів України">Похідні азаіндазолу або діазаіндазолу як медикамент</a>
Попередній патент: Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів
Наступний патент: Пристрій для заміни спікального візка та спосіб заміни
Випадковий патент: Індикаторна контрольна пломба












