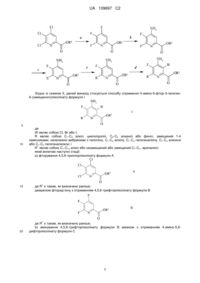
Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів
Номер патенту: 109697
Опубліковано: 25.09.2015
Автори: Подхорес Девід Е., Уайтекер Грегорі Т., Чжу Юаньмін, Сіддалл Томас Л., Арндт Кім Е., Рот Гарі Алан, Вест Скотт П., Лоу Крістіан Т., Ренга Джеймс М.
Формула / Реферат
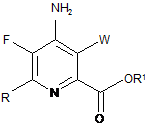
1. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І:
 , I
, I
де
W являє собою Сl, Вr або І;
R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; і
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
який включає наступні стадії:
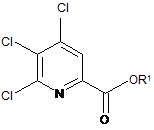
а) фторування 4,5,6-трихлорпіколінату формули А
 , A
, A
де R1 є таким, як визначено раніше;
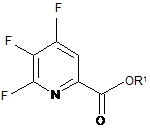
джерелом фторид-іону з отриманням 4,5,6-трифторпіколінату формули В:
 , B
, B
де R1 є таким, як визначено раніше;
b) амінування 4,5,6-трифторпіколінату формули В аміаком з отриманням 4-аміно-5,6-дифторпіколінату формули С
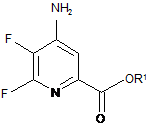 , C
, C
де R1 є таким, як визначено раніше;
с) заміна фтор-замісника в положенні 6 4-аміно-5,6-дифторпіколінату формули С на йод, бром або хлор-замісник шляхом обробки джерелом іонів йоду, брому або хлору з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули D:
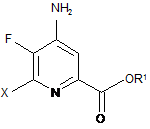 , D
, D
де X являє собою Сl, Вr або І, і R1 є таким, як визначено раніше;
d) галогенування 4-аміно-5-фтор-6-галогенпіколінату формули D джерелом галогену з отриманням 4-аміно-3,6-дигалоген-5-фторпіколінату формули Ε:
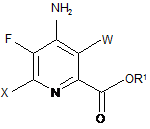 , E
, E
де W і X незалежно являють собою Сl, Вr або І, і R1 є таким, як визначено раніше; і
e) зв'язування 4-аміно-3,6-дигалоген-5-фторпіколінату формули Ε з арильною, алкільною або алкенільною металевою сполукою формули F:
R-Met, F
де R є таким, як визначено раніше, і Met являє собою Zn-галогенід, Zn-R, три-(С1-С4алкіл)олово, мідь або B(OR2)(OR3), де R2 і R3 незалежно один від одного являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу в присутності каталізатора на основі перехідного металу з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І.
2. Спосіб за п. 1, в якому аміновмісний продукт або проміжний продукт очищені шляхом: а) протонування кислотою з утворенням солі, b) виділення солі з високою чистотою шляхом кристалізації, осадження або екстракцій, і с) нейтралізації очищеної солі основою з утворенням очищеного нейтрального аміновмісного продукту або проміжної сполуки.
3. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І:
 , I
, I
де
W являє собою Сl, Вr або І;
R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; і
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
який включає наступні стадії:
а) фторування 4,5,6-трихлорпіколінату формули А:
 , A
, A
де R1 є таким, як визначено раніше;
джерелом фторид-іону з отриманням 4,5,6-трифторпіколінату формули В:
 , B
, B
де R1 є таким, як визначено раніше;
b) амінування 4,5,6-трифторпіколінату формули В аміаком з отриманням 4-аміно-5,6-дифторпіколінату формули С:
 , C
, C
де R1 є таким, як визначено раніше;
с) заміна фтор-замісника в положенні 6 4-аміно-5,6-дифторпіколінату формули С на йод, бром або хлор-замісник шляхом обробки джерелом йоду, брому або хлору з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули D:
 , D
, D
де X являє собою Сl, Вr або І; і
R1 є таким, як визначено раніше;
d) зв'язування 4-аміно-5-фтор-6-галогенпіколінату формули D з арильною, алкільною або алкенільною металевою сполукою формули F:
R-Met, F
де R є таким, як визначено раніше, і Met являє собою Zn-галогенід, Zn-R, три-(С1-С4алкіл)олово, мідь або B(OR2)(OR3), де R2 і R3 незалежно один від одного являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу в присутності каталізатора на основі перехідного металу з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінату формули G:
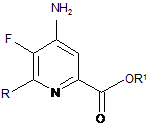 , G
, G
де R, R1 є такими, як визначено раніше; і
e) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули G джерелом галогену з отриманням 4-аміно-5-фтор-3-гало-6-(заміщеного)піколінату формули І.
4. Спосіб за п. 3, в якому аміновмісний продукт або проміжний продукт очищені шляхом: а) протонування кислотою з утворенням солі, b) виділення солі з високою чистотою шляхом кристалізації, осадження або екстракції, і с) нейтралізації очищеної солі основою з утворенням очищеного нейтрального аміновмісного продукту або проміжної сполуки.
5. Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І:
 , I
, I
де
W являє собою Сl, Вr або І;
R являє собою С1-С4алкіл, циклопропіл, С1-С4алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси; і
R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл;
який включає наступні стадії:
а) зв'язування 4,5,6-трихлорпіколінату формули А:
 , A
, A
де R, R1 є такими, як визначено раніше;
з арильною, алкільною або алкенільною металевою сполукою формули F:
R-Met, F
де R є таким, як визначено раніше, і Met являє собою Zn-галогенід, Zn-R, три-(С1-С4алкіл)олово, мідь або B(OR2)(OR3), де R2 і R3 незалежно один від одного являють собою водень, С1-С4алкіл, або, взяті разом, утворюють етиленову або пропіленову групу в присутності каталізатора на основі перехідного металу з отриманням 4,5-дихлор-6-(заміщеного)піколінату формули Η:
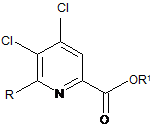 , H
, H
де R і R1 є такими, як визначено раніше;
b) фторування 4,5-дихлор-6-(заміщеного)піколінату формули Η джерелом фторид-іонів з отриманням 4,5-дифтор-6-(заміщеного)піколінату формули J:
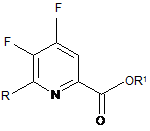 , J
, J
де R, R1 є такими, як визначено раніше;
с) амінування 4,5-дифтор-6-(заміщеного)піколінату формули J аміаком з отриманням 4-аміно-5-фтор-6-(заміщеного)піколінату формули K:
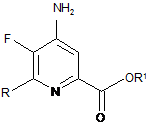 , K
, K
де R і R1 є такими, як визначено раніше; і
d) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули К джерелом галогену з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули І.
6. Спосіб за п. 5, в якому аміновмісний продукт або проміжна сполука очищені шляхом: а) протонування кислотою з утворенням солі, b) виділення солі з високою чистотою шляхом кристалізації, осадження або екстракцій, і с) нейтралізації очищеної солі основою з утворенням очищеного нейтрального аміновмісного продукту або проміжної сполуки.
7. Сполука, яка являє собою:
 ,
,
де R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси, і R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл.
8. Сполука, яка являє собою:
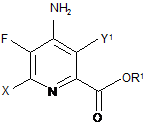 ,
,
де X являє собою І, Вr, Сl або F, Y1 являє собою Н, Сl, Вr або І, за умови, що, коли X являє собою Сl, Υ1 являє собою Н, Вr або І, і R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл.
9. Сполука, яка являє собою:
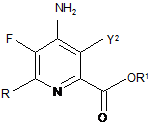 ,
,
де Y2 являє собою Н і R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси, і R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл.
10. Сполука, яка являє собою:
 ,
,
де R являє собою С1-С4алкіл, циклопропіл, С2-С4алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, С1-С4алкілу, С1-С4галогеналкілу, С1-С4алкокси або С1-С4галогеналкокси, і R1 являє собою С1-С12алкіл або незаміщений або заміщений С7-С11арилалкіл.
Текст
Реферат: 4-Аміно-5-фтор-3-галоген-6-(заміщені)піколінати зручно отримувати з 4,5,6-трихлорпіколінатів серією стадій, що включають обмін фтором, амінування, обмін галогеном, галогенування і зв'язування за допомогою перехідного металу. UA 109697 C2 (12) UA 109697 C2 UA 109697 C2 5 10 15 20 25 Даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген-6(заміщених)піколінатів. Більш конкретно, даний винахід стосується способу отримання 4-аміно5-фтор-3-галоген-6-(заміщених)піколінатів, в яких замісник 5-фтор вводиться шляхом заміни галогену на початку схеми способу. Патент США 6297197 B1 описує inter alia конкретні сполуки 6-(алкокси або арилокси)-4аміно-3-хлор-5-фторпіколінатів і їх застосування як гербіцидів. Патенти США 6784137 B2 і 7314849 B2 описують inter alia конкретні сполуки 6-(арил)-4-аміно-3-хлор-5-фторпіколінатів і їх застосування як гербіцидів. Патент США 7432227 B2 описує inter alia конкретні сполуки 6(алкіл)-4-аміно-3-хлор-5-фторпіколінатів і їх застосування як гербіцидів. Кожний з цих патентів описує отримання вихідних речовин для 4-аміно-3-хлор-5-фторпіколінату шляхом фторування відповідних 5-незаміщених піридинів 1-(хлорметил)-4-фтор-1,4-діaзонійбіцикло[2.2.2]октан біс(тетрафторборатом). Було б вигідно отримувати 4-аміно-5-фтор-3-галоген-6(заміщені)піколінати, без необхідності прямого фторування положення 5 піридинового кільця дорогим агентом фторування, таким як 1-(хлорметил)-4-фтор-1,4-діaзонійбіцикло[2.2.2]октан біс(тетрафторборатом). Даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген-6(заміщених)піколінатів з 4,5,6-трихлорпіколінатів. Більш конкретно, даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули I де W являє собою Cl, Br або I; R являє собою C1-C4 алкіл, циклопропіл, C2-C4 алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, C1-C4 алкілу, C1-C4 галогеналкілу, C1-C4 алкокси або C1-C4 галогеналкокси; і 1 R являє собою C1-C12 алкіл або незаміщений або заміщений C7-C11 арилалкіл; який включає наступні стадії: a) фторування 4,5,6-трихлорпіколінату формули А 1 30 де R є таким, як визначено раніше; джерелом фторид-іону з отриманням 4,5,6-трифторпіколінату формули В 1 де R є таким, як визначено раніше; b) амінування 4,5,6-трифторпіколінату формули В аміаком з отриманням 4-аміно-5,6дифторпіколінату формули С 35 1 UA 109697 C2 1 де R є таким, як визначено раніше; c) заміна фтор-замісника в положенні 6 4-аміно-5,6-дифторпіколінату формули С на йод, бром або хлор-замісник шляхом обробки джерелом іонів йоду, брому або хлору з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули D 5 10 15 20 25 де X являє собою Cl, Br або I; і 1 R є таким, як визначено раніше; d) галогенування 4-аміно-5-фтор-6-галогенпіколінату формули D джерелом галогену з отриманням 4-аміно-3,6-дигалоген-5-фторпіколінату формули Е де W і X незалежно являють собою Cl, Br або I; і 1 R є таким, як визначено раніше; і e) зв'язування 4-аміно-3,6-дигалоген-5-фторпіколінату формули Е з арильною, алкільною або алкенільною металевою сполукою формули F де R є таким, як визначено раніше, і Met являє собою Zn-галогенід, Zn-R, три-(C1-C4 2 3 2 3 алкіл)олово, мідь або В(OR )(OR ), де R і R незалежно являють собою водень, C1-C4 алкіл, або, взяті разом, утворюють етиленову або пропіленову групу в присутності каталізатора на основі перехідного металу з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули I. Стадії a)-e) можуть бути виконані в перерахованому порядку, як зображено на схемі I. Схема I Альтернативно, порядок, в якому виконують стадії, може бути перегрупований так, як проілюстрований, наприклад, на схемах II і III. Схема II 2 UA 109697 C2 Згідно зі схемою II, даний винахід стосується способу отримання 4-аміно-5-фтор-3-галоген6-(заміщеного)піколінату формули I 5 10 15 де W являє собою Cl, Br або I; R являє собою C1-C4 алкіл, циклопропіл, C2-C4 алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, C1-C4 алкілу, C1-C4 галогеналкілу, C1-C4 алкокси або C1-C4 галогеналкокси; і 1 R являє собою C1-C12 алкіл або незаміщений або заміщений C7-C11 арилалкіл; який включає наступні стадії: a) фторування 4,5,6-трихлорпіколінату формули А 1 де R є таким, як визначено раніше; джерелом фторид-іону з отриманням 4,5,6-трифторпіколінату формули В 1 20 де R є таким, як визначено раніше; b) амінування 4,5,6-трифторпіколінату формули В аміаком з отриманням 4-аміно-5,6дифторпіколінату формули С 3 UA 109697 C2 1 5 де R є таким, як визначено раніше; c) заміна фтор-замісника в положенні 6 4-аміно-5,6-дифторпіколінату формули С на йод, бром або хлор-замісник шляхом обробки джерелом іонів йоду, брому або хлору з отриманням 4-аміно-5-фтор-6-галогенпіколінату формули D 10 де X являєсобою Cl, Br або I; і 1 R є таким, як визначено раніше; d) зв'язування 4-аміно-5-фтор-6-галогенпіколінату формули D з арильною, алкільною або алкенільною металевою сполукою формули F 15 де R є таким, як визначено раніше, і Met являє собою Zn-галогенід, Zn-R, три-(C1-C4 2 3 2 3 алкіл)олово, мідь або В(OR )(OR ), де R і R незалежно один одного являють собою водень, C1C4 алкіл, або, взяті разом, утворюють етиленову або пропіленову групу в присутності каталізатора на основі перехідного металу з отриманням 4-аміно-5-фтор-6(заміщеного)піколінату формули G. 1 20 25 де R і R є такими, як визначено раніше; і e) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули G джерелом галогену з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули I. Схема III На Схемі III стадія с) заміни йоду, брому або хлору не є необхідною. Таким чином, даний винахід також стосується способу отримання 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули I 4 UA 109697 C2 5 10 15 20 де W являє собою Cl, Br або I; R являє собою C1-C4 алкіл, циклопропіл, C2-C4 алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, C1-C4 алкілу, C1-C4 галогеналкілу, C1-C4 алкокси або C1-C4 галогеналкокси; і 1 R являє собою C1-C12 алкіл або незаміщений або заміщений C7-C11 арилалкіл; який включає наступні стадії: a) зв'язування 4,5,6-трихлорпіколінату формули А 1 де R є таким, як визначено раніше; з арильною, алкільною або алкенільною металевою сполукою формули F де R є таким, як визначено раніше, і Met являє собою Zn-галогенід, Zn-R, три-(C1-C4 2 3 2 3 алкіл)олово, мідь або В(OR )(OR ), де R і R незалежно один одного являють собою водень, C1C4 алкіл, або, взяті разом, утворюють етиленову або пропіленову групу в присутності каталізатора на основі перехідного металу з отриманням 4,5-дихлор-6-(заміщеного)піколінату формули Н 1 де R і R є такими, як визначено раніше; b) фторування 4,5-дихлор-6-(заміщеного)піколінату формули Н джерелом фторид-іонів з отриманням 4,5-дифтор-6-(заміщеного)піколінату формули J 1 25 де R є таким, як визначено раніше; c) амінування 4,5-дифтор-6-(заміщеного)піколінату формули J аміаком з отриманням 4аміно-5-фтор-6-(заміщеного)піколінату формули K 1 де R і R є такими, як визначено раніше; і 5 UA 109697 C2 5 10 d) галогенування 4-аміно-5-фтор-6-(заміщеного)піколінату формули K джерелом галогену з отриманням 4-аміно-5-фтор-3-галоген-6-(заміщеного)піколінату формули I. 1 На будь-якій стадії на схемах I-III замісник складного ефіру, R , може необов'язково бути 1 замінений на інший замісник R . Ці складні ефіри, включаючи незаміщені або заміщені складні C7-C11 арилалкілові ефіри, можуть бути отримані етерифікацією без каталізатора або за допомогою реакцій переетерифікації із застосуванням способів, відомих в галузі техніки. Іншим аспектом даного винаходу є нові проміжні продукти, що отримуються в даному способі, тобто, сполуки, вибрані з групи, що складається з: a) 15 де R являє собою C1-C4 алкіл, циклопропіл, C2-C4 алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, C1-C4 алкілу, C1-C4 галогеналкілу, C1-C4 алкокси 1 або C1-C4 галогеналкокси, і R являє собою C1-C12 алкіл або незаміщений або заміщений C7-C11 арилалкіл; b) 20 де X являє собою I, Br, Cl або F, Y являє собою Н, Cl, Br або I, при умові, що, коли X являє 1 1 собою Cl, Y являє собою Н, Br або I, і R являє собою C1-C12 алкіл або незаміщений або заміщений C7-C11 арилалкіл; c) 1 2 25 30 35 де Y являє собою Н, Br або I, і R являє собою C1-C4 алкіл, циклопропіл, C2-C4 алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, C1-C4 алкілу, C1-C4 1 галогеналкілу, C1-C4 алкокси або C1-C4 галогеналкокси, і R являє собою C1-C12 алкіл або незаміщений або заміщений C7-C11 арилалкіл; і d) де R являє собою C1-C4 алкіл, циклопропіл, C2-C4 алкеніл або феніл, заміщений 1-4 замісниками, незалежно вибраними з галогену, C1-C4 алкілу, C1-C4 галогеналкілу, C1-C4 алкокси 1 або C1-C4 галогеналкокси, і R являє собою C1-C12 алкіл або незаміщений або заміщений C7-C11 арилалкіл. Терміни "алкіл", "алкеніл" і "алкініл", а також похідні терміни, такі як "алкокси", "ацил", "алкілтіо" і "алкілсульфоніл", як використовується в даному описі, охоплюють фрагменти з нерозгалуженим, розгалуженим ланцюгом і циклічні фрагменти. Якщо конкретно не указано інакше, кожний може бути незаміщеним або заміщеним одним або більше замісниками, вибраними з, але не обмежуючись ними, галогену, гідрокси, алкокси, алкілтіо, C1-C6 ацилу, 6 UA 109697 C2 5 10 15 20 25 30 35 40 45 50 формілу, ціано, арилокси або арилу, при умові, що замісники є стерично сумісними, і дотримуються правила утворення хімічного зв'язку і енергії деформації. Терміни "алкеніл" і "алкініл" призначені для позначення включення одного або більше ненасичених зв'язків. Термін "арилалкіл", як використовується в даному описі, стосується фенілзаміщеної алкільної групи, що містить загалом 7-11 вуглецевих атомів, таких як бензил (-CH2C6H5), 2метилнафтил(-CH2C10H7) і 1- або 2-фенетил (-CH2CH2C6H5 або -CH(CH3)C6H5). Фенільна група може бути сама по собі незаміщеною або заміщеною одним або більше замісниками, незалежно вибраними з галогену, нітро, ціано, C1-C6 алкілу, C1-C6 алкокси, галогенованого C1-C6 алкілу, галогенованої C1-C6 алкокси, C1-C6 алкілтіо, С(О)OC1-C6алкіл, або де два суміжних замісники, взяті разом, являють собою Об(CH2)nO-, де n=1 або 2, при умові, що замісники є стерично сумісні, і дотримуються умови утворення хімічного зв'язку і енергії деформації. Якщо конкретно не вказано інакше, термін "галоген", а також похідні терміни, такі як "гало", відносяться до фтору, хлору, брому і йоду. 6-Фенільні групи, заміщені 1-4 замісниками, незалежно вибраними з галогену, C1-C4 алкілу, C1-C4 галогеналкілу, C1-C4 алкокси або C1-C4 галогеналкокси, можуть мати будь-яку орієнтацію, але переважні ізомери 4-заміщений феніл, 2,4-двозаміщений феніл, 2,3,4-тризаміщений феніл, 2,4,5-тризаміщений феніл і 2,3,4,6-чотирьохзаміщений феніл. 4-Аміно-5-фтор-3-галоген-6-(заміщені)піколінати отримують з 4,5,6-трихлорпіколінатів серією стадій, що включають заміну фтору, амінування, заміну галогену, галогенування і зв'язування за допомогою перехідного металу. Індивідуальні стадії можуть бути виконані в різних послідовностях. Вихідні речовини для 4,5,6-трихлорпіколінату є відомими сполуками; див., наприклад, приклад 3 в патенті США 6784137 B2. Вищі складні ефіри, включаючи незаміщені або заміщені складні C7-C11 арилалкілові ефіри, можуть бути отримані реакціями прямої етерифікації або переетерифікації із застосуванням способів, відомими в галузі техніки. У реакції заміни фтору фторований піколінат отримують взаємодією відповідного хлорованого піколінату з щонайменше одним еквівалентом джерела фторид-іонів для заміни кожного хлор-замісника, що замінюється в кільці. Типові джерела фторид-іонів являють собою фториди лужних металів, що включають фторид натрію (NaF), фторид калію (KF) і фторид цезію (CsF), де переважними є KF і CsF. Також можуть бути застосовані фторидні солі, такі як фторид тетрабутиламонію (н-Bu4NF). Переважно, реакцію проводять в полярному апротонному розчиннику або такому реакційному середовищі, як диметилсульфоксид (ДМСО), N-метилпіролідинон (ΝΜΡ), NN-диметилформамід (ДМФ), гексаметилфосфорамід (HMPA) або сульфолан. Також можуть бути застосовані добавки, такі як краун-ефіри або агенти фазового перенесення, які, як відомо, збільшують швидкість обміну фторидом. Температура, при якій проводять реакцію, не є важливою, але звичайно складає від 70 °C до 180 °C і переважно від 80 °C до 120 °C. Оптимальна температура буде мінятися в залежності від того, який застосовують розчинник в конкретній реакції. Загалом, чим нижче температура, тим повільніше буде протікати реакція. Реакція за даним винаходом, як правило, проводиться при енергійному перемішуванні, достатньому для підтримки по суті однорідної дисперсної суміші реагентів. При проведенні реакції фторування ні швидкість, ні порядок додання реагентів не є важливими. Звичайно, розчинник і фторид лужного металу змішують до того, як в реакційну суміш додають хлорований піколінат. Типова реакція, як правило, займає від 2 до 100 годин і звичайно проводиться при атмосферному тиску. У той час як точні кількості реагентів не важливі, переважне застосування такої кількості фториду лужного металу, яка забезпечить щонайменше еквімолярну кількість атомів фтору по відношенню до кількості атомів хлору, що заміняються у вихідній речовині, тобто, щонайменше еквімолярної кількості фториду лужного металу. Після завершення реакції необхідний продукт регенерують шляхом застосування стандартних способів розділення і очищення. При амінуванні 4-фторпіколінату дозволяють реагувати з аміаком для заміщення атома фтору аміногрупою. 7 UA 109697 C2 5 10 15 20 25 30 35 40 У той час як необхідна тільки стехіометрична кількість аміаку, часто зручно застосовувати великий надлишок аміаку. Реакцію проводять в інертному розчиннику, переважно, полярному апротонному розчиннику або в реакційному середовищі, такому як ДМСО, NMP, ДМФ, HMPA або сульфолан. Альтернативно, може бути застосований водний гідроксид амонію, з використанням або без використання органічного розчинника. Температура, при якій проводять реакцію, не є важливою, але, як правило, складає від 0 °C до 45 °C і переважно від 10 °C до 30 °C. При проведенні реакції амінування 4-фторпіколінат розчиняють в розчиннику, і в реакційну суміш додаютьаміак з охолоджуванням. Надлишок газу аміаку, як правило, барботують через реакційну суміш. Типова реакція, як правило, займає від 0,5 до 5 годин і звичайно проводиться при атмосферному тиску. Аміновмісні продукти або проміжні продукти, що отримуються будь-яким з цих способів, можуть бути регенеровані звичайними способами, такими як випарювання або екстракція, і можуть бути очищені стандартними способами, такими як перекристалізація або хроматографія. На очищення аміновмісних продуктів або проміжних продуктів може також впливати протонування кислотою з утворенням солі, яку виділяють з високою чистотою шляхом кристалізації, осадження або екстракцій. Може бути застосована множина кислот, таких як соляна кислота, бромистоводнева кислота, азотна кислота, оцтова кислота або сірчана кислота. Безводна соляна кислота є переважною кислотою. Очищену сіль потім нейтралізують основою з утворенням нейтрального аміновмісного продукту або проміжного продукту. Можуть бути застосовані неорганічні основи, такі як гідроксид натрію, гідроксид калію, карбонат калію, карбонат натрію або гідрокарбонат натрію. Переважні органічні основи, такі як триетиламін. Очищення аміновмісного продукту або проміжного продукту може бути виконане таким чином негайно після стадії амінування або після проведення подальших реакцій, наприклад, галогенування, зв'язування. У реакції обміну галогеном (йодом, бромом або хлором), 6-йодований, 6-бромований або 6хлорований піколінат отримують взаємодією відповідного 6-фторованого піколінату з щонайменше одним еквівалентом іона йодиду, броміду або хлориду. Як правило, реакцію обміну галогеном проводять в присутності великого надлишку безводного йодоводню (HI), бромоводню (HBr) або хлороводню (HCl). Реакцію, як правило, проводять за відсутності води для зниження утворення побічних продуктів. Для обміну галогеном, як правило, потрібно від 5 до 50 еквівалентів HI, HBr або HCl, переважно, від 10 до 20 еквівалентів. Реакцію проводять в інертному розчиннику, переважно, полярному розчиннику, такому як діоксан або оцтова кислота. Температура, при якій проводять реакції, не є важливою, але, як правило, складає від 75 °C до 150 °C і переважно від 100 °C до 125 °C. Реакцію, як правило, проводять в герметично закритому реакторі під тиском, в якому можуть утримуватися гази HI, HBr або HCl. Типова реакція займає, як правило, від 0,5 до 5 годин. У реакції галогенування, атом хлору, брому або йоду вводять в положення 3 молекули піколінату шляхом реакції 3-незаміщеного піколінату джерелом галогену в інертному розчиннику. 8 UA 109697 C2 5 10 15 20 25 30 35 40 45 Коли атомом галогену в положенні 3 є Cl, джерелом хлору може бути власне хлор (Cl 2) або реагенти, такі як сульфурилхлорид, N-хлорсукцинімід або 1,3-дихлор-5,5-диметилгідантоїн. При використанні хлору або сульфурилхлориду застосовують великий надлишок хлоруючого агента. При застосуванні хлоргазу реакцію проводять в інертному розчиннику, переважно такому розчиннику, як дихлорметан, дихлорметан-вода або оцтова кислота. При використанні сульфурилхлориду реакцію можна провести в інертному розчиннику, такому як дихлорметан або бездомішковий сульфурилхлорид. Температура, при якій проводять реакцію, не є важливою, але, як правило, складає від 0 °C до 45 °C і переважно від 10 °C до 30 °C. Типова реакція, як правило, займає від 0,5 до 5 годин. Реакцію хлорування, як правило, проводять при атмосферному тиску. Коли хлоруючий агент, що застосовується, являє собою N-хлорсукцинімід або 1,3-дихлор5,5-диметилгідантоїн, реакцію проводять із застосуванням стехіометричної кількості хлоруючого реагенту. Виявлено, що в реакціях хлорування із застосуванням 1,3-дихлор-5,5диметилгідантоїну як хлоруючий агент, реагують обидва хлори в гідантоїні. Реакцію проводять в інертному полярному розчиннику, такому як ДМФ або ацетонітрил. Температура, при якій проводять реакцію, не є важливою, але, як правило, складає від 20 °C до 85 °C і переважно від 50 °C до 80 °C. Коли ацетонітрил застосовують як розчинник, зручно провести реакцію при температурі кипіння із зворотним холодильником. Типова реакція, як правило, займає від 0,5 до 5 годин. Реакцію хлорування, як правило, проводять при атмосферному тиску. Коли атом галогену в положенні 3 є бромом, джерелом брому може бути власне бром (Br2) або реагенти, такі як сульфурилбромід, N-бромсукцинімід або 1,3-дибром-5,5-диметилгідантоїн. Коли Br2 застосовують як агент бромування, може бути використаний великий надлишок, і реакцію проводять в інертному розчиннику, переважно, такому розчиннику, як дихлорметан, дихлорметан-вода або оцтова кислота. Температура, при якій проводять реакцію, не є важливою, але, як правило, складає від 0 °C до 45 °C і переважно від 10 °C до 30 °C. Типова реакція, як правило, займає від 0,5 до 5 годин. Реакцію бромування звичайно проводять при атмосферному тиску. Коли агент бромування, що застосовується, являє собою N-бромсукцинімід або 1,3-дибром5,5-диметилгідантоїн, реакцію проводять із застосуванням стехіометричної кількості реагенту бромування. Реакцію проводять в інертному полярному розчиннику, такому як ДМФ або ацетонітрил. Температура, при якій проводять реакцію, не є важливою, але, як правило, складає від 20 °C до 85 °C і переважно від 50 °C до 80 °C. Коли ацетонітрил застосовують як розчинник, зручно провести реакцію при температурі флегми. Типова реакція, як правило, займає від 0,5 до 5 годин. Реакцію бромування, як правило, проводять при атмосферному тиску. Коли атом галогену в положенні 3 являє собою I, джерелом йоду може бути власне йод (I 2) або реагенти, такі як монохлорид йоду або N-йодсукцинімід. Йодна кислота може бути використана разом з I2. Коли I2 використовують як йодуючий реагент, може бути використаний великий надлишок I2, і реакцію проводять в інертному розчиннику, переважно, такому розчиннику, як дихлорметан, дихлорметан-вода, метиловий спирт або оцтова кислота. Температура, при якій проводять реакцію, не є важливою, але, як правило, складає від 0 °C до 45 °C і переважно від 10 °C до 30 °C. Типова реакція, як правило, займає від 0,5 до 5 годин. Реакцію йодування, як правило, проводять при атмосферному тиску. У реакції зв'язування, 6-йод, бром або хлорпіколінат реагує з арильною, алкільною або алкенільною металевою сполукою, де металом є Zn-галогенід, Zn-R, три-(C1-C4 алкіл)олово, 2 3 2 3 мідь або В(OR )(OR ), де R і R незалежно один від одного являють собою водень, C1-C4 алкіл, або, взяті разом, утворюють етиленову або пропіленову групу, в присутності каталізатора на основі перехідного металу. 9 UA 109697 C2 5 10 15 20 25 30 35 40 45 "Каталізатор" являє собою каталізатор на основі перехідного металу, зокрема, паладієвий каталізатор, такий як діацетат паладію або дихлорид біс(трифенілфосфін)паладію(II) або нікелевий каталізатор, такий як нікель(II), ацетилацетонат або дихлорид біс(трифенілфосфін)нікелю(II). Крім того, каталізатори можуть бути отримані in situ з солей металів і лігандів, таких як ацетат паладію і трифенілфосфін або хлориду нікелю(II) і трифенілфосфіну. Ці in situ каталізатори можуть бути отримані попередньою взаємодією солі металу і ліганду, з подальшим доданням до реакційної суміші, або окремим доданням солі металу і ліганду безпосередньо в реакційну суміш. Як правило, реакції зв'язування проводять за відсутності кисню із застосуванням інертного газу, такого як азот або аргон. Способи, що застосовуються для видалення кисню з реакційних сумішей, де відбувається зв'язування, такі як барботування інертним газом, відомі фахівцям в галузі техніки. Приклади таких способів описані в The Manipulation of Air-Sensitive Compounds, 2ое видання; Редактори Shriver, D. F., Drezdzon, Wiley-Interscience, 1986. Застосовують субстехіометричні кількості каталізатора, як правило, від 0,0001 еквівалента до 0,1 еквівалента. Додаткові кількості ліганду можуть бути необов'язково додані для збільшення стійкості каталізатора і його дії. Додатково, добавки, такі як Na2CO3, K2CO3, KF, CsF і NaF, як правило, додають до реакції зв'язування. Реакція зв'язування, як правило, вимагає від 1 до 5 еквівалентів такої добавки, переважно від 1 до 2 еквівалентів. Вода може бути необов'язково додана до реакції зв'язування для збільшення розчинності цих добавок. Реакція зв'язування, як правило, вимагає від 1 до 3 еквівалентів арильної, алкільної або алкенільної металевої сполуки, переважно від 1 до 1,5 еквівалентів. Реакцію проводять в інертному розчиннику, такому як толуол, тетрагідрофуран (ТГФ), діоксан або ацетонітрил. Температура, при якій проводять реакцію, не є важливою, але, як правило, складає від 25 °C до 150 °C і переважно від 50 °C до 125 °C. Типова реакція, як правило, займає від 0,5 до 24 годин. Ніякого специфічного порядку додання реагентів, як правило, не потрібно. На практиці часто простіше об'єднувати всі реагенти крім каталізатора і потім видаляти кисень з реакційної суміші, в якій буде протікати реакція зв'язування. Після видалення кисню може бути доданий каталізатор для ініціювання реакції зв'язування. Коли Met частина арильної, алкільної або алкенільної металевої сполуки являє собою Znгалогенід, Zn-R або мідь, може бути необхідним захист реакційноздатних функціональних груп. Наприклад, якщо присутній аміно-замісник (-NHR або -NH2), може бути необхідним захист цих реакційноздатних груп. В галузі техніки відома множина груп для захисту аміногруп від реакції з металоорганічними реагентами. Приклади таких блокуючих груп описані в Protective Groups in Organic Synthesis, 3е видання; Редактори Greene, Wuts, P. G. M.; Wiley-Interscience, 1999. Вибір застосовуваного металу в R-Met залежить від багатьох чинників, таких як вартість, стійкість, реакційна здатність і необхідність в захисті реакційноздатних функціональних груп. Продукти, отримані будь-яким з цих способів, можуть бути регенеровані звичайними способами, такими як випарювання або екстракція, і можуть бути очищені стандартними способами, такими як перекристалізація або хроматографія. Наступні приклади представлені для ілюстрації даного винаходу. Приклади Отримання вихідної речовини Приклад А. Пропан-2-іл 4,5,6-трихлорпіколінат 10 UA 109697 C2 5 10 15 20 25 30 35 40 45 50 Метил 4,5,6-трихлорпіколінат (14,19 грамів (г), 59,0 мілімоль (ммоль)) суспендували в 2пропанолі (150 мілілітрів (мл)) в круглодонній колбі об'ємом 250 мл, обладнаній пасткою ДінаСтарка і зворотним холодильником. Додавали сірчану кислоту (98 % H2SO4; 8,07 г, 82 ммоль), і реакційну суміш нагрівали із зворотним холодильником. Через 20 годин (год.) нагрівання із зворотним холодильником, більша частина 2-пропанолу (100 мл) відганялася в першу фракцію дистиляту. Вміст резервуара тверднув при охолоджуванні до кімнатної температури. Отриману тверду речовину перемішували з етилацетатом (EtOAc; 500 мл) і насиченим (насич.) водним (водн.) розчином гідрокарбонату натрію (NaHCO 3; 500 мл). Органічний шар відділяли, промивали сольовим розчином і потім фільтрували через целіт. Органічний екстракт концентрували до 150 мл на роторному випарнику. Додавали гексан (100 мл), і розчин залишали при -20 °C протягом ночі. Кристали збирали, промивали гексаном і висушували на повітрі (7,58 г, температура плавлення 10,6-105,7 °C). Другий продукт отримували шляхом 1 концентрації фільтрату з отриманням загалом 10,36 г (65 %) H ЯМР (400 МГц, ДМСО-d6) δ 8,23 13 1 (с, 1H, піридин H), 5,16 (септет, J=6,3 Гц, 1H, CHMe2), 1,34 (д, J=6,3 Гц, 6H, CHMe2); C{ H} ЯМР (101 МГц, CDCl3) δ 161,9 (CO2R), 150,6, 145,9, 145,0, 133,1, 125,4 (C3), 70,7 (CHMe2), 21,7 (Me), Аналітично розраховано для C9H8Cl3NO2: C, 40,26; H, 3,00; N, 5,22, Знайдено: C, 40,25; H, 3,02; N, 5,22. Приклад В. Бензил 4,5,6-трихлорпіколінат Суміш метил 4,5,6-трихлорпіколінату (25 г, 0,10 моль (моль)) і бензилового спирту (100 г, 0,2 моль) в трьохгорлій круглодонній колбі об'ємом 250 мл нагрівали в атмосфері азоту до 100 °C. Додавали ізопропілат титана (0,6 г, 0,02 моль). Через 4 год. при 100 °C майже безбарвний розчин охолоджували і переносили в одногорлову круглодонную колбу об'ємом 250 мл. Надлишок бензилового спирту видаляли під вакуумом з отриманням майже білої твердої 1 речовини (31 г, 94 %): температура плавлення 125-126,5 °C; H ЯМР (400 МГц, CDCl3) δ 8,08 (с, 13 1 1H, піридин H), 7,42 (м, 2H, феніл), 7,31 (м, 3H, феніл), 5,40 (с, 2H, CH2Ph); C{ H} ЯМР (101 МГц, CDCl3) δ 162,0 (CO2R), 150,4, 145,0, 144,9, 134,7, 133,1, 128,3 (феніл CH), 125,4 (піридин CH), 67,88 (СH2Ph). Приклад С. Бензил 4,5,6-трихлорпіколінат Круглодонна колба на 22 л була оснащена термопарою, механічною мішалкою і пасткою Діна-Старка, зв'язаною з азотним барботером. Посудину продували азотом і потім додавали 4,5,6-трихлорпіколінат (2547 г, 10,07 моль), п-толуолсульфонату піридинію (PPTS; 130 г, 0,52 моль), бензиловий спирт (2249 г, 20,8 моль) і ксилоли (10278 г). Починали перемішування, і резервуар нагрівали до 140-145 °C. Азеотропну суміш ксилоли/вода збирали в пастці ДінаСтарка протягом 5 год. Загальна кількість дистиляту становила 4750 г (415 г складала вода). Після того як вода припиняла переходити в першу фракцію дистиляту, з реактора відбирали зразок і аналізували високоефективною рідинною хроматографією (ВЕРХ), щоб гарантувати залишок вихідної карбонової кислоти менше 1,5 % площі хроматограми. Реакційну суміш залишали охолоджуватися до кімнатної температури і перемішували протягом ночі. Ксилоли (4000 г) видаляли перегонкою під вакуумом. Розчин охолоджували до 85-100 °C, і потім вакуумно переносили в посудину з сорочкою для кристалізації об'ємом 30 л, оснащену механічною мішалкою і термопарою. Вакуум наповнювали азотом, і азотний барботер вміщували на посудину для кристалізації. Протягом 15 хвилин (хв.) до розчину кслилолу додавали ізопропіловий спирт (IPA; 6200 г). Отриманій суспензії дозволяли повільно охолодитися до кімнатної температури і потім охолоджували додатково до 5 °C. Тверду речовину збирали шляхом фільтрації, і фільтрувальний осад промивали холодним (5-10 °C) IPA (3731 г). Тверду речовину висушували на повітрі до постійної маси з отриманням білих кристалів (2765 г, газова хроматографія (ГХ) внутрішній стандарт чистоти 96,5 %, 84,3 %). Обмін фтором 11 UA 109697 C2 Приклад 1a. Пропан-2-іл 4,5,6-трифторпіколінат 5 10 15 20 25 3035 40 45 Трьохгорла колба об'ємом 250 мл була обладнана механічною мішалкою, пасткою ДінаСтарка з входом для азоту і термопарою. Колбу продували азотом і додавали CsF (23,38 г, 154 ммоль). Додавали безводний ДМСО (124 мл), і атмосферу над суспензією розряджали за допомогою вакуумного насоса/заповнювали (5×) азотом. Суспензію нагрівали при 80 °C протягом 30 хвилин. ДМСО (20 мл) відганяли під вакуумом при 75 °C для видалення будь-якої залишкової води. Додавали пропан-2-ілу 4,5,6-трихлорпіколінат (13,45 г, 50,1 ммоль) на фоні продування азотом. Атмосферу над реакційною сумішшю розряджали за допомогою вакуумного насоса/заповнювали (3×) азотом і нагрівали при 100 °C протягом 1 год. при енергійному перемішуванням. Друга трьохгорла колба об'ємом 250 мл була обладнана механічною мішалкою, пасткою Діна-Старка з входом для азоту і термопарою. Колбу продували азотом і додавали CsF (24,41 г, 0,160 ммоль). Додавали безводний ДМСО (30 мл), і атмосферу над суспензією розряджали за допомогою вакуумного насоса/заповнювали (5×) азотом. Суспензію нагрівали при 80 °C протягом 30 хвилин. ДМСО (22 мл) відганяли під вакуумом при 75 °C для видалення залишкової води. Охолоджену реакційну суміш з першої колби фільтрували через канюлю у другу колбу в атмосфері азоту. Атмосферу над реакційною сумішшю розряджали за допомогою вакуумного насоса/заповнювали азотом (5×) і потім нагрівали при 100 °C протягом 1 год. і потім протягом ще 90 хвилин при 110 °C. ГХ аліквоту зразка аналізували за допомогою ГХ показала присутність 96 % пропан-2-іл 4,5,6-трифторпіколінату з домішкою тільки 1,4 % пропан-2-іл 5-хлор-4,6дифторпіколінату. Розчин неочищеного продукту застосовували безпосередньо на стадії амінування без додаткового очищення. Альтернативно, продукт може бути виділений шляхом обробки водою, екстракцією за допомогою EtOAc і висушуванням з отриманням світлого жовто1 коричневого масла: H ЯМР (400 МГц, CDCl3) δ 7,94 (дд, JF-H=4,5, 8,7 Гц, 1H, H3), 5,30 (септет, 13 1 JH-H=6,3 Гц, 1H, CHMe2), 1,44 (д, JΗ-Η=6,3 Гц, 6H, CHMe2); C { H} ЯМР (101 МГц, CDCl3) δ 161,2 (с, CO2iPr), 157,3 (ддд, JF-C=266, 8, 6 Гц, C4/C6), 152,2 (ддд, JF-C=241, 12, 5 Гц, C4/C6), 141,1 (дт, JF-C=14, 7 Гц, C2), 137,0 (ддд, JF-C=270, 31, 13 Гц, C5), 113,8 (дд, JF-C=17, 4 Гц, C3), 70,4 (с, 19 CHMe2), 21,33 (с, ME); F ЯМР (376 МГц, CDCl3) δ -74,29 (дд, JF-F=24, 22 Гц, F6), -112,67 (ддд, JFF=22, 19, JF-H=8,3 Гц, F4), -151,58 (ддд, JF-F=24, 19, JF-H=4,7 Гц, F5). Приклад 1b. Пропан-2-іл 4,5-дифтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат Трьохгорла колба об'ємом 250 мл була обладнана дефлегматором, входом для азоту, механічною мішалкою і термопарою. Колбу заповнювали CsF (14,2 г, 93,0 ммоль), додавали безводний ДМСО (80 мл), і атмосферу над суспензією розряджали за допомогою вакуумного насоса/заповнювали (5×) азотом. Суспензію нагрівали при 80 °C протягом 30 хвилин. ДМСО (20 мл) відганяли під вакуумом для видалення будь-якої залишкової води. Додавали твердий пропан-2-ілу 4,5-дихлор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат (10,44 г, 26,6 ммоль), і атмосферу над розчином розряджали за допомогою вакуумного насоса/заповнювали (5×) азотом. Реакційну суміш нагрівали до 105 °C в атмосфері азоту. Через 4 год. при 105 °C ГХ аналіз аліквоти зразка показав відношення 91:6 дифторзаміщених до монофторзаміщених продуктів. Реакційну суміш залишали охолоджуватися до кімнатної температури. Друга трьохгорла колба об'ємом 250 мл була обладнана механічною мішалкою, дефлегматором з входом для азоту і термопарою. Колбу продували азотом і додавали CsF (7,5 г, 49,4 ммоль). Додавали безводний ДМСО (20 мл), і атмосферу над суспензією розряджали за допомогою вакуумного насоса/заповнювали (5×) азотом. Суспензію нагрівали при 80 °C 12 UA 109697 C2 5 10 15 20 25 30 35 40 45 протягом 30 хвилин. ДМСО (15 мл) відганяли під вакуумом для видалення залишкової води. Охолоджену реакційну суміш з першої колби фільтрували через канюлю у другу колбу в атмосфері азоту. Атмосферу над реакційною сумішшю розряджали за допомогою вакуумного насоса/заповнювали азотом (5×) і потім нагрівали при 100 °C протягом 2 год. ГХ аналіз аліквоти зразка показав відношення 93:2 бажаного продукту до монофторозаміщеного проміжного продукту. Реакційну суміш виливали у воду з льодом (550 г) і екстрагували за допомогою EtOAc (3×200 мл). Об'єднані органічні екстракти промивали водою (5×100 мл) і сольовим розчином, висушували над сульфатом магнію (MgSO4) і концентрували при зниженому тиску з отриманням коричневого масла (8,57 г), яке кристалізувалося при відстоюванні. Тверду речовину очищали хроматографією на силікагелі (330 г колонка з силікагелем; градієнт EtOAc-гексан 0-50 %) з 1 отриманням білої твердої речовини (4,98 г, 52 %): температура плавлення 98,4-100,0 °C; H ЯМР (400 МГц, ацетон-d6) δ 8,16 (дд, JF-H=10,0, 5,6 Гц, 1H, піридин H), 7,43 (м, 2H, феніл), 5,24 (гептет, JH-H=6,3 Гц, 1H, CHMe2), 4,01 (д, JF-H=1,1 Гц, 3H, OMe), 1,37 (д, JH-H=6,3 Гц, 6H, CHMe2); 13 1 С{ H} ЯМР (101 МГц, ацетон-d6) δ 163,1 (CO2R), 157,1 (дд, JF-C=264, 12 Гц, C4/C5), 154,8 (д, JFC=254 Гц, C2' феніл), 148,6 (дд, JF-C=267, 11 Гц, C4/C5), 147,4 (т, JF-C=6 Гц), 145,5 (д, JF-C=13 Гц), 144,6 (д, JF-C=13 Гц), 131,0, 126,8, 126,6 (д, JF-C=3,7 Гц), 123,2, 115,8 (д, JF-C=16 Гц), 70,6 19 (CHMe2), 62,1 (д, JF-C=4 Гц, OMe), 21,9 (CHMe2); F ЯМР (376 МГц, CDCl3) δ -124,82 (дд, JF-F=21 Гц, JF-H=9,9 Гц, F4), -129,45 (дд, JF-F=27,8 Гц, JF-H=6,9 Гц, фенил F), -141,81 (м, F5). Аналітично розраховано для C16H13ClF3NO3: C, 53,42; H, 3,64; N, 3,89. Знайдено: C, 53,77; H, 3,70; N, 3,95. ГХ аналіз аліквоти зразка показав, що продукт був на 95,5 % чистим з домішкою 1,7 % монофторозаміщеного продукту. Приклад 1c. Бензил 4,5-дифтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат Трьохгорла колба об'ємом 250 мл була обладнана дефлегматором, входом для азоту, механічною мішалкою і термопарою. Колбу заповнювали CsF (21,07 г, 139,0 ммоль). Додавали безводний ДМСО (100 мл), і атмосферу над суспензією розряджали за допомогою вакуумного насоса/заповнювали (5×) азотом. Суспензію нагрівали при 80 °C протягом 30 хвилин. ДМСО (30 мл) відганяли під вакуумом для видалення будь-якої залишкової води. Додавали твердий бензил 4,5-дихлор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат (15,34 г, 34,8 ммоль), і атмосферу над розчином розряджали за допомогою вакуумного насоса/заповнювали азотом (5×). Реакційну суміш нагрівали до 105 °C в атмосфері азоту. Через 6 год. при 105 °C ГХ аналіз аліквоти зразка показав відсутність піка монофторозаміщеного проміжного продукту на хроматограмі. Реакційну суміш залишали охолоджуватися до кімнатної температури. Реакційну суміш виливали у воду з льодом (400 г) і екстрагували за допомогою EtOAc (3×200 мл). Об'єднані органічні екстракти промивали насич. розчином NaHCO 3, водою (5×100 мл) і сольовим розчином. Екстракти висушували (MgSO4) і концентрували при зниженому тиску з отриманням жовто-коричневої твердої речовини (12,97 г). Тверду речовину очищали за допомогою флеш-хроматографії (330 г колонка з силікагелем; EtOAc-градієнт 0-20 %) з 1 отриманням білої твердої речовини (9,95 г; 70 %): температура плавлення 114-116 °C; H ЯМР (400 МГц, CDCl3) δ 8,01 (дд, JF-H=9,4, 5,5 Гц, 1H, пиридин H), 7,53-7,20 (м, 7H, феніл), 5,44 (с, 2H, 13 CH2Ph), 3,99 (д, JF-H=1,2 Гц, 3H, OMe); C ЯМР (101 МГц, CDCl3) δ 162,8 (д, JF-C=3 Гц, CO2Bn, 156,2 (дд, JF-C=267, 12 Гц), 153,9 (д, JF-C=255 Гц), 148,0 (дд, JF-C=269, 11 Гц), 145,4 (т, JF-C=7 Гц), 144,7 (д, JF-C=13 Гц), 144,6 (дд, JF-C=13, 2 Гц), 135,2 (c), 130,6 (д, JF-C=3 Гц), 125,6 (д, JF-C=4 Гц), 125,4 (д, JF-C=2 Гц), 122,0 (д, JF-C=14 Гц), 115,0 (д, JF-C=16 Гц), 67,9 (с, CH2Ph), 61,6 (д, JF-C=5 Гц, 19 1 OMe); F{ H} ЯМР (376 МГц, CDCl3) δ -123,90 (д, JF-F=19,7 Гц, F4), -128,37 (д, JF-F=33,5 Гц, F2'), 139,64 (дд, JF-F=33,5, 19,7 Гц, F5). Аналітично розраховано для C20H13ClF3NO3: C, 58,91; H, 3,21; N, 3,43. Знайдено: C, 59,03; H, 3,20; N, 3,39. Приклад 1d. Бензил 4,5-дифтор-6-(4-хлор-2-фтор-3-метоксифеніл)піколінат 13 UA 109697 C2 5 10 15 20 25 30 35 Прямостінковий реактор об'ємом 22 л з сорочкою був оснащений верхньою мішалкою, конденсатором, входом для азоту і виходом, і отвором, що закривається пробкою, для завантаження твердих речовин. Реактор продували азотом протягом 2 днів. Отвір для завантаження відкривали, в реактор швидко завантажували бензил 4,5-дихлор-6-(4-хлор-2фтор-3-метоксифеніл)піколінат (2032 г, 4,12 моль, чистота 89,3 %). CsF (2500 г, 16,46 моль) швидко виливали в реактор. Потім реактор завантажували безводним (
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 4-amino-5-fluoro-3-halo-6-(substituted)picolinates
Автори англійськоюWhiteker, Gregory, T., Arndt, Kim, E., Renga, James, M., Zhu, Yuanming, Lowe, Christian, T., Siddall, Thomas, L., Podhorez, David, E., Roth, Gary, Alan, West, Scott, P.
Автори російськоюУайтекер Грегори Т., Арндт Ким Э., Ренга Джэймс М., Чжу Юаньмин, Лоу Кристиан Т., Сиддалл Томас Л., Подхорес Дэвид Э., Рот Гари Алан, Вест Скотт П.
МПК / Мітки
МПК: C07D 213/04, A01N 43/40
Мітки: 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів, спосіб, отримання
Код посилання
<a href="https://ua.patents.su/31-109697-sposib-otrimannya-4-amino-5-ftor-3-galogen-6-zamishhenikhpikolinativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання 4-аміно-5-фтор-3-галоген-6-(заміщених)піколінатів</a>
Попередній патент: Піразоли як антагоністи crth2
Наступний патент: Похідні азаіндазолу або діазаіндазолу як медикамент
Випадковий патент: Спосіб підготування сипучого матеріалу до пневмотранспортування по трубопроводу