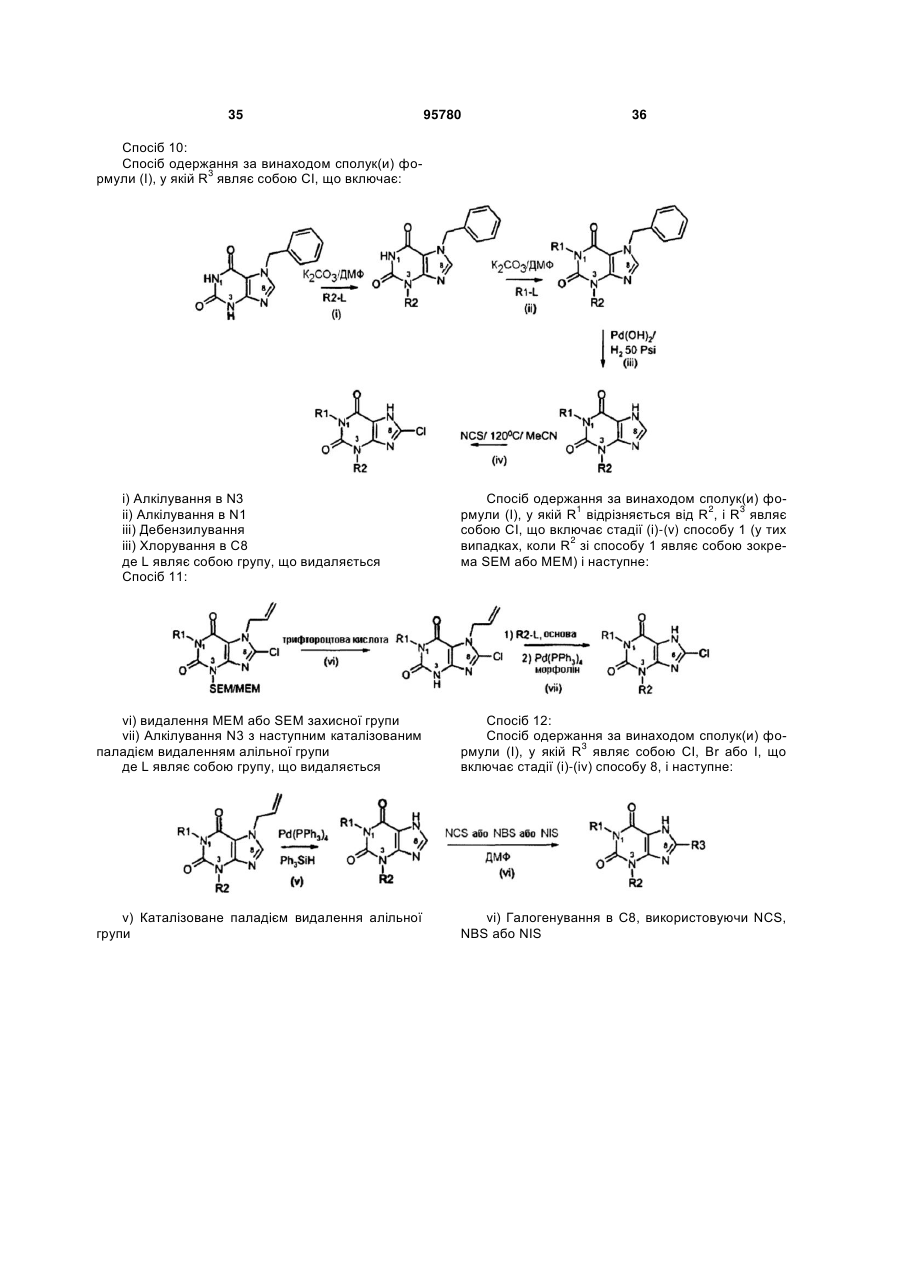
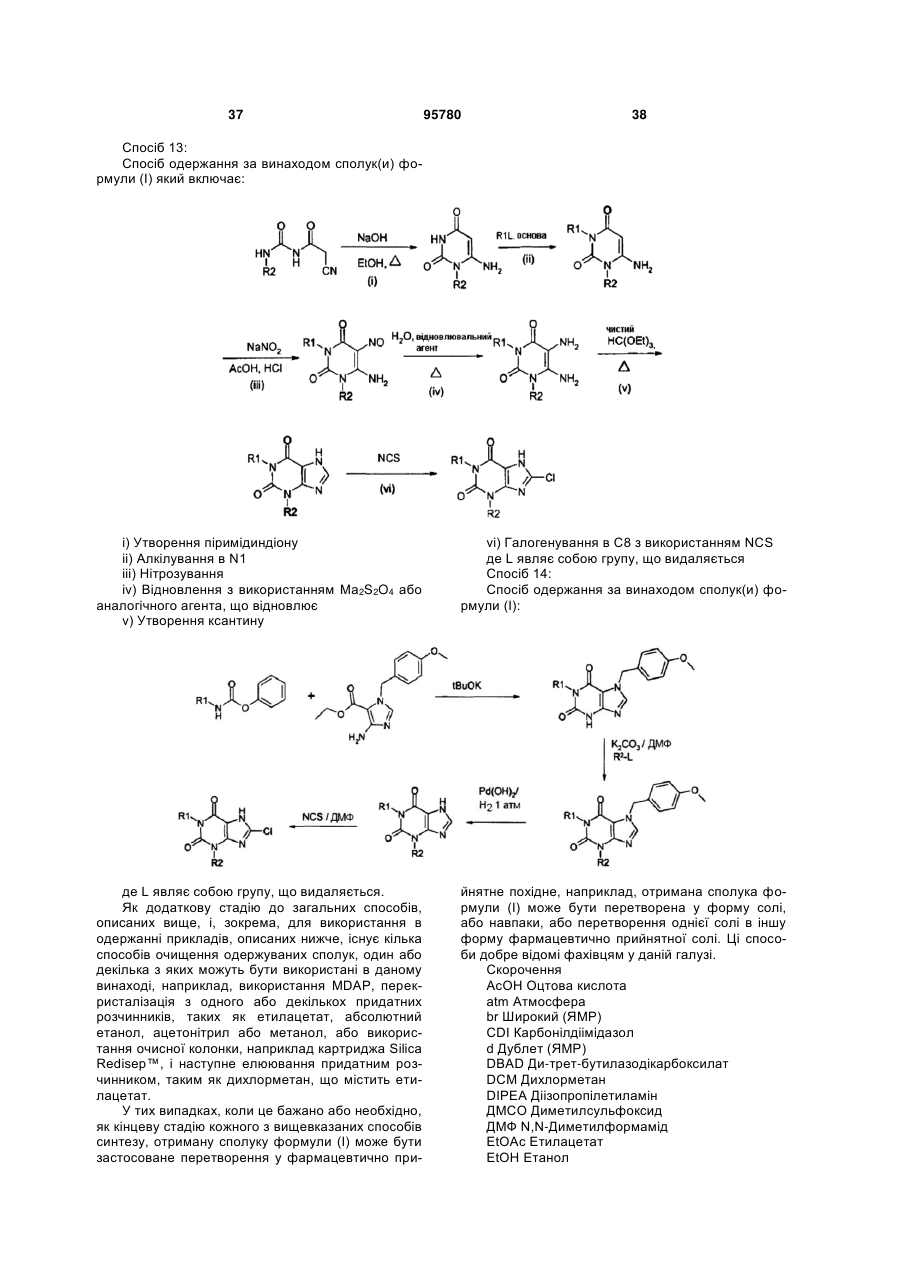
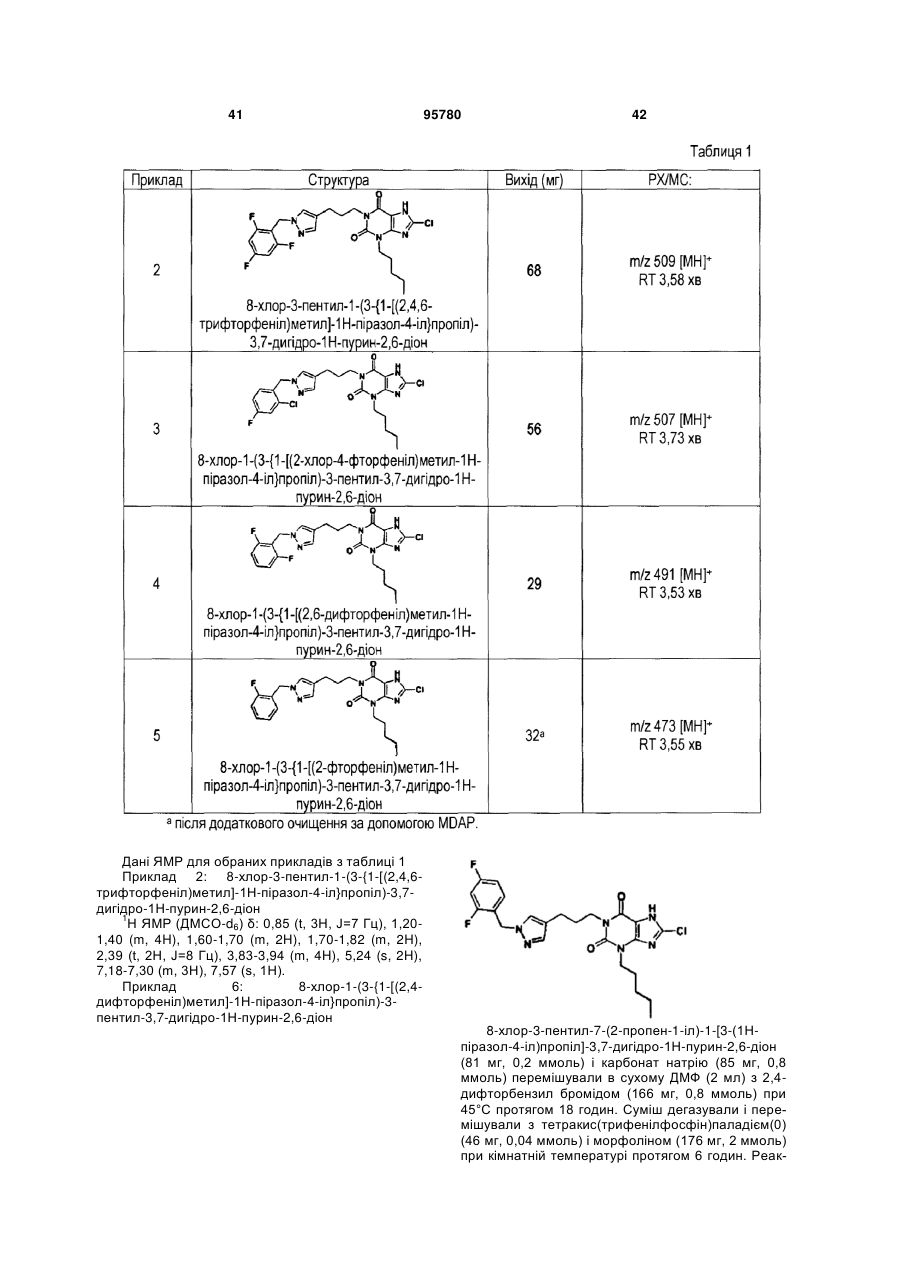
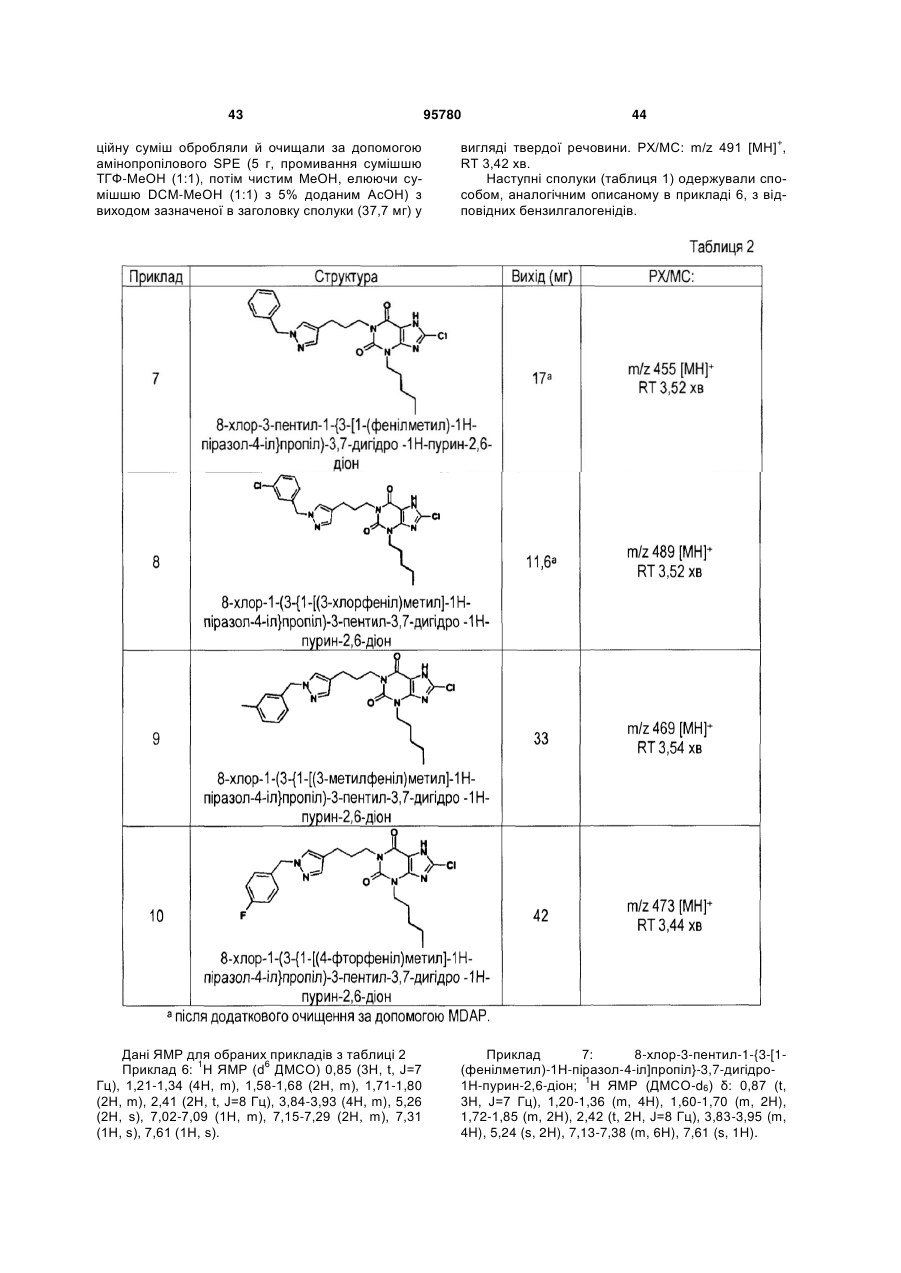
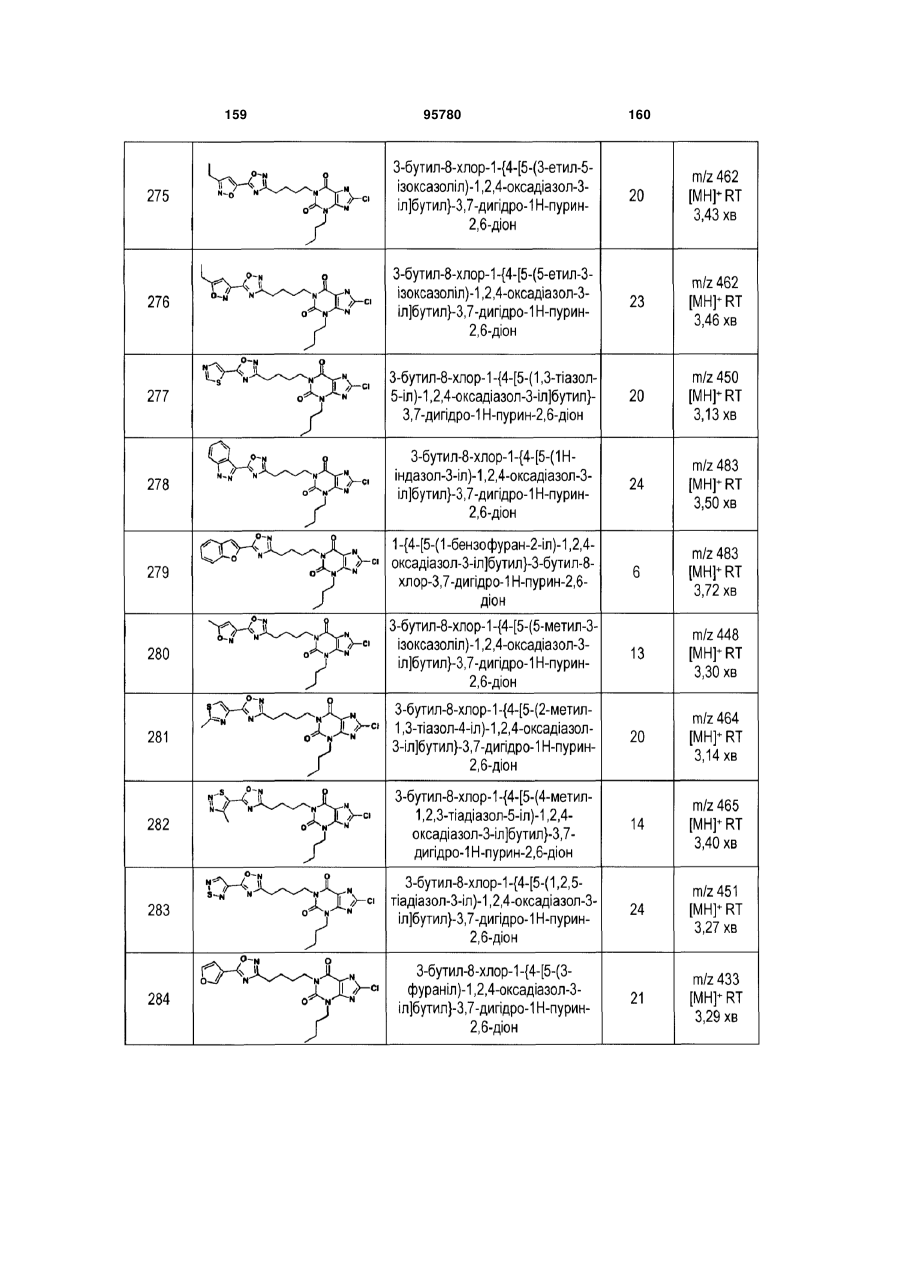
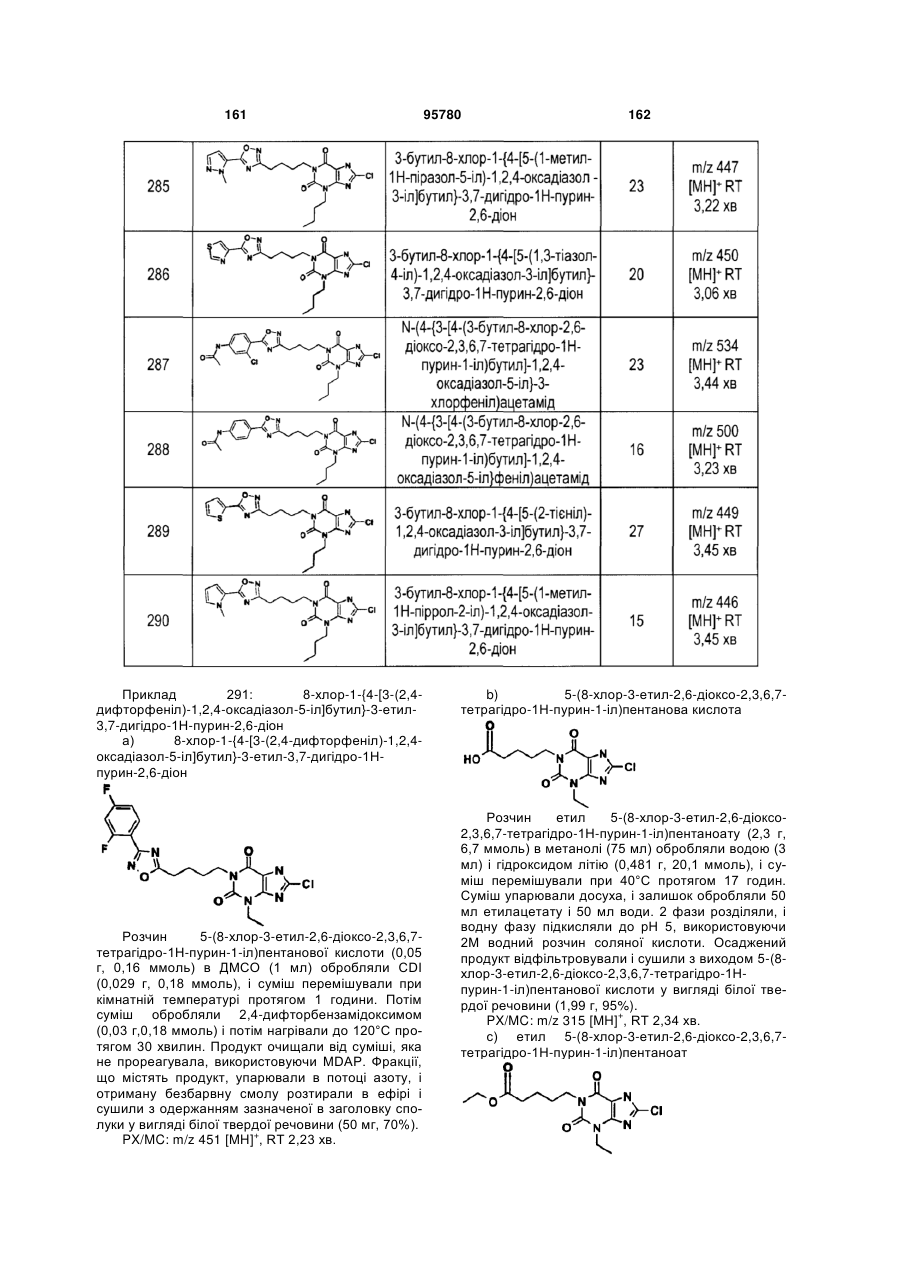
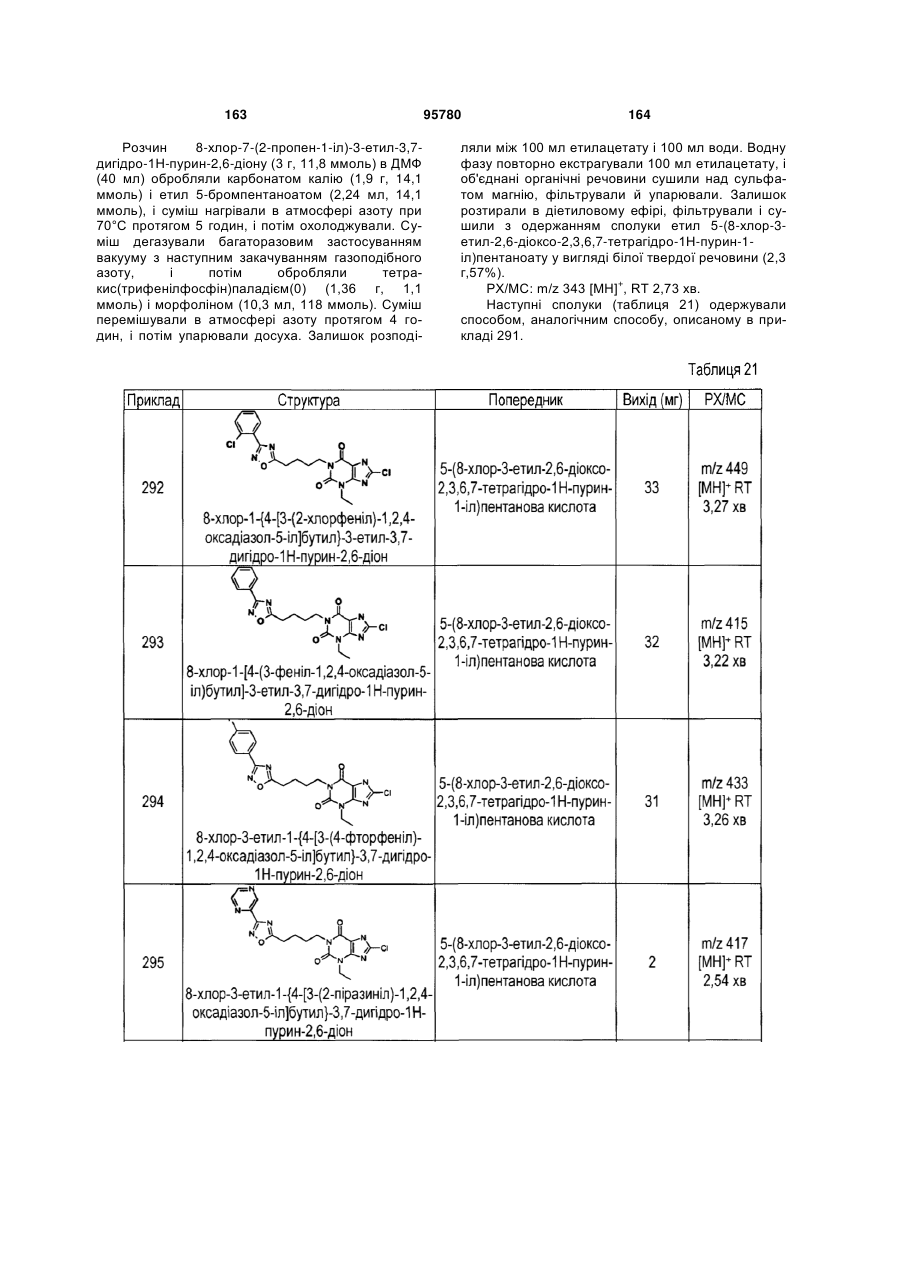
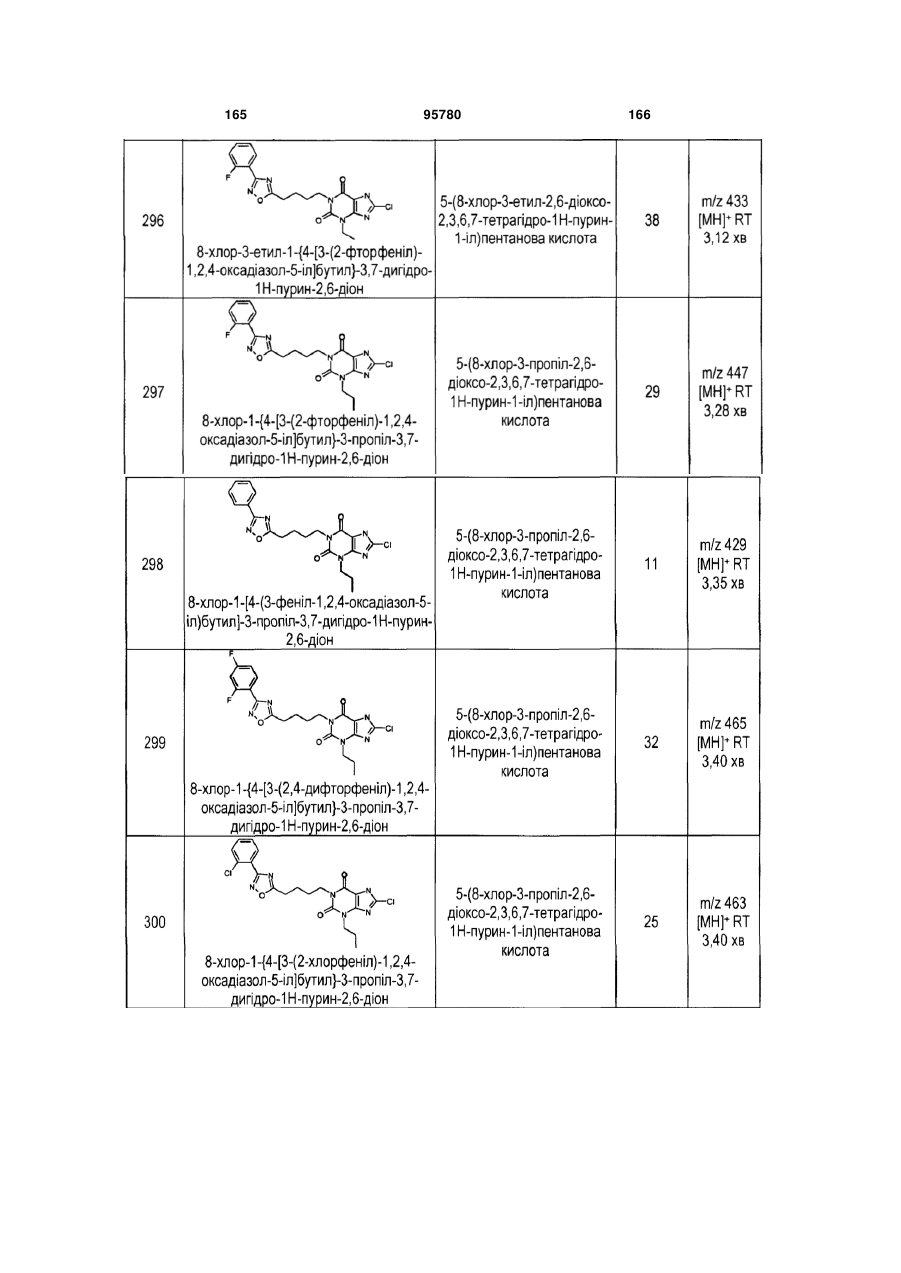
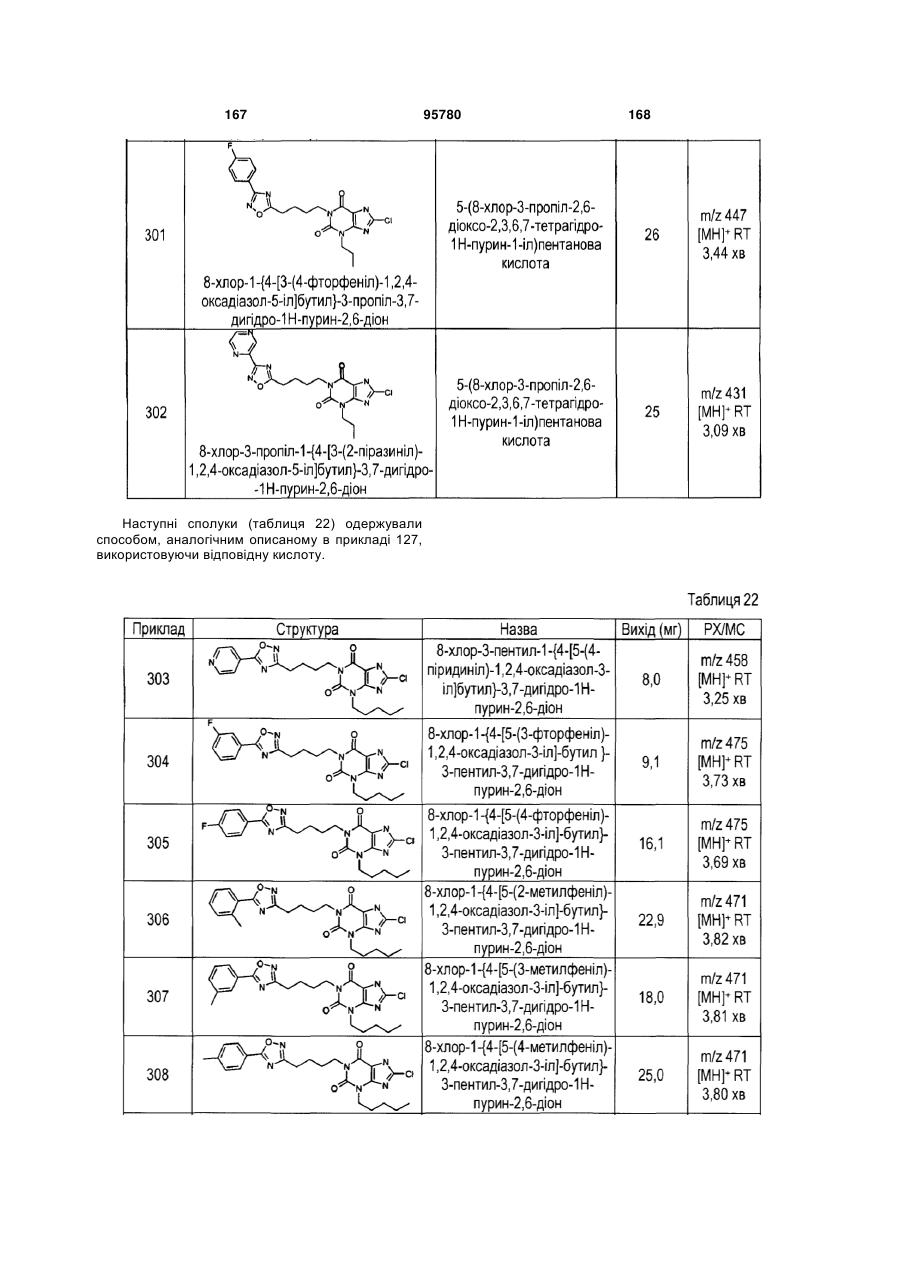
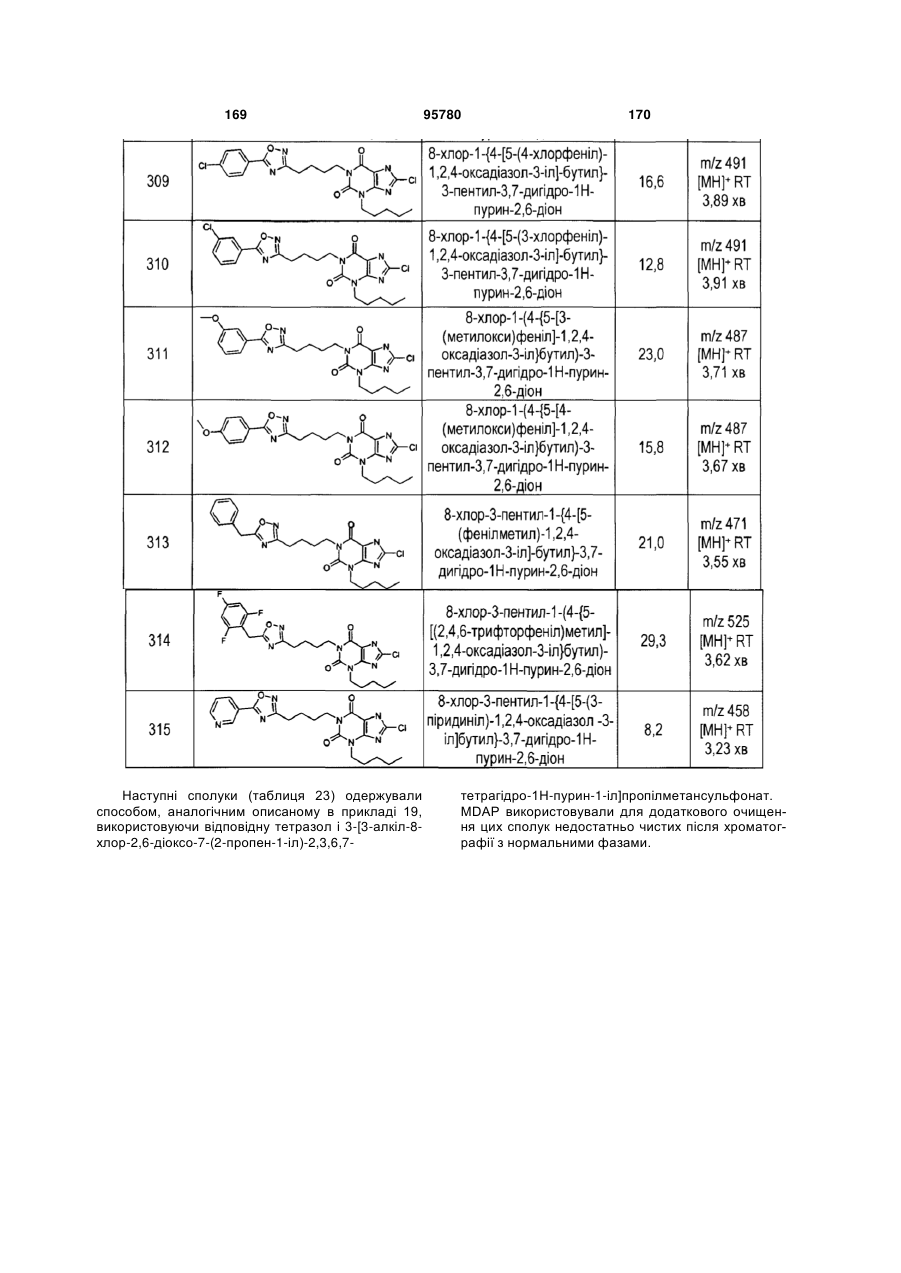
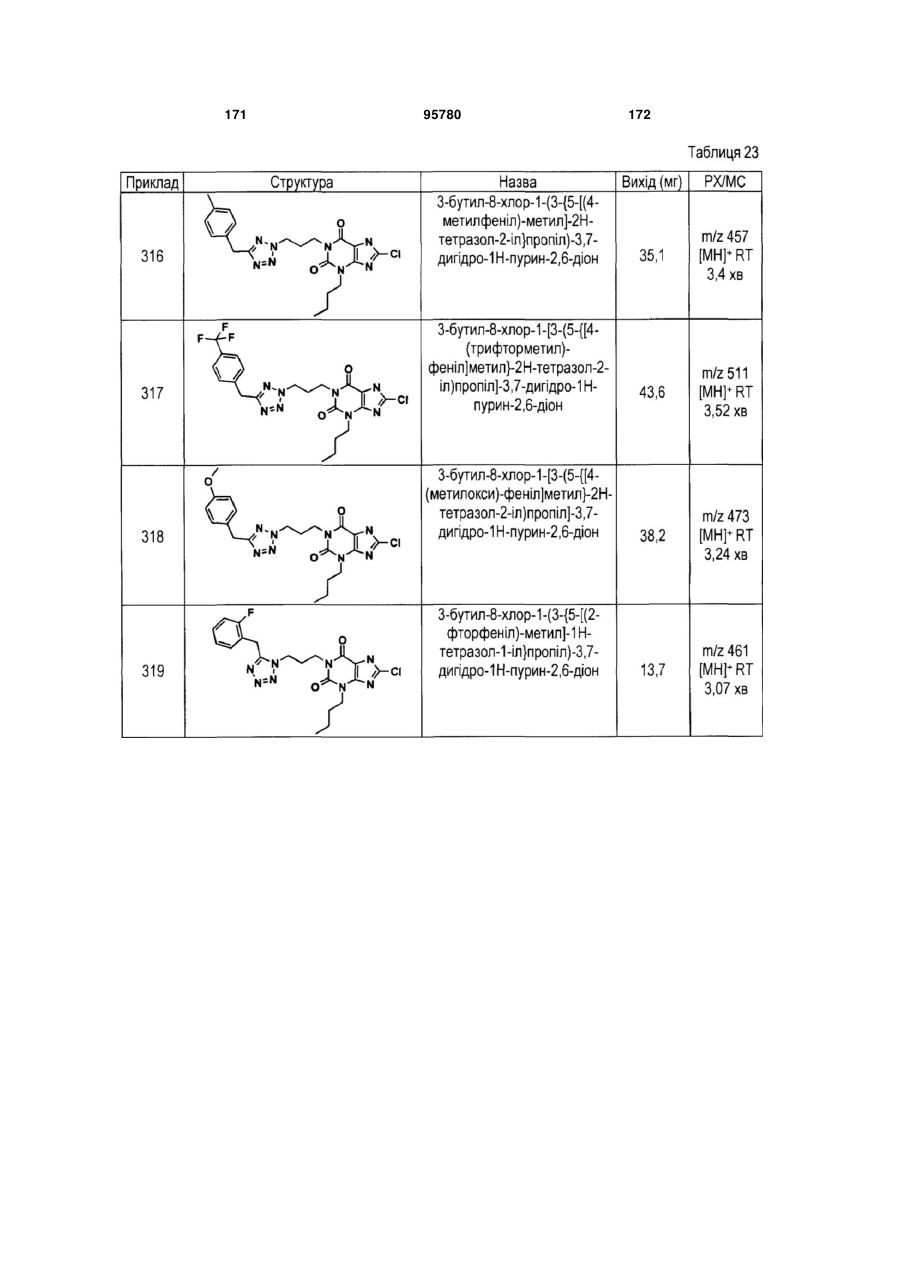
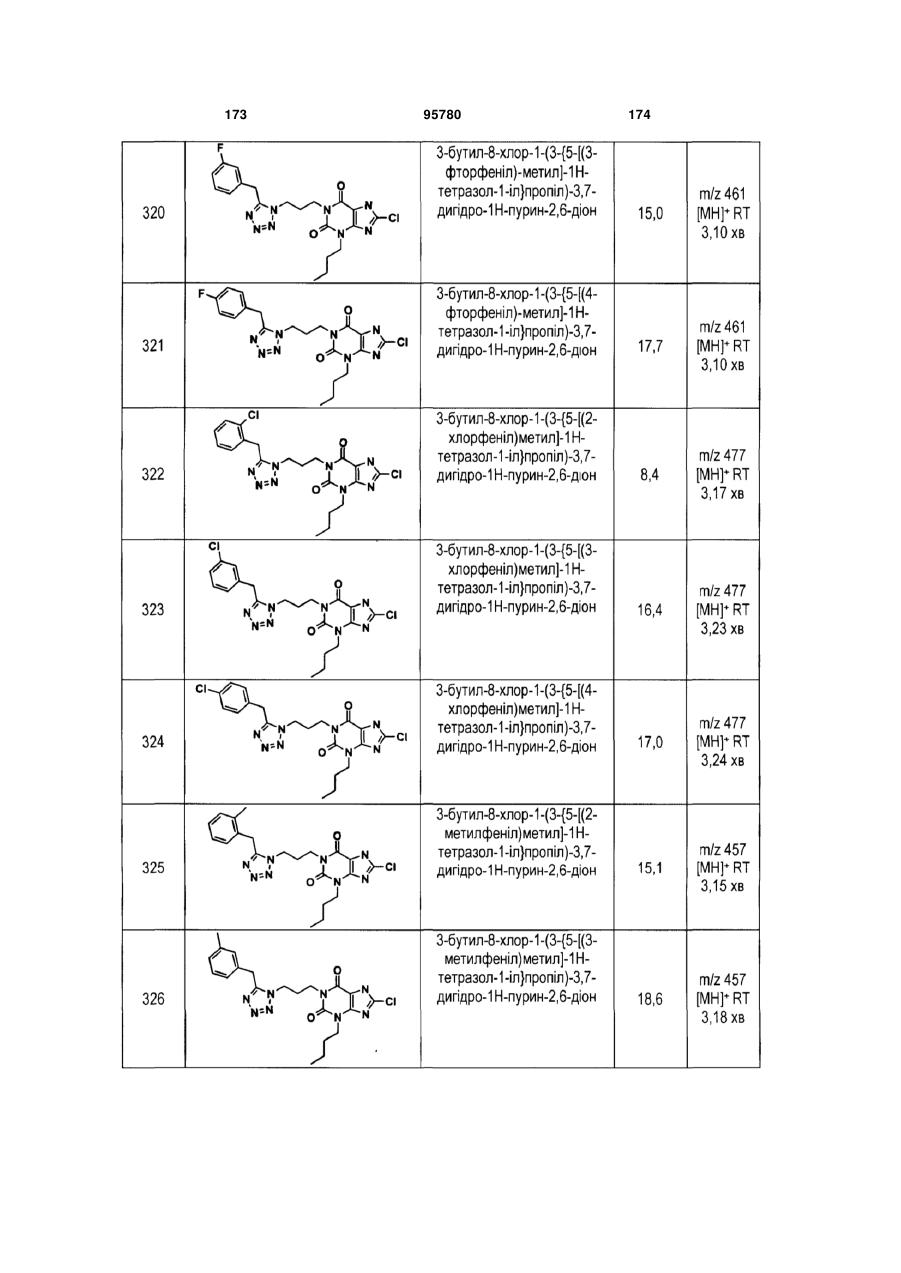
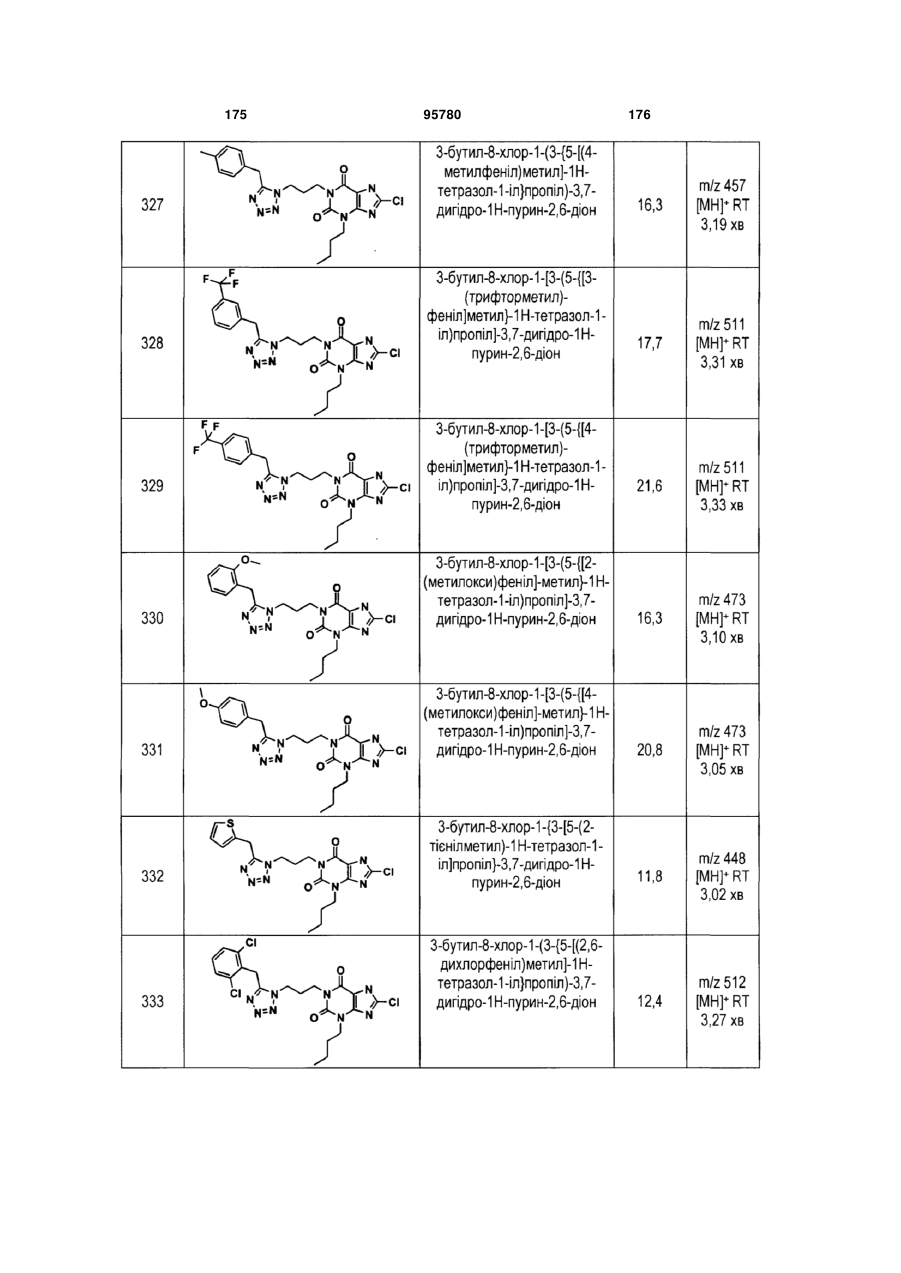
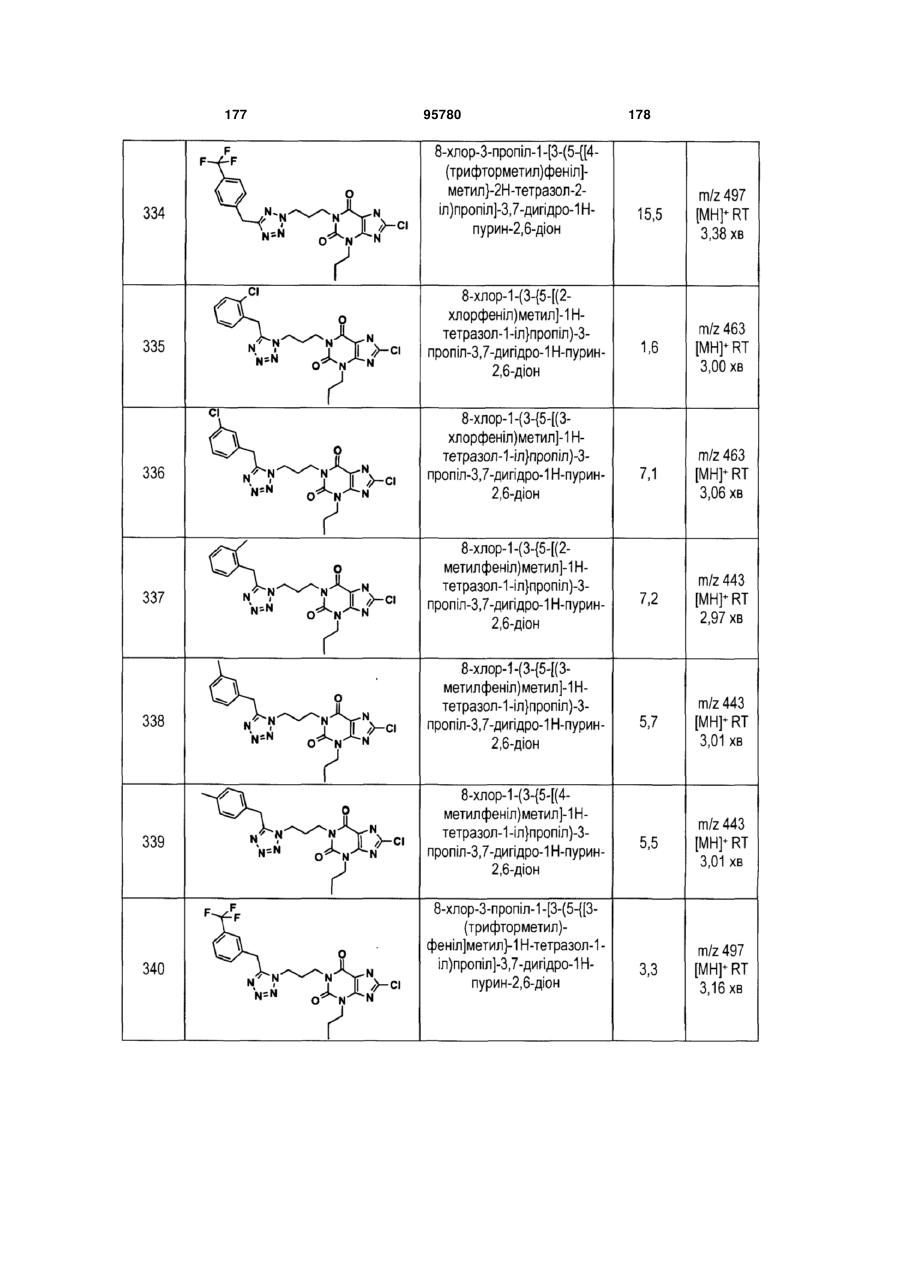
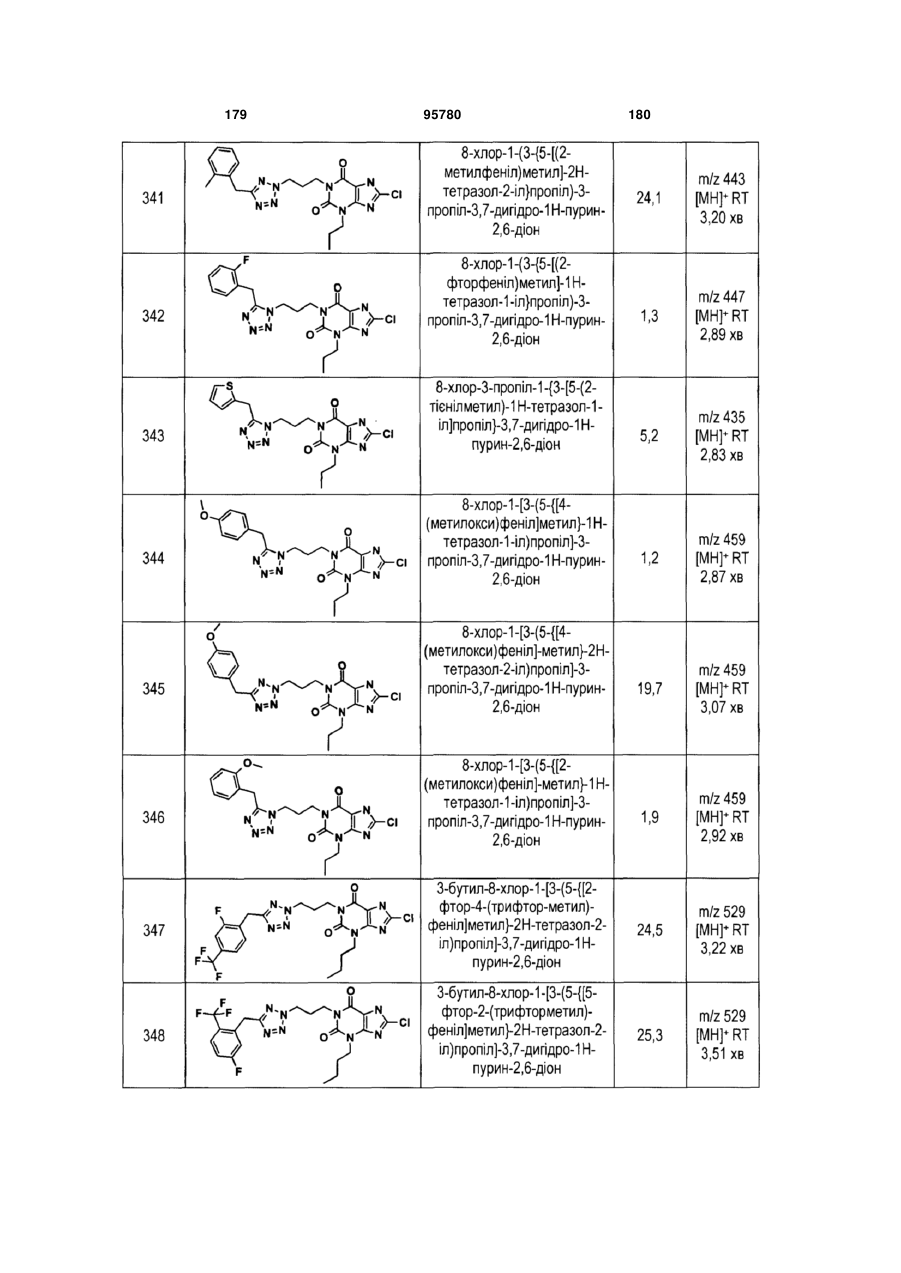
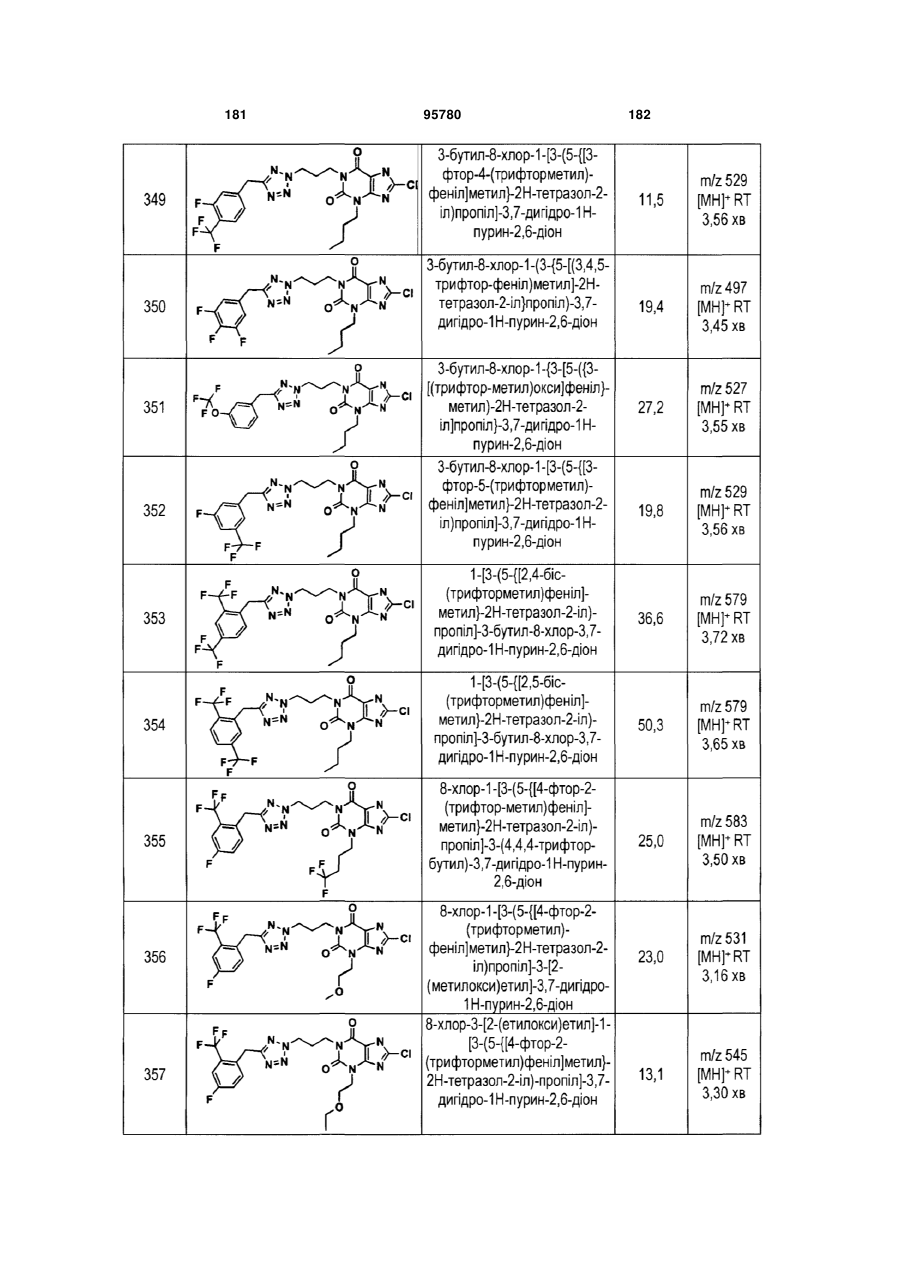
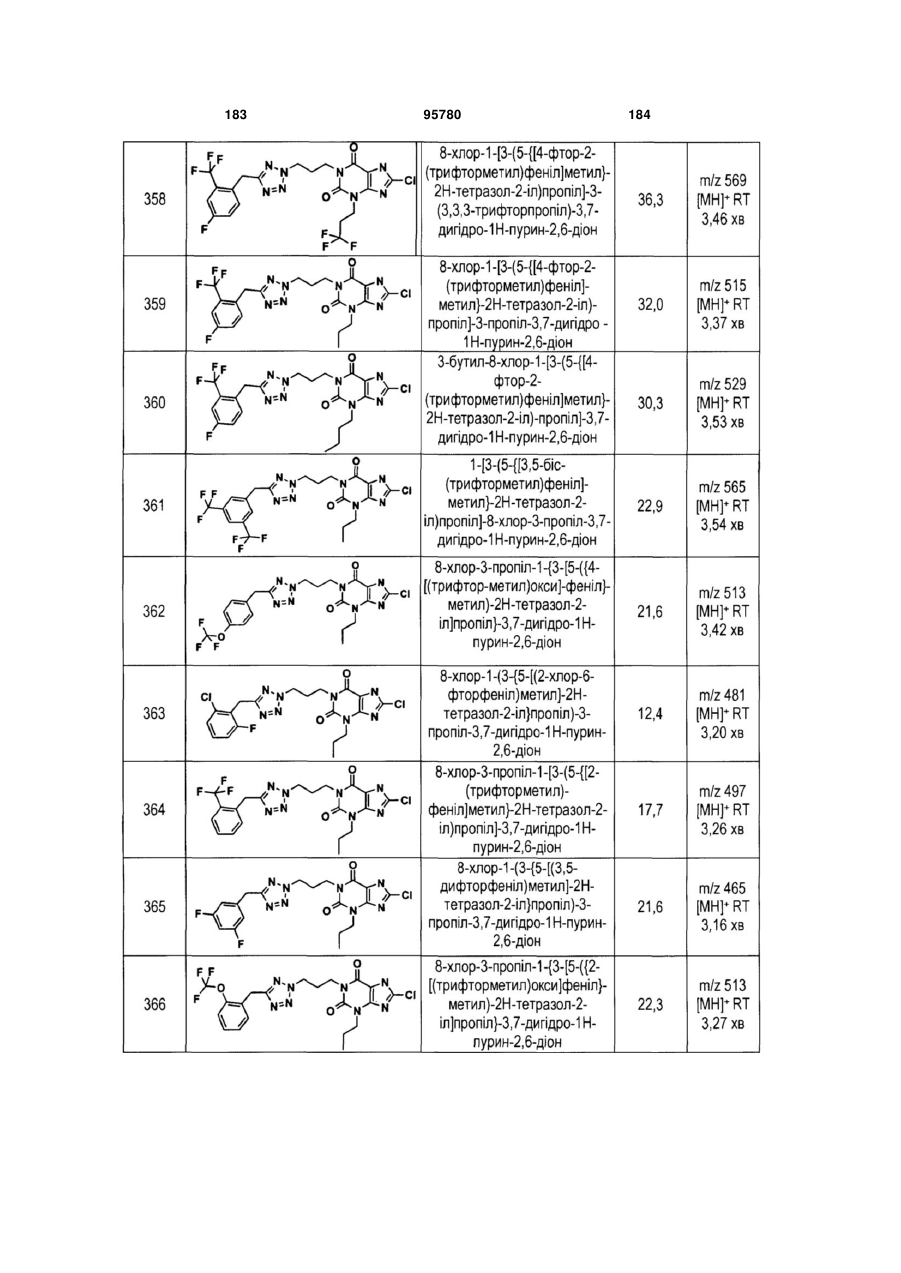
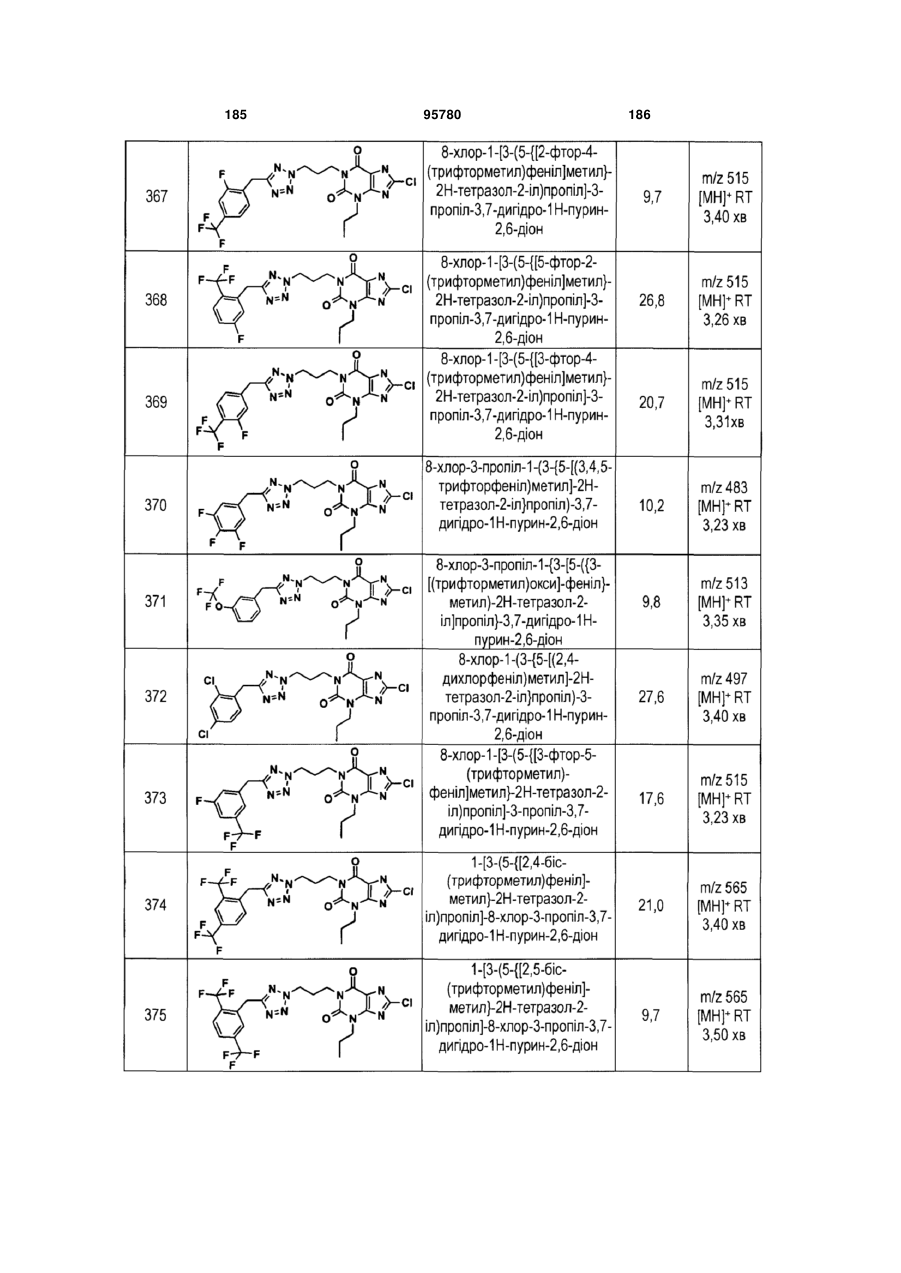
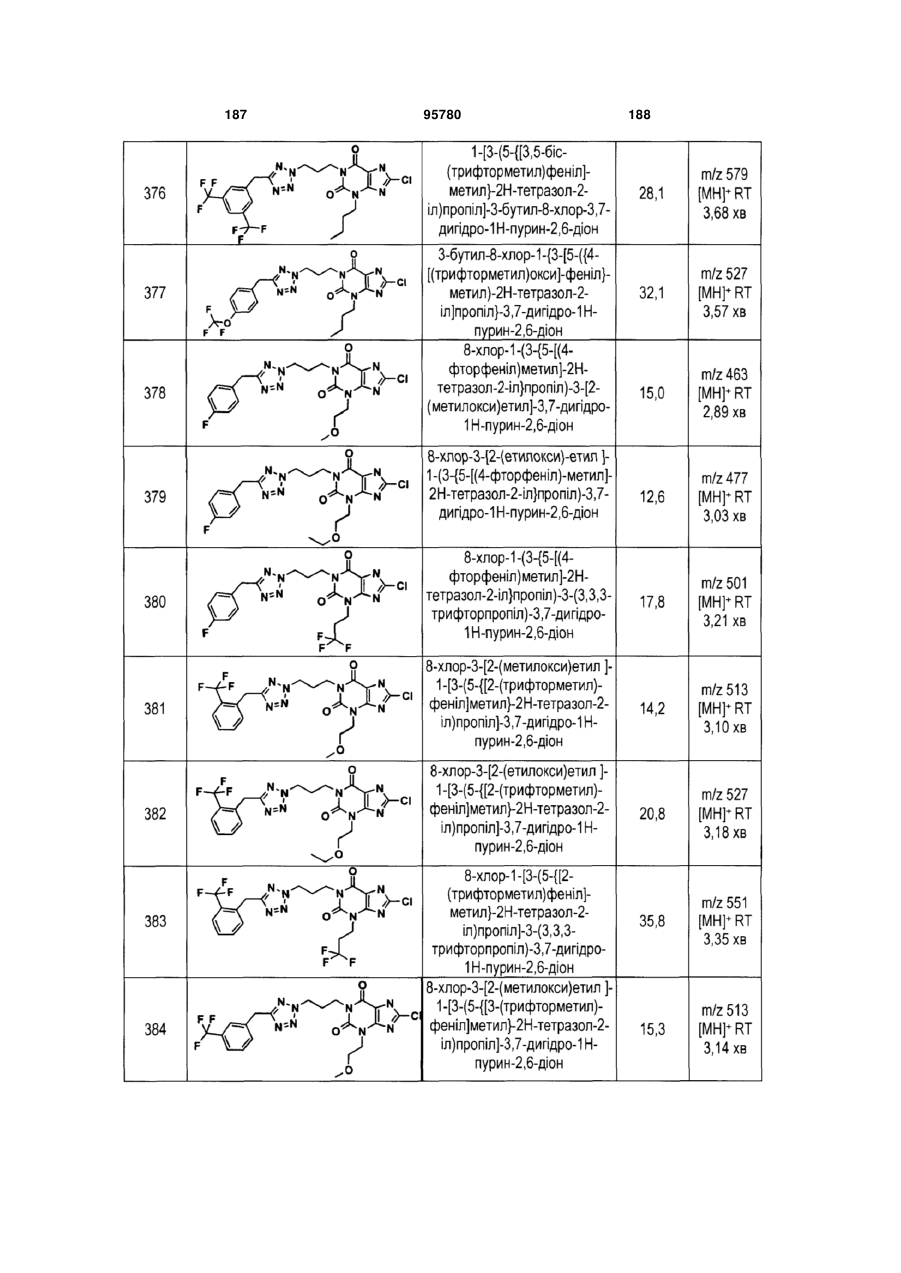
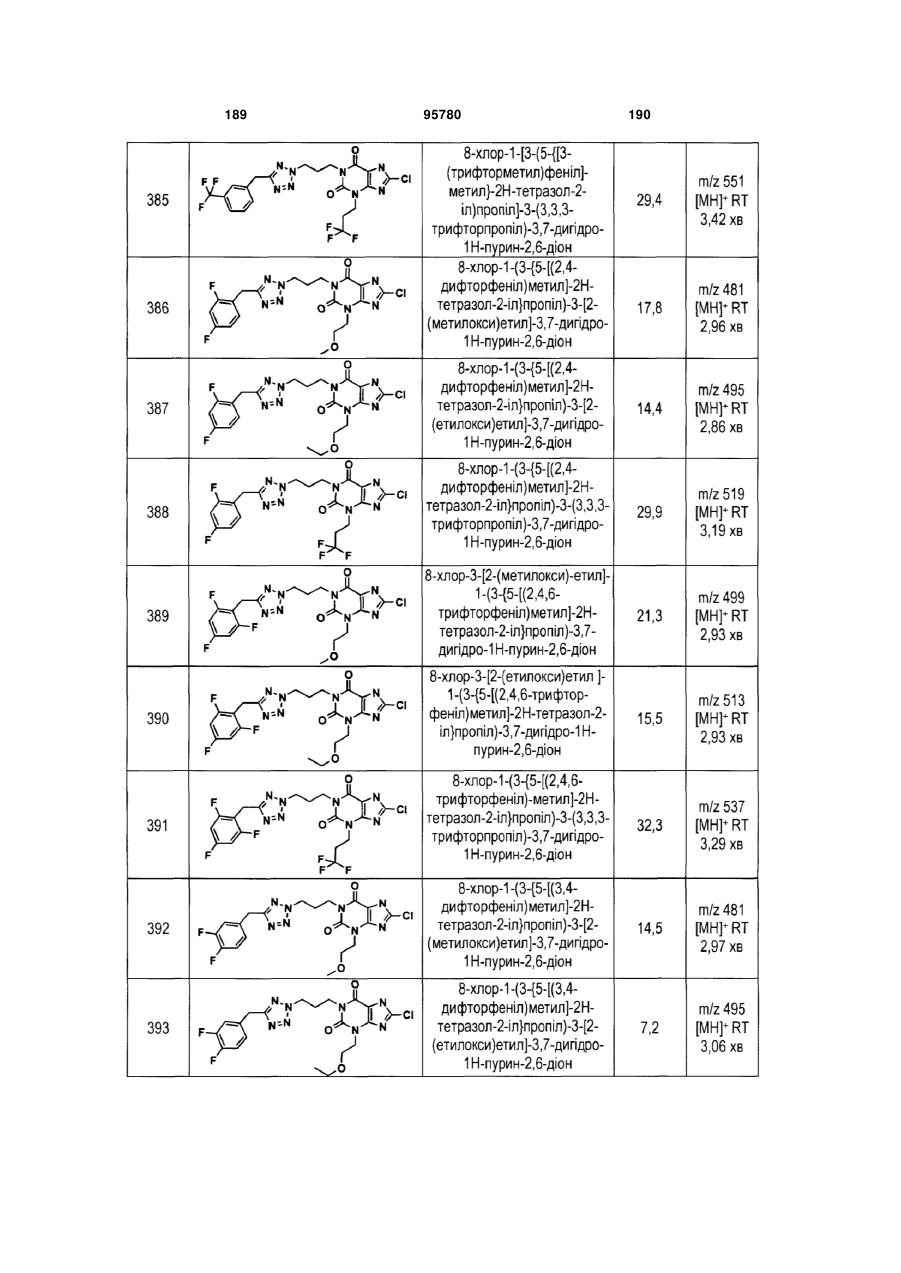
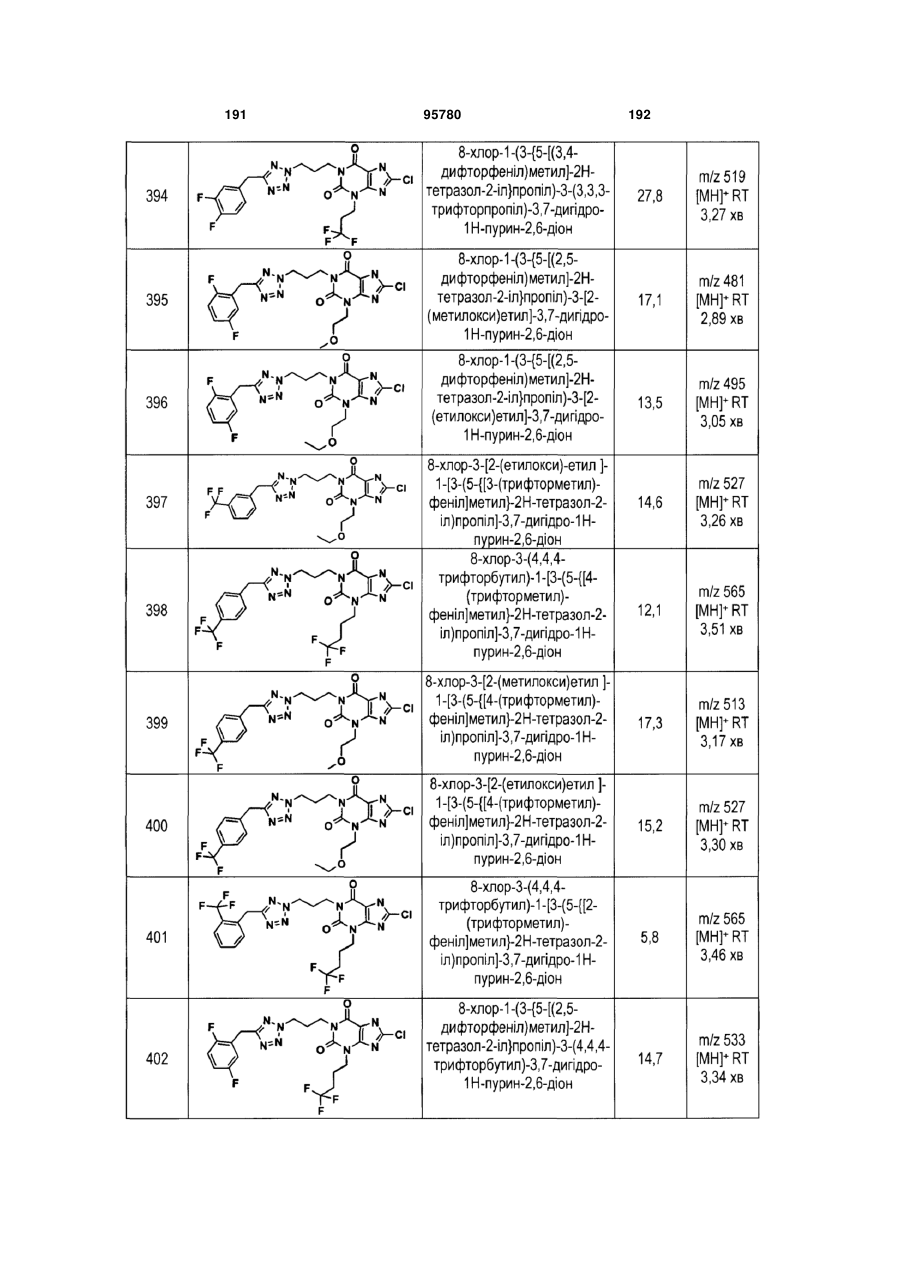
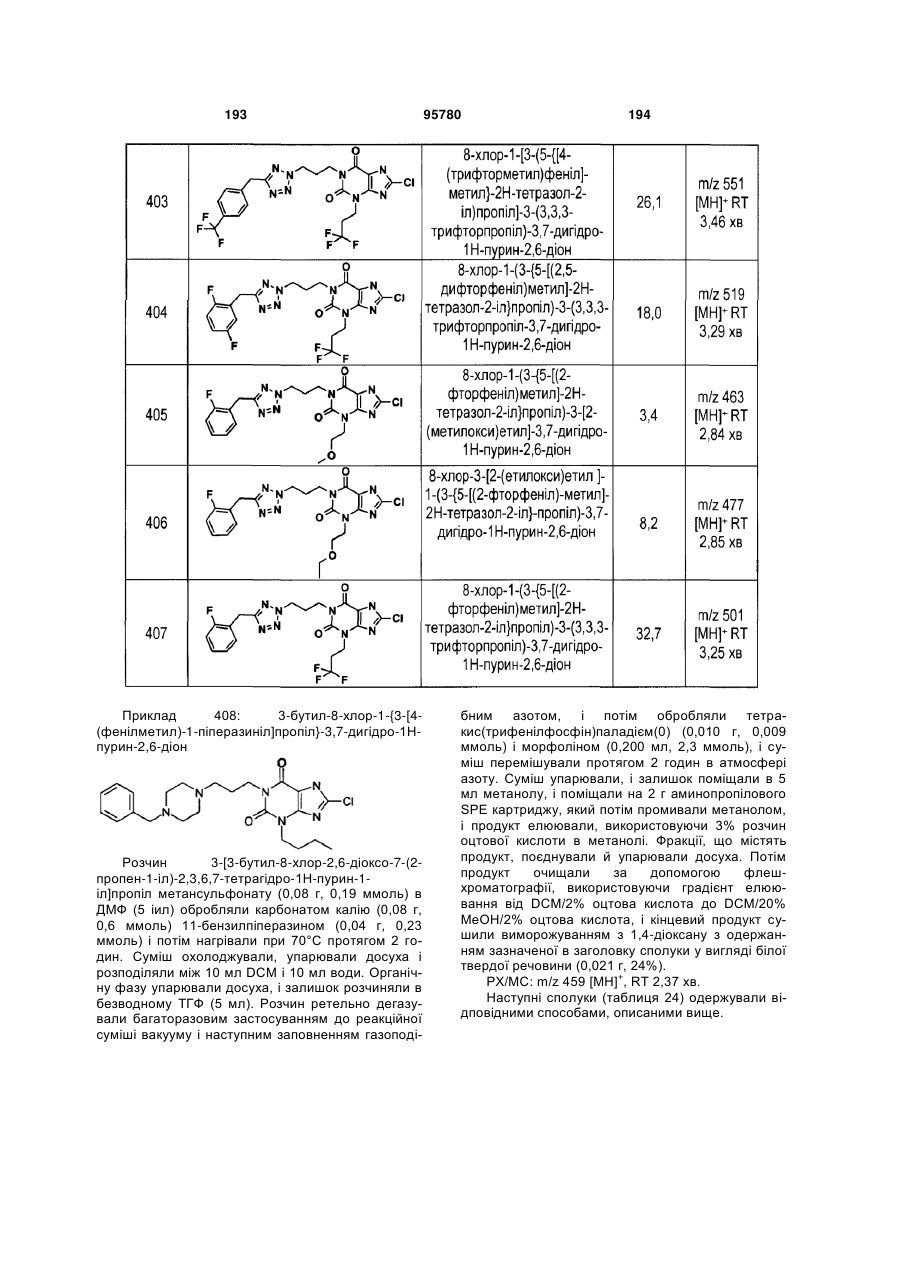
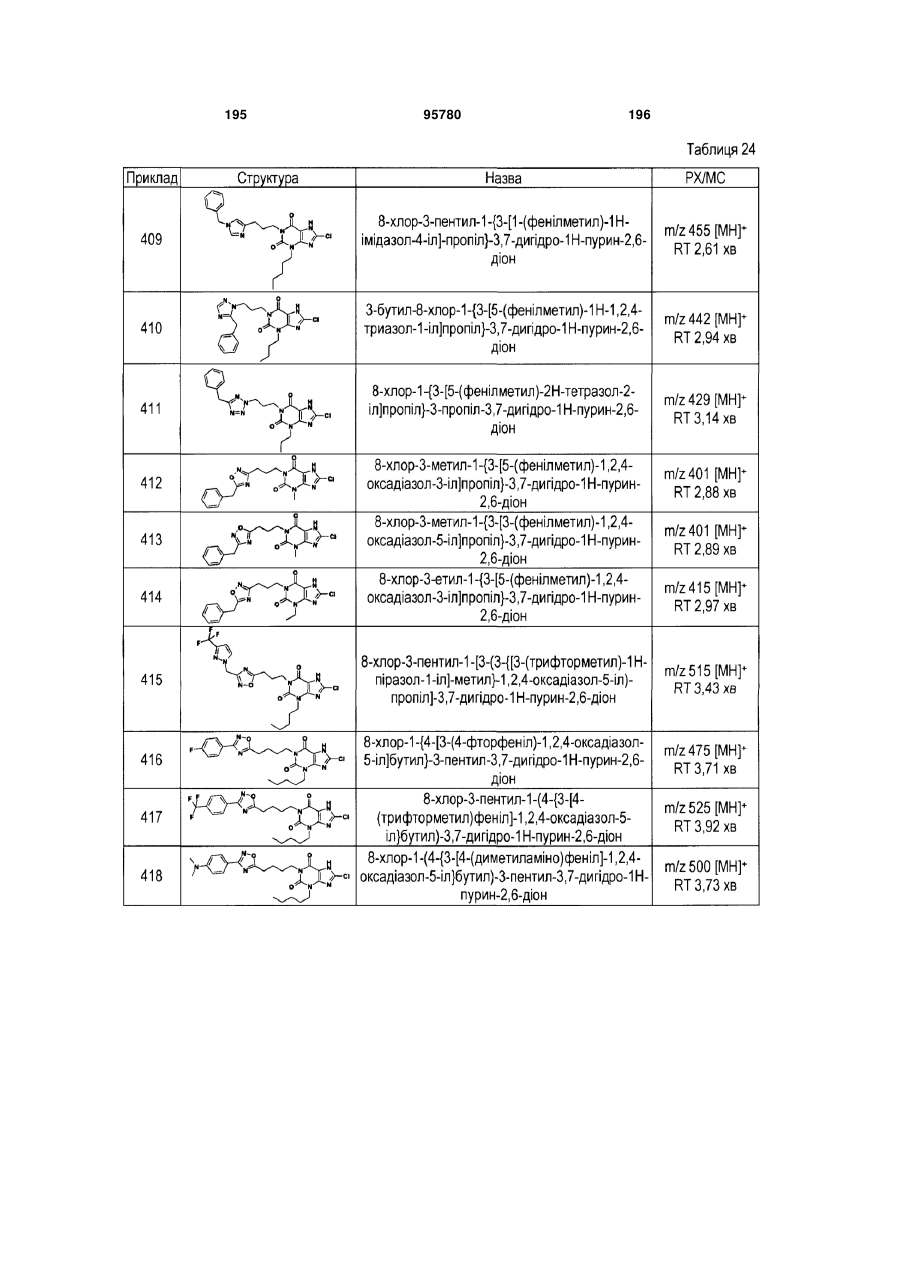
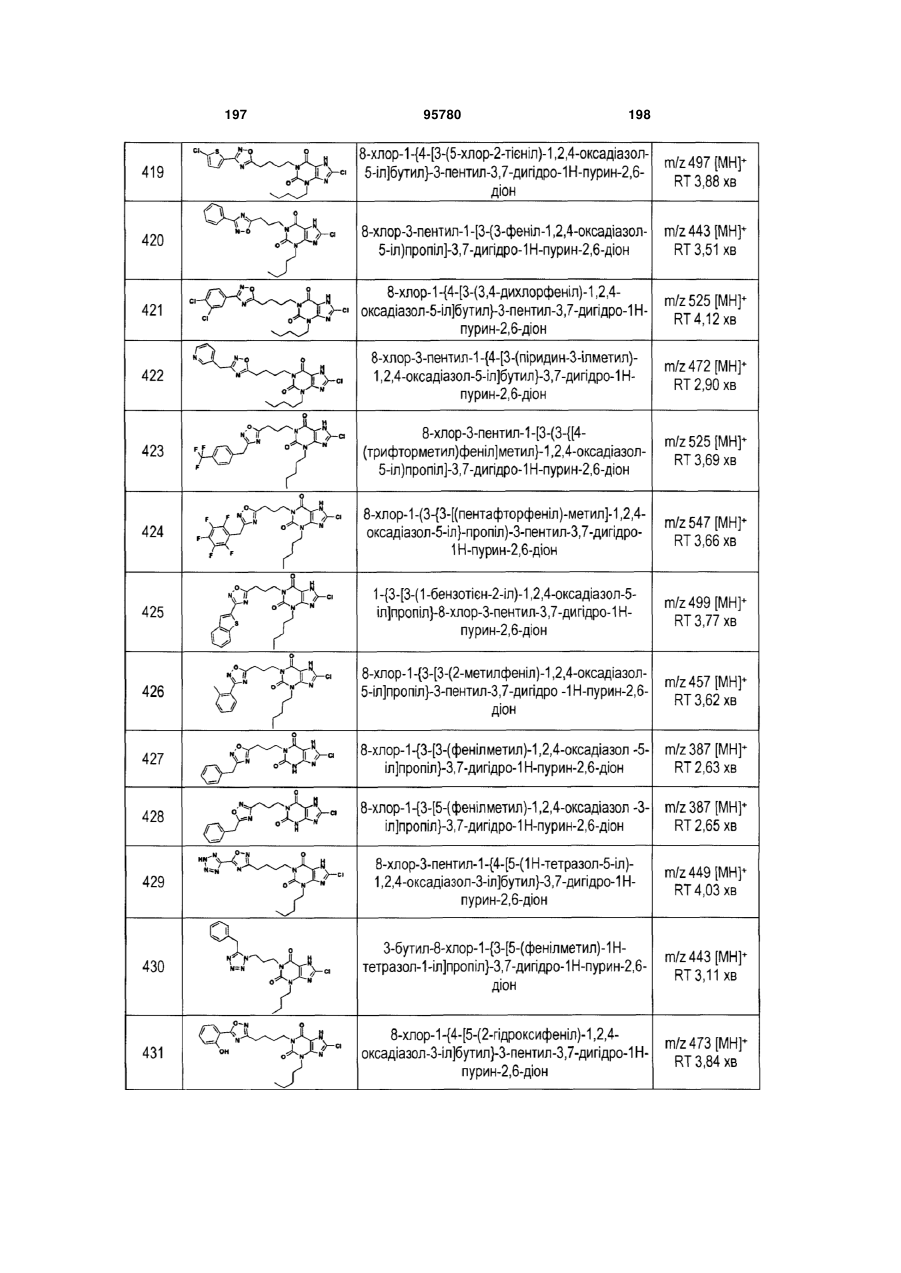
Похідні ксантину як селективні агоністи hm74a
Номер патенту: 95780
Опубліковано: 12.09.2011
Автори: Пінто Іван Лео, Хетлі Річард Джонатан Деніел, Мейсон Ендрю МкМертрі
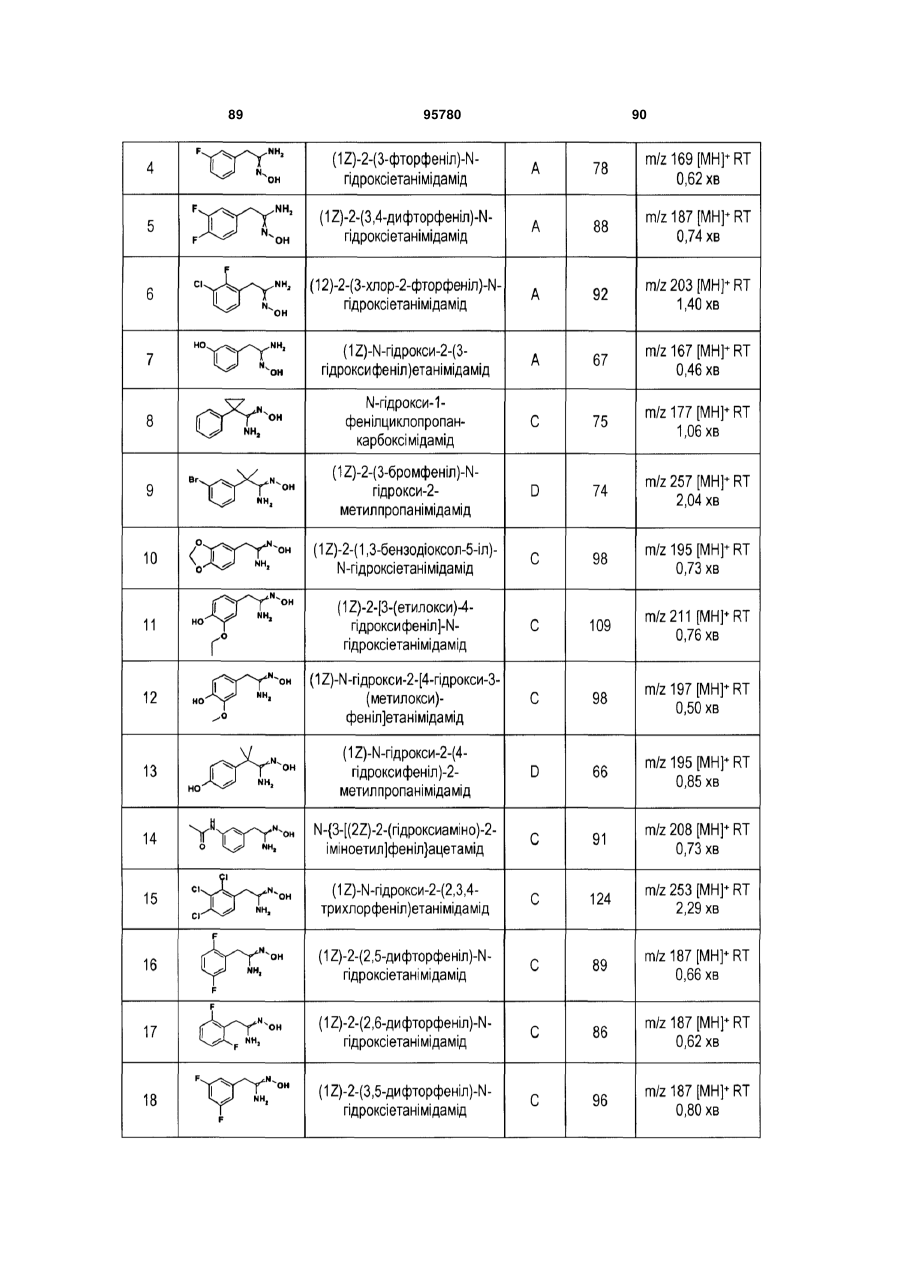
Формула / Реферат
1. Сполука формули (І)
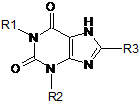 (І)
(І)
та її фармацевтично прийнятні солі або сольвати, де
R1 являє собою -(алкілен)m-Х-(алкілен)n-Y;
де m і n рівні числу атомів вуглецю в алкіленовому ланцюзі;
де X являє собою групу, вибрану з гетероарилу й гетероциклілу;
де Y являє собою групу, вибрану з арилу, гетероарилу і О-арилу; яка може бути необов'язково заміщена однією або декількома групами, незалежно вибраними з С1-6алкілу, С2-6алкенілу, С2-6алкінілу, галогену, -NH2, -(CH2)q-(O)p-(CH2)q-N(R5)C(O)OR8, -(CH2)q-N(R5)C(O)R8, -(CH2)q-(O)p-(CH2)q-C(O)NR5R6, -(CH2)q-N(R5)C(O)N(R5)R6, -(CH2)q-C(O)N((CH2)mOH)R5, -(CH2)q-N(R5)-S(O)2R8, -CH2-S(O)2N(R5)R6, -C1-6галогеналкілу, -OCF3, -OCH(F)2, -OCH2F, -C(O)OR5, -OR5, -R8CN, CN-SO2R9, -(СН2)nгетероарилу, -(СН2)nгетероциклілу, -(СН2)nциклоалкілу, -(СН2)nциклоалкенілу, -(СН2)nарилу;
R2 являє собою С3-6алкіл;
R3 являє собою галоген;
R5 і R6 незалежно вибрані з водню і С1-4алкілу;
R7 являє собою групу, вибрану з С1-6алкілу, С2-6алкенілу, С2-6алкінілу, -(CH2)tциклоалкілу, -(СН2)nциклоалкенілу, -(CH2)tгетероциклілу, -(CH2)tарилу і -(CH2)tгетероарилу;
R8 являє собою С1-4алкіл;
R9 являє собою групу, вибрану з С1-6алкілС2-6алкенілу, С2-6алкінілу, -(СН2)nциклоалкілу, -(СН2)nциклоалкенілу, -(СН2)nгетероциклілу, -(СН2)nарилу, -(СН2)nгетероарилу і CN;
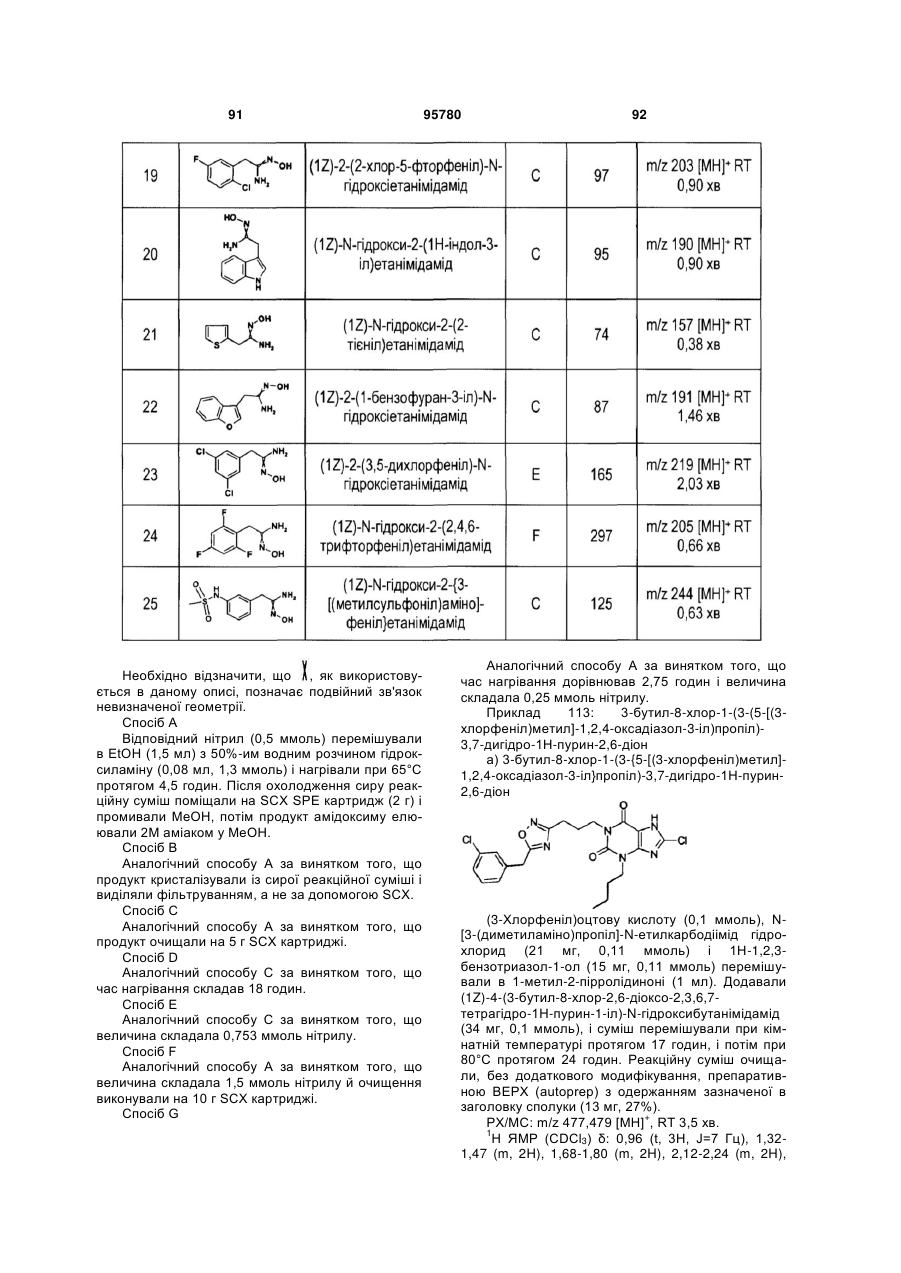
m являє собою ціле число, вибране з 3 і 4;
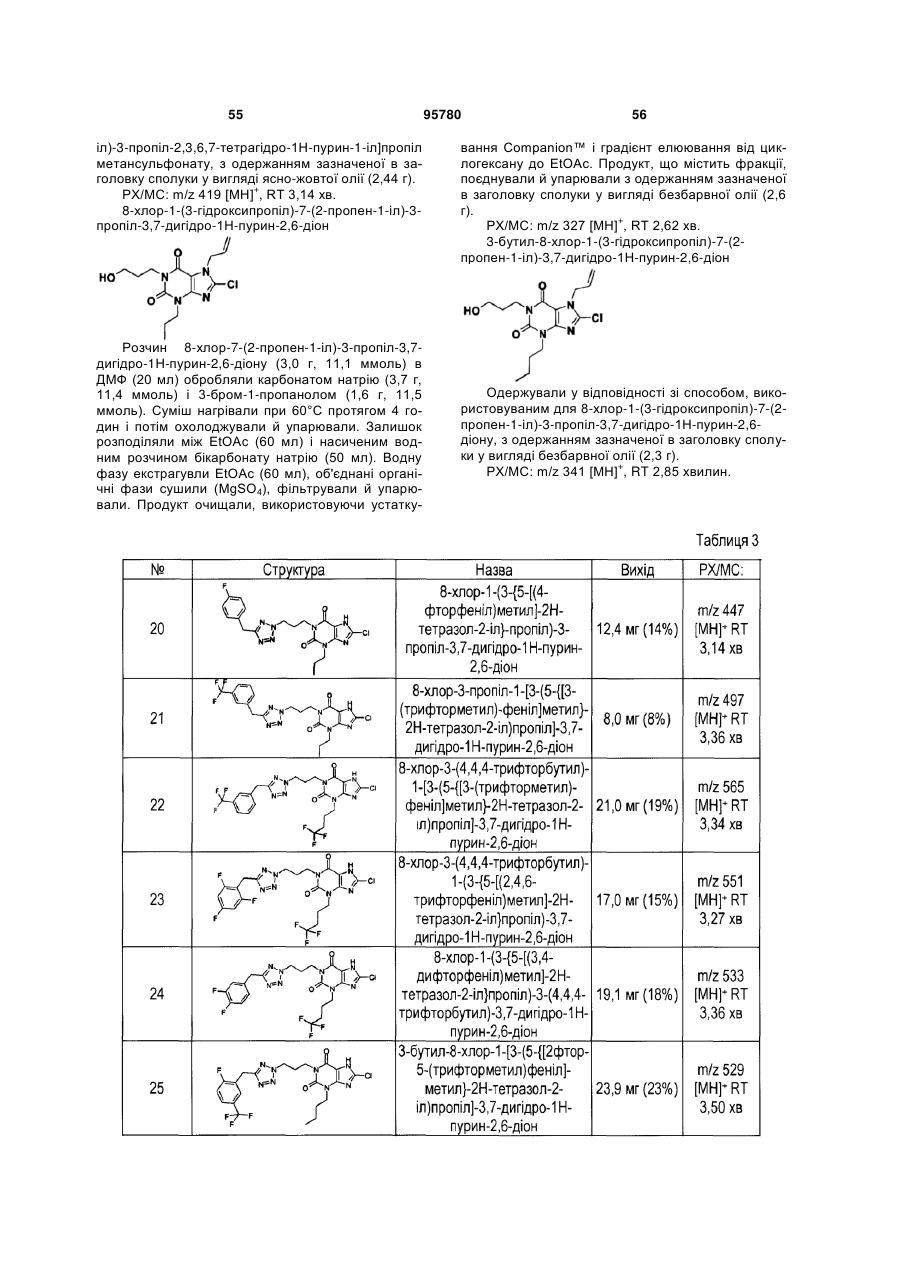
n являє собою ціле число, вибране з 0 і 1;
р являє собою ціле число, вибране з 0 і 1;
q являє собою ціле число, вибране з 0, 1 і 2; і
t являє собою ціле число, вибране з 1 і 2.
2. Сполука формули (І) за п. 1, де X являє собою групу, вибрану з гетероарилу.
3. Сполука формули (І) за п. 1 або 2, де X являє собою групу, вибрану з гетероарилу, що містить гетероатом азоту.
4. Сполука формули (І) за п. 3, де X являє собою оксадіазоліл або тетразол.
5. Сполука формули (І) за будь-яким з вищевказаних пунктів, де Y являє собою групу, вибрану з арилу та гетероарилу.
6. Сполука формули (І) за будь-яким з вищевказаних пунктів, де Y необов'язково заміщений одним або декількома галогеном(ами) і С1-6галогеналкілом(ами).
7. Сполука формули (І) за будь-яким з вищевказаних пунктів, де R3 являє собою хлор.
8. Сполука формули (І) за будь-яким з вищевказаних пунктів, де Y являє собою феніл, і m дорівнює 3, і n дорівнює 1.
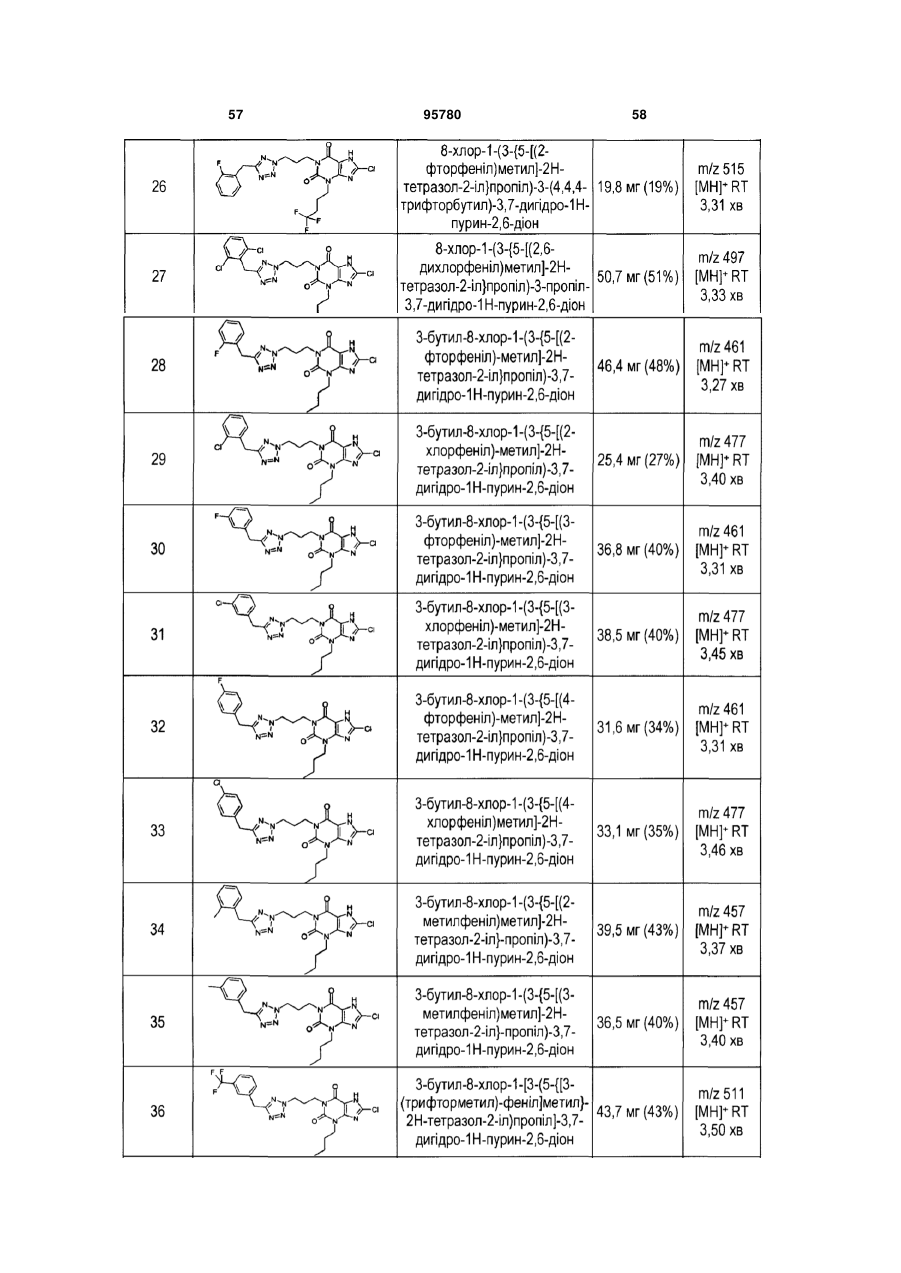
9. Сполука формули (І) за п. 1, де X являє собою тетразоліл, R2 являє собою бутил і R3 являє собою хлор.
10. Сполука формули (І) за п. 1, де X являє собою оксадіазоліл, Y являє собою піридиніл, R2 являє собою бутил, R3 являє собою хлор, m дорівнює 4, і n дорівнює 0.
11. Сполука формули (І) за п. 1, яка являє собою 3-бутил-8-хлор-1-(3-{5-[(4-фторфеніл)метил]-2Н-тетразол-2-іл}пропіл)-3,7-дигідро-1Н-пурин-2,6-діон
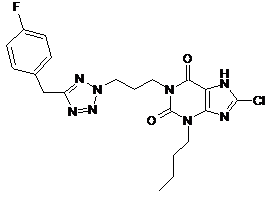 .
.
12. Сполука формули (І) за п. 1, яка являє собою 3-бутил-8-хлор-1-(3-{5-[(4-фторфеніл)метил]-2Н-тетразол-2-іл}пропіл)-3,7-дигідро-1Н-пурин-2,6-діон

або його фармацевтично прийнятну сіль.
13. Сполука формули (І) за будь-яким з вищевказаних пунктів для застосування при лікуванні людини або у ветеринарії.
14. Сполука формули (І) за будь-яким з пп. 1-12 для застосування при лікуванні діабетичної дисліпідемії та змішаної дисліпідемії та гіперліпопротеїнемії і/або запальних захворювань або станів.
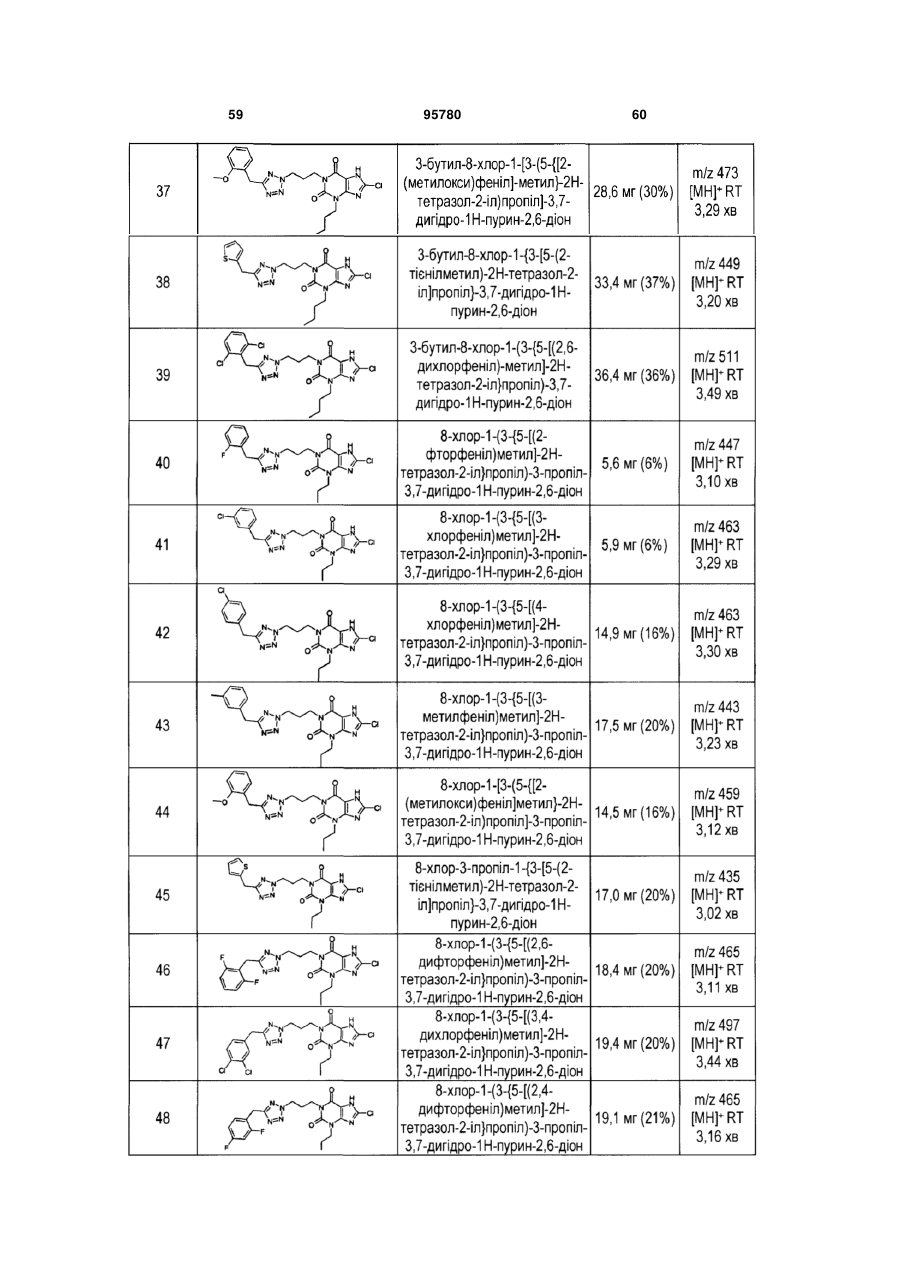
15. Сполука формули (І) за будь-яким з пп. 1-12 для застосування в лікуванні діабетичної дисліпідемії, змішаної дисліпідемії, серцевої недостатності, гіперхолестеринемії, серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз, гіпертригліцеридемію, цукрового діабету типу II, діабету типу І, резистентності до інсуліну, гіперліпідемії, нервової анорексії, ожиріння, захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності, захворювання периферичних судин або інсульту.
16. Сполука формули (І) за будь-яким з пп. 1-12 для застосування в одержанні лікарського засобу для лікування діабетичної дисліпідемії, змішаної дисліпідемії, серцевої недостатності, гіперхолестеринемії, серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз, гіпертригліцеридемію, цукрового діабету типу II, діабету типу І, резистентності до інсуліну, гіперліпідемії, нервової анорексії, ожиріння, захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності або інсульту.
17. Спосіб лікування стану людини або тварини, при якому передактивація рецептора НМ74А могла б мати ефект у відношенні захворювання або при якому активація рецептора буде ефективною, де вводять зазначеній хворій людині або тварині ефективну кількість сполуки формули (І) за будь-яким з пп. 1-12.
18. Спосіб за п. 17, де людина або тварина має діабетичну дисліпідемію, змішану дисліпідемію і гіперліпопротеїнемію або запальне захворювання чи стан.
19. Фармацевтична композиція, що містить сполуку формули (І) за будь-яким з пп. 1-12 і щонайменше один фармацевтично прийнятний розріджувач, наповнювач або носій.
20. Комбінація для спільного або роздільного введення, послідовно або одночасно, в роздільних або комбінованих фармацевтичних композиціях, де зазначена комбінація містить сполуку формули (І) за будь-яким з пп. 1-12 разом із щонайменше одним терапевтично активним засобом.
21. Фармацевтична композиція, що містить:
(і) сполуку формули (І) за будь-яким з пп. 1-12;
(іі) один або декілька терапевтично активних засобів, вибраних зі статинів, фібратів, смол, що зв'язують жовчну кислоту, і нікотинової кислоти; і
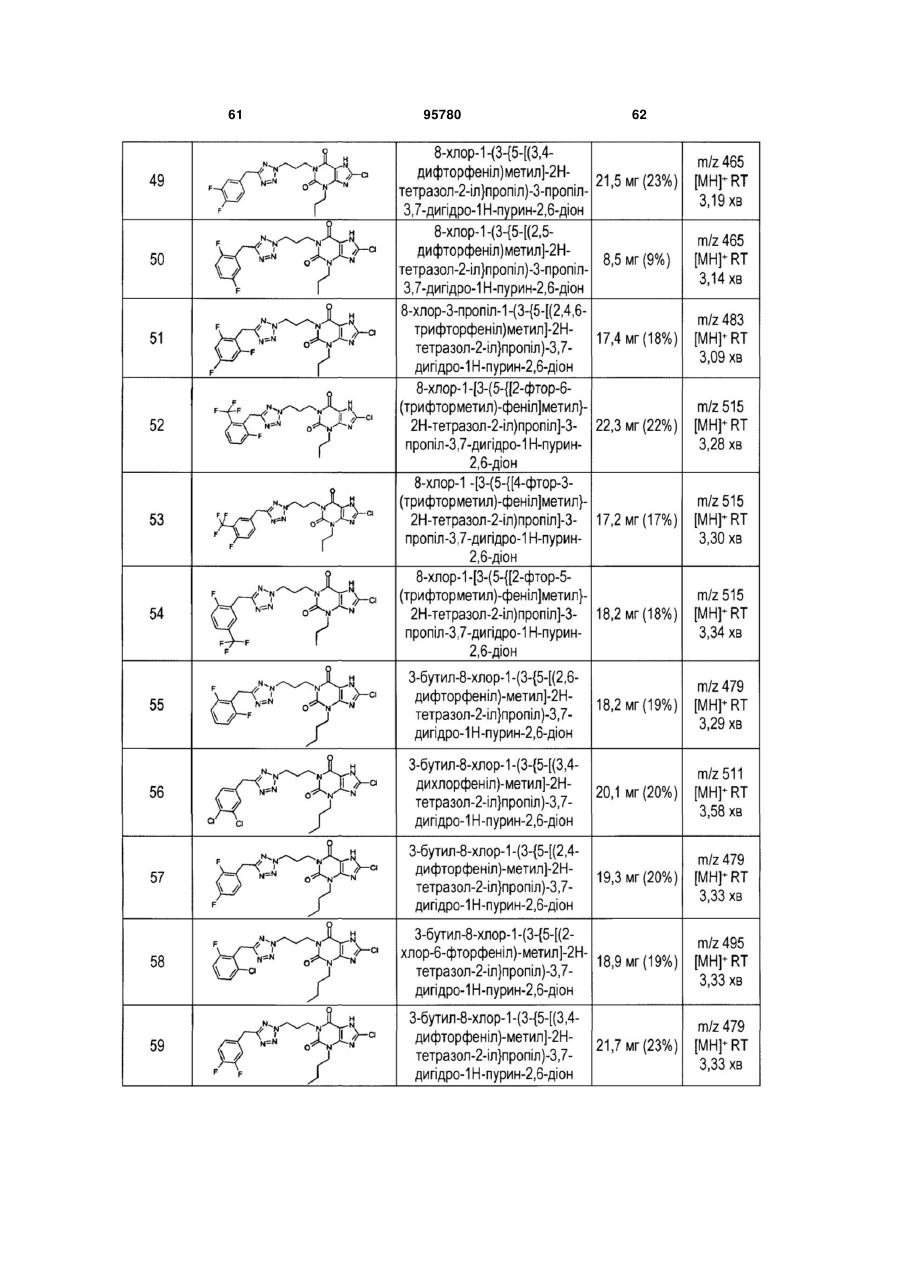
(ііі) один або декілька фармацевтично прийнятних розріджувачів, наповнювачів або носіїв.
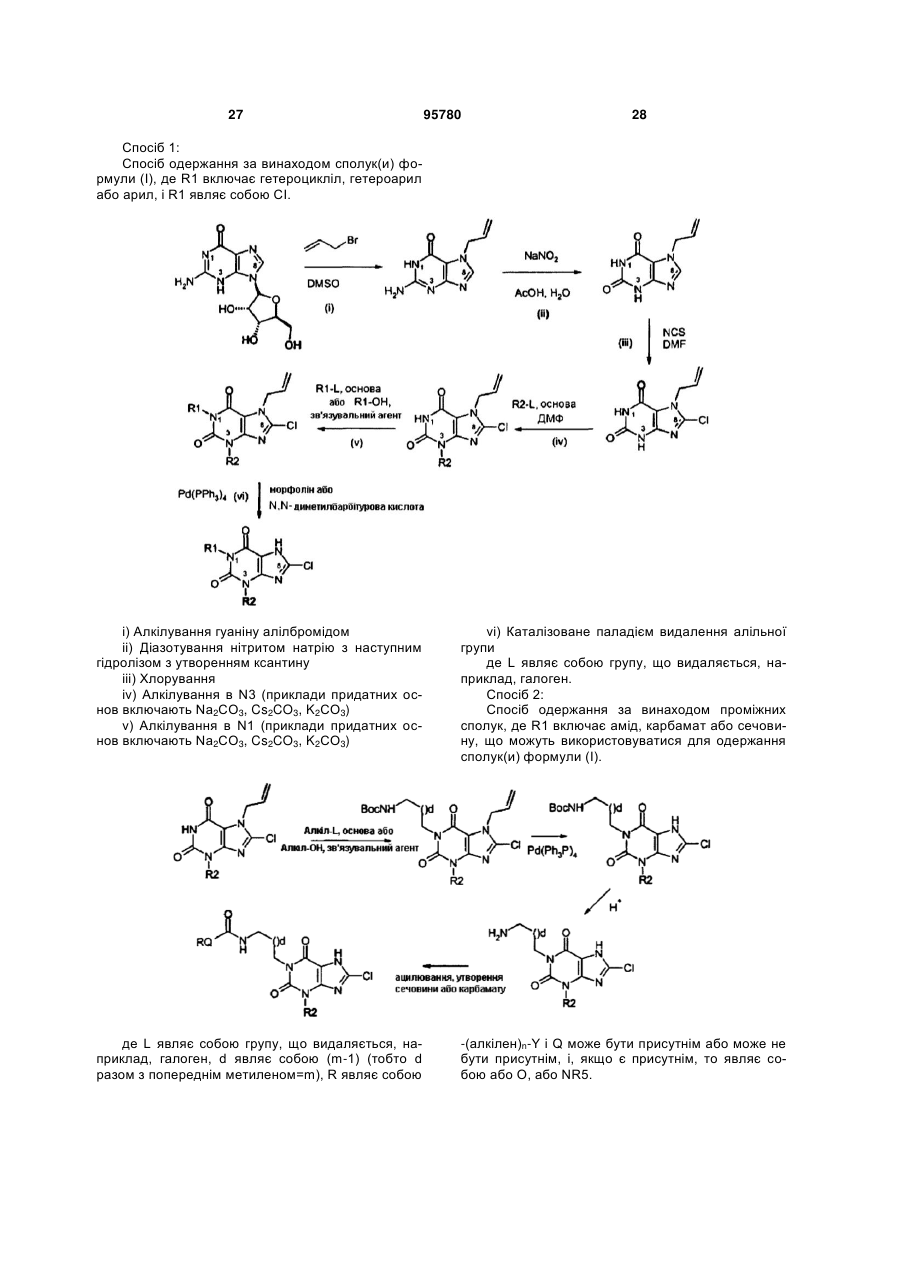
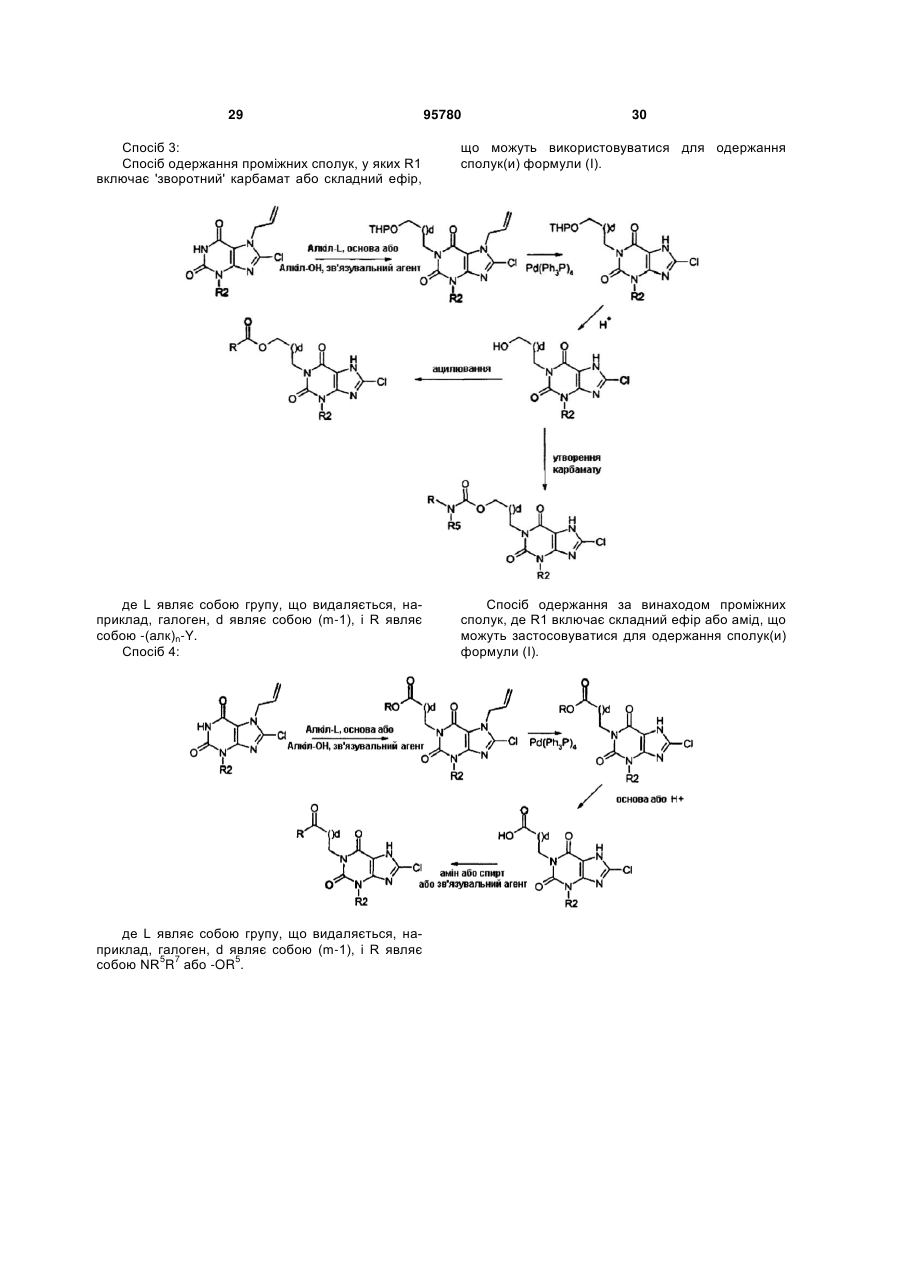
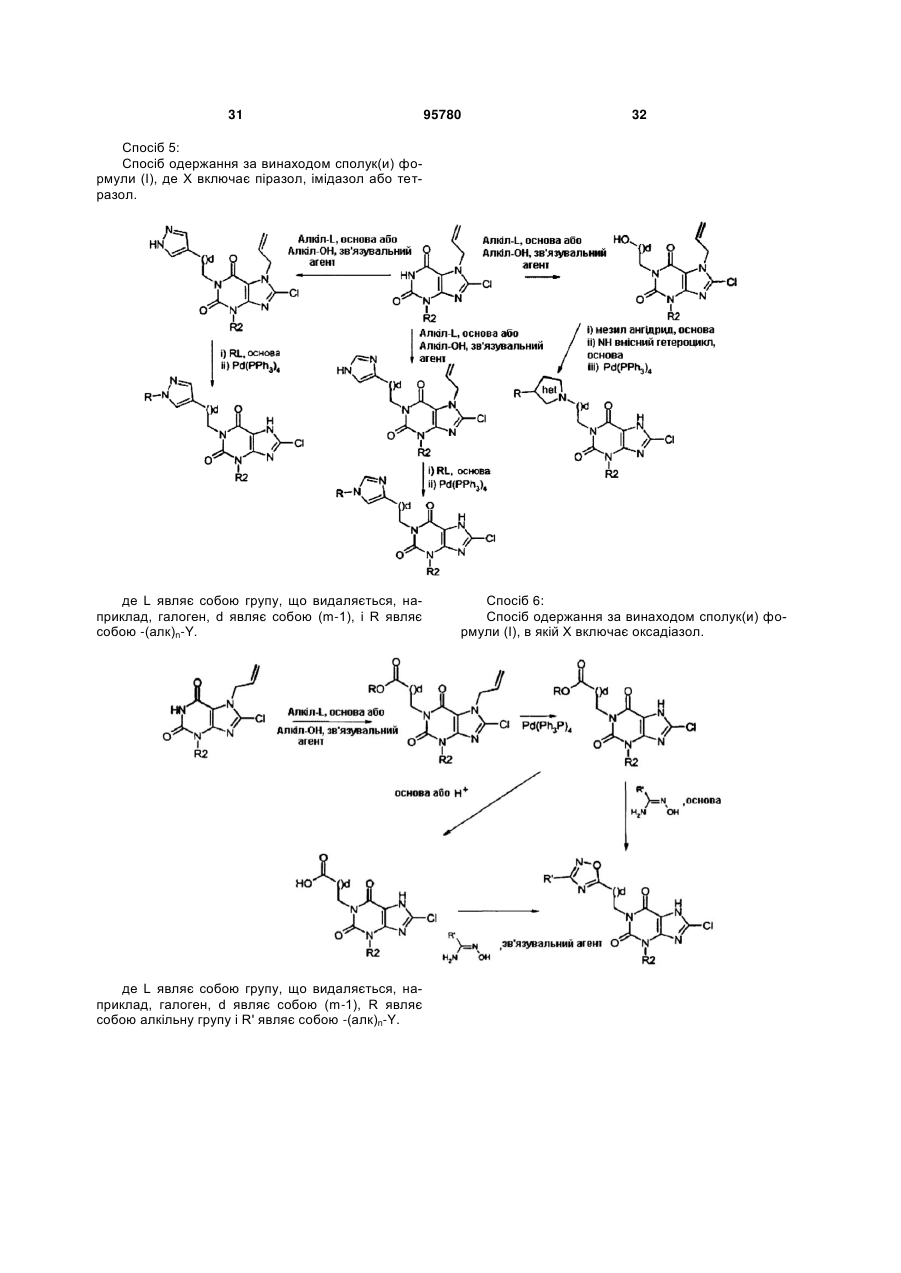
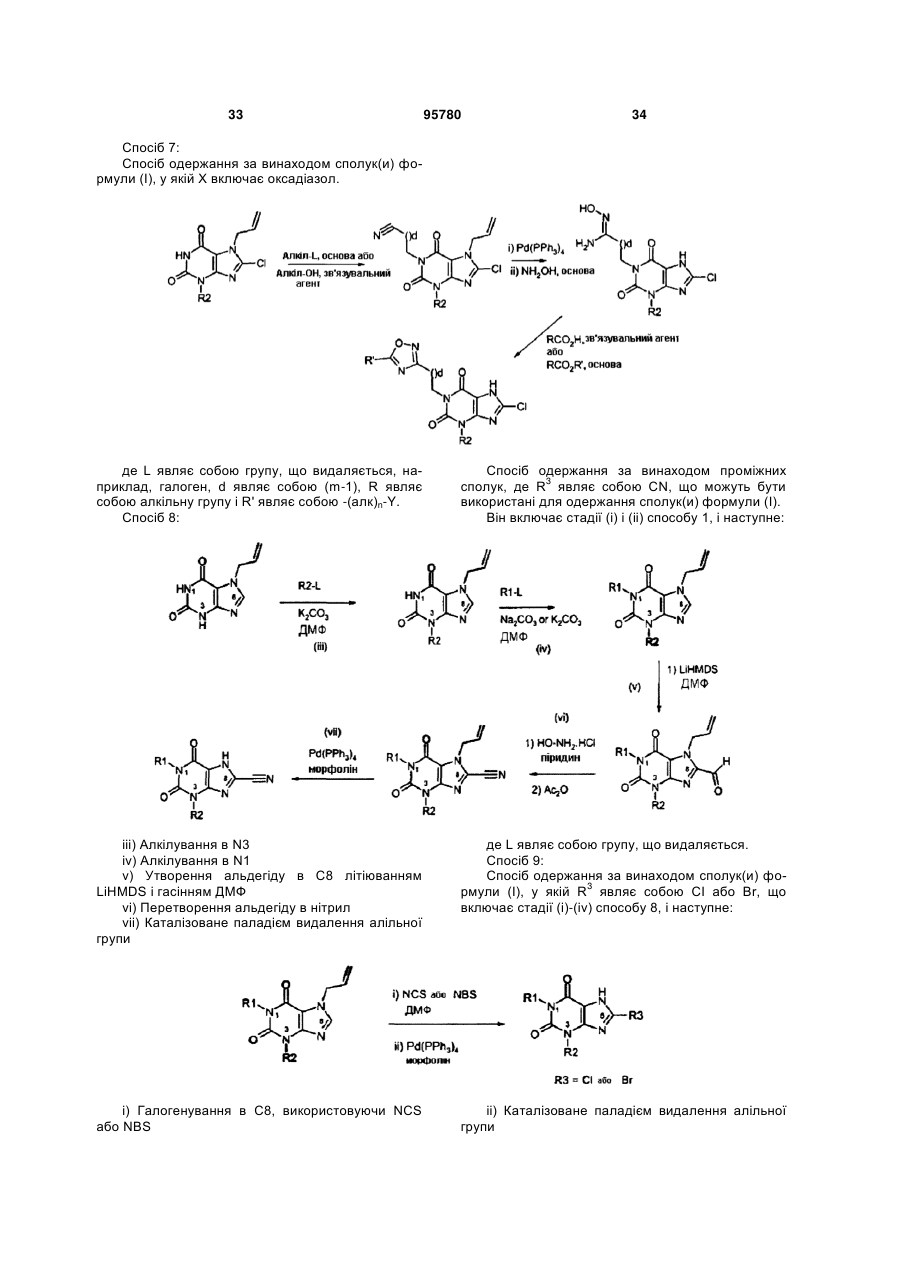
22. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-12 з відповідної вихідної речовини, наприклад, сполук(и) формули (II):
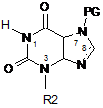 , (II)
, (II)
де РG=захисна група, де здійснюють:
(і) алкілування в N1 N7 захищеного ксантину;
(іі) алкілування в N3 N7 захищеного ксантину;
(ііі) галогенування в С8; і
(iv) видалення захисної групи N7; у будь-якому порядку, за умови, що видалення захисної групи виконують після алкілування.
Текст
1. Сполука формули (І) O H R1 N N R3 N O N 2 (19) 1 3 95780 9. Сполука формули (І) за п. 1, де X являє собою 2 3 тетразоліл, R являє собою бутил і R являє собою хлор. 10. Сполука формули (І) за п. 1, де X являє собою 2 оксадіазоліл, Y являє собою піридиніл, R являє 3 собою бутил, R являє собою хлор, m дорівнює 4, і n дорівнює 0. 11. Сполука формули (І) за п. 1, яка являє собою 3-бутил-8-хлор-1-(3-{5-[(4-фторфеніл)метил]-2Нтетразол-2-іл}пропіл)-3,7-дигідро-1Н-пурин-2,6діон F O N N N N H N N O Cl N N . 12. Сполука формули (І) за п. 1, яка являє собою 3-бутил-8-хлор-1-(3-{5-[(4-фторфеніл)метил]-2Нтетразол-2-іл}пропіл)-3,7-дигідро-1Н-пурин-2,6діон F O N N N N H N N O Cl N N або його фармацевтично прийнятну сіль. 13. Сполука формули (І) за будь-яким з вищевказаних пунктів для застосування при лікуванні людини або у ветеринарії. 14. Сполука формули (І) за будь-яким з пп. 1-12 для застосування при лікуванні діабетичної дисліпідемії та змішаної дисліпідемії та гіперліпопротеїнемії і/або запальних захворювань або станів. 15. Сполука формули (І) за будь-яким з пп. 1-12 для застосування в лікуванні діабетичної дисліпідемії, змішаної дисліпідемії, серцевої недостатності, гіперхолестеринемії, серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз, гіпертригліцеридемію, цукрового діабету типу II, діабету типу І, резистентності до інсуліну, гіперліпідемії, нервової анорексії, ожиріння, захворювання коронарних артерій, тромбозу, 4 стенокардії, хронічної ниркової недостатності, захворювання периферичних судин або інсульту. 16. Сполука формули (І) за будь-яким з пп. 1-12 для застосування в одержанні лікарського засобу для лікування діабетичної дисліпідемії, змішаної дисліпідемії, серцевої недостатності, гіперхолестеринемії, серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз, гіпертригліцеридемію, цукрового діабету типу II, діабету типу І, резистентності до інсуліну, гіперліпідемії, нервової анорексії, ожиріння, захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності або інсульту. 17. Спосіб лікування стану людини або тварини, при якому передактивація рецептора НМ74А могла б мати ефект у відношенні захворювання або при якому активація рецептора буде ефективною, де вводять зазначеній хворій людині або тварині ефективну кількість сполуки формули (І) за будьяким з пп. 1-12. 18. Спосіб за п. 17, де людина або тварина має діабетичну дисліпідемію, змішану дисліпідемію і гіперліпопротеїнемію або запальне захворювання чи стан. 19. Фармацевтична композиція, що містить сполуку формули (І) за будь-яким з пп. 1-12 і щонайменше один фармацевтично прийнятний розріджувач, наповнювач або носій. 20. Комбінація для спільного або роздільного введення, послідовно або одночасно, в роздільних або комбінованих фармацевтичних композиціях, де зазначена комбінація містить сполуку формули (І) за будь-яким з пп. 1-12 разом із щонайменше одним терапевтично активним засобом. 21. Фармацевтична композиція, що містить: (і) сполуку формули (І) за будь-яким з пп. 1-12; (іі) один або декілька терапевтично активних засобів, вибраних зі статинів, фібратів, смол, що зв'язують жовчну кислоту, і нікотинової кислоти; і (ііі) один або декілька фармацевтично прийнятних розріджувачів, наповнювачів або носіїв. 22. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-12 з відповідної вихідної речовини, наприклад, сполук(и) формули (II): O PG H O N N1 7 3 N 8 N R2 , (II) де РG=захисна група, де здійснюють: (і) алкілування в N1 N7 захищеного ксантину; (іі) алкілування в N3 N7 захищеного ксантину; (ііі) галогенування в С8; і (iv) видалення захисної групи N7; у будь-якому порядку, за умови, що видалення захисної групи виконують після алкілування. 5 Даний винахід відноситься до сполук, що є похідними ксантину, способів одержання зазначених похідних, фармацевтичних засобів, що містять ці сполуки, і застосування сполук у терапії, наприклад, у терапії захворювань, при яких предактивація рецептора НМ74А могла б мати ефект у відношенні захворювання, або при яких активація рецептора буде ефективною. Дисліпідемія є загальним терміном, використовуваним для опису хворих з аберантними ліпопротеїновими комплексами. Клінічно, основні класи сполук, використовувані для лікування пацієнтів з дисліпідемією, і відповідно з ризиком виникнення серцево-судинного захворювання, являють собою статини, фібрати, полімери, що зв'язують жовчні кислоти, і нікотинову кислоту. Нікотинову кислоту (ніацин, вітамін В) клінічно застосовували для пацієнтів з різними формами дисліпідемії протягом більш ніж 40 років. Основною дією нікотинової кислоти є інгібування гормон-чутливої тригліцеридліпази (HSL), яке призводить до зниження рівня неетерифікованих жирних кислот у плазмі (NEFA), що у свою чергу змінює жировий обмін у печінці, знижуючи вироблення LDL і VLDL (ліпопротеїни низької щільності та ліпопротеїни дуже низької щільності). Знижені рівні VLDL, як вважають, знижують активність білка, який переносить холестериновий ефір (СЕТР), підвищуючи рівні HDL (ліпопротеїни високої щільності), що може викликати видимі серцево-судинні поліпшення. Таким чином, нікотинова кислота дає досить бажану зміну ліпопротеїнових профілів; зниження рівнів VLDL і LDL при підвищенні HDL. Також, у декількох дослідженнях було показано, що нікотинова кислота має сприятливі ефекти на перебіг захворювання, знижуючи прогресування і підсилюючи ремісію атеросклеротичних ушкоджень, і знижуючи кількість серцево-судинних нападів. Інгібування HSL, яке спостерігається при лікуванні нікотиновою кислотою, опосередковане зниженням циклічного аденозинмонофосфату в клітині (сАМР), викликане G-білок-опосредкованим інгібуванням аденілілциклази. Останнім часом рецептори НМ74 і НМ74А, що зв'язуються з Gбілком, визначали як рецептори нікотинової кислоти (РСТ патентна заявка WO02/84298; Wise et. al. J. Biol Chem., 2003, 278 (11), 9869-9874). Послідовність ДНК НМ74А людини можна знайти в Genbank; номер доступу AY148884. Два інших документи підтверджують це відкриття (Tunaru et. al. Nature Medicine, 2003, 9(3), 352-255 і Soga et. al. Biochem Biophys Res Commun., 2003, 303 (1) 364369), однак позначення трохи відрізняються. У документі Tunaru позначення НМ74 людини, автори позначають як НМ74А, а в документі Soga HM74b відповідає НМ74А. Клітини, трансфіковані для експресії НМ74А і/або НМ74, підсилюють здатність викликати G, G-білок опосередковані відповіді після впливу нікотинової кислоти. У миші з недоліком гомологу нікотинової кислоти НМ74А (m-PUMA-G) не відбувається зниження рівнів NEFA у плазмі. Деякі похідні ксантину були синтезовані й описані в попередньому рівні техніки. Наприклад, в ЕР0389282 описані похідні ксантину як можливі 95780 6 медіатори порушень кровообігу в мозку. Ряд похідних ксантину були визначені Jacobson et. al., J. Med. Chem., 1993, 36, 2639-2644, як антагоністи аденозинового рецептора. Автори пропонують групу похідних ксантину, які є селективними агоністами рецептора нікотинової кислоти НМ74А, і які, відповідно, є потенційно ефективними для лікування, профілактики й ослаблення захворювань, при яких предактивація цього рецептора має ефект у відношенні захворювання, або при яких активація рецептора буде ефективною. Даний винахід відноситься до похідних ксантину і застосування цих похідних у терапії, наприклад, у лікуванні захворювань, при яких предактивація рецептора НМ74А могла б мати ефект у відношенні захворювання, або при яких активація рецептора буде ефективною. Наприклад, для лікування захворювань ліпідного обміну, включаючи дисліпідемію або гіполіпопротеїнемію, таких як діабетична дисліпідемія і змішана дисліпідемія, серцева недостатність, гіперхолестеринемія, серцево-судинне захворювання, включаючи атеросклероз, артеріосклероз і гіпертригліцеридемію. Як такі, сполуки також можуть застосовуватися як лікарські засоби для лікування захворювань коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності, захворювання периферичних судин та інсульту, а також серцево-судинних симптомів, пов'язаних з цукровим діабетом по типу II, діабетом по типу І, резистентністю до інсуліну, гіперліпідемією, нервовою анорексією, ожирінням. Також сполуки можуть застосовуватися для лікування запальних захворювань або станів, як описано нижче. Проміжні сполуки, композиції, способи і процеси, описані в даному описі, відносяться до додаткових варіантів здійснення винаходу. Відповідно до одного з аспектів винаходу автори пропонують щонайменше одну хімічну сполуку, обрану зі сполук формули (І) (I) і її фармацевтично прийнятних похідних, де 1 R являє собою -(алкілен)m-Х-(алкілен)n-Y; де m і n дорівнюють числу атомів вуглецю в алкіленовому ланцюзі; де X являє собою групу, обрану з гетероарилу і гетероциклілу; де Υ являє собою групу, обрану з арилу, гетероарилу та О-арилу; яка може бути необов'язково заміщена однією або декількома групами, незалежно обраними з С1-6алкілу, С2-6алкенілу, С2-6алкінілу, галогену, 5 7 5 8 (CH2)qNR R , -(CH2)q-(O)p-(CH2)q-N(R )C(O)OR , 5 8 5 6 (CH2)q-N(R )C(O)R , -(CH2)q-(O)p-(CH2)q-C(O)NR R , 5 5 6 -(CH2)q-N(R )C(O)NR R , -(CH2)q5 5 8 C(O)N((CH2)mOH)R , -(CH2)q-N(R )-S(O)2R , -CH25 6 S(O)2NR R , -C1-6галогеналкілу, -OCF3, -OCH(F)2, 5 5 8 9 OCH2F, -C(O)OR , -OR , -R CN, CN, -SO2R , 7 (СН2)nгетероарилу, -(СН2)nгетероциклілу, (СН2)nциклоалкілу, -(СН2)nциклоалкенілу і (СН2)nарилу; 2 R являє собою Сі-6 алкіл, що може бути необов'язково заміщений однією або декількома групами, незалежно обраними з циклоалкілу, Сі-6 4 галогеналкілу, галогену, -CN і -OR ; 3 R являє собою галоген; 4 R являє собою групу, обрану з водню, С1С2-6алкенілу, С2-6алкінілу, 6алкілу, (СН2)nциклоалкілу, -(СН2)nциклоалкенілу, (СН2)nгетероциклілу, -(СН2)nарил і (СН2)nгетероарилу; 5 6 R і R незалежно обрані з водню і С1-4алкілу; 7 R являє собою групу, обрану з С1-6алкілу, С2С2-6алкінілу, -(CH2)tциклоалкілу, 6алкенілу, (CH2)tциклоалкенілу, -(CH2)tгетероциклілу, (CH2)tарилу і -(CH2)tгетероарилу; 8 R являє собою С1-4алкіл; 9 R являє собою групу, обрану з С1-6алкілС2алкенілу, С2-6алкінілу, -(СН2)nциклоалкілу, 6 (СН2)nциклоалкенілу, -(СН2)nгетероциклілу, (СН2)nарилу, -(СН2)nгетероарилу і CN; m являє собою ціле число, обране з 3 і 4; n являє собою ціле число, обране з 0 і 1 ; p являє собою ціле число, обране з 0 і 1 ; q являє собою ціле число, обране з 0,1 і 2; і t являє собою ціле число, обране з 1 і 2. Передбачається, що сполука(и) може(уть) бути використана(і) для лікування захворювань, при яких предактивація рецептора НМ74А могла б мати ефект у відношенні захворювання, або при яких активація рецептора буде ефективною. Наприклад, у лікуванні захворювань ліпоїдного обміну, включаючи дисліпідемію і гіполіпопротеїнемію, наприклад, діабетичну дисліпідемію і змішану дисліпідемію, серцеву недостатність, гіперхолестеринемію, серцево-судинне захворювання, включаючи атеросклероз, артеріосклероз і гіпертригліцеридемію. Як такі, сполуки можуть також застосовуватися як лікарські засоби для лікування захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності, захворювання периферичних судин та інсульту, а також серцево-судинних симптомів, пов'язаних з цукровим діабетом по типу II, діабетом по типу І, резистентністю до інсуліну, гіперліпідемією, нервовою анорексією, ожирінням. Як такі, сполуки за даним винаходом можуть знайти застосування як агоністи або часткові агоністи рецептора НМ74А. Також сполуки можуть застосовуватися в лікуванні запальних захворювань або станів, як описано далі нижче. В одному з варіантів здійснення даного винаходу, X являє собою гетероарил. В іншому варіанті здійснення X являє собою гетероарил, що містить гетероатом азоту, наприклад, триазоліл, фуразаніл, оксадіазоліл, тетразоліл, імідазоліл або піразоліл. У наступному варіанті здійснення X являє собою групу, обрану з оксадіазолілу і тетразолілу. В іншому варіанті здійснення Υ являє собою необов'язково заміщену групу, обрану з арилу, наприклад, фенілу або нафтилу, гетероарилу, наприклад, піридинілу, тіазолілу, тієнілу, бензофуранілу або індолілу і О-арилу, наприклад, О-фенілу. 95780 8 У наступному варіанті здійснення, Υ являє собою необов'язково заміщену групу, обрану з арилу або гетероарилу. В одному з варіантів здійснення Υ обраний з арилу. В одному з варіантів здійснення даного винаходу, Υ може бути необов'язково заміщений одним або декількома: С1-6алкілом, С2-6алкенілом, С26алкінілом, галогеном, -NH2, -(CH2)q-(O)p-(CH2)q5 8 5 8 N(R )C(O)OR , -(CH2)q-N(R )C(O)R , -(CH2)q-(O)p5 6 5 5 6 (CH2)q-C(O)NR R , -(CH2)q-N(R )C(O)N(R )R , 5 5 8 (CH2)q-C(O)N((CH2)mOH)R , -(CH2)q-N(R )-S(O)2R , 5 6 CH2-S(O)2N(R )R , -C1-6галогеналкілом, -OCF3, 5 5 8 OCH(F)2, -OCH2F, -C(O)OR , -OR , -R CN, CN9 SO2R , -(СН2)nгетероарилом,(СН2)nгетероциклілом, -(СН2)nциклоалкілом, (СН2)nциклоалкенілом,-(СН2)nарилом; У наступному варіанті здійснення Υ заміщений 5 однією або декількома групами, обраними з OR , наприклад ОН або ОСН3, галогену, наприклад F або СІ, арилу, наприклад фенілу, С16галогеналкілу, наприклад CF3 або CH2CF3, OCF3, 8 5 8 R CN, CN, (CH2)q-N(R )-S(O)2R , наприклад 9 NHSO2CH3, i SO2R , наприклад SO2CH3. В подальшому варіанті здійснення Υ заміщений однією або декількома групами, обраними з 5 OR , галогену, С1-6галогеналкілу і -(CH2)q5 8 N(R )C(O)R . В іншому варіанті здійснення Υ заміщений однією або декількома групами, обраними з галогену і С1-6галогеналкілу. В іншому варіанті здійснення Υ додатково не заміщений. В одному з варіантів здійснення даного винаходу X і Υ, кожен, незалежно, являють собою гетероарил, що містить гетероатом азоту. У наступному варіанті здійснення, X являє собою оксадіазоліл, і Υ являє собою піридиніл. В іншому варіанті здійснення X являє собою тетразоліл, і Υ являє собою феніл. В іншому варіанті здійснення даного винаходу X являє собою оксадіазоліл, і Υ являє собою феніл. В одному з варіантів здійснення за винаходом, m дорівнює 4 і n дорівнює 0. У наступному варіанті здійснення m дорівнює 3 і n дорівнює 1. В одному з варіантів здійснення даного вина2 ходу R обраний з С3-6алкілу, наприклад, бутилу або пентилу, наприклад, н-бутилу або н-пентилу. У наступному варіанті здійснення даного вина3 ходу, R обраний із хлору і брому. В іншому варіа3 нті здійснення R являє собою хлор. В одному з варіантів здійснення даного вина7 ходу R являє собою групу, обрану з С1-6алкілу, С2алкенілу, С2-6алкінілу, -(СН2)nциклоалкілу, 6 (СН2)nциклоалкенілу, -(CH2)tгетероциклілу, (СН2)tарилу і -(CH2)tгетероарилу; В одному з варіантів здійснення даного винаходу X являє собою оксадіазоліл, Υ являє собою 2 3 феніл, R являє собою бутил, R являє собою хлор, і m дорівнює 4 і n дорівнює 0. У відношенні стереоізомерів, сполуки формули (І) можуть мати один або кілька асиметричних атомів вуглецю і можуть існувати у вигляді рацематів, сумішей рацематів і окремих енантіомерів або діастереомерів. Усі такі ізомерні форми вклю 9 чені в обсяг по даному винаходу, включаючи їх суміші. У тому випадку, коли сполука формули (І) містить алкенілову або алкеніленову групу, цис (Е) і транс (Ζ) ізомерія може також мати місце. Даний винахід включає окремі стереоізомери сполуки за винаходом і, коли доречно, їх окремі таутомерні форми, разом з їх сумішами. Виділення діастереоізомерів або цис і транс ізомерів може бути виконане звичайними способами, наприклад, фракційною кристалізацією, хроматографією або ВЕРХ стереоізомерної суміші агента, що також може бути отриманий з відповідної оптично чистої проміжної сполуки, або розділенням, таким як за допомогою ВЕРХ, відповідного рацемату, використовуючи прийнятний хіральний носій, або фракційною кристалізацією діастереоізомерних солей, утворених взаємодією відповідного рацемату з прийнятною оптично активною кислотою або основою, залежно від ситуації. Крім того, деякі кристалічні форми сполук формули (І) можуть існувати в поліморфних модифікаціях, що включені в даний винахід. Одна форма може мати перевагу над іншою формою, наприклад, одна форма може бути більш стабільна в порівнянні з іншою формою. Повинно бути зрозуміло, що даний винахід включає будь-яке сполучення конкретних варіантів здійснення й охоплює всі сполучення конкретних замісників, описаних у даному описі вище. По всьому даному опису і прикладених пунктах формули винаходу, слова «включати» і «містити» і варіанти, такі як «включає», «включаючи», «містить», «що містить», повинні розумітися як включаючи. Тобто, якщо контекст дозволяє, ці слова призначені для передачі можливого включення інших, конкретно не описаних, елементів або цілих чисел. Використовуваний у даному описі термін «алкіл» (коли використовується як група або як частина групи) відноситься до прямого або розгалуженого вуглеводневого ланцюга, якщо не зазначено інше, що містить визначену кількість атомів вуглецю. Наприклад, С3-6алкіл позначає прямий або розгалужений вуглеводневий ланцюг, що містить щонайменше 3 і максимально 6 атомів вуглецю. Приклади алкілу, як використовується в даному описі, включають, але ними не обмежуються, метил (Me), етил (Et), н-пропіл і ізопропіл. Використовуваний у даному описі термін «алкілен» позначає як прямий, так і розгалужений насичений або ненасичений ланцюг, або циклічні насичені вуглеводневі єднальні групи. Приклади алкіленових груп включають метилен (-СН2-), етилен (-СН2СН2-), етен (-СН=СН-) або циклопропілен, тощо. Наприклад, як використовується в даному описі, -(алкілен)пг, коли m дорівнює 3, являє собою -(СН2)3-, -С(СН3)2-, -СН2СН=СН- або циклопропілен-, тощо. Наприклад, як використовується в даному описі, -(алк)m-, у тих випадках, коли т дорівнює 4, являє собою -(СН2)4-, -СН2С(СН3)2-, СН2СН=СНСН2- або -СН2циклопропілен-, тощо. Наприклад, як використовується в даному описі, (алкілен)n, у тих випадках, коли n=1, позначає 95780 10 СН2-. Як використовується в даному описі, (алкілен)n, коли n=0, позначає, що в цьому положенні відсутній алкіленовий сполучний агент. Використовуваний у даному описі термін «алкеніл» відноситься до прямого або розгалуженого вуглеводневого ланцюга, що містить визначене число атомів вуглецю, який містить один або кілька подвійних зв'язків. Використовуваний у даному описі термін «алкініл» відноситься до прямого або розгалуженого вуглеводневого ланцюга, що містить визначену кількість атомів вуглецю, який містить один або кілька потрійних зв'язків. Використовуваний у даному описі термін «циклоалкіл» відноситься до насиченого моноциклічного вуглеводневого кільця з 3-8 атомів вуглецю. Приклади таких груп включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил. Використовуваний у даному описі термін «циклоалкеніл» відноситься до ненасиченого неароматичного моноциклічного вуглеводневого кільця з 3-8 атомів вуглецю, що містить один або декілька вуглець-вуглець подвійних зв'язків. Приклади таких груп включають циклопропеніл, циклобутеніл, циклопентеніл, циклогексеніл, циклогептеніл, циклооктеніл тощо. Використовуваний у даному описі термін «арил» відноситься до С6-12моноциклічного, біциклічного або трициклічного вуглеводневого кільця, де щонайменше одне кільце є ароматичним. Приклади таких груп включають феніл, нафтил або тетрагідронафталеніл, тощо. Використовуваний у даному описі термін «гетероарил» відноситься до 5-6 членного моноциклічного ароматичного кільця або конденсованого 810 членного біциклічного ароматичного кільця, що містить 1-4 гетероатоми, незалежно обраних, кожний, з атома кисню, азоту і сірки. Може бути один або декілька необов'язкових оксо замісників атомів вуглецю на кільці. Приклади таких моноциклічних ароматичних кілець включають тієніл, фурил, фуразаніл, пірроліл, триазоліл, тетразоліл, імідазоліл, оксазоліл, тіазоліл, оксадіазоліл, ізотіазоліл, ізоксазоліл, тіадіазоліл, піраніл, піразоліл, піримідил, піридазиніл, піразиніл, піридил, триазиніл, тетразиніл тощо. Приклади таких конденсованих ароматичних кілець включають хінолінил, ізохінолінил, хіназолінил, хіноксалінил, птеридиніл, ціннолінил, фталазиніл, нафтиридиніл, індоліл, ізоіндоліл, азаіндоліл, індолізиніл, індазоліл, пуриніл, пірролопіридиніл, фуропіридиніл, бензофураніл, ізобензофураніл, бензотієніл, бензоімідазоліл, бензоксазоліл, бензоізоксазоліл, бензотіазоліл, бензоізотіазоліл, бензоксадіазоліл, бензотіадіазоліл тощо. Використовуваний у даному описі термін «гетероцикліл» відноситься до 4-7 членного моноциклічного кільця або конденсованого 8-12 членного біциклічного кільця, що може бути насиченим або частково ненасиченим, що містить 1-4 гетероатоми, незалежно обраних, кожен, з кисню, азоту або сірки. У кільці можуть бути один або декілька необов'язкових оксо замісників атомів вуглецю. Приклади таких моноциклічних кілець включають пір 11 ролідиніл, азетидиніл, піразолідиніл, оксазолідиніл, піперидиніл, піперазиніл, морфолініл, тіоморфолініл, тіазолідиніл, гідантоїніл, валеролактаміл, оксираніл, оксетаніл, діоксоланіл, діоксаніл, оксатіоланіл, оксатіаніл, дитіаніл, дигідрофураніл, тетрагідрофураніл, дигідропіраніл, тетрагідропіраніл, тетрагідропіридиніл, тетрагідропіримідиніл, тетрагідротіофеніл, тетрагідротіопіраніл, діазепаніл, азепаніл тощо. Приклади таких біциклічних кілець включають індолініл, ізоіндолініл, бензопіраніл, хінуклідиніл, 2,3,4,5-тетрагідро-1Н-3-бензазепін, тетрагідроізохінолініл тощо. Використовувані в даному описі терміни «галоген» або «гало» відносяться, наприклад, до атома фтору, хлору, брому або йоду. Використовуваний у даному описі термін «С16галогеналкіл» відноситься до С1-6алкільної групи, як визначено в даному описі, де щонайменше один атом водню замінений галогеном. Приклади таких груп включають фторетил, трифторметил, трифторетил тощо. Як використовується в даному описі, у випадку, коли група вказується як «заміщена» іншою групою або має «один або кілька замісників», якщо не визначене конкретне положення для такого заміщення, повинно бути зрозуміло, що заміщення може мати місце в будь-якому положенні в групі. Використовуваний у даному описі термін «фармацевтично прийнятне похідне» відноситься до будь-якого фармацевтично прийнятного похідного сполуки за даним винаходом, наприклад, до солі, сольватів або складних ефірів, яке при введенні ссавцеві, такому як людина, здатне забезпечити (безпосередньо або побічно) таку сполуку або її активний метаболіт. Такі похідні очевидні для фахівця в даній галузі без проведення додаткових експериментів, дивися огляд в Burger's Medicinal Chemistry And Drug Discovery, 5th Edition, Vo 1: Principles and Practice, включений у даний документ як посилання. Використовуваний у даному описі термін «фармацевтично прийнятний», використовуваний у відношенні інгредієнта (активний інгредієнт, розріджувач, наповнювач або носій), що може бути включений у фармацевтичну композицію для введення пацієнтові, відноситься до інгредієнта, що є прийнятним у розумінні сумісності з будь-якими іншими інгредієнтами, які є присутніми у фармацевтичній композиції, і не є шкідливим для реципієнта. Використовуваний у даному описі термін «сольват» відноситься до сполук з різною стехіометрією, утвореними розчиненою сполукою (у цьому винаході, сполука формули (І) або її фармацевтично прийнятне похідне) і розчинником. Такі розчинники для цілей за даним винаходом не можуть перешкоджати біологічній активності розчину. Використовуваним розчинником може бути фармацевтично прийнятний розчинник. Приклади придатних фармацевтично прийнятних розчинників включають воду, етанол і оцтову кислоту. Прикладом використовуваного розчинника є вода, при цьому сольватом може називатися гідрат розглянутої розчиненої сполуки. 95780 12 Варто враховувати той факт, що для фармацевтичного застосування зазначені вище «сіль або сольват» будуть являти собою фармацевтично прийнятну сіль або сольват. Однак можуть знайти застосування й інші солі або сольвати, наприклад, при одержанні сполуки формули (І) або при одержанні її фармацевтично прийнятної солі або сольвату. Фармацевтично прийнятні солі включають солі, описані Berge, Bighley and Monkhouse, J. Pharm. Sci., 1977, 66, 1-19. Придатні фармацевтично прийнятні солі включають солі лужного металу, утворені додаванням основ лужного металу, таких як гідроксиди лужного металу. Приклади придатних солей лужного металу включають солі натрію і солі калію. Інші придатні фармацевтично прийнятні солі включають солі лужноземельного металу, такі як солі кальцію і солі магнію, солі амонію; або солі органічних основ, таких як етаноламін, триетаноламін, етилендіамін, триетиламін, холін і меглумін; або солі амінокислот, таких як аргінін, лізин і гістидин. Складні ефіри можуть бути активними самі по собі і/або бути такими, що гідролізуються в умовах in vivo в організмі людини. Придатні фармацевтично прийнятні складноефірні групи, що гідролізуються in vivo, включають групи, що розкладаються в організмі людини з одержанням вихідної кислоти або її солі. Складний ефір може бути утворений групою карбонової кислоти (-С(О)ОН), способами, добре відомими в даній галузі, включаючи реакції з відповідним спиртом. Наприклад, складні ефіри можуть являти собою складні С1-6алкілові ефіри, наприклад, складні метилові ефіри, складні етилові ефіри тощо. Використовуваний у даному описі термін «сполуки за винаходом» позначає сполуки відповідно до формули І і їх фармацевтично прийнятні похідні. Термін «сполука за винаходом» позначає будь-яку сполуку за винаходом, як визначено вище. Використовуваний у даному описі термін «щонайменше один хімічний об'єкт» позначає щонайменше одну хімічну речовину, обрану з групи сполук, що складається зі сполук формули І і їх фармацевтично прийнятних похідних. В одному з аспектів даного винаходу запропонований по суті кристалічний 3-бутил-8-хлор-1-{4[5-(2-піридиніл)-1,2,4-оксадіазол-3-іл]бутил}-3,7дигідро-1Н-пурин-2,6-діон форми 1. В іншому аспекті за винаходом запропонований по суті кристалічний 3-бутил-8-хлор-1-{4-[5-(2-піридиніл)-1,2,4оксадіазол-3-іл]бутил}-3,7-Дигідро-1Н-пурин-2,6діон форми 2. Був проведений термічний аналіз зразків по суті кристалічного 3-бутил-8-хлор-1-{4-[5-(2піридиніл)-1,2,4-оксадіазол-3-іл]бутил}-3,7-дигідро1Н-пурин-2,6-діону форми 1 і форми 2. Таким чином, запропонований по суті кристалічний 3-бутил8-хлор-1-{4-[5-(2-піридиніл)-1,2,4-оксадіазол-3іл]бутил}-3,7-дигідро-1Н-пурин-2,6-діон (форма 1 або форма 2), що має точку початку плавлення, визначену за допомогою ДСК (диференціальна скануюча калориметрія) (± 0,5°С): 160°С або вище і 147°С або вище, відповідно. 13 Зразки по суті кристалічного 3-бутил-8-хлор-1{4-[5-(2-піридиніл)-1,2,4-оксадіазол-3-іл]бутил}-3,7дигідро-1Н-пурин-2,6-діону форми 1 і 3-бутил-8хлор-1-{4-[5-(2-піридиніл)-1,2,4-оксадіазол-3іл]бутил}-3,7-дигідро-1Н-пурин-2,6-діону форми 2, отримані як описано в даному описі далі, давали порошкові рентгенограми, представлені на фігурах 1-2. Дифракційна рентгенограма індивідуальна для кристалічної форми. По суті кристалічні форми демонструють дифракційні рентгенограми з індивідуальним набором дифракційних піків, що можуть бути виражені в 2 тета кутах (°). 2 Тета кути дифракції визначають положення різних піків на рентгенограмі. Невеликі відхилення в 2 тета кутах, які спостерігаються, можливо залежать від конкретно використовуваного дифрактометру і способу одержання дослідником зразка. По суті кристалічні форми 3-бутил-8-хлор-1-{4[5-(2-піридиніл)-1,2,4-оксадіазол-3-іл]бутил}-3,7дигідро-1Н-пурин-2,6-діону можуть бути визначені наявністю характерного піку 2 тета кута, або множинних 2 тета кутів, які достовірно характеризують конкретні кристалічні форми. При ідентифікації по суті кристалічного 3-бутил-8-хлор-1-{4-[5-(2піридиніл)-1,2,4-оксадіазол-3-іл]бутил}-3,7-дигідро1Н-пурин-2,6-діону (форма 1) ці піки є в наступних положеннях, виражених у 2 тета кутах (±0,1 градусів): 5,4, 6,7, 9,7, 11,1, 12,9, 14,0, 15,6, 16,3, 16,7, 23,1 градусів. При ідентифікації по суті кристалічного 3-бутил-8-хлор-1-{4-[5-(2-піридиніл)-1,2,4оксадіазол-3-іл]бутил}-3,7-дигідро-1Н-пурин-2,6діону (форма 2) ці піки є в наступних положеннях, виражених у 2 тета кутах (±0,1 градусів): 5,2, 6,6, 10,4, 11,2, 13,4, 15,6, 18,1, 19,5, 20,9 градусів. В одному з варіантів здійснення, щонайменше один з вищевказаних 2 тета кутів використовується для визначення форми 1 по суті кристалічного 3-бутил8-хлор-1-{4-[5-(2-піридиніл)-1,2,4-оксадіазол-3іл]бутил}-3,7-дигідро-1Н-пурин-2,6-діону і форми 2 по суті кристалічного 3-бутил-8-хлор-1-{4-[5-(2піридиніл)-1,2,4-оксадіазол-3-іл]бутил}-3,7-дигідро1Н-пурин-2,6-діону. В інших варіантах здійснення, щонайменше 2, 3, 4 або 5 (у тих випадках, коли прийнятно) з вищевказаних 2 тета кутів використовуються для визначення форми 1 по суті кристалічного 3-бутил-8-хлор-1-{4-[5-(2-піридиніл)-1,2,4оксадіазол-3-іл]бутил}-3,7-дигідро-1Н-пурин-2,6діону, форми 2 по суті кристалічного 3-бутил-8хлор-1-{4-[5-(2-піридиніл)-1,2,4-оксадіазол-3іл]бутил}-3,7-дигідро-1Н-пурин-2,6-діону. Деяка припустима межа погрішності присутня в кожному визначенні 2 тета кута. Межа погрішності у вищевказаних 2 тета кутах приблизно дорівнює ±0,1 градусів для кожного з вищевказаних пікових визначень. Оскільки деяка припустима межа погрішності можлива у визначенні 2 тета кутів, кращий спосіб порівняння порошкових рентгенограм, для ідентифікації конкретної кристалічної форми, являє собою накладення порошкової рентгенограми невідомої форми на порошкову рентгенограму відомої форми. Наприклад, фахівець у даній галузі може накласти порошкову рентгенограму неідентифікованої форми 3-бутил-8-хлор-1-{4-[5-(2-піридиніл)1,2,4-оксадіазол-3-іл]бутил}-3,7-дигідро-1Н-пурин 95780 14 2,6-діону, отриманої способами, описаними в даному описі, наприклад, дивися фігуру З, І легко визначити, чи є дифракційна рентгенограма неідентифікованої форми в основному аналогічною порошковій рентгенограмі форми 1 або 2 по суті кристалічного 3-бутил-8-хлор-1-{4-[5-(2-піридиніл)1,2,4-оксадіазол-3-іл]бутил}-3,7-дигідро-1Н-пурин2,6-діону. Якщо порошкова рентгенограма є в основному аналогічною показаній на будь-якій з фігур 1-2, вищевказана форма може бути легко і точно визначена. Використовуваний у даному описі термін «по суті кристалічна форма» позначає, що вона по суті позбавлена аморфної форми 3-бутил-8-хлор-1-{4[5-(2-піридиніл)-1,2,4-оксадіазол-3-іл]бутил}-3,7дигідро-1Н-пурин-2,6-діону. Термін «по суті вільний» позначає вміст аморфної форми менше, ніж 50%, в одному аспекті менше, ніж 20% аморфної форми, в іншому аспекті менше, ніж 10% аморфної форми, в іншому аспекті менше, ніж 5% аморфної форми, в іншому аспекті менше, ніж 2% аморфної форми, в іншому аспекті менше, ніж 1% аморфної форми. Даний винахід відноситься до способу одержання форми по суті кристалічного 3-бутил-8хлор-1-{4-[5-(2-піридиніл)-1,2,4-оксадіазол-3іл]бутил}-3,7-дигідро-1Н-пурин-2,6-діону, як описано в даному описі. Сполуки формули (І) володіють потенційним терапевтичним ефектом у лікуванні і зменшенні інтенсивності симптомів безлічі захворювань ліпоїдного обміну, включаючи дисліпідемію і гіполіпопротеїнемію, таку як діабетична дисліпідемія і змішана дисліпідемія, серцеву недостатність, гіперхолестеринемію, серцево-судинне захворювання, включаючи атеросклероз, артеріосклероз, і гіпертригліцеридемію, цукровий діабет по типу II, діабет по типу І, резистентність до інсуліну, гіперліпідемію, нервову анорексію, ожиріння. Самі по собі, сполуки можуть також бути ефективними в терапії захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності, захворювання периферичних судин та інсульту. Було зроблене повідомлення, що рецептори НМ74 і НМ74А беруть участь у запальному процесі (WO02084298). Запалення являє собою групу судинних, клітинних та нейролігічних реакцій на травму. Запалення може характеризуватися як рух клітин запалення, таких як моноцити, нейтрофіли і гранулоцити, у тканині. Це звичайно пов'язане з ослабленою функцією ендотеліального бар'єра і набряком тканин. Запалення, яке стосується захворювання, звичайно називається хронічним запаленням. Таке хронічне запалення може виявляти себе за допомогою симптомів захворювання. Таким чином, метою протизапальної терапії є ослаблення цього хронічного запалення і забезпечення розвитку фізіологічного процесу видужання і відновлення тканин. Приклади запальних захворювань або станів, для лікування яких можуть застосовуватися сполуки за даним винаходом, включають захворювання або стани суглобів, наприклад, артрит (наприклад, ревматоїдний артрит, остеоартрит, простетичне ураження суглобів), або шлунково-кишкового трак 15 ту (наприклад, виразковий коліт, хвороба Крона й інші запальні захворювання кишечнику і шлунковокишкового тракту, гастрит і запалення слизової оболонки внаслідок ураження інфекцією, інтеропатія, викликана застосуванням нестероїдних протизапальних препаратів), легені (наприклад, синдром розладу дихання у дорослих, астма, кістозний фіброз або хронічне деструктивне захворювання легені), серця (наприклад, міокардит), нервової тканини (наприклад, розсіяний склероз), підшлункової залози, (наприклад, запалення, пов'язане з цукровим діабетом і його ускладненнями), нирок (наприклад, гломерулонефрит), шкіри (наприклад, дерматит, псоріаз, екзема, кропивниця, опік), очей (наприклад, глаукома), а також трансплантованих органів (наприклад, відторгнення) і синдром поліорганної недостатності (наприклад, системний еритематозний вовчак, сепсис) і запальне ускладнення внаслідок ураження вірусною або бактеріальною інфекцією, і запальні стани, пов'язані з атеросклерозом і наступним гіпоксичним або ішемічним інсультами (з або без реперфузії), наприклад, головного мозку або при ішемічному захворюванні серця. В одному з варіантів здійснення, сполуки за винаходом застосовують у лікуванні і профілактиці запалення, діабетів і серцево-судинних захворювань або станів, включаючи атеросклероз, артеріосклероз, гіпертригліцеридемію і змішану дисліпідемію. Нікотинова кислота має профіль значного побічного ефекту, ймовірно через високий рівень дозування (декілька грамів на добу). Найбільш розповсюдженим побічним ефектом є сильна шкірна гіперемія. У деяких варіантах здійснення даного винаходу сполуки можуть демонструвати знижені побічні ефекти в порівнянні з нікотиновою кислотою. НМ74А був ідентифікований як рецептор з високою спорідненістю до нікотинової кислоти, у той час як НМ74 являє собою рецептор з більш низькою спорідненістю. Сполуки за даним винаходом демонструють більш високу спорідненість до НМ74А, ніж до НМ74, і тому можуть застосовуватися як селективні агоністи НМ74А або часткові агоністи. Можливості сполук формули (І) активувати НМ74А можуть бути показані, наприклад, використовуючи наступні in vitro аналізи в цілісній клітині: Аналіз in vitro Для тимчасової трасфекції клітини НЕК293Т (клітини НЕК293, які стабільно експресують великий Т-антиген SV40) підтримували в DMEM, що містить 10% фетальної телячої сироватки і 2 мМ глютаміну. Клітини висівали в 90 мм чашки для культивування і вирощували до конфлюентності 60-80% (18-24 години) перед трансфекцією. НМ74А людини (GenBank™ номер доступу AY148884) субклонували в експресуючий вектор ссавця (pcDNA3; Invitrogen) і трансфікували, використовуючи реагент Lipofectamin™. Для трансфекції 9 мкг ДНК змішували з 30 мкл Lipofectamina в 0,6 мл Opti-MEM (Life Technologies Inc.) та інкубували при кімнатній температурі протягом 30 хвилин перед додаванням 1,6 мл Opti-MEM. Клітини обробляли сумішшю Lipofectamin/ДНК протягом 5 95780 16 годин і потім додавали 6 мл 20% (об'єм/об'єм) фетальної телячої сироватки в DMEM. Клітини збирали через 48 годин після трансфекції. Здійснювали обробку токсином коклюшу, додаючи в -1 середовище в кількості 50 нгмл протягом 16 годин. При всіх дослідженнях тимчасової трансфекції проводили котрансфекцію рецептора і G-білка Gi/0, G01α. Для одержання стабільної клітинної лінії описаний вище спосіб використовували для трансфекції клітин СНО-K1, які висівали в шести-лункові планшети з ростом до конфлюентності 30%. Ці клітини підтримували в середовищі DMEM-Ham F12 (доступне від Invitrogen), що містить 10% фетальної телячої сироватки і 2 мМ глютаміну. Через 48 годин після трансфекції в середовище додавали 400 мкг/мл генетицину (G418, Gibco) для відбору клітин, стійких до антибіотику, Клоновані клітинні лінії СН0-K1, які стабільно експресують НМ74А, підкріплювали за допомогою зв'язування з 35 [ S]-GTPγS, після додавання нікотинової кислоти. Препарат мембран Р2 - Дисперсійні фракції, що містять плазматичні мембрани Р2, одержували з клітинних мас, заморожених при -80°С після збору клітин. Усі процедури здійснювали при 4°С. Клітинні осади ресуспендували в 1 мл 10 мМ Tris-HCI і 0,1 мМ EDTA, рН 7,5 (буфер А) і гомогенізували протягом 20 с на Ultra Turrax з наступним пропусканням (5 разів) через голку 25 розміру. Клітинні лізати центрифугували при 1000 g протягом 10 хвилин у мікроцентрифузі з осадженням ядер і незруйнованих клітин і дисперсійні фракції Р2 відновлювали мікроцентрифугуванням при 16000 g протягом 30 хвилин. Дисперсійні фракції Р2 ресуспендували в буфері А і зберігали при -80°С перед аналізом. 35 Аналіз зв'язування з [ S]-GTPγS здійснювали при кімнатній температурі в 384-лунковому форматі на основі способів, описаних раніше (Wieland, Т. and Jakobs, K.H. (1994) Method Enzymol. 237, 313). Коротко, здійснювали розведення стандарту або досліджуваних сполук і додавали в 384лунковий планшет в об'ємі 10 мкл. Мембрани (НМ74А або НМ74) розводили в аналітичному буфері (20 мМ HEPES, 100 мМ NaCI, 10 мМ МgСІ2, рН 7,4), в який додатково додавали сапонін (60 мкг/мл), частинок Leadseeker WGA (Amersham; 250 мкг/лунка) і 10 мкМ GDP, таким чином, у кожну лунку, що містить 5 мкг мембран, додавали об'єм 35 20 мкл. [ S]-GTPγS (1170 Кі/ммоль, Amersham) розводили (1:1500) в аналітичному буфері й у кожну лунку додавали 20 мкл. Після додавання радіоліганду планшети герметизували, швидко центрифугували та інкубували протягом 4 годин при кімнатній температурі. Наприкінці періоду інкубування планшети зчитували на апараті Leadseeker (VIEWLUX PLUS; Perkin-Elmer) для визначення рівнів специфічного зв'язування. Ці аналізи деталізували, знижуючи кінцевий об'єм аналізу до 10 мкл. Для цього використовували уточнений протокол аналізу для 10 мкл. При цьому протоколі використовували тільки 100 нл стандартної або досліджуваної сполуки на лунку 384-лункової планшети і 1,5 мкг мембрани і 100 мкг частинок Leadseeker WGA. У випадку протоко 17 лу для маленького об'єму, мембрану, частинок і 35 [ S]-GTPγS змішували і потім 10 мкл цієї суміші розподіляли в кожну лунку. Інкубування і зчитування планшети були аналогічні аналізам для 10 мкл і 50 мкл. Усі сполуки прикладів досліджували в одному 35 або обох аналізах зв'язування [ S]-GTPγS, описаних вище (тобто в аналізах для 10 мкл і 50 мкл). Дані аналізували за допомогою креслення по точках кривої, використовуючи логістичне рівняння з чотирма параметрами, використовуючи програмне забезпечення ХС50 (у кожної кривої виключали максимум 2 точки). Специфічне зв'язування виражали як pEC50 і у вигляді % ефективності в порівнянні з максимальною відповіддю зв'язування нікотинової кислоти. Аналіз in vivo Сполуки за винаходом можна досліджувати на самцях пацюків Spague-Dawley (200-250 г), яких не годували щонайменше 12 годин перед дослідженням. Сполуки внутрішньовенно вводили з дозою або 1, або 3 мг/кг (5 мл/кг), або перорально з дозою в діапазоні від 1 до 30 мг/кг (10 мл/кг). Зразки крові (0,3 мл хвостової вени) брали перед введенням і три рази після введення сполук (час взяття коливався від 15 хвилин до 6 годин після введення сполуки). Кожен зразок крові переносили в пробірку з гепарином (Becton Dickinson Microtainer, PST LH) і центрифугували (10000 g протягом 5 хвилин) з одержанням зразка плазми. Зразки плазми аналізували на рівні неетерифікованих жирних кислот (NEFA), використовуючи комерційно доступний набір (Randox). Інгібування рівнів плазми NEFA, у порівнянні з рівнем до введення сполуки, використовували як замінник агоністичної активності НМ74А. Для визначення чи мають сполуки за винаходом активну відповідь, пов'язану з нікотиновою кислотою, їх вводили морським свинками. Самців морських свинок Dunkin Hartley (300-600 г; n=10-20 на групу) не годували протягом щонайменше 12 годин, але не більш ніж за 24 годин перед експериментом. Перед проведенням дослідження в кожної тварини брали зразки крові (0,5 мл) пункцією серця за оборотної анестезії (ізофлуран 3,5% з додаванням U2 (1 л/хв)). Вимір температури в усі проводили, поміщаючи в ліве вухо кожної тварини інфрачервоний температурний датчик. Вимір здійснювали з інтервалами в одну хвилину в період, починаючи за 5 хвилин до введення і закінчуючи 30 хвилинами після введення. Вимір температури потім проводили з 15-хвилинними інтервалами і закінчували через 2 години після введення. Тваринам вводили досліджувані сполуки за допомогою перорального зонда (5 мл/кг). Зразки крові (0,5 мл) брали пункцією серця під термінальною анестезією. Зразки крові в кожної тварини брали з одержанням даних на 0,5,1, 2, 3 і 4 годину після введення. Усі зразки крові поміщали в мішалку для крові на 5 хвилин, а потім зберігали на льоду до кінця експерименту. Після центрифугування (12000 g протягом 5 хвилин) плазму переносили в чисті пробірки і зберігали при -20°С до проведення аналізу з концентраціями NEFA. 95780 18 Деякі сполуки відповідно до формули (І) синтезували (дивися приклади синтезу нижче) і дослі35 джували в аналізах зв'язування [ S]-GTPγS, розглянутих вище. Деякі сполуки відповідно до формули (І), включаючи: 8-хлор-3-(3,3-диметилбутил)-1-[2(етилокси)етил]-3,7-дигідро-1Н-пурин-2,6-діон; використовували як проміжні сполуки в одержанні інших сполук відповідно до формули (І). Значення рЕС50 ілюстративних сполук (приклади 1-512) складали 4,3 (+/- 0,3 log одиниць) або більше, а ефективність в аналізі зв'язування з 35 [ S]-GTPγS, описаному вище, за допомогою якого їх досліджували, була 30% або більше (щодо нікотинової кислоти). Загальні способи очищення і розрахунку: РХ/МС: Спосіб Аналітичну ВЕРХ виконували на колонці Supelcosil™ ABZ+PLUS (Supelco) (3 мкМ, 3,3 см × 4,6 мм ВД (внутрішній діаметр)), елюючи 0,1% НСO2H і 0,01 Μ ацетатом амонію у воді (розчинник А), і 95% MeCN і 5% води (що містить 0,5% НСО2Н) (розчинник В), використовуючи наступний градієнт елюювання 0-0,7 хв 0%В, 0,7-4,2 хв 0100%В, 4,2-4,6 хвилин 100%В, 4,6-4,8 хв 1000%В при швидкості потоку рівного 3 мл/хв. УФ детектування на діодній матриці виконували в межах 215-330 нм. Мас-спектр (МС) реєстрували на мас-спектрометрі Waters ZQ, використовуючи способи позитивної іонізації електророзпилюван+ + ням [(ES+ve з одержанням МН і M(NH4) молекулярні іони] або негативної іонізації електророзпилюванням [(ES-ve з одержанням (М-Н) молекулярного іону]. Оцінювали тільки вихідний іон основних ізотопів. 1 Н ЯМР спектр реєстрували спектрометром Bruker DPX 400M Гц, використовуючи як еталон тетраметилсилан. Biotage™ хроматографія відноситься до очищення, виконуваного з використанням або системи очищення Flash 40і, або Flash 150i, придбаної у фірми Biotage AB, використовуючи картриджі, наповнені KPSil (оксид кремнію). Система Companion™ відноситься до системи очищення Teledyne Isco Combiflash Companion™. Це система очищення зі змінюваним градієнтом з УФ-детектуванням інтегральної, варіабельної довжини хвилі зі здатністю запуску автоматичного збору фракцій за допомогою порогу УФвипромінювання. Mass directed autoprep (MDAP) відноситься до способів, у яких речовину очищають високоефективною рідинною хроматографією, використовуючи або колонку Supelcosil™ ABZ + 5 мкМ (10 см × 20 мм внутрішній діаметр), або колонку Supelcosil™ ABZ + 10 мкМ (15 см × 30 мм внутрішній діаметр) з придатним градієнтом розчинника А: 0,1% НСО2Н у воді і розчинника В: 95% МеСІМ, 5% води (що містить 0,5% НСО2Н). Waters 2767 inject/collector запускають за допомогою MicroMass ZQ Mass Spectrometer при встановленні маси, що представляє інтерес (використовуючи програмне забезпечення Micromass MassLynx). 19 Препаративна ВЕРХ (Autoprep ВЕРХ або Autoprep) відноситься до способів, у яких речовину очищають високоефективною рідинною хроматографією на колонці Supelcosil™ ABZ + 5 мкМ (10 см × 21,2 мм внутрішній діаметр) з придатним градієнтом 0,1% НСО2Н у воді і MeCN (з 0,5% НСО2Н). Колектор фракцій Gilson 233 запускають при УФдетектуванні. SPE (екстракція твердої фази) відноситься до застосування поліетиленових картриджів, що наповнені сорбентом, використовуваним для очищення. Сорбент, що міститься в цих картриджах, буде точно визначений. Використовувані приклади представлені докладно нижче: С18 SPE відноситься до застосування картриджів, наповнених 40 мкМ С18 сорбентом на основі функціоналізованого оксиду кремнію (придбаний у фірми Varian Inc.). Сполуку завантажують, звичайно в співвідношенні 50:50 ДМСО/МеОН, на картридж, попередньо оброблений MeCN і урівноважений 5% MeCN у воді. Продукт елюють з придатним градієнтом 0,1% НСО2Н у воді і MeCN (0,5% НСО2Н). Амінопропіл SPE або колонка відноситься до застосування картриджів, наповнених 40 мкм - 120 мкм амінопропіл функціоналізованим оксидом кремнію (придбаний у фірми Varian Inc.). Сирий продукт звичайно завантажують в DCM/MeOH суміші на картридж, попередньо оброблений МеОН. Нейтральні комопненти елюють МеОН і/або DCM (3 або 4 об'єми колонки), а кислотні компоненти звичайно елюють елюентом, що містить частину АсОН (2-20%). Oasis™ Cartridges/Oasis™ SPE відносяться до SPE картриджів, наповнених полімерним сорбентом, виробленим фірмою Waters Corporation. Їх звичайно обробляють 3 колоночними об'ємами МеОН і врівноважують водою, перед завантаженням зразка. Солі і неорганічні речовини елюють водою, а продукт звичайно елюють МеОН або MeCN. Green House™ відноситься до 24 реакційної паралельної синтезаторної платформи, що доступна від RDT Ltd, UK. Як описано вище, сполуки формули (І) можуть знайти застосування в лікуванні людини або ветеринарії, наприклад, як активатори НМ74А, у лікуванні дисліпідемії і гіполіпопротеїнемії. Таким чином, інший варіант здійснення даного винаходу, відноситься до, щонайменше, однієї сполуки формули (І) або її фармацевтично прийнятного похідного, для застосування в лікуванні людини або ветеринарії, наприклад, у лікуванні розладів ліпоїдного обміну, включаючи дисліпідемію і гіполіпопротеїнемію, таку як діабетична дисліпідемія і змішана дисліпідемія, серцевої недостатності, гіперхолестеринемії, серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз, і гіпертригліцеридемію, цукровий діабет по типу II, діабет по типу І, резистентність до інсуліну, гіперліпідемію, нервову анорексію й ожиріння. Як такі, сполуки також передбачені для застосування в лікуванні захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової не 95780 20 достатності, захворювання периферичних судин та інсульту. Додатковий варіант здійснення даного винаходу відноситься до, щонайменше, однієї сполуки формули (І) або її фармацевтично прийнятного похідного, для застосування в одержанні лікарського засобу для лікування розладів ліпоїдного обміну, включаючи дисліпідемію і гіполіпопротеїнемію, таку як діабетична дисліпідемія і змішана дисліпідемія, серцевої недостатності, гіперхолестеринемії, серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз, і гіпертригліцеридемію, цукрового діабету по типу II, діабету по типу І, резистентності до інсуліну, гіперліпідемії, нервової анорексії, ожиріння. Як такі, сполуки також передбачені для застосування в лікуванні захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності, захворювання периферичних судин і інсульту. Буде прийнятий до уваги той факт, що посилання в даному описі на лікування поширюються і на профілактику, профілактику рецедиву й ослаблення симптомів, а також лікування визначених станів. Один з варіантів здійснення за винаходом відноситься до, щонайменше, однієї сполуки формули (І) або її фармацевтично прийнятного похідного, для застосування в лікуванні розладів ліпоїдного обміну, включаючи дисліпідемію і гіполіпопротеїнемію. Наприклад, застосування передбачає щонайменше одну сполуку формули (І) або її фармацевтично прийнятне похідне в лікуванні діабетичної дисліпідемії, змішаної дисліпідемії, серцевої недостатності, гіперхолестеринемії, цукрового діабету по типу II, діабету по типу І, резистентності до інсуліну, гіперліпідемії, нервової анорексії, ожиріння, захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності, інсульту і серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз і гіпертригліцеридемію. Повинно бути зрозуміло, що цей варіант здійснення даного винаходу включає будь-яке сполучення конкретних варіантів здійснення й охоплює всі сполучення конкретних замісників, описаних у даному описі вище, для сполук формули (І). Крім того, даний винахід відноситься до застосування щонайменше однієї сполуки формули (І) або її фармацевтично прийнятного похідного, в одержанні лікарського засобу для лікування запальних захворювань або станів суглоба, наприклад, артриту (наприклад, ревматоїдного артриту, остеоартриту, простетичного ураження суглоба), або шлунково-кишкового тракту (наприклад, виразкового коліту, хвороби Крона й інші запальні захворювання кишечнику і шлунково-кишкового тракту, гастриту і запалення слизової в результаті ураження інфекцією, інтеропатія, викликана застосуванням нестероїдних протизапальних препаратів), легені (наприклад, синдром розладу дихання в дорослих, астма, кістозний фіброз, або хронічне деструктивне захворювання легені), серця (наприклад, міокардит), нервової тканини (наприклад, розсіяний склероз), підшлункової залози, (наприклад, запалення, пов'язане з діабетом і його 21 ускладненнями), нирок (наприклад, гломерулонефрит), шкіри (наприклад, дерматит, псоріаз, екзема, кропивниця, опік), очей (наприклад, глаукома), а також трансплантованих органів (наприклад, відторгнення) і синдрому поліорганної недостатності (наприклад, системний еритематозний вовчак, сепсис), і запального ускладнення внаслідок ураження вірусною або бактеріальною інфекцією, і запальних станів, пов'язаних з атеросклерозом і наступним гіпоксичним або ішемічним інсультами (з або без реперфузії), наприклад, головного мозку або при ішемічному захворюванні серця. Додаткові або альтернативні варіанти здійснення відносяться до способу лікування стану людини або тварини, у тих випадках, коли предактивація рецептора НМ74 сприяє стану або в яких активація рецептора буде ефективною, метод якого включає введення зазначеній людині або тварині ефективної кількості щонайменше однієї сполуки формули (І) або її фармацевтично прийнятного похідного. Більш того, повинно бути зрозуміло, що цей варіант здійснення даного винаходу включає будьякі сполучення конкретних варіантів здійснення й охоплює всі сполучення конкретних замісників, описаних у даному описі вище для сполук формули (І). В одному з варіантів здійснення, даний винахід відноситься до способу лікування розладів ліпоїдного обміну, включаючи дисліпідемію і гіполіпопротеїнемію, таку як діабетична дисліпідемія і змішана дисліпідемія, серцевої недостатності, гіперхолестеринемії, серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз, і гіпертригліцеридемію, цукрового діабету по типу II, діабету по типу І, резистентності до інсуліну, гіперліпідемії, нервової анорексії й ожиріння, що включає введення зазначеній людині або тварині ефективної кількості щонайменше однієї сполуки формули (І) або її фармацевтично прийнятного похідного. Самі по собі, ці сполуки можуть також застосовуватися в способах лікування захворювання коронарних артерій, тромбозу, стенокардії, хронічної ниркової недостатності, захворювання периферичних судин та інсульту, що включають введення зазначеній людині або тварині ефективної кількості щонайменше однієї сполуки формули (І) або її фармацевтично прийнятного похідного. Кількість сполуки формули (І) або її фармацевтично прийнятного похідного, котре необхідне для досягнення бажаного біологічного ефекту буде, звичайно, залежати від деяких факторів, наприклад, способу введення і точного клінічного стану реципієнта. Звичайно, добова доза буде в межах 0,1 мг -1 г/кг, звичайно 0,1 - 100 мг/кг. Внутрішньовенна доза може бути, наприклад, у межах 0,01 мг - 0,1 г/кг, звичайно 0,01 мг -10 мг/кг, що може зручно вводитися вливанням від 0,1 мкг до 1 мг, у хвилину. Рідини для вливання, що придатні для цієї мети, можуть містити, наприклад, від 0,01 мкг до 0,1 мг, на мілілітр. Однократні дози можуть містити, наприклад, від 0,01 мкг до 1 г сполуки за винаходом. Таким чином, ампули для ін'єкцій можуть містити, наприклад, від 0,01 мкг до 0,1 г, і композиції для однократного перорального вве 95780 22 дення, такі як таблетки або капсули, можуть містити, наприклад, від 0,1 мг до 1 г, наприклад, від 5 мг до 50 мг. Сполука формули (І) або її фармацевтично прийнятне похідне може застосовуватися як сполука як така в лікуванні захворювання, у тих випадках, коли предактивація рецептора НМ74 сприяє захворюванню або в яких активація рецептора буде ефективною, приклад цього має місце бути в тому випадку, коли сполука за даним винаходом представлена з прийнятним носієм у формі фармацевтичної композиції. Носій повинний, обов'язково, бути прийнятним у сенсі сумісності з іншими інгредієнтами композиції і не повинний бути шкідливим для реципієнта. Носій може бути твердим або рідким, або як твердим, так і рідким, і може бути отриманий зі сполукою за винаходом у вигляді композиції для однократного прийому, наприклад, таблетки, що може містити від 0,05% до 95% за масою сполуки за винаходом. Композиції включають ці придатні для перорального, ректального, місцевого, трансбукального (наприклад, під'язичного) і парентерального (наприклад, підшкірного, внутрішньом'язового, внутрішньошкірного або внутрішньовенного) способу введення. Також винахід відноситься до способу одержання такої фармацевтичної композиції, що включає перемішування інгредієнтів. Композиції, придатні для перорального введення, можуть бути представлені в дискретних одиницях, таких як капсули, каші, пастилки або таблетки, що містять, кожна, визначену кількість сполуки формули (І) або її фармацевтично прийнятного похідного; у вигляді порошку або гранул; у вигляді водного або неводного розчину або суспензії; або у вигляді емульсії олія-в-воді або вода-в-олії. Звичайно, композиції одержують рівномірним і безпосереднім змішуванням сполуки формули (І) або її фармацевтично прийнятного похідного з рідким або дрібно здрібненим твердим носієм, або з обома, і потім, якщо необхідно, надаванням форми продукту. Наприклад, таблетка може бути отримана пресуванням або формуванням порошку або гранул сполуки формули (І) або її фармацевтично прийнятного похідного, необов'язково з одним або декількома додатковими інгредієнтами. Пресовані таблетки можуть бути отримані пресуванням, у відповідному апараті, сполуки в легкосипучій формі, такій як порошок або гранули, необов'язково змішані зі зв'язувальним, змащувальним, інертним розріджувачем і/або поверхневоактивним/диспергуючим агентом(ами). Формовані таблетки можуть бути отримані формуванням, у відповідному апараті, порошкоподібної сполуки, зволоженої інертним рідким розріджувачем. Таблетки і капсули для перорального введення можуть містити звичайні наповнювачі, такі як сполучні агенти, наприклад, сироп, гуміарабік, желатин, сорбіт, трагакант, клей на основі крохмалю або полівінілпірролідону; наповнювачі, наприклад, лактоза, мікрокристалічна целюлоза, цукор, кукурудзяний крохмаль, фосфат кальцію або сорбіт; речовини, що змащують, наприклад, стеарат магнію, стеаринова кислота, тальк, поліетиленгліколь 23 або оксид кремнію; розпушувачі, наприклад, картопляний крохмаль, натрій кроскармелоза або натрій крохмаль гліколят; або зволожувачі, такі як лаурилсульфат натрію. На таблетки може бути нанесене покриття способами, добре відомими в даній галузі. Рідкі препарати для перорального введення можуть бути у вигляді, наприклад, рідких або масляних суспензій, розчинів, емульсій, сиропів або еліксирів, або можутьбути представлені у вигляді сухого продукту для змішування перед застосуванням з водою або з іншим придатним носієм. Такі рідкі препарати можуть містити звичайні домішки, такі як суспендуючі агенти, наприклад, сироп сорбіту, метилцелюлоза, глюкозний/цукровий сироп, желатин, гідрокси метилцелюлоза, гідроксипропілметилцелюлоза, карбоксиметилцелюлоза, гель стеарату алюмінію або гідровані харчові жири; емульгуючі агенти, наприклад, лецитин, моно-олеат сорбітану або гуміарабік; неводні носії (які можуть включати харчові олії), наприклад, мигдальна олія, фракціонована кокосова олія, жирні складні ефіри, пропіленгліколь або етиловий спирт; або консерванти, наприклад, метил або пропіл п-гідроксибензоати або сорбінова кислота. Також препарати можуть містити буферізуючі солі, ароматизатори, барвники і/або підсолоджуючі агенти (наприклад, маніт), у залежності від ситуації. Препарати, придатні для трансбукального (під'язичного) способу введення, включають пастилки, що містять сполуки за винаходом, що знаходяться в ароматизованій основі, звичайно сахарозі та гуміарабіці або трагаканті, і пастилки, що містять сполуку за винаходом в інертній основі, такій як желатин і гліцерин або сахароза і гуміарабік. Препарати за даним винаходом, придатні для парентерального введення, містять стерильні водні препарати сполуки формули (І) або її фармацевтично прийнятного похідного, композиція може бути ізотонічною із кров'ю передбачуваного реципієнта. Ці препарати можуть вводитися внутрішньовенно, хоча введення може також бути ефективним за допомогою підшкірної, внутрішньом'язової або внутрішньошкірної ін'єкції. Такі препарати можуть бути зручно отримані шляхом змішування сполуки формули (І) або її фармацевтично прийнятного похідного з водою, і надання отриманого розчину стерильного та ізотонічного із кров'ю. Ін'єковані композиції за винаходом будуть звичайно містити від 0,1 до 5% вага/вага сполуки формули (І) або її фармацевтично прийнятного похідного. Таким чином, композиції за даним винаходом придатні для парентерального введення, що містять сполуку формули (І) або її фармацевтично прийнятне похідне можуть бути змішані для парентерального введення шляхом болюсного вливання або безперервної інфузії, і можуть знаходитися у формі для однократного прийому, наприклад, у формі ампул, пляшечок, невеликого об'єму інфузії або попередньо заповнених шприців, або в упакуваннях для багаторазового прийому з додаванням консерванту. Композиції можуть заповнювати такі форми у вигляді розчинів, суспензій або емульсій у водних або неводних носіях, і можуть містити 95780 24 агенти для одержання лікарських композицій, такі як антиоксиданти, буферні агенти, протимікробні агенти і/або агенти, які регулюють токсичність. Приклади композицій, придатних для перорального введення, включають композиції, що містять сполуку формули (І) або її фармацевтично прийнятне похідне, в 10% ДМСО і 90% гідрокарбонату натрію в стерильному сольовому розчині. Приклади композицій, придатних для внутрішньовенного введення включають композиції, що містять сполуку формули (І) або її фармацевтично прийнятне похідне, в 5% або 10% ДМСО і 95% або 90% гідрокарбонату натрію в стерильній воді. Альтернативно, терапевтично активний засіб може бути у формі порошку для змішування з придатним носієм, наприклад, стерильною, апірогенною водою, перед застосуванням. Сухі тверді форми можуть бути отримані наповненням стерильним порошком в асептичних умовах контейнерів або наповненням стерильного розчину в асептичних умовах кожного контейнера і ліофільним сушінням. Композиції, придатні для ректального введення, можуть бути представлені у вигляді свічок для однократного прийому. Вони можуть бути отримані змішуванням сполуки формули (І) або її фармацевтично прийнятного похідного з одним або декількома звичайними твердими носіями, наприклад, олія какао або гліцериди, з наступним надаванням форми отриманій суміші. Композиції, придатні для місцевого нанесення на шкіру, можуть бути отримані у формі мазі, крему, лосьйону, пасти, гелю, спрею, аерозолю або олії. Носії, що можуть бути використані, включають вазелін, ланолін, поліетиленгліколі, спирти і сполучення двох або більше цих речовин. Звичайно, концентрація сполуки формули (І), або її фармацевтично прийнятного похідного, дорівнює від 0,1 до 15% вага/вага композиції, наприклад, від 0,5 до 2%. При місцевому застосуванні, як використовується в даному описі, ми включаємо введення шляхом інсуфляції й інгаляції. Приклади різних типів препаратів для місцевого застосування включають мазі, креми, лосьйони, порошки, песарії, спреї, аерозолі, капсули або картриджі для застосування в інгаляторі або інсуфляторі, або краплі (наприклад, краплі для очей або для носа). Композиції мазей і крему можуть, наприклад, бути утворені на водній або масляній основі з додаванням придатних загущувачів і/або гелеутворюючих агентів, і/або розчинників. Такі основи можуть, таким чином, наприклад, включати воду і/або олію, таку як рідкий парафін або рослинна олія, така як арахісова олія або рицинова олія, або розчинник, такий як поліетиленгліколь. Загущувачі, що можуть застосовуватися, включають м'який парафін, стеарат алюмінію, цетостеариловий спирт, поліетиленгліколі, мікрокристалічний віск і бджолиний віск. Композиції лосьйонів можуть бути сформовані на водній або масляній основі, і також будуть звичайно містити один або декілька емульгуючих агентів, стабілізаторів, диспергаторів, суспендуючих агентів або загущувачів. 25 Порошки для зовнішнього застосування можуть бути утворені за допомогою будь-якої придатної порошкової основи, наприклад, тальку, лактози або крохмалю. Композиції крапель можуть бути отримані на водній або масляній основі, що також містять один або декілька диспергаторів, солюбілізуючі агенти або суспендуючі агенти. Композиції, які розпилюються, можуть бути отримані, наприклад, у вигляді водних розчинів або суспензій, або у вигляді аерозолей, що вивільняються з герметично закритих посудин, з використанням придатного газа-витиснювача, наприклад, дихлордифторметану, трихлорфторметану, дихлортетрафторетану, 1,1,1,2,3,3,3гептафторпропану, 1,1,1,2-тетрафторетану, вуглекислого газу або іншого придатного газу. Капсули і картриджі для застосування в інгаляторах або інсуфляторі, з, наприклад, желатину, можуть містити порошкову суміш сполуки за винаходом і придатну порошкову основу, таку як лактоза або крохмаль. Фармацевтичні композиції за винаходом можуть також застосовуватися в сполученні з іншими терапевтичними засобами, наприклад, у сполученні з іншими класами лікарських препаратів для лікування дисліпідемії (наприклад, статини, фібрати, смоли, що зв'язують жовчну кислоту, або нікотинова кислота). Сполуки за даним винаходом можуть застосовуватися в сполученні з одним або декількома іншими терапевтично активними засобами, наприклад, у сполученні з іншими класами лікарських препаратів для лікування дисліпідемії, такими як, інгібітори З-гідрокси-3-метилглутарил-коензим А редуктази (статини) або фібрати або смоли, що зв'язують жовчну кислоту, або нікотинова кислота. Таким чином, винахід відноситься, у наступному варіанті здійснення, до застосування такого сполучення в лікуванні захворювань у тих випадках, коли предактивація рецептора НМ74 сприяє захворюванню або в яких активація рецептора буде ефективною, і застосуванню щонайменше однієї сполуки формули (І) або її фармацевтично прийнятного похідного в одержанні лікарського засобу для комбінованої терапії розладів ліпоїдного обміну, включаючи дисліпідемію і гіполіпопротеїнемію, таку як діабетична дисліпідемія і змішана дисліпідемія, серцевої недостатності, гіперхолестеринемії, серцево-судинного захворювання, включаючи атеросклероз, артеріосклероз, і гіпертригліцеридемію, цукровий діабет по типу II, діабету по типу І, резистентності до інсуліну, гіперліпідемії, нервової анорексії й ожиріння. Коли сполуки за даним винаходом застосовуються в сполученні з іншими терапевтично активними засобами, сполуки вводяться або разом або роздільно, послідовно або одночасно будь-яким звичайним способом введення. Зазначені вище сполучення для зручності можуть бути представлені для застосування у формі 95780 26 фармацевтичної композиції, і в такий спосіб фармацевтичні засоби, що містять сполучення, як визначено вище, оптимально, разом з фармацевтично прийнятним носієм або наповнювачем, утворюють додатковий варіант здійснення за винаходом. Окремі компоненти таких сполучень можуть вводитися або разом, або роздільно, послідовно або одночасно в окремих або комбінованих фармацевтичних композиціях. При сполученні в одній композиції, буде враховуватися той факт, що два компоненти повинні бути стабільні і сумісні один з одним і іншими компонентами композиції і можуть бути об'єднані в композицію для введення. При роздільному одержанні, передбачається, що вони можуть бути об'єднані в будь-якій придатній композиції, способом, добре відомим у даній галузі, придатним для таких сполук. У випадку сполучення з другим терапевтичним засобом, активним проти того ж захворювання, доза кожного компонента може відрізнятися від дози, коли сполука застосовується окремо. Відповідні дози будуть легко визначені фахівцем у даній галузі. Таким чином, винахід стосується, у наступному варіанті здійснення, сполучення, що містить щонайменше одну сполуку формули (І) або її фармацевтично прийнятне похідне разом з іншим терапевтично активним засобом. Зазначене вище сполучення може бути зручно представлене для застосування у формі фармацевтичної композиції, і в такий спосіб фармацевтичні засоби, що містять сполучення, як визначено вище, разом з його фармацевтично прийнятним носієм, являють собою додатковий варіант здійснення за винаходом. Сполуки за даним винаходом та їх фармацевтично прийнятні похідні можуть бути отримані способами, описаними в даному описі далі, утворюючи додатковий варіант здійснення за винаходом. В одному з варіантів здійснення даний винахід відноситься до способу одержання сполук(и) формули (І) з відповідної вихідної речовини, наприклад, сполук(и) формули (II): (II) де РС=захисна група, де спосіб включає: (і) алкілування в N1 N7 захищеного ксантину; (іі) алкілування в N3 N7 захищеного ксантину; (ііі) галогенування в С8; і (iv) видалення захисної групи N7; у будь-якому порядку, що забезпечує видалення захисної групи після алкілування. 27 95780 28 Спосіб 1: Спосіб одержання за винаходом сполук(и) формули (І), де R1 включає гетероцикліл, гетероарил або арил, і R1 являє собою СІ. і) Алкілування гуаніну алілбромідом іі) Діазотування нітритом натрію з наступним гідролізом з утворенням ксантину ііі) Хлорування iv) Алкілування в N3 (приклади придатних основ включають Nа2СО3, Cs2CO3, K2СО3) ν) Алкілування в N1 (приклади придатних основ включають Nа2СО3, Cs2CO3, K2СО3) vi) Каталізоване паладієм видалення алільної групи де L являє собою групу, що видаляється, наприклад, галоген. Спосіб 2: Спосіб одержання за винаходом проміжних сполук, де R1 включає амід, карбамат або сечовину, що можуть використовуватися для одержання сполук(и) формули (І). де L являє собою групу, що видаляється, наприклад, галоген, d являє собою (m-1) (тобто d разом з попереднім метиленом=m), R являє собою -(алкілен)n-Y і Q може бути присутнім або може не бути присутнім, і, якщо є присутнім, то являє собою або О, або NR5. 29 95780 30 Спосіб 3: Спосіб одержання проміжних сполук, у яких R1 включає 'зворотний' карбамат або складний ефір, що можуть використовуватися для одержання сполук(и) формули (І). де L являє собою групу, що видаляється, наприклад, галоген, d являє собою (m-1), і R являє собою -(алк)n-Y. Спосіб 4: Спосіб одержання за винаходом проміжних сполук, де R1 включає складний ефір або амід, що можуть застосовуватися для одержання сполук(и) формули (І). де L являє собою групу, що видаляється, наприклад, галоген, d являє собою (m-1), і R являє 5 7 5 собою NR R або -OR . 31 95780 32 Спосіб 5: Спосіб одержання за винаходом сполук(и) формули (І), де X включає піразол, імідазол або тетразол. де L являє собою групу, що видаляється, наприклад, галоген, d являє собою (m-1), і R являє собою -(алк)n-Y. де L являє собою групу, що видаляється, наприклад, галоген, d являє собою (m-1), R являє собою алкільну групу і R' являє собою -(алк)n-Y. Спосіб 6: Спосіб одержання за винаходом сполук(и) формули (І), в якій X включає оксадіазол. 33 95780 34 Спосіб 7: Спосіб одержання за винаходом сполук(и) формули (І), у якій X включає оксадіазол. де L являє собою групу, що видаляється, наприклад, галоген, d являє собою (m-1), R являє собою алкільну групу і R' являє собою -(алк)n-Y. Спосіб 8: Спосіб одержання за винаходом проміжних 3 сполук, де R являє собою CN, що можуть бути використані для одержання сполук(и) формули (І). Він включає стадії (і) і (іі) способу 1, і наступне: ііі) Алкілування в N3 iv) Алкілування в N1 ν) Утворення альдегіду в С8 літіюванням LiHMDS і гасінням ДМФ vi) Перетворення альдегіду в нітрил vii) Каталізоване паладієм видалення алільної групи де L являє собою групу, що видаляється. Спосіб 9: Спосіб одержання за винаходом сполук(и) фо3 рмули (І), у якій R являє собою СІ або Вr, що включає стадії (i)-(iv) способу 8, і наступне: і) Галогенування в С8, використовуючи NCS або NBS іі) Каталізоване паладієм видалення алільної групи 35 95780 36 Спосіб 10: Спосіб одержання за винаходом сполук(и) фо3 рмули (І), у якій R являє собою СІ, що включає: і) Алкілування в N3 іі) Алкілування в N1 ііі) Дебензилування ііі) Хлорування в С8 де L являє собою групу, що видаляється Спосіб 11: Спосіб одержання за винаходом сполук(и) фо1 2 3 рмули (І), у якій R відрізняється від R , і R являє собою СІ, що включає стадії (i)-(v) способу 1 (у тих 2 випадках, коли R зі способу 1 являє собою зокрема SEM або MEM) і наступне: vi) видалення MEM або SEM захисної групи vii) Алкілування N3 з наступним каталізованим паладієм видаленням алільної групи де L являє собою групу, що видаляється Спосіб 12: Спосіб одержання за винаходом сполук(и) фо3 рмули (І), у якій R являє собою СІ, Вr або І, що включає стадії (i)-(iv) способу 8, і наступне: ν) Каталізоване паладієм видалення алільної групи vi) Галогенування в С8, використовуючи NCS, NBS або NIS 37 95780 38 Спосіб 13: Спосіб одержання за винаходом сполук(и) формули (І) який включає: і) Утворення піримідиндіону іі) Алкілування в N1 ііі) Нітрозування iv) Відновлення з використанням Ма2S2O4 або аналогічного агента, що відновлює ν) Утворення ксантину vi) Галогенування в С8 з використанням NCS де L являє собою групу, що видаляється Спосіб 14: Спосіб одержання за винаходом сполук(и) формули (І): де L являє собою групу, що видаляється. Як додаткову стадію до загальних способів, описаних вище, і, зокрема, для використання в одержанні прикладів, описаних нижче, існує кілька способів очищення одержуваних сполук, один або декілька з яких можуть бути використані в даному винаході, наприклад, використання MDAP, перекристалізація з одного або декількох придатних розчинників, таких як етилацетат, абсолютний етанол, ацетонітрил або метанол, або використання очисної колонки, наприклад картриджа Silica Redisep™, і наступне елюювання придатним розчинником, таким як дихлорметан, що містить етилацетат. У тих випадках, коли це бажано або необхідно, як кінцеву стадію кожного з вищевказаних способів синтезу, отриману сполуку формули (І) може бути застосоване перетворення у фармацевтично при йнятне похідне, наприклад, отримана сполука формули (І) може бути перетворена у форму солі, або навпаки, або перетворення однієї солі в іншу форму фармацевтично прийнятної солі. Ці способи добре відомі фахівцям у даній галузі. Скорочення АсОН Оцтова кислота atm Атмосфера br Широкий (ЯМР) CDI Карбонілдіімідазол d Дублет (ЯМР) DBAD Ди-трет-бутилазодікарбоксилат DCM Дихлорметан DIPEA Діізопропілетиламін ДМСО Диметилсульфоксид ДМФ Ν,Ν-Диметилформамід ЕtOАс Етилацетат ЕtOН Етанол 39 h година(и) ІРА Ізопропіловий спирт m Мультиплет (ЯМР) MDAP Mass directed autoprep MeCN Ацетонітрил MeOH Метанол хв Хвилина(и) NCS N-Хлорсукцинімід NBS N-бромсукцинімід NIS N-йодсукцинімід q Квартет (ЯМР) rt кімнатна температура RT Час утримування S Синглет (ЯМР) SPE картридж для екстрагування твердої фази t Триплет (ЯМР) ТФО Трифтороцтова кислота ТГФ Тетрагідрофуран DMEM Середовище, модифіковане по способу Дульбекко HEPES 4-(2-гідроксіетил)піперазин-1етансульфонова кислота LiHMDS Гексаметилдисиліламід літію Δ Нагрівання SEM 2-(триметилсиліл)етоксиметил MEM 2-метоксіетоксиметил Вос трет-бутоксикарбоніл ТНР тетрагідропіран Короткий опис фігур Фігура 1: Дані XRPD по суті кристалічного 3бутил-8-хлор-1-{4-[5-(2-піридиніл)-1,2,4-оксадіазол3-іл]бутил}-3,7-дигідро-1Н-пурин-2,6-діону форми 1. Фігура 2: Дані XRPD по суті кристалічного 3бутил-8-хлор-1-{4-[5-(2-піридиніл)-1,2,4-оксадіазол3-іл]бутил}-3,7-дигідро-1Н-пурин-2,6-діону форми 2. Фігура 3: Накладання даних XRPD для по суті кристалічного 3-бутил-8-хлор-1-{4-[5-(2-піридиніл)1,2,4-оксадіазол-3-іл]бутил}-3,7-дигідро-1Н-пурин2,6-діону форми 1 і форми 2. Наступні необмежуючі приклади ілюструють даний винахід: Приклади синтезу Необхідно відзначити, що визначення розташування (Z)-стереохімії в сполуках, описаних нижче, не було підтверджене експериментальними даними. Фахівець у даній галузі також визначить, що можливо взаємоперетворення між ізомерами Ε і Z. (Dondoni, Alessandro; Lunazzi, Lodovico; Giorgianni, Patrizia; Macciantelli, Dante. Carbonnitrogen rotational barrier as a stereochemical probe of benzamidoximes. Journal of Organic Chemistry (1975), 40(20), 2979-80). Приклад 1: 8-хлор-1-(3-{1-[(2-хлор-6фторфеніл)метил]-1Н-піразол-4-іл)пропіл)-3пентил-3,7-дигідро-1Н-пурин-2,6-діон а) 8-хлор-1-(3-{1-[(2-хлор-6-фторфеніл)метил]1Н-піразол-4-іл}пропіл)-3-пентил-3,7-дигідро-1Нпурин-2,6-діон 95780 40 8-хлор-3-пентил-7-(2-пропен-1-іл)-1-[3-(1Нпіразол-4-іл)пропіл]-3,7-дигідро-1Н-пурин-2,6-діон (61 мг, 0,15 ммоль) у сухому ДМФ (2 мл) перемішували з карбонатом натрію (64 мг, 0,6 ммоль) і 2хлор-6-фторбензил бромідом (134 мг, 0,6 ммоль) і нагрівали при 45°С протягом 18 годин в атмосфері азоту. Після охолодження до кімнатної температури суміш дегазували вакуумуванням і повторно подавали азот, і перемішували з тетракис(трифенілфосфін)паладіем(0) (35 мг, 0,303 ммоль) І морфоліном (0,13 мл) протягом 5,5 годин. Суміш розподіляли між ЕtOАс і 2М НСІ, органічну фазу відокремлювали й упарювали, і залишок очищали амінопропіловим SPE (5 г, промивання ТГФ-МеОН (1:1) потім чистим МеОН, і нарешті, елюючи DCM-MeOH (1:1), що містить 5% АсОН) з одержанням зазначеної в заголовку сполуки (57 мг) у вигляді твердої речовини. + РХ/МС: m/z 507 [МН] , RT 3,64 хв. b) 8-хлор-3-пентил-7-(2-пропен-1-іл)-1-[3-(1Нпіразол-4-іл)пропіл]-3,7-дигідро-1Н-пурин-2,6-діон 3-пентил-8-хлор-7-(2-пропен-1-іл)-3,7-дигідро1Н-пурин-2,6-діон (5 г, 16,86 ммоль) і 3-(1Нпіразол-4-іл)пропан-1-ол (2,12 г, 16,8 ммоль) перемішували в сухому ТГФ (150 мл) при 3°С. Додавали дибензил азодикарбоксилат (10,05 г, 33,7 ммоль), потім по краплинах додавали трифенілфосфін (8,83 г, 33,7 ммоль) у сухому ТГФ (70 мл). Суміш залишали нагріватися до кімнатної температури і перемішували протягом 18 годин. Додавали воду (1 мл) і розчинники упарювали. Залишок поміщали в Еt2О (200 мл), з якого кристалізували білу тверду речовину, в основному трифенілфосфін оксид, і відфільтровували. Фільтрат концентрували і додаткові побічні продукти кристалізували із суміші ефір-циклогексан. Фільтра^ що залишився, концентрували (19,2 г) і очищали на апараті Biotage™ (400 г), елюючи сумішшю ЕtOАсциклогексан (2:1) з одержанням зазначеної в заголовку сполуки у вигляді білої твердої речовини (2,89 г). + РХ/МС: m/z 405 [МН] , RT 3,19 хвилин. Наступні сполуки (таблиця 1) одержували способом, аналогічним описаному в прикладі 1, з відповідних бензилгалогенідів. 41 95780 42 Дані ЯМР для обраних прикладів з таблиці 1 Приклад 2: 8-хлор-3-пентил-1-(3-{1-[(2,4,6трифторфеніл)метил]-1Н-піразол-4-іл}пропіл)-3,7дигідро-1Н-пурин-2,6-діон 1 Н ЯМР (ДМСО-d6) δ: 0,85 (t, 3Н, J=7 Гц), 1,201,40 (m, 4H), 1,60-1,70 (m, 2H), 1,70-1,82 (m, 2H), 2,39 (t, 2H, J=8 Гц), 3,83-3,94 (m, 4H), 5,24 (s, 2H), 7,18-7,30 (m, 3Н), 7,57 (s, 1H). Приклад 6: 8-хлор-1-(3-{1-[(2,4дифторфеніл)метил]-1Н-піразол-4-іл}пропіл)-3пентил-3,7-дигідро-1Н-пурин-2,6-діон 8-хлор-3-пентил-7-(2-пропен-1-іл)-1-[3-(1Нпіразол-4-іл)пропіл]-3,7-дигідро-1Н-пурин-2,6-діон (81 мг, 0,2 ммоль) і карбонат натрію (85 мг, 0,8 ммоль) перемішували в сухому ДМФ (2 мл) з 2,4дифторбензил бромідом (166 мг, 0,8 ммоль) при 45°С протягом 18 годин. Суміш дегазували і перемішували з тетракис(трифенілфосфін)паладієм(0) (46 мг, 0,04 ммоль) і морфоліном (176 мг, 2 ммоль) при кімнатній температурі протягом 6 годин. Реак 43 95780 44 + ційну суміш обробляли й очищали за допомогою амінопропілового SPE (5 г, промивання сумішшю ТГФ-МеОН (1:1), потім чистим МеОН, елюючи сумішшю DCM-MeOH (1:1) з 5% доданим АсОН) з виходом зазначеної в заголовку сполуки (37,7 мг) у вигляді твердої речовини. РХ/МС: m/z 491 [МН] , RT 3,42 хв. Наступні сполуки (таблиця 1) одержували способом, аналогічним описаному в прикладі 6, з відповідних бензилгалогенідів. Дані ЯМР для обраних прикладів з таблиці 2 1 6 Приклад 6: Н ЯМР (d ДМСО) 0,85 (3Н, t, J=7 Гц), 1,21-1,34 (4Н, m), 1,58-1,68 (2Н, m), 1,71-1,80 (2Н, m), 2,41 (2Н, t, J=8 Гц), 3,84-3,93 (4H, m), 5,26 (2Н, s), 7,02-7,09 (1Н, m), 7,15-7,29 (2Н, m), 7,31 (1Н, s), 7,61 (1Η, s). Приклад 7: 8-хлор-3-пентил-1-{3-[1(фенілметил)-1Н-піразол-4-іл]пропіл}-3,7-дигідро1 1Н-пурин-2,6-діон; Н ЯМР (ДMCO-d6) δ: 0,87 (t, 3Н, J=7 Гц), 1,20-1,36 (m, 4H), 1,60-1,70 (m, 2H), 1,72-1,85 (m, 2H), 2,42 (t, 2H, J=8 Гц), 3,83-3,95 (m, 4H), 5,24 (s, 2H), 7,13-7,38 (m, 6H), 7,61 (s, 1H). 45 Приклад 11: 8-хлор-1-(3-{1-[(2хлорфеніл)метил]-1Н-піразол-4-іл)пропіл)-3пентил-3,7-дигідро-1Н-пурин-2,6-діон Одержували способом, описаним для 8-хлор1-(3-{1-[(2,4-дифторфеніл)метил]-1Н-піразол-4іл}пропіл)-3-пентил-3,7-дигідро-1Н-пурин-2,6-діону, приклад 6, але з 2-хлорбензил броміду (164 мг, 0,8 ммоль). Однак, для того, щоб виконати стадію видалення захисної групи, додатково додавали тетракис(трифенілфосфін)паладій(0) (40 мг) і морфолін (0,15 мл), і перемішування продовжували протягом ще 5,5 годин. Очищення за допомогою амінопропілового SPE, як описано вище, давало зазначену в заголовку сполуку у вигляді твердої речовини (42 мг). + РХ/МС: m/z 489 [МН] , RT 3,67 хв. Приклад 12: 3-бутил-8-хлор-1-(3-[1(фенілметил)-1Н-імідазол-4-іл]пропіл}-3,7-дигідро1Н-пурин-2,6-діон а) 3-бутил-8-хлор-1-{3-[1-(фенілметил)-1Німідазол-4-іл]пропіл}-3,7-дигідро-1Н-пурин-2,6-діон Розчин 3-бутил-8-хлор-1-[4-(1Н-імідазол-4іл)бутил]-7-(2-пропен-1-іл)-3,7-дигідро-1Н-пурин2,6-діону (300 мг, 0,77 ммоль) в безводному ТГФ (5 мл) обробляли бензилбромідом (144 мг, 0,84 ммоль) і DIPEA (147 мкл, 0,84 ммоль). Суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 4 днів. Суміш розподіляли між ЕtOАс і 2М НСІ (водний). Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували. Сирий продукт очищали на SPE колонці з силікагелем, використовуючи 0,5-5% градієнтну суміш MeOH/DCM. Отримані фракції поєднували і концентрували у високому вакуумі. Продукт розчиняли в ТГФ (5 мл), потім додавали Рd(РРh3)4 (88 мг, 0,077 ммоль) і морфолін (670 мкл, 7,67 ммоль), і суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 3 годин. Додавали 88 мг Рd(РРh3)4 (0,077 ммоль), і суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 16 годин. Суміш розподіляли між ЕtOАс і Н2О. Органічний шар відокремлювали і водний шар екстрагували ЕtOАс (×2). Органічні шари поєднували, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували. Сирий продукт очищали MDAP з одержан 95780 46 ням зазначеної в заголовку сполуки у вигляді білої твердої речовини (9 мг, 2%). + РХ/МС: m/z 441 [МН] , RT 2,50 хв. 1 H ЯМР (ДМСО-d6) δ: 0,89 (t, 3Н, J=7,5 Гц), 1,28 (m, 2H), 1,60 (m, 2H), 1,79 (m, 2H), 2,48 (t, перекритий ДМСО, 2Н, J =7,5 Гц), 3,89 (m, 4Н), 5,17 (s, 2Н), 7,08 (s, 1Н), 7,31, (m, 6Н), 8,03 (s, 1Η). b) 3-бутил-8-хлор-1-[3-(1Н-імідазол-4іл)пропіл]-7-(2-пропен-1-іл)-3,7-дигідро-1Н-пурин2,6-діон Розчин 3-бутил-8-хлор-7-(2-пропен-1-іл)-3,7дигідро-1Н-пурин-2,6-діону (2,8 г, 9,9 ммоль) в безводному ТГФ (60 мл) обробляли 3-(1Німідазол-4-іл)-1-пропанолом (1,5 г, 12 ммоль) у безводному ТГФ (10 мл) і РРh3 (3,4 г, 13 ммоль). Додавали DBAD (2,9 г, 13 ммоль) одною частиною, і суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 18 годин. Суміш розподіляли між ЕtOАс і Н2О. Водний шар екстрагували і промивали ЕtOАс. Органічні шари поєднували, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували. Сирий продукт очищали за допомогою SPE картриджа на силікагелі, використовуючи градієнтну суміш МеОН/ЕtOАс (0,5%-7% МеОН). Отримані фракції поєднували і концентрували з одержанням зазначеної в заголовку сполуки у вигляді білої твердої речовини (2,16 г, 55%). + РХ/МС: m/z 391 [МН] , RT 2,40 хв. с) 3-бутил-8-хлор-7-(2-пропен-1-іл)-3,7-дигідро1Н-пурин-2,6-діон До розчину 3-бутил-7-(2-пропен-1-іл)-3,7дигідро -1Н-пурин-2,6-діону (3,34 г, 13,4 ммоль) в безводному ДМФ (19 мл) додавали NCS, (1,97 г, 14,8 ммоль) і залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 22 годин. Суміш концентрували у вакуумі з одержанням жовтої твердої речовини, що фільтрували і промивали МеОН з одержанням першої порції. Фільтрат концентрували до твердої речовини і промивали МеОН з одержанням другої порції, і повторювали ще два рази з одержанням зазначеної в заголовку сполуки. Наприкінці промивання фільтрат додатково очищали за допомогою картриджа SPE (Si, 20 г), елюючи сумішшю ЕtOАс:циклогексан (1:1). Об'єднані тверді речовини сушили у вакуумі з одержанням зазначеної в заголовку сполуки (2,42 г, 64%). 47 95780 + РХ/МС: m/z 283 [МН] . Приклад 13: 3-бутил-8-хлор-1-(3-{1-[(2,3дифторфеніл)метил]-1Н-імідазол-4-ил)пропіл)-3,7дигідро -1Н-пурин-2,6-діон Розчин 3-бутил-8-хлор-1-[4-(1Н-імідазол4ил)бутил]-7-(2-пропен-1-ил)-3,7-дигідро-1Н-пурин2,6-діону (150 мг, 0,38 ммоль) у безводному ДМФ (3 мл) обробляли 1-(бромметил)-2,4дифторбензолом (54 мкл, 0,42 ммоль) і DIPEA (73 мкл, 0,42 ммоль). Суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 3 днів. Суміш розподіляли між ЕtOАс і 2М НСІ (водний). Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували. Сирий продукт очищали на SPE колонці із силікагелем, використовуючи DCM для завантаження речовини в колонку і наступне промивання домішок із градієнтною сумішшю 0-5% MeOH/DCM для елюювання сполуки. Отримані фракції поєднували і концентрували і залишки розчиняли в безводному ДМФ (3 мл). Розчин дегазували, потім додавали Рd(РРh3)4 (39 мг, 0,034 ммоль) і морфолін (200 мкл, 2,3 ммоль), і суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 3 годин. Сирий продукт очищали за допомогою амінопропілового SPE, використовуючи МеОН для завантаження сполуки в колонку і наступне промивання домішок градієнтною сумішшю 0-5% АсОН/МеОН для елюювання продукту. Отримані фракції поєднували і концентрували у високому вакуумі з одержанням зазначеної в заголовку сполуки у вигляді білої твердої речовини (14 мг, 7%). + РХ/МС: m/z 477 [МН] , RT 2,54 хв. Приклад 14: 3-бутил-8-хлор-1-[3-(1-{[2(трифторметил)феніл]метил}-1Н-імідазол-4іл)пропіл]-3,7-дигідро-1Н-пурин-2,6-діон Розчин 3-бутил-8-хлор-1-[4-(1Н-імідазол-4іл)бутил]-7-(2-пропен-1-іл)-3,7-дигідро-1Н-пурин2,6-діону (150 мг, 0,38 ммоль) у безводному ДМФ (3 мл) обробляли 1-(хлорметил)-2(трифторметил)бензолом (61 мкл, 0,42 ммоль) і DIPEA (73 мкл, 0,42 ммоль). Суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 3 днів. Суміш розподіляли між ЕtOАс і 2М НСІ (водна). Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували. Сирий продукт очищали на SPE колонці із силікагелем, 48 використовуючи DCM для завантаження речовини в колонку і наступне промивання домішок градієнтною сумішшю 0-5% MeOH/DCM для елюювання сполуки. Отримані фракції поєднували і концентрували, і залишки промивали в безводному ДМФ (3 мл). Розчин дегазували, потім додавали Рd(РРh3)4 (35 мг, 0,030 ммоль) і морфолін (174 мкл, 2,0 ммоль), і суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 3 годин. Сирий продукт очищали за допомогою амінопропілового SPE, використовуючи МеОН для завантаження сполуки в колонку і наступне промивання домішок градієнтною сумішшю 0-5% АсОН/МеОН для елюювання продукту. Отримані фракції поєднували і концентрували у високому вакуумі з одержанням зазначеної в заголовку сполуки у вигляді білої твердої речовини (50 мг, 26%). + РХ/МС: m/z 509 [МН] , RT 2,64 хв. Приклад 15: 3-бутил-8-хлор-1-[3-(1-{[3(трифторметил)феніл]метил}-1Н-імідазол-4іл)пропіл]-3,7-дигідро-1Н-пурин-2,6-діон Розчин 3-бутил-8-хлор-1-[4-(1Н-імідазол-4іл)бутил]-7-(2-пропен-1-іл)-3,7-дигідро-1Н-пурин2,6-діону (150 мг, 0,38 ммоль) у безводному ДМФ (3 мл) обробляли 1-(хлорметил)-3(трифторметил)бензолом (65 мкл, 0,42 ммоль) і DIPEA (73 мкл, 0,42 ммоль). Суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 3 днів. Суміш розподіляли між ЕtOАс і 2М НСІ (водна). Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували. Сирий продукт очищали на SPE колонці із силікагелем, використовуючи DCM для завантаження речовини в колонку і наступне промивання домішок градієнтною сумішшю 0-5% MeOH/DCM для елюювання сполуки. Отримані фракції поєднували і концентрували, і залишки промивали в безводному ДМФ (3 мл). Розчин дегазували, потім додавали Рd(РРh3)4 (30 мг, 0,027 ммоль) і морфолін (156 мкл, 1,8 ммоль), і суміш залишали перемішуватися при кімнатній температурі в атмосфері азоту протягом 3 годин. Сирий продукт очищали за допомогою амінопропілового SPE, використовуючи МеОН для завантаження сполуки в колонку і наступне промивання домішок градієнтною сумішшю 0-5% АсОН/МеОН для елюювання продукту. Отримані фракції поєднували і концентрували у високому вакуумі з одержанням зазначеної в заголовку сполуки у вигляді білої твердої речовини (18 мг, 9%). + РХ/МС: m/z 509 [МН] , RT 2,78 хв. Приклад 16: 3-бутил-8-хлор-1-(3-[3(фенілметил)-1Н-1,2,4-триазол-1-іл]пропіл)-3,7дигідро-1Н-пурин-2,6-діон 49 а) 3-бутил-8-хлор-1-{3-[3-(фенілметил)-1Н1,2,4-триазол-1-іл]пропіл}-3,7-дигідро-1Н-пурин2,6-діон Розчин 3-бутил-8-хлор-1-{3-[3-(фенілметил)1Н-1,2,4-триазол-1-іл]пропіл}-7-(2-пропен-1-іл)-3,7дигідро-1Н-пурин-2,6-діону (669 мг, 1,39 ммоль) в ТГФ (7 мл) дегазували із застосуванням вакууму і потім подавали азот. Додавали Рd(РРh3)4 (160 мг, 0,14 ммоль), і суміш повторно дегазували. Додавали морфолін (1,2 мл, 13,9 ммоль), і суміш перемішували в атмосфері азоту протягом 18 годин, потім розподіляли між 2М НСІ (водна) і ЕtOАс. Органічний шар відокремлювали, і водний шар повторно екстрагували ЕtOАс. Об'єднані екстракти знову промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували з одержанням залишку жовтого кольору. Додавали МеОН, і потім продукт завантажували на амінопропіловий SPE, елюючи сумішшю 2-3% АсОН/ МеОН. Отримані фракції поєднували і концентрували з одержанням ясно-жовтої твердої речовини (380 мг). Приблизно четверту частину речовини очищали за допомогою autoprep ВЕРХ, а частину, що залишилася, кристалізували із суміші МеОН:ДМСО (1:1) з одержанням зазначеної в заголовку сполуки у вигляді білої твердої речовини (125 мг, 31%). + РХ/МС: m/z 442 [MH] ,RT 3,0 хв. 1 Н ЯМР (ДМСО-d6) δ: 0,89 (t, 3Н, J=7 Гц), 1,30 (m, 2H), 1,62 (m, 2H), 2,07 (m, 2H), 3,90 (m, 6H), 4,13 (t, 2H, J=7 Гц), 7,24 (m, 5H), 8,36 (1H, s), 14,5 (brs, 1H). b) 3-бутил-8-хлор-1-{3-[3-(фенілметил)-1Н1,2,4-триазол-1-іл]пропіл}-7-(2-пропен-1-іл)-3,7дигідро-1Н-пурин-2,6-діон Розчин 3-(фенілметил)-1Н-1,2,4-триазолу (2,1 г, 13,2 ммоль) в МеОН (40 мл) обробляли 0,5М NaOMe в МеОН (29 мл), потім 1,3дибромпропаном (1,7 мл). Після перемішування протягом 5 годин при 50°С суміш розподіляли між 2М НСІ (водна) і ЕtOАс. Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували з одержанням маслянистого залишку (1,0 г). До нього додавали бутил-8-хлор-7-(2-пропен-1-іл)-3,7дигідро-1Н-пурин-2,6-діон (917 мг, 3,2 ммоль) і 95780 50 Cs2CO3 (1,2 г, 3,6 ммоль). Додавали ДМФ (15 мл), і суміш перемішували при 50°С протягом 20 годин, потім розподіляли між 2М НСІ (водна) і ЕtOАс. Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували. Отриману олію (1,52 г) поміщали на колонку з SPE силікагелем (50 г), елюючи сумішами ЕtOАс/циклогексан. Одержували два ізомерних продукти триазолу у вигляді суміші 2:1, замість зазначеної в заголовку сполуки, у вигляді жовтої пастоподібної речовини (697 мг, 67%, виходячи зі співвідношення присутніх ізомерів). + РХ/МС: m/z 482 [МН] , RT 3,3 хв. Приклад 17: 8-хлор-3-пентил-1-(3-[5(фенілметил)-2Н-тетразол-2-іл]пропіл)-3,7-дигідро1Н-пурин-2,6-діон Розчин 5-бензил-1Н-тетразолу (1,0 г, 6,24 ммоль) в МеОН (5 мл) обробляли 1-хлор-3йодпропаном (1,0 мл, 9,36 ммоль) і розчином 0,5М NaOMe в МеОН (4,7 мл, 9,36 ммоль). Реакційну суміш нагрівали зі зворотним холодильником протягом 18 годин, потім розподіляли між 2М НСІ (водна) і ЕtOАс. Органічний шар відокремлювали, і водний шар екстрагували ще раз ЕtOАс. Об'єднані екстракти промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували з одержанням жовтої твердої речовини (796 мг). 700 мг цієї речовини піддавали взаємодії з 8-хлор-3-пентил-7(2-пропен-1-іл)-3,7-дигідро-1Н-пурин-2,6-діоном (732 мг, 2,47 ммоль) і Cs2CO3 (967 мг, 3,0 ммоль) в ДМФ (20 мл) при 75°С протягом 24 годин. Реакційну суміш залишали прохолоджуватися до кімнатної температури, і суміш дегазували із застосуванням вакууму, і потім подавали азот. Додавали Рd(РРh3)4 (428 мг, 0,37 ммоль), і суміш повторно дегазували. Додавали морфолін (2,1 мл, 24,7 ммоль), і суміш перемішували в атмосфері азоту протягом 3 годин, потім розподіляли між 2М НСІ (водна) і ЕtOАс. Органічний шар відокремлювали, і водний шар екстрагували повторно. Об'єднані екстракти концентрували з одержанням залишку жовтого кольору. Додавали МеОН, і потім продукт поміщали на амінопропіловий SPE, елюючи сумішшю 2-3% АсОН/МеОН. Отримані фракції поєднували і концентрували, потім очищали за допомогою MDAP з одержанням зазначеної в заголовку сполуки у вигляді білої твердої речовини (35 мг, 3%). + РХ/МС: m/z 457 [МН] , RT 3,5 хвилин. 1 Н ЯМР; (ДМСО-d6) δ: 0,85 (t, 3Н, J=7 Гц), 1,211,34 (m, 4H), 1,62 (m, 2H), 2,22 (m, 2H), 3,88 (t, 2H, J=7 Гц), 3,97 (t, 2Н, J=7 Гц), 4,17 (s, 2Н), 4,67 (t, 2Н, J=7 Гц), 7,20-7,32 (m, 5Н), 14,5 (br s, 1H). Приклад 18: 3-бутил-8-хлор-1-(3-[5(фенілметил)-2Н-тетразол-2-іл]пропіл)-3,7-дигідро1Н-пурин-2,6-діон 51 Розчин 5-бензил-1Н-тетразолу (1,8 г, 11,2 ммоль) в МеОН (30 мл) обробляли 1,3дибромпропаном (5,7 мл, 56,2 ммоль) і 0,5М NaOMe в МеОН (31,5 мл), потім перемішували при 40°С в атмосфері азоту протягом 60 годин. Суміш розподіляли між 2М НСІ (водна) і ЕtOАс. Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували. Часткове очищення за допомогою SPE (20 г оксид кремнію, суміш циклогексан/ЕtOАс) і устаткування Companion™ (оксид кремнію SPE, суміш циклогексан/ЕtOАс) давало олію (1,98 г, 62% суміш ізомерів, 2:1 замість 2-(3-бромпропіл)-5(фенілметил)-2Н-тетразолу), що використовували сирим на наступній стадії. Суміш 3-бутил-8-хлор-7(2-пропен-1-іл)-3,7-дигідро-1Н-пурин-2,6-діону (1,74 г, 6,1 ммоль), сирого 2-(3-бромпропіл)-5(фенілметил)-2Н-тетразол) (1,9 г, 6,8 ммоль), Сs2СО3 (2,2 г, 6,8 ммоль) і ДМФ (60 мл) перемішували при 45°С в атмосфері азоту протягом 24 годин. Суміш дегазували із застосуванням вакууму і потім подавали азот. Додавали Рd(РРh3)4 (705 мг, 0,61 ммоль) і суміш дегазували повторно. Додавали морфолін (5,4 мл, 61,4 ммоль), і суміш перемішували в атмосфері азоту протягом 4 годин, і потім розподіляли між 2М НСІ (водна) і ЕtOАс. Органічний шар відокремлювали, промивали насиченим сольовим розчином, сушили (MgSO4) і концентрували з одержанням залишку жовтого кольору. Додавали МеОН, і потім продукт поміщали на амінопропілову колонку, елюючи сумішшю 2% АсОН/МеОН. Продукт додатково очищали за допомогою устаткування Companion™, використовуючи суміші ЕtOАс/циклогексан. Отриману тверду речовину перемішували в киплячому Еt2О, і після охолодження до кімнатної температури фільтрували. Зазначену в заголовку сполуку збирали у вигляді білої твердої речовини (1,01 г, 37%) і сушили при 50°С у вакуумі. + РХ/МС: m/z 443 [МН] , RT 3,3 хв. 1 H ЯМР (ДМСО-d6) δ: 0,89 (t, 3Н, J=7 Гц), 1,29 (m, 2H), 1,61 (m, 2H), 2,22 (m, 2H), 3,89 (t, 2H, J=7 Гц), 3,97 (t, 2H, J=7 Гц), 4,17 (s, 2H), 4,67 (t, 2H, J=7 Гц), 7,20-7,32 (m, 5H), 14,5 (brs, 1H). Приклад 19: 8-хлор-1-(3-(5-[(4фторфеніл)метил]-2Н-тетразол-2-іл)пропіл)-3(4,4,4-трифторбутил)-3,7-дигідро-1Н-пурин-2,6діон a) 8-хлор-1-(3-{5-[(4-фторфеніл)метил]-2Нтетразол-2-іл}пропіл)-3-(4,4,4-трифторбутил)-3,7дигідро-1Н-пурин-2,6-діон 95780 52 5-[(4-Фторфеніл)метил]-1Н-тетразол (75 мг, 0,4 ммоль) обробляли карбонатом калію (100 мг, 0,7 ммоль) і ДМФ (3 мл). Суміш обробляли розчином 3-[8-хлор-2,6-діоксо-7-(2-пропен-1-іл)-3-(4,4,4трифторбутил)-2,3,6,7-тетрагідро-1Н-пурин-1іл]пропіл метансульфонату (100 мг, 0,2 ммоль) в ДМФ (0,5 мл). Суміш перемішували і нагрівали при 60°С протягом 3 годин, потім охолоджували й упарювали. Залишок розподіляли між хлороформом 3 3 (4 мл) і водою (2 см ). До кожного додавали 1 см насиченого водного бікарбонату натрію (3 мл). Суміш розділяли, і органічну фазу упарювали. Залишок розчиняли в безводному ТГФ (3 мл), і суміш дегазували з обережним застосуванням вакууму і наступною подачею азоту до суміші. Суміш обробляли тетракис(трифенілфосфін)паладієм(0) (10 мг, 0,008 ммоль) і морфоліном (0,2 мл, 2,3 ммоль), і потім перемішували в атмосфері азоту протягом 2 годин. Суміш упарювали, і розподіляли між хлороформом (4 мл) і насиченим водним хлоридом амонію (3 мл). Суміш розділяли, і водну фазу повторно екстрагували хлороформом. Органічну фазу упарювали, і залишок розчиняли в МеОН (3 мл). Розчин поміщали на верхівку 2-х г амінопропілового SPE і промивали МеОН (15 мл). Бажаний продукт елюювали з картриджа 3% об'єм/об'єм розчином АсОН в МеОН (20 мл). Продукт, що містить фракції, поєднували й упарювали, і залишок піддавали очищенню за допомогою колоночної флеш-хроматографії (градієнт елюювання від 10:1 циклогексан/ЕtOАс до ЕtOАс). Фракції, що містять продукт, поєднували й упарювали з виходом продукту у вигляді безбарвної олії. Розтирання з мінімальною кількістю діетилового ефіру дозволяло отвердити продукт, і його ретельно висушували з виходом зазначеної в заголовку сполуки у вигляді білої твердої речовини (18,7 мг, 18%). + РХ/МС: m/z 515 [МН] , RT 3,31хв. 1 H ЯМР (CDCI3) δ: 2,06 (m, 2H), 2,21 (m, 2H), 2,45 (m, 2H), 4,17 (m, 4H), 4,24 (t, 2H, J=7,0 Гц), 4,70 (t, 2H, J=7,2 Гц), 6,96 (m, 2H), 7,25 (m, 2H). b) 3-[8-хлор-2,6-диоксо-7-(2-пропен-1-іл)-3(4,4,4-трифторбутил)-2,3,6,7-тетрагідро-1Н-пурин1-іл]пропіл метансульфонат Розчин 8-хлор-1-(3-гідроксипропіл)-7-(2пропен-1-іл)-3-(4,4,4-трифторбутил)-3,7-дигідро1Н-пурин-2,6-діону (0,82 г, 2,1 ммоль) в DCM (20 53 мл) обробляли триетиламіном (0,42 мл, 3,1 ммоль) і ангідридом метансульфонової кислоти (0,40 г, 2,3 ммоль). Через 1 годину суміш обробляли насиченим водним розчином бікарбонату натрію (20 мл). Суміш розділяли, і органічну фазу сушили (МgSO4), фільтрували й упарювали з одержанням зазначеної в заголовку сполуки (0,91 г), що використовували без додаткового очищення. + PX/MC: m/z 473 [MH] , RT 3,17 хв. c) 8-хлор-1-(3-гідроксипропіл)-7-(2-пропен-1іл)-3-(4,4,4-трифторбутил)-3,7-дигідро-1Н-пурин2,6-діон Розчин 8-хлор-7-(2-пропен-1-іл)-3-(4,4,4трифторбутил)-3,7-дигідро-1Н-пурин-2,6-діону (1,0 г, 3,0 ммоль) в ДМФ (15 мл) обробляли карбонатом натрію (1,16 г, 3,6 ммоль) і З-бром-1пропанолом (0,3 мл, 3,3 ммоль). Суміш нагрівали при 60°С протягом 4 годин, і потім охолоджували й упарювали. Залишок розподіляли між ЕtOАс (50 мл) і водою (50 мл). Органічну фазу сушили (MgSO4), фільтрували й упарювали. Продукт очищали флеш-хроматографією, використовуючи градієнт елюювання від циклогексану до ЕtOАс. Фракції, що містять продукт, поєднували й упарювали з одержанням зазначеної в заголовку сполуки у вигляді безбарвної олії (0,82 г, 75%). + РХ/МС: m/z 395 [МН] , RT 2,90 хв. d) 8-хлор-7-(2-пропен-1-іл)-3-(4,4,4трифторбутил)-3,7-дигідро-1Н-пурин-2,6-діон Розчин 8-хлор-7-(2-пропен-1-іл)-3,7-дигідро1Н-пурин-2,6-діону (2,0 г, 8,8 ммоль) в ДМФ (20 мл) обробляли карбонатом натрію (1,15 г, 10,8 ммоль) і 4-бром-1,1,1-трифторбутаном (1,86 г, 9,7 ммоль). Суміш перемішували при 50°С протягом 18 годин, потім охолоджували й упарювали. Залишок розподіляли між ЕtOАс (100 мл) і насиченим водним розчином бікарбонату натрію (50 мл). Органічну фазу сушили (MgSO4), фільтрували й упарювали. Залишок розтирали в суміші діетилового ефіру і циклогексану, потім продукт відфільтровували і сушили з виходом зазначеної в заголовку сполуки у вигляді білої твердої речовини (1,18 г, 40%). + РХ/МС: m/z 337 [МН] , RT 2,83 хв. e) 5-[(4-Фторфеніл)метил]-1Н-тетразол 95780 54 Суміш хлориду триетил амонію (4,14 г, 30 ммоль) і азиду натрію (1,95 г, 30 ммоль) обробляли розчином (4-фторфеніл)ацетонітрилу (1,35 г, 10 ммоль) в толуолі (14 мл), і суміш перемішували і нагрівали при 100°С протягом 5 годин. Охолоджену суміш обробляли водою (10 мл), і суміш розділяли. Водну фазу перемішували і додавали по краплинах концентровану соляну кислоту до осадження продукту з розчину. Охолоджений продукт відфільтровували, промивали водою і сушили з виходом зазначеної в заголовку сполуки у вигляді білої твердої речовини (1,27 г, 72%). + РХ/МС: m/z 179 [МН] , RT 2,24 хв. Сполуки, зазначені в таблиці 3, одержували способом, аналогічним описаному в прикладі 19: 8-хлор-1-(3-{5-[(4-фторфеніл)метил]-2Н-тетразол2-іл}пропіл)-3-(4,4,4-трифторбутил)-3,7-дигідро-1Нпурин-2,6-діон, з відповідним метансульфонатом і тетразолом. MDAP використовували для додаткового очищення цих сполук, недостатньо очищених після звичайної фазової хроматографії. Проміжні сполуки метансульфонатів та їхні вихідні спирти одержували у відповідності з такими способами: 3-[8-хлор-2,6-діоксо-7-(2-пропен-1-іл)-3-пропіл2,3,6,7-тетрагідро-1Н-пурин-1-іл]пропіл метансульфонат Розчин 8-хлор-1-(3-гідроксипропіл)-7-(2пропен-1-іл)-3-пропіл-3,7-дигідро-1Н-пурин-2,6діону (1,99 г, 6,1 ммоль) в DCM (50 мл) обробляли триетиламіном (1,2 мл, 8,6 ммоль) і ангідридом метансульфонової кислоти (1,2 г, 6,9 ммоль). Через 1,5 години суміш обробляли водою (50 мл). Суміш розділяли, і водну фазу екстрагували DCM (25 мл), об'єднані органічні фази сушили (MgSO4), фільтрували й упарювали з одержанням зазначеної в заголовку сполуки у вигляді ясно-жовтої олії (2,38 г), що використовували без додаткового очищення. + PX/MC: m/z 405 [МН] , RT 2,93 хв. 3-[3-бутил-8-хлор-2,6-діоксо-7-(2-пропен-1-іл)2,3,6,7-тетрагідро-1Н-пурин-1-іл]пропіл метансульфонат Одержували у відповідності зі способом, використаним для 3-[8-хлор-2,6-діоксо-7-(2-пропен-1 55 іл)-3-пропіл-2,3,6,7-тетрагідро-1Н-пурин-1-іл]пропіл метансульфонату, з одержанням зазначеної в заголовку сполуки у вигляді ясно-жовтої олії (2,44 г). + РХ/МС: m/z 419 [МН] , RT 3,14 хв. 8-хлор-1-(3-гідроксипропіл)-7-(2-пропен-1-іл)-3пропіл-3,7-дигідро-1Н-пурин-2,6-діон Розчин 8-хлор-7-(2-пропен-1-іл)-3-пропіл-3,7дигідро-1Н-пурин-2,6-діону (3,0 г, 11,1 ммоль) в ДМФ (20 мл) обробляли карбонатом натрію (3,7 г, 11,4 ммоль) і 3-бром-1-пропанолом (1,6 г, 11,5 ммоль). Суміш нагрівали при 60°С протягом 4 годин і потім охолоджували й упарювали. Залишок розподіляли між ЕtOАс (60 мл) і насиченим водним розчином бікарбонату натрію (50 мл). Водну фазу екстрагувли ЕtOАс (60 мл), об'єднані органічні фази сушили (MgSO4), фільтрували й упарювали. Продукт очищали, використовуючи устатку 95780 56 вання Companion™ і градієнт елюювання від циклогексану до ЕtOАс. Продукт, що містить фракції, поєднували й упарювали з одержанням зазначеної в заголовку сполуки у вигляді безбарвної олії (2,6 г). + РХ/МС: m/z 327 [МН] , RT 2,62 хв. 3-бутил-8-хлор-1-(3-гідроксипропіл)-7-(2пропен-1-іл)-3,7-дигідро-1Н-пурин-2,6-діон Одержували у відповідності зі способом, використовуваним для 8-хлор-1-(3-гідроксипропіл)-7-(2пропен-1-іл)-3-пропіл-3,7-дигідро-1Н-пурин-2,6діону, з одержанням зазначеної в заголовку сполуки у вигляді безбарвної олії (2,3 г). + РХ/МС: m/z 341 [MH] , RT 2,85 хвилин. 57 95780 58 59 95780 60
ДивитисяДодаткова інформація
Назва патенту англійськоюXanthine derivatives as selective hm74a agonists
Автори англійськоюHatley Richard Jonathan Daniel, Mason Andrew Mcmurtrie, Pinto Ivan Leo
Назва патенту російськоюПроизводные ксантина как селективные агонисты нм74а
Автори російськоюХетли Ричард Джонатан Дениэл, Мейсон Эндрю МкМертри, Пинто Иван Лео
МПК / Мітки
МПК: A61P 9/00, A61K 31/495, C07D 473/04, C07D 473/06, A61P 3/00
Мітки: селективні, похідні, агоністи, hm74a, ксантину
Код посилання
<a href="https://ua.patents.su/108-95780-pokhidni-ksantinu-yak-selektivni-agonisti-hm74a.html" target="_blank" rel="follow" title="База патентів України">Похідні ксантину як селективні агоністи hm74a</a>
Попередній патент: Клейова композиція, спосіб її одержання, комбінований склад на основі клейової композиції, спосіб склеювання, виріб із застосуванням клейової композиції
Наступний патент: Спосіб одержання бромпікрину
Випадковий патент: Стоматологічний пінцет