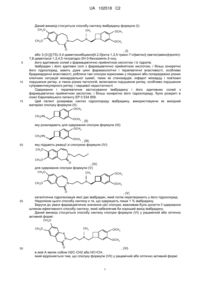
Спосіб синтезу івабрадину і його адитивних солей з фармацевтично прийнятною кислотою
Номер патенту: 102518
Опубліковано: 25.07.2013
Автори: Жан-П'єр Лекув, Жан-Луї Пельон, Еме Дессанж, Бернар Серкіз, Жан-Мішель Лерестіф
Формула / Реферат
1. Спосіб синтезу сполуки формули (VI) у рацемічно або оптично активній формі:
 , (VI)
, (VI)
в якій А являє собою Н2С-СН2 або НС=СН,
який відрізняється тим, що сполуку формули (VII) у рацемічній або оптично активній формі:
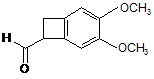 , (VII)
, (VII)
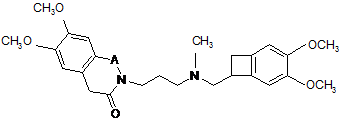
піддають реакції відновного амінування зі сполукою формули (VIII):
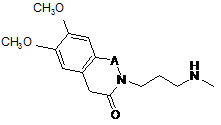 , (VIII)
, (VIII)
в якій А є таким же, як визначено тут вище,
у присутності відновного агента,
в органічному розчиннику або суміші органічних розчинників.
2. Спосіб синтезу за п. 1, який відрізняється тим, що сполука формули (VII) знаходиться в оптично активній формі і більш конкретно має (S) конфігурацію.
3. Спосіб синтезу за п. 2, який відрізняється тим, що група А являє собою Н2С-СН2 і продукт реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII) являє собою івабрадин формули (І):
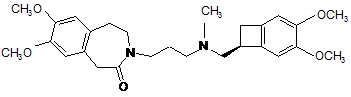 , (I)
, (I)
який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати.
4. Спосіб синтезу за п. 2, який відрізняється тим, що група А являє собою НС=СН і продукт реакції відновного амінування сполуки формули (VII), що має (S) конфігурацію, зі сполукою формули (VIII) являє собою сполуку формули (V):
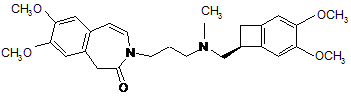 , (V)
, (V)
каталітична гідрогенізація якої дає івабрадин формули (І):
 , (I)
, (I)
який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати.
5. Спосіб синтезу за п. 1, який відрізняється тим, що сполука формули (VII) знаходиться у рацемічній формі і за реакцією відновного амінування сполуки формули (VII) зі сполукою формули (VIII) здійснюють стадію оптичного розкладання одержаної рацемічної сполуки формули (VI).
6. Спосіб синтезу за п. 5, який відрізняється тим, що А являє собою Н2С-СН2 і продукт, одержаний після стадії оптичного розкладання сполуки формули (VI), являє собою івабрадин формули (І):
 , (I)
, (I)
який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати.
7. Спосіб синтезу за п. 5, який відрізняється тим, що А являє собою НС=СН і продукт, одержаний після стадії оптичного розкладання сполуки формули (VI), являє собою сполуку формули (V):
 , (V)
, (V)
каталітична гідрогенізація якої дає івабрадин формули (І):
 , (I)
, (I)
який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, янтарної кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати.
8. Спосіб синтезу за будь-яким з пп. 1-7, який відрізняється тим, що відновний агент, який застосовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), вибирають з триацетоксиборгідриду натрію, ціаноборгідриду натрію і диводню у присутності каталізатора, такого як паладій, платина, нікель, рутеній, родій і їх похідні, особливо каталізатор використовують на основі або в оксидній формі.
9. Спосіб синтезу за п. 8, який відрізняється тим, що відновний агент, який застосовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), являє собою триацетоксиборгідрид натрію.
10. Спосіб синтезу за будь-яким з пп. 1-9, який відрізняється тим, що розчинник, який застосовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII) вибирають з тетрагідрофурану, дихлорметану, 1,2-дихлоретану, ацетатів, спиртів, переважно етанолу, метанолу або ізопропанолу, толуолу і ксилолу.
11. Спосіб синтезу за п. 8, який відрізняється тим, що розчинник, який застосовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), являє собою суміш тетрагідрофурану і дихлорметану.
12. Сполука формули (VII) у рацемічній або оптично активній формі:
 . (VII)
. (VII)
Текст
Реферат: Спосіб синтезу івабрадину формули (І): CH3O CH3O CH3 OCH3 N N OCH3 O (I) і його адитивних солей з фармацевтично прийнятною кислотою. CH3O CH3O CH3 N O N OCH3 OCH3 ФАРМАЦЕВТИЧНО UA 102518 C2 (12) UA 102518 C2 UA 102518 C2 Даний винахід стосується способу синтезу івабрадину формули (І): CH3O CH3 N N CH3O OCH3 OCH3 O 5 10 15 , (I) або 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-(метил)аміно]пропіл)7,8-диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-ону, його адитивних солей з фармацевтично прийнятною кислотою і їх гідратів. Івабрадин і його адитивні солі з фармацевтично прийнятною кислотою, і більш конкретно його гідрохлорид, мають дуже цінні фармакологічні і терапевтичні властивості, особливо брадикардичні властивості, роблячи такі сполуки корисними у лікуванні або попередженні різних клінічних ситуацій міокардіальної ішемії, таких як стенокардія, інфаркт міокарду і пов'язані порушення ритму, а також різних патологій, включаючи порушення ритму, особливо порушення суправентикулярного ритму, і серцевої недостатності. Одержання і терапевтичне застосування івабрадину і його адитивних солей з фармацевтично прийнятною кислотою, і більш конкретно його гідрохлориду, були розкриті в описі Європейського патенту ЕР 0 534 859. Цей патент розкриває синтез гідрохлориду івабрадину, використовуючи як вихідний матеріал сполуку формули (II): OCH3 CH3HN OCH3 , (II) яку розкладають для одержання сполуки формули (III): OCH3 CH3HN 20 OCH3 , (III) яку піддають реакції зі сполукою формули (IV): CH3O I N CH3O O , (IV) для одержання сполуки формули (V): CH3O CH3 N N CH3O OCH3 OCH3 O 25 , (V) каталітична гідрогенізація якої дає івабрадин, який потім перетворюють у його гідрохлорид. Недоліком цього способу синтезу є те, що одержують лише 1 % івабрадину. Беручи до уваги фармацевтичне значення цієї сполуки, важливим було досягти її одержання шляхом ефективного способу синтезу, який забезпечив би хороший вихід івабрадину. Даний винахід стосується способу синтезу сполуки формули (VI) у рацемічній або оптично активній формі: CH3O CH3 CH3O OCH3 A N 30 N OCH3 O , (VI) в якій А являє собою Н2С-СН2 або НС=СН, який відрізняється тим, що сполуку формули (VII) у рацемічній або оптично активній формі: 1 UA 102518 C2 OCH3 H OCH3 O , (VII) піддають реакції відновного амінування зі сполукою формули (VIII): CH3O CH3O A H N N O 5 10 , (VIII) в якій А є таким же, як визначено тут вище, у присутності відновного агента, в органічному розчиннику або суміші органічних розчинників. У переважному втіленні даного винаходу сполука формули (VII) знаходиться в оптично активній формі, і більш конкретно має (S) конфігурацію. Коли А являє собою Н2С-СН2, продукт реакції відновного амінування сполуки формули (VII), що має (S) конфігурацію, зі сполукою формули (VIII) являє собою івабрадин формули (І): CH3O CH3O CH3 N OCH3 N OCH3 O 15 20 , (I) який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. Коли А являє собою НС=СН, продукт реакції відновного амінування сполуки формули (VII), що має (S) конфігурацію, зі сполукою формули (VIII) являє собою сполуку формули (V): CH3O CH3O CH3 N OCH3 N OCH3 O , (V) каталітична гідрогенізація якої дає івабрадин формули (І): CH3O CH3O CH3 N OCH3 N OCH3 O 25 30 , (I) який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. В іншому переважному втіленні даного винаходу сполука формули (VII) знаходиться у рацемічній формі. За реакцією відновного амінування рацемічної сполуки формули (VII) зі 2 UA 102518 C2 сполукою формули (VIII) у цьому випадку йде стадія оптичного розкладання одержаної сполуки формули (VI). Коли А являє собою Н2С-СН2, продукт, одержаний після стадії оптичного розкладання сполуки формули (VI), являє собою івабрадин формули (І): CH3O CH3O 5 10 CH3 N N OCH3 O , (I) який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. Коли А являє собою НС=СН, продукт, одержаний після стадії оптичного розкладання сполуки формули (VI), являє собою сполуку формули (V): CH3O CH3O 15 OCH3 CH3 N OCH3 N OCH3 O , (V) каталітична гідрогенізація якої дає івабрадин формули (І): CH3O CH3O CH3 N OCH3 N OCH3 O 20 25 30 35 40 , (I) який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. Серед відновних агентів, які можуть бути використані для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), можуть бути згадані, без будьякого обмеження, сполуки, що дають гідриди, або диводень у присутності каталізатора. Серед відновних агентів, які можуть бути використані для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), можуть бути згадані, без будьякого обмеження, триацетоксиборгідрид натрію, ціаноборгідрид натрію і диводень у присутності каталізатора, такого як паладій, платина, нікель, рутеній, родій і їх похідні, особливо використовують каталізатор на основі або в оксидній формі. Відновний агент, який переважно використовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), являє собою триацетоборгідрид натрію. Серед розчинників, які можуть бути використані для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), можуть бути згадані, без будьякого обмеження, тетрагідрофуран, дихлорметан, 1,2-дихлоретан, ацетати, спирти, переважно етанол, метанол або ізопропанол, толуол і ксилол. У переважному втіленні даного винаходу розчинник, використаний для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), являє собою суміш органічних розчинників. 3 UA 102518 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розчинник, який переважно використовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), являє собою суміш тетрагідрофурану і дихлорметану. Сполука формули (VII), в рацемічній або оптично активній формі, являє собою новий продукт, корисний як проміжна сполука синтезу у хімічній або фармацевтичній промисловості, особливо у синтезі івабрадину, його адитивних солей з фармацевтично прийнятною кислотою і їх гідратів і, як така, складає невід'ємну частину даного винаходу. Перелік використаних абревіатур: ДМФ: N, N-диметилформамід ТГФ: тетрагідрофуран IЧ: інфрачервоний Наведені нижче приклади демонструють даний винахід. Точки плавлення (т.п.) вимірювали на стенді Кофлера (СК). Приклад 1: 7,8-Диметокси-3-[3-(метиламіно)пропіл]-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он 50 г (0,18 моль) 3-(7,8-диметоксі-2-окси-1,2,4,5-тетрагідро-ЗН-3-бензазепін-3-іл)пропаналю розчиняють у 625 мл метанолу. Одержаний розчин охолоджують до 0 °C і потім додають 62,5 мл (0,81 моль; 4,5 еквіваленти) водного 40 % розчину метиламіну. Перемішують протягом однієї години при 0 °C і потім додають 7,5 г (0,2 моль; 1,1 еквіваленти) NaBH4. Перемішують протягом 30 хвилин при 0 °C і потім перемішують протягом 12 годин при температурі навколишнього середовища. Метанол випаровують. Залишок вміщують у водний розчин хлористоводневої кислоти (1N) і промивають етилацетатом. Водну фазу потім доводять до рН=8 шляхом додавання 20 % розчину гідроксиду натрію і екстрагують дихлорметаном. Органічну фазу промивають водою, висушують над MgSO4, фільтрують і потім випаровують досуха для одержання 52 г олії, яку очищують шляхом флеш-хроматографії на 1,5 кг кремнезему (елюент = дихлорметан/етанол/NН4ОН: 80/20/2). 42 г очікуваного продукту одержують у формі твердої речовини білого кольору. Вихід = 80 %. Т.п. (СК) = 68-70 °C. Приклад 2: 7,8-Диметокси-3-[3-(метиламіно)пропіл]-1,3-дигідро-2Н-3-бензазепін-2-он Стадія 1: трет-бутил [3-(7,8-диметокси-2-оксо-1,2-дигідро-ЗН-3-бензазепін-3іл)пропіл]метилкарбамат 1,7 г (7,8 ммоль) 7,8-диметокси-1,3-дигідро-2Н-3-бензазепін-2-ону суспендують у 35 мл ДМФ і потім додають 374 мг (9,35 ммоль, 1,2 еквіваленти) гідриду натрію (60 % суспензія в олії). Одержують прозорий блідо-жовтий розчин, який перемішують протягом однієї години при 25 °C. Потім додають краплями 1,94 г (9,35 ммоль, 1,2 еквіваленти) трет-бутил (3хлорпропіл)метилкарбамату, розчиненого у 10 мл ДМФ. Все разом нагрівають при 50 °C протягом ночі і потім розчинник випаровують досуха. Залишок вміщують у воду і екстрагують дихлорметаном. Органічну фазу висушують над MgSO 4, фільтрують і випаровують досуха. Одержують 4,2 г олії, яку очищують шляхом флеш-хроматографії на 200 г кремнезему (елюент = дихлорметан/етилацетат: 80/20). 2,3 г очікуваного продукту одержують у формі безбарвної олії. Вихід = 77 %. -1 ІЧ (чистий): = 1685, 1659, 1155, 1102, 872, 770 см . Стадія 2: 7,8-Диметокси-3-[3-(метиламіно)пропіл]-1,3-дигідро-2Н-3-бензазепін-2-он 1,9 г (4,86 моль) продукту, одержаного на Стадії 1, розчиняють у 30 мл етанолу і до цього розчину додають 7 мл (24,3 ммоль, 5 еквіваленти) НС1 в етанолі (3,5N). Нагрівають протягом ночі при 60 °C і випаровують реакційну суміш досуха. Одержаний залишок вміщують у воду і водну фазу потім доводять до рН=8 шляхом додавання 20 % розчину гідроксиду натрію і екстрагують дихлорметаном. Органічну фазу промивають водою, висушують над MgSO 4, фільтрують і потім випаровують досуха. 1,1 г вказаного у заголовку продукту одержують у формі безбарвної олії. Вихід = 78 %. -1 ІЧ (чистий): v=3400, 1651, 1610, 1510, 856, 710 см . Приклад 3: 3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил Вказану у заголовку сполуку можуть одержувати шляхом циклізації 3-(2-бром-4,5диметоксифеніл)пропан нітрилу, як розкрито в літературі (дивіться Tetrahedron 1973, 29 73-76) або відповідно до наступної послідовності реакцій: Стадія 1: 3,4-Диметокси-б-гідроксибензальдегід 4 UA 102518 C2 5 10 15 20 25 30 35 40 45 50 55 60 У тригорлій колбі диспергують 40,8 г хлориду алюмінію у 200 мл дихлорметану з перемішуванням. Розчин охолоджують до 0 °C. Краплями вливають розчин 20 г (0,101 моль) 3,4,6-триметоксибензальдегіду, розчиненого у 100 мл дихлорметану. Температурі знову дають піднятись до 19 °C і перемішують протягом 45 хвилин. Гідролізують реакційну суміш за допомогою 400 мг води і льоду і потім додають 100 мл 1N HC1 і перемішують протягом 30 хвилин. Дають відокремитись і потім екстрагують за допомогою 200 мл дихлорметану. Органічну фазу промивають 100 мл 1N HC1, 100 мл води і 100 мл насиченого водного розчину NaCl і потім висушують над MgSO4, фільтрують і випаровують досуха. Одержують 16,4 г вказаного у заголовку продукту. Вихід = 77 %. -1 ІЧ (чистий): v-1625, 1146 см . Стадія 2: 2-Форміл-4,5-диметоксифенілу диметилсульфамат 16,2 г (0,0889 моль) 3,4-диметокси-6-гідроксибензальдегіду розчиняють у 80 мл ДМФ. Охолоджують до 10 °C і додають частинами 24,6 г (0,178 мль) карбонату калію. Дають повернутись до температури навколишнього середовища і перемішують протягом 30 хвилин. Охолоджують приблизно до 10 °C і вливають клаптями 10,1 мл (0,093 моль) N, Nдиметилсульфамоїлу хлориду. Дають повернутись до температури навколишнього середовища і перемішують протягом 2 годин. Реакційну суміш вливають у 600 г води і льоду і перемішують протягом 1 години при температурі навколишнього середовища. Одержаний залишок відфільтровують і промивають 3 рази за допомогою 50 мл води кожний раз і потім висушують у вакуумі. Одержують 21,3 г вказаного у заголовку продукту. Вихід = 83 % -1 ІЧ (чистий): v=1670, 1278, 1150 см . Стадія 3: 2-(2-Ціановініл)-4,5-диметоксифенілу диметилсульфамат Додають частинами 3,1 г (0,0773 моль) гідриду натрію при 0 °C до розчину 11,9 мл (0,0736 моль) діетилціанометилфосфонату у 400 мл ТГФ. Суміш охолоджують до -10 °C і додають краплями суспензію 21,3 г (0,0736 моль) 2-форміл-4,5-диметоксифенілу диметилсульфамату у 200 мл ТГФ. Перемішують протягом 30 хвилин і гідролізують за допомогою 600 мл розчину гідрокарбонату натрію і води (50/50) і потім екстрагують розчин двічі 300 мл толуолу кожний раз. Органічну фазу промивають 100 мл води і 100 мл насиченого водного розчину NaCl і потім висушують над MgSO4, фільтрують і випаровують досуха. Одержаний залишок кристалізують у 80 мл діізопропілового ефіру при температурі навколишнього середовища і потім фільтрують і промивають 20 мл діізопропілового ефіру і висушують у вакуумі. Одержують 18,4 г вказаного у заголовку продукту. Вихід = 80 %. -1 ІЧ (чистий): v=2217, 1631, 1165 см . Стадія 4: 2-(2-Ціаноетил)-4,5-диметоксифенілу диметилсульфамат Диспергують 6,7 г (0,177 моль) боргідриду натрію у 150 мл ТГФ. Вливають краплями суспензію 18,4 г (0,059 моль) 2-(2-ціановініл)-4,5-диметоксифеніл диметилсульфамату у 200 мл ТГФ. Вливають краплями 48 мл метанолу. Нагрівають протягом 3 годин при 50 °C і потім охолоджують і додають 1 г (0,026 моль) боргідриду натрію. Реакційну суміш нагрівають при 50 °C протягом 1 години і потім перемішують протягом ночі при температурі навколишнього середовища. Гідролізують шляхом вливання у реакційну суміш 60 мл водного 4N розчину НС1, підтримуючи при цьому температуру на рівні приблизно 20 °C. Додають 40 г льоду і 30 мл води і потім екстрагують двічі 200 мл етилацетату кожного разу. Органічну фазу промивають водою і насиченим водним розчином NaCl і потім висушують над MgSO4, фільтрують і випаровують досуха. Одержують 17,4 г вказаного у заголовку продукту. Вихід = 94 %. -1 ІЧ (чистий): v=2246 см . Стадія 5: 3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил В атмосфері азоту перемішують разом 5,4 мл (0,0382 моль) повторно дистильованого діізопропіламіну і 60 мл ТГФ. Суміш охолоджують до -50 °C і вливають краплями 15,3 мл (0,0382 моль) 2,5N розчину булиллітію у гексані. Температурі дають піднятись знову до -5 °C і перемішують протягом 10 хвилин. Розчин охолоджують до -60 °C і вливають краплями розчин 3 г (0,00954 моль) 2-(2-ціаноетил)-4,5-диметоксифенілу диметилсульфамату у 35 мл ТГФ. Температурі дають знову повільно піднятись до -24 °C, спостерігаючи при цьому за допомогою ВЕРХ зникнення реагуючої речовини. Реакційну суміш додають до суміші води і льоду і екстрагують етилацетатом. Промивають органічні фази послідовно 1N розчином гідроксиду натрію, водним 1N розчином НС1, водою і насиченим водним розчином NaCl і потім висушують їх над MgSO4, фільтрують і випаровують розчинники. Одержують 2 г залишку, який очищують за 5 UA 102518 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою флеш-хроматографії на 70 г кремнезему (елюент = дихлорметан) для одержання 0,9 г вказаного у заголовку продукту у формі твердої речовини білого кольору. Вихід = 50 %. Т.п. (СК) = 89-91 С. Приклад 4 (R, S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбальдегід 10 г (52,8 ммоль) 3,4-диметокси-біцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрилу розчиняють у 100 мл безводного толуолу. Розчин охолоджують до -78 °C і потім краплями додають 55 мл розчину діізобутилалюмінію гідриду (1,2М в толуолі), підтримуючи при цьому температуру нижче -65 °C (час виконання = 45 хвилин). Перемішування проводять протягом 1 години при 78 °C після завершення додавання. Гідроліз проводять шляхом додавання краплями 20 мл метанолу. Температурі дають повернутись до -30 °C і потім реакційну суміш додають до 200 мл НСl (O, 1N) і екстрагування ефіром проводять двічі. Органічну фазу промивають послідовно водою і насиченим водним розчином NaCl і потім висушують над MgSO 4, фільтрують і випаровують досуха для одержання 8 г вказаного у заголовку продукту у формі блідо-жовтої олії. Вихід = 79 %. -1 IЧ (чистий): v=2714, 2630, 1712 см . Приклад 5: (R, S)-3-(3-{[(3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил](метил)аміно}пропіл)7,8-диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он 8 г (52,4 ммоль, 1,2 еквіваленти) (R, S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7карбальдегіду розчиняють у суміші 150 мл безводного ТГФ і 20 мл дихлорметану. Додають 12,8 г (43,6 ммоль) 7,8-диметокси-3-[3-(метиламіно)пропіл]-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-ону і 2,48 мл (43,6 ммоль) оцтової кислоти. Все охолоджують до 0 °C і перемішують протягом 30 хвилин. Потім додають 14 г (65,6 ммоль, 1,5 еквіваленти) триацетоксиборгідриду натрію. Реакція протікає миттєво. Проводять випаровування досуха. Залишок додають у 1N розчин гідроксиду натрію і екстрагують дихлорметаном. Органічну фазу промивають водою, висушують над MgSO4, фільтрують і випаровують досуха для одержання 20 г олії, яку очищують шляхом флеш-хроматографії на 800 г кремнезему (елюент = дихлорметан/етанол/NH 4С)Н: 90/10/1). Одержують 16,8 г вказаного у заголовку продукту у формі безбарвної олії, яка кристалізується при температурі навколишнього середовища. Вихід = 82 %. Т.п. (СК) = 98-100 °C. Приклад 6: 3-{3-[{[(7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]пропіл}-7,8диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он гідрохлорид 2,1 г рацемічної сполуки, одержаної у Прикладі 5, розділяють на 60 см х 60 см колонці, наповненій 2,1 кг фази Chiralpak ® AD (гранулометрія 20 мкм). Використаний елюент являє собою суміш етанол/ацетонітрил/діетиламін (10/90/0,1 за обсягом) при швидкості потоку 50 мл/хв. Відповідний ультрафіолетовий детектор використовують при швидкості хвилі 280 нм. 0,95 г енантіомера, який має (R) конфігурацію, одержують у формі меренги білого кольору і потім одержують 0,95 г енантіомера, який має (S) конфігурацію, також у формі меренги білого кольору. Гідрохлорид енантіомера, який має (S) конфігурацію, потім одержують шляхом застосування методики, розкритої в описі патенту ЕР 0 534 859 (Приклад 2, Стадія Е). Приклад 7: 3-{3-[[(3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил](метил)аміно]пропіл}-7,8диметокси-1,3-дигідро-2Н-3-бензазепін-2-он 1,1 г (3,78 ммоль) 7,8-диметокси-3-[3-(метиламіно)пропіл]-1,3-дигідро-2Н-3-бензазепін-2-ону розчиняють у 50 мл ТГФ і 7 мл дихлорметану. Додають 0,69 г (4,53 ммоль, 1,2 еквіваленти) 3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбальдегіду і 0,22 мл оцтової кислоти. Реакційну суміш охолоджують до 0 °C і додають 1,2 г (5,67 ммоль, 1,5 еквіваленти) триацетоксиборгідриду натрію. Реакція протікає миттєво. Випаровують досуха. Залишок вміщують у воду і водну фазу доводять до рН=8 шляхом додавання 20 % розчину гідроксиду натрію і екстрагують дихлорметаном. Органічну фазу промивають водою, висушують над MgSO 4, фільтрують і випаровують досуха. Одержують 1,7 г олії, яку очищують шляхом флеш-хроматографії на 100 г кремнезему (елюент = дихлорметан/етанол/NН4ОН: 95/5/0,5) для одержання 1,4 г вказаного у заголовку продукту у формі безбарвної олії. Вихід = 79 %. 6 UA 102518 C2 -1 5 10 15 20 25 30 IЧ (чистий): v=1656, 1607, 1511, 1273, 1206, 1102, 836, 760 см . Приклад 8: 3-{3-[{[(7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]пропіл}-7,8диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он гідрохлорид 1,4 г рацемічної сполуки, одержаної у Прикладі 7, розділяють на 60 см х 60 мм колонці, наповненій 3 кг фази Chiralpak ® Т101 (гранулометрія 20 мкм). Використаний елюент являє собою суміш етанол/ацетонітрил/діетиламін (10/90/0,1 за обсягом) при швидкості потоку 100 мл/хв. Відповідний ультрафіолетовий детектор використовують при швидкості хвилі 280 нм. 0,56 г енантіомера, який має (R) конфігурацію одержують у формі безбарвної олії, потім одержують 0,62 г енантіомера, який має (S) конфігурацію, також у формі безбарвної олії. Сполуку, яка має (S) конфігурацію, потім гідрогенізують шляхом застосування методики, розкритої в описі патенту ЕР 0 534 859 (Приклад 1, Стадія D). Гідрохлорид одержаної сполуки одержують шляхом застосування методики, розкритої в описі патенту ЕР 0 534 859 (Приклад 2, Стадія Е). Приклад 9: 3-{3-[{[(7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]пропіл}-7,8диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он гідрохлорид Відповідно до методики Прикладу 5, починаючи з (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5триєн-7-карбальдегіду і 7,8-диметокси-3-[3-(метиламін)пропіл]-1,3,4,5-тетрагідро-2Н-3бензазепін-2-ону, одержують основу івабрадину, яку потім перетворюють в його гідрохлорид шляхом застосування методики, розкритої в описі патенту ЕР 0 534 859 (Приклад 2, Стадія Е). Приклад 10: 3-{3-[{[(7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]пропіл}-7,8диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он гідрохлорид Відповідно до методики Прикладу 7, починаючи з (7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5триєн-7-карбальдегіду і 7,8-диметокси-3-[3-(метиламін)пропіл]-1,3-дигідро-2Н-3-бензазепін-2ону, одержують сполуку, яку гідрогенізують шляхом застосування методики, розкритої в описі патенту ЕР 0 534 859 (Приклад 1, Стадія D) для одержання основи івабрадину, яку потім перетворюють в його гідрохлорид шляхом застосування методики, розкритої в описі патенту ЕР 0 534 859 (Приклад 2, Стадія Е). ФОРМУЛА ВИНАХОДУ 1. Спосіб синтезу сполуки формули (VI) у рацемічно або оптично активній формі: CH3O CH3 CH3O OCH3 A N 35 N OCH3 O , (VI) в якій А являє собою Н2С-СН2 або НС=СН, який відрізняється тим, що сполуку формули (VII) у рацемічній або оптично активній формі: OCH3 H OCH3 O , (VII) піддають реакції відновного амінування зі сполукою формули (VIII): CH3O CH3O A N 40 H N O , (VIII) в якій А є таким же, як визначено тут вище, 7 UA 102518 C2 5 у присутності відновного агента, в органічному розчиннику або суміші органічних розчинників. 2. Спосіб синтезу за п. 1, який відрізняється тим, що сполука формули (VII) знаходиться в оптично активній формі і більш конкретно має (S) конфігурацію. 3. Спосіб синтезу за п. 2, який відрізняється тим, що група А являє собою Н2С-СН2 і продукт реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII) являє собою івабрадин формули (І): CH3O CH3O CH3 N OCH3 N OCH3 O 10 15 , (I) який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. 4. Спосіб синтезу за п. 2, який відрізняється тим, що група А являє собою НС=СН і продукт реакції відновного амінування сполуки формули (VII), що має (S) конфігурацію, зі сполукою формули (VIII) являє собою сполуку формули (V): CH3O CH3O CH3 N OCH3 N OCH3 O 20 , (V) каталітична гідрогенізація якої дає івабрадин формули (І): CH3O CH3O CH3 N OCH3 N OCH3 O 25 30 35 , (I) який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. 5. Спосіб синтезу за п. 1, який відрізняється тим, що сполука формули (VII) знаходиться у рацемічній формі і за реакцією відновного амінування сполуки формули (VII) зі сполукою формули (VIII) здійснюють стадію оптичного розкладання одержаної рацемічної сполуки формули (VI). 6. Спосіб синтезу за п. 5, який відрізняється тим, що А являє собою Н2С-СН2 і продукт, одержаний після стадії оптичного розкладання сполуки формули (VI), являє собою івабрадин формули (І): CH3O CH3O CH3 N OCH3 N OCH3 O , (I) який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної 8 UA 102518 C2 5 кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. 7. Спосіб синтезу за п. 5, який відрізняється тим, що А являє собою НС=СН і продукт, одержаний після стадії оптичного розкладання сполуки формули (VI), являє собою сполуку формули (V): CH3O CH3O CH3 OCH3 N N OCH3 O 10 , (V) каталітична гідрогенізація якої дає івабрадин формули (І): CH3O CH3O CH3 OCH3 N N OCH3 O 15 20 25 30 , (I) який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, янтарної кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. 8. Спосіб синтезу за будь-яким з пп. 1-7, який відрізняється тим, що відновний агент, який застосовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), вибирають з триацетоксиборгідриду натрію, ціаноборгідриду натрію і диводню у присутності каталізатора, такого як паладій, платина, нікель, рутеній, родій і їх похідні, особливо каталізатор використовують на основі або в оксидній формі. 9. Спосіб синтезу за п. 8, який відрізняється тим, що відновний агент, який застосовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), являє собою триацетоксиборгідрид натрію. 10. Спосіб синтезу за будь-яким з пп. 1-9, який відрізняється тим, що розчинник, який застосовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII) вибирають з тетрагідрофурану, дихлорметану, 1,2-дихлоретану, ацетатів, спиртів, переважно етанолу, метанолу або ізопропанолу, толуолу і ксилолу. 11. Спосіб синтезу за п. 8, який відрізняється тим, що розчинник, який застосовують для проведення реакції відновного амінування сполуки формули (VII) зі сполукою формули (VIII), являє собою суміш тетрагідрофурану і дихлорметану. 12. Сполука формули (VII) у рацемічній або оптично активній формі: OCH3 H 35 OCH3 O . (VII) Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the synthesis of ivabradine and addition salts thereof with a pharmaceutically acceptable acid
Автори англійськоюJean-Louis PEGLION, Aimee Dessinges, Bernard Serkiz, Jaen-Michel Lerestif, Jean-Pierre Lecouve
Назва патенту російськоюСпособ синтеза ивабрадина и его аддитивных солей с фармацевтически приемлемой кислотой
Автори російськоюЖан-Луи Пельон, Эме Дессанж, Бернар Серкиз, Жан-Мишель Лерестиф, Жан-Пьер Лекув
МПК / Мітки
МПК: C07D 405/12, A61K 31/55, C07D 491/056
Мітки: синтезу, адитивних, кислотою, прийнятною, солей, івабрадину, фармацевтично, спосіб
Код посилання
<a href="https://ua.patents.su/11-102518-sposib-sintezu-ivabradinu-i-jjogo-aditivnikh-solejj-z-farmacevtichno-prijjnyatnoyu-kislotoyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу івабрадину і його адитивних солей з фармацевтично прийнятною кислотою</a>
Наступний патент: Система охолодження металургійного агрегату
Випадковий патент: Пристрій для сушіння і обробки зерноподібних матеріалів електромагнітним полем при пониженому тиску