Спосіб однореакторного паралельного синтезу алкілсульфідів, сульфоксидів та сульфонів
Номер патенту: 104592
Опубліковано: 10.02.2016
Автори: Остапчук Євген Миколайович, Боголюбський Андрій Васильович, Михайлюк Павло Костянтинович
Формула / Реферат
1. Спосіб однореакторного паралельного синтезу алкілсульфідів, сульфоксидів та сильфонів, в якому тіосечовину загальної формули (І):
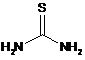 , (I)
, (I)
вводять в реакцію з алкілгалогенідом загальної формули (II):
Alk Hal , (II)
де Hal являє собою атом фтору, хлору, брому або йоду; та
Alk являє собою С1-С6-алкіл, який може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, -NHC1-С6-алкілу, -N(С1-С6-алкіл)2, -CONHC1-C6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, -SOС1-С6-алкілу або -SO2C1-C6-алкілу, і де до С3-С10-циклоалкілу, С6-С10-арилу і С2-С9-гетероарилу може бути необов'язково приконденсований С6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-C6-алкілу, -N(С1-С6-алкіл)2, -CONHC1-C6-алкілу, -СОС1-С6-алкілу, -SC1-C6-алкілу, -SOC1-С6-алкілу або -SO2C1-C6-алкілу;
одержуючи проміжну тіольну сіль формули (III):
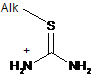 , (III)
, (III)
де Alk є таким як зазначено вище, яку обробляють лугом і вводять в реакцію з другим алкілгалогенідом загальної формули (IV):
Alk'Hal , (IV)
де Наl являє собою атом хлору; та
Alk' являє собою С1-С6-алкіл, який може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, -NHС1-С6-алкілу, -N(С1-С6 алкіл)2, -CONH С1-С6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, -SOC1-С6-алкілу або -SO2C1-C6-алкілу, де С1-С6-алкіл семи згаданих останніми замісників може бути необов'язково додатково заміщений С1-С6-алкокси, С3-С10-циклоалкілом, С6-С10-арилом, С2-С9-гетероарилом, кожен з яких може бути заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, -NHC1-C6-алкілу, -N(С1-С6-алкіл)2, -CONH С1-С6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, -SOC1-С6-алкілу або -SO2C1-C6-алкілу, і де до С3-С10-циклоалкілу, С6-С10-арилу і С2-С9-гетероарилу, згаданих вище може бути необов'язково приконденсований С6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, C2-C6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NH С1-С6-алкілу, -N(C1-C6-алкіл)2, -CONHC1-C6-алкілу, -СОС1-С6 алкілу, -SC1-С6-алкілу, -SOC1-С6-алкілу або -SO2 С1-С6-алкілу;
з одержанням сульфіду загально формули (V):
![]() , (V)
, (V)
який можна надалі окиснити Н2О2 до сульфоксиду загальної формули (VI):
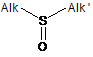 , (VI)
, (VI)
або сумішшю Н2О2 та (ΝΗ4)2ΜοO4 до сульфону загальної формули (VII):
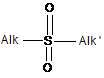 . (VII)
. (VII)
2. Спосіб за п. 1, в якому окислення проводять в присутності кислоти, такої як оцтова кислота.
Текст
Реферат: Спосіб однореакторного паралельного синтезу алкілсульфідів, сульфоксидів та сульфонів, в якому тіосечовину загальної формули (І): S H2 N NH2 , (I) вводять в реакцію з алкілгалогенідом загальної формули (II): Alk Hal , (II) де Hal являє собою атом фтору, хлору, брому або йоду; та Alk являє собою С1-С6-алкіл, який може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, -NHC1-С6-алкілу, -N(С1-С6-алкіл)2, -CONHC1-C6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, SOС1-С6-алкілу або -SO2C1-C6-алкілу, і де до С3-С10-циклоалкілу, С6-С10-арилу і С2-С9гетероарилу може бути необов'язково приконденсований С 6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-C6-алкілу, -N(С1-С6-алкіл)2, CONHC1-C6-алкілу, -СОС1-С6-алкілу, -SC1-C6-алкілу, -SOC1-С6-алкілу або -SO2C1-C6-алкілу. UA 104592 U (54) СПОСІБ ОДНОРЕАКТОРНОГО ПАРАЛЕЛЬНОГО СИНТЕЗУ АЛКІЛСУЛЬФІДІВ, СУЛЬФОКСИДІВ ТА СУЛЬФОНІВ UA 104592 U UA 104592 U 5 10 15 20 25 30 Корисна модель належить до галузі органічної хімії, а саме до способу однореакторного паралельного синтезу алкілсульфідів, сульфоксидів та сильфонів. У високопропускному скринінгу (HTS) для пошуку нових лікарських препаратів використовуються сполуки, що складаються з малих, ковалентно зв'язаних функціоналізованих фрагментів (будівельних блоків). Ці фрагменти з'єднані або безпосередньо, або за допомогою певної групи, лінкера. При виборі лінкера враховують наступні вимоги: (1) малий розмір, (2) мінімальна кількість обертальних зв'язків і (3) простий метод синтезу, що дозволяє отримати великі бібліотеки сполук. У цьому контексті, сульфідні (R-S-R'), сульфінільні (R-S(O)-R') і сульфонільні (R-SO2-R') групи, що входять до складу багатьох біологічно активних речовин і препаратів, являють собою ідеальні лінкери. Ці фрагменті цікаві ще й тим, що вони покращують важливі параметри лікарських препаратів: зменшують ліпофільність, збільшують розчинність у воді, та є ефективними акцепторами водневого зв'язку. Але дані групи відповідають всім вищезгаданим критеріям до лінкера, окрім (3), оскільки поки невідомі зручні і недорогі підходи до синтезу великих сетів цих сполук. Враховуючи цей факт, існує потреба у дослідженні методу паралельного синтезу алкілсульфідів, сульфоксидів та сульфонів. Вибір алкілпохідних 3 базувався на зростаючому інтересі до сполук з насиченим скелетом, оскільки sp -гібридизовані 3 3 атоми карбону поряд з атомом сірки можуть збільшити гнучкість R-Csp -S-Csp -R' фрагмента, що забезпечить кращу спорідненість до тривимірної кишені білка-мішені. Розроблюваний метод повинен відповідати наступним умовам паралельного синтезу: (а) використання стабільних, недорогих, нетоксичних і сумісних один з одним реагентів та розчинників; (b) можливість застосовувати різноманітні вихідні сполуки; (с) проста експериментальна процедура. На першому етапі винахідники намагалися розробити оптимальний підхід до отримання сульфідів, вихідних матеріалів в синтезі сульфоксидів та сульфонів. Типовим методом отримання сульфідів є алкілуванням тіолів. Проте, вихідні тіоли мають неприємний запах і нестабільні до окиснення в умовах навколишнього середовища, а нижчі гомологи вельми леткі та токсичні. За іншою методикою тіоли можуть бути отримані in situ за реакцією тіосечовини з відповідним алкілуючим реагентом та наступним гідролізом проміжного продукту з утворення тіолятів. Подальша взаємодія тіоляту з іншим алкілуючим агентом дає сульфід. Дана тристадійна процедура відповідає вищевказаним умовам до паралельного синтезу: вона базується на недорогих реагентах: тіосечовина та алкілгалогеніди; забезпечує отримання різноманітних наборів сульфідів шляхом варіювання алкілуючих агентів та дозволяє отримати продукти з високим виходом і чистотою при однореакторному синтезі. Таким чином, об'єктом корисної моделі є спосіб однореакторного паралельного синтезу алкілсульфідів, сульфоксидів та сильфонів, в якому тіосечовину загальної формули (І): S 35 40 45 H2 N NH2 , (I) вводять в реакцію з алкілгалогенідом загальної формули (II): Alk Hal, (II) де Hal являє собою атом фтору, хлору, брому або йоду; та Alk являє собою С1-С6-алкіл, який може бути необов'язково заміщений одним або більшою кількість замісників незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, -NHC1-C6-алкілу, -N(C1-C6-алкіл)2, -CONHС1-С6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, SOC1-С6-алкілу або -SO2C1-C6-алкілу, і де до С3-С10-циклоалкілу, С6-С10-арилу і С2-С9гетероарилу може бути необов'язково приконденсований С 6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С1-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-С6-алкілу, -N(С1-С6-алкіл)2, CONHС1-С6-алкілу, -СОС1-С6-алкілу, -SC1-C6-алкілу, -SOC1-С6-алкілу або –SО2С1-С6-алкілу; одержуючи проміжну тіольну сіль формули (III): Alk S 50 + H2N NH2 , (III) де Alk є таким як зазначено вище, яку обробляють лугом і вводять в реакцію з другим алкілгалогенідом загальної формули (IV): Alk'Hal', (IV) 1 UA 104592 U 5 10 15 де Hal' являє собою атом хлору; та Аік' являє собою С1-С6-алкіл, який може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, -NHC1-С6-алкілу, -N(С1-С6-алкіл)2, -CONHС1-С6-алкілу, -СО-С1-С6-алкілу, -SC1-С6-алкілу, SOC1-С6-алкілу або -SO2C1-C6-алкілу, де С1-С6-алкіл семи згаданих останніми замісників може бути необов'язково додатково заміщений Сі-Сб-алкокси, С3-С10-циклоалкілом, С6-С10-арилом, С2-С9-гетероарилом, кожен з яких може бути заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, NHC1-C6-алкілу, -N(C1-C6-алкіл)2, -CONHC1-C6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, -SOC1-С6алкілу або -SO2C1-C6-алкілу, і де до С3-С10-циклоалкілу, С6-С10-арилу і С2-С9-гетероарилу, згаданих вище, може бути необов'язково приконденсований С6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6-алкілу, -N(С1-С6-алкіл)2, CONHС1-С6-алкілу, -СО С1-С6-алкілу, -SC1-С6-алкілу, -SOС1-С6-алкілу або -SO2C1-C6-алкілу; з одержанням сульфіду загальної формули (V): Alk S 20 Alk ' , (V) який можна надалі окиснити Н2О2 до сульфоксиду загальної формули (VI): Alk ' Alk S O , (VI) або сумішшю Н2О2 та (ΝΗ4)2ΜοO4 до сульфону загальної формули (VII): O Alk S Alk ' O 25 30 35 40 45 50 . (VII) Як зазначається вище, термін "С1-С6-алкіл" стосується алкільного радикалу, що має від одного до шести атомів вуглецю і має нерозгалужену або розгалужену будову. Прикладами алкільних груп є, але не обмежується, метил, етил, пропіл, ізопропіл, бутил, ізобутил, вторбутил, трет-бутил, пентил, 2-пентил, 3-пентил, ізопентил, неопентил, (R)-2-метилбутил, (S)-2метилбутил, 3-метилбутил, 2,3-диметилпропіл, 2,3-диметилбутил, гексил і т.і. Термін "С2-С6-алкеніл" стосується алкенільного радикалу, що містить від двох до шести атомів вуглецю і має нерозгалужену або розгалужену будову. Алкенільними групами є, але не обмежується, етеніл, 1-пропеніл, 2-пропеніл, 2-метил-2-пропеніл, бутеніл, пентеніл, 3-гексеніл і т.і. Термін "С2-С6-алкініл" стосується алкінільного радикалу, що містить від двох до шести атомів вуглецю і має нерозгалужену або розгалужену будову. Алкінільними групами є, але не обмежується, етиніл, 1-пропініл, 2-пропініл, 2-метил-2-пропініл, бутиніл, пентиніл, 3-гексиніл і т.і. Термін "С1-С6-алкокси" стосується алкоксирадикалу, що має від одного до шести атомів вуглецю, що мають нерозгалужену або розгалужену будову. Алкоксигрупами є, але не обмежується, метокси, етокси, пропокси, ізопропокси, бутокси, гексилокси і т.і. Термін "С3-С10-циклоалкіл", як тут використовується, стосується моно-, конденсованих або місткованих біциклічних або трициклічних карбоциклічних кілець, що містять, в деяких втіленнях, від трьох до десяти атомів вуглецю. Як тут використовується, циклоалкільні кільця можуть необов'язково містити один або два подвійні зв'язки. Термін "циклоалкіл" також включає спіроциклоалкільні групи, включаючи поліциклічні системи, зв'язані через один атом. Циклоалкільними групами є, але не обмежується, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, бі-цикло[2,2,1]гептаніл, біцикло[3,2,1]октаніл, біцикло[5,2,0]нонаніл, адамантил і т.і. Термін "С6-С10-арил", як тут використовується, стосується групи, що походить від ароматичного вуглеводню, що містить від шести до десяти атомів вуглецю. Прикладами таких груп є, але не обмежується, феніл і нафтил. Термін "арил" також включає конденсовані поліциклічні ароматичні системи, в яких ароматичне кільце є конденсованим з одним або більше кілець. Прикладами є, але не обмежується, 1-нафтил, 2-нафтил, 1-антрацил і 2антрацил. Також включеними в межі рамок терміну "арил", як тут використовується, є група, в 2 UA 104592 U 5 10 15 20 25 30 якій ароматичне кільце є конденсованим з одним або більше неароматичних кілець, таким як інданіл, фенантридиніл або тетрагідронафтил, де радикал або точка приєднання знаходиться на ароматичному кільці. Термін "С2-С9-гетероарил, як тут використовується, стосується ароматичної моно-циклічної або біциклічної гетероциклічної групи, що має загалом від 5 до 9 атомів в кільці, і що містить від 2 до 9 атомів вуглецю і від одного до чотирьох гетероатомів, що незалежно вибирають з азоту, кисню і сірки, за умови, що кільце згаданої групи не містить два сусідні атоми кисню або два сусідні атоми сірки. Гетероарильні групи є бензоконденсованими циклічними системами. Прикладами гетероарильних груп є, але не обмежується, піроліл, фурил, тієніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, ізотіазоліл, триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл, тіазоліл, тетразоліл, піридиніл, піразиніл, піримідил, піридазиніл, триазиніл, індоліл, ізоіндоліл, індолізиніл, бензофураніл, бензотіофеніл, індазоліл, бензимідазоліл, бензоксазоліл, фуро[3,2b]піридиніл, бензотіазоліл, бензофуразаніл, пуриніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, цинолініл, фталазиніл, піридо[3,4-d]піримідил, птеридиніл і т.і… Запропонований спосіб використовує перетворення тіосечовини в сульфіди та перетворення сульфідів в сульфоксиди або сульфідів в сульфони. Перше перетворення включає 1) алкілування тіосечовини, 2) каталітичне розкладання проміжного продукту, та 3) алкілування тіоляту. Наступним перетворенням було моно- або повне окиснення сульфіду. Оптимізація процесу до умов прямого синтезу включала пошук простого набору хімікатів; можливості застосовування до широкого спектру субстратів; забезпечення високих виходів і чистоти проміжних продуктів на кожній стадії. Також, необхідно уникати гетерогенних сумішей в умовах паралельного синтезу, бо наявність нерозчинної речовини може впливати на ефективність реакції та ускладнити виділення продукту. Оптимізація призвела до розробки двохстадійного способу. На першій стадії еквімолярні кількості тіосечовини (І) та алкілгалогеніду (II) витримували при 100 °C протягом 2 годин (Схема 1). Як алкілуючі реагенти були вибрані алкілхлориди, бо бромід та йодид аніони, що утворюються при використанні відповідних алкілбромідів або йодидів, можуть приймати участь в галогенуванні активних груп продукту в умовах реакції. Як розчинник для алкілування був вибраний 2-пропанол, оскільки, він сумісний зі стадією окиснення і повністю розчиняє реагенти, підвищуючи ефективність алкілування. Схема 1 1. AlkCl (1екв)., iPrOH, 100 C, 2 г 2. КОН (2,5 екв.), Alk'Cl (0,95 екв.), 60 с, 2 г Alk S Alk ' (V) 1. AlkCl (1екв)., iPrOH, 100 C, 2 г 2. КОН (2,5 екв.), Alk'Cl (0,95 екв.), 60 с, 2 г 3. Н2О2 (2,2 екв.), МеОН/АсОН, 40 С, 4 г S Alk S Alk ' O H2N NH2 (I) (VI) 1. AlkCl (1екв)., iPrOH, 100 C, 2 г 2. КОН (2,5 екв.), Alk'Cl (0,95 екв.), 60 с, 2 г 3. Н2О2 (2,2 екв.), МеОН/АсОН, 40 С, 4 г МеОН/АсОН, 70 С, 5 г O Alk S Alk ' O (VII) 35 40 Далі проводилося утворення та алкілування тіоляту: до реакційної суміші додавали надлишок основи у вигляді 4М розчину КОН в метанолі, а потім алкілхлорид (II). Подальше нагрівання реакційної суміші при 60 °C протягом 2 годин в ультразвуковій бані забезпечує високу ефективність утворення сульфідів (V). КОН був вибраний, бо розчинний в спиртах та ефективно утворює тіоляти. Тіолят генерувався в надлишку (як правило, 5 моль%) порівняно з кількістю алкілхлориду (IV), що дозволяло уникнули домішок, непрореагованих алкілуючих реагентів. Надлишок гідрофільного тіоляту легко відмивався водно-2-пропанольним розчином після стадії алкілування або водою як сульфонат після стадії окиснення. Якщо сульфід був кінцевим продуктом, до реакційної суміші додавали воду, при цьому в більшості випадків продукт утворював осад. Для окиснення in situ генерованого сульфіду, 3 UA 104592 U 5 10 15 реакційну суміш розводили метанолом і додавали оцтову кислоту та окисник. Розведення запобігало енергійній реакції та витоку суміші. Додавання кислоти необхідно для нейтралізації надлишку основи, тому що Н2О2 розкладається в лужному середовищі, що зменшує ефективність реакції окиснення. Для моноокиснення використовували експериментально встановлену кількість Н2О2 у 2,2 екв., що було достатньо для утворення сульфоксиду та мінімізувало утворення сульфонів. Використання більшої кількість Н 2О2 для повного окиснення було неефективним, бо утворювалась значна кількість домішок, насамперед непрореагованих сульфідів і сульфоксидів. Тому на стадії утворення сульфонів використали промотор (ΝΗ4)2ΜοO4, більш розчинний та ефективний аналог МоО3. Експериментально встановлені кількості Н2О2 (6 екв.) та (ΝΗ4)2ΜοO4 (0,1 екв.) дозволили подолати вищезгадану проблему. Реакції окиснення проводилися в ультразвуковій бані при нагріванні: моноокиснення - при 40 °C протягом 4 годин, повне окиснення - при 70 °C протягом 5 годин. Подібно до сульфідів, більшість сульфонів осаджувалися з реакційної суміші і відокремлювалися фільтруванням. Для сульфоксидів і добре розчинних сульфонів, виділення продукту включало випаровування розчинника з наступною екстракцією хлороформом. Для перевірки способу було вибрано два ряди алкілхлоридів з нашої внутрішньої бібліотеки (Хімічний набір 1 та Хімічний набір 2). F Cl F Cl 1{1} Cl Cl 1{3} 1{2} Cl Cl 1{5} 1{4} Cl Cl N N Cl O N Cl N F N Cl O N 1{6} 1{8} 1{7} N Cl O 1{10} 1{9} Хімічний набір 1 (II) O N H F Cl N H 2{1} N H 2{2} 2{3} O O O Cl Cl N H N H 2{4} 2{5} Cl N H 2{6} O O Cl Cl Cl N H 2{7} 30 O Cl O 20 25 F O Cl N N H O O N 2{9} 2{8} Хімічний набір 2 (IV) При виборі реагентів ми виключили алкілхлориди, що містять групи схильні до окиснення в умовах реакції, наприклад арилоксиди, похідні піролу, індолу і фурану. Для перевірки нашого методу була проведена 81 паралельна реакція в одному реакторі, по 3 перетворення на парі алкілхлоридів: до сульфіду, до сульфоксиду та до сульфону (Таблиця 1). Аналіз реакційних сумішей дозволив оцінити ефективність експериментальної процедури. Так, в більшості випадків продукти були отримані з високим виходом та чистотою (понад 90 %). Тільки в 28 % експериментів було необхідно очищення флеш-хроматографією, що призвело до низьких виходів в окремих випадках. Незважаючи на це, отримана кількість продуктів перевищувала 30 мг, що було достатньо для біохімічних тестів або скринінгу. Ідентичність та 4 UA 104592 U чистота синтезованих сполук були підтвердженні аналізом. Таблиця 1. Синтезовані набори S-лінкерсполук. 5 1 Η і 13 С ЯМР спектроскопією та РХ-МС UA 104592 U 6 UA 104592 U а 5 10 15 перша цифра вказую алкілхлорид з Хімічного набору 1, а друга з Хімічного набору 2. Розуміючи важливість сульфідів, сульфоксидів, та сульфонів у розробці лікарських препаратів і популярність насичених сполук, винахідники вважають, що розроблений метод буде корисний для вчених, що займаються комбінаторним синтезом вищезгаданих класів сполук, та дозволить розширити їх різноманітність. Експериментальна частина Всі хімічні речовини і розчинники були отримані з комерційно доступних джерел (Enamine, 1 13 Sigma-Aldrich) і використані без подальшого очищення. Н і С ЯМР-спектри знімали на Bruker Avance DRX 500 спектрометрі в ДМСО-d6, використовуючи тетраметилсилан (TMS) як внутрішній стандарт. ІЧ-спектри знімали на Perkin-Elmer Spectrum BX II. Точки плавлення визначалися на апараті Buchi і приведені без коригування. РХ-МС аналіз проводили на Agilent 1100 HPLC, оснащеному діодною матрицею і мас-селективним детектором, колонка: Zorbax SBC18, 4,6 мм 15 мм. Розчинник, А, ацетонітрил - вода з 0,1 % тфа (95:5); В, вода з 0,1 % тфа. Очищення сполук проводили з використанням інструменту Companion Combi-Flash, обладнаного УФ-детектором і багаторазової колонки LukNova [розчинник А, СНСl3; В, СНСl3: метанол (7:3, за об'ємом)]. 7 UA 104592 U 5 10 15 20 25 Загальна методика синтезу сульфідів (V). Суміш тіосечовини (І) (1 ммоль) та алкілюючого агенту (II) (1 ммоль) в 0,6 мл 2-пропанолу нагрівали протягом 2 годин при 100 °C в закритій посудині об'ємом 8 мл. Після охолодження до кімнатної температури, до пробірки додали послідовно 4 Μ розчин KОН (2,5 ммоль) в метанолі та алкілюючий агент (IV) (0,95 ммоль). Отриману суміш нагрівали протягом 2 годин при 60 °C в ультразвуковій бані. Сульфіди (V) зазвичай випадали з розчину в осад при охолодженні реакційної суміші до кімнатної температури. Продукт піддавали фільтрації та сушінню. В інших випадках додавали хлороформ (3 мл) і воду (7 мл), потім органічну фазу відокремлювали, промивали водою (7 мл) та упарювали з отриманням продукту (V). Якщо продукт мав чистоту нижче 90 %, його очищали за допомогою флеш-хроматографії. Загальна методика синтезу сульфоксидів (VI) і сульфонів (VII). Суміш тіосечовини (І) (1 ммоль) і алкілюючого агенту (II) (1 ммоль) в 0,6 мл 2-пропанолу нагрівали протягом 2 годин при 100 °C в закритій посудини об'ємом 8 мл. Після охолодження до кімнатної температури до реакційної пробірки додавали послідовно 4 Μ розчин КОН (2,5 ммоль) в метанолі та алкілюючий агент (IV) (0,95 ммоль). Отриману суміш нагрівали протягом 2 годин при 60 °C в ультразвуковій бані. Після охолодження до кімнатної температури суміш розводили метанолом (3 мл) і підкислювали оцтовою кислотою (0,175 мл). Потім додавали окисник: Н 2О2 (2,2 ммоль, 0,175 мл 50 %-вий розчин в Н2О) для моноокиснення чи Н2О2 (6 ммоль, 0,45 мл 50 %-вий розчин в Н2О) і (ΝΗ4)2ΜοΟ4 (0,1 ммоль, 0,175 мл, 10 % розчин в Н2О) для повного окиснення. Суміш нагрівали протягом 4 годин при 40 °C (моноокиснення) або ж протягом 5 годин при 70 °C (повне окиснення) в ультразвуковій бані. Сульфони (VII) зазвичай випадають з розчину при охолодженні реакційної суміші до кімнатної температури. Осади фільтрували та сушили в сушильній шафі. Сульфоксиди (VI) і добре розчинні сульфони (VII) отримували після обробки реакційних сумішей хлороформом (3 мл) і водою (7 мл) та подальшим розділення і випаровування органічної фази. Якщо продукти малі чистоту менше 90 %, їх чистили за допомогою флеш-хроматографії. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 30 1. Спосіб однореакторного паралельного синтезу алкілсульфідів, сульфоксидів та сульфонів, в якому тіосечовину загальної формули (І): S H2 N 35 40 45 NH2 , (I) вводять в реакцію з алкілгалогенідом загальної формули (II): Alk Hal , (II) де Hal являє собою атом фтору, хлору, брому або йоду; та Alk являє собою С1-С6-алкіл, який може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, -NHC1-С6-алкілу, -N(С1-С6-алкіл)2, -CONHC1-C6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, SOС1-С6-алкілу або -SO2C1-C6-алкілу, і де до С3-С10-циклоалкілу, С6-С10-арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-C6-алкілу, -N(С1-С6-алкіл)2, CONHC1-C6-алкілу, -СОС1-С6-алкілу, -SC1-C6-алкілу, -SOC1-С6-алкілу або -SO2C1-C6-алкілу; одержуючи проміжну тіольну сіль формули (III): Alk S + H2N 50 NH2 , (III) де Alk є таким як зазначено вище, яку обробляють лугом і вводять в реакцію з другим алкілгалогенідом загальної формули (IV): Alk'Hal , (IV) де Наl являє собою атом хлору; та Alk' являє собою С1-С6-алкіл, який може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6 8 UA 104592 U 5 10 15 алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, -NHС1-С6-алкілу, -N(С1-С6 алкіл)2, -CONH С1-С6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, SOC1-С6-алкілу або -SO2C1-C6-алкілу, де С1-С6-алкіл семи згаданих останніми замісників може бути необов'язково додатково заміщений С1-С6-алкокси, С3-С10-циклоалкілом, С6-С10-арилом, С2-С9-гетероарилом, кожен з яких може бути заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, карбонілу, ОН, SH, -CN, NO2, NHC1-C6-алкілу, -N(С1-С6-алкіл)2, -CONH С1-С6-алкілу, -СОС1-С6-алкілу, -SC1-С6-алкілу, -SOC1С6-алкілу або -SO2C1-C6-алкілу, і де до С3-С10-циклоалкілу, С6-С10-арилу і С2-С9-гетероарилу, згаданих вище може бути необов'язково приконденсований С 6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, C2-C6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NH С1-С6-алкілу, -N(C1-C6-алкіл)2, CONHC1-C6-алкілу, -СОС1-С6 алкілу, -SC1-С6-алкілу, -SOC1-С6-алкілу або -SO2 С1-С6-алкілу; з одержанням сульфіду загально формули (V): Alk S Alk ' , (V) який можна надалі окиснити Н2О2 до сульфоксиду загальної формули (VI): Alk ' Alk S O , (VI) або сумішшю Н2О2 та (ΝΗ4)2ΜοO4 до сульфону загальної формули (VII): O Alk 20 S Alk ' O . (VII) 2. Спосіб за п. 1, в якому окислення проводять в присутності кислоти, такої як оцтова кислота. Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Автори англійськоюBoholiubskyi Andrii Vasyliovych
Автори російськоюБоголюбский Андрей Васильевич
МПК / Мітки
МПК: C07C 2/00
Мітки: алкілсульфідів, сульфонів, паралельного, спосіб, сульфоксидів, синтезу, однореакторного
Код посилання
<a href="https://ua.patents.su/11-104592-sposib-odnoreaktornogo-paralelnogo-sintezu-alkilsulfidiv-sulfoksidiv-ta-sulfoniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб однореакторного паралельного синтезу алкілсульфідів, сульфоксидів та сульфонів</a>
Попередній патент: Пристрій для автоматизованого вимірювання контактної різниці потенціалів безконтактним методом
Наступний патент: Спосіб однореакторного паралельного синтезу вторинних амінів
Випадковий патент: Траверса для стикування космічного апарата












