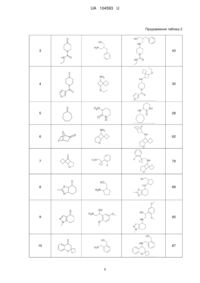
Спосіб однореакторного паралельного синтезу вторинних амінів
Формула / Реферат
1. Спосіб однореакторного паралельного синтезу вторинних амінів, в якому кетон формули (І):
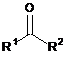 , (I)
, (I)
в якій
R1 являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2-С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-С6алкілу, -N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SC1-С6алкілу, -SOC1-С6алкілу або -SO2C1-C6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9 гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-С6алкілу, -N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SC1-C6алкілу, -SOC1-С6алкілу або -SO2C1-C6алкілу;
R2 являє собою С1-С6 алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10 арил, С2-С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6 алкілу, С2-С6 алкенілу, С2-С6 алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-C6алкілу, -N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОC1-С6алкілу, -SС1-С6алкілу, -SO С1-С6алкілу або -SO2С1-С6алкілу, і де до С3-С10 циклоалкілу, С6-С10арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6 алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SО2С1-С6алкілу;
або R1 та R2 можуть бути об'єднані разом утворюючи циклічний або спіроциклічний кетон, що має від 3 до 10 атомів вуглецю в циклічній системі і який необов'язково має гетероатоми в циклічній системі, такі як О, S або N, і який необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6 алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1-С6алкілу, і до якого необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, - С1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1-С6алкілу; вводять в реакцію з первинним аміном формули (II):
![]() , (II)
, (II)
в якій
R3 являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10 циклоалкіл, С6-С10арил, С2-С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -COС1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1-С6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С1-С6алкенілу, С1-С6алкінілу, С1-С6алкокси, С3-С10 циклоалкілу, С6-С10арилу, С2-С9 гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SC1-C6алкілу, -SOC1-С6алкілу або -SO2C1-C6алкілу;
в присутності ізопропоксиду титану (IV) та 1-(триметилсиліл)-2-піролідинону при нагріванні з наступним відновленням одержаного проміжного продукту боргідридом натрію (NaBH4), з утворенням вторинного аміну формули (III):
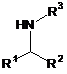 , (III)
, (III)
де R1, R2 та R3 є такими як визначено вище.
2. Спосіб за п. 1, в якому Ті(ОіРr)4 і 1-ТМС-піролідинон використовують в кількості 0,03 еквівалентів і 2,5 еквівалентів, відповідно, на 1 еквівалент субстрату.
Текст
Реферат: Спосіб однореакторного паралельного синтезу вторинних амінів, в якому кетон формули (І): O R 1 R 2 , (I) в якій 1 R являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-С6алкілу, N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SC1-С6алкілу, -SOC1-С6алкілу або -SO2C1C6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С 1-С6алкілу, С2-С6алкенілу, С2С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, CN, NO2, -NHC1-С6алкілу, -N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SC1-C6алкілу, SOC1-С6алкілу або -SO2C1-C6алкілу; 2 R являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількість замісників незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-C6алкілу, N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОC1-С6алкілу, -SС1-С6алкілу, -SO С1-С6алкілу або -SO2С1С6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількість замісників незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, CN, NO2, -NHС1-С6алкілу, -N(С1-С6 алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, SOС1-С6алкілу або -SО2С1-С6алкілу. UA 104593 U (54) СПОСІБ ОДНОРЕАКТОРНОГО ПАРАЛЕЛЬНОГО СИНТЕЗУ ВТОРИННИХ АМІНІВ UA 104593 U UA 104593 U 5 10 15 Корисна модель відноситься до галузі органічної хімії, а саме до способу однореакторного паралельного синтезу вторинних амінів, що базується на відновному амінуванні кетонів. Перетворення карбонільних сполук з використанням відновного амінування представляє легкий і надійний спосіб одержання функціоналізованих амінів, що робить великий внесок у розвиток синтетичної та медичної хімії. Існує два підходи до реакції відновного амінування: прямий і непрямий синтез. У прямому способі синтезу поєднують амін, карбонільний компонент і відновник, що спрощує експериментальну процедуру. У непрямому підході відновленню підлягає попередньо синтезований імін. Обидва способи, розроблені належним чином, дозволяють проводити синтез в одному реакторі і тому зручні для одержання бібліотек вторинних амінів. На сьогоднішній день в галузі комбінаторної хімії існує потреба оптимізації способів паралельного синтезу вторинних амінів, структурних елементів багатьох лікарських засобів, з використанням відновного амінування кетонів. Для досягнення мети винахідники розробили спосіб, який задовольняє критеріям паралельного синтезу: (а) використання недорогого, стабільного і безпечного відновника, (б) проста методика в одному реакторі, (с) проста експериментальна процедура з використанням доступного лабораторного обладнання. Відповідно, об'єктом корисної моделі є однореакторний паралельний синтез вторинних амінів, що базується на відновному амінуванні кетонів, з загальною формулою (І): O R 20 25 30 35 40 45 50 55 1 R 2 , (I) в якій 1 R являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-C6алкілу, N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1С6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників незалежно вибраних з С 1-С6 алкілу, С2-С6алкенілу, С2С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, SOС1-С6алкілу або -SO2С1-С6 алкілу; 2 R являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6 алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1С6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9 гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників незалежно вибраних з С 1-С6алкілу, С2-С6алкенілу, С2С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, SOС1-С6алкілу або -SO2С1-С6алкілу; 1 2 або R та R можуть бути об'єднані разом утворюючи циклічний або спіроциклічний кетон, що має від 3 до 10 атомів вуглецю в циклічній системі і який необов'язково має гетероатоми в циклічній системі, такі як О, S або N, і який необов'язково заміщений одним або більшою кількістю замісників незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, -SOС1С6алкілу або -SO2С1-С6алкілу, і до якого необов'язково приконденсований С6-С10арил або С2С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2C1C6алкілу; що вводять в реакцію з первинним аміном з загальною формулою (II): 1 UA 104593 U R 3 H2N 5 10 15 , (II) в якій 3 R являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1С6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С 1-С6алкілу, С2-С6алкенілу, С2С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9 гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6 алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, SOС1-С6алкілу або -SO2С1-С6алкілу; в присутності ізопропоксиду титану (IV) та 1-(триметилсиліл)-2-піролідинону при нагріванні з наступним відновленням одержаного проміжного продукту боргідридом натрію (NaBH4), з утворенням вторинного аміну формули (III): HN R 1 20 25 30 35 40 45 50 2 1 R 3 2 R , (III) 3 де R , R тa R є такими як визначено раніше. Як зазначається вище, термін "галоген" означає хлор, бром, йод та фтор. Термін "С1-С6 алкіл" стосується алкільного радикалу, що має від одного до шести атомів вуглецю, і має нерозгалужену або розгалужену будову. Прикладами алкільних груп є, але не обмежується, метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, тpeт-бутил, пентил, 2пентил, 3-пентил, ізопентил, неопентил, (R)-2-метилбутил, (S)-2-метилбутил, 3-метилбутил, 2,3диметилпропіл, 2,3-диметилбутил, гексил і т.і. Термін "С2-С6 алкеніл", стосується алкенільного радикалу, що містить від двох до шести атомів вуглецю, і має нерозгалужену або розгалужену будову. Алкенільними групами є, але не обмежується, етеніл, 1-пропеніл, 2-пропеніл, 2-метил-2-пропеніл, бутеніл, пентеніл, 3-гексеніл і т.і… Термін "С2-С6 алкініл", стосується алкінільного радикалу, що містить від двох до шести атомів вуглецю, і має нерозгалужену або розгалужену будову. Алкінільними групами є, але не обмежується, етиніл, 1-пропініл, 2-пропініл, 2-метил-2-пропініл, бутиніл, пентиніл, 3-гексиніл і т. і Термін "С1-С6алкокси", стосується алкокси радикалу, що має від одного до шести атомів вуглецю, що мають нерозгалужену або розгалужену будову. Алкокси групами є, але не обмежується, метокси, етокси, пропокси, ізопропокси, бутокси, гексилокси і т.і… Термін "С3-С10 циклоалкіл", як тут використовується, стосується моно, конденсованих або місткованих біциклічних або трициклічних карбоциклічних кілець, що містять, в деяких втіленнях, від трьох до десяти атомів вуглецю. Як тут використовується, циклоалкільні кільця можуть необов'язково містити один або два подвійні зв'язки. Термін "циклоалкіл" також включає спіроциклоалкільні групи, включаючи поліциклічні системи, зв'язані через один атом. Циклоалкільними групами є, але не обмежується, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, біцикло[2,2,1]гептаніл, біцикло[3,2,1]октаніл, біцикло[5,2,0]нонаніл, адамантил і т.і… Термін "С6-С10арил", як тут використовується, стосується групи, що походить від ароматичного вуглеводню, що містить від шести до десяти атомів вуглецю. Прикладами таких груп є, але не обмежується, феніл і нафтил. Термін "арил" також включає конденсовані поліциклічні ароматичні системи, в яких ароматичне кільце є конденсованим з одним або більше кілець. Прикладами є, але не обмежується, 1-нафтил, 2-нафтил, 1-антрацил і 2антрацил. Також включеними в межі рамок терміну "арил", як тут використовується, є група, в якій ароматичне кільце є конденсованим з одним або більше неароматичних кілець, таким як інданіл, фенантридиніл або тетрагідронафтил, де радикал або точка приєднання знаходиться на ароматичному кільці. Термін "С2-С9гетероарил", як тут використовується, стосується ароматичної моноциклічної або біциклічної гетероциклічної групи, що має загалом від 5 до 9 атомів в кільці, і що містить від 2 до 9 атомів вуглецю і від одного до чотирьох гетероатомів, що незалежно вибирають з азоту, 2 UA 104593 U 5 10 15 20 25 30 35 40 45 50 кисню і сірки, за умови, що кільце згаданої групи не містить два сусідні атоми кисню або два сусідні атоми сірки. Гетероарильні групи є бензо-конденсованими циклічними системами. Прикладами гетероарильних груп є, але не обмежується, піроліл, фурил, тієніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, ізотіазоліл, триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл, тіазоліл, тетразоліл, піридиніл, піразиніл, піримідил, піридазиніл, триазиніл, індоліл, ізоіндоліл, індолізиніл, бензофураніл, бензотіофеніл, індазоліл, бензімідазоліл, бензоксазоліл, фуро[3,2й]піридиніл, бензотіазоліл, бензофуразаніл, пуриніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, цинолініл, фталазиніл, піридо[3,4-d]піримідил, птеридиніл і т.і… Запропонований спосіб однореакторного паралельного синтезу вторинних амінів складається з двох стадій, що виконуються в одному реакторі, і які можна зобразити наступним чином: На першій стадії утворюється активний проміжний продукт, який відновлюється на другий стадії. Для уніфікації і спрощення стадії одержання проміжного продукту було використано промотор, такий як ізопропоксид титану (IV) (Ті(ОіРr)4), що утворює активний проміжний продукт, який далі відновлюється. Для узагальнення підходу винахідники використали суміш Ті(ОіРr)4 та 1-(триметилсиліл)-2піролідинону (l-TMS-піролідинону), яка дозволила підвищити ефективність формування і відновлення іміну. 1-(триметилсиліл)-2-піролідинон (l-TMS-піролідинону) є сумісним з NaBH4 та продукує побічні продукти, які легко відокремити, гексаметилдисилоксан і піролідинон, що дозволяє спростити спосіб однореакторного паралельного синтезу вторинних амінів. Як відновник винахідники обрали боргідрид натрію (NaBH4), який є недорогим, стабільним і безпечним відновником порівняно з іншими поширеними відновниками. Проблему низької реакційної здатності NaBH4 по відношенню до імінів, отриманих з просторово-ускладнених амінів або кетонів, було вирішено шляхом застосування згаданого вище промотора або шляхом видалення води за рахунок гідролізу 1-TMS-піролідинону. Оптимізація умов реакції дозволила визначити необхідну кількість Ті(ОіРr)4 і 1-ТМСпіролідінону: 0,03 еквівалентів і 2,5 еквівалентів на 1 еквівалент субстрату, відповідно. Таким чином, винахідники використовували 1,1 моль % Ті(ОіРr)4 в 1-ТМС-піролідиноновій суміші на стадії утворення іміну. Застосування такої суміші суттєво зменшило кількість титанової кислоти, що є побічним продуктом реакції, і дозволило замінити трудомістку фільтрацію і промивання простою екстракцією хлороформом (СНСІ3). Для проведення тестових дослідів було вибрано 20 кетонів з різними структурними елементами: ациклічні та циклічні, алкіл і арил, та варіюванням електрофільності карбонільної групи (колонка 1 в Таблиці 1 та Таблиці 2). Далі для експериментів було вибрано 20 первинних амінів: моно- і функціоналізованих, з алкільними і арильними замісниками, та варіюванням нуклеофільності аміногрупи (колонка 2 в Таблиці 1 і Таблиці 2). Винахідниками було проведено 20 паралельних реакцій відновного амінування для перевірки оптимізованого підходу (Таблиця 1, Таблиця 2). Мета винахідників полягала в тому, щоб синтезувати різноманітний ряд, який представляв би всі можливі випадки. Для одержання іміну змішували разом кетон 1, амін 2 і 1,1 моль% Ті(ОіРr)4 в 1-ТМСпіролідиноні і нагрівали реакційну суміш при 70 °C, перемішуючи за рахунок струшування. Потім відновлювали утворений проміжній продукт, іміновий комплекс титану(ІУ), за допомогою NaBH4 при кімнатній температурі. Використовуючи вищевказаний спосіб синтезу в одному реакторі, отримали вторинні аміни 3 з 30-96 % виходом і високою чистотою (Таблиця 1, Таблиця 2). РХМС-аналіз неочищених зразків показав, що основні домішки були вихідні матеріали. Додаткове очищення проводили в 30 % випадків за допомогою колонної хроматографії (Експерименти 3, 5, 3 UA 104593 U 5 10 15 20 7 в Таблиці 1, Експерименти 3-5 у Таблиці 2). Щоб довести ідентичність і чистоту отриманих 1 13 сполук, їх охарактеризували за допомогою Н і С ЯМР-спектроскопії, елементним та РХ-МСаналізом. ЯМР-спектри амінів, отриманих з хіральних субстратів містили діастереомеричні суміші (Експерименти 1, 2, 5, 7, 8 в Таблиці 1 і Експерименти 1, 3, 4, 6-9 у Таблиці 2). Експериментальні дані показують, що оптимізований метод забезпечує майже однакову ефективність в реакціях з ациклічними і циклічними (середні виходи 74 % і 66 %, відповідно), алкіл і арил кетонами (середні виходи 65 % і 76 %, відповідно). Метод не обмежується алкіламінами: сполуки 3 отримані з ариламінів 2, менш активних нуклеофілів, були отримані з середніми і високими виходами (Експеримент 3 і 6 в Таблиці 1, Експеримент 2 у Таблиці 2). Тестові експерименти підтвердили ефективність запропонованого підходу для отримання вторинних амінів, синтезованих з одного або обох просторово утруднених субстратів, наприклад, Експерименти 5 і 7 у Таблиці 1, Експеримент 6 у Таблиці 2. Наявність додаткових функціональних груп в амінах 2 не вплинула на вихід і чистоту кінцевих продуктів (Експерименти 1, 2,8 в Таблиці 1 і Експерименти 8-10 у Таблиці 2). В цілому, був створений метод однореакторного відновного амінування кетонів, оптимізованого для умов паралельного синтезу. Цей метод дозволив отримати колекцію вторинних амінів, з субстратів що містили легкодоступну або стерично утруднену карбонільну або аміногрупи, довівши таким чином можливість його застосування для широкого діапазону реагентів. Винахідники вважають, що цей спосіб допоможе дослідникам розширити колекцію синтетично доступних вторинних амінів. Таблиця 1 Вторинні аміни, отримані з ациклічних кетонів Експеримент 1 2 3 Вихід (%) 1 96 2 78 3 46 4 85 5 40 4 UA 104593 U Продовження таблиці 1 6 72 7 42 8 88 9 90 10 83 Таблиця 2 Вторинні аміни, отримані з циклічних кетонів Експеримент 1 2 3 Вихід (%) 1 60 2 83 5 UA 104593 U Продовження таблиці 2 3 43 4 30 5 28 6 62 7 79 8 89 9 95 10 87 6 UA 104593 U 5 10 15 20 25 30 35 40 45 50 55 60 Експериментальний розділ Аміни, кетони, розчинники, NaBH4, та Ті(ОіРr)4 отримували з комерційно доступних джерел (Aldrich, Enamine Ltd.) та використовували без подальшої очистки. 1-(триметилсиліл)-2піролідинон був синтезований відповідно до попередньо описаної методики. ЯМР-спектри знімали на спектрометрі BrukerAvance DRX 500 використовуючи CDCI3 або ДМСO-d6 як розчинники та СНСl3 чи ДМСO-d6 як внутрішні стандарти, відповідно. Точки плавлення визначали на апараті плавлення Buchi і представлені без коригування. РХ-МС аналіз проводили на Agilent 1100 HPLC обладнаному діодною матрицею та мас-селективним детектором Agilent LC/MSD SL. Відповідно до РХ-МС аналізу всі синтезовані сполуки мають чистоту понад 95 %. Елементний аналіз проводили на Vario MICRO Cube (Elementar) Elemental Micro-Analyzer. ІЧспектри були отримані на Perkin-Elmer Spectrum BX II (FTIR). Загальна процедура відновного амінування кетонів в одному реакторі в умовах паралельного синтезу Стадія (і): Кетон 1 (1 ммоль), первинний амін 2 (1 ммоль) та суміш Ті(ОіРr)4 (0,01 моль) в 1(триметилсиліл)-2-піролідиноні (2,5 ммоль) нагрівали до 70 °C при струшуванні в герметичній посудині протягом 6 годин. Стадія (іі): Після охолодження до кімнатної температури, до розчину додавали 2 мл ЕtOН та струшували в шейкері до повної гомогенізації і потім додавали NaBH4 (1,8 ммоль). Отриману гетерогенну суміш залишали на ніч при кімнатній температурі. Далі, додавали 2 мл Н2О та обробляли суміш ультразвуком протягом 2 годин при кімнатній температурі, для розкладання надлишку NaBH4. Продукт екстрагували 3 мл СНСl3, органічну фазу промивали Н2О (37 мл), висушували над Na2SO4 та упарювали розчинник. Зразки з чистотою нижче 90 %, що 1 визначалась за допомогою РХ-МС чи Н ЯМР спектроскопії, далі очищали колонною хроматографією (SiO2, розчинник А: СНСl3, розчинник В: /РrОН, лінійний градієнт від 0 % 100 % розчинник В). 2-(1-метил-3-феніл-пропіламіно)-1-n-толілетанол (Експеримент 1, Табл. 1) Вихід: 271 мг, 96 %; жовтувата тверда речовина, Тпл. 65-67 °C. -1 ІЧ (КВr): 3385, 3290, 3085, 3064, 3025, 2971, 2941, 2919, 2860, 2817, 1458, 1071 см . 1 Н ЯМР (500 МГц, CDCl3): δ=1,00 (м, 3Н, СН3), 1,51 (м, 1Н, СН), 1,65 (м, 1Н, СН), 2,27 (с, 3Н, СН3), 2,52-2,62 (м, 4Н, 2СН2), 2,62-2,71 (м, 1Н, СН), 3,40 (шс, 1Н, NH), 4,54 (м, 1Н, СН), 5,18 (шс, 1Н, ОН), 7,11 (м, 2Н, Аr), 7,15 (м, 3Н, Аr), 7,23 (м, 4Н, Аr). 13 С ЯМР (125 МГц, ДМСО-d6) δ=20,3, 20,4, 20,8, 31,6 (2), 38,5, 38,6, 51,8, 51,9, 55,0, 55,1, 71,7, 71,8, 125,6 (2), 125,9, 128,3, 128,6, 135,8, 141,7 (2), 142,5, 142,6. + МС m/z [M+H] підраховано для C19H26NO: 284,2; знайдено: 284,2. Аналітичні підрахунки для C19H25NO: С, 80,52; Н, 8,89; N, 4,94; знайдено С, 80,48; Н, 8,77; N, 4,89. 2-(5-бром-2-метоксифеніл)-2-(3-метил-4-(2-нітрофеніл)бутан-2-іламіно)етанол (Експеримент 2, Табл. 1) Вихід: 428 мг, 78 %; жовтувата масляниста рідина. 1 H ЯМР (500 МГц, ДМСO-d6): =0,5-1,1 (м, 6Н, 2СН3), 1,5-2,6 (м, СН + СН2+NH), 3,0-3,3 (м, 2Н, СН2), 3,4-3,51 (м, 1Н, СН), 3,75 (м, 3Н, СН3), 4,0-4,6 (м, 1Н, СН), 4,7-4,9 (м, 1Н, ОН), 6,91 (м, 1Н, Аr), 7,1-7,9 (м, 6Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =12,4 (2), 15,5, 15,8, 16,9, 20,5, 30,0, 32,6, 35,6, 36.2, 41,5, 50,9, 52,6, 55,0, 55,4, 55,7, 55,8, 55,9, 64,7, 64,9, 65,7, 68,1, 69,3, 112,1, 112,2, 113,0, 113,2, 124,4, 127,4, 130,0, 130,1, 132,8, 144,3, 149,3, 149,9, 150,1, 155,7, 156,3, 156,4 (2). + МС m/z [M+H] підраховано для C20H26BrN2O4: 438,1; знайдено: 438,2. Аналітичні підрахунки для C20H25BrN2O4: С, 54,93; Н, 5,76; N, 6,41; знайдено С, 54,87; Н, 5,71; N, 6,47. 6-метокси-N-(1-метил-1H-піразол-4-іл)пропан-2-іл)піридин-3-амін (Експеримент 3, Табл. 1) Вихід: 113 мг, 46 %; жовтувата масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =1,04 (д, J=6,3 Гц, 3Н, СН3), 2,40 (дд, J=14,5, 7,5 Гц, 1Н, СН2), 2,61 (дд, J=14,3, 5,2 Гц, 1Н, СН2), 3,43 (м, 1Н, СН), 3,72 (с, 3Н, СН3), 3,76 (с, 3Н, СН3), 5,06 (д, J=8,4 Гц, 1Н, NH), 7,05 (дд, J-8,9, 3,0 Гц, 1Н, Аr), 7,25 (с, 1Н, Аr), 7,47 (с, 1Н, Аr), 7,5 (д, J=2,6 Гц, 1Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =18,8, 20,5, 30,0, 41,2, 50,0, 57,2, 58,6, 60,4, 63,7, 64.3, 100,7, 106,1, 117,2, 128,7, 128,1, 128,6, 134,3, 139,4, 143,2, 143,7. + МС m/z [M+H] підраховано для С13Н19N4О: 247,2; знайдено: 247,0. Аналітичні підрахунки для C13H18N4O: С, 63,39; Н, 7,37; N, 22,75; знайдено С, 63,32; Н, 7,29; N, 22,82. 7 UA 104593 U 5 10 15 20 25 30 35 40 45 50 55 Дициклопропіл-N-(1'-метил-1,4'-біпіперидин-4'-іл)метил)метанамін (Експеримент 4, Табл. 1) Вихід: 258 мг, 85 %; жовтувата масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =0,05-0,13(м, 2Н, СН2), 0,13-0,23 (м, 2Н, СН2), 0,3-0,45 (м, 4Н, 2СН2), 0,72-0,82 (м, 2Н, 2СН), 1,06 (т, J=8,1 Гц, 1Н, СН), 1,33-1,52 (м, 10Н, 5СН2), 1,64-1,72 (м, 2Н, СН2), 2,07-2,16 (м, 5Н, NCH3 + СН2), 2,38-2,45 (м, 2Н, СН2), 2,46-2,5 (м, 2Н, СН2), 2,63 (с, 2Н, СН2), 2,9-3,2 (ш с, 1Н, NH). 13 С ЯМР (125 МГц, ДМСO-d6): 8=1,8, 2,8, 16,4, 25,0, 27,2, 29,7, 45,6, 46,1, 49,6, 51,6,55,9,67,1. + МС m/z [M+H] підраховано для C19H36N3: 306,3; знайдено: 306,4. Аналітичні підрахунки для C19H35N3: С, 74,70; Н, 11,55; N, 13,75; знайдено С, 74,66; Н, 11,60; N, 13,68. N-(циклопропіл(2,5-дифлуорфеніл)метил)-1-(5-флуорпіридин-3-іл)етанамін (Експеримент 5, Табл. 1) Вихід: 121 мг, 40 %; жовтувата тверда речовина, Тил. 75-77 °C. ІЧ (КВr): 3287, 3089, 3072, 3006, 2983, 2973, 2925, 2860, 1594, 1583, 1485, 1431, 1257, 1 1146,1027 см- . 1 Н ЯМР (500 МГц, ДМСO-d6): =0-0,16 (м, 2Н, СН2), 0,22-0,33 (м, 1Н, СН2), 0,44-0,65 (м, 1Н, СН2), 0,95-1,13 (м, 1Н, СН), 1,16-1,3 (м, 3Н, СН3), 2,74-2,82, 2,83-2,93 (м, 1Н, NH), 2,95-3,06, 3,153,2 (м, 1Н, СН), 3,4-3,53, 3,89-3,97 (м, 1Н, СН), 6,95-7,2 (м, 2Н, Аr), 7,28-7,35, 7,43-7,53 (м, 1Н, Аr), 7,55-7,7 (м, 11Н, Аr), 8,18-8,25, 8,3-8,32(м, 1Н, Аr), 8,32-8,34, 8,38-7,43 (м, 1Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): 8=2,3, 4,6, 17,2, 17,9, 23,6, 24,3, 52,0, 52,7, 56,3, 57,3, 114,6 (дд, J1=24 Гц, J2=5 Гц), 116,4 (дд, h=25 Гц, J2=8,8 Гц), 116,7 (дд, J, = 26 Гц, h=8,8 Гц), 120,7 (д, J=18 Гц), 120,8 (д, J=18 Гц), 133,0 (дд, J, = 17 Гц, J2=6,3 Гц), 135,8 (д, J=24 Гц), 136,3 (д, J=24 Гц), 143,65, 143,7 (д, J=3,8 Гц), 144,8 (д, J=3,8 Гц), 156,4 (д, J=240 Гц), 158,8 (д, J=240 Гц), 159,5 (д, J=254 Гц). + МС m/z [M+H] підраховано для C17H18F3N2: 307,1; знайдено: 307,0. Аналітичні підрахунки для C17H17F3N2: С, 66,66; Н, 5,59; N, 9,14; знайдено С, 66,72; Н, 5,53; N, 9,10. N-(1-(2,5-диметоксифеніл)етил)-3,4-диметилбензенамін (Експеримент 6, Табл. 1) Вихід: 205 мг, 72 %; жовтувата масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =1,31 (д, J=6,6 Гц, 3Н, СН3), 1,99 (с, 3Н, СН3), 2,02 (с, 3Н, СН3), 3,60 (с, 3Н, СН3), 3,80 (с, 3Н, СН3), 4,69 (м, 1Н, СН), 5,74 (д, J=8,2 Гц, 1Н, NH), 6,13 (д, J=8,6 Гц, 1H, Аr), 6,31 (с, 1Н, Аr), 6,69 (м, 2Н, Аr), 6,87 (м, 2Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): 8=18,3, 19,9, 22,8, 45,8, 55,1, 56,0, 110,0, 110,8, 111,7, 112,6, 114,5, 122,9, 129,8, 135,2, 135,9, 146,0, 150,6, 153,4. + МС m/z [M+H] підраховано для C18H24NO2: 286,2; знайдено: 286,0. Аналітичні підрахунки для C18H23NO2: С, 75,76; Н, 8,12; N, 4,91; знайдено С, 75,80; Н, 8,00; N, 4,85. N-(4-(метилсульфініл)феніл)етил)-N-фенілфуран-2-амін (Експеримент 7, Табл. 1) Вихід: 142 мг, 42 %; жовтувата тверда речовина, Тпл. 73-75 °C. -1 ІЧ (КВr): 3298, 3111, 3062, 3030, 2966, 2914, 2847, 1497, 1087, 1044, 1010 см . 1 Н ЯМР (500 МГц, ДМСO-d6): =1,28 (дд, J=13,4, 6,6 Гц, 3Н, СН3), 2,73 (д, J=2,7 Гц, 3Н, СН3), 2,93-3,21 (м, 1Н, NH), 3,5-3,62, 3,67-3,8 (м, 1Н, СН), 4,52 (д, J=25,3 Гц, 1Н, СН), 6,13 (с, 0,5Н, Het), 6,31 (с, 1Н, Het), 6,41 (с, 0,5Н, Het), 7,17-7,36 (м, 5Н, Аr), 7,43-7,57 (м, 3Н, Аr), 7,63 (м, 2Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =24,2, 24,3, 43,2, 54,5, 54,5, 55,0 (2), 57,6, 58,0, 105,9, 106,7, 110,3 (2), 123,9, 127,1, 127,3, 127,4, 127,6, 127,7, 128,2, 128,4, 141,4, 141,8, 142,0, 142,2, 144,5, 148,7, 148,9, 156,2, 156,8. + МС m/z [M+H] підраховано для C20H22NO2S: 340,1; знайдено: 340,0. Аналітичні підрахунки для C20H21NO2S: С, 70,77; Н, 6,24; N, 4,13; знайдено С, 70,73; Н, 6,30; N, 4,17. 1-(2-((1-фенілпропіламіно)метил)бензил)піперидин-4-ол (Експеримент 8, Табл. 1) Вихід: 296 мг, 88 %; жовтувата масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =0,70 (т, J=7,4 Гц, 3Н, СН3), 1,26 (м, 2Н, СН2), 1,53 (м, 1Н, СН2), 1,60 (м, 2Н, СН2), 1,67 (м, 1Н, СН2), 1,94 (м, 2Н, СН2), 1,53 (м, 1Н, NH), 2,58 (м, 1Н, СН), 3,42 (д, J=13,2 Гц, 2Н, СН2), 3,51 (м, 2Н, СН2), 4,53 (ш с, 1Н, ОН), 7,18 (м, 5Н, Аr), 7,32 (м, 4Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =10,6, 30,7, 34,4, 48,8, 60,2, 63,9, 73,7, 125,9, 126,3, 126,6, 127,0, 127,4, 127,9, 128,1, 129,8, 130,4, 136,9, 140,1, 144,4. + МС m/z [M+H] підраховано для C22H31N2O: 339,3; знайдено: 339,4. 8 UA 104593 U 5 10 15 20 25 30 35 40 45 50 55 Аналітичні підрахунки для C22H30N2O: С, 78,06; Н, 8,93; N, 8,28; знайдено С, 78,10; Н, 8,87; N, 8,22. N-бензил(циклопропіл)(3-(трифлуорметил)феніл)метанамін (Експеримент 9, Табл. 1) Вихід: 274 мг, 90 %; жовтувата масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =0,21 (м, 1Н, СН2), 0,29 (м, 2Н, СН2), 0,53 (м, 1Н, СН2), 0,99 (м, 1Н, СН), 2,70 (ш с, 1Н, NH), 2,93 (д, J=8,5 Гц, 1Н, СН), 3,46 (д, J=14 Гц, 1Н, СН2), 3,56 (д, J=13,7 Гц, 1Н, СН2), 7,26 (м, 5Н, Аr), 7,56 (м, 2Н, Аr), 7,65 (д, J=7,8 Гц, 1Н, Аr),7,73(с, 1Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =2,4, 4,9, 18,8, 50,6, 65,7, 123,5 (к, J=4Гц), 124,5 (к, J=276Гц), 126,5, 127,8, 128,1, 129,2, 131,5, 140,8, 146,1. + МС m/z [M+H] підраховано для C18H19F3N: 306,2; знайдено: 306,3. Аналітичні підрахунки для C18H18F3N: С, 70,80; Н, 5,94; N, 4,59; знайдено С, 70,83; Н, 5,87; N, 4,52. N-(2,5-диметоксибешил)(4-флуорфеніл)(1-метил-1H-піразол-3-іл)метанамін (Експеримент 10, Табл. 1) Вихід: 294 мг, 83 %; жовтувата масляниста рідина. 1 H ЯМР (500 МГц, ДМСO-d6): =2,65 (ш с, 1Н, NH), 3,53 (с, 2Н, СН2), 3,67 (с, 3Н, СН3), 3,68 (с, 3Н, СН3), 3,74 (с, 3Н, СН3), 4,76 (с, 1Н, СН), 6,08 (д, J=2,1 Гц, 1Н, СН), 6,75 (дд, J=3,0, 8,8 Гц, 1Н, СН, Аr), 6,85 (д, J=8,8 Гц, 1Н, СН, Аr), 6,92 (д, J=2,7 Гц, 1Н, Аr), 7,11 (т, J=8,8 Гц, 2Н, Аr), 7,43 (м, 2Н, Аr), 7,53 (д, J=1,8 Гц, 1Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =38,3, 45,4, 55,3, 55,7, 59,3, 102,7, 111,6 (д, J=21,4 Гц), 114,8 (д, J=20 Гц), 115,1, 129,3 (д, J=8,2 Гц), 129,6, 131,3, 140,0 (д, J-2,5 Гц), 152,2, 154.5.161,1 (д, J=243 Гц). + МС m/z [M+H] підраховано для C20H23FN3O2:356,2; знайдено: 356,2. Аналітичні підрахунки для C20H20FN3O2: С, 67,59; Н, 6,24; N, 11,82; знайдено С, 67,63; Н, 6,18; N, 11,85. N-(1-(5-флуорпіридин-3-іл)етил)-2-метилциклопентанамін (Експеримент 1, Табл. 2) Вихід: 133 мг, 60 %; жовтувата масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =0,78-0,91 (м, 3Н, СН3), 0,97-1,15 (м, 1Н, СН2), 1,17-1,32 (м, 4Н, СН3 + СН2), 1,3-1,85 (м, 5Н, СН2), 1,95-2,12 (м, 1Н, NH), 2,3-2,38 (м, 0,5Н, СН), 2,6-2,66 (м, 0,5Н, СН), 3,73-3,90 (м, 1Н, СН), 7,64 (м, 1Н, Аr), 8,40 (м, 2Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =13,9, 19,5, 19,5, 20,3, 21,8, 22,2, 24,1, 24,5, 29,9, 31,2, 32,5, 33,1, 34,5, 36,6, 52,7, 53,0, 53,2, 53,4, 58,9, 59,4, 63,5, 64,3, 120,7 (2) (д, J=18 Гц), 120,8 (д, J=18 Гц), 135,8 (д, J=23 Гц), 135,9 (2) (д, J=23 Гц),144,6 (д, J=2,5 Гц), 144,8, 144.9.145.2 (д, J=2,5 Гц), 159,4 (д, J-254 Гц), 159,5 (д, J=254 Гц). + МС m/z [M+H] підраховано для C13H20FN2:223,2; знайдено: 223,2. Аналітичні підрахунки для C13H19FN2: С, 70,24; Н, 8,61; N, 12,60; знайдено С, 70,20; Н, 8,57; N, 12,55. N-(2-метил-5-морфолін-4-ілметилфеніл)-(тетрагідротіопіран-4-іл)-амін (Експеримент 2, Табл. 2) Вихід: 254 мг, 83 %; біла тверда речовина, Тпл. 95-97 °C. ІЧ (КВr): 3395, 3055, 3017, 2962, 2941, 2898, 2850, 2809, 2765, 1610, 1527, 1453, 1110,1007 -1 см . 1 Н ЯМР (500 МГц, CDCl3): =1,58 (к, J=11,3 Гц, 2H, СН2), 2,04 (с, 3Н, СН3), 2,18 (д, J=14,3 Гц, 2Н, СН2), 2,31 (м, 4Н, 2СН2), 2,65 (м, 2Н, СН2), 2,75 (м, 2Н, СН2), 3,29 (м, 1Н, СН), 3,55 (м, 4Н, 2СН2), 4,34 (д, J=8,2 Гц, 1Н, NH), 6,42 (д, J=7,3 Гц, 1Н, Аr), 6,5 (с, 1Н, Аr), 6,88 (д, J=7,1 Гц, 1Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =17,5, 27,3, 33,9, 50,1, 53,3, 62,9, 66,3, 110,6, 116,5, 120,8,129,9, 136,0, 144,7. + МС m/z [M+H] підраховано для C17H27N2OS: 307,2; знайдено: 307,2. Аналітичні підрахунки для C17H26N2OS: С, 66,62; Н, 8,55; N, 9,14; знайдено С, 66,67; Н, 8,43; N, 9,09. 4-(2-гідроксиметил-3-феніл-пропіламіно)-піперидин-1-карбонової кислоти етиламід (Експеримент 3, Табл. 2) Вихід: 137 мг, 43 %; жовтувата тверда речовина, Тпл. 83-85 °C. -1 ІЧ (КВr): 3506, 3443, 3271, 3061, 3023, 2974, 2931, 2851, 1677, 1620, 1451, 1050 см . 1 Н ЯМР (500 МГц, CDCl3): =0,99 (т, J=7,1 Гц, 3Н, СН3), 1,04 (м, 2Н, СН2), 1,66 (м, 2Н, СН2), 1,79 (м, 1Н, СН), 1,96 (м, 1Н, СН2), 2,07 (м, 1Н, СН2), 2,43 (м, 1Н, СН), 2,53 (м, 3Н, СН2+NH), 2,67 (т, J=12,1 Гц, 2Н, NCH2), 3,03 (м, 2Н, СН2), 3,20 (т, J=6,8 Гц, 1Н, ОН), 3,36 (м, 2Н, СН2), 3,79 (д, J=13,2 Гц, 2Н, ОСН2), 6,36 (т, J=5,2 Гц, NH), 7,16 (м, 3Н, Аr), 7,26 (т, J=7,5 Гц, 2Н, Аr). 9 UA 104593 U С ЯМР (125 МГц, ДМСO-d6): =15,7, 20,5, 30,0, 32,0, 32,1, 35,0, 35,5, 41,5, 42,3, 42,7, 48,1, 54,6, 63,3, 125,7, 128,2, 129,1, 141,0, 157,4. + МС m/z [M+H] підраховано для C18H30N3O2: 320,2; знайдено: 320,4. Аналітичні підрахунки для C18H29N3O2: С, 67,68; Н, 9,15; N, 13,15; знайдено С, 67,63; Н, 9,06; N, 13,09. 1-(фуран-3-карбоніл)-N-{3-етоксиспіро[3,3]гептан-1-іл}піперидин-4-амін (Експеримент 4, Табл. 2) Вихід: 100 мг, 30 %; жовта масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =1,12 (м, 3Н, СН3), 1,19 (м, 2Н, СН2), 1,55-1,9 (м, 6Н, ЗСН2), 1,96 (т, J=7,6 Гц, 1Н, СН2), 2,04 (т, J=7,6 Гц, 1Н, CH2), 2,20 (м, 1Н, СН2), 2,24 (м, 0,5Н, СН2), 2,52,54 (м, 1Н, NH), 2,54-2,60 (м, 0,5Н, СН2), 2,64-2,8 (м, 1Н, NCH), 2,8-3,1 (ш с, 1Н, NCH2), 3,09 (м, 0,5Н, СН), 3,1-3,24 (ш с, 1Н, NCH2), 3,3 (ш с, 0,5Н, CH), 3,40 (м, 2Н, ОСН2), 3,42-3,52 (м, 0,5Н, СН), 3,66-3,72 (м, 0,5Н, СН), 3,74-4,06 (ш с, 1Н, СН2), 4,1-4,4 (ш с, 1Н, СН2), 6,62 (с, 1Н, Het), 7,72 (с, 1Н, Het), 7,98 (с, 1Н, Het). 13 С ЯМР (125 МГц, ДМСO-d6): 8=15,5 (3), 16,2, 16,8, 19,1, 26,1, 26,4, 30,9, 33,1, 35,2, 50,1, 51,0, 52,5, 52,6 (2), 54,1, 63,4, 63,6, 74,0, 77,5, 110,5, 121,1, 143,4, 143,4, 162,5. + МС m/z [M+H] підраховано для C19H29N2O3: 333,2; знайдено: 333,3. Аналітичні підрахунки для C19H28N2O3: С, 68,65; Н, 8,49; N, 8,43; знайдено С, 68,71; Н, 8,42; N, 8,47. 3-(циклогептиламіно)піперидин-2-он (Експеримент 5, Табл. 2) Вихід: 62 мг, 28 %; білувата тверда речовина, Тпл. 70-72 °C. -1 ІЧ (КВr):3546, 3306, 3204, 2928, 2852, 1645, 1496, 1465, 1445, 1420 см . 1 Н ЯМР (500 МГц, ДМСO-d6): =1,2-1,43 (м, 6Н, ЗСН2), 1,43-1,61 (м, 6Н, ЗСН2), 1,62-1,83 (м, 4Н, 2СН2), 1,92-2,03 (м, 1Н, NH), 2,60-2,70 (м, 1Н, NCH), 3,03-3,07 (м, 1Н, NCH), 3,091 (ш с, 2Н, NCH2), 7,50 (ш с, 1Н, NHC(O)). 13 С ЯМР (125 МГц, ДМСO-d6): =20,6, 23,6, 23,8, 27,9, 28,1, 28,3, 33,3, 35,9, 41,0, 55,0, 55,7, 172,5. + МС m/z [M+H] підраховано для С12Н23N2О: 211,2; знайдено: 211,4. Аналітичні підрахунки для С12Н22N2О: С, 68,53; Н, 10,54; N, 13,32; знайдено С, 68,57; Н, 10,48; N, 13,27. N-{біцикло[2.2.1]гептан-2-іл}-4-оксоспіро[біцикло[3.2.0]гептан-6,1'-циклобутан]-7-амін (Експеримент 6, Табл. 2) Вихід: 153 мг, 62 %; білувата масляниста рідина.1 Н ЯМР (500 МГц, ДМСO-d6): =0,56-0,74 (м, 1Н, СН2), 1,15-1,5 (м, 5Н, СН + СН2), 1,5-2,48 (м, 14Н, 3СН + 5СН2+NH), 2,7-2,9 (м, 1Н, NCH), 2,9-3,22 (м, 1Н, NCH), 3,44-3,56 (м, 1Н, ОСН), 3,763,96 (м, 1Н, ОСН2), 3,96-4,14 (м, 1Н, СН2). 13 С ЯМР (125 МГц, ДМСO-d6): =16,0, 16,6, 20,1 (2), 20,4, 20,6, 25,9, 26,4, 26,5, 30,0 (2), 32,7, 33,1, 36,4, 40,5, 41,0, 43,8, 44,5, 48,2, 50,3, 50,8, 54,9, 55,4, 56,0, 56,3 (2), 57,4 (2), 57,8, 61,3, 62,1, 68,1, 68,2, 68,9, 69,0, 81,1, 81,8. + МС m/z [M+H] підраховано для C16H26NO: 248,2; знайдено: 248,3. Аналітичні підрахунки для C16H25NO: С, 77,68; Н, 10,19; N, 5,66;знайдено С, 77,64; Н, 10,10; N, 5,58. N-{[1-(2-флуорфеніл)циклопропіл]метил}-4-оксоспіро[біцикло[3.2.0]гептан-6,1’-циклобутан]-7амін (Експеримент 7, Табл. 2) Вихід: 238 мг, 79 %; білувата масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =0,6-0,87 (м, 4Н, 2СН2), 1,32-2,10 (4СН2+NH), 2,3-2,4 (1Н, т, СН), 2,69 (м, 1Н, СН2), 3,32 (м, 3Н, 2СН + СН2), 3,9 (м, 2Н, ОСН2), 7,10 (м, 2Н, Аr), 7,25 (м, 1Н, Аr), 7,36 (м, 1Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =10,1, 10,4, 16,0, 16,5, 19,7, 21,7, 24,1, 25,7, 26,4, 30,6, 32,9, 49,8, 54,7 (2), 55,0, 56,6, 62,6, 67,9, 68,0, 68,6, 81,0, 81,5, 115,1 (д, J=23 Гц), 115,2 (д, J=23 Гц), 123,9 (д, J=3,8 Гц), 124,0 (д, J=3,8 Гц), 128,4 (д, J=7,5 Гц), 128,5 (д, J=7,5 Гц), 131,1 (д, J=14 Гц), 132,4 (д, J=5 Гц), 132,5 (д, J=5 Гц), 162,1 (д, J=245 Гц). + МС m/z [M+H] підраховано для C19H25FNO: 302,2; знайдено: 302,2. Аналітичні підрахунки для C19H24FNO: С, 75,71; Н, 8,03; N, 4,65;знайдено С, 75,78; Н, 7,90; N, 4,79. (2-(2-метил-4,5,6,7-тетрагідробензо[(і]тіазол-7-іламіно)циклопентил)метанол (Експеримент 8, Табл. 2) Вихід: 237 мг, 89 %; жовтувата масляна рідина. 13 5 10 15 20 25 30 35 40 45 50 55 10 UA 104593 U Н ЯМР (500 МГц, ДМСO-d6): =1,34-1,8 (м, 8Н, 4СН2), 1,8-2,1 (м, 4Н, СН2 + СН, + NH), 2,54 (с, 3Н, СН3), 2,55-2,61 (м, 2Н, СН2), 3,15-3,40 (м, 2Н, ОСН2), 3,45-3,54 (м, 1Н, СН), 3,81 (м, 1Н, СН), 4,51 (ш с, 1Н, ОН). 13 С ЯМР (125 МГц, ДМСO-d6): =18,9, 20,2, 20,3, 21,6, 21,8, 26,5 (2), 26,6, 30,0, 30,6, 31,8, 32,7, 44,3, 44,7, 50,7, 51,9, 57,2, 58,2, 61,2, 61,4, 63,3, 133,6, 133,9, 150,1, 162,8. + МС m/z [M+H] підраховано для C14H23N2OS: 267,2; знайдено: 267,4. Аналітичні підрахунки для C14H22N2OS: С, 63,12; Н, 8,32; N, 10,52; знайдено С, 63,08; Н, 8,20; N, 10,45. 1-(2,5-диметоксифеніл)-2-(1-метил-4,5,6,7-тетрагідро-1H-індазол-4-іламіно)етанол (Експеримент 9, Табл. 2) Вихід: 314 мг, 95 %; жовтувата масляниста рідина. 1 Н ЯМР (500 МГц, ДМСO-d6): =1,43-2,0 (м, 6Н, 3СН2), 2,47-2,57 (м, 2Н, СН2), 2,72-2,80 (м, 1Н, СН), 3,63 (с, 3Н, СН3), 3,65-3,71 (м, 4Н, NH + СН3), 3,72 (д, J=9,9 Гц, 3Н, СН3), 4,93 (м, 1Н, СН), 5,13 (ш с, 1Н, ОН), 6,75 (дд, J=8,8, 2,9 Гц, 1Н, Аr), 6,86 (дд, J=8,9, 2,9 Гц, 1Н, Аr), 7,0 (м, 1Н, Аr), 7,23 (д, J=9,1 Гц, 1Н, Het). 13 C ЯМР (125 МГц, ДМСO-d6): =18,9, 19,2, 20,7, 20,7, 29,4, 29,8, 35,4, 49,2, 49,4, 53,3, 53,6, 55,3, 55,9, 66,2, 66,3, 111,6, 111,7, 111,8, 111,9 (2), 112,6 (2), 118,8, 119,1, 133,8, 133,9, 135,6, 138,2, 138,3, 149,8 (2), 153,3 (2). + MC m/z [M+H] підраховано для C18H26N3O3: 332,2; знайдено: 332,2. Аналітичні підрахунки для C18H25N3O3: С, 65,23; Н, 7,60; N, 12,68; знайдено С, 65,30; Н, 7,50; N, 12,58. {2-[({3,4-дигідроспіро[1-бензопіран-2,1'-циклобутан]-4-іл}аміно)метил]-феніл}метанол (Експеримент 10, Табл. 2) Вихід: 267 мг, 87 %; жовтувата масляниста рідина. 1 H ЯМР (500 МГц, ДМСO-d6): =1,65-1,99 (м, 4Н, 2СН2), 2,0-2,35 (м, 5Н, 2СН2+NH), 3,75-3,90 (м, 3Н, NCH+NCH2), 4,63 (м, 2Н, ОСН2), 5,60 (ніс, 1Н, ОН), 6,73 (д, J=8,0 Гц, 1Н, Аr), 6,84 (д, J=7,4 Гц, 1Н, Аr), 7,08 (д, J=7,4 Гц, 1Н, Аr), 7,24 (м, 2Н, Аr), 7,40 (м, 2Н, Аr), 7,47 (д, J=7,4 Гц, 1Н, Аr). 13 С ЯМР (125 МГц, ДМСO-d6): =12,4, 33,9, 34,5, 34,7, 47,1, 49,0, 61,6, 77,9, 116,2, 116,5, 120,0, 125,3, 126,9, 127,7, 127,8, 128,0, 129,3, 138,4, 141,0, 153,3. + МС m/z [M+H] підраховано для C20H24NO2: 310,2; знайдено: 310,3. Аналітичні підрахунки для C20H23NO2: С, 77,64; H, 7,49; N, 4,53; знайдено С, 77,56; Н, 7,32; N, 4,43. 1 5 10 15 20 25 30 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 35 1. Спосіб однореакторного паралельного синтезу вторинних амінів, в якому кетон формули (І): O R 1 R 2 , (I) 40 45 50 55 в якій 1 R являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-С6алкілу, N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SC1-С6алкілу, -SOC1-С6алкілу або -SO2C1C6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9 гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, CN, NO2, -NHC1-С6алкілу, -N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SC1-C6алкілу, SOC1-С6алкілу або -SO2C1-C6алкілу; 2 R являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHC1-C6алкілу, N(C1-C6алкіл)2, -CONHC1-C6алкілу, -СОC1-С6алкілу, -SС1-С6алкілу, -SO С1-С6алкілу або -SO2С1 11 UA 104593 U 5 10 15 С6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С 1-С6алкілу, С2-С6алкенілу, С2С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, SOС1-С6алкілу або -SО2С1-С6алкілу; 1 2 або R та R можуть бути об'єднані разом утворюючи циклічний або спіроциклічний кетон, що має від 3 до 10 атомів вуглецю в циклічній системі і який необов'язково має гетероатоми в циклічній системі, такі як О, S або N, і який необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -SС1-С6алкілу, -SOС1С6алкілу або -SO2С1-С6алкілу, і до якого необов'язково приконденсований С6-С10арил або С2С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, N(С1-С6алкіл)2, -CONHС1-С6алкілу, -С1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1С6алкілу; вводять в реакцію з первинним аміном формули (II): R 20 25 30 35 H2N , (II) в якій 3 R являє собою С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, С3-С10циклоалкіл, С6-С10арил, С2С9гетероарил, кожен з яких може бути необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, N(С1-С6алкіл)2, -CONHС1-С6алкілу, -COС1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1С6алкілу, і де до С3-С10циклоалкілу, С6-С10арилу і С2-С9гетероарилу може бути необов'язково приконденсований С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С 1-С6алкілу, С1-С6алкенілу, С1С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9 гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6алкілу, -N(С1-С6алкіл)2, -CONHC1-C6алкілу, -СОС1-С6алкілу, -SC1-C6алкілу, SOC1-С6алкілу або -SO2C1-C6алкілу; в присутності ізопропоксиду титану (IV) та 1-(триметилсиліл)-2-піролідинону при нагріванні з наступним відновленням одержаного проміжного продукту боргідридом натрію (NaBH4), з утворенням вторинного аміну формули (III): HN R 40 3 1 R 3 2 R , (III) 1 2 3 де R , R та R є такими як визначено вище. 2. Спосіб за п. 1, в якому Ті(ОіРr)4 і 1-ТМС-піролідинон використовують в кількості 0,03 еквівалентів і 2,5 еквівалентів, відповідно, на 1 еквівалент субстрату. Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07C 209/00
Мітки: спосіб, паралельного, амінів, вторинних, однореакторного, синтезу
Код посилання
<a href="https://ua.patents.su/14-104593-sposib-odnoreaktornogo-paralelnogo-sintezu-vtorinnikh-aminiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб однореакторного паралельного синтезу вторинних амінів</a>
Попередній патент: Спосіб однореакторного паралельного синтезу алкілсульфідів, сульфоксидів та сульфонів
Наступний патент: Машина для внесення мінеральних добрив з відцентровим розсіювальним органом
Випадковий патент: Теплообмінник