Похідне піридопіразиндіону та його застосування як противиразкового засобу
Номер патенту: 106523
Опубліковано: 10.09.2014
Автори: Любчанская Валєрія Марковна, Калінкіна Маріна Алєксєєвна, Паршін Валєрій Алєксандровіч, Гранік Владімір Грігорьєвіч
Формула / Реферат
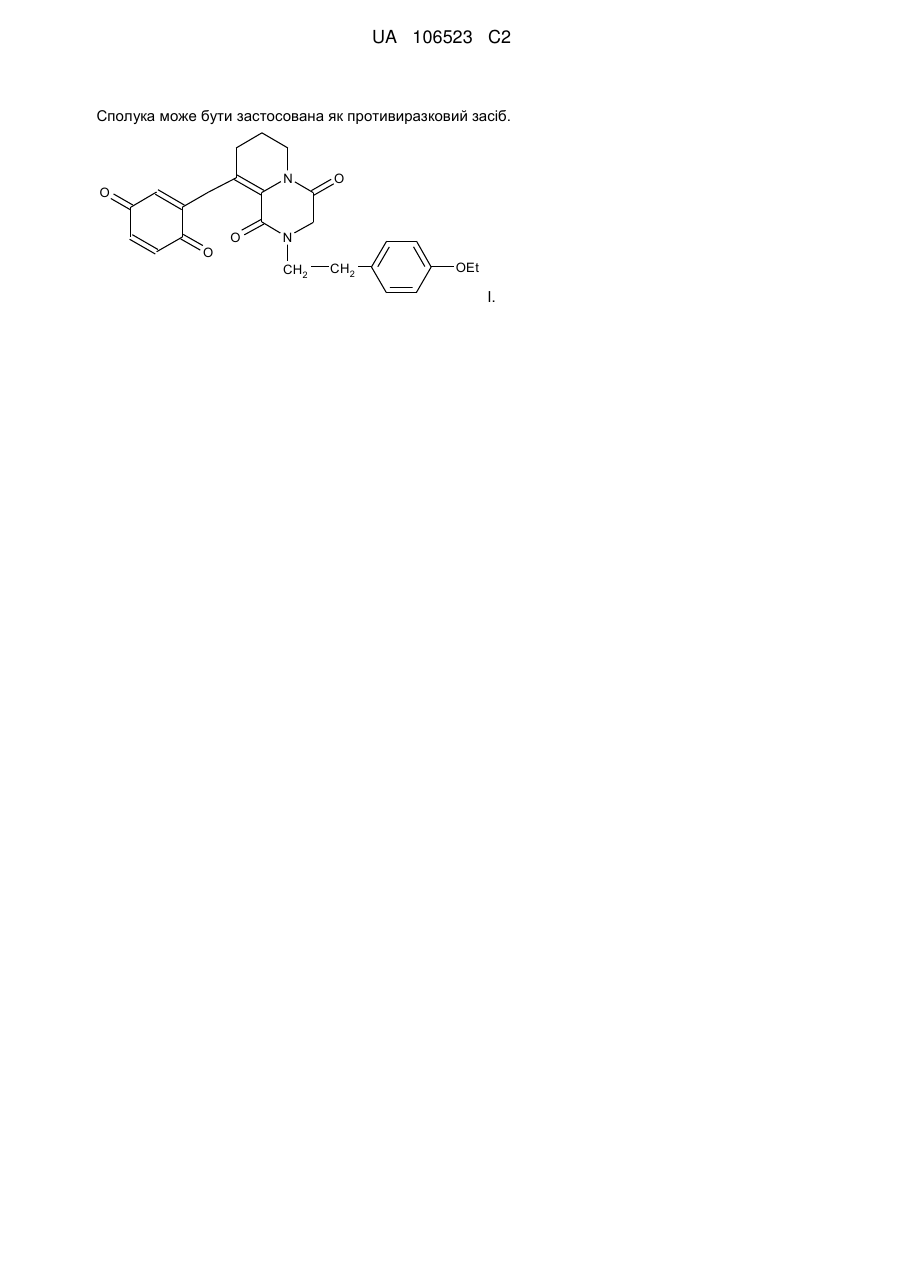
1. Сполука, що являє собою 9-(хіноніл-2)-2-п-етоксифенілетил-4,5,6,7,8,9,10,11-октагідропіридо[1,2-а]піразиндіон-1,4 формули (І)
 I.
I.
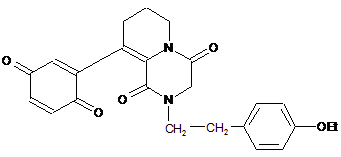
2. Застосування сполуки, що являє собою 9-(хіноніл-2)-2-п-етоксифенілетил-4,5,6,7,8,9,10,11-октагідропіридо[1,2-а]піразиндіон-1,4 формули (І)
 , I
, I
як зворотного інгібітора Н,K-АТФази.
3. Застосування за п. 2 як антисекреторного засобу для пригнічення секреції соляної кислоти в шлунку.
4. Застосування за п. 2 як гастропротекторного засобу.
5. Застосування за будь-яким з пп. 2-4 для лікування кислотозалежних захворювань шлунково-кишкового тракту.
6. Застосування за будь-яким з пп. 2-5 як противиразкового засобу.
Текст
Реферат: Даний винахід стосується галузі хіміко-фармацевтичної промисловості та медицини та стосується нової сполуки, що може знайти застосування як противиразковий препарат. Сполука являє собою 9-(хіноніл-2)-2-п-етоксифенілетил-4,5,6,7,8,9,10,11-октагідропіридо[1,2а]піразиндіон-1,4 формули (І) або його фармацевтично прийнятні комплексні похідні. UA 106523 C2 (12) UA 106523 C2 Сполука може бути застосована як противиразковий засіб. N O O O O N CH2 CH2 OEt I. UA 106523 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої відноситься винахід Даний винахід відноситься до галузі хіміко-фармацевтичної промисловості тай медицини та стосується нової сполуки, яке може знайти застосування в якості противиразкового препарату. Попередній рівень техніки Захворювання органів травлення завжди перебували в центрі уваги лікарів через свою значну поширеність. З великої кількості хвороб даної групи особливе соціальне та медичне значення має виразкова хвороба шлунка та дванадцятипалої кишки, оскільки за частотою вона перевищує всю іншу патологію шлунково-кишкового тракту. Лікувальні заходи при виразковій хворобі направляють на зниження впливу, що ушкоджує, шлункового соку, (антисекреторні препарати) у відношенні до навколишніх тканин; підвищення резистентності тканин, які зазнають його впливу, у першу чергу, слизової шлунка (гастропротекторні засоби) і антимікробна терапія, спрямована на знищення мікроорганізмів Helicobacter pylori. Основа лікування BX — курсова або підтримуюча терапія антисекреторними препаратами, це - інгібітори протонного насоса, блокатори Н2-рецепторів гістаміну, антацидні препарати, препарати вісмуту (вісмуту субсаліцилат/субцитрат), сукральфат (комбінація гідроокису алюмінію та цукрового октасульфату). При цьому колись популярні препарати 80-х років блокатори Н2-гістамінових рецепторів значною мірою поступилися місцем більш ефективним антисекреторним засобам — інгібіторам протонної помпи (ІПП). Блокатори протонного насоса вперше були синтезовані у 1976 році. Ними виявилися дві речовини — тимопразол і омепразол. Тимопразол не знайшов широкого застосування, але омепразол одержав широке поширення. Саме він був офіційно рекомендований для клінічного застосування в 1988 році на Всесвітньому конгресі гастроентерологів у Римі. Однією з причин такого визнання омепразолу стало підтвердження його високої ефективності в знищенні бактерії Helicobacter pylori (HP), відкриття якої в 1983 році змусило переглянути погляди на природу гастродуоденальних захворювань. Значимість хелікобактерної інфекції набула величезне значення також тому, що експерти ВОЗ після аналізу результатів численних досліджень визнали її канцерогенною для людини. У зв'язку з цим надзвичайну актуальність здобувають питання ерадикації - знищення Helicobacter pylori у слизистій оболонці шлунка з метою забезпечити сприятливі умови для загоєння виразок. Незважаючи на загальне визнання омепразолу як першого ефективного представника ІПП, пошуки в напрямку його вдосконалення тривали. І в 1992 році фахівці японської фірми Такеда синтезували ІПП нового покоління — лансопразол. Через кілька років в арсеналі лікарів усього світу з'явилися ІПП наступних поколінь: пантопразол, рабепразол, езомепразол. Таким чином, ІПП (інгібітори протонної помпи) є найбільше часто використовуваними препаратами для лікування виразки шлунка та дванадцятипалої кишки на даний час в усьому світі. ІПП використовуються для лікування BX трохи більше 15 років, тому ще не повною мірою відомо про те, наскільки вони безпечні. Небезпечні побічні ефекти або взаємодії, які представляють загрозу для життя пацієнта, нового препарату з іншими лікарськими засобами можуть не бути виявлені доти, поки не буде накопичений достатній досвід застосування - мова може йти про сотні тисяч випадків використання. Однак уже і зараз з'являються відомості про негативний вплив препаратів цього типу (в основному омепразолу) на печінку при застосуванні у дітей [1]. У клініці також відзначені такі побічні ефекти при застосуванні ІПП, як діарея, нудота, абдомінальна колька, сонливість, головний біль. При тривалому застосуванні омепразолу та інших інгібіторів протонної помпи (також як і при застосуванні деяких інших антисекреторних препаратів) можливо стійке та глибоке пригнічення кислої шлункової секреції, а в деяких випадках атрофії секреторних клітин шлунка, що призводить до серйозних ускладнень (розвиток новотворів типу гастриноми, аденокарциноми, засіяння Helicobacter pylori, кишкові інфекції, розлад всмоктування кишечником жирів, мінералів і вітамінів). Усі зазначені ускладнення описані в наступних роботах [2]. Поряд із цим, треба враховувати, що метаболізм ІПП відбувається за участю цитохрому Р450 - оксидазної системи, тому при тривалому застосуванні ІПП може розвитися толерантність до даних препаратів при виснаженні активності даної ферментної системи [3]. Із цим можливо пов'язаний синдром скасування препарату - рецидиви захворювання відзначені в різний термін (від 2 до 22 тижнів) у середньому 14 тижнів після скасування омепразолу [4]. Також спостерігаються інші побічні та небажані ефекти препаратів цього класу, які зокрема зазначені в інструкції із застосування препаратів (головний біль, діарея, алергічні реакції, гінекомастія та ін.). 1 UA 106523 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, ІПП є ефективними препаратами, які одержали широке просування для лікування BX, однак, необхідно враховувати їх побічні ефекти та несприятливі наслідки (найнебезпечніші, аж до смертельних випадків - це інфікування Helicobacter pylori і розвиток пухлин шлунка), а також деякий відсоток випадків, коли вони виявляються неактивними при лікуванні. Тому пошук нових противиразкових засобів є важливою і актуальною задачею. Найбільш перспективним напрямком у створенні нових противиразкових препаратів є одержання препарату з гастропротекторними властивостями, оскільки в цьому випадку не відбувається "жорсткого" пригнічення шлункової секреції. Останнє призводить до основних несприятливих подій - засіяння шлунка Helicobacter pylori і розвитку онкологічних процесів. У ряді випадків таке пригнічення шлункової секреції не потрібно при збереженні нормальної секреції або взагалі зниженої, що часто зустрічається при виразковій хворобі. Просто достатньо "захистити" слизову оболонку шлунка від її подразнюючої дії, щоб ушкоджена слизова шлунка не роз'їдалася кислотою, а була захищена від неї. Такі препарати створені на основі простагландинів. Позитивними властивостями простагландинів при лікуванні виразки шлунка є їх здатність активувати протеїнкіназу, яка, впливаючи на клітинні мембрани, може захищати слизову оболонку шлунка від агресивного впливу кислоти та пепсину, а також стимуляція ними секреції слизу. З іншого боку, простагландини мають антисекреторну активність у відношенні до шлункового соку. Така комбінація противиразкових ефектів робить простагландини дуже привабливими в якості лікарських засобів, однак, досвід застосування цих препаратів відносно невеликий, тільки на рівні клінічних випробувань [5]. Перспективним напрямком є створення гастропротекторних препаратів -донорів NO. Оксид азоту діє як багатофункціональний гастропротекторний медіатор, що впливає на ряд аспектів фізіології шлунково-кишкового тракту (ШКТ), включаючи секрецію слизу та бікарбонату, потік крові в стінках ШКТ [6]. Крім того, відомі протимікробні властивості NO, зокрема щодо бактерій Helicobacter pylori [7]. Прямою антисекреторною дією донори NO не володіють, але бікарбонат, який секретується у шлунку під дією донорів оксиду азоту, взаємодіє із соляною кислотою та у такий спосіб нейтралізує її. У якості противиразкових засобів використовуються також речовини, які блокують секрецію соляної кислоти: це блокатори Н2-рецепторів (фамотидин, ранітидин, циметидин) та інгібітори протонного насоса. Блокатори H2-рецепторів мають ряд недоліків у порівнянні з інгібіторами протонного насоса: по-перше, блокується тільки сигнал, який виникає при зв'язуванні гістаміну, по-друге, їх дія оборотна, та вони швидко елімінуються із кровоносного русла, тому пацієнт повинен пити кілька таблеток на день. Та, нарешті, їх застосування приводить до посилення синтезу рецепторів для гістаміну, у результаті чого після скасування Н 2-блокаторів спостерігається рикошетний спалах секреції HCl. З інгібіторів протонного насоса першим на ринку в 80-і роки з'явився омепразол (фірма "Астра Зенека"), який являє собою заміщений бензимідазол. Інгібітори протонного насоса, наявні на ринку на даний час, також відносяться до заміщених бензимідазолів. Це нексіум (очищений S-ізомер омепразолу або езомепразол, фірма "Астра Зенека"), численні генерики омепразолу, парієт (рабепразол, фірма "Янсен Силаг") і контролок (пантопразол, фірма Бік Гульден, останній в Росії відсутній). Усі ці сполуки являють собою проліки. Вони є слабкими + основами, які при потраплянні в кисле середовище парієтальних канальців зв'язують H і перетерплюють внутрішньомолекулярну перебудову, що приводить до їх перетворення на властно ліки, активний сульфенамід, що взаємодіє зSH-групами Η,Κ-АТФази, експонованими в порожнину секреторного канальця. Сульфенаміди утворюють ковалентний зв'язок з SHгрупами, внаслідок чого їх дія необоротна. їх ефект усувається тільки після елімінації молекули Η,Κ-АТФази, модифікованої інгібітором, а час напівжиття Η,Κ-АТФази людини становить близько 40 годин. Саме із цієї причини застосування необоротних інгібіторів протонного насоса другого покоління, таких як парієт і нексіум, забезпечує дуже високу ефективність лікування кислотозалежних захворювань. При лікуванні виразкової хвороби цими інгібіторами в комбінації з антибіотиками, що усувають інфекцію Helicobacter pylori, ефективність становить більш 90 % [20]. Крім необоротних інгібіторів протонного насоса відомі також оборотні інгібітори, ліки, на основі яких, дотепер не випускалися. Очевидно, це пов'язано з дуже високою ефективністю та безпекою дії ліків на основі необоротних інгібіторів протонного насоса. Серед оборотних інгібіторів протонного насоса найбільш відомий імідозопіридин SCH-28080, + який інгібує Η,Κ-АТФазу конкурентним по відношенню K способом з Ki (константою інгібування) у ряді 0,2-0,24 мкМ [21]. Аналоги SCH-28080 взаємодіють із фрагментом а-субодиниці Н, КАТФази довжиною в 44 амінокислотних залишків, що починається з Leu-854 та закінчується Arg 2 UA 106523 C2 5 10 15 20 25 897. Цей фрагмент гомологічний подібному у Η,Κ-АТФазі, яку SCH-28080 також інгібує, але з меншою спорідненістю. Очевидно, він являє собою К-єднальний центр цих родинних ферментів. Крім SCH-28080 відомий більш специфічний інгібітор SK&F, який інгібує тільки Η,Κ+ АТФазу з 0,5 мкМ і конкурує з SCH-28080 та K , а також SK&F 96356, який інгібує Η,Κ-АТФазу з + К;=0,07 мкМ, що також конкурує з SCH-28080 та K . Препарат SCH 28080, який має формулу: може бути зазначений у якості найбільш близького аналога [19]. Сполука є ефективною, однак можлива конкуруюча дія по відношенню до іонів K, що може призвести до несприятливих побічних ефектів. Сутність винаходу Задачею даного винаходу є створення сполуки, яке має ефективну противиразкову активність і яка не має побічних дій, які проявляють відомі засоби. Задача вирішується синтезом нової сполуки, що представляє собою похідну піридопіразиндіонів. Згідно з даним винаходом пропонується сполука - 9-(хіноніл-2)етоксифенілетил-4,5,6,7,8,9,10,11 -октагідропіридо [1,2-а]піразиндіон-1,4 формули (І) і його фармацевтично прийнятні комплексні похідні. Докладний опис винаходу Синтез цільової сполуки І Вихідною для синтезу є похідна хромену (II), яка під дією хлорацетилхлориду перетворюється на відповідну хлорацетильну похідну (III). Дія на останню β (п-етоксифеніл)етиламіну привела до розкриття піранового циклу, утворення піперазиндіонового кільця. Наступне окиснення гідрохінонового фрагмента в проміжній IV привело до цільової сполуки І (одержання хромену II описано авторами в роботі: В.М. Любчанская, Л.М. Алексеева C.A. Савина, А.С. Шашков, В.Г. Граник, Изв. АН, сер. хім., 2002, № 10,стор. 1736-1743). 3 UA 106523 C2 5 10 15 20 25 30 35 40 Одержання III До суспензії 4,23 г (19 ммоль) хромену II в 35 мл толуолу додають при перемішуванні 7,7 мл (95 ммоль) хлорацетилхлориду, кип'ятять 1 годину, прохолоджують, відфільтровують 5,47 г III 1 (98 %), т. пл. 159-162C (спирт). Спектр H ЯМР (d6 ДМСО) δ м.д.: 2,01(кв. 2Н), 2,89 (т., 2Н), 3,71(уш с. 2Н), 4,38 (с. 2Н), 7,03 (м. 2H), 7,26 (д. 1H), 9,60 (с. 1H). Одержання IV До розчину 0,88 г (3 ммоль) III в 6 мл ДМФА додають 12 ммоль β (п-етоксифеніл)етиламіну, перемішують 10 годин при 20C, розбавляють водою, відфільтровують 1 г IV, вихід 93 %, т. пл. 169-171C (ацетонітрил). Одержання І До суспензії 1 ммоль IV в 10 мл хлороформу додають розчин 0,14 г бікарбонату натрію в 2,5 мл води та суміш, що окислює, з 0,6 г K3[Fe(CN)6], 0,14 г NaHCO3 і 0,18 г поташу 6 мл води. Суміш перемішують 1 годину при 20C, органічний шар відокремлюють і упарюють, залишок розтирають з ефіром, одержують 85 % І, т. пл.137-140C. Знайдене: C 68,36, H 6,12, N 6,57. 1 C24H24N2O4. Обчислене: C 68,56, H 5.75, N 6,66. Спектр H ЯМР (ДМСО-с16, δ, м.д.): 1,32, 4,25 (тр., кв. 3Н, CH3CH2, J=7,5 Гц), 1,86 (к, 2Н, 7-CH2, J=7,5 Гц), 2,34 (уш. с, 2Н, 8-CH2), 2,68 і 3,40 (обоє т., за 2Н, 2-CH2CH2, J=7,2 Гц), 4,04 (с, 2Н, 3-CH2), 6,68 (д., 1H, J=2,8 Гц), 6,78 (к., 1H, 4'-H), 1 6,89 (к., 1H, 5'-H. J=8,4 Гц), 6,80-7,10 (АА'ВВ , 4Н, C6H4). У якості фармацевтично прийнятних комплексних сполук можуть бути отримані, наприклад, сполуки із циклодекстринами. Нові сполуки мають антисекреторну та гастропротекторну активність. Приклад 1 Дослідження противиразкової активності сполуки І вивчали на наступних моделях 1.1. Ушкодження слизової оболонки шлунка у мишей, спричинені введенням 0,6 H соляної кислоти та індометацинум [13] Мишей-самців масою 23-24 г позбавляли їжі протягом 24 годин, доступ до води не обмежували. Досліджувану сполуку в дозах 25, 50 і 100 мг/кг вводили зондом у шлунок за 1, 3 і 6годин до введення 0,6 H соляної кислоти (5 мл/кг) та індометацину (20 мг/кг), ще через 1 годину тварин забивали, вилучали шлунки і підраховували кількість виразок. У якості препаратів порівняння застосовували фамотидин у дозах 25 і 50 мг/кг усередину та омепразол у дозі 50 мг/кг усередину. 1.2. Ушкодження слизової оболонки у мишей, спричинені введенням абсолютного етанолу [14] Мишей-самців масою 20-23 г позбавляли їжі за 24 години до досліду та за 18 годин до досліду обмежували доступ до води. Досліджувану сполуку в дозах 25, 50 і 100 мг/кг вводили зондом у шлунок за 1,3 і 6 годин до введення абсолютного етанолу (0,3 мл), ще через годину тварин забивали, вилучали шлунки і вимірювали довжину ушкоджених ділянок слизової оболонки в міліметрах. У дослідах використовували контроль - тварин, які не отримували досліджувану сполуку, а тільки по 0,3 мл фізіологічного розчину. У якості препаратів порівняння застосовували фамотидин у дозах 25 і 50 мг/кг усередину та омепразол у дозі 50 мг/кг усередину. 4 UA 106523 C2 1.3. Ушкодження слизової оболонки шлунка в щурів, спричинені введенням сполуки 48/80 [15] 5 10 15 20 25 30 35 40 45 50 55 60 Досліджувану сполуку в дозі 25 і 100 мг/кг вводили зондом до шлунка за 1 і 6 годин до внутрішньочеревинного введення сполуки 48/80, розвиток ушкоджень слизової оболонки шлунка спостерігали через 3 години після введення сполуки 48/80. Тварин забивали, вилучали шлунки та вимірювали довжину ушкоджених ділянок слизової оболонки в міліметрах. У якості препаратів порівняння застосовували фамотидин у дозах 25 і 50 мг/кг усередину та омепразол у дозі 50 мг/кг усередину. 1.4. Хронічна виразка шлунка, спричинена введенням щурам 0,025 мл 20 % оцтової кислоти [16] Хронічну виразку шлунка у щурів викликали введенням 0,025 мл 20 % оцтової кислоти під серозну оболонку шлунка на межі фундального та антрального відділів. Через добу після операції досліджувану сполуку (у дозі 50 мг/кг) і препарати порівняння (омепразол 50 мг/кг і фамотидин 50 мг/кг) вводили зондом у шлунок один раз у день протягом 21 дня. Кожні 7 днів забивали по 6 тварин з контрольної та піддослідних груп та визначали площу виразкового 2 дефекту шлунка в мм . Приклад 2 Дослідження антисекреторної активності 2.1. Дослідження базальної секреції в щурів під впливом досліджуваних речовин [17] Дослідження проводили на щурах-самцях масою 180-200 г. Тварин позбавляли їжі протягом 24 годин, воду не обмежували. Під ефірним наркозом розтинали черевну порожнину та накладали лігатуру на пілоричний відділ шлунка. Через 4 години після операції досліджували вміст шлунка; визначали об'єм секреції у розрахунку на 100 г маси тіла тварини, рН шлункового соку, вільну соляну кислоту та загальну кислотність шлункового соку. Досліджувану сполуку вводили усередину при дозі 100 мг/кг у вигляді водної суспензії з додаванням твін-80 за 60 хвилин до перев'язування пілоруса. Контрольним тваринам вводили дистильовану воду з додаванням твін-80. У якості препаратів порівняння застосовували фамотидин у дозах 25 і 50 мг/кг усередину та омепразол у дозі 50 мг/кг усередину. 2.2. Дослідження секреції шлунка, стимульованої гістаміном, пентагастрином і 1амінопіреном Дослідження проводили на щурах-самцях масою 180-200 г. Тварин позбавляли їжі протягом 24 годин, воду не обмежували. Перед накладенням лігатур на пілоричний відділ шлунка щурам вводили підшкірно гістамін (2,5 мг/кг), іншій групі тварин - пентагастрин 10 мг/кг підшкірно, а третій групі тварин - 1-амінопірен 1 мг/кг. Досліджувану сполуку вводили усередину при дозі 100 мг/кг у вигляді водної суспензії з додаванням твін-80 за 1 і 3 години до перев'язування пілоруса. Контрольним тваринам вводили дистильовану воду з додаванням твін-80. У якості препаратів порівняння застосовували фамотидин у дозах 25 і 50 мг/кг усередину та омепразол у дозі 50 мг/кг усередину. Через 4 години після операції досліджували вміст шлунка; визначали об'єм секреції у розрахунку на 100 г маси тіла тварини, рН шлункового соку, вільну соляну кислоту та загальну кислотність шлункового соку. Приклад 3. Дослідження моторно-рухової активності 3.1. Дослідження пропульсивної активності кишечнику [18] Досліджувані сполуки вводили мишам-самцям масою 22-24 г зондом у шлунок за 60 хвилин до введення активованого вугілля (0,3 мл 10 % суспензії у шлунок). Через 2 години тварин забивали за допомогою CO2 і вимірювали довжину ділянки тонкого кишечнику (у см), заповненого активованим вугіллям. Контрольним тваринам вводили усередину по 0,3 мл води, препаратом порівняння був церукал у дозі 25 мг/кг усередину. Приклад 4. Визначення токсичності (ЛД50) досліджуваних речовин при однократномувведенні [19] Результати дослідження 1. Показано, що вивчені похідні піперазиндіону мають гастро-протекторну дію щодо виразок шлунка, спричинених введенням абсолютного етанолу, введенням вольтарену, та виразки шлунка, спричиненої введенням сполуки 48/80; а також виявляють противиразкову дію, сприяючи загоєнню виразкового дефекту на моделі хронічної оцтової виразки шлунка. їх ефективність вище ніж у фамотидину та рівна омепразолу. За тривалістю ефекту досліджувані сполуки також рівні омепразолу та фамотидину, пролонгованої дії вони не мають. 2. При вивченні антисекреторної активності показано, що омепразол блокує базальну секрецію на 25 % через 1 годину після його введення та на 40 % -через 3 години; фамотидин: через 1 годину - на 56 % і через 3 години - на 80 %. Досліджувана нова сполука не пригнічує базальну кислотну шлункову секрецію, що принципово відрізняє їх від відомих противиразкових засобів (блокаторів Н2-рецепторів, інгібіторів протонної помпи). 5 UA 106523 C2 5 10 15 20 25 30 35 40 45 50 55 Таким чином, фамотидин сильно блокує базальну секрецію, омепразол помірно блокує базальну шлункову секрецію. Досліджувана нова сполука не пригнічує базальний рівень шлункової секреції. 3. При дослідженні стимульованої секреції шлункового соку показано, що омепразол блокує секрецію, стимульовану гістаміном на 70 % через 1 годину після його введення та на 80 % через 3 години; стимульовану пентагастрином також у середньому на 90 % і стимульовану 1амінопіреном на 90 %. Фамотидин блокує стимульовану гістаміном секрецію на 90 % через 1 годину після його введення та на 95 % через 3 години; стимульовану пентагастрином у середньому на 40 % і стимульовану 1-амінопіреном через 1 годину на 36 %, а через 3 години на 40 %. Нова сполука блокує секрецію стимульовану гістаміном на 40 % через 1 годину після його введення та на 57 % через 3 години; стимульовану пентагастрином також у середньому на 54 % і стимульовану 1-амінопіреном на 50 %. Таким чином, омепразол блокує секрецію шлункового соку, стимульовану усіма трьома сполуками (гістаміном, пентагастрином, 1-амінопіреном), фамотидин блокує тільки секрецію, стимульовану гістаміном і слабко іншими сполуками (пентагастрином і 1-амінопіреном), досліджувана сполука блокує усі три види стимульованої секреції (також як і омепразол), але більш помірно. 4. При дослідженні моторно-рухової активності шлунка показано, що омепразол сповільнює моторно-рухову роботу кишечнику в середньому на 35 %, фамотидин не впливає на моторнорухову активність кишечнику, нова досліджувана сполука також не впливає на моторно-рухову активність кишечнику. Таким чином, вплив на моторно-рухову активність кишечнику виявляє тільки омепразол. Дана властивість препарату, особливо при його тривалому застосуванні, може негативно позначитися на основному противиразковому ефекті, тому що при вповільненні моторнорухової активності шлунка та кишечнику вміст шлунка творить додаткову подразнюючу дію на виразковий дефект. При дослідженні загальної токсичності показано, що нова сполука та її солі малотоксичні, також як і омепразол. При порівнянні ЛД50 омепразолу, фамотридіну та досліджуваних сполук показано, що нові сполуки менш токсичні у порівнянні з фамотидином та омепразолом. Приклад 5. Перевірка дії сполуки І на ферментативну активність Н, К-АТФази зі слизової оболонки шлунка кролика, дослідження оборотності цієї дії та оцінка ефекту цієї сполуки в + присутності іонів K Препарат мікросом, збагачений активністю Η,Κ-АТФази, був отриманий за методом, запропонованім R.A. Farley і L.D. Faller. Слизову оболонку шлунка одержували з кролика, якого попередньо піддавали декапітації. Усі операції проводили на льоді. Шлунок розрізали по лінії найбільшої кривизни, промивали та зіскрібали зі стінок шлунка слизову оболонку. Отриману слизову заморожували та зберігали при -80C. Для виділення препарату мікросом, збагачених Η,Κ-АТФазою, слизову шлунка розморожували та гомогенізували в середовищі виділення (0,25 M сахароза, 5 мм PIPES, 20 мм ТРИС, рН 7,4) гомогенізатором типу Polytron (макс. обороти, 30 сек). Співвідношення ваги тканини до середовища виділення - 1:20. Далі гомогенат центрифугували 10 хвилин при 10000 g. Осад відкидали, а супернатант центрифугували 1 годину при 100000 g. Отриманий осад ресуспендували в середовищі виділення (у мінімальному об'ємі, необхідному для ресуспендування). Суспензію нашаровували на східчастий градієнт Фікола 400, виготовленого на середовищі виділення: 12 % розчин Фікола, 4 % розчин Фікола. Далі центрифугували 180 хвилин при 100000 g. Після центрифугування на границі 4 % Фікола та 12 % Фікола помітна біла смуга, яка являє собою фракцію мікросом, збагачену Η,Κ-АТФазою. Фракцію збирали, розділяли на аліквоти та зберігали при -80C. Активність вимірювали за наростанням в середовищі неорганічного фосфату, який утворюється при гідролізі АТФ. Концентрацію неорганічного фосфату вимірювали за методом Ратбуна та Бетлах. Середовище інкубації містило: 30 мМ імідазолу, рН 7,4, 3 мМ MgCl2, 130 мМ NaCl, 20 мМ KCl, 3 мМ АТФ, 2 мМ уабаїну, 0,1 мМ ЕГТА, 2,25 мкМ валіноміцину, 5 мМ NaN3, 5 мкМ СССР (протонофор карбонілціанід м-хлорофеніл гідразон). В інкубаційну пробу вносили середовище інкубації та розморожену та гомогенізовану фракцію мікросом. Пробу інкубували при 37C 20 хвилин і зупиняли реакцію додаванням холодного стоп-розчину (3 M ацетату натрію, 3,7 % формальдегід, рН 4,3). Для оцінки вмісту фосфату, одержуваного при ензиматичному гідролізі АТФ, у пробу додавали 2 % розчин молібдату амонію та розчин хлориду олова (3 мг/мл). Після розвитку синього забарвлення через 15 хвилин проби колориметрували при довжині хвилі 650 нм. 6 UA 106523 C2 5 10 15 20 25 30 35 40 45 50 55 Активність Η,Κ-АТФази визначали як активність, що інгібується 0,1 мМ SCH-28080. Активність Η,Κ-АТФази, що пригнічується цим інгібітором, становила близько 30 %. -8 -4 Концентрація досліджуваної сполуки варіювала у діапазоні від 10 до 10 M. Результати дослідження Сполука І проявляє інгібуючу дію на активність Η,Κ-АТФази зі слизової оболонки шлунка -6 кролика з I50=10 M. Ефект сполуки І на Η,Κ-АТФазу є оборотним, він розвивається за часом миттєво та усувається при розведенні комплексу фермент-інгібітор. Було досліджено, чи існує конкуренція між І та іонами калію. З цією метою досліджена залежність активності Η,Κ-АТФази від концентраці KCl, а потім - інгібуюча дія І на цей фермент при насичуючих (20 мМ), та ненасичуючих (2 мМ) концентраціях KCl. + Встановлено, що сполука І не конкурує з іонами K , навпаки, ефект сполуки І на активність + Η,Κ-АТФази зі слизової оболонки шлунка кролика підсилювався під дією іонів K : значення І50 -5 -6 складало 10 M при 2 мМ KCl і 10 M при 20 мМ KCl. Висновки 1. Речовина І оборотно інгібує гідролітичну активність Η,Κ-АТФази, значення I50 становить -6 10 M при 20 мМ KCl. + 2. Інгібуюча здатність речовини І підсилюється при підвищенні концентрації K . Значення I50 -5 -6 знижується від 10 M при 2 мМ KCl до 10 Μ при 20 мМ KCl. Така властивість речовини І можливо дає перевагу при її використанні в живих системах. Отримані результати свідчать, що сполука І є ефективним оборотним інгібітором Η,ΚАТФази. Однак на відміну від відомого оборотного інгібітору SCH-28080 дія І не є конкурентною + щодо калія. Очевидно, І не зв'язується в K-єднальному центрі ферменту. Більше того, K підсилює інгібуючу дію І. Це може виявитися важливим незалежно від того, з боку цитоплазми + або з боку секреторного канальця діє інгібітор, тому що концентрація K може досягати високих значень і в секреторному канальці, який безпосередньо пов'язаний з порожниною шлунка. Таким чином, сполука І є новим невідомим раніше типом оборотних інгібіторів Η,Κ-АТФази, дія + яких неконкурентна щодо K . Джерела інформації:: 1. El-Matary W., Dalzell M. "Omeprazole-induced hepatitis" // Pediatr. Emerg. Care, 2005, V. 21(8): 529-530. 2. Raghunath A.S., O'Morain C, McLoughlin R.C. "Rewiew article: the long-term use of protonpump inhibitors" // Aliment Pharmacol. Ther., 2005 V. 22, Suppl. 1: 55-63. 3. Reilly J.P. "Safety profile of the proton-pump inhibitors" // Best Pract. Res. CHn. Gastroenterol., 2001, V 15 (3): 355 370. 4. Clissold S.P. and Campoli-Richards D.M. "Omeprazole: A prelimi-nary review of its pharmacodynamic and pharmacokinetic properties, and thera-peutic potential in peptic ulcer disease and Zollinger-Ellison syndrome" // Drugs, 1986, V. 32: 15-47. 5. Katz, L.B., Shriver, D.A. "Rioprostil heals pre-existing aspirin-induced gastric lesions in dogs during daily aspirin administration without altering the anti-inflammatory or analgesic efficacy of aspirin" // J Pharmacol. Exp. Ther., 1989, 251(2): 774. 6. Esplugues J.V., Calatayund S., Beltran B. et al. "Role of nitric oxide in gastric functions" // Meth. And Find. Exp. And CHn. Pharmacol., 1997, V. 19A, 25 -27. 7. Cuzzolin L., Adami A., Crivellente F. et al. "Role of endogenous and exogenous nitric oxide on intestinal mucosa and microflora in the rat" // Inflammation, 1997, V. 21, N 4: 443 - -450. 8. Yoshimura-Mishima, M., Akamatsu, H., Adachi, Y., Horio, T., "Sup-pressive effect of Orengedoku-to (Huang-Lian-Jie-Du-Tang) on the production of superantigen by Staphylococcus aureus" //Jpn Pharmacol. Ther., 2002, 30(3): 225. 9. Kido, T. et al. Inhibitory effect of Oren-gedoku-to (TJ-15) on gastric mucosal in-jury induced by compound 48/80 Jpn J Pharmacol., 1999, 79(Suppl. I) Abst P-24. 10. Hayashi, T. et al. Inhibitory action of Oren-gedoku-to extract on enzymatic lipid peroxidation in rat liver microsomes. Biol. Pharm. Bull., 2001, 24(10): 1165. 11. Saha, J.K., Wang, T., Glavin, A., Chen, L., Garvey, D.S., Letts, L.G., Tarn, S.W. Nitric-oxide donating H2-receptor antagonist and proton pump inhibitor with enhanced anti-ulcerogenic activities in rats FASEB J, 2000, 14(8) Abst 1399. 12. Saha, J.K. et al. Enhanced gastroprotective and anti-ulcerogenic activities in rats of a new class of proton pump inhibitor containing nitrosothiol nitric oxide donor Dig Dis Week (May 20-23, Atlanta) 2001, Abst 772. 13. Yano S., Harada M., Watanabe K. et al. "Antiulcer activities of glycyrrhetinic acid derivatives in experimental gastric lesion models" // Chem. Pharm. Bull. (Tokyo), 1989, V. 37, N 9, P. 2500-2504. 7 UA 106523 C2 5 10 15 20 14. Derelanko M., Long J. "Carbenoxolone Sodium protects rat gastric mucosa against Ethanolinduced necrosis"// Proc. Soc. Exp. Biol. Med., 1981, V. 166, N 3, P. 394-397. 15. Ohta Y., Kobayashi Т., Inui К. et al. "Protective effect of teprenone against acute gastric mucosal lesions induced by compound 48/80, a mast cell degranulator, in rats" // J. Pharmacol. Sci., 2003, V. 93: 337-346. 16. Shay H., Komarov S., FeIs S.,et al. "A simple methods for the uniform production of gastric ulceration in the rat" // Gastroenterology, 1945, N 5, P. 43-61. 17. Janssen P., Jageneau A. "Research papers a new series of potent analgesics: dextro 2;2;diphenyl-3-methyl-4-morpholino-butyryl-pyrrolidine and related amides" // J. Pharm. Pharmacol., 1957, V. 9, P. 381-399. 18. Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Ленинград, 1963. 19. Kaminski J., et al. Antiulcer agents. 5. Inhibition of gastric H+/K(+)-ATPase by substituted imidazo[l, 2-a]pyridines and related analogues and its implication in modeling the high affinity potassium ion binding site of the gastric proton pump enzyme. J. Med. Chem., 1991 Feb;34(2):53341. 20. Sachs G., Shin, J.M, Vagin, 0., Lambrecht, N., Yakubov, I, Munson K. (2007) The gastric Η,ΚATPase as a drug target: past, present, and future. J. CHn. Gastroenterol., 41(6 Suppl 2):S226-242. 21. Vagin, O., Munson K., Denevich, S., Sachs, G., SCH28080, a K+-competitive inhibitor of the gastric Η,Κ-ATPase, binds near the M5-6 luminal loop, preventing K+access to the ion binding domain. Biochemistry., 2002 41(42): 12755-12762. ФОРМУЛА ВИНАХОДУ 25 1. Сполука, що являє собою 9-(хіноніл-2)-2-п-етоксифенілетил-4,5,6,7,8,9,10,11октагідропіридо[1,2-а]піразиндіон-1,4 формули (І) N O O O O N CH2 OEt CH2 I. 2. Застосування сполуки, що являє собою 9-(хіноніл-2)-2-п-етоксифенілетил-4,5,6,7,8,9,10,11октагідропіридо[1,2-а]піразиндіон-1,4 формули (І) N O O O N CH2 30 35 O OEt CH2 ,I як зворотного інгібітора Н,K-АТФази. 3. Застосування за п. 2 як антисекреторного засобу для пригнічення секреції соляної кислоти в шлунку. 4. Застосування за п. 2 як гастропротекторного засобу. 5. Застосування за будь-яким з пп. 2-4 для лікування кислотозалежних захворювань шлунковокишкового тракту. 6. Застосування за будь-яким з пп. 2-5 як противиразкового засобу. 8 UA 106523 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюПроизводное пиридопиразиндиона и его применение в качестве противоязвенного средства
Автори російськоюГраник Владимир Григорьевич, Любчанская Валерия Марковна, Паршин Валерий Александрович, Калинкина Марина Алексеевна
МПК / Мітки
МПК: A61K 31/4985, C07D 471/04, A61P 1/00
Мітки: засобу, похідне, піридопіразиндіону, застосування, противиразкового
Код посилання
<a href="https://ua.patents.su/11-106523-pokhidne-piridopirazindionu-ta-jjogo-zastosuvannya-yak-protivirazkovogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Похідне піридопіразиндіону та його застосування як противиразкового засобу</a>
Попередній патент: Спосіб очищення каналізаційних стоків від сполук вуглецю, азоту і фосфору із використанням комбінованих очисних споруд
Наступний патент: Спосіб видобування газу з морських газогідратних покладів
Випадковий патент: Суміш для ніздрюватого бетону