Спосіб контролю експресії генів ферментів біосинтезу амінокислот у клітинах пухлин за допомогою канаваніну при комбінованій ензимотерапії раку
Номер патенту: 107417
Опубліковано: 25.12.2014
Автори: Винницька-Мироновська Божена Орестівна, Чень Олег Ігорович, Стасик Олег Володимирович, Курліщук Юлія Валеріївна, Барська Марина Леонідівна, Бобак Ярослав Петрович
Формула / Реферат
Спосіб контролю експресії генів, що кодують ферменти біосинтезу амінокислот, у клітинах пухлин при комбінованій ензимотерапії раку включає пригнічення експресії аргініносукцинатсинтетази (ASS) та/або аспарагінсинтетази (ASNS) в культивованих клітинах пухлин на моделях клітин раку шлунка та лімфобластної лейкемії людини з використанням природного аналога аргініну рослинного походження канаваніну в концентрації не більше 0,1 мМ на тлі впливу рекомбінантною аргіназою І людини.
Текст
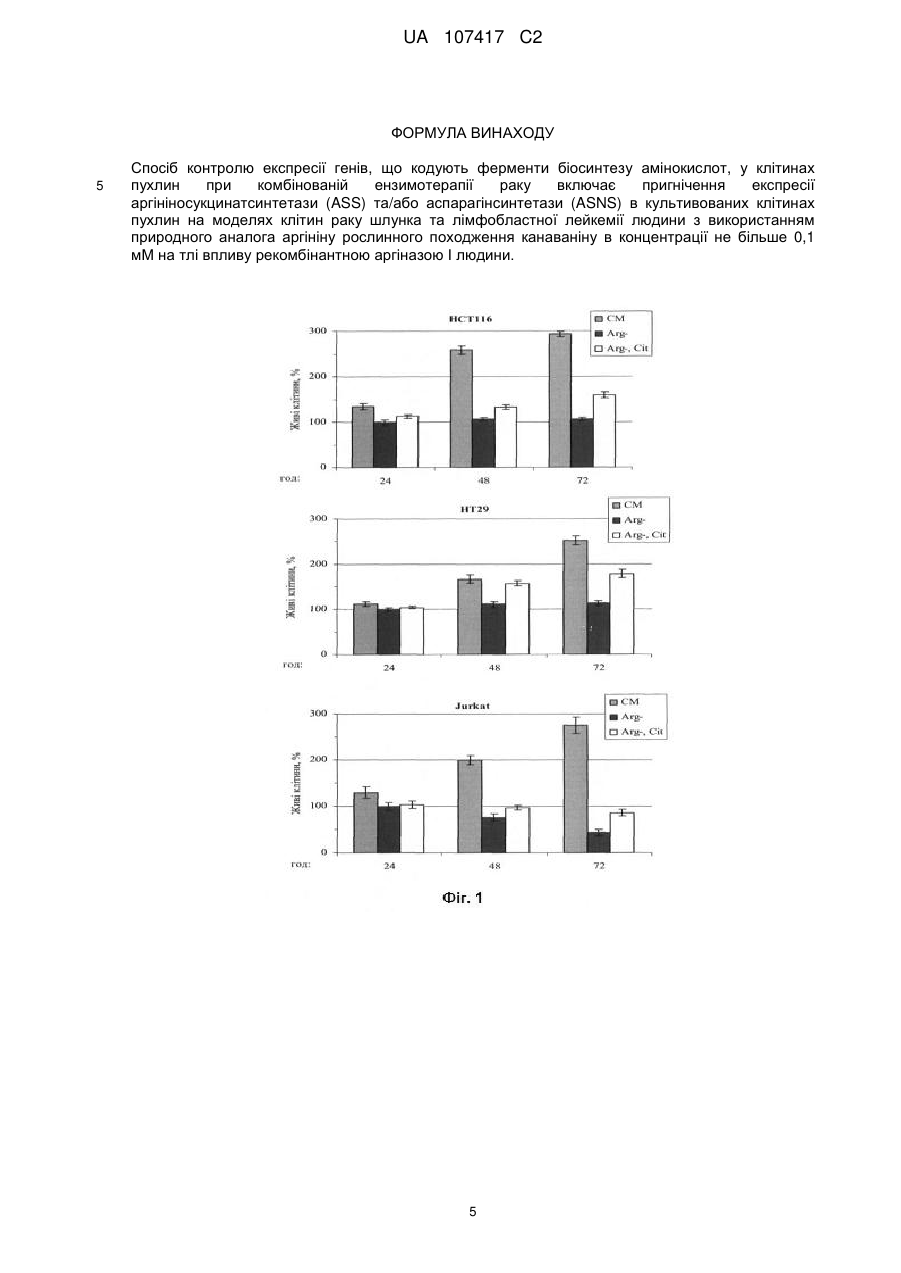
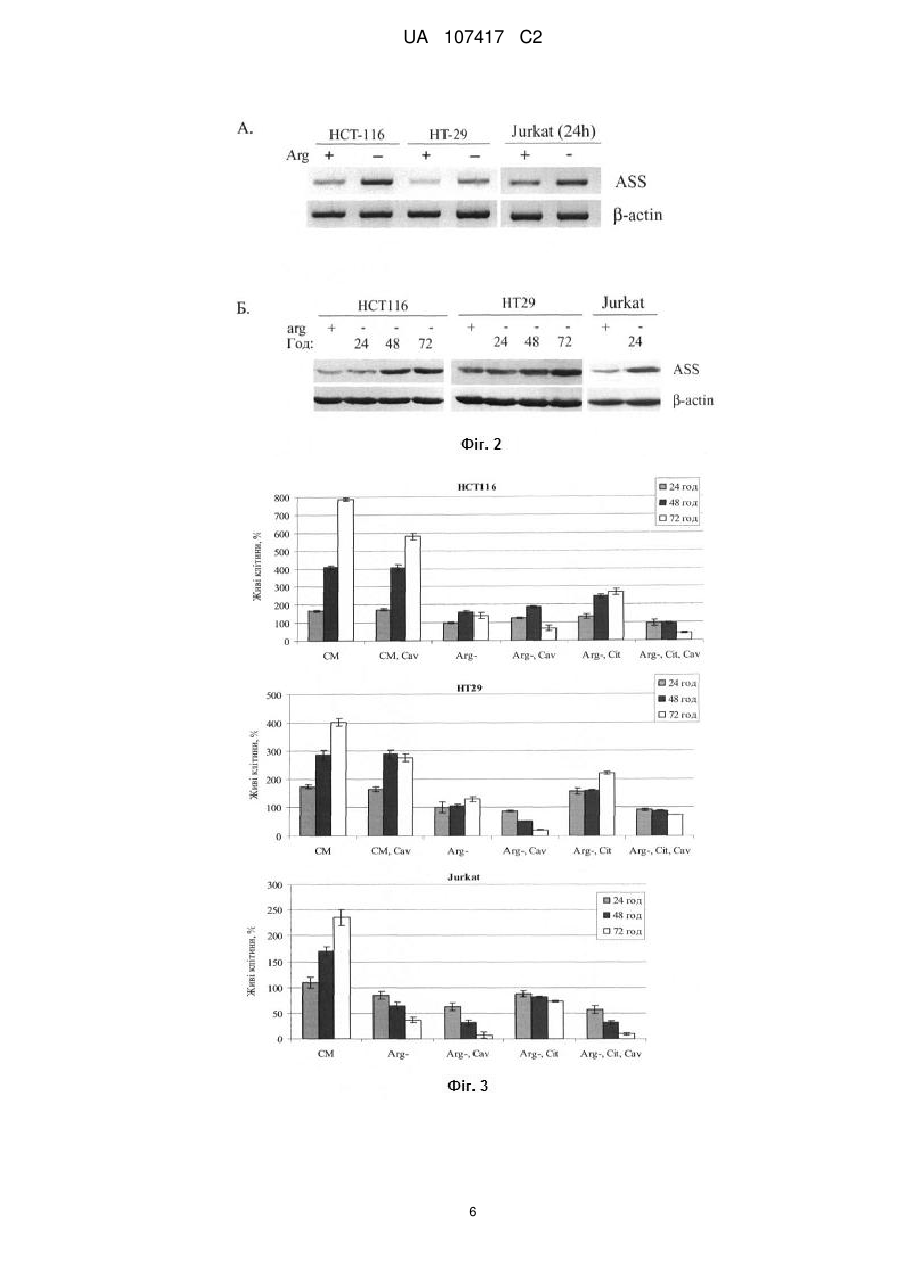
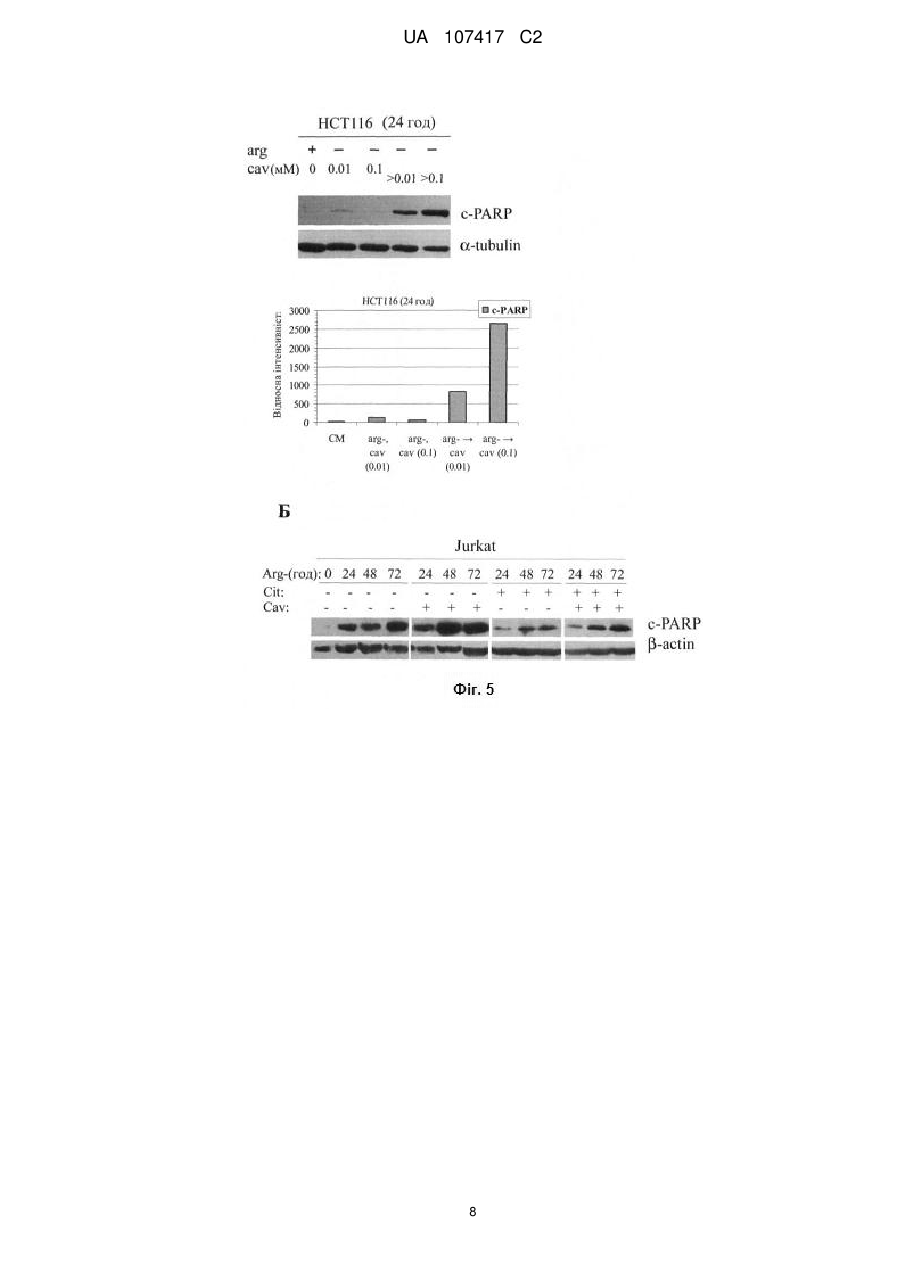
Реферат: Винахід належить до способу контролю експресії генів, що кодують ферменти біосинтезу амінокислот, у клітинах пухлин при комбінованій ензимотерапії раку, який включає пригнічення UA 107417 C2 (12) UA 107417 C2 експресії аргініносукцинатсинтетази (ASS) та/або аспарагінсинтетази (ASNS) в культивованих клітинах пухлин на моделях клітин раку шлунка та лімфобластної лейкемії людини з використанням природного аналога аргініну рослинного походження канаваніну в концентрації не більше 0,1 мМ на тлі впливу рекомбінантною аргіназою І людини. UA 107417 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується способу пригнічення експресії генів біосинтезу амінокислот аргініну - аргініносукцинатсинтетази (ASS) та аспарагіну - аспарагінсинтетази (ASNS) у клітинах пухлин, з метою інгібування ресинтезу аргініну чи аспарагіну та блокування проліферації злоякісних клітин за умов штучно створеного дефіциту аргініну в плазмі крові хворих за допомогою рекомбінантних ферментів аргіназ, зокрема аргінази І людини та у поєднанні з рекомбінантною аспарагіназою. Запропонований комбінаційний метод протипухлинної терапії може бути використаний у медицині, зокрема у терапії солідних пухлин та лейкемій, які виявляють дерепресію ASS та ASNS за умов дефіциту аргініну. Опис проблеми Відомо, що більшість протипухлинних хемотерапевтичних препаратів, які використовуються у сучасній медичній практиці, мають значну негативну побічну дію внаслідок неспецифічної токсичності для клітин різних тканин і органів людини. Тому одним із пріоритетних завдань сучасної науки та медицини є розробка нових ефективних, селективних і водночас малотоксичних методів терапії онкологічних захворювань. Голодування за індивідуальними амінокислотами є одним із підходів протипухлинної терапії, що відповідають вищевказаним вимогам [1, 2]. Відомо, що деякі типи пухлин виявляють підвищену потребу в екзогенних амінокислотах та, відповідно, високу чутливість до голодування за метіоніном, аспарагіном та аргініном in vitro та in vivo. Так, голодування за аспарагіном, викликане дією рекомбінантної аспарагінази, зараз широко використовується для лікування гострих дитячих лейкемій. Голодування за аргініном, в свою чергу, може бути штучно створене в організмі за допомогою рекомбінантних ферментів деградації цієї амінокислоти, аргініндеімінази бактерій або аргінази людини І. Обидва ферменти на даний час проходять клінічні випробування як монотерапевтичні агенти [3]. Як сигнальні механізми клітини обумовлюють та опосередковують чутливість злоякісних клітин до дефіциту екзогенного аргініну in vitro та in vivo поки-що залишається предметом досліджень та дискусій. Однак, встановлено, що in vivo необхідною, але не достатньою, умовою чутливості різних типів пухлин до дії ферментів деградації аргініну є їх нездатність перетворювати попередник аргініну цитрулін до аргініну, що каталізується ферментом циклу сечовини аргініносукцинатсинтетазою (ASS) [4]. Слід підкреслити, що до злоякісних пухлин людини, дефіцитних за ASS і, як наслідок, потенційно чутливих до нестачі аргініну in vivo, належать агресивні форми карцином простати, підшлункової залози, яєчників, нирок, ретинобластоми а також меланоми. Більшість із цих типів пухлин є летальними, оскільки характеризуються високим метастатичним потенціалом, і для них на даний час не розроблено достатньо ефективних методів терапії. Однак, існує також низка невирішених проблем, які гальмують практичне використання відповідної протипухлинної ензимотерапії. Однією із головних є виникнення в процесі лікування резистентних до терапії форм ("клонів") пухлин з відновленою експресією гена ASS, оскільки дефіцит ферменту ASS у злоякісних клітинах зумовлюється не мутаціями у відповідному гені, а специфічним пригніченням його транскрипції, можливо внаслідок гіперметилювання його промотора. При підвищенні експресії ASS, що зокрема стимулюється голодуванням за аргініном in vitro у моношаровій та тривимірній культурі сфероїдів пухлинних клітин, відповідні пухлини повністю або частково втрачають чутливість до ензимотерапії на основі рекомбінантних аргініндеградуючих ферментів in vivo [5]. Останнє є зумовленим наявністю у кров'яному руслі пулу вільного цитруліну, що синтезується в епітелії кишечнику, та його конверсією до аргініну у клітинах пухлин, що лімітується ендогенною активністю ASS. Перспективним підходом для вирішення цієї проблеми є використання низькомолекулярних сполук, здатних специфічно інгібувати активність ASS, однак такі селективні інгібітори поки не розроблені. Іншим рішенням може бути контроль рівня експресії ASS на рівні транскрипції відповідного гена у клітинах пухлин за допомогою низькомолекулярних сполук, зокрема аналогів аргініну, як пропонується згідно з даним винаходом. В основу винаходу поставлено задачу розробити спосіб регуляції експресії ASS в культивованих клітинах пухлин (на моделях клітин раку шлунку та лімфобластної лейкемії людини) з використанням природного аналога аргініну рослинного походження канаваніну, з метою покращення ефективності методу протипухлинної терапії на основі голодування за аргініном, створеного за допомогою аргінази І людини чи інших рекомбінантних аргіназ. Поставлене завдання вирішується тим, що канаванін, як структурний аналог аргініну, згідно з винаходом, призводить до індукції сигнальних механізмів клітини, що викликають значне пригнічення експресії ASS за дефіциту аргініну. Канаванін при цьому не підлягає деградації аргіназою за використаних низьких концентрацій, одночасно підсилюючи протипухлинний 1 UA 107417 C2 5 10 15 20 25 30 35 40 45 50 55 ефект, створений додаванням рекомбінантної аргінази людини, додатково селективно індукуючи програмовану загибель клітин (апоптоз) у злоякісних клітин [9]. Канаванін (1-2-аміно-4(гуанідиноокси)бутират) є природним токсичним аналогом амінокислоти аргініну рослинного походження, що ефективно включається у новосинтезовані білки у комах та тварин, а також людини, замість аргініну [6]. На цьому базується захисний механізм деяких канаванін-продукуючих стручкових рослин з родини Leguminosae, спрямований проти їх природних консументів. Наслідком такої "молекулярної мімікрії" канаваніну є формування канаванінвмісних білків з порушеною структурою та, відповідно, пошкодженими функціональними властивостями, внаслідок суттєвих відмінностей фізико-хімічних властивостей аргініну та канаваніну. Оскільки багато типів пухлин характеризуються збільшенням кількості транспортера аргініну, а отже і його структурного аналога канаваніну, який використовує ту ж систему транспортерів, останній може виявляти селективну дозозалежну протипухлинну дію. І дійсно, протипухлинна дія канаваніну була продемонстрована в експериментах in vitro, а також in vivo на моделях тварин [7, 8]. Однак, через необхідність використання високих доз канаваніну in vivo за фізіологічних концентрацій аргініну і, як наслідок, виражену загальну токсичність, на даний час канаванін як хіміотерапевтичний препарат в клінічній практиці не використовується. Незважаючи на це, нашими нещодавніми дослідженнями встановлено, що голодування за аргініном може суттєво та селективно підсилювати антипроліферативний ефект канаваніну in vitro щодо злоякісних клітин [9]. Нами вперше показано, що цитотоксичність канаваніну за відсутності аргініну, як метаболічного конкурента, значно сильніше і селективно підвищується саме для пухлинних, але не для нормальних клітин (на два порядки проти одного порядку концентрації для останніх). Імовірною причиною такого феномену є підвищений транспорт аргініну чи канаваніну у пухлинних клітин та встановлена нами специфічна дерегуляція синтезу білка у злоякісних клітин при голодуванні за аргініном. Зокрема була виявлена селективна індукція програмованої смерті клітини (апоптозу) у пухлинних, але не псевдонормальних, клітин при ко-адміністрації рекомбінантної аргінази та низьких доз канаваніну in vitro. Також нами встановлено, що канаванін за використаних концентрацій (до 0,1 мМ) ефективно пригнічує експресію гена ASS, блокуючи таким чином ресинтез аргініну з його попередника цитруліну, що повинно значно підсилити терапевтичний ефект in vivo. Такий регуляторний ефект канаваніну є більш вираженим для суспензійних лейкемічних клітин людини, у порівнянні з моношаровими клітинами карцином кишечнику. Поряд з цим встановлено, що при дефіциті екзогенного аргініну у клітинах лейкемій канаванін викликає інгібування транскрипції іншого біосинтетичного гена ASNS (аспарагінсинтетази), що створює можливість одночасного застосування комбінації канаваніну, рекомбінантних аргіназ (проходять клінічні випробування) та аспарагіназ (використовуються у клінічній практиці для лікування гострих лейкемій). Ми пропонуємо, що створення одночасного дефіциту двох амінокислот в організмі хворих поряд з використанням канаваніну для контролю експресії їх біосинтетичних генів, значно підсилить терапевтичний ефект та унеможливить появу резистентних до терапії злоякісних клітин, зокрема при лікуванні гострих лейкемій людини. Важливим також є встановлений нами факт, що рекомбінантна аргіназа І людини здатна ефективно деградувати аргінін у культуральному середовищі, що містить канаванін, не зазнаючи інгібування останнім та не розщеплюючи канаванін за використаних концентрацій. Це спостереження узгоджується із встановленою раніше значно нижчою відносно аргініну спорідненістю аргінази І до канаваніну як субстрату. Таким чином, згідно із нашим винаходом, використання канаваніну як компонента нової комбінаційної протипухлинної терапії на основі голодування за аргініном (а саме при дії рекомбінантних аргіназ) може суттєво підвищити її ефективність внаслідок: 1) блокування ресинтезу аргініну (зумовлене специфічним пригніченням канаваніном експресії ASS) та 2) додаткового селективного підсилення цитотоксичності протипухлинної терапії. Для терапії лейкемій може бути застосована комбінація голодування за двома амінокислотами (аргініном та аспарагіном) та канаваніну. Підсумовуючи, винахід стосується створення терапевтичної композиції рекомбінантної аргінази та канаваніну з метою контролю біосинтезу амінокислот у клітинах пухлин і може застосовуватися для лікування раку, зокрема солідних пухлин чи лейкемій, в тому числі таких, що здатні до ресинтезу аргініну з цитруліну внаслідок індукованої голодуванням дерепресії ASS, і які є малочутливими до "класичної" монотерапії, що базується на штучно створеному дефіциті аргініну, а також зокрема для лікування лейкемій, чутливих до дефіциту аспарагіну. Таким чином, прогнозується, що запропонована терапевтична композиція дозволить значно 2 UA 107417 C2 5 10 15 20 25 30 35 40 45 50 55 60 розширити спектр пухлин, чутливих до відповідної ензимотерапії, підвищити ефективність лікування та значно зменшити імовірність відновлення хвороби. Найбільш близькими до запропонованого є описані у літературі [3] та запатентовані [10, 11] способи терапії деяких типів пухлин з використанням рекомбінантних "пегільованих" ферментів аргінази І людини та аргініндеімінази з бактерії Mycoplasma hominis. Однак у експериментах на тваринах та клінічних випробуваннях встановлено, що чутливими до цих препаратів (хоча у багатьох випадках відбувалась зупинка росту пухлин, яка не супроводжувалась їх ремісією) є лише деякі пухлини (ASS-дефіцитні та нездатні до дерепресії відповідного гена при голодуванні за аргініном), також відзначено появу резистентних до терапії ASS-позитивних клонів трансформованих клітин [4]. У запропонованому способі використовуються наступні методи: культивування клітин in vitro, полімеразна ланцюгова реакція (ПЛР), електрофорез ДНК в агарозному гелі, електрофорез білків в поліакриламідному гелі в денатуруючих умовах, вестерн-блот аналіз білків (ВБ). Комбінаційна терапія на основі рекомбінантної аргінази та канаваніну як спосіб регуляції експресії ASS в клітинах раку кишечнику людини (colorectal cancer) та гострої лімфобластної лейкемії (acute lymphoblastic leukemia) буде далі описана за допомогою нижченаведених прикладів. У даних прикладах використовуються наступні креслення: На Фіг. 1 зображено швидкість проліферації клітин раку товстого кишечнику людини (НСТ116 та НТ29) та гострої лімфобластної лейкемії (Jurkat) у визначених середовищах з аргініном чи його попередником цитруліном. CM - повноцінне середовище (аргінін - 0,4 мМ), БА - безаргінінове середовище, БА+Cit безаргінінове середовище з цитруліном (0,4 мМ). На Фіг. 2 зображено активацію експресії (дерепресію) аргініносукцинатсинтетази (ASS) у клітинах раку товстого кишечнику НСТ116, НТ29 та клітинах лейкемії людини Jurkat за відсутності у середовищі аргініну. (А) Аналіз мРНК транскриптів гена ASS методом ПЛР та зворотної транскриптазної реакції. (Б) Аналіз білкового продукту гена ASS методом Вестернблотингу. На Фіг. 3 зображено вплив канаваніну на проліферацію ракових клітин ліній НСТ116, НТ29 та Jurkat в залежності від присутності аргініну чи його біосинтетичного попередника цитруліну. CM - повноцінне середовище (аргінін - 0,4 мМ), Arg - безаргінінове середовище, Arg-, Cit безаргінінове середовище з цитруліном (0,4 мМ), Cav - канаванін (0,1 мМ) На Фіг. 4 зображено вплив канаваніну на рівень експресії аргініносукцинатсинтетази (ASS) у клітинах раку товстого кишечнику НСТ116, НТ29 та клітин лейкемії людини Jurkat. (А) Аналіз мРНК транскриптів гену ASS. (Б) Аналіз білкових продуктів гену ASS. На Фіг. 5 показано вплив канаваніну на індукцію апоптозу (за утворенням фрагментованої форми білка PARP) у пухлинних клітин ліній НСТ116 (А) та Jurkat (Б). В дослідах з НСТ116 канаванін додавався одночасно з початком голодування за аргініном, або після 24 год. голодування. Arg - аргінін - (0,4 мМ), Cit - цитрулін (0,4 мМ), Cav - канаванін (0,1 мМ). На Фіг. 6 показано вплив канаваніну на експресію аспарагінсинтетази (ASNS) у клітинах лейкемії людини Jurkat. Наведено результати аналізу мРНК транскриптів гену ASNS методом зворотної транскриптазної реакції та ПЛР. Дослідження комбінаційної терапії на основі рекомбінантної аргінази та канаваніну як способу регуляції експресії ASS та ASNS в клітинах раку кишечнику та гострої лейкемії людини здійснювалось у кілька етапів: Етап 1. Проаналізовано вплив біосинтетичного попередника аргініну цитруліну на проліферацію пухлинних клітин ліній НСТ116, НТ29 та Jurkat. Для цього клітини культивували впродовж 24, 48 і 72 годин у повноцінному середовищі, визначеному середовищі без аргініну, а також у безаргініновому середовищі з додаванням цитруліну. Виявлено що у середовищі без аргініну, як незамінною амінокислотою in vitro [12] проліферація клітин усіх ліній була заблокованою, однак цитрулін виявився здатним забезпечувати різною мірою клітинний поділ (НСТ116, НТ29), або підтримувати життєздатність (Jurkat) пухлинних клітин (Фіг. 1). Така захисна дія цитруліну вказує на його конверсію пухлинними клітинами до аргініну внаслідок функціонування ASS. Етап 2. Відомо, що екзогенний цитрулін з кров'яного русла може служити попередником синтезу аргініну в клітинах внаслідок послідовної дії двох цитозольних ензимів аргініносукцинатсинтетази (ASS) та аргініносукцинат ліази (ASL), де активність першого є лімітуючою. Виявлено, що за присутності аргініну рівень експресії гену ASS є відносно низьким як у культивованих клітинах колоректального раку (НСТ116 та НТ29) і в клітинах лейкемії 3 UA 107417 C2 5 10 15 20 25 30 35 40 45 50 людини (Jurkat). Однак за відсутності аргініну в середовищі кількість мРНК та білка ASS швидко зростає, що, в свою чергу, забезпечує ресинтез аргініну при наявності цитруліну, підвищене виживання (Jurkat) та обмежену проліферацію клітин досліджуваних ліній (НСТ116 та НТ29) (Фіг. 2). Таким чином, відповідні пухлинні клітини, внаслідок дерепресії синтезу ASS, будуть малочутливими до монотерапії на основі голодування за аргініном in vivo. Етап 3. Проаналізовано вплив структурного аналога аргініну рослинного походження канаваніну на проліферацію досліджуваних ліній клітин НСТ116, НТ29, Jurkat). Встановлено, що за присутності аргініну канаванін у концентрації 0,1 мМ незначно впливав на ріст клітин досліджуваних ліній (НСТ116, НТ29). Однак за відсутності аргініну в середовищі, незалежно від присутності цитруліну, канаванін у концентрації 0,1 мМ призводив до значного і швидкого зниження кількості живих клітин усіх досліджуваних ліній (Фіг. 3). Етап 4. Встановлено, що нездатність клітин до проліферації у безаргініновому середовищі за присутності цитруліну при додаванні канаваніну є пов'язаною з інгібуванням експресії гена ASS. Значне зниження кількості мРНК та білка ASS виявлено як у клітинах колоректального раку (НСТ116 та НТ29) так і в клітинах лейкемії людини (Jurkat). При цьому канаванін у концентрації 0,1 мМ призводив до зниження рівня експресії ASS практично до базового рівня (на повному середовищі з аргініном) (Фіг. 4А), а помітна інгібуюча дія канаваніну спостерігалась навіть при його дуже низьких концентраціях (0,01 мМ) (Фіг. 4Б). Етап 5. Встановлено, що ефект додавання канаваніну одночасного з перенесенням клітин у безаргінінове середовище, та при адміністрації канаваніну після 24 год. голодування відрізнялись. В останньому випадку клітини раку кишечнику виявляли підвищений рівень фрагментованого білка PARP (класичного маркера апоптозу) (Фіг. 5А). Також показано, що за присутності цитруліну канаванін призводив до додаткової індукції апоптозу у клітинах Jurkat (Фіг. 5Б), таким чином підсилюючи терапевтичний ефект голодування. Отже, такий режим комбінаційної терапії пропонується даним винаходом як більш ефективний. Етап 6. Встановлено, що у клітинах лейкемії людини Jurkat за дефіциту аргініну канаванін, крім експресії ASS, викликає інгібування транскрипції іншого біосинтетичного гена амінокислоти аспарагіну аспарагінсинтетази (ASNS) (Фіг. 6), що створює можливість паралельного застосування комбінації рекомбінантних аргіназ та аспарагіназ для створення одночасного дефіциту двох амінокислот в організмі хворих поряд з використанням канаваніну для контролю експресії їх біосинтетичних генів, що значно підсилить терапевтичний ефект ензимотерапії гострих лейкемій людини та повинно унеможливити появу резистентних до терапії форм злоякісних клітин. Джерела інформації: 1. Izzo F. et al. J. Clin. Oncol. - 2004. - V. 22, No. 10. - P. 1815-1822. 2. Ascierto P. A. et al. J. Clin. Oncol. - 2005. - V. 23, No. 30. - P. 7660-7668. 3. Thomas Yau et al. Invest New Drugs. - 2013. - V. 31. - P. 99-107. 4. Delage B. et al. Int. J. Cancer. - 2010. - V. 126, No. 12. - P. 2762-2772. 5. Vynnytska-Myronovska B. et al. Int. J. Cancer. - 2012. - V. 130, № 9. - P. 2164-2175. 6. Bence A. K. et al. J. Enzyme Inhib. Med. Chem. - 2003. - V. 18, No. 5. - P. 383-394. 7. Jang M. H. et al. Biochem. Biophys. Res. Commun. - 2002. - V. 295, No. 2. - P. 283-288. 8. Green M. H. et al. Cancer Res. - 1980. - V. 40, No. 3. - P. 535-537. 9. Vynnytska В. О. et al. Anticancer Drugs. - 2011. - V. 22, No. 2. - P. 148-157. 10. Cheng N. M. et al. US Patent No. 20050244398. 2005. 11. Tepic S. et al. European Patent No. EP1499342 A2. 2003. 12. Bobak Y. P. et al. Cell Biol. Int. - 2010. V. 4. - P. 1085-1090. 4 UA 107417 C2 ФОРМУЛА ВИНАХОДУ 5 Спосіб контролю експресії генів, що кодують ферменти біосинтезу амінокислот, у клітинах пухлин при комбінованій ензимотерапії раку включає пригнічення експресії аргініносукцинатсинтетази (ASS) та/або аспарагінсинтетази (ASNS) в культивованих клітинах пухлин на моделях клітин раку шлунка та лімфобластної лейкемії людини з використанням природного аналога аргініну рослинного походження канаваніну в концентрації не більше 0,1 мМ на тлі впливу рекомбінантною аргіназою І людини. 5 UA 107417 C2 6 UA 107417 C2 7 UA 107417 C2 8 UA 107417 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/195, A61K 38/46, A61P 35/00
Мітки: канаваніну, пухлин, клітинах, комбінований, експресії, раку, ензимотерапії, амінокислот, генів, ферментів, спосіб, біосинтезу, допомогою, контролю
Код посилання
<a href="https://ua.patents.su/11-107417-sposib-kontrolyu-ekspresi-geniv-fermentiv-biosintezu-aminokislot-u-klitinakh-pukhlin-za-dopomogoyu-kanavaninu-pri-kombinovanijj-enzimoterapi-raku.html" target="_blank" rel="follow" title="База патентів України">Спосіб контролю експресії генів ферментів біосинтезу амінокислот у клітинах пухлин за допомогою канаваніну при комбінованій ензимотерапії раку</a>
Попередній патент: Автоматизована механічна решітка для очищення стічних вод
Наступний патент: Збиральне пристосування для збиральної машини
Випадковий патент: Спосіб визначення відхилень від прямолінійності осі обертання обертової печі