Фармацевтична композиція, що містить мометазону фуроат та азеластину гідрохлорид, для назального введення
Номер патенту: 111343
Опубліковано: 25.04.2016
Автори: О Мі-Чін, Лі Гін-Хейг, Чой Бьонг-Сан, Лі Санг-Йонг, Парк Джін-Ха, Рю Чонг-Хейг
Формула / Реферат
1. Фармацевтична композиція для назального введення, що містить мометазону фуроат, азеластину гідрохлорид та тауматин, причому азеластину гідрохлорид у кількості від 0,05 до 1,0 % мас./об. та тауматин у кількості від 0,1 до 0,5 % мас./об., в перерахунку на загальний об′єм композиції, який зменшує гіркоту та подразнення, що спричинені азеластином.
2. Фармацевтична композиція для назального введення за п. 1, яка містить, у водному середовищі, від 0,01 до 1,0 % мас./об. мометазону фуроату; від 0,05 до 1,0 % мас./об. азеластину гідрохлориду; від 0,1 до 0,5 % мас./об. тауматину; від 1,0 до 5,0 % мас./об. загусника; від 0,2 до 0,6 % мас./об. буферного агента; від 0,001 до 0,1 % мас./об. поверхнево-активної речовини; від 5,0 до 10,0 % мас./об. ізотонічного агента; від 0,01 до 1,0 % мас./об. стабілізатора; та від 0,002 до 0,05 % мас./об. консерванту.
3. Фармацевтична композиція для назального введення за п. 2, яка містить, у водному середовищі, від 0,01 до 1,0 % мас./об. мометазону фуроату; від 0,05 до 1,0 % мас./об. азеластину гідрохлориду; від 0,1 до 0,5 % мас./об. тауматину; від 1,0 до 5,0 % мас./об. суміші мікрокристалічної целюлози та натрію карбоксиметилцелюлози; від 0,2 до 0,6 % мас./об. суміші лимонної кислоти та цитрату натрію; від 0,001 до 0,1 % мас./об. поліоксиметиленсорбітану моноолеату; від 5,0 до 10,0 % мас./об. суміші гліцерину та сорбіту; від 0,01 до 1,0 % мас./об. едетату натрію; та від 0,002 до 0,05 % мас./об. бензалконію хлориду.
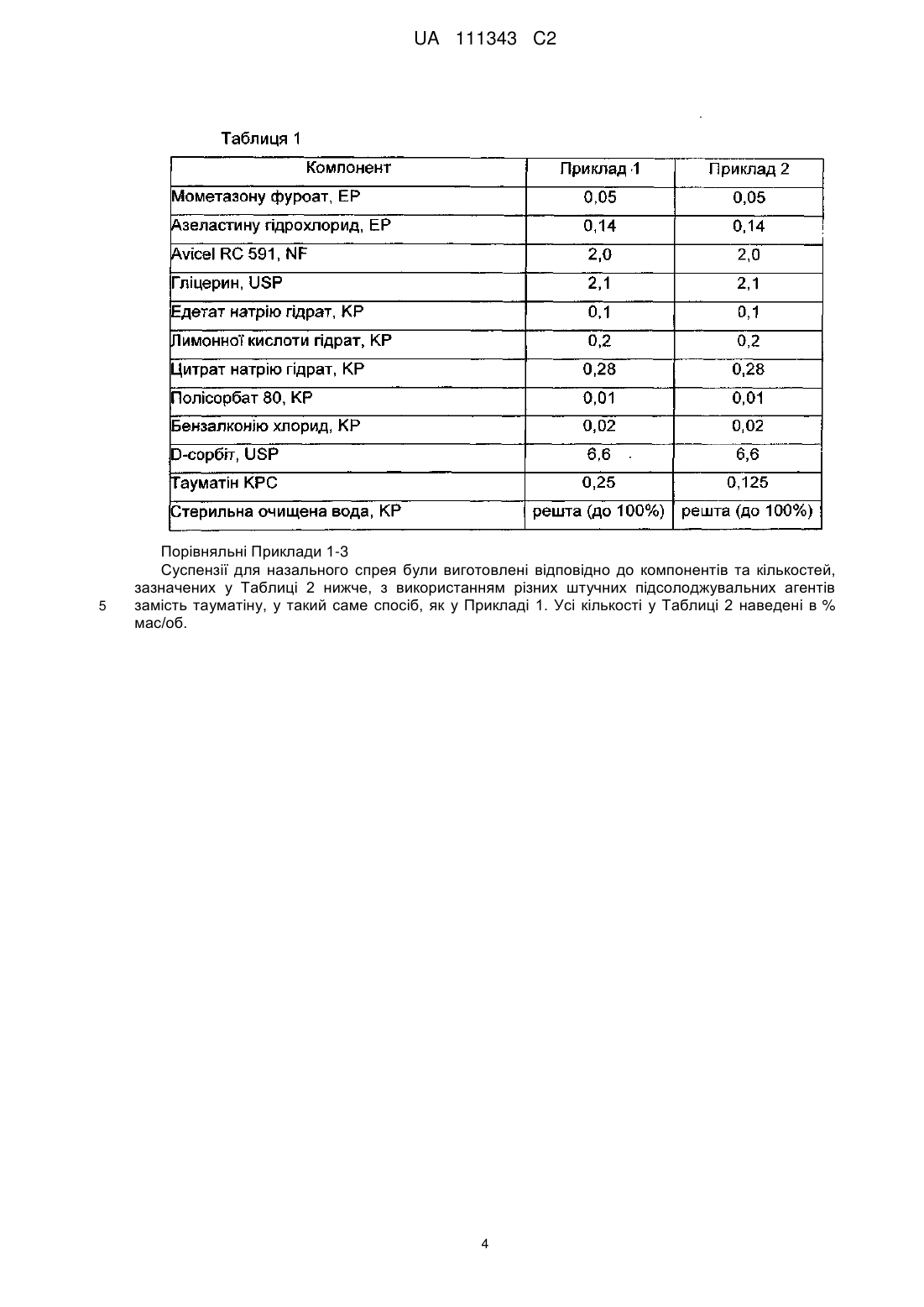
4. Фармацевтична композиція для назального введення за п. 3, яка містить 0,05 % мас./об. мометазону фуроату; 0,14 % мас./об. азеластину гідрохлориду; 0,25 % мас./об. тауматину; 2,0 % мас./об. суміші мікрокристалічної целюлози та натрію карбоксиметилцелюлози; 0,2 % мас./об. лимонної кислоти; 0,28 % мас./об. цитрату натрію; 0,01 % мас./об. поліоксиметиленсорбітану моноолеату; 2,1 % мас./об. гліцерину; 6,6 % мас./об. сорбіту; 0,1 % мас./об. едетату натрію; 0,02 % мас./об. бензалконію хлориду; та решту становить вода.
5. Фармацевтична композиція для назального введення за п. 4, у формі назального спрею.
6. Фармацевтична композиція для назального введення за будь-яким із пп. 1-3 у формі назального спрею.
Текст
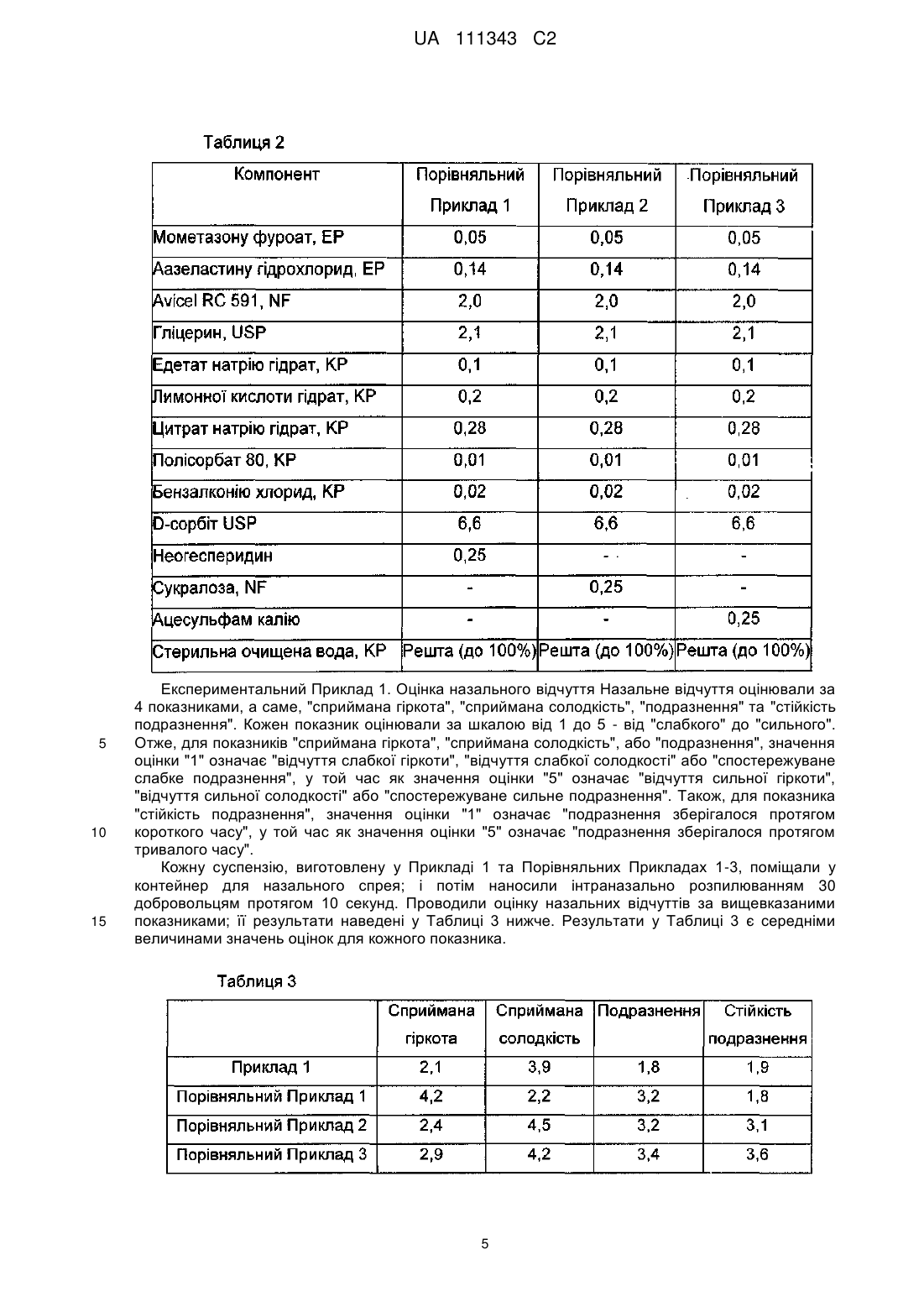
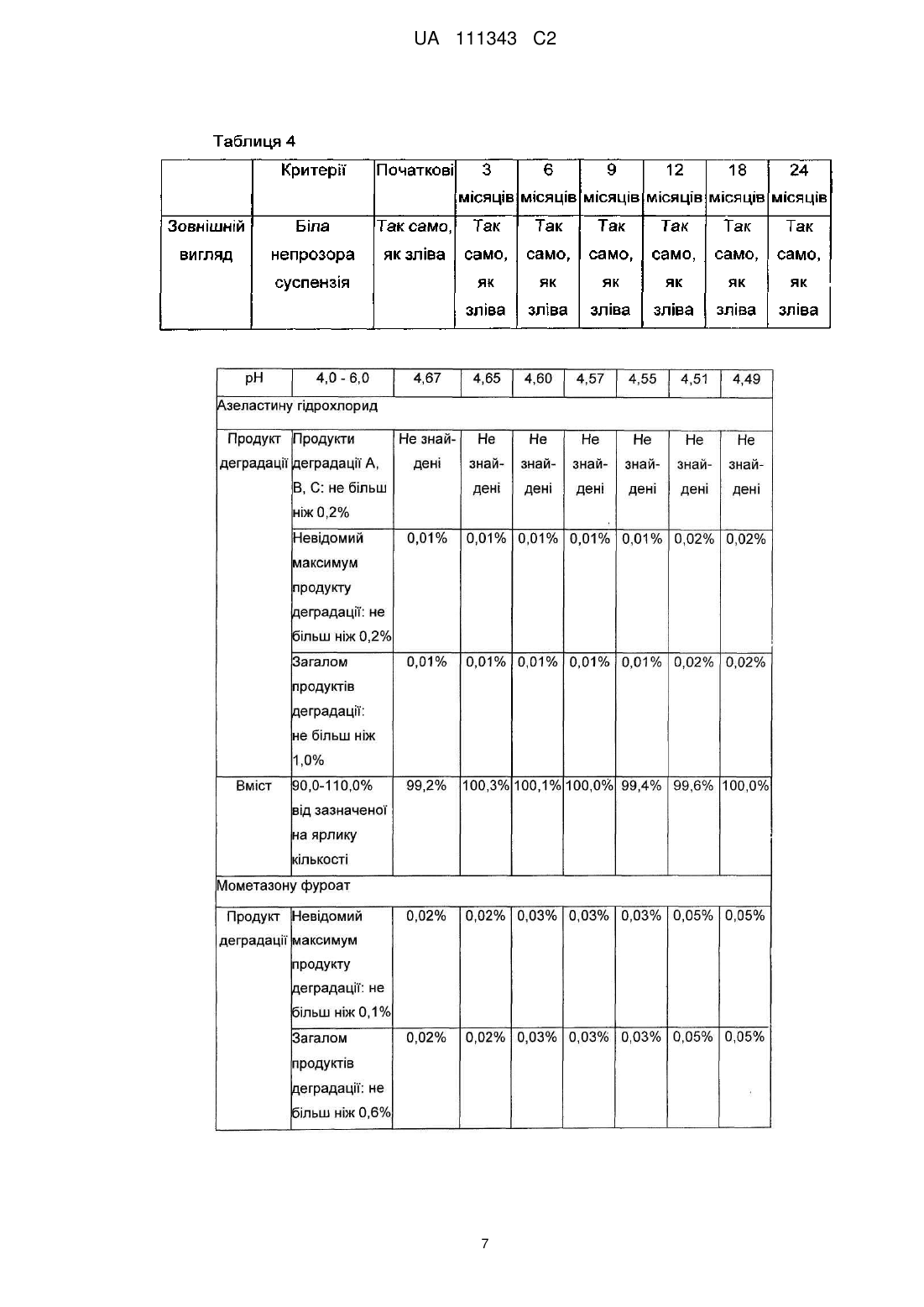
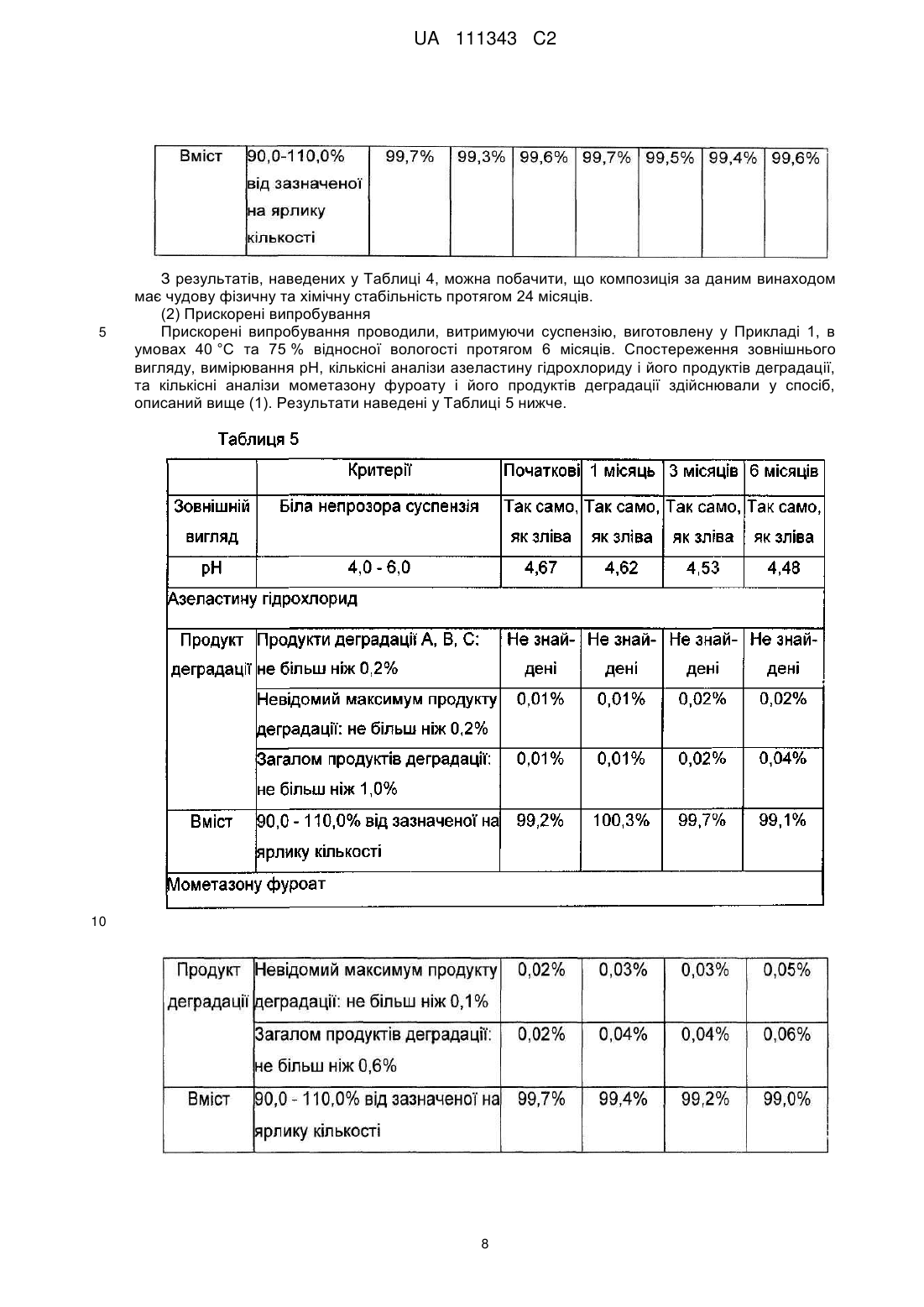
Реферат: Винахід належить до фармацевтичної композиції для назального введення, що містить мометазону фуроат, азеластину гідрохлорид та тауматин, причому азеластину гідрохлорид у кількості від 0,05 до 1,0 % мас./об. та тауматин у кількості від 0,1 до 0,5 % мас./об., в перерахунку на загальний об′єм композиції, який зменшує гіркоту та подразнення, що спричинені азеластином. UA 111343 C2 (12) UA 111343 C2 UA 111343 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується фармацевтичної композиції для назального введення, яка містить мометазону фуроат та азеластину гідрохлорид. Більш конкретно, даний винахід стосується фармацевтичної композиції, назальне сприйняття якої поліпшене завдяки зменшенню гіркоти та подразнення від азеластину гідрохлориду шляхом використання тауматіну. ВІДОМИЙ РІВЕНЬ ТЕХНІКИ Відомо, що мометазону фуроат, один зі стероїдів, використовуваних для лікування алергічного риніту, має високу ефективність при пролонгованому полегшенні симптомів. Відомо, що азеластину гідрохлорид, один з антигістаміних препаратів короткочасної дії, є високоефективним при негайному поліпшенні симптомів. Отже, очікується, що спільне введення цих двох лікарських засобів в комбінованій композиції виявлятиме чудовий ефект при довготривалому лікуванні алергічного риніту, разом з негайним симптоматичним поліпшенням. Міжнародна публікація WO97/01337 розкриває композицію назального спрея або назальних крапель, що містить азеластин або його сіль та беклометазон, флунісолід, триамцинолон, дексаметазон або будесонід. Також, міжнародна публікація WO2003/105856 розкриває фармацевтичну композицію, придатну для назального або очного введення (наприклад, назальний спрей), яка містить азеластин або його сіль та стероїд, такий як мометазону фуроат. При цьому, азеластину гідрохлорид має сильний гіркий смак. Гіркий смак є настільки 6 інтенсивним, що вважається неприємним навіть при розведенні у 1x10 разів (патент США 5164194). Після інтраназального застосування азеластину гідрохлориду, така гіркота азеластину гідрохлориду потрапляє до глотки, тим самим спричинюючи неприємний смак та подразнення. Патент США 6576677 розкриває використання полівінілпіролідону та/або кополівідону для полегшення неприємного смаку азеластину гідрохлориду. Також, міжнародна публікація WO2006/058022 розкриває фармацевтичну композицію, що містить азеластину гідрохлорид та мометазону фуроат, у якій сукралоза використовується як агент для маскування гіркоти. Опис. Технічна проблема Даний винахід пропонує фармацевтичну композицію для назального введення, що включає мометазону фуроат та азеластину гідрохлорид, назальне відчуття якої є поліпшеним через зменшення гіркоти та подразнення від азеластину гідрохлориду завдяки використанню тауматіну, екстрагованого з природного джерела, а саме, Thaumatococcus daniellii Benth. Таким чином, метою даного винаходу є створення фармацевтичної композиції для назального введення, що включає мометазону фуроат та азеластину гідрохлорид, у якій тауматін використовується як агент для зменшення гіркоти та подразнення. Технічне рішення Відповідно до аспекту цього винаходу, запропонована фармацевтична композиція для назального введення, що містить мометазону фуроат та азеластину гідрохлорид, причому фармацевтична композиція містить також тауматін у якості агента для зменшення гіркоти та подразнення. У фармацевтичній композиції для назального введення відповідно до цього винаходу, тауматін може бути присутнім у кількості, яка знаходиться в інтервалі значень від 0,1 до 0,5 % мас/об. У варіанті втілення цього винаходу, пропонується фармацевтична композиція, що містить від 0,01 до 1,0 % мас/об, мометазону фуроату; від 0,05 до 1,0 % мас/об, азеластину гідрохлориду; від 0,1 до 0,5 % мас/об, тауматіну; від 1,0 до 5,0 % мас/об, загусника; від 0,2 до 0,6 % мас/об, буферного агента; від 0,001 до 0,1 % мас/об, поверхнево-активної речовини; від 5,0 до 10,0 % мас/об, ізотонічного агента; від 0,01 до 1,0 % мас/об, стабілізатора; та від 0,002 до 0,05 % мас/об, консерванту, у водному середовищі. У кращому варіанті втілення, пропонується фармацевтична композиція, що містить з 0,05 % мас/об, мометазону фуроату; 0,14 % мас/об, азеластину гідрохлориду; 0,25 % мас/об, тауматіну; 2,0 % мас/об, суміші мікрокристалічної целюлози та натрію карбоксиметилцелюлози; 0,2 % мас/об, лимонної кислоти; 0,28 % мас/об, цитрату натрію; 0,01 % мас/об, поліоксиметиленсорбітану моноолеату; 2,1 % мас/об, гліцерину; 6,6 % мас/об, сорбіту; 0,1 % мас/об, едетату натрію; 0,02 % мас/об, бензалконію хлориду; і рештою є вода. Фармацевтична композиція може бути введена краще у формі назального спрея. КОРИСНІ ЕФЕКТИ Авторами цього винаходу було виявлено, що тауматін ефективно зменшує гіркоту та подразнення від азеластину гідрохлориду, тим самим забезпечуючи чудове назальне відчуття при інтраназальному введенні. Отже, схильність пацієнтів дотримуватися режиму застосування лікарського засобу може бути підвищена шляхом композицій із мометазону фуроату та 1 UA 111343 C2 5 10 15 20 25 30 35 40 45 50 55 60 азеластину гідрохлориду з використанням тауматіну у якості агента для зменшення гіркоти та подразнення; з наступним введенням одержаної композиції інтраназально. Крім того, фармацевтична композиція для назального введення, що містить мометазону фуроат та азеластину гідрохлорид, до складу якої входить тауматін, за цим винаходом, має чудову стабільність. НАЙКРАЩИЙ СПОСІБ ЗДІЙСНЕННЯ Цей винахід розкриває фармацевтичну композицію для назального введення, що містить мометазону фуроат та азеластину гідрохлорид, яка містить також тауматін у якості агента для зменшення гіркоти та подразнення. Зазначений "тауматін" є білковою сумішшю, одержуваною шляхом екстракції насіння Thaumatococcus daniellii Benth (рослина із Західної Африки) водою з наступним очищенням екстракту. Білкова суміш містить 5 білків, а саме, тауматіни І, II, III, а та b, переважно, тауматіни І та II. Тауматіни І та II мають майже однакові амінокислотні послідовності. Тауматін включений до Корейського кодексу харчових домішок (Korea Food Additives Code); і використовується у морозиві, освіжаючих напоях і т.д., як підсолоджувальний або смаковий агент. Відомо, що тауматін є білком, який продукується проти ураження віроїдними патогенами. Тауматіни виявляють інгібуючу активність проти росту гіфів та споруляції грибів. Авторами цього винаходу було виявлено, що тауматін ефективно зменшує гіркоту та подразнення від азеластину гідрохлориду, тим самим забезпечуючи чудове назальне відчуття при інтраназальному введенні. У фармацевтичній композиції за цим винаходом, тауматін може бути присутнім у кількості, яка знаходиться в інтервалі значень від 0,1 до 0,5 % мас/об., краще, від 0,2 до 0,4 % мас/об., ще краще, приблизно 0,25 % мас/об., в перерахунку на загальний об'єм композиції. У фармацевтичній композиції для назального введення за цим винаходом, мометазону фуроат, один з активних інгредієнтів, може бути присутнім у кількості, яка знаходиться в інтервалі значень від 0,01 до 1,0 % мас/об., краще, у кількості в інтервалі значень від 0,05 до 0,5 % мас/об., ще краще, у кількості близько 0,05 % мас/об., в перерахунку на загальний об'єм композиції. Також, азеластину гідрохлорид, інший активний інгредієнт, може бути присутнім у кількості, яка знаходиться в інтервалі значень від 0,05 до 1,0 % мас/об., краще, у кількості в інтервалі значень від 0,1 до 0,5 % мас/об., ще краще, у кількості близько 0,14 % мас/об., в перерахунку на загальний об'єм композиції. Фармацевтична композиція для назального введення за цим винаходом може містити, звичайно використовувані в композиціях для назального введення, такі компоненти як загусники, буферні агенти, поверхнево-активні речовини, ізотонічні агенти, стабілізатори, консерванти і т.д. Як загусник, може бути використана суміш мікрокристалічної целюлози та натрію карбоксиметилцелюлози (наприклад, Avicel RC 591, Avicel RC 581, Avicel CL 611 і т.д.). Загусник може бути використаний у кількості в інтервалі значень від 1,0 до 5,0 % мас/об., краще, у кількості в інтервалі значень від 1,0 до 4.0 % мас/об., ще краще, у кількості близько 2,0 % мас/об., в перерахунку на загальний об'єм композиції, хоча його кількість змінюється у залежності від використовуваного загусника. Як буферний агент може бути використана комбінація кислоти та її солі (наприклад, комбінація лимонної кислоти та цитрату натрію). Буферний агент може бути використаний у кількості в інтервалі значень від 0,2 до 0,6 % мас/об., краще, у кількості в інтервалі значень від 0,3 до 0,5 % мас/об., в перерахунку на загальний об'єм композиції, хоча його кількість змінюється у залежності від використовуваного буферного агента, концентрації буфера і т.д. У варіанті втілення може бути використана комбінація приблизно 0,2 % мас/об, лимонної кислоти (або її гідрату) та 0,28 % мас/об, цитрату натрію (або його гідрату), в перерахунку на загальний об'єм композиції. Поверхнево-активна речовина сприяє суспендуванню мометазону фуроату, одного з важкорозчинних у воді лікарських засобів. Як поверхнево-активна речовина може бути використаний поліоксиметиленсорбітан моноолеат (наприклад, Polysorbate 40, Polysorbate 60, Polysorbate 80 і т.д.). Поверхнево-активна речовина може бути використана у кількості, яка знаходиться у інтервалі значень від 0,001 до 0,1 % мас/об., краще, у кількості в інтервалі значень від 0,005 до 0,05 % мас/об., ще краще, у кількості близько 0,01 % мас/об., в перерахунку на загальний об'єм композиції, хоча її кількість змінюється у залежності від використовуваної поверхнево-активної речовини (buffering agent). Як ізотонічний агент можуть бути використані гліцерин, сорбіт або комбінація гліцерину та сорбіту. Оскільки використання сахаридів може додатково надавати солодкого смаку, краще можуть використовуватися сахариди (такі як сорбіт). Ізотонічний агент може бути використаний 2 UA 111343 C2 5 10 15 20 25 30 35 40 45 у кількості в інтервалі значень від 5,0 до 10,0 % мас/об., краще, у кількості в інтервалі значень від 6,0 до 9,0 % мас/об., в перерахунку на загальний об'єм композиції, хоча його кількість змінюється у залежності від використовуваного ізотонічного агента. У варіанті втілення може бути використана комбінація приблизно 2,1 % мас/об, гліцерину та 6,6 % мас/об, сорбіту (наприклад, D-сорбіту), в перерахунку на загальний об'єм композиції. Як стабілізатор може бути використаний едетат натрію або його гідрат. Стабілізатор може бути використаний у кількості в інтервалі значень від 0,01 до 1,0 % мас/об., краще, у кількості близько 0,1 % мас/об., в перерахунку на загальний об'єм композиції. Крім того, як консервант можуть бути використані звичайні консерванти, такі як бензалконію хлорид, у кількості в інтервалі значень від 0,002 до 0,05 % мас/об., краще, у кількості близько 0,02 % мас/об., в перерахунку на загальний об'єм композиції. У варіанті втілення цього винаходу, пропонується фармацевтична композиція для назального введення, яка містить від 0,01 до 1,0 % мас/об, мометазону фуроату; від 0,05 до 1,0 % мас/об, азеластину гідрохлориду; від 0,1 до 0,5 % мас/об, тауматіну; від 1,0 до 5,0 % мас/об, загусника; від 0,2 до 0,6 % мас/об, буферного агента; від 0,001 до 0,1 % мас/об, поверхнево-активної речовини; від 5,0 до 10,0 % мас/об, ізотонічного агента; від 0,01 до 1,0 % мас/об, стабілізатора; та від 0,002 до 0,05 % мас/об, консерванту, у водному середовищі (наприклад, очищена вода тощо). В іншому варіанті втілення цього винаходу пропонується фармацевтична композиція для назального введення, яка містить у водному середовищі у водному середовищі (наприклад, очищена вода тощо).від 0,01 до 1,0 % мас/об, мометазону фуроату; від 0,05 до 1,0 % мас/об, азеластину гідрохлориду; від 0,1 до 0,5 % мас/об, тауматіну; від 1,0 до 5,0 % мас/об, суміші мікрокристалічної целюлози та натрію карбоксиметилцелюлози; від 0,2 до 0,6 % мас/об, суміші лимонної кислоти та цитрату натрію; від 0,001 до 0,1 % мас/об, поліоксиметиленсорбітану моноолеату; від 5,0 до 10,0 % мас/об, суміші гліцерину та сорбіту; від 0,01 до 1,0 % мас/об, едетату натрію; та від 0,002 до 0,05 % мас/об, бензалконію хлориду. У кращому варіанті втілення цього винаходу, пропонується фармацевтична композиція для назального введення, що містить 0,05 % мас/об, мометазону фуроату; 0,14 % мас/об, азеластину гідрохлориду; 0,25 % мас/об, тауматіну; 2,0 % мас/об, суміші мікрокристалічної целюлози та натрію карбоксиметилцелюлози; 0,2 % мас/об, лимонної кислоти; 0,28 % мас/об, цитрату натрію; 0,01 % мас/об, поліоксиметиленсорбітану моноолеату; 2,1 % мас/об, гліцерину; 6,6 % мас/об, сорбіту; 0,1 % мас/об, едетату натрію; 0,02 % мас/об, бензалконію хлориду; і рештою є вода. Фармацевтична композиція для назального введення відповідно до цього винаходу може бути введена краще у формі назального спрея. Тому фармацевтична композиція за цим винаходом може бути приготовлена краще у формі назального спрея. Цей винахід буде описаний більш детально з посиланням на наступні приклади. Ці приклади призначені лише для ілюстративних цілей і не повинні обмежувати обсяг цього винаходу. Приклади 1 та 2. Суспензії для назального спрея Суспензії для назального спрея були виготовлені відповідно до компонентів та кількостей, зазначених у Таблиці 1 нижче. Усі кількості в Таблиці 1 наведені в % мас/об. Диспергували Avicel RC 591 та гліцерин у стерильній очищеній воді за допомогою змішувача Homo Mixer (Суміш І). В окремій посудині, азеластину гідрохлорид, бензалконію хлорид, лимонної кислоти гідрат, цитрату натрію гідрат, едетату натрію гідрат, D-сорбіт та тауматін розчиняли у стерильній очищеній воді при перемішуванні суміші (Суміш II). В окремій посудині, мометазону фуроат та полісорбат 80 диспергували у стерильній очищеній воді (Суміш III). Суміш І змішували із сумішшю II при перемішуванні; і одержану суміш потім змішували з сумішшю III при перемішуванні. Стерильну очищену воду додавали до одержаної суміші, для доведення її до кінцевого об'єму. 3 UA 111343 C2 5 Порівняльні Приклади 1-3 Суспензії для назального спрея були виготовлені відповідно до компонентів та кількостей, зазначених у Таблиці 2 нижче, з використанням різних штучних підсолоджувальних агентів замість тауматіну, у такий саме спосіб, як у Прикладі 1. Усі кількості у Таблиці 2 наведені в % мас/об. 4 UA 111343 C2 5 10 15 Експериментальний Приклад 1. Оцінка назального відчуття Назальне відчуття оцінювали за 4 показниками, а саме, "сприймана гіркота", "сприймана солодкість", "подразнення" та "стійкість подразнення". Кожен показник оцінювали за шкалою від 1 до 5 - від "слабкого" до "сильного". Отже, для показників "сприймана гіркота", "сприймана солодкість", або "подразнення", значення оцінки "1" означає "відчуття слабкої гіркоти", "відчуття слабкої солодкості" або "спостережуване слабке подразнення", у той час як значення оцінки "5" означає "відчуття сильної гіркоти", "відчуття сильної солодкості" або "спостережуване сильне подразнення". Також, для показника "стійкість подразнення", значення оцінки "1" означає "подразнення зберігалося протягом короткого часу", у той час як значення оцінки "5" означає "подразнення зберігалося протягом тривалого часу". Кожну суспензію, виготовлену у Прикладі 1 та Порівняльних Прикладах 1-3, поміщали у контейнер для назального спрея; і потім наносили інтраназально розпилюванням 30 добровольцям протягом 10 секунд. Проводили оцінку назальних відчуттів за вищевказаними показниками; її результати наведені у Таблиці 3 нижче. Результати у Таблиці 3 є середніми величинами значень оцінок для кожного показника. 5 UA 111343 C2 5 10 15 20 25 30 35 40 45 50 55 Як видно з результатів, наведених у Таблиці 3, композиція, що містить тауматін відповідно за цим винаходом, продемонструвала майже повну відсутність гіркоти та відносно сильну солодкість; а також, продемонструвала чудові властивості, особливо за показником подразнення та показником стійкості подразнення. Композиція, що містить неогесперидин, який є одним зі штучних підсолоджувальних агентів (тобто, Порівняльний Приклад 1), продемонструвала дуже поганий ефект маскування гіркого смаку та подразнення, спричинюваних азеластину гідрохлоридом. Також, композиція, що містить сукралозу (тобто, Порівняльний Приклад 2), продемонструвала відносно гарний ефект маскування гіркоти, але дуже поганий ефект маскування подразнення. Композиція, що містить ацесульфам калію (тобто, Порівняльний Приклад 3), продемонструвала не лише дуже погані ефекти маскування подразнення, але також подразнення, стійке протягом тривалого часу. Отже, можна побачити, що композиція, яка містить тауматін за цим винаходом, виявляє чудові назальні відчуття, у порівнянні з тими, що містять інші підсолоджувальні агенти. Експериментальний Приклад 2. Тести на подразнення слизової Як тест на подразнення слизової був проведений тест на подразнення очної слизової, тому що очна слизова є більш чутливою до подразнення, ніж назальна слизова; а добре відпрацьований метод випробувань дозволяє легко інтерпретувати результати. Тести проводили згідно з внутрішнім протоколом фірми (протокол 10-BL-455). Підготовку за цим протоколом та проведення випробувань здійснювали згідно з Основними принципами досліджень токсичності лікарських засобів (Guideline on Toxicity Study of Drugs, No. 2009-116, KFDA, 4 August 2009), Належною лабораторною практикою (Good Laboratory Practice, No. 2009183, KFDA, 22 December 2009), та Принципами належної лабораторної практики Організації економічного співробітництва і розвитку (OECD Principles of Good Laboratory Practice, 1997). Суспензію за Прикладом 1 наносили на очну слизову білих новозеландських кролів у дозі 0,1 мл/тварину; і потім спостерігали за симптомами протягом 7 днів. Були одержані такі результати: (1) протягом періоду випробувань не спостерігалось жодного загального симптому (симптомів) та загибелі тварин, асоційованих із застосуванням досліджуваних матеріалів; (2) протягом періоду випробувань не спостерігалось будь-яких змін ваги тіла, асоційованих із застосуванням досліджуваних матеріалів; (3) після застосування досліджуваних матеріалів не спостерігалось ніяких змін як у групі з промиванням очей, так і у групі без промивання очей, за результатами спостереження очної реакції; (4) індекс гострого очного подразнення (І.А.О.І.) був визначений як нульовий (тобто, не подразник) протягом періоду випробувань, за результатами спостереження очної реакції після застосування досліджуваних матеріалів. Таким чином, фармацевтична композиція, виготовлена відповідно до цього винаходу, була визначена як не подразник, при нанесенні на очну слизову; і тому було також визначено, що вона не спричинюватиме жодного подразнення при застосуванні у назальній порожнині. Експериментальний Приклад 3. Тести на фізичну та хімічну стабільність (1) Випробування на довготривале зберігання Були проведені тести на стабільність при тривалому зберіганні, у яких суспензія, виготовлена у Прикладі 1, утримувалася в умовах 20±5 °C та 60 % відносної вологості протягом 24 місяців. Зовнішній вигляд оцінювали неозброєним оком; і рН вимірювали за допомогою рНметра. Як кількісні аналізи азеластину гідрохлориду та його продуктів деградації, так і кількісні аналізи мометазону фуроату та його продуктів деградації проводили методом високоефективної рідинної хроматографії (ВЕРХ), за таких умов проведення ВЕРХ: Умови ВЕРХ для кількісних аналізів азеластину гідрохлориду та його продуктів деградації - Колонка: Колонка Capcellpak С18 (4,6 × 250мм, 5 мкм) - Температура колонки: 30°С - Детектор: УФ-спектрофотометр (довжина хвилі: 212 нм) Рухома фаза: готують шляхом додавання 941,1 мг 1-гексансульфонату натрію до 1 л 40 % розчину ацетонітрилу. Умови ВЕРХ для кількісних аналізів мометазону фуроату та його продуктів деградації - Колонка: Колонка Capcellpak C18 (4,6 × 150мм, 5 мкм) - Температура колонки: 30°С - Детектор: УФ-спектрофотометр (довжина хвилі: 254 нм) - Рухома фаза: змішаний розчинник з води та ацетонітрилу (50/50) Результати випробувань на стабільність при довготривалому зберіганні в умовах 20±5 °C та 60 % відносної вологості протягом 24 місяців наведені у Таблиці 4 нижче. 6 UA 111343 C2 7 UA 111343 C2 5 З результатів, наведених у Таблиці 4, можна побачити, що композиція за даним винаходом має чудову фізичну та хімічну стабільність протягом 24 місяців. (2) Прискорені випробування Прискорені випробування проводили, витримуючи суспензію, виготовлену у Прикладі 1, в умовах 40 °C та 75 % відносної вологості протягом 6 місяців. Спостереження зовнішнього вигляду, вимірювання рН, кількісні аналізи азеластину гідрохлориду і його продуктів деградації, та кількісні аналізи мометазону фуроату і його продуктів деградації здійснювали у спосіб, описаний вище (1). Результати наведені у Таблиці 5 нижче. 10 8 UA 111343 C2 З результатів, наведених у Таблиці 5, можна побачити, що композиція за даним винаходом також має чудову фізичну та хімічну стабільність у прискорених випробуваннях, що тривали 6 місяців. 5 10 15 20 25 30 ФОРМУЛА ВИНАХОДУ 1. Фармацевтична композиція для назального введення, що містить мометазону фуроат, азеластину гідрохлорид та тауматин, причому азеластину гідрохлорид у кількості від 0,05 до 1,0 % мас./об. та тауматин у кількості від 0,1 до 0,5 % мас./об., в перерахунку на загальний об'єм композиції, який зменшує гіркоту та подразнення, що спричинені азеластином. 2. Фармацевтична композиція для назального введення за п. 1, яка містить, у водному середовищі, від 0,01 до 1,0 % мас./об. мометазону фуроату; від 0,05 до 1,0 % мас./об. азеластину гідрохлориду; від 0,1 до 0,5 % мас./об. тауматину; від 1,0 до 5,0 % мас./об. загусника; від 0,2 до 0,6 % мас./об. буферного агента; від 0,001 до 0,1 % мас./об. поверхневоактивної речовини; від 5,0 до 10,0 % мас./об. ізотонічного агента; від 0,01 до 1,0 % мас./об. стабілізатора; та від 0,002 до 0,05 % мас./об. консерванту. 3. Фармацевтична композиція для назального введення за п. 2, яка містить, у водному середовищі, від 0,01 до 1,0 % мас./об. мометазону фуроату; від 0,05 до 1,0 % мас./об. азеластину гідрохлориду; від 0,1 до 0,5 % мас./об. тауматину; від 1,0 до 5,0 % мас./об. суміші мікрокристалічної целюлози та натрію карбоксиметилцелюлози; від 0,2 до 0,6 % мас./об. суміші лимонної кислоти та цитрату натрію; від 0,001 до 0,1 % мас./об. поліоксиметиленсорбітану моноолеату; від 5,0 до 10,0 % мас./об. суміші гліцерину та сорбіту; від 0,01 до 1,0 % мас./об. едетату натрію; та від 0,002 до 0,05 % мас./об. бензалконію хлориду. 4. Фармацевтична композиція для назального введення за п. 3, яка містить 0,05 % мас./об. мометазону фуроату; 0,14 % мас./об. азеластину гідрохлориду; 0,25 % мас./об. тауматину; 2,0 % мас./об. суміші мікрокристалічної целюлози та натрію карбоксиметилцелюлози; 0,2 % мас./об. лимонної кислоти; 0,28 % мас./об. цитрату натрію; 0,01 % мас./об. поліоксиметиленсорбітану моноолеату; 2,1 % мас./об. гліцерину; 6,6 % мас./об. сорбіту; 0,1 % мас./об. едетату натрію; 0,02 % мас./об. бензалконію хлориду; та решту становить вода. 5. Фармацевтична композиція для назального введення за п. 4, у формі назального спрею. 6. Фармацевтична композиція для назального введення за будь-яким із пп. 1-3 у формі назального спрею. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition for nasal administration comprising mometasone furoate and azelastine hydrochloride
Автори англійськоюLee, Sang-Yong, Lee, Geun-Hyeog, Choi, Byong-Sun, Ryu, Jong-Hyeon, Park, Jin-Ha, O, Mi-Jin
Назва патенту російськоюФармацевтическая композиция для назального введения, содержащая мометазона фуроат и азеластина гидрохлорид
Автори російськоюЛи Санг-Йонг, Ли Гин-Хейг, Чой Бёнг-Сан, Рю Чонг-Хейг, Парк Джин-Ха, О Ми-Чин
МПК / Мітки
МПК: A61P 11/02, A61K 31/573, A61K 31/55, A61K 9/12
Мітки: назального, містить, композиція, введення, гідрохлорид, азеластину, фуроат, мометазону, фармацевтична
Код посилання
<a href="https://ua.patents.su/11-111343-farmacevtichna-kompoziciya-shho-mistit-mometazonu-furoat-ta-azelastinu-gidrokhlorid-dlya-nazalnogo-vvedennya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить мометазону фуроат та азеластину гідрохлорид, для назального введення</a>