Протипухлинна сполука кахалаліду, її застосування та спосіб одержання
Номер патенту: 80992
Опубліковано: 26.11.2007
Автори: Елісес Марьяно, Куевас Марчанте Марія дель, Ферклот Глінн Томас, Авілес Марін Пабло Мануель, Сасак Халіна
Формула / Реферат
1. Сполука формули I
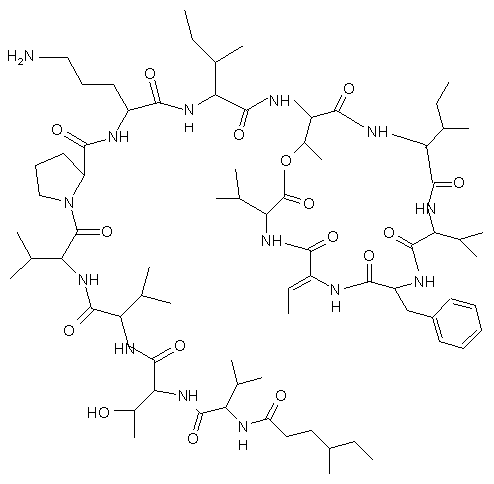 Формула І
Формула І
і її фармацевтично прийнятні солі, складні ефіри та солі складних ефірів, таутомери і сольвати.
2. Сполука за п. 1, яка являє собою (4S)-MeHex-D-Val-L-Thr-L-Val-D-Val-D-Pro-L-Orn-D-allo-Ile-цикло(D-allo-Thr-D-allo-Ile-D-Val-L-Phe-Z-Dhb-L-Val) і її фармацевтичнo прийнятні солі, складні ефіри та солі складних ефірів, таутомери і сольвати.
3. Сполука за п. 1, яка являє собою (4S)-MeHex-D-Val-L-Thr-L-Val-D-Val-D-Pro-L-Orn-D-allo-Ile-цикло(D-allo-Thr-D-allo-Ile-D-Val-L-Phe-Z-Dhb-L-Val) і її фармацевтичнo прийнятні солі.
4. Сполука за будь-яким з пунктів 1-3, яка містить щонайбільше 25 % будь-якого іншого кахалаліду.
5. Сполука за будь-яким з пунктів 1-3, яка містить щонайбільше 10 % будь-якого іншого кахалаліду.
6. Сполука за будь-яким з пунктів 1-3, яка містить щонайбільше 5 % будь-якого іншого кахалаліду.
7. Сполука за будь-яким з пунктів 1-3, яка містить щонайбільше 2 % будь-якого іншого кахалаліду.
8. Сполука за будь-яким з пунктів 1-3, яка містить щонайбільше 1 % будь-якого іншого кахалаліду.
9. Сполука за будь-яким з пунктів 1-3, яка містить щонайбільше 0,5 % будь-якого іншого кахалаліду.
10. Сполука за будь-яким з пунктів 1-3, яка містить менше ніж 0,5 % будь-якого іншого кахалаліду.
11. Сполука за будь-яким з пунктів 4-10, де іншим кахалалідом є кахалалід F, який має 5-метилгексильний бічний ланцюг.
12. Сполука, визначена в будь-якому з пунктів 1-3, яка є сполукою, по суті, в чистому вигляді.
13. Фармацевтична композиція, яка містить сполуку, визначену у будь-якому з пунктів 1-12, і фармацевтично прийнятний носій, наповнювач або розріджувач.
14. Спосіб лікування будь-якого ссавця, переважно людини, ураженого злоякісною пухлиною, який включає в себе введення ураженому індивіду терапевтично ефективної кількості сполуки, визначеної у будь-якому з пунктів 1-12.
15. Спосіб за пунктом 14, де ссавцем є людина.
16. Спосіб за пунктом 15, де пацієнт уражений стійкою формою злоякісної пухлини, яка не дає сприятливої відповіді на інші види терапії.
17. Спосіб за пунктом 15, де злоякісна пухлина вибрана із злоякісної пухлини передміхурової залози, злоякісної пухлини молочної залози, гепатоклітинної карциноми, меланоми, злоякісної пухлини прямої кишки, злоякісної пухлини нирки, злоякісної пухлини яєчника, карциноми легень NSCL, злоякісної пухлини епітелію, злоякісної пухлини підшлункової залози і пухлин, які експресують в підвищеній кількості онкоген Her2/neu.
18. Застосування сполуки, визначеної у будь-якому з пунктів 1-12, у виробництві лікарського засобу.
19. Застосування сполуки, визначеної у будь-якому з пунктів 1-12, у виробництві лікарського засобу для лікування злоякісної пухлини.
20. Набір, що включає в себе окремі контейнери, які містять фармацевтичну композицію, що включає в себе сполуку, визначену у будь-якому з пунктів 1-12, і відновлювальний агент.
21. Спосіб одержання сполуки, визначеної у будь-якому з пунктів 1-3, твердофазним синтезом, де як вихідну сполуку використовують 4-метилгексанову кислоту або (4S)-метилгексанову кислоту.
Текст
1. Сполука формули I NH щонайбільше 5 % будь-якого іншого кахалаліду. O NH 7. Сполука за будь-яким з пунктів 1-3, яка містить NH O щонайбільше 2 % будь-якого іншого кахалаліду. O O N O O NH NH HN O N H O HN O O 8. Сполука за будь-яким з пунктів 1-3, яка містить щонайбільше 1 % будь-якого іншого кахалаліду. 9. Сполука за будь-яким з пунктів 1-3, яка містить NH щонайбільше 0,5 % будь-якого іншого кахалаліду. 10. Сполука за будь-яким з пунктів 1-3, яка містить O менше ніж 0,5 % будь-якого іншого кахалаліду. NH HO O O N H 11. Сполука за будь-яким з пунктів 4-10, де іншим кахалалідом є кахалалід F, який має 5 метилгексильний бічний ланцюг. Формула І 12. Сполука, визначена в будь-якому з пунктів 1-3, яка є сполукою, по суті, в чистому вигляді. UA O N H (19) O (11) 6. Сполука за будь-яким з пунктів 1-3, яка містить H 2N 80992 щонайбільше 10 % будь-якого іншого кахалаліду. 13. 3 Фармацевтична композиція, яка містить 80992 пухлини підшлункової пухлин, фармацевтично прийнятний носій, наповнювач Her2/neu. або розріджувач. 18. Застосування сполуки, визначеної у будь 14. Спосіб лікування будь-якого ссавця, переважно якому з пунктів 1-12, у виробництві лікарського людини, ураженого злоякісною пухлиною, який засобу. включає в себе введення ураженому індивіду 19. Застосування сполуки, визначеної у будь терапевтично якому з пунктів 1-12, у виробництві лікарського сполуки, кількості які експресують кількості підвищеній і сполуку, визначену у будь-якому з пунктів 1-12, і ефективної в 4 залози онкоген визначеної у будь-якому з пунктів 1-12. засобу для лікування злоякісної пухлини. 15. Спосіб за пунктом 14, де ссавцем є людина. 20. Набір, що включає в себе окремі контейнери, 16. Спосіб за пунктом 15, де пацієнт уражений які стійкою формою злоякісної пухлини, яка не дає включає в себе сполуку, визначену у будь-якому з сприятливої відповіді на інші види терапії. пунктів 1-12, і відновлювальний агент. 17. Спосіб за пунктом 15, де злоякісна пухлина 21. Спосіб одержання сполуки, визначеної у будь вибрана із злоякісної пухлини передміхурової якому з пунктів 1-3, твердофазним синтезом, де як залози, вихідну сполуку використовують 4-метилгексанову злоякісної пухлини молочної залози, гепатоклітинної карциноми, меланоми, злоякісної містять кислоту або фармацевтичну композицію, (4S)-метилгексанову що кислоту. пухлини прямої кишки, злоякісної пухлини нирки, злоякісної пухлини яєчника, карциноми легень NSCL, злоякісної пухлини епітелію, злоякісної Даний винахід пов'язаний з новими протипухлинними сполуками кахалаліду, зокрема, з аналогами кахалаліду F, де аліфатична 5метилгексанова кислота заміщена 4метилгексановою кислотою, фармацевтичними композиціями, що містять їх, і їх застосуванням як протипухлинних, антивірусних, протигрибкових агентів і при лікуванні псоріазу. Сполуки кахалаліду являють собою пептиди, виділені з гавайських морських травоїдних видів молюска Elysia rufescens і його корму, зеленої водорості Bryopsis. sp. Кахалаліди A-F описані у [Hamman et al., J. Am. Chem. Soc, 1993, 115, 58255826]. Кахалаліди A-G описані у [Hamann, Μ. et al., J. Org. Chem, 1996, 61, 6594-6600: "Kahalalides: bioactive peptides from a marine mollusk Elysia rufescens and its algal diet Bryopsis sp."]. Кахалаліди Η і J описані у [Scheuer P. J. et al, J. Nat. Prod. 1997, 60, 562-567: "Two acyclic kahalalides from the sacoglossan mollusk Elysia rufescens"]. Кахалалід О описаний у [Scheuer P. J. et al., J. Nat. Prod. 2000, 63(1) 152-4: A new depsipeptide from the sacoglossan mollusk Elysia ornata and the green alga Bryopsis species"]. У зв'язку з кахалалідом К [див. публікацію Kan, Y. et al., J. Nat. Prod. 1999 62(8) 1169-72: "Kahalalide K: A new cyclic Depsipeptide from the hawaiian green alga bryopsis species"]. Що стосується пов'язаних з ним публікацій, хдив. також Goetz et al., Tetrahedron, 1999, 55; 7739-7746: "The absolute stereochemistry of Kahalalide F"; Albericio, F. et al. Tetrahedron Letters, 2000, 41, 9765-9769: "Kahalalide B. Synthesis of a natural cyclodepsipeptide"; Becerro et al. J. Chem. Ecol. 2001, 27(11), 2287-99: "Chemical defenses of the sarcoglossan mollusk Elysia rufescens and its host Alga bryopsis sp."ї. Серед кахалалідних сполук кахалалід F є найбільш багатообіцяючим через його протипухлинну активність. Він має складну структур у, що включає в себе шість амінокислот в циклічній частині і екзоциклічний ланцюжок з семи амінокислот з кінцевою групою з жирної кислоти. Про його активність проти клітинних культур in vitro клітин А-549 легеневої карциноми людини і клітин НТ-29 кишкової карциноми людини повідомлялося в [п ублікації ЕР 610078]. Було також показано, що кахалалід F має противірусні і протигрибкові властивості. У передклінічних дослідженнях in vivo було показано, що максимально переносима доза (МПД) однократної болюсної в/в ін'єкції кахалаліду F у самиць мишей становить 280мкг/кг. Незважаючи на те, що однократні дози трохи вищі 5 80992 6 за МПД в/в були виключно токсичні, так що у і її фармацевтично прийнятними солями, тварин виявлялися ознаки нейротоксичності, що проліками, таутомерами і сольватами. закінчувались смертельним виходом, дозу в Така сполука відповідає кахалаліду F з 4280мкг/кг кахалаліду F можна було вводити метилгексановим ланцюгом у вигляді кінцевої повторно, за схемою п'ять введень по одному жирної кислоти, і надалі в даному описі буде введенню в день, без будь-яких ознак гострої позначатися як 4-метилгексановий KF. токсичності. [Див. Supko, F. et al., Proceedings of У переважному втіленні даний винахід the 1999 AACR NCI EORTC International пов'язаний із сполукою, що містить (4S)Conference, abstract 315: "Preclinical pharmacology метилгексанову кислоту, що має формулу 2: studies with the marine natural product Kahalalide F"]. У [Міжнародній заявці WO 0236145] описані фармацевтичні композиції, що містять кахалалід F, і нові варіанти застосування цієї сполуки в лікуванні раку - ця публікація у всій своїй повноті включена в даний опис у вигляді посилання. У [Міжнародній заявці WO 0333012], від дати подачі якої вимагається пріоритет за даною заявкою, описане клінічне застосування сполук кахалаліду в онкології, і ця публікація також у всій своїй повноті включена в даний опис у вигляді посилання. У [патенті Великобританії GB 0304367], від дати подачі якого також вимагається пріоритет за даною заявкою, описане застосування сполук кахалаліду при лікуванні псоріазу і споріднених до нього сполук, і ця публікація також у всій своїй повноті включена в даний опис у вигляді посилання. Синтез і цитотоксичні активності природних і синтетичних сполук кахалаліду описані в [Міжнародній заявці WO 0158934], яка у всій своїй і її фармацевтично прийнятними солями, повноті включена в даний опис у вигляді пролінами, таутомерами і сольватами. Така посилання. У [документі WO 0158934] описаний сполука буде надалі в даному описі позначатися синтез кахалаліду F, а також сполук із подібною як (4S)-метилгексановий KF. структурою, в яких кінцевий ланцюг з жирної Даний винахід пов'язаний з фармацевтичною кислоти замінений іншими жирними кислотами. композицією, що містить визначену вище сполуку і Як і раніше відчувається необхідність в фармацевтично прийнятний носій, наповнювач створенні нових протипухлинних сполук, зокрема, або розріджувач. додаткових сполук кахалаліду з поліпшеними Даний винахід додатково пов'язаний зі властивостями. способом лікування будь-якої тварини, особливо Автори винаходу несподівано виявили, що людини, ураженої злоякісною пухлиною або одна із сполук-аналогів кахалаліду має досить псоріазом, причому цей спосіб включає в себе перспективну активність і виявляє підвищену введення ураженому захворюванням індивіду протипухлинну дію на моделях in vivo. терапевтично ефективної кількості сполуки, що Даний винахід пов'язаний із сполукою визначається вище. формули 1: Даний винахід може бути використаний, зокрема, для лікування пацієнтів з рефрактерними злоякісними пухлинами, які відрізняються незадовільною реакцією на інші терапевтичні впливи. Зокрема, композиції згідно з винаходом можуть бути використані після того як були використані інші види хіміотерапії, які не мали належної дії. Даний винахід направлений, зокрема, на лікування пацієнтів, уражених злоякісною пухлиною переміхурової залози, злоякісною пухлиною молочної залози, гепатоцелюлярною карциномою, меланомою, злоякісною пухлиною ободової і прямої кишки, злоякісною пухлиною нирки, злоякісною пухлиною яєчника, злоякісною пухлиною NSCL (карцинома легень), злоякісною пухлиною епітелію, злоякісною пухлиною підшлункової залози і пухлинами, для яких характерна підвищена експресія онкогену Her2/neu. 7 80992 8 У іншому аспекті даний винахід направлений на застосування визначеної вище сполуки для виробництва лікарського засобу. У переважному втіленні, вказаний лікарський засіб призначений для лікування злоякісної пухлини, псоріазу, вірусної інфекції або грибкової інфекції. Даний винахід додатково пов'язаний з наборами, що включають в себе роздільні контейнери, що містять фармацевтичну композицію, яка містить визначену вище сполуку і відновлюючий агент. Способи відновлення також забезпечуються даним винаходом. Даний винахід направлений також на спосіб отримання визначеної вище сполуки. У способі отримання переважно використовується як вихідна сполука 4-метилгексанова кислота. У переважному втіленні, 4-метилгексанова кислота являє собою (4S)-метилгексанову кислоту. У найбільш переважному втіленні цей спосіб являє Проте, сполуки згідно з винаходом мають собою твердофазний синтез. асиметричні центри, і, отже, існують в різних Автори винаходу ідентифікували аналоги енантіомерних і діастереомерних формах. Даний винахід пов'язаний із застосуванням всіх оптичних кахалаліду F, які проявляють значно більш ізомерів і стереоізомерів сполук згідно з поліпшену активність в порівнянні з кахалалідом F. Як показано в порівняльних прикладах, 4винаходом і їх сумішей, а також з метилгексановий кахалалід F нез'ясованим чином фармацевтичними композиціями, що містять їх, і зі проявляє поліпшену ефективність на in vivo способами лікування, в яких вони використовуються. моделях злоякісних пухлин. Це представляється Для зручності автори винаходу посилаються ще більш несподіваним з точки зору малих структурних відмінностей між 4-метилгексановим на сполуки згідно з винаходом, а саме на сполуки кахалалідом F і 5-метилгексановим кахалалідом F. 1 і 2, як на сполуки 4-метилгексилкахалаліду F, Сполукою згідно з винаходом є кахалалід F з або сполуки 4-мегексКF. Переважно сполуки 4мегексКF згідно з винаходом є сполуками, які у ланцюгом 4-метилгексанової жирної кислоти великій мірі вільні, по суті вільні або повністю замість 5-метилгексанової,. що має стр уктуру відповідно до формули 1: вільні від інших сполук кахалаліду. Наприклад, сполука 4-мегексКF згідно з винаходом переважно вільна від кахалаліду F, що має 5метилгексильний бічний ланцюг. Зокрема, 4мегексКF згідно винаходу переважно містить найбільше 25%, 10%, 5%, 2%, 1% або 0,5%, або менш ніж 0,5% будь-якого іншого кахалаліду, особливо кахалаліду F. В близькому аспекті, 4мегексКF згідно з винаходом забезпечується по суті в чистому вигляді. Така сполука 4-мегексКF, в деякій мірі вільна від інших кахалалідів, особливо підходить для фармацевтичних композицій і способів лікування згідно з винаходом. Даний винахід включає в себе сполуки згідно з винаходом і їх фармацевтично прийнятні солі, в яких один або більше атомів водню, вуглецю або інших атомів заміщені їхніми ізотопами. Такі сполуки можуть бути використані як засоби для наукових досліджень і діагностики при вивченні Зокрема, є переважним, щоб ця сполука мало метаболізму і фармакокінетики, а також в аналізах стереохімію, що визначається формулою 2: зв'язування. У даному описі сполуки згідно з винаходом, включаючи сполуки формули 1 і 2, визначаються як сполуки, які включають в себе також і фармацевтично прийнятні похідні або проліки. "Фармацевтично прийнятне похідне або проліки" означає будь-яку фармацевтично прийнятну сіль, складний ефір, сіль складного ефіру або інше похідне сполуки згідно з винаходом, яке при введенні реципієнту здатне забезпечити (прямо або непрямо) сполуку згідно з винаходом або його метаболіт або залишок. Особливо переважними похідними і проліками є такі, які збільшують 9 80992 10 біодоступність сполук згідно з винаходом, коли такі Переважні фармацевтичні композиції сполук сполуки вводяться пацієнту (наприклад, додаючи згідно з винаходом включають в себе рідину сполуці, що вводиться перорально, властивість (розчини, суспензії або емульсії) з відповідним підвищеної абсорбції в крові), поліпшують складом для внутрішньовенного введення, і вони доставку батьківської сполуки до конкретного можуть містити сполуки в чистому вигляді або в біологічного компартменту, підвищують комбінації з будь-яким носієм або іншими розчинність, створюючи можливість введення фармацевтично активними сполуками. шляхом ін'єкції, змінюють метаболізм або Подальшим путівником в зв'язку з змінюють швидкість екскреції. фармацевтичними композиціями може служити Солі сполук згідно з винаходом включають в [міжнародна заявка WO 0236145], яка у всій її себе адитивні солі, отримані з азоту в сполуці повноті включена в даний опис у вигляді формули 1 або 2. Терапевтична активність, як посилання. визначено в даному описі, пов'язана з Таким чином, комбінація неіонної поверхневофрагментом, отриманим із сполуки згідно з активної речовини і органічної кислоти є винаходом, а ідентичність компонента, що прийнятною для використання з агентомзалишився, не так важлива, хоч для наповнювачем для отримання ліофілізованої терапевтичних і профілактичних цілей переважно, форми сполуки згідно з винаходом, прийнятної щоб він був фармацевтично прийнятним для для відновлення. Відновлення переважно пацієнта. Приклади фармацевтично прийнятних проводять шляхом змішування емульсифікуючого кислотно-адитивних солей включають в себе такі солюбілізатора, алканолу і води. кислотно-адитивні солі, які отримані з мінеральних Ліофілізовані композиції переважно кислот, таких хлористоводнева, бромистоводнева, включають в себе в основному наповнювач, фосфорна, метафосфорна, азотна і сірчана наприклад, щонайменше 90% або щонайменше кислоти, органічних кислот, таких як винна, 95% агента-наповнювача. Приклади агентівоцтова, трифтороцтова, лимонна, яблучна, наповнювачів добре відомі і включають в себе молочна, фумарова, бензойна, гліколева, сахарозу і маніт. Можуть бути використані також і глюконова, янтарна і метансульфонова і інші агенти-наповнювачі. арилсульфонова, наприклад параНеіонною поверхнево-активною речовиною в толуолсульфонова, кислоти. Переважною сіллю є ліофілізованій композиції переважно є складний сіль трифтороцтової кислоти. ефір сорбітану, більш переважно - складний ефір Сполуки згідно з винаходом можуть бути поліетиленсорбітану, такий як отримані відповідно до синтетичних процесів, поліоксіетиленсорбітаналканоат, зокрема, описаних в [міжнародній заявці WO 0158934], поліоксіетиленсорбітанмоноолеат, наприклад, наприклад, при додаванні відповідної (S) або (R) полісорбат-80. Неіонна поверхнево-активна 4-метилгексанової кислоти замість 5речовина звичайно становить невеликий відсоток метилгексанової в прикладі 3 [міжнародної заявки композиції, наприклад, від 0 до 5% композиції, WO 0158934]. Отже, даний винахід наприклад, від 2 до 3 або 4% композиції. розповсюджується також на спосіб отримання Органічною кислотою в складі ліофілізованої сполуки формули 1 або 2. В цьому способі як композиції звичайно є аліфатична кислота, вихідний матеріал використовується 4переважно гідроксикарбонова кислота, а більш метилгексанова кислота. Найбільш переважним переважно - гідроксиполікарбонова кислота, вихідним матеріалом є (4S)-метилгексанова зокрема, лимонна кислота. Органічна кислота кислота. Спосіб синтезу переважно являє собою звичайно становить невеликий відсоток спосіб твердофазного синтезу. Додаткові композиції, наприклад, від 0 до 5% композиції, подробиці синтезу наведені в прикладах. наприклад, від 2 до 3 або 4% композиції. Спосіб згідно з винаходом може бути Кількість сполуки згідно з винаходом в складі здійснений на основі вихідних матеріалів в ліофілізованої композиції звичайно складає менше енантіо-, стереоконтрольованому і швидкому за 1% або частіше менше ніж 0,1% суміші. режимі, з використанням переваг методології Прийнятна кількість міститься в межах від 50 до твердофазного синтезу, де протягом всіх операцій 200мкг, наприклад, приблизно 100мкг на 100мг синтезу молекула в конструкції пов'язана з композиції. нерозчинною підкладкою. Емульсифікуючий солюбілізатор для Фармацевтичні композиції сполук згідно з відновлюючого агента в прийнятному випадку винаходом можуть бути адаптовані для будь-якого містить складний ефір поліетиленгліколю, бажаного шляху введення, наприклад, особливо складний ефір жирної кислоти, більш перорального (включаючи букальне або переважно - ПЕГ-олеат, такий як ПЕГ-олеат-35. під'язичне), ректального, назального, місцевого Емульсифікуючий солюбілізатор в прийнятному (включаючи букальне, під'язичне або випадку складає від 0 до 10% поновлюючого трансдермальне), вагінального або агента, звичайно приблизно від 3 до 7%, парентерального (включаючи підшкірне, наприклад, приблизно 5%. Алаканол звичайно є внутрішньом'язове, внутрішньовенне або етанолом, який в прийнятному випадку складає від внутрішньодермальне) шляхів введення. Такі 0 до 10% відновлюючого агента, звичайно композиції можуть бути отримані будь-яким приблизно від 3 до 7%, наприклад, приблизно 5%. способом, відомим в галузі фармації, наприклад, Іншу частин у відновлюючого агента складає вода, шляхом асоціації активного інгредієнту з носієм і в результаті отримують відновлений розчин, (носіями) або наповнювачем (наповнювачами). підходящий для внутрішньовенної ін'єкції. 11 80992 12 Подальше розбавлення відновленого розчину 900мкг/м 2/день, переважно від 500 до 0,9% фізіологічним розчином може бути зроблене 800мкг/м 2/день, більш переважно від 600 до для інфузії кахалалідної сполуки. Відповідне для 750мкг/м 2/день. Особливо переважними є дози інфузії обладнання переважно включає в себе приблизно від 650 до 700мкг/м 2/день. скляний контейнер, який є переважнішим У наступному аспекті даного винаходу поліетиленового. Трубки переважно повинні бути пропонується спосіб лікування людини, ураженої зроблені з сілікону. злоякісною пухлиною, що включає в себе Далі, переважний відновлюючий агент складає введення вказаному хворому сполуки згідно з від 2 до 7%, наприклад, приблизно 5%, винаходом щодня протягом 5 днів в дозі нижче емульсифікуючого солюбілізатора; від 2 до 7%, 930мкг/м 2/день, після чого слідує період наприклад, приблизно 5%, спирту; а решта - вода. відновлення, що складає від 1 до 4 тижнів, Композиції можуть бути представлені в протягом якого сполуки кахалаліду хворому не контейнерах з одиничною дозою або в вводять. Доза переважно становить 650контейнерах з багаторазовою дозою, наприклад, 750мкг/м 2/день, більш переважно - приблизно закритих ампулах і флаконах, і можуть зберігатися 700мкг/м 2/день. Час інфузії переважно складає між в заморожено-висушеному (ліофілізованому) 1 і 24 годинами, більш переважно - між 1 і 3 стані, потребуючи лише додаткового стерильного годинами. Особливо переважним є час інфузії, що рідкого носія, наприклад, води для ін'єкцій, що становить приблизно 1 годину або приблизно 3 використовується безпосередньо перед години. Період, що залишається, переважно вживанням. становить 2-3 тижні, більш переважно - приблизно Таким чином, даний винахід додатково 2 тижні. пов'язаний з наборами, що включають в себе Даний винахід також забезпечує спосіб окремі контейнери, що містять ліофілізовану лікування людини, ураженої злоякісною пухлиною, композицію і відновлювальний агент. Опис що включає в себе введення вказаному хворому способів відновлення також включений в набір. сполуки згідно з винаходом щотижня в дозі нижче Введення сполук або композицій згідно з 800мкг/м 2/день. Доза переважно становить 600винаходом проводиться шляхом внутрішньовенної 700мкг/м 2/день, більш переважно - 650мкг/м 2/день. інфузії. Час інфузування може досягати 72 годин, Час інфузії переважно складає від 1 до 24 годин, більш переважно від 1 до 24 годин, найбільш більш переважно - від 1 до 3 годин. Особливо переважно або приблизно 1 година, або переважним є час інфузії, що становить приблизно приблизно 3 години. Особливо переважними є 1 годину. короткі часи інфуз ування, які дозволяють Незважаючи на наведене вище орієнтовне здійснювати терапевтичний вплив без дозування, точна підбірка дозування сполуки буде необхідності перебування хворого в госпіталі варіювати в залежності від конкретної композиції, протягом нічного часу. Однак у разі необхідності способу введення і з урахуванням конкретної інфузія може приблизно продовжуватися протягом ситуації, пов'язаної з станом самого хворого і 24 годин і навіть довше. пухлини, які зазнають лікування. Повинні братися Робиться циклічне введення, в переважному до уваги і інші чинники, такі як вік, вага тіла, стать, способі введення пацієнтам проводять дієта, час введення, швидкість виведення, стан внутрішньовенну інфузію сполуки згідно з хворого, комбінація лікарських засобів, реакція винаходом в перший тиждень кожного циклу, потім чутливості і тяжкість захворювання. Введення в інший час в рамках циклу пацієнтам дають час може здійснюватись в безперервному режимі або для відновлення. Переважна тривалість кожного ж періодично, в рамках максимально переносимої циклу складає або 1, або 3, або 4 тижні; у разі дози. необхідності можуть застосовува тися множинні Даний винахід особливо направлений на цикли. У альтернативному протоколі дозування лікування пацієнтів, уражених злоякісною сполуки згідно з винаходом вводять, наприклад, пухлиною переміхурової залози, злоякісною приблизно протягом 1 години протягом 5 днів пухлиною молочної залози, гепатоцелюлярною підряд протягом 3 тижнів. Як варіанти можуть бути карциномою, меланомою, злоякісною пухлиною прописані й інші схеми. прямої кишки, злоякісною пухлиною нирки, У випадку необхідності вдаються до злоякісною пухлиною яєчника, карциномою легень відстрочення дози або зниження доз і зміни схеми NSCL, злоякісною пухлиною епітелію, злоякісною введення, в залежності від толерантності пухлиною підшлункової залози, пухлинами, які в індивідуального пацієнта до лікування, зокрема, надлишку експресують онкоген Her2/neu. У зниження доз рекомендується хворим, у яких рівні найбільш переважному варіанті воно направлене трансаміназ або лужної фосфатази в сироватці на лікування гепатоцелюлярної злоякісної вищі за норму. пухлини, меланоми, злоякісної пухлини молочної У одному з аспектів даного винаходу залози і злоякісної пухлини передміхурової залози. забезпечується спосіб лікування людини, ураженої Даний винахід також відноситься до способу злоякісною пухлиною, що включає в себе лікування шкірного захворювання, що включає в введення вказаному хворому сполуки згідно з себе гіперпроліферацію дермальних клітин у винаходом в дозі нижче за 1200мкг/м 2/день, ссавців, де вказаний спосіб включає в себе переважно нижче за 930мкг/м 2/день, а більш введення вказаному ссавцеві ефективної, переважно нижче за 800мкг/м2/день. Відповідною нетоксичної кількості сполуки згідно з винаходом. дозою є щонайменше 320мкг/м 2/день. Переважно, якщо шкірним захворюванням є Переважною є доза в інтервалі від 400 до псоріаз. Даний винахід переважно направлений на 13 80992 14 лікування хворої людини, ураженої псоріазом, Після промивання з використанням DMF і особливо, тяжкою формою псоріазу. СН2СI2, Alloc-груп у видаляли за допомогою Сполуки і композиції згідно з винаходом Pd(PPh3)4 (58мг, 0,05ммоль, 0,1еквів.) в можуть бути використані і в поєднанні з іншими присутності PhSiH 3 (617мкл, 5ммоль, 10еквів.) в лікарськими засобами для забезпечення атмосфері Аr. За хищений пептид відщеплювали комбінованої терапії. Вказані інші лікарські засоби від полімерної смоли за допомогою суміші ТФОможуть становити частину однієї і тієї ж композиції СН2Сl2 (1:99) (5´30сек). Фільтрат збирали на Н 2О або ж можуть бути представлені у вигляді окремої (4мл), і Н2О частково видаляли на роторному композиції для одночасного введення або ж випарнику. Потім додавали ACN для розчинення роздільного введення в різний час. Тотожність твердої речовини, що утворилася в процесі іншого лікарського засобу не є особливо видалення Н2О, і розчин ліофілізували, отримуючи лімітованою, хоч комбінації з іншими 639мг (387мкмоль, вихід 77%) вказаної в заголовку хіміотерапевтичними, гормональними засобами і сполуки із ступенем чистоти >95%, що антитілами повинні враховуватися. Кількості підтверджено методом HPLC (Кондиція A, tR сполуки згідно з винаходом і іншого 10,5хв). фармацевтично активного агента або агентів і (4S)-MeHex-D-Val-Thr-Val-D-Val-D-Pro-Orn-Dвідносні часи введення повинні бути відпрацьовані allo-Ile-цикло(D-allo-Thr-D-allo-Ile-D-Val-Phe-Z-Dhbз метою досягнення бажаного ефекту комбінованої Val)=(4S)метилгексановий KF терапії. Захи щений пептид (приклад 6) (639мг, Приклади 387мкмоль) розчиняли в СН 2Сl2 (390мл, 1мМ), і Приклад 1: отримання (4S)-метилгексанового HOBt (237мг, 1,55ммоль) розчиняли в KF мінімальному об'ємі DMF для розчинення HOBt, Основні процедури і початкові стадії процесу додавали DIEA (203мкл, 1,16ммоль, 3еквів.) і відповідають таким, описаним в [міжнародній DIPCDI (240мкл, 1,55ммоль, еквів.). Суміш заявці WO 0158934]. залишали на мішалці протягом 1 години, потім (4S)-MeHex-D-Val-Thr(tBu)-Val-D-Val-D-Proрезультат виконання стадії циклізації Orn(Boc)-D-allo-Ile-D-allo-Тhr(VаI-АIIос)-D-аIIо-ІIе-Dконтролювали методом HPLC. Розчинник VаI-О-ТrtСl-полімерна смола: видаляли шляхом випаровування в умовах Fmoc-групу видаляли, і до вказаного вище зниженого тиску. Захи щений циклічний пептид пептидил-полімеру послідовно додавали Fmocрозчиняли в суміші ТФО-Н 2О (19:1, 85мл), і суміш, Val-OH (678мг, 2ммоль, 4еквів.), Fmoc-Thr(tBu)-BIH що утворилася залишали на мішалці протягом 1 (992мг, 2,5ммоль, 5еквів.), Fmoc-D-Val-OH (678мг, години. Розчинник видаляли шляхом 2ммоль, 4еквів.) і (4S)-MeHex-OH (195мг, випаровування в умовах зниженого тиску, і 1,5ммоль, 3еквів.) (приклад 3) з використанням додавали діоксан (30мл), і розчинник видаляли DIPCDI (233мкл на 1,5ммоль і 3еквів.; 310мкл на шляхом випаровування в умовах зниженого тиску 2ммоль і 4еквів.; і 388мкл на 2,5ммоль, 5еквів.) і (цей процес повторювали тричі), потім додавали HOBt (230мг на 1,5ммоль і 3еквів.; 307мг на Н2О (40мл), і здійснювали ліофілізацію. Грубий 2ммоль і 4еквів.; і 395мг, 2,5ммоль, 5еквів.) продукт очищали методом HPLC (Kromasil C 8 протягом 90хв. У всіх випадках через 90хв. 5мкм, 205´50мм), ізократично 44% ацетонітрилу зв'язування нінгідриновий тест був негативним. (+0,05% ТФО) у воді (+0,05% ТФО), 55мл/годину, Видалення Fmoc-групи і промивання проводили, детектували при 220нм, отримуючи вказаний в як описано в розділі General Procedures. заголовку продукт (192мг, 0,13ммоль, вихід 26%, (4S)-MeHex-D-Val-Thr(tBU)-Val-D-Val-D-Pro92,3%). MALDI-TOF-MS, розраховуючи для Orn(Boc)-D-allo-Ile-D-allo-Thr(Val-Z-Dhb-Phe-Alloc)C75H124N14 O16 , 1477,9. D-allo-Ile-D-Val-O-TrtCl-полімернa смола: Отримано: m/z 1500,12 [M+Na]+, 1515,97 Alloc-груп у видаляли за допомогою Pd(PPh3)4 [М+K]+. (58мг, 0,05ммоль, 0,1еквів.) в присутності PhSiH3 Спектр 1H-ЯМР (2,5мМ; 500МГц, H2O-D2O (9:1) (617мкл, 5ммоль, 10еквів.) в атмосфері Аr, a Allocцієї сполуки вказаний в таблиці І). Phe-Z-Dhb-OH (666мг, 2ммоль, 4еквів.) і HOAt (273мг, 2ммоль, 4еквів.) розчиняли в DMF (1,25мл) і додавали до пептидил-полімерної смоли, потім додавали DIPCDI (310мкл, 2ммоль, 4еквів.), і суміш перемішували протягом 5 годин, коли нінгідриновий тест був негативним. Після промивання з використанням DMF і СН2Сl2 аліквоту пептидил-полімерної смоли обробляли сумішшю ТФО-Н 2О (1:99) протягом 1хв, і отриманий продукт охарактеризовували з використанням методу MALDI-TOF-MS, розраховуючи для С 88Н146N14 О21, 1736,18. Отримано: m/z 1758,67 [M+NA]+, 1774,62 1618,2 [М+К]+. (4S)-MeHex-D-Val-Thr(tBU)-Val-D-Val-D-ProOrn(Boc)-D-allo-Ile-D-allo-Thr(Val-Z-Dhb-Phe-H)-Dallo-Ile-D-Val-OH: 15 80992 16 1 H-ЯМР-спектроскопію [1Н, NOESY, TOCSY при (278К)] проводили на установці Varian Unity Plus (500МГц). Хімічні зсуви (d) виражені в частинах на мільйон у бік зменшення відносно тетраметилсилану (TMS). Константи зв'язування виражені в Герцах. Приклад 2: отримання (4R)-метилгексанового KF Експериментальні процедури проводилися, як в прикладі 1, починаючи з 1г полімерної смоли, з єдиним виключенням, що на відповідній стадії (4S)-MexHe x був замінений на (4R)-MexHex. Отриманий продукт (220мг, 0,15ммоль, 30%, 92,3% чистоти) був о характеризований за допомогою ES-MS, C75H124N14O 16 , 1477,9. Отримано: m/z 1499,07 [M+Na]+, 1514,94 [М+К]+. Приклад 3: Цитотоксична активність in vitro Метою даних досліджень є припинення росту культури пухлинних клітин "in vitro" шляхом безперервного контакту цих клітин із зразком, що тестується. Різновид колориметричного аналізу з використанням реакції сульфородаміну В (SRB) був адаптований для кількісного вимірювання росту клітин та їх життєздатності [відповідно до технології, описаної Philip Skehan, et al. (1990), New colorimetric cytotoxicity assay for anticancer drug screening, J. Natl. Cancer Inst., 82: 1107-1112]. У цьому способі аналізу використовують 96ямкові культуральні мікропланшети діаметром 9мм (Faircloth, 1988; Mosmann, 1983). Більшість клітинних ліній отримана з Американської Колекції Типових Культур (АТСС), утвореної з різних типів ракових клітин людини. Клітини підтримували в культуральному середовищі RPMI 1640, 10% PBS, збагаченому 0,1г/л пеніциліну і 0,1г/л стрептоміцинсульфату, а потім інкубували при 37°С в атмосфері 5% СО2 і 98% вологості. Для проведення експериментів клітини збирали з субконфлюентних культур за допомогою трипсину і перед посівом ресуспендували їх в свіжому середовищі. 17 80992 Клітини висівали в 96-ямкові культуральні мікропланшети, по 5´103 клітин на ямку, в аліквоти з 195мкл середовища, і залишали їх, даючи їм прикріпитися до поверхні планшета в умовах росту в культуральному середовищі, що не містить лікарського засобу, протягом 18 годин. Потім додавали зразки [випробовуваної сполуки] в аліквотах по 5мкл в кількостях, що варіюювали від 10 до 10-8мкг/мл, розчинених в DMSO/EtOH/PBS (0,5:0,5:99). Після 48-годинної експозиції протипухлинний ефект вимірювали, використовуючи метод SRB: клітини фіксували шляхом додавання 50мкл холодної 50% (вага/об'єм) трихлороцтової кислоти (ТХО) і інкубували протягом 60 хвилин при 4°С. Планшети промивали деіонізованою водою і сушили. Сто мікролітрів розчину SRB (0,4% вага/об'єм в 1% оцтовій кислоті) додавали в кожну ямку мікропланшета і інкубували протягом 10 хвилин при кімнатній температурі. Незв'язаний SRB видаляли шляхом промивання 1% оцтовою кислотою. Планшети сушили на повітрі, і зв'язаний барвник солюбілізували Трис-буфером. Оптичні густини зчитували на автоматичному спектрофотометричному пристрої для зчитування планшетів при одній довжині хвилі в 490нм. На основі даних, отриманих в трьох паралельній ямках, обчислювали величини середніх значень +/- SD. Були обчислені деякі параметри, що характеризують відповіді клітин: GI=інгібування росту, TGI=загальне інгібування росту (цитостатичний ефект) і LC=клітинна загибель (цитотоксичний ефект). Результати приведені в таблиці II, істотних відмінностей між наведеними сполуками не відмічається: 18 Приклад 4: токсичність in vitro З метою встановлення цитотоксичності вказаних лікарських засобів відносно нормальних клітин використовували 96-ямкові планшети, засіяні з щільністю по 5000 клітин на ямку клітинами нормальних клітинних ліній, встановлених відповідно до вказівок АТСС: AML12, нормальні клітини печінки миші, і NRK-52Е, нормальні клітини нирки щура. Після висівання клітин в кожному планшеті їх витримували протягом ночі перед додаванням лікарського засобу, що тестується. До кожної ямки (100мкл середовища) додавали 10мкл лікарського засобу в середовищі в різних концентраціях (в кінцевій концентрації 1´10-10-0,01мг/мл), а потім інкубували протягом ночі при 37°С в присутності 5% СО2. Всі експерименти повторювали щонайменше 3 рази, 19 80992 20 причому в кожному експерименті використовували методу Mann-Whitney) вдалося з'ясувати, що існує по дві паралельні проби. Через 24 години значна різниця в ефективності між двома здійснювали аналіз MTS (водний CellTiter 96), вказаними сполуками, що є досить несподіваним з відповідно до інструкцій виробника (PROMEGA) тієї точки зору, що ці сполуки мають дуже подібну (для всіх типів клітин). Життєздатність клітин структур у, а також в світлі результатів, наведених (мітохондріальну активність) визначали шляхом в попередніх прикладах. ферментативного перетворення формазанового На основі описаних тут досліджень субстрату. ефективності і проведених раніше експериментів Як видно з результатів, наведених в таблиці на токсичність (приклад 4) терапевтичний показник III, істотни х відмінностей між сполуками 5щонайменше 1,33 (1´МПД/0,75´МПД, доза, при метилгексанового KF і (4S)-метилгексанового KF якій лікарський засіб є токсичним/дозу, при якій не спостерігається. лікарський засіб є ефективним) може бути затверджений для сполуки (4S)-метилгексановий Таблиця III KF. Крім того, ще одним пов'язаним з цим біологічним результатом виявилось те, що Печінка ALM ІС 50 (мкМ) протипухлинний ефект (4S)-метилгексанового KF Нирка NRKІС50 (мкМ) 5-метилгексановий KF 3,4 відносно молочної залози був більш тривалим, ніж 2,7 (4S)-метилгексановий KF 5,4 відносно трансплантатів передміхурової залози 2,7 (приклад 7), при одній і тій самій відносній дозі МПД. Резюмуючи, можна стверджувати, що (4S)Приклад 5: МПД in vivo у миші CD-I і ν метилгексановий KF безперечно є більш потужним безтимусних тварин ізомером відносно трансплантатів молочної Максимально переносиму дозу визначали у залози, а тривалість його біологічної дії дає мишей CD-I і у безтимусних мишей (обох статей) підстави вважати, що він має більш тривалий для кожного лікарського засобу після однократного вплив на пухлини такого типу. введення болюсу і після 5 щоденних введень дози. Результати наведені в таблиці IV, де істотних відмінностей між сполуками 5-метилгексанового KF і (4S)-метилгексанового KF не спостерігається. Доза (мкг/кг) Контроль Таблиця IV 5-метилгексановий KF 245 5-метилгексановий KF (4S)-метилгексановий KF (4S)-метилгексановий KF 245 Самці мишей CD-I Болюс МПД 300 300 Самиці мишей CD-I Болюс МПД 200 Приклад 7: ефективність in vivo при 200 Самці мишей CD-I 5DD МПД ксенотрансплантації передміхурової залози (5DD) 175-350 175-350 Ефективність однакової 175-350 дози кожного з 5Самиці мишей CD-I 5DD МПД 175-350 метилгексанового KF і (4S)-метилгексанового KF Самці безтимусних мишей Болюс МПД 350 350 вивчали у безтимусних самців мишей, яким після Самиці безтимусних мишей Болюс МПД 325 325 ксенотрансплантації передміхурової залози Самці безтимусних мишей 5DD МПД 350 350 внутрішньовенно (в/в) вводили протягом п'яти днів Самиці безтимусних мишей 5DD МПД 325 325 підряд (тобто в режимі QD´5) болюсні ін'єкції (дні 0-4). Сполуки застосовували у вигляді Приклад 6: ефективність in vivo при свіжоприготовлених запаяних в ампули розчинів в ксенотрансплантації молочної залози (5DD) складі з носієм [кремофор-ЕL/етанол/вода Ефективність 5-метилгексанового KF і (4S)(5:5:90)]. Кожну добову дозу (в режимі QD´5) метилгексанового KF, кожен з яких вводили в вводили внутрішньовенно в об'ємі 0,2мл розчину кількості трьох чвертей від максимально для ін'єкцій на 20 грамів ваги тварини. переносимей дози (МПД), вивчали у безтимусних Оцінка власне розміру пухлини в групах, самиць мишей, яким після ксенотрансплантації оброблених відповідним чином, відносно молочної залози внутрішньовенно (в/в) вводили контрольної групи, якій вводили носій (тобто % протягом п'яти днів підряд (тобто в режимі QD ´5) DΤ/DС), показала, що найнижче (оптимальне) болюсні ін'єкції (дні 0-4). Сполуки застосовували у значення досягалося на день 3 після початку вигляді свіжоприготовлених запаяних в ампули введення лікарського засобу у всіх групах. Крім розчинів в складі з носієм [кремофортого, за допомогою попарного статистичного EL/етанол/вода (5:5:90)]. Кожну добову дозу (в аналізу (з використанням непараметричного режимі QD´5) вводили внутрішньовенно в об'ємі методу Mann-Whitney) вдалося з'ясувати, що 0,2мл розчину для ін'єкцій на 20 грамів ваги істотно більша ефективність досягалася з тварини. допомогою (4S)-метилгексанового KF в дозі Оцінка власне розміру пухлини в групах, 262мкг/кг/день. На основі описаних тут досліджень оброблених відповідним чином, відносно ефективності і проведених раніше експериментів контрольної групи, якій вводили носій (тобто % на токсичність (приклад 4) терапевтичний показник DΤ/DC), показала, що найнижче (оптимальне) щонайменше 1,33 (1´МПД/0,75´МПД, доза, при значення досягалось на день 3 після початку якій лікарський засіб є токсичним/дозу, при якій введення лікарського засобу у всіх групах. Крім лікарський засіб є ефективним) може бути того, за допомогою попарного статистичного аналізу (з використанням непараметричного Власне розмі 21 80992 затверджений для сполуки (4S)-метилгексановий KF. Результати наведені нижче в таблиці VI. 22 Таблиця VI Контроль 5-метилгексановий KF (4S)-метилгексановий KF Доза (мкг/кг) 262 262 Власне розмір пухлини, мм 3, n=10 236 126 62 % DΤ/DС 100 53 26 Приклад 8: протипухлинна активність аналогів кахалаліду F, що досліджується на порожнистих волокнах з використанням панелі ліній пухлинних клітин людини Протипухлинна активність аналогів кахалаліду F, що обговорювалась вище, була перевірена на системі порожнистих волокон (HF) за допомогою панелі ліній пухлинних клітин людини, а саме клітин SK-Нер-1 (гепатоми), HepG2 (гепатоклітинної карциноми), Рапс-1 (підшлункової залози) і МеI-28 (меланоми). Пухлинні клітини людини були інкапсульовані в порожнисті волокна in vitro, a потім імплантовані безтимусним мишамсамицям in vivo. Дози 5-метилгексанового KF і (4S)метилгексанового KF підбирали на основі попередніх МПД-експериментів, проведених на безтимусних мишах, внаслідок яких було вибране дозування 325мкг/кг/день (див. приклад 5). П'ять днів підряд дозу вводили внутрішньоочеревинно (в/о) в об'ємі 0,2мл розчину для ін'єкцій на 20 грамів ваги тварини. Загалом сполука KF-4(S)-Met проявляє статистично значущу протипухлинну активність проти клітин гепатоми (підшкірно, п/ш), гепатоклітинної карциноми (як підшкірно, так і внутріпшьочеревинно), підшлункової залози (внутрішньочеревинно) і виявляє тенденцію у бік значущості е фекту (тобто Р=0,059) при підшкірному введенні при пухлині підшлункової залози і меланомі. На відміну від цієї сполуки, KF5-Met активний відносно меншої кількості типів пухлин, а саме тільки відносно пухлин підшлункової залози (як підшкірно, так і внутрішньочеревинно) і меланоми (підшкірно), але не відносно всіх типів раку печінки, які були протестовані. Нижче в таблиці наведені сумарні результати, які ясно показують відмінності між цими сполуками. Лікарський засіб Носій KF-4(S)-Met KF-5-Met Тип пухлини/НР-локалізація (довільна кількість клітин/HF) SK-Hep-1 HepG2 Раnс-1 Me1-28 в/о п/ш в/о п/шо в/о п/ш в/о п/ш 0,575 0,872 0,576 0,509 0,200 0,392 2,078 1,77 0,485 0,525* 0,335* 0,319* 0,129* 0,237§ 1,906 1,51 0,693 0,686 0,475 0,361 0,149* 0,192* 1,771 1,56 *Статистично знануще, Р
ДивитисяДодаткова інформація
Назва патенту англійськоюKahalaide antitumoral compound, use thereof and process for the preparation
Автори англійськоюFaircloth Glynn Thomas, Elices Mariano, Sasak Halina, Aviles Marin Pablo Manuel
Назва патенту російськоюПротивоопухолевое соединение кахалалида, его применение и способ получения
Автори російськоюФерклот Глинн Томас, Элисес Марьяно, Сасак Халина, Авилес Марин Пабло Мануэль
МПК / Мітки
МПК: C07K 14/435, C07K 7/08, A61P 35/00
Мітки: кахалаліду, сполука, протипухлинна, спосіб, одержання, застосування
Код посилання
<a href="https://ua.patents.su/11-80992-protipukhlinna-spoluka-kakhalalidu-zastosuvannya-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Протипухлинна сполука кахалаліду, її застосування та спосіб одержання</a>
Попередній патент: Твердий препарат, що містить інсуліновий сенсибілізатор та активний агент, корисний при лікуванні діабету
Наступний патент: Спосіб виробництва діоксиду титану та гідратовані оксиди титану
Випадковий патент: Спосіб діагностики алергії до тарганів












