Тієнопіримідиндіони і їх використання у модуляції аутоімунних хвороб
Формула / Реферат
1. Сполука формули (І):

в якій
R1 і R2 кожна незалежно репрезентує С1-6алкіл, С3-6алкеніл, С3-5циклоалкілС1-3алкіл або С3-6циклоалкіл, кожен з яких може бути, як варіант, заміщений 1-3 атомами галогену;
Q є CR4R5, де R4 - гідроген, флуор або С1-6алкіл, a R5 - гідроген, флуор або гідрокси;
Аr є 5-10-членною ароматичною кільцевою системою, в якій до 4 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфуру, причому ця кільцева система, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С1-4алкілу (як варіант, заміщеного 1, 2 або 3 гідроксигрупами), С1-4алкокси, галогену, галогеналкілу, дигалогеналкілу або тригалогеналкілу (де алкільні групи, відповідно, містять 1-4 атомів карбону), С1-4алкоксіС1-4алкілу, С1-4алкілтіо, С1-4алкоксикарбонілу, С2-4алканоїлу, оксогрупи, тіоксогрупи, нітрогрупи, ціаногрупи, -N(R6)R7 і -(CH2)-N(R6)R7, гідрокси, С1-4алкілсульфонілу, С1-4алкілсульфінілу, карбамоїлу, С1-4алкілкарбамоїлу, ді-(С1-4алкіл)карбамоїлу, карбокси, SO2N(R8)R9;
Аr2 є 5- або 6-членним ароматичним кільцем, що містить до 4 гетероатомів, незалежно вибраних з нітрогену, сульфуру або оксигену, які можуть бути, як варіант, заміщені однією або більше групами, незалежно вибраними з С1-4алкілу (як варіант, заміщеного 1, 2 або 3 гідроксигрупами), С1-4алкокси, галогену, галогеналкілу, дигалогеналкілу або тригалогеналкілу (де алкільні групи, відповідно, містять 1 - 4 атоми карбону), С1-4алкоксі-С1-4алкілу, С1-4алкілтіо, С1-4алкоксикарбонілу, С2-4алканоїлу, оксогрупи, тіоксогрупи, нітрогрупи, ціаногрупи, -N(R6)R7 і -(CH2)-N(R6)R7, гідрокси, С1-4алкілсульфонілу, С1-4алкілсульфінілу, карбамоїлу, С1-4алкілкарбамоїлу, ді-(С1-4алкіл)карбамоїлу, карбокси, SO2N(R8)R9;
р дорівнює від 1 до 4;
R6 і R7 кожна незалежно репрезентує атом гідрогену, С1-4алканоїльну або С1-4алкільну групу, або разом з атомом нітрогену, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, яке, як варіант, містить додатково О, S, NH або N-алкільну групу;
R8 і R9 кожна незалежно репрезентує атом гідрогену, С1-4алканоїльну або С1-4алкільну групу, або разом з атомом нітрогену, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, яке, як варіант, містить додатково О, S, NH або N-алкільну групу;
і її фармацевтично прийнятні солі і сольвати за умови, що сполука не є 5-{(4S)-4-гідроксіізоксазолідин-2-ілкарбоніл}-1-(ізобутил)-3-метил-6-[5-метил-3-феніл-1Н-піразол-4-ілметил]тієно[2,3-d]піримідин-2,4(1Н,3Н)-діоном, 6-[3,5-диметил-1-феніл-1Н-піразол-4-ілметил]-5-[(4S)-4-гідроксіізоксазолідин-2-ілкарбоніл]-1-ізобутил-3-метилтієно[2,3-d]-піримідин-2,4(1Н,3Н)-діоном або 6-[3,5-диметил-1-феніл-1Н-піразол-4-ілметил]-5-[(4S)-4-гідроксіізоксазолідин-2-ілкарбоніл]-3-метил-1-пропілтієно[2,3-d]піримідин-2,4(1Н,3Н)-діоном або їх фармацевтично прийнятними сіллю або сольватом.
2. Сполука за п. 1, яка відрізняється тим, що у ній R1 є С1-6алкілом.
3. Сполука за п. 1 або п. 2, яка відрізняється тим, що у ній R2 є метилом.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що у ній Q є СН2.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що у ній Аr є 5- або 6-членною ароматичною кільцевою системою, в якій до 2 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфуру, причому ця кільцева система, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С1-4алкілу, С1-4алкокси, галогену, дигалогеналкілу, тригалогеналкілу, оксогрупи, тіоксогрупи, ціаногрупи і С1-4алкілсульфонілу.
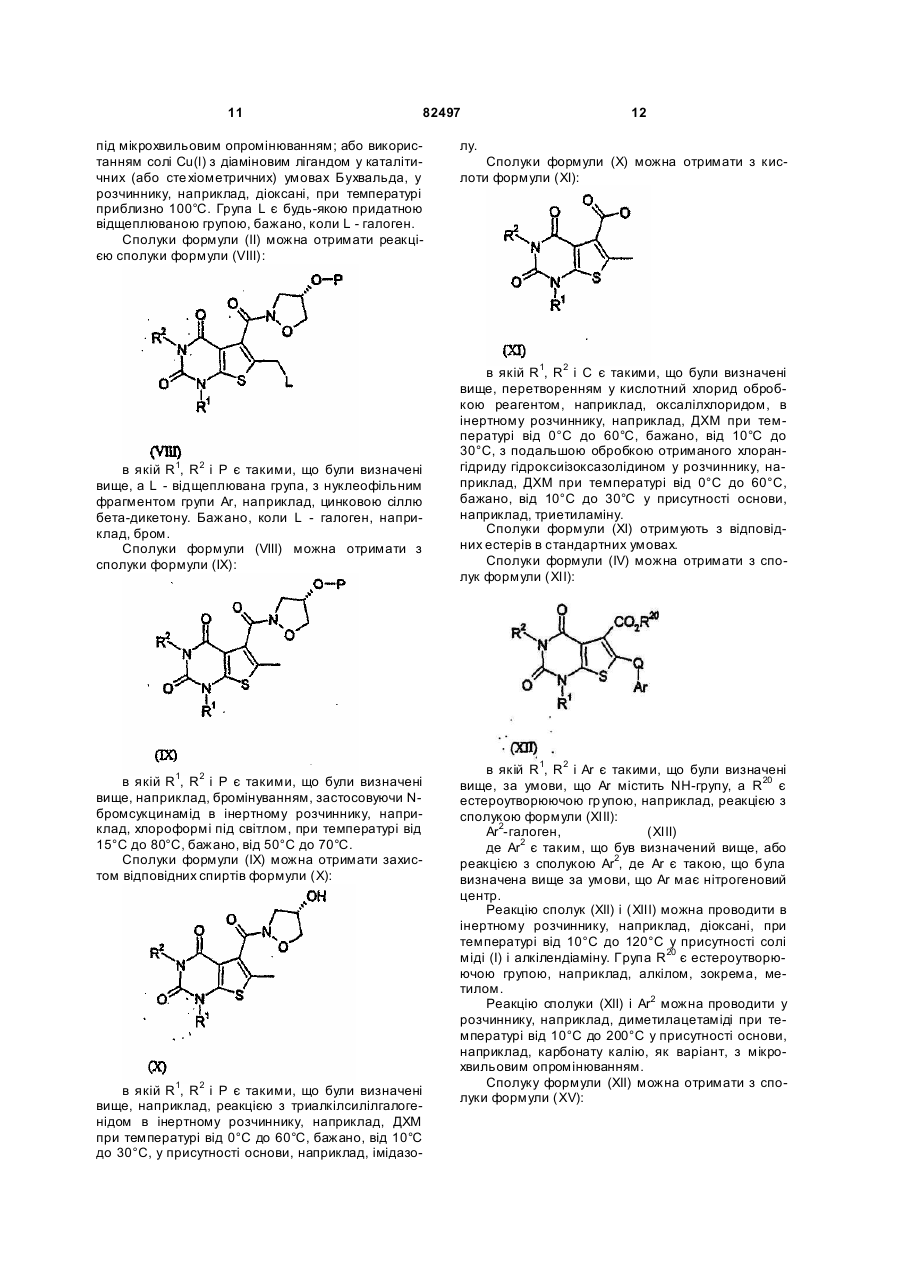
6. Сполука за п. 5, яка відрізняється тим, що у ній Аr є групою субформули (і)
де R10 і R11 незалежно вибрані з Н, С1-6алкілу або галогенС1-6алкілу, а Аr2 є такою, що була визначена вище.
7. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що у ній Аr2 не є фенілом.
8. Сполука за п. 7, яка відрізняється тим, що у ній Аr2 має щонайменше один гетероатом.
9. Сполука за будь-яким з пп. 1-6, яка відрізняється тим, що у ній Аr2 є 5- або 6-членною ароматичною кільцевою системою, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, сульфуру або оксигену, причому ця кільцева система, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С1-4алкілу, С1-4алкокси, галогену, дигалогеналкілу, тригалогеналкілу, оксогрупи, тіоксогрупи, ціаногрупи і С1-4алкілсульфонілу.
10. Сполука за п. 9, яка відрізняється тим, що у ній Аr2 є піридинілом або піримідинілом.
11. Сполука за п. 9, яка відрізняється тим, що у ній Аr2 є тіазолілом.
12. Сполука формули (І), яка відрізняється тим, що вибрана з групи, яку складають:
6-[[3,5-диметил-1-(2-піримідиніл)-1Н-піразол-4-іл]метил]-5-[[(4S)-4-гідрокси-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)тієно[2,3-d]-піримідин-2,4-(1Н,3Н)-діон та
6-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4-іл]метил]-5-[[(4S)-4-гідрокси-2-ізоксазолідиніл]карбоніл]-3-метил-1-(1-метилетил)тієно[2,3-d]-піримідин-2,4-(1Н,3Н)-діон,
(S)-2-[[6-[3,5-диметил-1-(2-тіазоліл)-1Н-піразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(1-метилетил)-2,4-діоксотієно[2,3-d]-піримідин-5-іл]карбоніл]-4-ізоксазолідинол та їх фармацевтично прийнятні солі.
13. Сполука за будь-яким з пп. 1-12, призначена для використання у терапії.
14. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль, визначені у будь-якому з пп. 1-12, разом з фармацевтичним носієм.
15. Спосіб створення імуносупресії, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-12.
16. Спосіб лікування, або зниження ризику хвороб дихальних шляхів у пацієнтів, що страждають від цих хвороб або мають підвищений ризик захворювання цими хворобами, який включає введення цьому пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-12.
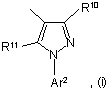
17. Спосіб одержання сполуки формули (І) за п. 1, у якому здійснюють взаємодію сполуки формули (II):
в якій R1 і R2 є такими, що були визначені у формулі (І), або є їх захищеними похідними, а X і Y вибрані з С1-4алкілу (як варіант, заміщеного 1, 2 або 3 гідроксигрупами), С1-4алкокси, галогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксіС1-4алкілу, С1-4алкоксикарбонілу, -(CH2)pN(R8)R9,
зі сполукою формули (ІІІ):
Ar2-G1-G2, (III)
в якій Аr2 є такою, що була визначена у формулі (І), або є її захищеною похідною, a G1 є NH і G2 є NH2, SH або ОН,
і, як варіант, після взаємодії, у будь-якому порядку здійснюють:
- видалення захисних груп,
- утворення фармацевтично прийнятної солі.
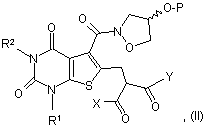
18. Спосіб одержання сполуки формули (І) за п.1, у якому здійснюють
взаємодію сполуки формули (IV):
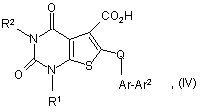
в якій R1, R2, Аr і Аr2 є такими, що були визначені у формулі (І), або є їх захищеними похідними,
зі сполукою формули (V)
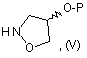
в якій Р - захисна група,
і, як варіант, після взаємодії, у будь-якому порядку здійснюють:
- видалення захисних груп,
- утворення фармацевтично прийнятної солі.
19. Спосіб одержання сполуки формули (І) за п.1, у якому:
для сполуки формули (І), де Аr має NH-групу, здійснюють реакцію сполуки формули (VI):
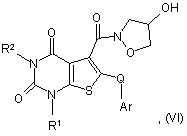
в якій R1 і R2 є такими, що були визначені у формулі (І), а Аr є такою, що була визначена у формулі (І), за умови, що Аr містить NH-групу, або є її захищеною похідною,
зі сполукою формули (VII):
Ar2-L, (VII)
в якій Аr2 є такою, що була визначена у формулі (І), або є її захищеною похідною, a L євідщеплюваною групою,
і, як варіант, після взаємодії, у будь-якому порядку здійснюють:
- видалення захисних груп,
- утворення фармацевтично прийнятної солі.
Текст
1. Сполука формули (І): OH O O N R2 O N Q S N O , (I) Ar-Ar2 2 (19) 1 3 82497 R1 є С1-6алкілом. 3. Сполука за п. 1 або п. 2, яка відрізняється тим, що у ній R2 є метилом. 4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що у ній Q є СН 2. 5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що у ній Аr є 5- або 6-членною ароматичною кільцевою системою, в якій до 2 кільцевих атомів можуть бути ге тероатомами, незалежно вибраними з нітрогену, оксигену і сульфур у, причому ця кільцева система, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С 1-4алкілу, С1-4алкокси, галогену, дигалогеналкілу, тригалогеналкілу, оксогрупи, тіоксогрупи, ціаногрупи і С1-4алкілсульфонілу. 6. Сполука за п. 5, яка відрізняється тим, що у ній Аr є гр упою субформули (і) R10 R11 N N , (i) Ar2 де R10 і R11 незалежно вибрані з Н, С1-6алкілу або галогенС 1-6алкілу, а Аr2 є такою, що була визначена вище. 7. Сполука за будь-яким з попередніх пунктів, яка відрізняє ться тим, що у ній Аr2 не є фенілом. 8. Сполука за п. 7, яка відрізняється тим, що у ній Аr2 має щонайменше один гетероатом. 9. Сполука за будь-яким з пп. 1-6, яка відрізняється тим, що у ній Аr2 є 5- або 6-членною ароматичною кільцевою системою, в якій до 3 кільцевих атомів можуть бути ге тероатомами, незалежно вибраними з нітрогену, сульфур у або оксигену, причому ця кільцева система, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С 1-4алкілу, С1-4алкокси, галогену, дигалогеналкілу, тригалогеналкілу, оксогрупи, тіоксогрупи, ціаногрупи і С1-4алкілсульфонілу. 10. Сполука за п. 9, яка відрізняється тим, що у ній Аr2 є піридинілом або піримідинілом. 11. Сполука за п. 9, яка відрізняється тим, що у ній Аr2 є тіазолілом. 12. Сполука формули (І), яка відрізняє ться тим, що вибрана з групи, яку складають: 6-[[3,5-диметил-1-(2-піримідиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]-піримідин-2,4-(1Н,3Н)-діон та 6-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-2ізоксазолідиніл]карбоніл]-3-метил-1-(1 4 метилетил)тієно[2,3-d]-піримідин-2,4-(1Н,3Н)-діон, (S)-2-[[6-[3,5-диметил-1-(2-тіазоліл)-1Н-піразол-4іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]-піримідин-5іл]карбоніл]-4-ізоксазолідинол та їх фармацевтично прийнятні солі. 13. Сполука за будь-яким з пп. 1-12, призначена для використання у терапії. 14. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль, визначені у будь-якому з пп. 1-12, разом з фармацевтичним носієм. 15. Спосіб створення імуносупресії, який включає введення пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 112. 16. Спосіб лікування, або зниження ризику хвороб дихальних шляхів у пацієнтів, що страждають від цих хвороб або мають підвищений ризик захворювання цими хворобами, який включає введення цьому пацієнту терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, визначених у будь-якому з пп. 1-12. 17. Спосіб одержання сполуки формули (І) за п. 1, у якому здійснюють взаємодію сполуки формули (II): O-P O O N R2 O N Y S N O X O , (II) O R1 1 2 в якій R і R є такими, що були визначені у формулі (І), або є їх захищеними похідними, а X і Y вибрані з С1-4алкілу (як варіант, заміщеного 1, 2 або 3 гідроксигрупами), С1-4алкокси, галогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксіС 18 9 4алкілу, С 1-4алкоксикарбонілу, -(CH 2)pN(R )R , зі сполукою формули (ІІІ): Ar2-G1-G2, (III) в якій Аr2 є такою, що була визначена у формулі (І), або є її захищеною похідною, a G1 є NH і G2 є NH2, SH або ОН, і, як варіант, після взаємодії, у будь-якому порядку здійснюють: - видалення захисних гр уп, - утворення фармацевтично прийнятної солі. 18. Спосіб одержання сполуки формули (І) за п.1, у якому здійснюють взаємодію сполуки формули (IV): 5 O 82497 CO2 H R2 O N S N R2 Q Ar-Ar2 OH O N O 6 O N , (IV) R1 в якій R1, R2, Аr і Аr2 є такими, що були визначені у формулі (І), або є їх захи щеними похідними, зі сполукою формули (V) O-P HN , (V) O в якій Р - захисна група, і, як варіант, після взаємодії, у будь-якому порядку здійснюють: - видалення захисних гр уп, - утворення фармацевтично прийнятної солі. 19. Спосіб одержання сполуки формули (І) за п.1, у якому: для сполуки формули (І), де Аr має NH-групу, здійснюють реакцію сполуки формули (VI): Винахід стосується тієнопіримідиндионів, процесів їх приготування, фармацевтичних композицій, що містять їх, і їх використання у терапії. Винахід також стосується їх використання у модуляції автоімунної хвороби. Т-клітини грають важливу роль в імунній реакції, однак при автоімунних хворобах Т-клітини невідповідним чином активуються проти певних тканин і проліферації, викликаючи, наприклад, запалення, пов'язане з ревматоїдним артритом. Інгібування проліферації Т-клітин є сприятливим у модуляції автоімунної хвороби. Винахід стосується сполук, які є корисними у модуляції автоімунної хвороби. Винахід стосується сполуки формули (1): Де: R1 і R2 кожна незалежно репрезентує С 1-6алкіл, С3-6алкеніл, С3-6циклоалкілС 1-3алкіл або С36циклоалкіл, кожен з яких може бути, як варіант, заміщений 1-3 атомами галогену; Q є CR4R5, де R4 - гідроген, флуор або С 15 6алкіл, a R - гідроген, флуор або гідрокси; Аr є 5-10-членною ароматичною кільцевою системою, в якій до 4 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, оксигену і суль фуру, причому ця кільцева система як варіант, заміщена одним або більше замісника O S N Q Ar , (VI) R в якій R1 і R2 є такими, що були визначені у формулі (І), а Аr є такою, що була визначена у формулі (І), за умови, що Аr містить NH-групу, або є її захищеною похідною, зі сполукою формули (VII): Ar2-L, (VII) в якій Аr2 є такою, що була визначена у формулі (І), або є її захищеною похідною, a L є відщеплюваною групою, і, як варіант, після взаємодії, у будь-якому порядку здійснюють: - видалення захисних гр уп, - утворення фармацевтично прийнятної солі. 1 ми, незалежно вибраними з С1-4алкілу (як варіант, заміщеного 1, 2 або 3-ма гідроксигрупами), С14алкокси, галогену, галогеналкілу, дигалогеналкілу або тригалогеналкілу (де алкільні групи відповідно містять 1-4 атомів карбону), С1-4алкоксиС 1-4алкілу, С1-4алкілтіо, С1-4алкокси-карбонілу, С2-4алканоїлу, оксогрупи, тіоксогрупи, нітрогрупи, ціаногрупи, N(R6)R7 і -(CH2)pN(R8)R9, гідрокси, С14алкілсульфонілу, С 1-4алкілсульфінілу, карбамоїлу, С1-4алкіл-карбамоїлу, ди-(С1-4алкіл)карбамоїлу, карбокси, SO2N(R8)R9; Аr2 є 5- або 6-членним ароматичним кільцем, що містить до 4 гетероатомів, незалежно вибраних з нітрогену, сульфур у або оксигену, які можуть бути як варіант, заміщені однією або більше групами, незалежно вибраними з С1-4алкілу (як варіант, заміщеного 1, 2 або 3-ма гідроксигрупами), С1галогену, галогеналкілу, дигало4алкокси, геналкілу або тригалогеналкілу (де алкільні групи, відповідно, містять 1-4 атоми карбону), С1С1-4алкілтіо, С14алкокси-С 1-4алкілу, 4алкоксикарбонілу, С 2-4aлканоїлу, оксогрупи, тіоксогрупи, нітрогрупи, ціаногрупи, -N(R6)R7 і (CH2)pN(R8)R9, гідрокси, С1-4алкілсульфонілу, С14алкілсульфінілу, карбамоїлу, С 1-4алкілкарбамоїлу, ди-(С1-4алкіл)карбамоїлу, карбокси, SO2N(R8)R9; р дорівнює від 1 до 4; R6 і R7 кожна незалежно репрезентує атом гідрогену, С1-4алканоїльну або С1-4алкільну гр упу, або разом з атомом нітрогену, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне кільце, яке як варіант, містить додатково О, S, NH або N-алкільну груп у; R8 і R9 кожна незалежно репрезентує атом гідрогену, С1-4алканоїльну або С1-4алкільну гр упу, або разом з атомом нітрогену, до якого вони приєднані, утворюють 5-7-членне насичене гетероциклічне 7 82497 кільце, яке як варіант, містить додатково О, S, NH або N-алкільну груп у; і її фармацевтично прийнятних солей і сольватів за умови, що сполука не є 5-{(4S)-4гідроксиізоксазолідин-2-ілкарбоніл]-1-(ізобутил)-3метил-6-[5-метил-3-феніл-1Н-піразол-4ілметил]тієно[2,3-d]піримідин-2,4(1 Н,ЗН)-діоном, 6-[3,5-диметил-1феніл-1Н-піразол-4-ілметил]-5-[(43)-4гідроксиізоксазолідин-2-ілкарбоніл]-1-ізобутил-3метилтієно[2,3-d]-піримідин-2,4(1Н,3Н)-діоном або 6-[3,5-диметил-1-феніл-1Н-піразол-4-ілметил]-5[(4S)-4-гідроксиізоксазолідин-2-ілкарбоніл]-3метил-1-пропілтієно[2,3-d]піримідин-2,4(1Н,3Н)діоном або їх фармацевтично прийнятною сіллю або сольватом. R1 - С1-6алкіл або С3-6циклоалкіл, зокрема, С11 6алкіл. Бажано, коли R - етил, пропіл, бутил або циклопропіл. Більш бажано, коли R1 - етил, ізобутил, ізопропіл або циклопропіл. Найкраще, коли R1 - С1-6алкіл, наприклад, ізобутил або ізопропіл. Бажано, коли R2 - С1-6алкіл, наприклад, етил або метил, більше бажано, метил. Q - CR5R6, де R5 - гідроген, С1-6алкіл, a R6 - гідроген. Бажано, коли Q - CR4R5, де R4 і R5 обидві є гідрогеном. Прикладами 5-10-членних моно- або біциклічних ароматичних кільцевих систем для Аr є тієніл, фураніл, піроліл, піролопіридин, імідазоліл, піридил, піразиніл, піримідил, піридазиніл, триазиніл, оксазоліл, тіазоліл, ізоксазоліл, піразоліл, оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл і хінолініл. Приклади 5-7-членних насичених гетероциклічних кілець, утворених R6 і R7 і R8 і R9, включають морфолін, піперидин, N-алкілпіперидин, піперазин, піролідин тощо. Бажано, коли Аr є 5- або 6членною ароматичною кільцевою системою, в якій до 2 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфур у, причому кільцева система, як варіант, заміщена одним або більше замісниками, незалежно вибраними з С1-4алкілу, С1-4алкокси, галогену, галогенС 1-4алкілу, дигалогенС 1-4алкіл4, тригалогенС1-4алкіл4, оксогрупи, тіоксогрупи, ціаногрупи або С1-4алкілсульфонілу. Більш бажано, коли Аr є 5-членним ароматичним кільцем з двома атомами нітрогену, заміщеним як зазначено вище. Конкретним прикладом Аr є, як варіант, заміщене піразольне кільце. Бажано, коли Аr є заміщеним піразольним кільцем. Найкраще, коли Аr є піразольним кільцем, дизаміщеним С1-4алкілом, зокрема, метилом. Наприклад, Аr є відповідною групою субформули (і) де R10 і R11 незалежно вибрані з Н, С1-6алкілу, галогенС 1-4алкілу, дигалогенС 1-4алкілу або трига 8 логенС1-4алкілу, а Аr є такою, що була визначена вище є такою. R10 і R11 вибрані з Н або С1-3алкілу, наприклад, метилу. Зокрема обидві R10, R11 є С 1-3алкілом, наприклад, метилом. Аr2 є 5- або 6-членною ароматичною кільцевою системою, в якій до 3 кільцевих атомів можуть бути гетероатомами, незалежно вибраними з нітрогену, оксигену і сульфур у, причому кільцева система як варіант, заміщена одним або більше замісниками, незалежно вибраними з С 1-4алкілу, С1-4алкокси, галогену, дигалогеналкілу, тригалогеналкілу, оксогрупи, тіоксогрупи, ціаногрупи, С14алкілсульфонілу. Бажано, коли Аr2 не є фенілом. Зокрема, Аr2 включає щонайменше один гетероатом. Прикладами галогеналкільної групи є галогенС1-4алкільні групи, які включають галогенметильні групи, наприклад, флуоретильні групи. Прикладами дигалогеналкільної групи є дигалогенС 14алкільні групи, включаючи дифлуорметил і дихлорметил. Прикладами тригалогеналкільної групи є тригалогенС 1-4алкільні групи, наприклад, трифлуорметил. У бажаному втіленні, Аr2 є 5-членним ароматичним кільцем, що містить атоми нітрогену і сульфур у і заміщене, як зазначено вище. Більш бажано, коли Аr2 є тіазольним кільцем, заміщеним галогеном, зокрема, флуором. У іншому втіленні винаходу, Аr2 є піридином або піримідином. Кільця несуть щонайменше одного замісника, але є переважно незаміщеними. Бажано, коли Аr2 є піридинілом або піримідинілом. Бажані сполуки формули (І) включають: 6-[[3,5-диметил-1-(2-піримідиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон і 6-[[3,5-диметил-1-(2-пірідиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-2ізоксазолідиніл]карбоніл]-3-метил-1-(3метилетил)тієно[2,3-d]піримідин-2,4(1Н,3В)-діон, і їх фармацевтично прийнятні солі. Іншою бажаною сполукою формули (І) є (S)-2[[6-(f3,5-диметил-1-(2-тіазоліл)-1Н-піразол-4іл]метил]-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]-піримідин-5іл]карбоніл]-4-ізоксазолідинол і його фармацевтично прийнятні солі. Алкільні групи, одиночні або як частина іншої групи, можуть бути лінійними або розгалуженими. Якщо не вказано інше, вони можуть містити 1-6, бажано, 1-4 атоми карбону. Зрозуміло, що сполуки формули (І) або їх солі можуть виявляти таутомерію; креслення у цьому описі репрезентують лише одну з можливих таутомерних форм. Однак, винахід включає будь-яку таутомерну форму. Деякі сполуки формули (1) можуть існувати у стереоізомерних формах. Винахід включає всі геометричні і оптичні ізомери сполук формули (1) і їх суміші, включаючи рацемати. Вони також утворюють аспект винаходу. Солями, придатними для використання у фа 9 82497 рмацевтичній композиції, можуть бути фармацевтично прийнятні солі, але і інші солі можуть бути корисними у виготовленні сполук формули І і їх фармацевтично прийнятних солей. Фармацевтично прийнятні солі винаходу можуть, наприклад, включати кислотоадитивні солі сполук формули І, достатньо основні для утворення таких солей. Такі кислотоадитивні солі включають, наприклад, солі з неорганічними або органічними кислотами, які дають фармацевтично прийнятні аніони, наприклад, з гідрогалогеновими (зокрема, гідрохлоридною або гідробромідною кислотою, бажано, гідрохлоридною) або з сульфатними або фосфатними кислотами, або з трифлуороцтовою, лимонною або малеїновою кислотами. Придатні солі включають гідрохлориди, гідроброміди, фосфа ти, сульфати, гідросульфати, алкілсульфонати, арилсульфонати, ацетати, бензоати, цитрати, малеати, фумарати, сукцинати, лактати і тартрати. Крім того, коли сполуки формули І є достатньо кислотними, фармацевтично прийнятні солі можуть бути утворені з неорганічними або органічними основами, які дають фармацевтично прийнятний катіон. Такі солі з неорганічними або органічними основами включають, наприклад, солі лужних металів, наприклад, сіль натрію або калію, солі лужно-земельних металів, наприклад, кальцію або магнію сіль, амонієві солі або, наприклад, сіль з метиламіном, диметиламіном, триметиламіном, піперидином, морфоліном або трис-(2-гідроксиетил)аміном. Бажані солі включають кислотоадитивні солі, наприклад, гідрохлорид, гідробромід, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат або р-толуолсульфонат, або солі лужних металів, наприклад, натрію або калію. Згідно з подальшим аспектом, винахід включає спосіб приготування сполуки формули (І), який включає: (a) реакцію сполуки формули (II): в якій R1 і R2 є такими, що були визначені у формулі (І) або є їх захищеними похідними, а X і Y вибрані з С1-4алкілу (як варіант, заміщеного 1, 2 або 3 гідроксигрупами), C1-4алкокси, галогеналкілу, дигалогеналкілу, тригалогеналкілу, С1-4алкоксиС 18 9 4алкілу, С 1-4алкокси-карбонілу, -(CH 2)pN(R )R , з сполукою формули (III): Ar2-G1-G2 (III) де Аr2 є такою, що була визначена у формулі (І), або є її захищеною похідною, a G1 є NH, G2 NH2, SH або ОН, або (b) реакцію сполуки формули (IV): 10 в якій R1, R2, Аr і Аr2 є такими, що були визначені у формулі (І), або є їх захи щеними похідними, з сполукою формули (V) в якій P - захисна група, або (с) для сполуки формули (І), де Аr має NHгруп у, реакцію сполуки формули (VI): в якій R1 і R2 є такими, що були визначені у формулі (І), а Аr є такою, що була визначена у формулі (І) за умови, що Аr має NH-групу, або є її захищеною похідною, з сполукою формули (VII): Аг 2 - L (VII) в якій Аr2 є такою, що була визначена у формулі (І), або є її захи щеною похідною, a L є відщеплюваною групою, і як варіант, після виконання операції (а), (b) або (с) у будь-якому порядку: - видалення захисних гр уп - утворення фармацевтично прийнятної солі. Реакцію сполуки (II) і (III) бажано проводити в інертному розчиннику, наприклад, етанолі, при температурі від 0°С до 100°С, бажано, від 10°С до 50°С, як варіант, у присутності каталітичної кількості кислоти, наприклад, трифлуороцтової. Реакцію сполук (IV) і (V) проводять перетворенням карбонокислотної функції в активовану форму реакцією з сполучаючим агентом, наприклад, EDCI і 1-гідроксибензо-триазолом, в інертному розчиннику, наприклад, ДХМ, у присутності основи, бажано, триетиламіну або етилдіізопропіламіну, при температурі від 0°С до 100°С, бажано, від 10°С до 50°С, у присутності сполуки (V). Реакцію сполук (VI) і (VII) проводять нагріванням в інертному розчиннику, наприклад, NMP у присутності основи, наприклад, карбонату металу 11 82497 під мікрохвильовим опромінюванням; або використанням солі Cu(l) з діаміновим лігандом у каталітичних (або сте хіометричних) умовах Бухвальда, у розчиннику, наприклад, діоксані, при температурі приблизно 100°С. Група L є будь-якою придатною відщеплюваною групою, бажано, коли L - галоген. Сполуки формули (II) можна отримати реакцією сполуки формули (VIII): в якій R1, R2 і Р є такими, що були визначені вище, a L - відщеплювана група, з нуклеофільним фрагментом групи Аr, наприклад, цинковою сіллю бета-дикетону. Бажано, коли L - галоген, наприклад, бром. Сполуки формули (VIII) можна отримати з сполуки формули (IX): 1 2 в якій R , R і Р є такими, що були визначені вище, наприклад, бромінуванням, застосовуючи Nбромсукцинамід в інертному розчиннику, наприклад, хлороформі під світлом, при температурі від 15°С до 80°С, бажано, від 50°С до 70°С. Сполуки формули (IX) можна отримати захистом відповідних спиртів формули (X): в якій R1, R2 і Р є такими, що були визначені вище, наприклад, реакцією з триалкілсилілгалогенідом в інертному розчиннику, наприклад, ДХМ при температурі від 0°С до 60°С, бажано, від 10°С до 30°С, у присутності основи, наприклад, імідазо 12 лу. Сполуки формули (X) можна отримати з кислоти формули (XI): в якій R1, R2 і С є такими, що були визначені вище, перетворенням у кислотний хлорид обробкою реагентом, наприклад, оксалілхлоридом, в інертному розчиннику, наприклад, ДХМ при температурі від 0°С до 60°С, бажано, від 10°С до 30°С, з подальшою обробкою отриманого хлорангідриду гідроксиізоксазолідином у розчиннику, наприклад, ДХМ при температурі від 0°С до 60°С, бажано, від 10°С до 30°С у присутності основи, наприклад, триетиламіну. Сполуки формули (XI) отримують з відповідних естерів в стандартних умовах. Сполуки формули (IV) можна отримати з сполук формули (XII): в якій R1, R2 і Аr є такими, що були визначені вище, за умови, що Аr містить NH-групу, a R20 є естероутворюючою гр упою, наприклад, реакцією з сполукою формули (XIII): Аr2-галоген, (XIII) де Аr2 є таким, що був визначений вище, або реакцією з сполукою Аr2, де Аr є такою, що була визначена вище за умови, що Аr має нітрогеновий центр. Реакцію сполук (XII) і (XIII) можна проводити в інертному розчиннику, наприклад, діоксані, при температурі від 10°С до 120°С у присутності солі міді (І) і алкілендіаміну. Група R20 є естероутворюючою групою, наприклад, алкілом, зокрема, метилом. Реакцію сполуки (XII) і Аr2 можна проводити у розчиннику, наприклад, диметилацетаміді при температурі від 10°С до 200°С у присутності основи, наприклад, карбонату калію, як варіант, з мікрохвильовим опромінюванням. Сполуку формули (XII) можна отримати з сполуки формули (XV): 13 82497 в якій R1, R2 і R20 є такими, що були визначені вище, реакцією з сильною основою, наприклад, літійдіізопропіламідом у розчиннику, наприклад, ТГФ, при температурі від -78°С до 0°С з подальшим доданням сполуки формули (XVI): Аr-СНО (XVI) Сполуки формули (IV) отримують з сполук формули (XVII): в яких R1, R2 і R20, Аr і Аr 2 є такими, що були визначені вище, або деоксигенуванням, застосовуючи сильну кислоту, наприклад, ТФК, у присутності джерела гідриду, наприклад, триетилсилану, як варіант, у розчиннику, наприклад, ДХМ, при температурі від 10°С до 40°С, або активацією гідроксильної групи естерифікацією з анактивованою карбоновою кислотою, наприклад, трифлуороцтовим ангідридом або метансульфоніл-хлоридом в інертному розчиннику, наприклад, етилацетаті з подальшим гідролізом, наприклад, з застосуванням паладію на карбоні при 1-5 бар і при 10-80°С. Сполуки формули (XVII) отримують з сполуки формули (XV), визначеної вище, реакцією з сполукою (XVIII): Аr2-Аr-СНО (XVIII) в якій Аr і Аr 2 є такими, що були визначені вище, в умовах, подібних застосованим для реакції сполук (XV) і (XVI). Сполуки формули (VI) можуть бути утворені з сполук формули (XII) гідролізом естерної функції (з використанням гідроксиду лужного або лужноземельного металу у водовмісному розчиннику, наприклад, водному етанолі або метанолі) при температурі від 0°С до 100°С, або застосуванням водної неорганічної кислоти в інертному розчиннику при температурі від 20°С до 100°С, з подальшим сполученням кислотного залишку з сполукою формули (V) у присутності конденсуючого агента, наприклад, РуВrОР в інертному розчиннику, наприклад, ТГФ, у присутності основи, наприклад, триетиламіну, при температурі від 0°С до 30°С. Вихідні матеріали є такими, що були визначені вище. Вони є у продажу, або їх можна отримати, застосовуючи звичайну хімію, відому фа хівцям. Корисність сполук винаходу полягає в їх фар 14 макологічній активності у людей і тварин. їх призначають як фармакологічні засоби у лікуванні (профілактиці) автоімунних, запальних, проліферативних і гіперпроліферативних хвороб і імунологічно опосередкованих хвороб, включаючи відторгнення трансплантованих органів або тканин і СНІД. Прикладами таких станів є: (1) (респіраторні шляхи) обструктивна хвороба дихальних шляхів; астма, зокрема, бронхіальна, алергічна, внутрішня, зовнішня і пилова, хронічна або стійка (наприклад, застаріла астма і надчутливість дихальних шляхів)); хронічна обструктивна легенева хвороба (ХОЛХ) (наприклад, незворотна ХОЛХ); бронхіт; гострий, алергічний, атрофічний риніт або хронічний риніт (наприклад, творожистий риніт, гіпертрофічний риніт, гнійний риніт, сикативний риніт), медикаментозний риніт, мембранний риніт (включаючи крупозний, фібринозний і псевдомембранний риніт), сезонний риніт (включаючи нервовий риніт (сінна пропасниця) і вазомоторний риніт); саркоїдоз; хвороби, пов'язані з фермерськими легенями; фіброїдні легені і пов'язані з ними хвороби і ідіопатична внутрішньотканинна пневмонія; (2) (кістки і суглоби) ревматоїдні артрити, серонегативні спондилоартропатії (наприклад, анкілозний спондиліт, псоріазний артрит і хвороба Рейтера), хвороба Бесе, синдром Сйоргена і системний склероз; (3) (шкіра і очі) псоріаз, атопікальний дерматит, контактний дерматит, інші екзематичні дерматити, себорейний дерматит, Lichen planus, пемфігус, бульйозний пемфігус, бульйозний епідермолізис, кропивниця, ангіодерми, васкуліти, еритеми, шкірні еозинофіли, хронічні шкірні виразки, увеліт, виразкове ареатакомне облисіння і весінній кон'юнктивіт; (4) (шлунково-кишечний тракт) коеліатична хвороба, проктит, еозинофільний гастроентерит, мастоцитоз, хвороба Крона, виразковий коліт; харчові алергії з дією, віддаленою від кишечнику (наприклад, мігрень, риніт і екзема); (5) (інші тканинні і системні хвороби) множинний склероз, атеросклероз, СНІД, еритематозна волчанка; системна волчанка, еритематоз; тироїдит Хашімото, бульбоспинадний параліч, діабет типу І, нефротичний синдром, еозинофілія fascitis, синдром гіпер-lgE, лепроматозна проказа, сезарний синдром і ідіопатична тромбоцитопенія (6) (відторгнення аллотрансплантату) гостре і хронічне, після, наприклад, трансплантації нирки, серця, печінки, легені, кісткового мозку, шкіри і роговиці; і хронічна хвороба несприяття трансплантату; і (7) рак. Відповідно, винахід стосується сполуки формули (1) або її фармацевтично прийнятної солі, визначених вище і призначених для використання у терапії Ще одним аспектом винаходу є використання сполуки формули (1) або її фармацевтично прийнятної солі, визначених вище, у виготовленні медикаменту для використання у терапії. Тут термін "терапія" також включає "профілак 15 82497 тику", якщо не визначено інше. Терміни "терапевтичний" і "терапевтично" слід розуміти відповідно. Профілактика є особливо доречною стосовно пацієнтів, які вже страждали від певних хвороби або стану, або вважаються більш сприйнятливими до них. Особи, яким загрожує ризик захворювання даними хворобою або станом загалом включають тих, що мають родинну історію таких захворювань, або тих, в яких шляхом генетичного тестування або скринінгу була виявлена особлива чутливість до розвитку таких хвороби або стану. Винахід також включає спосіб забезпечення імуносупресії (наприклад, у лікування відторгнення алотрансплантату), який включає введення пацієнту терапевтично ефективності кількості сполуки формули (1) або її фармацевтично прийнятної солі, визначених вище . Винахід, крім того, включає спосіб лікування, або зниження ризику хвороб дихальних шляхів (наприклад, астми або ХОЛХ) у пацієнтів, що страждають від цих хвороб або мають підвищений ризик захворювання, який включає введення цьому пацієнту терапевтично ефективної кількості сполуки формули (1) або її фармацевтично прийнятної солі, визначених вище. У зазначеній вище терапії доза сполуки, яку вводять, залежить від типу сполуки, способу введення, типу терапії і розладу, для якого призначено терапію. Однак, взагалі для створення імуносупресії денна доза сполуки формули (1) має становити від 0,1мг/кг, бажано, від 0,3мг/кг, більш бажано, від 0,5мг/кг, найкраще від 1мг/кг до 30мг/кг маси пацієнта (включно). При лікування хвороб дихальних шля хів денна доза сполуки формули (1) має становити від 0,001мг/кг до 30мг/кг маси пацієнта. Сполуки формули (1) і її фармацевтично прийнятні солі можна застосовувати як такі, але найчастіше вони мають вводитись у формі фармацевтичної композиції, яка містить сполуку формули (1) або її сіль/сольват (активний інгредієнт) разом з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Залежно від способу введення, фармацевтична композиція переважно включає від 0,05 до 99% (за масою), бажано менше 80%(за масою), наприклад, від 0,10 до 70% (за масою), більш бажано, менше 50% (за масою) активного інгредієнта від повної маси композиції. Отже, винахід також стосується фармацевтичної композиції, яка містить сполуку формули (1) або фармацевтично прийнятну сіль, визначені вище, разом з фармацевтично прийнятними ад'ювантом, розріджувачем або носієм. Винахід, крім того, стосується способу приготування фармацевтичної композиції винаходу, який включає змішування сполуки формули (1) або її фармацевтично прийнятної солі, визначених вище, з фармацевтично прийнятними ад'ювантом, розріджувачем або носієм. Фармацевтичну композицію винаходу можна вводити локально (наприклад, у легені і/або дихальні шляхи, на шкіру) у формі розчинів, суспензій, гептафлуоралканових аерозолів і сухи х порошкових композицій; або системно, наприклад, оральним введенням у формі таблеток, капсул, сиропів, 16 порошків або гранул, або парентеральним введенням у формі розчинів або суспензій, або підшкірно, або ректально у формі супозиторіїв, або трансдермально. Здатність сполук інгібувати стимульовану РМА/іономіцином проліферацію моно-нуклеарних клітин у периферійній крові можна оцінити, наприклад, застосовуючи описану нижче процедуру. Винахід ілюструється наведеними далі Прикладами, в яких, якщо не зумовлено інше: (і) випарювання проводять обертальним випарюванням у вакуумі і процедури обробки проводять після видалення фільтруванням твердих залишків, наприклад, висушуючи х засобів; (іі) операції проводять при зовнішній температурі, тобто при 18-25°С і в атмосфері інертного газу, наприклад, аргону або нітрогену; (ііі) вихід наведено лише для ілюстрації, і він не завжди є максимально можливим; (iv) стр уктура кінцевих продуктів формули (І) підтверджуються ядерним (звичайно протонним) магнітним резонансом (ЯМР) і масспектрографією; значення хімічного зсуву протонного магнітного резонансу виміряють за дельташкалою, а множинності піків позначено: s - синглет; d - дублет; t - триплет; m - мультиплет; br широкий; q - квартет, quin - квінтет; (v) інтермедіати взагалі не одержують повної характеризації, а чистота оцінюється тонкошаровою хроматографією (ТШХ), рідинною хроматографією високого розрізнення (РХВР), масспектрометрією (МС), інфрачервоним (ІЧ) або ЯМР-аналізом; Абревіатури 2,3-дихлор-5,6-диціано-1,4-бензохінон - ДДХ Диметилформамід - ДМФ Тетрагідрофуран - ТГФ Приклад 1 6-[[3,5-диметил-1-(2-піримідиніл-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4[1Н,3Н)-діон а) Етилметил 2-метил-5-(N,Nметилетиламіно)-тіофен-3,4-дикарбоксилат Етоксикарбонілметилентрифенілфосфоран (33,8г) у сухому ТГФ (200мл) обробляють ізопропілізотіоціанатом (10,1г) при 65°С протягом 16 год. під азотом. Суміш охолоджують до -78°С і додають метил 3-бром-2-оксобутаноат. Реакцію залишають повільно нагрітись до кімнатної температури і через 24 год. при кімнатній температурі додають ще метил 3-бром-2-оксобутаноату (2,8г) і суміш гріють при 60°С 16 год. Охолоджену реакцію виливають у воду (1,5л) і екстрагують в етер. Су 17 82497 шіння і випарювання дають масло, яке хроматографують. (SiO2/10:1 ізогексан-етилацетат і потім 5:1 ізогексан-етилацетат), отримуючи бажану сполуку (23,5г). d HCDCL31,23-1,35(9H,m), 2,26(3H,s), 3,46(1H, m), 3,82(3H, s), 4,2(2Н, q), 7,42(1H, br.s)/ b) Метил 1,2,3,4-тетрагідро-3,6-диметил-1-(1метилетил)-2.4-діоксотієно[2.3-d]піримідин-5карбоксилат Ціанат срібла (13,5г), суспендований у безводному толуолі (90мл), під азотом обробляють краплями ацетилхлоридом (5,34мл) і енергійно перемішують протягом 30 хвил. Додають продукт операції а) (23г), розчинений у безводному толуолі (15мл), і суміш перемішують 72 год. Додають етер (360мл), нерозчинний матеріал відфільтровують і промивають невеликою кількістю етеру. Об'єднані органічні розчини промивають насиченим розчином бікарбонату натрію, сушать і випарюють. Залишок обробляють розчином метоксиду натрію у метанолі (25% (за масою), 64мл) при кімнатній температурі протягом 72 год. Реакцію охолоджують у льоду, обробляють триметилсилілхлоридом (50,8мл) і перемішують при кімнатній температурі протягом ночі. Всі леткі компоненти видаляють у вакуумі і залишок розділяють між водою і етилацетатом. Сушіння і випарювання органічного розчину дає залишок, який хроматографують (SiO2/2:1 ізогексан-етилацетат, потім 3:2 ізогексан-етилацетат) до ізолювання головного компонента (12,2г), який утримують у сухому ДМФ (150мл) з карбонатом калію (6,95г) і метилйодидом (7,1г) протягом 72 год. при кімнатній температурі. Суміш вливають у воду (2л), підкислюють і екстрагують в етер. Промивання розсолом, сушіння і випарювання дають тверду речовину, яку кип'ятять в ізогексані (200мл) з етилацетатом (3мл). Після охолодження збирають осаджену блідожовту тверду речовину й сушать, отримуючи бажану сполуку (10,5г). МС (АРСІ) [М+Н]+ 297 d HCDCL3 1,6 (6H, d), 2,44 (3H,s), 3,37 (ЗН, s), 3,95(3H, s), 4,66(1H, br). c) 1,2,3,4-тетрагідро-3,6-диметил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5карбонова кислота До розчину продукту операції b) (3,81г) у ТГФ (50мл) у метанолі (5мл) додають 1N NaOH (25,7мл) і суміш перемішують під азотом протягом 18 год., потім підкислюють 2,5N HCI і екстрагують ДХМ, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском, отримуючи бажану сполуку як тверду речовину (3,40г). МС (ESI) 283 [М+Н]+ d) 5-[[(4S)-4-гідрокси-2-ізоксазолідиніл] карбоніл]-3,6-диметил-1-(1-метилетил)-тієно-[2,3d]піримідин-2,4(1H,3H)-діон До суспензії продукту частини с) (3,40г) у ДХМ (50мл) додають оксалілхлорид (1,16мл) і ДМФ (10мкл) і суміш перемішують під азотом 2 год. До суспензії (S)-4-ізоксазолідинолгідрохлориду (1,53г) і триетиламіну (3,52мл) у ДХМ (20мл) додають розчин хлорангідриду при 0°С під азотом і суміш перемішують при кімнатній температурі 3 год., потім промивають водою, сушать над безводним 18 сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом етилацетатом і одержують бажану сполуку як тверду речовину (2,52г). МС (ESI) 354 [М+Н]+ d НДМСО 1,50-1,52 (6Н, m), 2,30-2,34 (3Н, m), 3,18-3,19 (3Н, m), 3,42-4,08 (4Н, m), 4,59-4,74 (2Н, m), 5,49-5,50 (1Н, m). e) 5-[[(4S)-4-[[(1,1-диметилетил) диметилсиліл]окси]-2-ізоксазолідиніл]карбоніл]-3,6-диметил1-(1-метилетил)тіено[2,3-d]піримідин-2,4(1Н,3Н)діон До розчину продукту частини d) (2,52г) у ДХМ (30мл) додають імідазол (0,53г) і третбутилдиметилсилілхлорид (1,18г) і суміш перемішують під нітрогеном 24 год., потім підкислюють 1N НСІ і екстрагують ДХМ. Органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі, з елюентом ігексан/етил-ацетат (3:1), потім і-гексан/етилацетат (1:1), отримуючи бажану сполуку (2,42г), d НДМСО 0,09 (6Н, d), 0,86 (9Н, s), 1,50 (6Н, d), 2,31-2,34 (3Н, m), 3,18-3,19 (3Н, m), 3,44-4,15 (4Н, m), 4,50-4,97 (2Н, m). f) 6-бромметил-5-[[(4S)-4-[[(1,1-диметилетил) диметилсиліл]окси]-2-ізоксазолідиніл]-карбоніл]-3метил-1-(1-метилетил)тієно[2,3-d]піримідин2,4(1Н,3Н)-діон До розчину продукту частини e) (2,42г) у хлороформі (100мл) додають N-бром-сукцинімід (1,01г) і суміш гріють при кипінні під зворотним холодильником з опримінюванням вольфрамовою лампою (300Вт) протягом 2 год., потім охолоджують, промивають 1N розчином NaOH, промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском, отримуючи бажану сполуку (2,83г). МС (ESI) 546 і 548 [М+Н]+ g) 6-(2-ацетил-3-оксобутил)-5-[[(4S)-4-[[(1,1диметилетил)диметилсиліл]окси]-2ізоксалідиніл]карбоніл]-3-метил-1-(1метилетил)тіено[2,3-d]піримідин-2,4(1Н,3Н)-діон Розчин продукту частини f) (2,83г) і гідратацетилацетонату цинку (1,47г) у хлороформі (50мл) гріють при кипінні під зворотним холодильником для 1 год., потім охолоджують, промивають розчином бікарбонату натрію, фільтрують через целіт, промивають розсолом, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском, отримуючи бажану сполуку (2,93г). МС (ESI) 566 [М+Н]+ h) 5-[[(4S)-4-[[(1,1-диметилетил) диметилсиліл]окси]-2-ізоксазолідиніл]-карбоніл]-6-[[3,5диметил-1-(2-піримідиніл)-1Н-піразол-4-іл]метил]3-метил-1-(1-метилсиліл)тієно[2,3-d]піримідин2,4(1Н,3H)-діон До розчину продукту частини g) (0,73г) у хлороформі (25мл) додають піримідин-2-ілгідразин (0,27г) і суміш перемішують 48 год., потім промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографі 19 82497 єю на кремнеземі, з елюентом і-гексан/етилацетат (1:1), потім і-гексан/етил ацетат (1:4), отримуючи бажану сполуку (0,43г). МС (ESI) 640 [М+Н]+ і) 6-[[3,5-диметил-1-(2-піримідиніл)-1Н-піразол4-іл]метил]-5-[[(45)-4-гідрокси-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]іпіримідин-2,4(1Н,3Н)-діон Розчин продукту частини h) (0,43г) і трифлуороцтову кислоту (0,5мл) у ДХМ (10мл) перемішують 72 год., потім концентрують у вакуумі, розбавляють розчином бікарбонату натрію і екстрагують етилацетатом, органічні екстракти промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі, з елюентом етилацетат, потім етилацетат/метанол (9:1), отримуючи бажану сполуку (30мг). МС (АРСІ) 526 [M+H]+ d 1НДМСО 1,44-1,46 (6H, m), 2,16-2,19 (3H, m), 2,53-2,55 (3H, m), 3,17-3,19 (3H, m), 3,48-4,14 (6H, m), 4,38 (1H, s, br), 4,60-4,80 (1H, m), 5,48-5,52 (1H, m), 7,46 (1H, dt), 8,87 (2H,t). Приклад 2 6-[[3,5-диметил-1-(2-піридиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон a) 5-[[(4S)-4-[[(1,1-диметилетил) диметилсиліл]окси]-2-ізоксазолідиніл]карбоніл]-6-[[3,5диметил-1-(2-пірідиніл)-1Н-піразол-4-іл]метил]-3метил-1-(1-метилетил)тієно[2,3-d]піримідин2,4(1Н,3Н)-діон До розчину продукту прикладу 1, частина г), (0,73г) у хлороформі (25мл) додають піридин-2ілгідразин (0,28г) і суміш перемішують 48 год., потім промивають водою, сушать над безводним сульфатом магнію, фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом ігексан, потім і-гексан/етилацетат (1:1), отримуючи бажану сполуку (0,28г). МС (ESI) 639 [М+Н]+ b) 6-[[3,5-диметил-1-(2-пірідиніл)-1Н-піразол-4іл]метил]-5-[[(4S)-4-гідрокси-2ізоксазолідиніл]карбоніл]-3-метил-1-(1метилетил)тієно[2,3-d]піримідин-2,4(1Н,3Н)-діон Розчин продукту частини а) (0,28г) і трифлуороцтову кислоту (0,5мл) у ДХМ (10мл) перемішують 72 год., потім концентрують у вакуумі, розбавляють розчином бікарбонату натрію і екстрагують етилацетатом. Органічні екстракти промивають водою, сушать над безводним сульфатом магнію, 20 фільтрують і випарюють під зниженим тиском. Залишок очищають колонною хроматографією на кремнеземі з елюентом етилацетат, потім етилацетат/метанол (49:1), отримуючи бажану сполуку (88мг). МС (АРСІ) 525 [М+Н]+ d 1НДМСО 1,44-1,47 (6Н, m), 2,17-2,19 (3Н, m), 2,56-2,58 (3Н, m), 3,47-4,14 (6Н, m), 4,38 (1Н, s, br), 4,60-4,80 (1Н, m), 5,51-5,52 (1Н, m), 7,30-7,34 (1Н, m), 7,80 (1Н, d), 7,95 (1H,dt), 8,45-8,47 (1H, m). Приклад 3 (S)-2-[[6-[[3,5-диметил-1-(2-тіазоліл)-1Нпіразол-4-іл]метил]-1,2,3,4-тетрагідро-3-метил-1(1-метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-ізоксазолідинол Суміш (S)-2-[[6-[(3,5-диметил-1Н-піразол-4іл)метил]-1,2,3,4-тетрагідро-3-метил-1-(1метилетил)-2,4-діоксотієно[2,3-d]піримідин-5іл]карбоніл]-4-ізоксазолідинолу (237мг), 2бромтіазолу (237мг), йодиду міді (І) (20мг), трансциклогексан-1,2-діаміну (15мг) і карбонату калію (145мг) гріють при 100°С у 1,4-діоксані (1мл) протягом 24 год. Реакційну суміш концентрують до сухості і очи щають хроматографією на SiO2 (патрон Biotage) з елюентом ЕЮАс до 5% МеОН у EtOAc) і потім звортнофазовою хроматографією, отримуючи бажану сполук у вигляді білої твердої речовини (110мг). МС (АРСІ +ve) M+H = 531,1d 1НДМСО, 120°С 1,47 (6Н, d), 2,17 (3Н, s), 2,60 (3Н, s), 3,20 (3Н, s), 3,46 (1Н, d), 3,75 (1Н, d), 3,893,95 (2Н, m), 3,89 (2Н, s), 4,46 (1Н, sep), 4,70 (1Н, s), 5,08 (1Н, s), 7,38 (1Н, d), 7,56 (1H,d). Фармакологічні дані Інгібування РМА/іономіцин-стимульованої проліферації мононуклеарних клітин у периферійній крові Це дослідження проводили у 96-коміркових плоскодонних мікротитрувальних планшетах. Сполуки отримували як 10мм маточні розчини у диметилсульфоксиді, з яких у 50-разовому розбавленні, отриманому у RPMI, були отримані послідовні розбавлення цього розчину. 10мкл 50-разово розбавленого маточного розчину, або його розбавлень додавали до комірки, отримуючи концентрації, починаючи з 9,5мкМ і нижче. У кожну комірку вносили 1х105 РВМС, отриманого з периферійної крові одного донора-людини, у середовищі RPMI1640 з доданням 10% сироватки людини, 2мM глютаміну і пеніциліну/стрептоміцину. Додавали ацетат форболміристрату (РМА) (кінцева концентрація 0,5нг/мл) і іономіцин (кінцева концентрація 500нг/мл), і, отже, кінцевий об'єм аналізу 21 82497 становив 0,2мл. Клітини інкубували при 37°С у зволоженій атмосфері з 5% діоксиду карбону протягом 72 год. Для кінцевих 6 год. інкубування додавали 3Н-тимідин (0,5мКі). Рівень радіоактивності, внесений клітинами, є мірою проліферації. Комп’ютерна в ерстка А. Крулевський 22 У цьому випробування сполуки Прикладів показали значення ІА50 менше 1x10-6М. Зокрема, для Прикладів 1 lA50 становило 8,3, а для Прикладу 3 9,0. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюThienopyridazinones and theair use
Автори англійськоюGuile Simon David, Ingall Anthony Howard
Назва патенту російськоюТиенопиримидиндионы и их использование в модуляции аутоиммунных болезней
Автори російськоюГил Саймон Дейвид, Инголл Энтони Говард
МПК / Мітки
МПК: C07D 495/04, A61P 37/02
Мітки: тієнопіримідиндіони, модуляції, використання, хвороб, аутоімунних
Код посилання
<a href="https://ua.patents.su/11-82497-tiehnopirimidindioni-i-kh-vikoristannya-u-modulyaci-autoimunnikh-khvorob.html" target="_blank" rel="follow" title="База патентів України">Тієнопіримідиндіони і їх використання у модуляції аутоімунних хвороб</a>
Попередній патент: Спосіб вимірювання квазістаціонарного магнітного поля
Наступний патент: Спосіб керування процесом або регулювання процесу на установці для обробки тиском, охолодження і/або термічної обробки металевого матеріалу
Випадковий патент: Свердловинний заряд