Кристалічний безводний арипіпразол g, спосіб його одержання, фармацевтична композиція, що містить арипіпразол g, та спосіб її одержання
Номер патенту: 84923
Опубліковано: 10.12.2008
Автори: ТАНІГУТІ Юіті, Нісіока Йосіхіро, ІСІГАМІ Макото, Томікава Кендзі, Фудзімура Цутому, Уцумі Наото, Сінхама Коіті, КАВАСАКІ Дзюньіті, Кобаясі Норіюкі, Томінага Мітіакі, Оой Йосіхіро, ФУДЗІМОТО Кійосі, Тахакасі Масанорі, БАНДО Такудзі, Абе Каору, Ямада Сьохей, ЯБУУТІ Чуйосі, АОКІ Сатосі, Накагава Томонорі
Формула / Реферат
1. Кристалічний безводний арипіпразол G, який має:
(24) порошковий рентгенодифракційний спектр, що має характерні піки порошкової рентгенодифракції при 2![]() =10,1°, 12,8°, 15,2°, 17,0°, 17,5°, 19,1°, 20,1°, 21,2°, 22,4°, 23,3°, 24,5° та 25,8°;
=10,1°, 12,8°, 15,2°, 17,0°, 17,5°, 19,1°, 20,1°, 21,2°, 22,4°, 23,3°, 24,5° та 25,8°;
чіткі інфрачервоні смуги вбирання при 2942, 2813, 1670, 1625, 1377, 1195, 962 та 787 см-1;
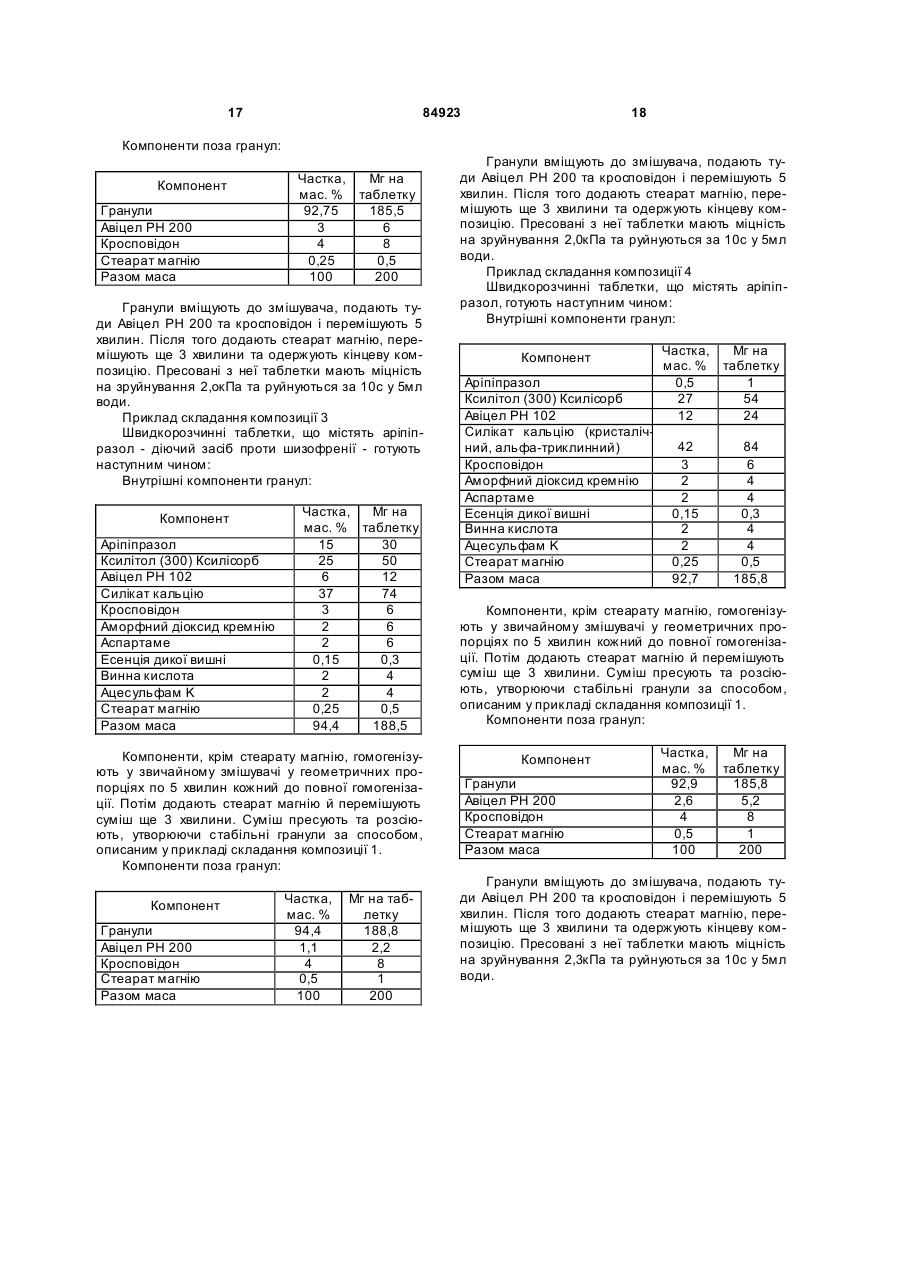
ендотермічний пік на кривій термогравіметрії/ДТА (швидкість нагрівання 5°/хв.) близько 141,0 °С та екзотермічний пік близько 122,7 °С.
2. Спосіб одержання кристалічного безводного арипіпразолу G за п. 1, який відрізняється тим, що склистому безводному арипіпразолу дають відстоятися у закритій посудині протягом щонайменше 2 тижнів.
3. Фармацевтична композиція, яка містить кристалічний безводний арипіпразол G за п. 1 разом з фармакологічно прийнятними носіями.
4. Спосіб одержання гранул, який відрізняється тим, що проводять вологе гранулювання кристалічного безводного арипіпразолу G за п. 1, висушують одержані гранули при 70-100 °С, класифікують їх, після чого знову сушать класифіковані гранули при 70-100 °С.
5. Спосіб одержання фармацевтичної твердої оральної композиції, який відрізняється тим, що кристалічний безводний арипіпразол G за п. 1 змішують з одним або кількома фармакологічно прийнятними носіями і сушать при 70-100 °С.
6. Фармацевтична тверда оральна композиція, що містить кристалічний безводний арипіпразол G за п. 1 й один або кілька фармакологічно прийнятних носіїв, яка має принаймні одну швидкість розчинення, вибрану з групи, що містить 60 % або більше при рН 4,5 за 30 хвилин, 70 % або більше при рН 4,5 за 60 хвилин та 55 % або більше при рН 5,0 за 60 хвилин.
Текст
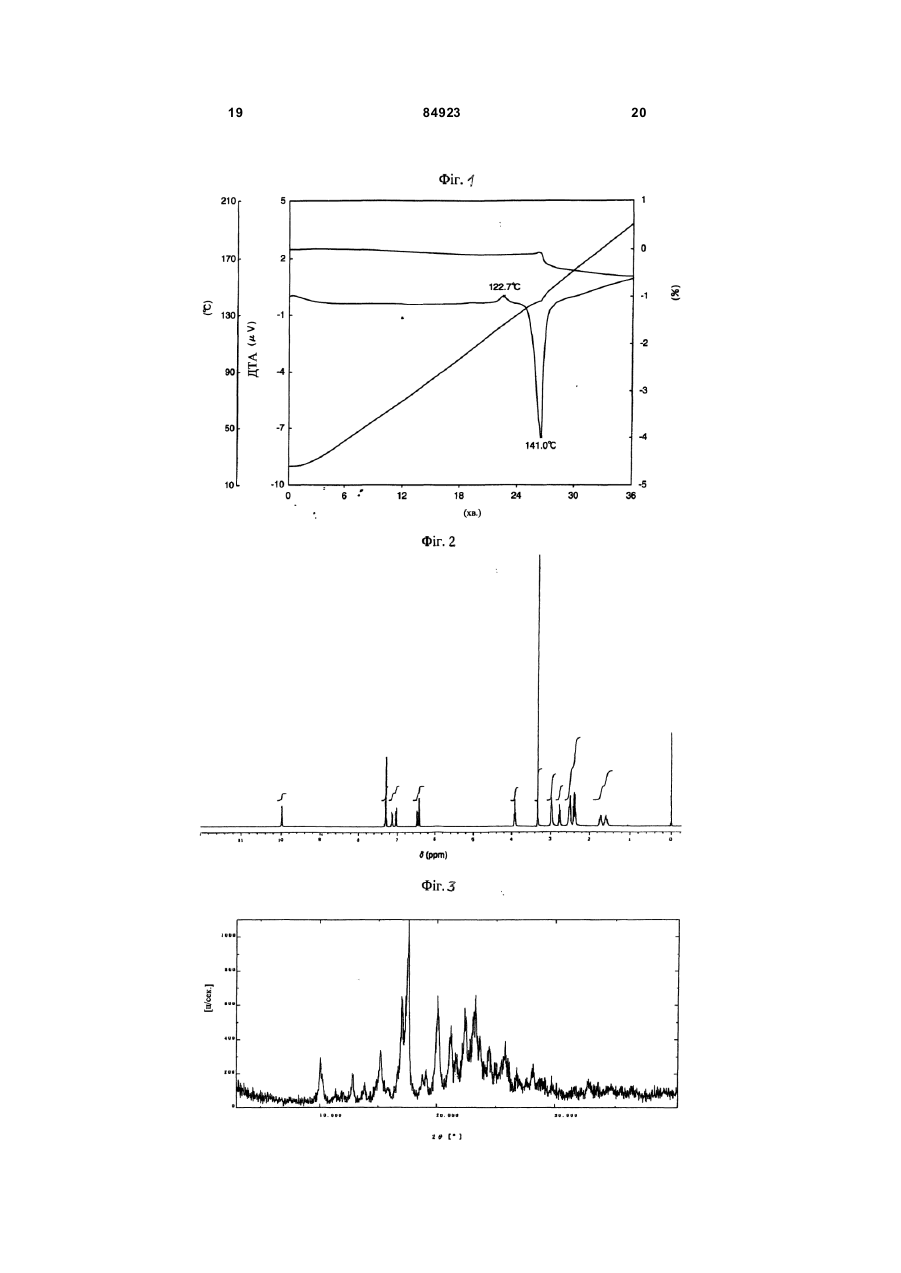
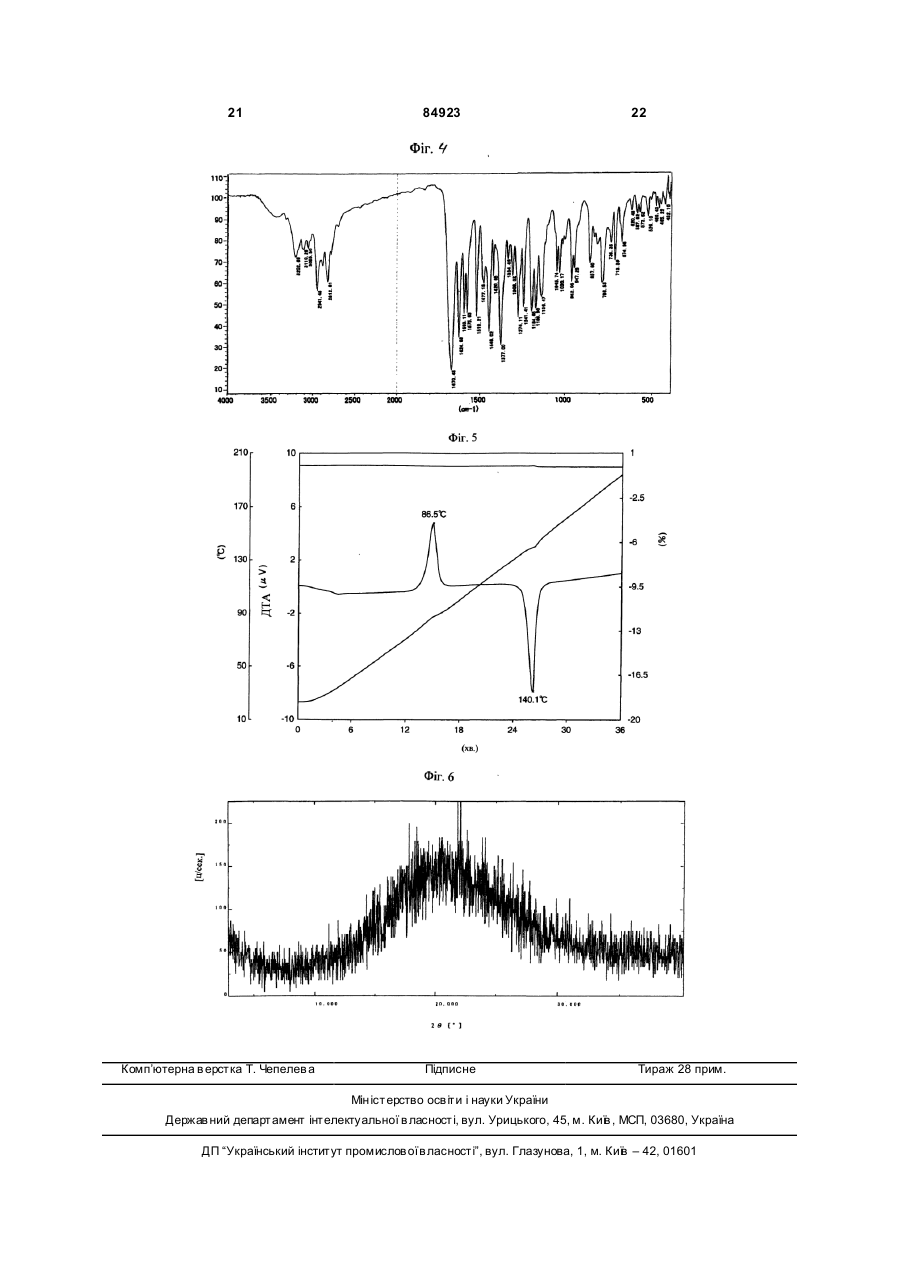
1. Кристалічний безводний арипіпразол G, який має: (24) порошковий рентгенодифракційний спектр, що має характерні піки порошкової рентгенодифракції при 2 q =10,1°, 12,8°, 15,2°, 17,0°, 17,5°, 19,1°, 20,1°, 21,2°, 22,4°, 23,3°, 24,5° та 25,8°; C2 2 (19) 1 3 84923 4льцгеймера, множинний склероз, інсулінозалежний діабет та м'язова дистрофія. Рання діагностика та лікування можуть значно полегшити одужання. Більш того, раннє лікарське втручання може відвернути коштовн у госпіталізацію. Згідно з прикладом 1 викладеної [заявки Японії №191256/1990], кристали безводного аріпіпразолу одержують, наприклад, реакцією 7-(4бромбутокси)-3,4-дігідрокарбостирілу з 1-(2,3діхлорфенілпіперадином та перекристалізацією одержаного безводного аріпіпразолу з етанолом. Також, як витікає з Праць 4-го японо-корейського симпозіуму з розділення (6-8 жовтня 1996p.), кристали безводного аріпіпразолу готують нагріванням гідрату аріпіпразолу при 80°С. Однак одержані зазначеними способами кристали безводного аріпіпразолу мають суттєвий недолік — вони надто гігроскопічні. Гігроскопічність цих кристалів утр уднює їх обробку, бо доводиться вживати коштовних та виснажливих заходів, щоб виключити їхній контакт з вологою при виготовленні та змішуванні Під дією вологи безводна форма набирає воду й перетворюється на водну. Це пов'язане з низкою незручностей. По-перше, водна форма аріпіпразолу має нижчу біозасвоюваність і гірше розчинюється, ніж безводні форми аріпіпразолу. По-друге, коливання співвідношення безводних та водних форм аріпіпразолу від партії до περτίϊ ліків може порушува ти стандарти, завдані регулюючими органами. Потретє, при подрібнюванні частки діючої речовини, звичайного безводного аріпіпразолу, можуть прилипати до устаткування, а це призводить до затримок процесу, відволікання уваги оператора, підвищення собівартості, витрат на ремонт та зниження продуктивності. По-четверте, опріч проблем, пов'язаних з потраплянням вологи у виробництві цих гігроскопічних безводних аріпіпразолів, можливе вбирання вологи під час зберігання та перевезення може погіршити розчинність діючої речовини аріпіпразолу. Отже, термін зберігання ліків може суттєво скоротитися або зростуть витрати на упакування. Було б украй бажано створити таку форму аріпіпразолу, що посідала б низьку гігроскопічність, що полегшило б виробничий процес лікарського продукту, поліпшило б термін зберігання, забезпечило б потрібну розчинність та біозасвоюваність. Також у Працях 4-го японо-корейського симпозіуму з розділення (6-8 жовтня 1996р.) стверджується, що кристали безводного аріпіпразолу існують як кристали типу І та типу II; кристали безводного аріпіпразолу типу І можна приготувати перекристалізацією з розчину аріпіпразолу в етанолі або нагріванням гідрату аріпіпразолу при 80°С, тоді як кристали безводного аріпіпразолу типу II можна приготувати нагріванням кристалів безводного аріпіпразолу типу І при 130-140°C протягом 15 годин. Описаними вище способами кристали безводного аріпіпразолу типу II з високою чистотою неможливо одержати у промислових умовах з належною відтворюваністю. Згідно з винаходом за заявкою заявки №2003010503 пропонується форма аріпіпразолу зі 4 зменшеною гігроскопічністю, більш придатна до виготовлення в умовах фармакологічного виробництва. Винахідники встановили, що ця форма аріпіпразолу являє собою кристалічну речовину, яку ми позначаємо як "кристали безводного аріпіпразолу В". Розроблено також конкретний спосіб виробництва цієї безводної кристалічної речовини, який становить інший аспект цього винаходу. Зокрема, у межах цього винаходу встановлено, що для одержання кристалів безводного аріпіпразолу В з бажаними фармакологічними властивостями та найбільшою ефективністю процесу гідрат А має слугувати проміжною сполукою. Також встановлено, що для одержання гідрату А потрібне подрібнювання звичайного гідрату. Після цього гідрат А можна перевести в кристали безводного аріпіпразолу В шля хом нагрівання, як зазначено у винаході. Несподівано з'ясовано, що якіцо нагрівати звичайний гідрат перед помелом, має місце суттєва агломерація, що робить виробництво неекономічним. Окрім гідрату А аріпіпразолу та кристалів безводного аріпіпразолу В, зазначених вище, винахід за [заявкою №2003010503] дозволяє одержувати кристали безводного аріпіпразолу C-G. Задачею винаходу за даною виділеною заявкою є створення нових кристалів безводного аріпіпразолу G. Більш того, іншою задачею винаходу є створення кристалів безводного аріпіпразолу, які не перетворюються легко на гідрати та не втрачають початкової розчинності навіть після тривалого зберігання фармацевтичної композиції, що містить безводний аріпіпразол. Наступною задачею винаходу є створення способу, що дозволяє одержувати кристали безводного аріпіпразолу високої чистоти у промислових умовах з належною відтворюваністю. Поставлена задача вирішується тим, що створено кристалічний безводний аріпіпразол G, який має: (20) порошковий рентгенодифракційний спектр, що має характерні піки порошкової рентгенодифракції при 2θ=10,1°, 12,8°, 15,2°, 17,0°, 17,5°, 19,1°, 20,1°, 21,2°, 22,4°, 23,3°, 24,5° та 25,8°; чіткі інфрачервоні смуги вбирання при 2942, 2813,1670,1625, 1377, 1195, 962 та 787см -1; ендотермічний пік на кривій термогравіметрії/ДТА (швидкість нагрівання 5°/хв.) біля 141,0°С та екзотермічний пік біля 122,7°C. Автори винаходу провели дослідження, спрямовані на досягнення вищезазначених цілей. У процесі досліджень вони встановили, що цільові кристали безводного аріпіпразолу можна одержувати нагріванням звичайного безводного аріпіпразолу при певній температурі. Далі було встановлено, що цільові кристали безводного аріпіпразолу можна одержати перекристалізацією звичайного безводного аріпіпразолу у певних розчинниках. Більш того, автори винаходу встановили також, що цільові кристали безводного аріпіпразолу можна одержувати суспендуванням звичайного безводного аріпіпразолу у певному розчиннику та нагріванням одержаної суспензії. 5 84923 Винахід створено на підставі цих відкриттів та набутих знань. Фіг.1 термогравіметрично-диференційна термограма з аналізом ендотермічної кривої кристалів безводного аріпіпразолу типу G, одержаного у прикладі 1-b. Фіг.2 - 1H-ЯМР спектр (DMSO-d6, TMS) кристалів безводного аріпіпразолу типу G, одержаного у прикладі 1-b. Фіг.3 - порошкова рентгенодифрактограма кристалів безводного аріпіпразолу типу G, одержаного у прикладі 1-b. Фіг.4 - ІЧ-спектр кристалів безводного аріпіпразолу типу G, одержаного у прикладі 1-b. Фіг.5 крива термогравіметричнодиференційного термічного аналізу з урахуванням ендотермічної кривої склистої форми кристалів безводного аріпіпразолу, одержаного у прикладі 1-а. Фіг.6 - порошкова рентгенодифрактограма склистої форми кристалів безводного аріпіпразолу, одержаного у прикладі 1-а. Винахід стосується кристалів безводного аріпіпразолу (надалі "кристалів безводного аріпіпразолу типу G"), який характеризується наступними фізико-хімічними властивостями (1-4): (1) Його ендотермічна крива по суті збігається з кривою термогравіметрії/ДТА (швидкість нагрівання 5°С/хв)., наведеною на Фіг.1. (2) Його 1Н-ЯМР спектр по суті збігається з 1НЯМР (DMSO-d6 , TMS) спектром, наведеним на Фіг.2. (3) Його порошковий рентгенодифракційний спектр по суті збігається зі спектром, наведеним на Фіг.3. (4) Його ІЧ спектр по суті збігається з 14 (KBr) спектром, наведеним на Фіг.4. Винахід стосується способу одержання кристалів безводного аріпіпразолу за п.1, який відрізняється тим, що склистий безводний аріпіпразол вміщують до зачиненої посудини та витримують у ній протягом принаймні 2 тижнів. Кристали безводного аріпіпразолу типу G Кристалічний безводний аріпіпразол типу G за винаходом має наступні фізико-хімічні властивості (19-22): (19) Його ендотермічна крива по суті збігається з кривою термогравіметрії/ДТА (швидкість нагрівання 5°С/хв), наведеною на Фіг.1. Зокрема, вона відрізняється наявністю ендотермічного піку біля 141,0°С та екзотермічного піку біля 122,7°C. (21) Його 1Н-ЯМР спектр по суті збігається з 1 Н-ЯМР (D MSO-d6, TMS) спектром, наведеним на Фіг.2. Зокрема, він має характерні піки при 1,551,63ч. на млн. (m, 2H). 1,68-1,78ч. на млн. (m, 2H), 2,35-2,46ч. на млн. (m, 4H), 2,48-2,56ч. на млн. (m, 4Н+DMSO), 2,78ч. на млн. (t, J=7,4Гц, 2Н), 2,97ч. на млн. (brt, J=4,6Гц, 4Н), 3,92ч. на млн. (t, J=6,3Гц, 2Н). 6,43ч. на млн. (d, J=2,4Гц, 1H), 6,49ч. на млн. (del, J=8,4Гц, J=2,4Гц, 1H), 7,04ч. на млн. (d, J=8,1Гц, 1H), 7,11-7,17ч. на млн. (m, 1H), 7,287,32ч. на млн. (m, 2H) та 10,00ч. на млн. (s, 1H). (22) Його порошковий рентгенодифракційний спектр по суті збігається зі спектром, наведеним на Фіг.3. Зокрема, він має характерні піки порош 6 кової рентгенодифракції при 2θ=10,1°, 12,8°, 15,2°, 17,0°, 17,5°, 19,1°, 20,1°, 21,2°, 22,4°, 23,3°, 24,5° та 25,8°. (23) Його ІЧ спектр по суті збігається з наведеним на Фіг.4 ІЧ (KBr) спектром. Зокрема, він має чіткі інфрачервоні смуги вбирання при 2942, 2813, 1670, 1625, 1377, 1195, 962 та 787 см -1. Спосіб одержання кристалів безводного аріпіпразолу типу G Кристали безводного аріпіпразолу типу G за винаходом можна одержати, наприклад. вміщуючи склистий безводний аріпіпразол до зачиненої посудини та витримуванням у ній при кімнатній температурі протягом принаймні двох тижнів, переважно від двох тижнів до шести місяців. Склистий безводний аріпіпразол як вихідний матеріал можна одержати нагріванням та розплавленням безводного аріпіпразолу при температурі біля 170°С з наступним охолодженням до кімнатної температури. Сировиною може слугувати звичайний кристалічний безводний аріпіпразол, наприклад, кристали безводного аріпіпразолу типу І, типу II та подібні, й ці безводні аріпіпразоли можуть бути очищеними або неочищеними. Або сировиною можуть бути кристали безводного аріпіпразолу типу В, типу C, типу D, типу F або типу E, одержані згідно з винаходом. Ці безводні аріпіпразоли можуть використовуватися окремо або в комбінаціях по два й більше типів. Одержані кристали безводного аріпіпразолу типу G можна виділити та очистити відомими прийомами. Наприклад, якщо дати склистому безводному аріпіпразолу вистоятися, як описано вище, можна одержати кристали безводного аріпіпразолу типу G 100% чистоти. Кристали безводного аріпіпразолу типу C , тип у D, типу E, типу F або типу G за винаходом не перетворюються з легкістю на відповідні гідрати і по суті не втрачають початкової розчинності навіть після тривалого зберігання. Згідно з винаходом створені способи одержання кристалів безводного аріпіпразолу високої чистоти, які можна використовувати в промисловому виробництві з високим ступенем відтворюваності. Згідно з винаходом створені фармакологічні композиції, що містять кристали безводного аріпіпразолу, в якого не погіршується розчинність і які не втрачають відмінної стабільності навіть при тривалому зберіганні. Кристали безводного аріпіпразолу. що слугують сировиною при виготовленні кристалів безводного аріпіпразолу G, одержують, наприклад, способом "а" або способом "b", як описано нижче. Спосіб "а" одержання сирих кристалів аріпіпразолу Кристали звичайного безводного аріпіпразолу одержують відомим способом, як описано у прикладі 1 викладеної [заявки Японії 191256/1990]. Суспензію 47г 7-(4-бромбутокси)-3,4дігідрокарбостирілу, 35г йодиду натрію у 600мл ацетонітрилу нагрівають зі зворотнім холодильником 30 хвилин. До цієї суспензії додають 40г 1(2,3-діхлорфеніл)піперазину та 33мл триетиламіну 7 84923 й нагрівають суміш зі зворотнім холодильником ще 3 години. Після видалення розчинника випарюванням одержаний осад розчиняють у хлороформі, промивають водою та сушать з безводним сульфатом магнію. Розчинник видаляють випарюванням, а одержаний осад двічі перекристалізують з етанолу, одержуючи 57,1г 7-{4-[4-(2,3діхлорфеніл)-1-піперазиніл]бутокси}-3,4-дігідрокарбосгирілу. Безбарвні пластівчасті кристали Точка топлення: 139,0-139,5°C Спосіб "b" одержання звичайного безводного аріпіпразолу Спосіб описано у Працях 4-го японокорейського симпозіуму з розділення (6-8 жовтня 1996p.). Більш того, кристали безводного аріпіпразолу В за винаходом готують, наприклад, нагріванням звичайного гідрату аріпіпразолу при 90-125°C. Час нагрівання становить, як правило, 3-50 годин і встановлюється залежно від температури нагрівання. Час та температура нагрівання знаходяться у зворотний залежності, отже, нагрівання триває тим довше, чим нижче температура нагрівання, і навпаки. Зокрема, якщо гідрат А аріпіпразолу нагрівають при 100°C, час нагрівання становить біля 24 годин, тоді як при температурі 120°C час нагрівання скорочується до біля 3 годин. Гідрат аріпіпразолу, який слугує сировиною для виготовлення кристалів безводного аріпіпразолу В за винаходом, одержують способом "с", як описано далі. Спосіб "с" одержання звичайного гідрату Гідрат аріпіпразолу одержують розчиненням кристалів безводного аріпіпразолу, одержаних способом "а", у водному розчиннику, нагріванням та наступним охолодженням одержаного розчину. Цим способом осаджують кристали гідрату аріпіпразолу з водного розчинника. Водним розчинником звичайно слугує органічний розчинник з вмістом води. Органічний розчинник має змішуватися з водою. Це може бути спирт, як метанол, етанол, пропанол або ізопропанол, кетон, як ацетон, етер, як тетрагідрофуран, діметилформамід, або їхня суміш, причому перевага віддається етанолові. Вміст води у водному розчиннику може становити 10-25об.%, переважно біля 20об.%. Лікарська композиція Лікарська композиція за винаходом містить кристалічний безводний аріпіпразол типів В, C, D, E, F та G у фармакологічно прийнятному носії або комбінації носіїв. Фармакологічно прийнятними носіями є загально поширені у фармації розріджувачі та наповнювачі, як то наповнювачі, сухі розріджувачі, зв'язуючі, зволожники, подрібнювачі, ПАР та мастила. Лікарська композиція за винаходом може являти собою звичайну лікарську форму, як от таблетки, швидкорозчинні таблетки, пілюлі, порошки, рідини, суспензії, емульсії, гранули, капсули, супозиторії або речовини для ін'єкцій (рідини, суспензії та ін.) У разі таблеток можна використовувати велике розмаїття відомих носіїв. Це лактоза, сахароза, 8 хлорид натрію, глюкоза, ксилітол, маннітол, еритрітол, сорбітол, сечовина, крохмаль, карбонат кальцію, каолін, кристалічна целюлоза, кремнезем та інші наповнювачі; вода, етанол, пропанол, простий сироп, рідка глюкоза, рідкий крохмаль, розчин желатину, карбоксіметилцелюлоза, шелак, метилцелюлоза, фосфа т калію, полівінилпіролідон та інші зв'язуючі; сушений крохмаль, альгінат натрію, агаровий порошок, порошок ламінарії, бікарбонат натрію, карбонат кальцію, поліоксіетиленсорбітан, ефіри масних кислот, лаурілсульфат натрію, моногліцеридстеарат, крохмаль, лактоза та інші подрібнювачі; сахароза, стеарин, олія какао, гідрогенізована олія та інші інгібітори подрібнення; четвертинні солі амонію, лаурілсульфат натрію та інші агенти, що сприяють засвоєнню; гліцерин, крохмаль та інші утримувачі вологи; крохмаль, лактоза, каолін, бентоніт, колоїдний діоксид кремнію та інші адсорбенти; очищений тальк, стеарат, порошок борної кислоти, поліетиленгліколь та інші мастила і т.ін. Таблетки за потреби можна виготовляти зі звичайним покриттям, наприклад, цукровим, желатиновим, ентеропокриттям або плівковим покриттям, або як подвійні та багатошарові таблетки. При виробництві пілюль можна використовувати безліч відомих носіїв, наприклад, глюкозу, лактозу, крохмаль, олію какао, стверджену рослинну олію, каолін, тальк та інші наповнювачі; порошок гуміарабіку, порошок тракаганту, желатин, етанол та інші зв'язуючі; ламінаран, агар та інші подрібнювачі й т.ін. Носіями для супозиторіїв можуть бути поліетиленгліколь, олія какао, вищі спирти, ефіри вищи х спиртів, желатин, напівсинтетичний гліцерид та ін. Капсули готують відомим способом, змішуючи кристалічний безводний аріпіпразол з різними носіями, що зазначені вище, та вміщуючи суміш до твердих желатинових капсул, м'яких капсул, капсул з ГПМЦ (гідроксіпропилметилцелюлози) та ін. Крім того, до лікарської композиції можна вводити фарбники, консерванти, парфуми, смакові та солодкі добавки, а також інші діючі засоби. Якщо оральний твердий лікарський препарат готують у вигляді гранул, то це можна робити шляхом вологого гранулювання суміші порошків кристалічного безводного аріпіпразолу (звичайного або обраного з групи, що включає кристали безводного піперазолу типів В, C, D, E, F та G) з різноманітними відомими носіями, як от сухими розріджувачами, подрібнювачами, інгібіторами подрібнення, зволожниками, прискорювачами засвоєння, адсорбентами, мастилами, фарбниками і т.ін. (приклади таких речовин нгіведені вище) з доданням рідини (як правило, води або водних розчинів зв'язуючих речовин). Вологу грануляцію можна здійснювати різними прийомами, наприклад, грануляція у киплячому шарі, місильна грануляція, грануляція в екструдері, барабанна грануляція та ін. У разі грануляції у киплячому шарі компоненти гранул, що містять різні носії, змішують з повітрям на вході, потім при постійному псевдозрідженні напилюють суміш та рідину з одержанням гранул. У разі місильної грануляції 9 84923 компоненти ретельно перемішують, а потім додають рідину, продовжуючи перемішування, й одержують гранули. Якщо потрібно, одержані гранули розсіюють до потрібного розміру за допомогою відповідного сита або млина. Розсіяні гранули піддають повторній сушці. Способи сушки теж можуть бути різними, наприклад, сушка у киплячому шарі, барабанній сушарці, вакуумній сушарці та ін. Як правило, сушку провадять у звичайному режимі, наприклад, у разі сушарки киплячого шару процес займає від 10 хвилин до 1 години при витраті повітря 0,5-50 м 3/хв. з температурою на вході 70100°C. Висушені гранули розсіюють та сушать знову. Повторна сушка у сушарці киплячого шару або у барабанній сушарці займає від 1 до 6 годин при витраті повітря 0,5-50м 3/хв. з температурою на вході 70-100°C. У вакуумній сушарці процес ведуть під зниженим тиском біля 0-10 торр при температурі сорочки 70-100°C протягом 1-6 годин. Одержані таким чином гранули можуть призначатися безпосередньо для орального прийому або при потребі формуватися у таблетки. Якщо з висушених гранул формують таблетки, їх потім знову піддають сушці. Одержана таким чином тверда оральна лікарська композиція містить кристалічний безводний аріпіпразол, який по суті не перетворюється на гідрат навіть при тривалому зберіганні, а тому швидкість розчинення композиції майже не погіршується (швидкість розчинення для підтримання максимальної концентрації (Сmах): 60% або більше при рН4,5 за 30 хвилин, 70% або більше при рН4,5 за 60 хвилин, 55% або більше при рН5,0 за 60 хвилин). Також можна одержати фармакологічну тверду оральну композицію шляхом гранулювання звичайного кристалічного гідрату аріпіпразолу описаними вище способами, сушки звичайним способом у подібних умовах та повторної сушки. Якщо сушені гранули, одержані відомим шляхом, формують у таблетки, їх сушать знов і одержують фармакологічну тверду оральну композицію зі збереженою швидкістю розчинення (швидкість розчинення для підтримання максимальної концентрації (Сmах): 60% або більше при рН4,5 за 30 хвилин, 70% або більше при рН4,5 за 60 хвилин, 55% або більше при рН5,0 за 60 хвилин). З цього можна зробити висновок, що кристали звичайного безводного аріпіпразолу або гідрату аріпіпразолу, піддані дворазовій сушці, перетворюються у фармацевтичній твердій оральній композиції на кристали безводного аріпіпразолу типу В. Вміст кристалів безводного аріпіпразолу типів В, C, D, E, F та G у лікарській композиції за винаходом обирається у широких межах залежно від медичного призначення. Як правило, вміст кристалічного безводного аріпіпразолу В становить 170мас.% лікарської композиції, зокрема, 130мас.%. Спосіб введення лікарської композиції за винаходом обирається залежно від її складу, від віку, статі та інших особливостей (в тому числі тяжкості хвороби) пацієнта. Таблетки, пілюлі, рідини, суспензії, емульсії, гранули та капсули вводять перорально. Ін'єкції роблять внутрішньовенно, при 10 чому вводять або чисту композицію, або розріджують її, наприклад, глюкозою чи амінокислотами. Чисту композицію можна також вводити внутрішньом'язово, внутрішньошкірно, підшкірно або внутрішньочеревно. Суппозиторії вводять внутрішньоректально. Дозування лікарської композиції за винаходом обирають залежно від призначення, віку, статі, інших особливостей пацієнта, тяжкості його стану і т.н., але звичайно доза кристалічного безводного аріпіпразолу становить 0,1-10мг на 1кг ваги тіла на добу. Одинична доза кристалів безводного аріпіпразолу В має знаходитися в межах 1-100мг, зокрема, 1-30мг. Лікарська композиція за винаходом є надзвичайно стабільна, і її розчинність не погіршується навіть після тривалого зберігання. Лікарська композиція за винаходом ефективна для профілактики та лікування розладів центральної нервової системи, наприклад, шизофренії, а також для лікування важковиліковної (наркогенної, хронічної) шизофренії з порушенням розумової діяльності й без порушення, тривожних станів, в тому числі м'яких, маній, в тому числі гострої манії біполярного розладу та гострої манії, біполярних розладів, депресій, включаючи депресію біполярного розладу, аутизму, синдрому Дауна, гіперактивного розладу з дефіцитом уваги (ГРДУ), хвороби Альцгеймера, хвороби Паркінсона та інших нейродегенеративних хвороб, панічних станів, нав'язливих примусових розладів (НПР), розладів сну, сексуальних дисфункцій, алкогольної та наркотичної залежності, блювання, захитування, опасистості, мігренів та погіршення розумової діяльності. Аналітичні методи (1) Н-ЯМР спектр вимірюють у DMSO-d6 з використанням TMS як еталону. (2) Порошкова рентгенодифракція Картину порошкової дифракції визначають на дифрактометрі RAD-2B фірми Рігаку денкі при кімнатній температурі, використовуючи наповнену Cu Ka трубку (35кВ, 20мА) як джерело випромінювання з ширококутним гоніометром, розсіюючою діафрагмою 1°, світловідсічною щілиною 0,15мм, графітовим вторинним монохроматором та лічильником сцинтиляцій. Дані збирають у режимі безперервної розгортки 2θ, швидкість розгортай 5°/хв. приростами по 0,02° в інтервалі від 3° до 40°. (3) ІЧ спектри вимірюють no KBr. (4) Термогравіметричний/диференціальний термічний аналіз Аналіз виконують на блоці керування Сейко SSC 5200 та вимірювальному блоці одночасного термогравіметричного та диференціального термічного аналізу TG/DTA 220. Зразки по 5-10мг вміщують до відкритих алюмінієвих піддонів та нагрівають від 20°С до 200°C в атмосфері сухого азоту зі швидкістю 5°С/хв. Стандартом слугує α-окис алюмінію. (5) Диференціальна скануюча калориметрія Аналіз виконують на блоці керування Сейко SSC 5200 та диференціальному скануючому калориметрі DSC 220С. Зразки по 5-10мг вміщують до гофрованих алюмінієвих піддонів та нагрівають від 11 84923 20°С до 200°C в атмосфері сухого азоту зі швидкістю 5°С/хв. С тандартом слугує α-окис алюмінію. (6) Вимірювання розміру часток 0,1г часток суспендують у розчині 0,5г соєвого лецитину в 20мл n-гексану й вимірюють розмір часток нa вимірювальному приладі Microtrack HRA фірми Майкротрек ко. (7) Випробування на гігроскопічність 1г зразку точно відважують до бюкса (діаметр 5см), вкривають серветками та залишають у середовищі 60°С/BB 100% (вода/десикатор). За 24 години видаляють бюкс, ставлять його до середовища з кімнатною температурою та BB біля 30% (насичений водний розчин гексагідрату хлориду магнію/десикатор), залишають там на 24 години та вимірюють вміст води у зразку за методом Карла Фішера. (8) Твердотільна 13С-ЯМР спектрометрія Твердотільний 13С-ЯМР спектр вимірюють наступним чином. Вимірювальний прилад: твердотільний ЯМР спектрометр СМХ-360 фірми Кемагнетік інк. Комп'ютер: SPARC Station 2 фірми Сан майкросістемс Операційна система, програмне забезпечення: Solalis 1.1.1 Rev.B (UNIX), Spinsight Ver.2.5 Назва замірюваного імпульсу: метод TOSS (назва програми в апаратурі) з застосуванням методу CP/MAS. Ширинa замірюваного імпульсу: імпульс 90° в умовах комбінованої парності. Вимірювальна трубка: цирконієва, зовнішній діаметр 7,5мм, місткість 0,8мл Число обертів: 4250Гц (обертів за секунду) Час контакту: 1мс Час чекання: 20с Кратність: 512 разів Температура вимірювання: біля 25°C зовні вимірювальної трубки Зовнішній стандарт: метилова група (617.3) гексаметилбензолу. Далі винахід пояснюється докладніше на порівняльних прикладах, прикладах, зразках та прикладах виготовлення лікарських форм. Порівняльний приклад 1 19,4г 7-(4-хлорбутокси)-3,4-дігідрокарбостирілу та 16,2г 1-(2,3-діхлорфеніл)піперадин-1-гідрохлориду додають до розчину 8,39г карбонату калію у 140мл води та перемішують 3 години. Після реакції суміш охолоджують та відфільтровують осад кристалів. їх розчиняють у 350мл етилацетату й нагріванням зі зворотнім холодильником видаляють біля 210мл азеотропної водноетилацетатної суміші. Решту розчину о холоджують та відфільтровують осад кристалів. Кристали сушать 14 годин при 60°С й одержують 20,4г сирого аріпіпразолу (вихід 74,2%). 30г одержаного таким чином сирого аріпіпразолу перекристалізують з 450мл етанолу, як описано у викладеній заявці [Японії №191256/1990], і одержані кристали сушать 40 годин при 80°С, одержуючи кристалічний безводний аріпіпразол. Вихід становить 29,4г (98.0%). Точка топлення кристалів безводного аріпіпразолу - 140°С, що збігається з точкою топлення 12 кристалічного безводного аріпіпразолу, описаного у викладеній [заявці Японії №191256/1990]. Після 24-годинного перебування у десикаторі при вологості 100% і температурі 60°С продукт показує гігроскопічність 3,28% (див.таблицю далі). Порівняльний приклад 2 6930г проміжного сирого аріпіпразолу, одержаного у порівняльному прикладі 1, розчиняють при нагріванні у 138л етанолу з вмістом води 20% за способом, описаним у Працях 4-го японокорейсьного симпозіуму з техніки розділення, поступово (2-3 години) охолоджують до кімнатної температури, а потім заморожують до близько 0°С. Осад відфільтровують і одержують біля 7200г вологого гідрату аріпіпразолу. Одержані кристали сушать 30 годин при 80°С і одержують 6480г кристалів звичайного безводного аріпіпразолу (ви хід 93,5%). Точка топлення продукту становить 139,5°C. За методом Карла Фішера встановлено, що ці кристали безводні, вони містять лише 0,03% вологи. Після 24-годинного перебування у десикаторі при вологості 100% і температурі 60°С продукт показує гігроскопічність 1,78% (див.таблиці далі). Порівняльний приклад 3 820г проміжного вологого гідрату аріпіпразолу, одержаного у порівняльному прикладі 2, сушать 2 години при 50°С і одержують 780г кристалічного гідрату аріпіпразолу. За методом Карла Фішера він має вміст вологи 3,82%. Як видно з Фіг.6 опису за [заявкою 2003010503], термогравіметричний/ДТА аналіз показує ендотермічні піки при 75,0, 123,5 та 140,5°C. Оскільки обезводнювання починається біля 70°С, чітко вираженої точки топлення немає. Як видно на Фіг.7 опису за [заявкою 2003010503], порошковий рентгенодифракційний спектр гідрату аріпіпразолу. одержаного таким способом, показує характерні піки при 2θ=12,6°, 15,1°, 17,4°, 18,2°, 18,7°, 24,8° та 27,5°. Порошковий рентгенодифракційний спектр цього продукту збігається зі спектром гідрагу аріпіпразолу, представленого на 4-му японокорейському симпозіумі з техніки розділення. Порівняльний приклад 4 Готують таблетки з вмістом 15мг кристалів безводного аріпіпразолу типу І, одержаного у порівняльному прикладі 2. 525г кристалів безводного аріпіпразолу тип у І, 1995г лактози, 350г кукурудзяного крохмалю та 350г кристалічної целюлози засипають до сушарки-гранулятора киплячого шару (Flow coater FLO-5 фірми Фройнд індастріал) і перемішують там при псевдозріджуванні біля 3 хвилин при витраті повітря 3м 3/хв. с температурою на вході 70°С. Після того на гранульовані компоненти при псевдозріджуванні в таких само умовах набризкують біля 1400г водного розчину, одержуючи вологі гранули. Гранули сушать 15 хвилин при температурі повітря на вході 80°С. Одержані висушені гранули містять 4,3% води (вихід 99%). Висушені гранули розсіюють на ситі 710мкм. До розсіяних гранул примішують біля 1мас.% стеарату магнію, після чого подають на таблетувальну машину 12HUK фірми Кікусуй сейсакусьо. Одержані таблетки мають масу 95мг кожна. 13 84923 Вміст води у таблетках вимірюють за методом волюметричного титрування Карла Фишера, описаним у Японській фармакопеї, або за методом електричного кількісного титрування. Методика вимірювання вмісту води: Зразок (0.1-0,5г; у даному разі 1 таблетка) точно зважують і вимірюють вміст води на спеціальному приладі. Волюметричне титрування: Автоматичний прилад для вимірювання вмісту води, модель KF-06 фірми Міцубісі кемікл корп. Електричне кількісне титрування: Автоматичний мікроприлад для вимірювання вмісту води, модель AQ-7F фірми Хіранума сангьо; Автоматична установка випарювання води, модель LE-20S фірми Хіранума сангьо. Температура нагрівання: 165±10°С. Витрата азоту: біля 150мл/хв. Порівняльний приклад 5 Готують таблетки з вмістом 15мг кристалів безводного аріпіпразолу типу В. 4500г кристалів безводного аріпіпразолу типу В, 17100г лактози, 3000г кукурудзяного крохмалю та 3000г кристалічної целюлози засипають до сушарки-гранулятора киплячого шару (NEWMARUMERIZER NQ-500 фірми Фудзі Паудал ко.лтд) і перемішують там при псевдозріджуваняі біля 3 хвилин при витраті повітря 10-15м 3/хв. с температурою на вході 70°С. Після того на гранульовані компоненти при псевдозріджуванні в таких само умовах набризкують біля 12000г 5% водного розчину гідроксіпропилцелюлози, одержуючи вологі гранули. Гранули суша ть 28 хвилин при температурі повітря на вході 85°C. Одержані висушені гранули містять 3,8% води (виміряно за методикою, наведеною в порівняльному прикладі 4) (вихід 96%). Висушені гранули розсіюють на ситі 850мкм. До розсіяних гранул примішують біля 1мас.% стеарату магнію, після чого подають на таблетувальну машину 12 HUK фірми Кікусуй сейсакусьо. Одержані таблетки мають масу 95мг кожна. Таблиця Зразок Порів няльний приклад 1 Порів няльний приклад 2 Початковий Вміст в ологи вміст вологи, через 24 годи% ни, % 0,04 3,28 0,04 1,78 Приклад 1 a) 10г кристалічного безводного аріпіпразолу типу І, одержаного у порівняльному прикладі 2, вміщують до круглого лотка з нержавіючої сталі діаметром 80мм та нагрівають до біля 170°С до повного розтоплення. При охолодженні розплаву утворюється твердий світло-коричневий корок. Його зскрібають з лотка і одержують 9,8г склистого безводного аріпіпразолу (вихід 98%). Одержаний склистий продукт відрізняється відсутністю помітних піків на порошковій рентгенограмі (див.Фіг.6). За даними термогравіметрії/ДТА (швидкість нагрівання 5°С/хв.), які наведені на Фіг.5. екзотермічний пік у кристалічного безводного аріпіпразолу 14 типу В спостерігається біля 86,5°C. Між тим ендотермічний пік у кристалічного безводного аріпіпразолу типу В завдяки розтопленню має місце біля 140,1°C. b) Склистий безводний аріпіпразол, одержаний у прикладі 1-а, вміщують до зачиненої посудини та дають стояти при кімнатній температурі протягом біля 6 місяців. Одержують 25г кристалічного безводного аріпіпразолу типу G, який змінює колір з світло-коричневого на білий (вихід 100%). Точка топлення 138-139°C. Кристалічний безводній аріпіпразол типу G, одержаний у такий спосіб, має ендотермічну криву, яка по суті збігається з кривою термогравіметрії/ДТА (швидкість нагрівання 5°С/хв.), наведеною на Фіг.1. Зокрема, вона відрізняється наявністю ендотермічного піку біля 141,0°С та екзотермічного піку біля 122,7°C. Кристалічний безводний аріпіпразол типу G, одержаний у такий спосіб, має 1Н-ЯМР спектр, який по суті збігається з 1Н-ЯМР (DMSO-d6, TMS) спектром, наведеним на Фіг.2. Зокрема, він мас характерні піки при 1,55-1,63ч. на млн. (m, 2H), 1,68-1,78ч. на млн. (m, 2Н). 2,35-2,46ч. на млн. (m, 4H), 2,48-2,56ч. на млн. (m, 4H+DMSO), 2,78ч. на млн. (t, J=7,4Гц, 2Н), 2,97ч. на млн. (brt, J=4,6Гц, 4Н), 3,92ч. на млн. (t, J=6,3Гц, 2Н), 6,43ч. на млн. (d, J=2,4Гц, 1H), 6,49ч. на млн. (dd, J=8,4Гц, J=2,4Гц, 1H), 7,04ч. на млн. (d, J=8,1 Гц. 1H), 7,117,17ч. на млн. (m, 1H), 7,28-7,32ч. на млн. (m, 2H) та 10,00ч. на млн. (s, 1H). Кристалічний безводний аріпіпразол типу G, одержаний у такий спосіб, має порошковий рентгенодифракційний спектр, який по суті збігається зі спектром, наведеним на Фіг.3. Зокрема, він має характерні піки порошкової рентгенодифракції при 2θ=10,1°, 12,8°, 15,2°, 17,0°. 17,5°, 19,1°, 20,1°, 21,2°, 22,4°, 23,3°, 24,5° та 25,8°. Кристалічний безводний аріпіпразол типу G, одержаний у такий спосіб, має ІЧ спектр, який по суті збігається з наведеним на Фіг.4 ІЧ (KBr) спектром. Зокрема, він має чіткі інфрачервоні смуги вбирання при 2942, 2813, 1670, 1625, 1377, 1195, 962 та 787см -1. Приклад 2 a) Підготовка гранул таблеток з вмістом по 30мг кристалічного безводного аріпіпразолу до податкової сушки Готують таблетки з вмістом 15мг кристалів безводного аріпіпразолу типу І, одержаного у порівняльному прикладі 2. 1500г кристалів безводного аріпіпразолу типу В, 5700г лактози, 1000г кукурудзяного крохмалю та 1000г кристалічної целюлози засипають до сушарки-гранулятора киплячого шару (Flow coater FLO5M фірми Фройнт сангьо к.к.) і перемішують там при псевдозріджуванні біля 3 хвилин при витраті повітря 3-4м 3/хв. с температурою на вході 60°С. Після того на гранульовані компоненти при псевдозріджуванні в таких само умовах набризкують біля 4000г водного розчину гідроксіпропилцелюлози, одержуючи вологі гранули. Гранули сушать 20 хвилин при температурі повітря на вході 85°C. Одержані висушені гранули містять 3,8% води 15 84923 (виміряно за методикою, наведеною у порівняльному прикладі 4). b) 4кг висушених гранул, одержаних у прикладі 2-а, класифікують на млині Fiore F-0 фірми Токудзю корп. 3кг класифікованих гранул засипають до сушарки-гранулятора киплячого шару (Flow eoater FLO-5M фірми Фройнд індастріал ко.лтд.) і сушать там 2 години при витраті повітря 2 mVxb с температурою на вході 85°C. Одержані висушені гранули містять 3,6% води (виміряно за методикою, наведеною у порівняльному прикладі 4). До розсіяних гранул примішують біля 1мас.% стеарату магнію, після чого подають на таблетувальну машину моделі Virgo фірми Кікусуй сейсакусьо. Одержані таблетки мають масу 190мг кожна. c) 3кг висушених гранул, одержаних у прикладі 2-а, засипають до вакуумної сушарки-гранулятора (модепі VG-50 фірми Кікусуй сейсакусьо ко.лтд.) і сушать там 1 годин}' під зниженим тиском 5 торр при температурі сорочки 70°С. Одержані висушені гранули містять 1,1% води (виміряно за методикою, наведеною у порівняльному прикладі 4) До розсіяних гранул примішують біля 1мас.% стеарату магнію, після чого подають на таблетувальну машину моделі Virgo фірми Кікусуй сейсакусьо. Одержані таблетки мають масу 190мг кожна. Приготування зразка Кристали безводного аріпіпразолу G 5мг Крохмаль 131мг Стеарат магнію 4мг Лактоза 60мг Разом 200мг. Таблетки вищенаведеного складу готують відомим способом. Приклади складання композиції У нижченаведених прикладах використовується лікарська субстанція аріпіпразолу, одержана шляхом помелу або подрібнення звичайного гідрату аріпіпразолу з наступним його нагріванням для переведення до безводної форми (Кристали безводного аріпіпразолу В). Приклад складання композиції 1 Швидкорозчинні таблетки готують наступним чином: Внутрішні компоненти гранул: Компонент Ксилітол (300) Ксилісорб Авіцел РН 102 Силікат кальцію Кросповідон Аморфний діоксид кремнію Аспартаме Есенція дикої вишні Винна кислота Ацесульфам К Стеарат магнію Разом маса Частка, Mг на мас. % таблетку 26 52 12 24 43,35 86,7 3 6 2 4 2 4 0,15 0,3 2 4 2 4 0,25 0,5 92,75 185,5 16 Компоненти, крім стеарату магнію, гомогенізують у звичайному змішувачі у геометричних пропорціях по 5 хвилин кожний до повної гомогенізації. Потім додають стеарат магнію й перемішують суміш ще 3 хвилини. Суміш пресують під тиском 30-35кгс/см 2 у звичайному ущільнювачі з отвором такої форми, що ущільнена маса виходить звідти у вигляді стрічок. Стрічки класифікують на ситі 30 меш (600мкм), утворюючи стабільні гранули розміром 150-400мкм Компоненти поза гранул: Компонент Гранули Авіцел PH 200 Кросповідон Стеарат магнію Разом маса Частка, мас. % 92,75 3 4 0,25 100 Mг на таблетку 185,5 6 8 0,5 200 Гранули вміщують до змішувача, подають туди Авіцел PH 200 та кросповідон і перемішують 5 хвилин. Після того додають стеарат магнію, перемішують ще 3 хвилини та одержують кінцеву композицію. Пресовані з неї таблетки мають міцність на зруйнування 2,3кПа та руйнуються за 10с у 5мл води. Змішування композиції показує відмінну текучість та відсутність проблем з потьоками, закозлюванням та налипанням. Встановлено, що застосування Авіцелу PH 102 у складі гранул та Авіцелу PH 200 як компонента поза гранул поліпшує якість готових таблеток. Приклад складання композиції 2 Швидкорозчинні таблетки, що містять комбінацію двох сортів силікату кальцію, готують наступним чином: Внутрішні компоненти гранул: Компонент Частка, мас. % 26 12 Ксилітол (300) Ксилісорб Авіцел РН 102 Силікат кальцію (кристаліч33,35 ний, альфа-триклинний) Г\берсорб 600 NF (аморфнкй 10 силікат кальцію) Кросповідон 3 Аморфний діоксид кремнію 2 Аспартаме 2 Есенція дикої вишні 0,15 Винна кислота 2 Ацесульфам K 2 Стеарат магнію 0,25 Разом маса 92,75 Mг на таблетку 52 24 66,7 20 6 4 4 0,3 4 4 0,5 185,5 Компоненти, крім стеарату магнію, гомогенізують у звичайному змішувачі у геометричних пропорціях по 5 хвилин кожний до повної гомогенізації. Потім додають стеарат магнію й перемішують суміш ще 3 хвилини. Суміш пресують та розсіюють, утворюючи стабільні гранули за способом, описаним у прикладі складання композиції 1. 17 84923 18 Компоненти поза гранул: Компонент Гранули Авіцел PH 200 Кросповідон Стеарат магнію Разом маса Частка, Mг на мас. % таблетку 92,75 185,5 3 6 4 8 0,25 0,5 100 200 Гранули вміщують до змішувача, подають туди Авіцел PH 200 та кросповідон і перемішують 5 хвилин. Після того додають стеарат магнію, перемішують ще 3 хвилини та одержують кінцеву композицію. Пресовані з неї таблетки мають міцність на зруйнування 2,окПа та руйнуються за 10с у 5мл води. Приклад складання композиції 3 Швидкорозчинні таблетки, що містять аріпіпразол - діючий засіб проти шизофренії - готують наступним чином: Внутрішні компоненти гранул: Компонент Аріпіпразол Ксилітол (300) Ксилісорб Авіцел РН 102 Силікат кальцію Кросповідон Аморфний діоксид кремнію Аспартаме Есенція дикої вишні Винна кислота Ацесульфам K Стеарат магнію Разом маса Частка, Mг на мас. % таблетку 15 30 25 50 6 12 37 74 3 6 2 6 2 6 0,15 0,3 2 4 2 4 0,25 0,5 94,4 188,5 Компоненти, крім стеарату магнію, гомогенізують у звичайному змішувачі у геометричних пропорціях по 5 хвилин кожний до повної гомогенізації. Потім додають стеарат магнію й перемішують суміш ще 3 хвилини. Суміш пресують та розсіюють, утворюючи стабільні гранули за способом, описаним у прикладі складання композиції 1. Компоненти поза гранул: Компонент Гранули Авіцел PH 200 Кросповідон Стеарат магнію Разом маса Частка, мас. % 94,4 1,1 4 0,5 100 Mг на таблетку 188,8 2,2 8 1 200 Гранули вміщують до змішувача, подають туди Авіцел PH 200 та кросповідон і перемішують 5 хвилин. Після того додають стеарат магнію, перемішують ще 3 хвилини та одержують кінцеву композицію. Пресовані з неї таблетки мають міцність на зруйнування 2,0кПа та руйнуються за 10с у 5мл води. Приклад складання композиції 4 Швидкорозчинні таблетки, що містять аріпіпразол, готують наступним чином: Внутрішні компоненти гранул: Компонент Аріпіпразол Ксилітол (300) Ксилісорб Авіцел PH 102 Силікат кальцію (кристалічний, альфа-триклинний) Кросповідон Аморфний діоксид кремнію Аспартаме Есенція дикої вишні Винна кислота Ацесульфам K Стеарат магнію Разом маса Частка, Mг на мас. % таблетку 0,5 1 27 54 12 24 42 3 2 2 0,15 2 2 0,25 92,7 84 6 4 4 0,3 4 4 0,5 185,8 Компоненти, крім стеарату магнію, гомогенізують у звичайному змішувачі у геометричних пропорціях по 5 хвилин кожний до повної гомогенізації. Потім додають стеарат магнію й перемішують суміш ще 3 хвилини. Суміш пресують та розсіюють, утворюючи стабільні гранули за способом, описаним у прикладі складання композиції 1. Компоненти поза гранул: Компонент Гранули Авіцел PH 200 Кросповідон Стеарат магнію Разом маса Частка, мас. % 92,9 2,6 4 0,5 100 Mг на таблетку 185,8 5,2 8 1 200 Гранули вміщують до змішувача, подають туди Авіцел PH 200 та кросповідон і перемішують 5 хвилин. Після того додають стеарат магнію, перемішують ще 3 хвилини та одержують кінцеву композицію. Пресовані з неї таблетки мають міцність на зруйнування 2,3кПа та руйнуються за 10с у 5мл води. 19 84923 20 21 Комп’ютерна в ерстка Т. Чепелев а 84923 Підписне 22 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystal anhydrous arypiprasole g, a method for its obtaining, pharmaceutical compositions, containing arypiprasole g, and method for its obtaining
Автори англійськоюBando Takuji, Aoki Satoshi, Kawasaki Junichi, Ishigami Makoto, Taniguchi Youichi, Yabuuchi Tsuyoshi, Fujimoto Kiyoshi, Nishioka Yoshihiro, Kobayashi Noriyuki, Fujimura Tsutomu, TAKAHASHI, Masanori, Abe Kaoru, Nakagawa Tomonori, Sinhama Koiti, Utsumi Naoto, Tominaga Michiaki, Ooi Yoshihiro, Yamada Shohei, Tomikawa Kenji
Назва патенту російськоюКристаллический безводный арипипразол g, способ его получения, фармацевтическая композиция, содержащая арипипразол g, и способ ее получения
Автори російськоюБандо Такудзи, Аоки Сатоси, Кавасаки Дзюньити, Исигами Макото, Танигути Юити, Ябуути Чуйоси, Фудзимото Кийоси, Нисиока Йосихиро, Кобаяси Нориюки, Фудзимура Цутому, Тахакаси Масанори, Абе Каору, Накагава Томонори, Синхама Коити, Уцуми Наото, Томинага Митиаки, Оой Йосихиро, Ямада Сьохей, Томикава Кендзи
МПК / Мітки
МПК: C07D 215/227, A61K 31/496, A61P 25/18
Мітки: арипіпразол, безводний, спосіб, містить, одержання, фармацевтична, кристалічний, композиція
Код посилання
<a href="https://ua.patents.su/11-84923-kristalichnijj-bezvodnijj-aripiprazol-g-sposib-jjogo-oderzhannya-farmacevtichna-kompoziciya-shho-mistit-aripiprazol-g-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Кристалічний безводний арипіпразол g, спосіб його одержання, фармацевтична композиція, що містить арипіпразол g, та спосіб її одержання</a>
Попередній патент: Система для обертання продуктів, що мають неправильну геометричну форму, система для транспортування продуктів та спосіб обертання продукту
Наступний патент: Арипіпразол f, спосіб його одержання, фармацевтична композиція, що містить арипіпразол f, та спосіб її одержання
Випадковий патент: Спосіб лікування гіпертонічної хвороби