Трансдермальна йонтофоретична система для введення сполук піперазиніл-2(3н)-бензоксазолону
Номер патенту: 87493
Опубліковано: 27.07.2009
Автори: Тоніссен Хендрік, Боустра Йоганна А., Вербаан Фредерік Й., Конживарам Раджкумар В., Вемулапаллі Вишватедж, Банга Аджай К., ван ден Берг Дірк-Ян, ван Шаренбург Густав Й.М.
Формула / Реферат
1. Застосування принаймні однієї сполуки загальної формули
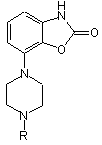 , (I)
, (I)
де R - метил або бензил, та її фармацевтично прийнятних солей або суміші будь-яких зазначених компонентів, а за бажанням також фармацевтично прийнятного електроліту для виготовлення пристрою для йонтофоретичного лікування хвороби Паркінсона та синдрому втомлених ніг.
2. Застосування за п. 1, де зазначений йонтофоретичний пристрій має ємність, яка містить сполуку формули І або композицію на її основі, а за бажанням також фармацевтично прийнятний електроліт.
3. Застосування за будь-яким з пп. 1, 2, де сполука формули І та електроліт, якщо він присутній, розчинені у носії, що являє собою водний розчин або гель.
4. Застосування за п. 3, де йонтофоретичний пристрій додатково містить мембрану, яка відокремлює носій від шкіри під час трансдермального введення шляхом йонтофорезу.
5. Застосування за будь-яким з пп. 1-4, у якому під час йонтофоретичного введення
a) сполукою формули І є 7-(4-метил-1-піперазиніл)-2(3Н)-бензоксазолон або його фармацевтично прийнятна сіль;
b) концентрація зазначеної сполуки варіює між 0,1 - 90 мг/мл;
c) електроліт, що забезпечує Сl-1, спочатку присутній в кількості між 0,005 та 2 ммоль;
d) прийнятний під час даного етапу застосування електричний струм є між 0,1 та 40 Вольт;
е) густина струму під час даного етапу застосування знаходиться між 0,001 та 1 мА/см3;
f) рівень рН варіює від 3,0 до 7,5.
6. Застосування за п. 5, де
а) сполукою формули І є 7-(4-метил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль моногідрохлориду;
b) концентрація зазначеної сполуки варіює між 1 0 - 7 5 мг/мл;
c) рівень рН варіює від 5,0 до 6,0.
7. Застосування за будь-яким з пп. 1-4, у якому під час етапу йонтофоретичного введення
а) сполукою формули 1 є 7-(4-бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його фармацевтично прийнятна сіль;
b) концентрація зазначеної сполуки варіює між 0,1 - 90 мг/мл;
c) електроліт, що забезпечує Сl-1, спочатку присутній в кількості між 0,005 та 2 ммoль;
d) прийнятний під час даного етапу застосування електричний струм знаходиться між 0,1 та 40 Вольт;
е) густина струму під час даного етапу застосування знаходиться між 0,001 та 1 мА/см3;
f) рівень рН варіює від 3,0 до 7,5.
8. Застосування за п. 7, у якому
a) сполукою формули І є 7-(4-бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль мономезилату;
b) концентрація зазначеної сполуки варіює між 1 - 30 мг/мл;
c) рівень рН варіює від 3,5 до 6,0.
9. Йонтофоретична система для введення сполуки через шкіру, яка містить
(а) пристрій для трансдермального введення, що прикладається до шкіри і містить перший електрод та другий електрод та ємність із сполукою загальної формули І або її композицією, а за бажанням також з фармацевтично прийнятним електролітом, електрично з’єднану з першим та другим електродами;
(b) засіб для приєднання джерела електроенергії до першого та другого електродів і
(с) за бажанням мембрану, що закриває ємність.
10. Йонтофоретична система за п. 9, де сполука являє собою 7-(4-метил-1-піперазиніл)-2(3Н)-бензоксазолон або його фармацевтично прийнятну сіль.
11. Йонтофоретична система за п. 9, де зазначена сполука являє собою 7-(4-бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його фармацевтично прийнятну сіль.
12. Йонтофоретична система за п. 9, де зазначена ємність містить фармацевтично прийнятний електроліт та 7-(4-метил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль моногідрохлориду або її композицію у розчині з рН від 5,0 до 6,0.
13. Йонтофоретична система за п. 12, де зазначений розчин має рН приблизно 5,5.
14. Йонтофоретична система за п. 9, де зазначена ємність містить фармацевтично прийнятний електроліт та 7-(4-бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль мономезилату або її композицію у розчині з рН від 3,5 до 6,0.
15. Йонтофоретична система за п. 14, де зазначений розчин має рН приблизно 4,0.
16. Ампула, здатна заповнювати або поповнювати йонтофоретичну систему, яка містить 7-(4-метил-1-піперазиніл)-2(3Н)-бензоксазолон або його фармацевтично прийнятну сіль, або їх композицію, а за бажанням також фармацевтично прийнятний електроліт.
17 Ампула за п. 16, яка містить 7-(4-метил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль моногідрохлориду та зазначений вибірковий фармацевтично прийнятний електроліт у розчині з рН від 5,0 до 6,0.
18 Ампула за будь-яким з пп. 16, 17, яка містить 7-(4-метил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль моногідрохлориду у розчині з концентрацією від 10 до 75 мг/мл.
19. Ампула, здатна заповнювати або поповнювати йонтофоретичну систему, яка містить 7-(4-бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його фармацевтично прийнятну сіль, або їх композицію, а за бажанням також фармацевтично прийнятний електроліт.
20. Ампула за п. 19, яка містить 7-(4-бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль мономезилату та зазначений вибірковий фармацевтично прийнятний електроліт у розчині з рН від 3,5 до 6,0.
21. Ампула за будь-яким з пп. 19, 20, яка містить 7-(4-бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль мономезилату у розчині з концентрацією від 1до 30 мг/мл.
22. Набір, що містить
1) йонтофоретичну систему для введення сполуки крізь шкіру, яка містить
(а) пристрій для трансдермального введення, що прикладається до шкіри й містить перший електрод та другий електрод, та ємність, придатну для зберігання композиції діючої сполуки;
(b) засіб для приєднання джерела електроенергії до першого та другого електродів і
(с) за бажанням мембрану, що закриває ємність під час перевезення, зберігання та/або застосування;
2) одну або кілька ампул за будь-яким з пп. 16-21.
23. Набір, який містить одну або кілька ампул за будь-яким з пп. 16-21.
Текст
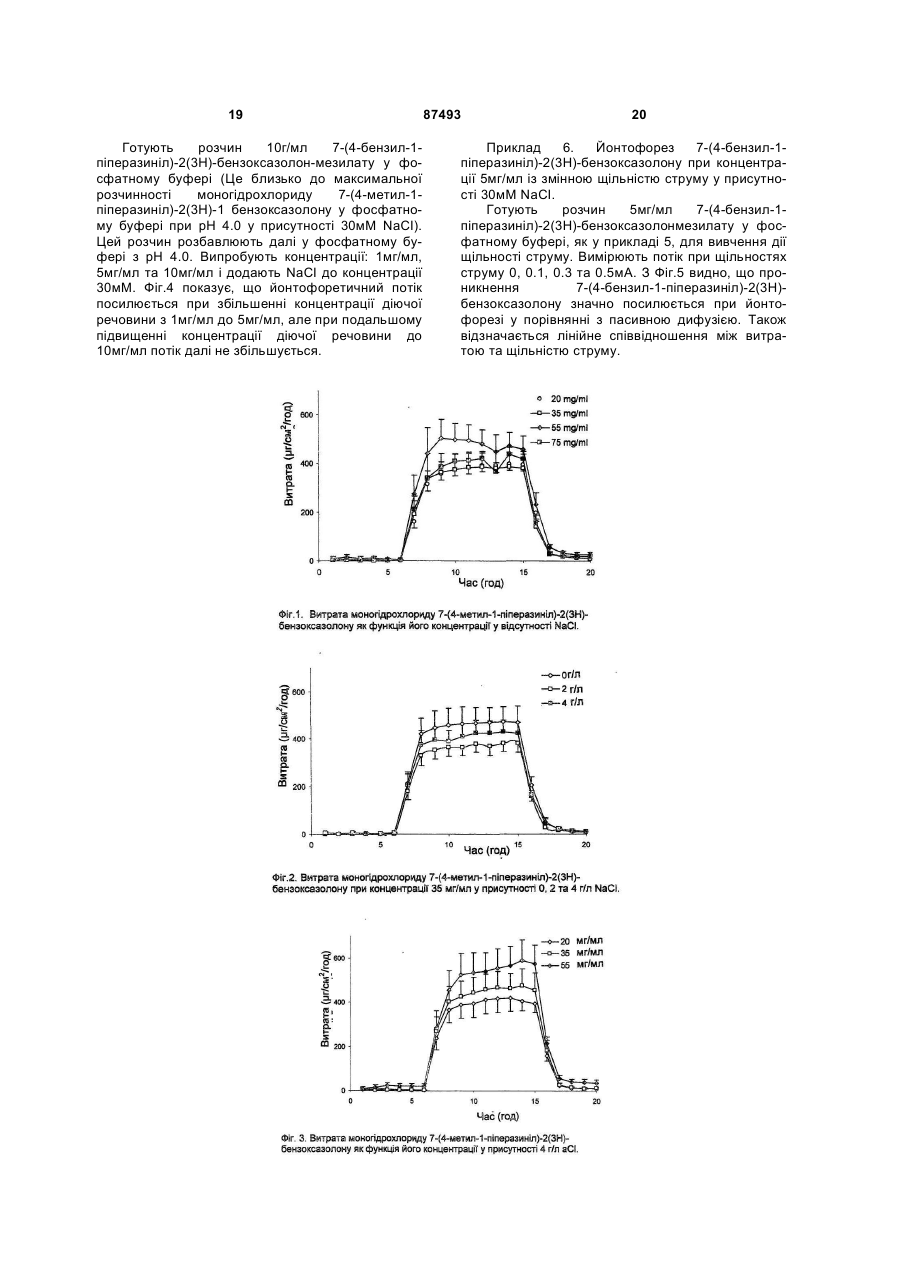
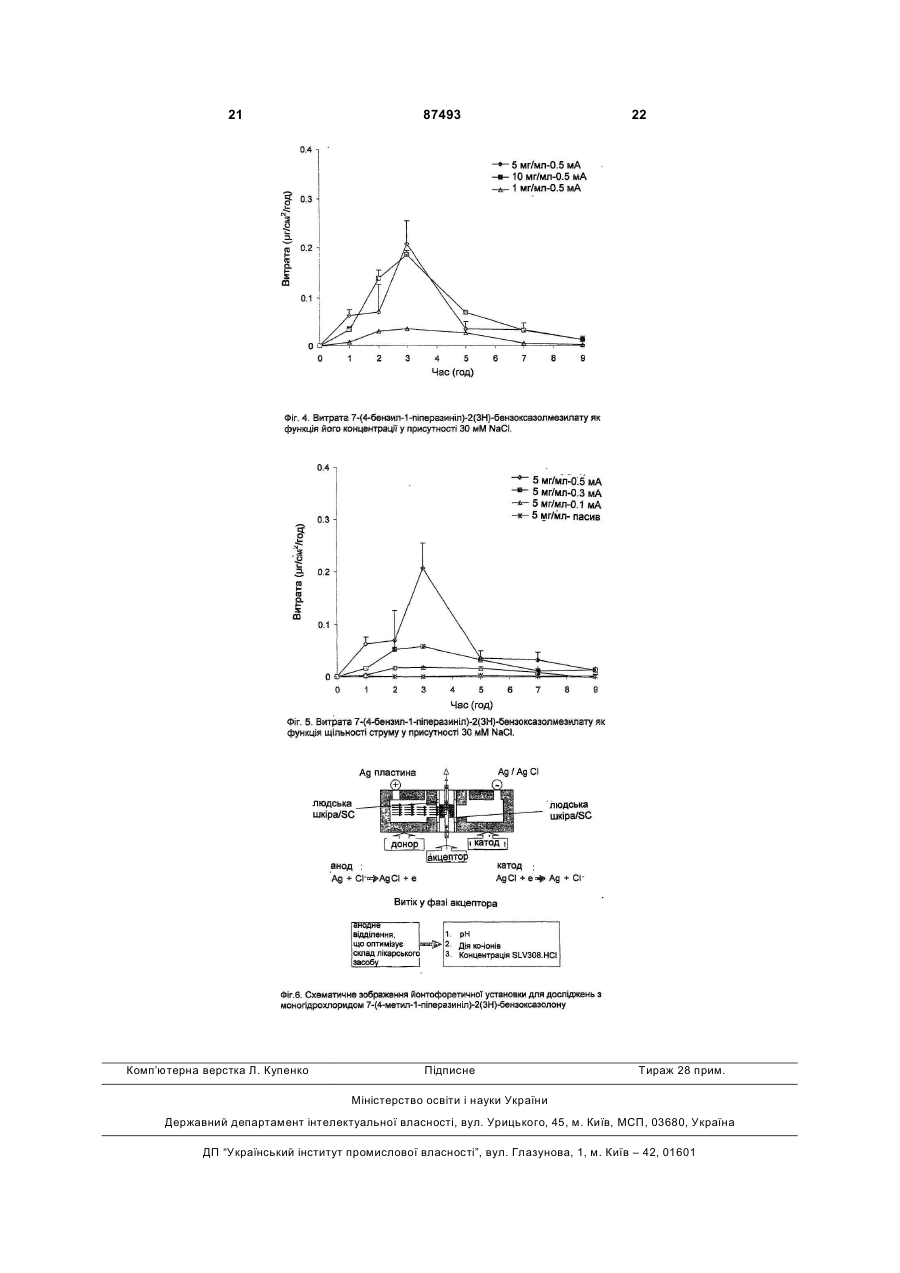
1. Застосування принаймні однієї сполуки загальної формули H N O O 2 (19) 1 3 87493 4 b) концентрація зазначеної сполуки варіює між 0,1 - 90 мг/мл; c) електроліт, що забезпечує Сl-1, спочатку присутній в кількості між 0,005 та 2 ммoль; d) прийнятний під час даного етапу застосування електричний струм знаходиться між 0,1 та 40 Вольт; е) густина струму під час даного етапу застосування знаходиться між 0,001 та 1 мА/см3; f) рівень рН варіює від 3,0 до 7,5. 8. Застосування за п. 7, у якому a) сполукою формули І є 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолон або його сіль мономезилату; b) концентрація зазначеної сполуки варіює між 1 30 мг/мл; c) рівень рН варіює від 3,5 до 6,0. 9. Йонтофоретична система для введення сполуки через шкіру, яка містить (а) пристрій для трансдермального введення, що прикладається до шкіри і містить перший електрод та другий електрод та ємність із сполукою загальної формули І або її композицією, а за бажанням також з фармацевтично прийнятним електролітом, електрично з’єднану з першим та другим електродами; (b) засіб для приєднання джерела електроенергії до першого та другого електродів і (с) за бажанням мембрану, що закриває ємність. 10. Йонтофоретична система за п. 9, де сполука являє собою 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолон або його фармацевтично прийнятну сіль. 11. Йонтофоретична система за п. 9, де зазначена сполука являє собою 7-(4-бензил-1-піперазиніл)2(3Н)-бензоксазолон або його фармацевтично прийнятну сіль. 12. Йонтофоретична система за п. 9, де зазначена ємність містить фармацевтично прийнятний електроліт та 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолон або його сіль моногідрохлориду або її композицію у розчині з рН від 5,0 до 6,0. 13. Йонтофоретична система за п. 12, де зазначений розчин має рН приблизно 5,5. 14. Йонтофоретична система за п. 9, де зазначена ємність містить фармацевтично прийнятний електроліт та 7-(4-бензил-1-піперазиніл)-2(3Н)бензоксазолон або його сіль мономезилату або її композицію у розчині з рН від 3,5 до 6,0. 15. Йонтофоретична система за п. 14, де зазначений розчин має рН приблизно 4,0. 16. Ампула, здатна заповнювати або поповнювати йонтофоретичну систему, яка містить 7-(4-метил1-піперазиніл)-2(3Н)-бензоксазолон або його фармацевтично прийнятну сіль, або їх композицію, а за бажанням також фармацевтично прийнятний електроліт. 17 Ампула за п. 16, яка містить 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолон або його сіль моногідрохлориду та зазначений вибірковий фармацевтично прийнятний електроліт у розчині з рН від 5,0 до 6,0. 18 Ампула за будь-яким з пп. 16, 17, яка містить 7(4-метил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль моногідрохлориду у розчині з концентрацією від 10 до 75 мг/мл. 19. Ампула, здатна заповнювати або поповнювати йонтофоретичну систему, яка містить 7-(4-бензил1-піперазиніл)-2(3Н)-бензоксазолон або його фармацевтично прийнятну сіль, або їх композицію, а за бажанням також фармацевтично прийнятний електроліт. 20. Ампула за п. 19, яка містить 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолон або його сіль мономезилату та зазначений вибірковий фармацевтично прийнятний електроліт у розчині з рН від 3,5 до 6,0. 21. Ампула за будь-яким з пп. 19, 20, яка містить 7(4-бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його сіль мономезилату у розчині з концентрацією від 1до 30 мг/мл. 22. Набір, що містить 1) йонтофоретичну систему для введення сполуки крізь шкіру, яка містить (а) пристрій для трансдермального введення, що прикладається до шкіри й містить перший електрод та другий електрод, та ємність, придатну для зберігання композиції діючої сполуки; (b) засіб для приєднання джерела електроенергії до першого та другого електродів і (с) за бажанням мембрану, що закриває ємність під час перевезення, зберігання та/або застосування; 2) одну або кілька ампул за будь-яким з пп. 16-21. 23. Набір, який містить одну або кілька ампул за будь-яким з пп. 16-21. Цей винахід стосується трансдермального йонтофоретичного введення фармацевтичних сполук загальної формули (І) де R - метил, етил, етил, заміщений одним або кількома атомами фтору, або цикло-(С3-7)алкілметил, який може бути вибірково заміщений одним або кількома атомами фтору, або бензил, 2-піриділметил, 3-піриділметил або 4піриділметил, який може бути вибірково заміщений одним або кількома замісниками, обраними зпоміж галогену, гідроксилу, ціану, аміну, моно- або ді-С1-3-алкіламіну, С1-3-алкокси, CF3, OCF3, SCF3, С1-4-алкілу, d.3-алкілсульфоніламіну, фенілу, фуранілу та тієнілу і де зазначені замісники феніл, 5 фураніл та тієніл можуть у свою чергу бути заміщені 1-3 замісниками з групи гідрокси, галоген, С1-4-алкокси, С1-4-алкіл, ціан, амінкарбоніл, моноабо ді-С1-4-алкіламінкарбоніл, та фармацевтично прийнятні солі і проліки цих сполук. Зокрема, винахід стосується трансдермального йонтофоретичного введення фармацевтичних сполук загальної формули (І), де R - метил, етил, етил, заміщений одним або кількома атомами фтору, або цикло-(С37)-алкілметил, який може бути заміщений одним або кількома атомами фтору, або бензил, 2піриділметил, 3-піриділметил або 4-піриділметил, який може бути заміщений одним або кількома замісниками, обраними з-поміж галогену, гідроксилу, ціану, аміну, моно- або ді-С1-3-алкіламіну, C1-3алкокси, CF3, OCF3, SCF3, С1-4-алкілу, С1-3алкілсульфоніламіну. Точніше, винахід стосується трансдермального йонтофоретичного введення фармацевтичних сполук загальної формули (І), де R - метил або бензил, який може бути вибірково заміщений 1-3 замісниками з групи гідроксил та галоген. Переважно у цьому винаході вживаються сполуки, де R метил або бензил. Ще точніше, винахід стосується застосування принаймні однієї сполуки загальної формули (І), як визначено вище, або їх сумішей, для одержання йонтофоретичного пристрою для лікування больових розладів, зокрема, синдрому втомлених ніг, та розладів центральної нервової системи, зокрема, хвороби Паркінсона. Винахід також стосується застосування сполук загальної формули (І) для одержання (а) розчину, який застосовується у пристрої для трансдермального ведення шляхом йонтофорезу або у наборах капсул, що містять сполуку, готову для застосування у зазначеному пристрої, (b) пристрою, придатного для трансдермального введення шляхом ионтофорезу, причому зазначений трансдермальний пристрій містить ємкість, де знаходиться сполука формули І або композиція на її основі, а за бажанням також фармацевтично прийнятний електроліт, причому такий пристрій може застосовуватися у способі регулювання характеристики введення фармацевтичних сполук загальної формули (І) та композицій на їх основі, та застосування таких регульованих характеристик введення при лікуванні больових розладів, зокрема, синдрому втомлених ніг, та розладів центральної нервової системи, зокрема, хвороби Паркінсона. Передумови створення винаходу Сполуки загальної формули І, як визначено вище, є відомі з WO00/29397 та WO01/85725. Ці сполуки виявляють мінливу дію як часткові агоністи або агоністи рецептора допаміну D2, а також є агоністами рецептора 5НТ1А. Ці різноманітні властивості визначають цінність сполук для лікування уражень та розладів центральної нервової системи, спричинених розладами допамінергійних або серотонергійних систем, зокрема, хворобою Паркінсона або синдромом втомлених ніг. У певних випадках, наприклад, коли оральне введення або ін'єкція тієї чи іншої фармацевтично активної сполуки (також званої лікарським препаратом) виявляється неефективним або неприйнятним внаслідок поганого засвоєння у гастроенте 87493 6 ральному тракті, болісного першого прийому, болю та дискомфорту хворого або інших бічних ефектів чи недоліків, трансдермальне введення може виявитися найкращим способом доставки такої сполуки до організму. Це має місце, наприклад, при хворобі Паркінсона, коли препарат треба увести хворим, які знаходяться уві сні, у коматозному або анестезованому стані. Далі, з'являється усе більше доказів, що тривала допамінова стимуляція дозволяє уникнути проблем, пов'язаних з неоднаковим дозуванням, і що безперервне введення препарату знижує частоту періодів загострення (P. Niall and W.H. Oertel, Congress Report of 7th International Congress of Parkinson's Disease and Movement Disorders, Miami, Florida, November 1014, 2002). Тим не менш, трансдермальне введення теж має недоліки, оскільки не завжди вдається забезпечити засвоєння ліків крізь шкіру. Йонтофоретичне трансдермальне введення це введення іонів або розчинних солей фармацевтичних діючих сполук до тканин тіла під дією прикладеного електричного поля. Огляди особливостей та переваг йонтофоретичних систем трансдермального введення у порівнянні з пасивними трансдермальними системами, а також іншими засобами введення лікарських сполук до кровообігу див. О. Wong, "Iontophoresis: Fundamentals," у Drugs Pharm. Sci. (1994), 62 (Drug Permeation Enhancement), 219-46 (1994); P. Singh et al., "Iontophoresis in Drug Delivery: Basic Principles and Applications", Critical Reviews in Therapeutic Drug Carrier Systems, 11 (2 & 3): 161213 (1994); та Ajay K. Banga, Electrically Assisted Transdermal and Topical Drug Delivery, Taylor and Francis Group Ltd., London UK, 1998, ISBN 0-74840687-5. У певних випадках, коли трандермальне введення за допомогою наліпок виявляється неефективним або неприйнятним внаслідок поганої проникності шкіри, завдяки якій доводиться робити надто великі наліпки, йонтофоретичне трансдермальне введення може дуже ефективно доставляти таку сполуку до організму. Найважливішою перевагою йонтофоретичного трансдермального введення є те, що можна точно регулювати кількість препарату, що вводиться, і поступово привчати хворих до певних доз препарату протягом, скажімо, кількох тижнів. Незважаючи на ці переваги, йонтофоретичні методи мають обмеження, оскільки характеристика введення цілком залежить від виду препарату, що вводиться. Хоча проведено чимало експериментів з йонтофоретичного введення різноманітних діючих сполук, фахівець часто не має інформації, що дозволяла б індивідуально підібрати стратегію введення того чи іншого препарату. Оскільки виявилися великі труднощі з виготовленням наліпок такого розміру, щоб забезпечити введення сполук загальної формули (І), існує потреба розроблення способу йонтофоретичного введення таких сполук, який забезпечував би змінну швидкість доставки зазначених сполук до організму у залежності від індивідуальних особливостей лікування. 7 Сутність винаходу Винахід стосується йонтофоретичної трансдермальної технології, яка забезпечує проникнення сполук загальної формули (І) та композицій на їх основі крізь людську шкіру. Зокрема, метою винаходу є забезпечення використання сполуки загальної формули (І), її фармацевтично прийнятних солей та проліків у композиції для трансдермального введення шляхом ионтофорезу, причому зазначена композиція містить сполуку формули І, а за бажанням також фармацевтично прийнятний електроліт. Виготовлена композиція є придатна для використання у пристрої для трансдермального введення шляхом йонтофорезу при лікуванні хвороби Паркінсона та синдрому втомлених ніг. Більш конкретно, метою винаходу є забезпечення використання сполук загальної формули (І) та їх фармацевтично прийнятних солей та проліків при виготовленні пристрою, придатного для трансдермального введення шляхом йонтофорезу при лікуванні хвороби Паркінсона та синдрому втомлених ніг, причому зазначений трандермальний пристрій містить ємкість із сполукою формули і або композицією на її основі, а за бажанням також фармацевтично прийнятний електроліт. Коли цей пристрій прикладається до шкіри живого тіла і електричний струм пропускається крізь шкіру, сполуки загальної формули (І) та їх фармацевтично прийнятні солі та проліки надходять крізь шкіру до організму. Далі, мета винаходу полягає у створенні йонтофоретичної системи для введення сполук загальної формули (І) та їх композицій крізь шкіру, причому така система містить пристрій для трансдермального введення, що прикладається до шкіри й містить перший електрод та другий електрод, а також ємкість з фармацевтично прийнятним електролітом та сполуками загальної формули (І) або їх композиціями, яка електрично поєднана з першим та другим електродами, і джерело електричної енергії, поєднане з першим та другим електродами, причому ємкість містить сполуки загальної формули І та їх композиції, а за бажанням також фармацевтично прийнятний електроліт. Наступною метою винаходу є створення набору, який містить йонтофоретичну систему в поєднанні з однією або кількома ампулами, що вміщують сполуку загальної формули (І), або набору, який містить одну або кілька ампул із сполукою загальної формули (І), для поповнення ємкості йонтофоретичної системи. Кількість ампул у наборах становить від 2 до 91, переважно від 7 до 28, оптимально від 14 до 28. Шкіра, крізь яку здійснюється введення, - то шкіра тварин, наприклад, шкіра людини. Короткий опис креслень Фіг.1 зображує течію 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону крізь роговий шар як функцію концентрації діючої речовини залежно від часу. Фіг.2 зображує течію 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону крізь роговий шар як функцію концентрації електроліту залежно від часу. 87493 8 Фіг.3 зображує течію 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону крізь людський роговий шар як функцію концентрації діючої речовини залежно від часу у присутності 4г/л NaCI. Фіг.4 зображує течію 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолонмезилату крізь безволосу шкіру щура як функцію концентрації діючої речовини залежно від часу у присутності 30 мілімолів (мМ) NaCI. Фіг.5 зображує течію 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолонмезилату крізь безволосу шкіру щура як функцію концентрації діючої речовини залежно від щільності струму у присутності 30 мілімолів (мМ) NaCI. Фіг.6 - схематичне зображення йонтофоретичної системи, що використовувалася при випробуваннях 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолону. Докладний опис винаходу Система для трансдермального йонтофоретичного введення містить перший (донорський) електрод з електролітично доступною діючою речовиною у відповідному носії, а за бажанням також з речовиною, що сприяє проникненню, лічильний електрод та джерело енергії, причому перший та другий електроди кожний електрично поєднані з джерелом енергії. Перший та другий електроди можуть фізично контактувати із шкірою на відстані один від одного, завдяки чому при пропусканні електричного струму від джерела енергії крізь електроди хворий отримує крізь свою шкіру терапевтичну дозу діючої речовини. Нами несподівано встановлено, що йонтофоретичні характеристики (дозу та профіль) введення хворому тієї чи іншої діючої речовини загальної формули (І) можна регулювати, підбираючи відповідні сполучення вихідної концентрації лікарського засобу й електроліту та прикладений струм (змінний/постійний) у йонтофоретичній системі. Наприклад, з'ясовано, що сполучення певної щільності струму (змінного/постійного) з вихідною концентрацією електроліту дозволяє одержати йонтофоретичний пристрій прийнятного розміру, в якому можна регулювати профіль введення лікарського засобу. Здатність індивідуально підбирати профіль введення при йонтофорезі поліпшує контроль дії засобу на хворого. Крім того, завдяки індивідуальному підбору режиму введення йонтофорез може перетворитися на дуже ефективний спосіб практичного введення сполук формули (І). У цьому описі термін "профіль проникнення" означає графік витоку діючої речовини залежно від часу протягом певного періоду введення. Термін "ампула" тут означає ємкість, у якій зберігається діюча речовина перед потраплянням до пристрою. У принаймні одному варіанті здійснення винаходу ампулу можна підбирати зручною для користувача. Будь-який засіб утримання діючої речовини окремо від йонтофоретичного пристрою можна вважати "ампулою". Наприклад, це може бути знімне змінне начиння. Електроліти, що вживаються у способах за винаходом, можуть містити одновалентні або двохвалентні іони, наприклад, усі водорозчинні сполуки-донори СІ-, як то НСІ, NaCI, KCI, CaCI2, MgCI2, 9 триетиламонійхлорид та трибутиламонійхлорид. У переважному варіанті здійснення винаходу електролітом є NaCI. Потрібна кількість електроліту залежить від таких факторів, як площина транспортування пристрою, обсяг носія, концентрація діючої речовини, щільність струму, тривалість йонтофорезу та ефективність введення. Кількість електроліту може становити, наприклад, принаймні біля 0.005ммоля, принаймні біля 0.01ммоля або принаймні біля 0.05ммоля. Верхня межа кількості електроліту може становити, наприклад, біля 2ммолів, біля 1.0ммоля або біля 0.3ммоля. Початкову кількість електроліту можна виразити як концентрацію, скажімо, принаймні біля 0.005 М, принаймні біля 0.01 Μ або принаймні 0.03 М. Початкову кількість електроліту можна виразити як концентрацію, скажімо, не більше 2 М, не більше біля 0.2 Μ або не більше біля 0.2 М. Сполуки, які можна вводити згідно з винаходом, перелічені вище. Проліки зазначених сполук входять до обсягу винаходу. Проліки - це лікарські засоби, які не є активними самі по собі, але перетворюються на один або кілька активних метаболитів. Проліки - це біозворотні похідні молекул лікарських засобів, які використовуються для подолання тих чи інших перешкод на користь молекули вихідної речовини. До цих перешкод належать, зокрема, розчинність, проникність, стабільність, пресистемний метаболізм та обмеження прицільності (Medicinal Chemistry: Principles and Practice, 1994, ISBN 0-85186-494-5, Ed.: F. D. King, p. 215; J. Stella, "Prodrugs as therapeutics", Expert Opin. Ther. Patents, 14(3), 277-280, 2004; P.Ettmayer et al., "Lessons learned from marketed and investigational prodrugs", J.Med.Chem., 47, 2393-2404, 2004). Проліки, тобто сполуки, які, потрапивши будь-яким шляхом до організму, метаболізуються на сполуки формули (1), охоплюються обсягом винаходу. Зокрема, це стосується сполук із первинними чи вторинними амінними або гідроксигрупами. Такі сполуки здатні реагувати з органічними кислотами, даючи сполуки формули (1), де присутня додаткова група, яка легко відщеплюється після введення до організму, наприклад, такі, як амідин, енамін, основа Манніха, похідне гідроксилметилену, похідне О(ацілоксіметиленкарбамату), карбамату, ефіру, аміду або енамінону. Як зазначено вище, сполуки формули І можна використовувати у вигляді фармацевтично прийнятних солей, похідних від неорганічних або органічних кислот. Солі проліків також охоплюються обсягом винаходу. "Фармацевтично прийнятні" солі це такі, що з точки зору діючої медицини є придатні для контакту з тканинами людей та нижчих тварин без зайвої токсичності, подражнень, алергічних реакцій та подібних у межах співвідношення користь-розумний ризик. Фармацевтично прийнятні солі добре відомі фахівцям. Наприклад, S. М. Berge et at. докладно описують фармацевтично прийнятні солі у J. Pharmaceutical Sciences, 1977, 66: 1 et seq. Ці солі можна готувати одразу при кінцевому виділенні та очистці сполук за винаходом або окремо шляхом реакції функції вільної основи з відповідною органічною кислотою. Серед 87493 10 кислих адуктних солей можна навести ацетат, адипат, альгінат, цитрат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, камфорат, камфорсульфонат, діглюконат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, фумарат, гідрохлорид, гідробромид, гідройодид, 2гідроксиетансульфонат (ізотіонат), лактат, малеат, мезилат, метансульфонат, нікотинат, 2нафталінсульфонат, оксалат, пальмитат, пектинат, персульфат, 3-фенілпропіонат, пікрат, півалат, пропіонат, сукцинат, тартрат, тіоцианат, фосфат, глутамат, бікарбонат, р-толуолсульфонат та ундеканоат (перелік невичерпний). Кислотами, які утворюють фармацевтично прийнятні кислі адуктні солі, можуть бути неорганічні кислоти, як соляна, бромистоводнева, сірчана та фосфорна, й органічні, як щавлева, малеїнова, бурштинова та цитринова. До діючих речовин, що їх можна вводити заявленим способом, належать, зокрема, такі сполуки, як 7-(4-метил-1-піперазиніл)-2(3Н)- бензоксазолон або його моногідрохлоридна сіль (SLV308, див. Drugs of the Future 2001, 26, 128-32) та 7-(4бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його мономезилатна cmb(SLV318). 7-(4-метил-1-піперазиніл)-2(3Н)- бензоксазолон або його моногідрохлоридна сіль та 7-(4бензил-1-піперазиніл)-2(3Н)-бензоксазолон або його мономезилатна сіль є придатні для лікування синдрому втомлених ніг або хвороби Паркінсона. Сполуки формули (І), проліки, їх фармацевтично прийнятні солі або суміші можна вводити до організму у відповідності з цим винаходом. рН розчину в ємкості з лікарським засобом у деяких варіантах здійснення винаходу може становити принаймні 3.0. В інших варіантах рН може бути менше або дорівнювати приблизно 7.5. Також рН може становити від біля 4.0 до біля 6.5. рН можна підтримувати на постійному рівні за допомогою буферу, наприклад, цитратного або фосфатного. Для 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолону або його моногідрохлоридної солі корисний рН переважно становить від біля 5.0 до біля 6.0. Також для цієї сполуки можливий рН біля 5.5. Для 7-(4-бензил-1-піперазиніл)-2(3Н)бензоксазолону або його мономезилатної солі рН може становити, наприклад, від біля 3.5 до біля 6.0. Також для цієї сполуки можливий корисний рН біля 4.0. Під час введення можна прикладати постійний або змінний, наприклад, пульсуючий або змінний, струм. Можна також збільшувати струм під час введення з метою титрування концентрації сполуки формули (І), що збільшується. Напругу під час введення встановлюють такою, щоб не пошкодити шкіру живої істоти й водночас забезпечити достатній рівень трансдермального поглинання діючої речовини. Напруга може становити, наприклад, принаймні біля 0.1 В, або принаймні біля 0.5 В, або принаймні біля 1 В. Напруга може також не перевищувати, наприклад, біля 40 В, або біля 20 В, або біля 10 В. Частота пульсуючої або змінної напруги може становити, наприклад, принаймні біля 0.01Гц, або 11 принаймні біля 100Гц, або принаймні біля 5кГц. Частота пульсуючої або змінної напруги може не перевищувати, наприклад, біля 200кГц, або біля 100кГц, або біля 80кГц. Пульсуюча або змінна напруга може мати будь-яку форму хвилі, наприклад, синусоїдну, квадратну, трикутну, пилкоподібну, прямокутну та ін. Крім того, пульсуюча або змінна напруга може прикладатися з робочим циклом менше 100%. Щільність струму може становити, наприклад, принаймні біля 0.001мА/см2, або принаймні біля 0.005мА/см2, або принаймні біля 0.025мА/см2. Також щільність струму може не перебільшувати, наприклад, біля 1.0мА/см2, біля 0.8мА/см2або біля 0.5мА/см2. У ємкості знаходяться лікарський засіб і за бажанням електроліт з носієм у вигляді водного розчину або (гідро)гелю. Гель може являти собою водорозчинний полімер або гідрогель. У принципі припустимим є будь-який гель. Гель можна обирати таким, щоб не пошкоджував шкіру (корозія та подражнення). Гелі можуть мати відповідні властивості, як от добрий контакт із шкірою (адгезийність) та електропровідність. Як приклади можна навести агар, агарозу, полівініловий спирт або зшиті гідрогелі, як от гідроксипропилметилцелюлоза (НРМС), метилцелюлоза (МС), гідроксиетилцелюлоза (НЕС), карбоксіметилцелюлоза (CMC), полівінілпіролідон (PVP) та полвівнілацетатфталат (PVAP) (перелік невичерпний). Речовини, що сприяють проникненню, є добре відомі фахівцям, наприклад, С2-С4 спирти, такі як етанол та ізопропанол, поверхнево активні речовини, наприклад, аніонні, такі як солі жирних кислот з 5-30 атомами вуглецю, наприклад, лаурилсульфат натрію та подібні сульфатні солі жирних кислот, катіонні, такі як алкіламіни з 8-22 атомами вуглецю, наприклад олеїламін, та неіонні поверхнево активні речовини, такі як полісорбати та поліоксамери; аліфатичні одноатомні спирти з 8-22 атомами вуглецю, такі як деканол, лауриловий спирт, міристиловий спирт, пальмитиловий спирт, лінолениловий спирт та олеїловий спирт, жирні кислоти з 5-30 атомами вуглецю, такі як олеїнова, стеаринова, ліноленова, пальмитинова, міристинова, лаурилова та капринова кислоти, і їх ефіри, такі як етилкаприлат, ізопропилміристат, метиллаурат, гексаметиленпальмитат, гліцерилмонолаурат, поліпропиленглікольмонолаурат та поліетиленглікольмонолаурат, саліцилова кислота та її похідні, алкілметилсульфоксиди, такі як децилметилсульфоксид та діметилсульфоксид, 1-заміщені азациклоалкан-2-они, такі як 1додецилазациклогептан-2-он (AZONE®); аміди, такі як октиламід, олеїламід, гексаметиленлаурамід, лаурилдіетаноламід, поліетиленгліколь-3лаурамід, Ν,Ν-діетил-m-толуоламід та кротамітон, і будь-які інші сполуки, що є сумісні із сполуками загальної формули (І) та пристроями за винаходом і що мають здатність сприяти трансдермальному проникненню. В альтернативному варіанті здійснення винаходу носій відокремлено від шкіри мембраною. Мембрану можна обрати, наприклад, такою, що має низький опір до електричного струму, та/або 87493 12 не дозволяє суттєво посилювати перепони до транспортування діючої сполуки, та/або утримує носій у пристрої при зберіганні та перевезенні. Низький опір електричному струму в одному з варіантів визначається як 20% від опору шкіри. Мембрана не суттєвого посилює бар’єр проти транспортування діючої сполуки, коли витік діючої речовини через пристрій з мембраною становить не менше 75% від величини витоку через пристрій без мембрани. Можуть застосовуватися, наприклад, мембрани з низьким електричним опором, описані у D.F. Stamiatialis et al., J. Controlled Release 2002, 81, 335-345, зокрема, мембрани СТ10 kDA, CT-20 kDA, PES-30 kDA та PSf-100 kDA фірми Sartorius, Dialysis-5 kDA фірми Diachema, CA-10 kDa, CA-25 kDa, CA-50 kD та CA-100 kDa фірми Amika й NF-PES-10 та NF-CA-30 фірми Nadir Filtration. Йонтофоретична система для здійснення цього винаходу може містити пристрої та/або компоненти з великого розмаїття відомих на ринку й прийоми та матеріали, описані у численних патентах та публікаціях, що стосуються йонтофоретичних систем. Зокрема, йонтофоретична трансдермальна система може містити йонтофоретичний пристрій фірми The Alza corporation з Маунтін=В'ю, штат Каліфорнія, США (трансдермальна технологія E-trans®), фірми Birch Point Medical Inc. з СентПола, штат Мінесота, США (пристрій lontoPatch™, що працює за технологією одноразового електронного введення WEDD™), фірми lomed із СолтЛейк-Сіті, штат Юта, США (пристрої IOMED™ Phoresor, які використовують електроди IOGEL®, TransQ®Fiex, TransQ®E, TransQ®1&2 або Numby Stuff® й середовище GelSponge®), або пристрій виробництва Vyteris з Фейр-Лоун, штат НьюДжерсі, США (система Active Transdermal), або пристрій виробництва Етрі з Сент-Пола, штат Мінесота (наприклад, Empi DUPEL™), або пристрій, відомий як LECTRO™ Patch, виробництва General Medical Device Corp. у Лос-Анджелесі, Каліфорнія. Електроди можуть бути реактивні або нереактивні. Реактивні електроди - це наприклад, такі, що виготовляються із солей металів, таких як хлориду срібла або матеріалів, описаних у US 4,752,285. Срібнохлоридні електроди можуть бути вироблені на основі знань фахівця або придбані у фірми lomed. Інші реактивні електроди можуть бути вироблені з комбінації іонообмнінних смол, наприклад, такі як виготовляє фірма Еmрі. Нереактивні електроди - це наприклад такі, що виготовляються з металів, таких як золото або платина, або з частинок вуглецю в полімерній матриці, як ті, що застосовуються у системі LECTRO™ Patch. Адгезиви до шкіри у йонтофоретичних пристроях - це чутливі до тиску матеріали, як у пасивних трансдермальних системах, що виробляються з силіконових або акрилових полімерів або з каучуків, таких як поліізобутилен. Можна також застосовувати комбінацію чутливих та провідних адгезивів, як описано у ЕРА 0542294. У ємкості концентрація діючої речовини може становити, наприклад, принаймні біля 0.1мг/мл і може бути не вище, наприклад, біля 90мг/мл. У деяких варіантах концентрація 7-(4-метил-1 13 піперазиніл)-2(3Н)-бензоксазолону або його моногідрохлоридної солі становить, наприклад, від біля 20 до біля 75мг/мл. В інших варіантах ця концентрація знаходиться у межах від біля 20 до біля 55мг/мл. Щодо 7-(4-бензил-1-піперазиніл)-2(3Н)бензоксазолону або його мономезилату, то його концентрація може становити від біля 1 до біля 30мг/мл, а в інших випадках від біля 5 до біля 10мг/мл. Ємкість для лікарського засобу йонтофоретичної системи може містити також інші речовини. Вони обираються з добре відомих і традиційних у техніці йонтофорезу, Такими речовинами можуть бути, наприклад, антимікробні агенти, консерванти, антиоксиданти, речовини, що сприяють проникненню, та буферні речовини. Доза, яка вводиться за один сеанс, може суттєво різнитися. Наприклад, в одному з варіантів мінімальна доза становить біля 0.05мг. В іншому варіанті доза не може перевищувати 100мг. В окремих варіантах одинична доза 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону або його моногідрохлориду може дорівнювати від біля 0.05 до біля 60мг. В інших випадках вона коливається від біля 0.05 до біля 30мг. Доза, що вводиться, визначається на підставі одного або багатьох факторів, таких, як вид речовини, стан хворого, його вік, маса тіла, переносність ліків та ін. Швидкість витоку крізь шкіру принаймні однієї сполуки формули І може становити, наприклад, принаймні біля 50мкг на годину. В інших варіантах ця швидкість не має перевищувати, наприклад, біля 4000мкг на годину. У деяких варіантах здійснення цього винаходу йонтофоретичний спосіб введення лікарських сполук передбачає періодичне прикладання йонтофоретичного трансдермального пристрою з різною частотою - від двох разів на добу до разу на тиждень або на місяць. Протягом того, що у цьому описі зветься сеансом лікування, накладають пристрій, йонтофоретично вводять лікарський засіб та знімають пристрій. Хоча абсолютна кількість введеного лікарського засобу може різнитися дуже суттєво, дозою тут вважається кількість лікарського засобу, чи то велика, чи то мала, введена протягом одного сеансу за одне прикладання пристрою до одного місця на тілі. Протягом сеансу лікарський засіб можна вводити безперервно або через певні інтервали. Інтервали можуть становити від біля 10 хвилин до 24 або 48 годин. У деяких випадках може виявитися доцільним припиняти введення протягом певного відрізку доби, наприклад, вночі на 6, 7 або 8 годин. Після того, як курс введення лікарського засобу розпочався, може бути бажано рівномірно або по стадіям нарощувати дозу протягом певного часу, починаючи з малої кількості аж до максимально переносної, і цей період зветься часом титрування. Період титрування може становити, наприклад, принаймні 3 доби, або не більше ніж 42 доби. У деяких варіантах період титрування може займати від 7 до 21 доби, в інших біля 14 діб. Спосіб йонтофоретичного введення за винаходом мо 87493 14 же виявитися придатним для такого безперервного або стадіального нарощування, оскільки дозволяє регулювати дозу, що вводиться, нарощуючи лінійно або по стадіях щільність струму. У деяких варіантах здійснення винаходу йонтофоретична система містить: (a) пристрій для трансдермального введення, який прикладається до шкіри й містить перший електрод, другий електрод та ємкість із сполукою формули І, як зазначено вище, а за бажанням також із фармацевтично прийнятним електролітом, електрично поєднану з першим та другим електродами, та (b) засіб поєднання джерела електричної енергії з першим та другим електродами. Джерелом електроенергії може слугувати, наприклад, батарея, акумулятор або енергія з мережі. Засобом поєднання з джерелом електроенергії може бути будь-який провідник або носій енергії, наприклад, дріт, мережний адаптер, регулятор потужності тощо, або комбінація двох чи більше з них. Йонтофоретична система може також містити інші методики та матеріали, зокрема, такі, як описано у WO 92/17239, ЕРА 0547482 та US 4,764,164, повний зміст яких включено до цього опису як посилальний матеріал. У деяких варіантах поверхня транспортування пристрою становить щонайменше біля 1.0см2, в інших - щонайбільше біля 30см2. У певних випадках поверхня транспортування охоплює від біля 2 до біля 15см2, або ж вона становить від біля 5 до біля 10см2. В іншому варіанті здійснення винаходу ємкість йонтофоретичної системи надходить до користувача порожньою й заповнюється перед тим, як систему прикладено до шкіри, або після того. Під час використання у цьому варіанті до йонтофоетичної системи додають одну або кілька ампул із сполукою загальної формули і, як визначено вище, яка може мати вигляд проліків або солі, або з композицією двох або більше сполук, а за бажанням також фармацевтично прийнятний електроліт. Така комбінація йонтофоретичної системи з однією або кількома ампулами зветься початковим набором. Кількість ампул у наборі може становити, наприклад, від 7 до 91, в інших варіантах від 14 до 28. Сполука та електроліт, якщо він є, можуть мати вигляд твердих кристалів, аморфного або ліофілізованого матеріалу, які необхідно розчинити у воді перед заповненням ємкості йонтофоретичного пристрою, або ж у вигляді розчину, готового до використання. Йонтофоретичну систему можна поповнювати свіжим розчином кожні 3-48 годин або, наприклад, кожні 24 години. В іншому варіанті набір, призначений для багаторазового використання, аж доки йонтофоретична система лишається працездатною, містить лише одну або кілька ампул із сполукою загальної формули І, як визначено вище, яка може мати вигляд проліків або солі, або з композицією двох або більше сполук, а за бажанням також фармацевтично прийнятний електроліт. У цьому описі вираз "біля" поряд з величиною показує межі коливань такої величини, що є зро 15 зуміле для фахівця. Наприклад, "біля" означає, що значущі величини, помилки округлення тощо утворюють інтервал величин навколо названого числа, який охоплюється поняттям цього числа. Нижченаведені приклади лише докладніше ілюструють винахід, ніяким чином не обмежуючи обсяг винаходу. Приклади Приклад 1. Загальна методика. Ізоляція рогового шару людини Препарат рогового шару людини (HSC) готують з підданої дерматомізації здорової людської шкіри. Протягом 24 годин після хірургічного видалення людської шкіри (черевної або грудинної) видаляють залишковий підшкірний жир. Аби уникнути забруднення підшкірним жиром, поверхню шкіри обережно протирають паперовими серветками, змоченими 70% етанолом. Шкіру піддають дерматомізації до глибини близько 300мкм елетродерматомізатором модель В фирми Padgett з Канзас-Сіті, США. Далі її інкубують дермальною стороною на ватманському папері, змоченому розчином 0.1% трипсину у полібутадієнстиролі протягом ночі при 4°С і потім 1 годину при 37°С. Далі роговий шар відокремлюють від нижче розташованих епідерміса та дерми. Залишкову активність трипсину блокують, занурюючи роговий шар до розчину 0.1% інгібітора трипсину у полібутадієнстиролі з рН 7.4. Роговий шар кілька разів промивають водою та зберігають у десикаторі, що містить силікагель, в атмосфері N2, щоб попередити окислення ліпідів. Ізоляція безволосої шкіри щурів Безволосих щурів умертвляють діоксидом вуглецю у спеціальній камері за півгодини після початку експерименту. Черевну шкіру обережно видаляють так, щоб м'язи та жир не потрапили до шкіри. Далі із шкіри нарізають маленькі квадратики, які вміщуються до дифузійного приладу Франца (система транспортування крізь мембрану фірми PermeGear, США), та зберігають їх у 0.1Μ калійфосфатному буфері. Синтез діючої речовини Гідрохлорид 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолону синтезують згідно із способом, наведеним у WO00/29397 та Drugs of the Future 2001, 26, 128-32. 7-(4-бензил-1-піперазиніл)-2(3Н)бензоксазолонмезилат готують у відповідності до WO01/85725 та WO02/066449. Розчини в експерименті з ионтофорезом Сіль НСІ 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолону розчиняють у розчині 10мМ цитрату натрію. рН доводять до 5.5 розчином 10 мМ цитринової кислоти. 7-(4-бензил-1-піперазиніл)2(3Н)-бензоксазолонмезилат розчиняють у 0.1Μ калійфосфатному буфері. рН доводять до 4.0 ортофосфорною кислотою. Експерименти з йонтофорезу 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону Експерименти з йонтофорезу 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолону виконують з використанням джерела постійного струму, що управляється 9канальним комп'ютером (відділення електроніки Gorlaeus Laboratories Лейденського університету, Нідерланди). Можна також використовувати наяв 87493 16 не на ринку джерело живлення РСТ-МК1 фірми Moor Instruments, Велика Британія. Анодом слугує срібний пластинчастий електрод (наприклад, Silver foil >99.99% чистоти завтовшки 1.0мм (№ за каталогом Aldrich 36,943-8), 5см завдовжки, 3мм завширшки), а срібно-срібнохлоридний електрод (який одержують, занурюючи 2-3 рази срібний дріт (>99.99% чистоти, Ø 1.0мм (№ за каталогом Aldrich 26,559-4), зігнутий зверху, щоб утворити невеличкий виступ (близько 3мм), під прямим кутом до вертикального стовбура електрода до розплавленого порошку хлориду срібла (>99.999% чистоти, № за каталогом Aldrich 20,438-2) виконує роль катода. (Або ж можна приготувати срібний пластинчастий та срібно-срібнохлоридний електроди згідно з Ajay K. Banga, Electrically Assisted Transdermal and Topical Drug Delivery, Taylor and Francis Group Ltd., London UK, 1998, ISBN 0-74840687-5, або їх можна придбати у виробника, наприклад, фірми lomed.) Усі експерименти з дифузії виконують при щільності постійного струму 0.5мА/см2 з безперервною трьохкамерною течією крізь дифузійні комірки при кімнатній температурі. Дифузійна установка містить перистальтичний насос, колектор фракцій та 8 дифузійних комірок (дифузійну комірку див. Фіг.4). В усіх дифузійних дослідженнях використовують роговий шар. Людський роговий шар вимочують у полібутадієнстиролі з рН 7.4 2 години, після чого вміщують до комірок. Два шматочки рогового шару встановлюють між анодом та катодом і між акцептором і катодом, причому апікальний бік повернуто до анодного та катодного відділень. Опорною мембраною для рогового шару слугує діалізна мембрана (зріз 5,000 D). Відділення щільно поєднані кільцями з параплівки. Температура у акцепторній камері становить 37°С. Течію полібутадієнстиролу крізь акцепторну камеру підтримують постійною протягом усього експерименту - 6 - 8мл на годину. Після 6 годин пасивної дифузії вмикають струм. Струм вимикають через t = 15 годин. Ще за 5 годин (післяйонтофорезний період) виконують пасивну дифузію. Щільність струму під час йонтофорезу становить 0.5мА/см2. Опір листків рогового шару під час експерименту фіксують двома додатковими срібними електродами. Дуже низький опір свідчить про те, що роговий шар у комірці пробито. Тоді дані про дифузію анулюють. Усі досліди повторюють принаймні по три рази. Кількість донорів шкіри для кожного досліду становить принаймні 3. Експерименти з йонтофорезу 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолону. Експерименти з йонтофорезу 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолону виконують у дифузійному приладі Франца (система транспортування крізь мембрану фірми PermeGear, США), підвішеному до вимірювача Keith ley 2400, а струм фіксують мультиметром. У донорській половині ячейки підтримують кімнатну температуру (25°С), тоді як у рецепторній половині температура становить 37°С Рецепторне відділення безперервно перемішують. Свіжозрізану безволосу шкіру щурів вміщують до вертикальних дифузійних комірок після того, як рецепторне відділення заповниться 17 відповідним рецепорним середовищем, здатним підтримувати режим занурення. Склад рецепторного середовища такий самий, як донорського середовища без діючої речовини, що дозволяє підтримувати режим занурення. Лікарську композицію вміщуюють до донорського відділення. Анодом у донорському відділенні слугує срібний дріт, а катодом у рецепторному відділенні - срібносрібнохлоридний електрод. Постійний струм від джерела вмикають на 3 години. Втім, проби відбирають протягом 24 годин, аби перевірити, чи закінчиться посилена доставка після припинення подачі струму. Проби з рецепторного відділення беруть через певні проміжки часу й піддають високоефективній рідинній хроматографії, як описано далі. Проби поповнюють свіжим рецепторним середовищем, і ці поповнення враховують при розрахунках. Високоефективний рідинний хроматографічний аналіз (HPLC) 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолон аналізують на високоефективному рідинному хроматографі з ультрафіолетовим детектором (фірми Waters Chromatography, ЕттенЛер, Нідерланди). Колонка Chrornsep SS (250*3 мм L*i.d.) термостатована при 30°С. Рухома фаза являє собою буфер з ацетонітрилу-метанолу0.7г/л ацетату амонію з рН 5.6 (12/6/82 обс.), її витрата становить 0.5мл/хв. Детектування виконується на хвилі 215нм. На хроматограмах досліджуваних розчинів не виявлено продуктів окислення або розкладу сполуки. 7-(4-бензил-1-піперазиніл)-2(3Н)бензоксазолон аналізують на високоефективному рідинному хроматографі з ультрафіолетовим детектором (система Waters Alliance). Колонка Chromsep SS (150*3 мм L*i.d.) з розміром частинок 5мкм термостатована при 40°С. Рухомою фазою слугує дегазований розчин 1.54г ацетату амонію у 460мл води (рН доведений до 4.6 оцтовою кислотою) та 540мл метанолу. Витрата рухомої фази 0.5мл/хв. Детектування на хвилі 243нм. Обсяг впорскування 10мкл. Приклад 2. Йонтофорез моногідрохлориду 7(4-метил-1-піперазиніл)-2(3Н)-бензоксазолону зі змінною концентрацією діючої речовини Готують розчин 75мг/мл моногідрохлориду 7(4-метил-1-піперазиніл)-2(3Н)-бензоксазолону у цитратному буфері (Це 85% максимальної розчинності моногідрохлориду 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону у цитратному буфері при рН 5.5). Цей розчин далі розбавлюють у цитратному буфері при рН 5.5. Випробують концентрації: 20мг/мл, 35мг/мл, 55мг/мл та 75мг/мл. Як показано на Фіг.1, після вмикання струму різко збільшується витік 7-(4-метил-1-піперазиніл)2(3Н)-бензоксазолону. Під час йонтофорезу спостерігаються надзвичайно великі потоки 7-(4метил-1-піперазиніл)-2(3Н)-бензоксазолону. Середні значення переносу за час ионтофорезу становлять 394 ± 26, 383 ± 42, 459 ± 59, 418 ± 31мкг/год/см2 для концентрацій донора 20, 35, 55, 75 мг/мл відповідно. Не виявлено суттєвих відмін між цими величинами при однобічному дисперсійному аналізі ANOVA (значення р між усіма групами 87493 18 > 0.05). рН донорського розчину протягом експерименту не змінюється більше, ніж на 0.2 одиниці. Приклад 3. Йонтофорез моногідрохлориду 7(4-метил-1-піперазиніл)-2(3Н)-бензоксазолону зі змінною концентрацією електроліту Моногідрохлорид 7-(4-метил-1-піперазиніл)2(3Н)-бензоксазолону розчиняють у розчині 10 mМ цитрату натрію. рН доводять до 5.5 10мМ цитринової кислоти. Додають хлорид натрію до вмісту в розчині 0, 2 або 4мг/мл NaCI. Підтримують постійну концентрацію моногідрохлориду 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону 35мг/мл. При 4мг/мл NaCI обрана концентрація моногідрохлориду 7-(4-метил-1-піперазиніл)-2(3Н)бензоксазолону становить 80% його максимальної розчинності. Розчинність моногідрохлориду 7-(4метил-1-піперазиніл)-2(3Н)-бензоксазолону тим більша, чим менша концентрація NaCI. На Фіг.2 видно, що після вмикання струму різко збільшується витік 7-(4-метил-1-піперазиніл)2(3Н)-бензоксазолону. Під час йонтофорезу спостерігаються надзвичайно великі потоки 7-(4метил-1-піперазиніл)-2(3Н)-бензоксазолону. Середні значення переносу за час йонтофорезу становлять 471 ± 65, 377 ± 37 та 424 ± 50мкг/год/см2 (середня величина ± середня помилка вимірювання) для концентрацій хлориду натрію 0, 2, 4мг/мл відповідно. Не виявлено суттєвих відмін між цими величинами при однобічному дисперсійному аналізі ANOVA (значення р між усіма групами > 0.05). рН донорського розчину протягом експерименту не змінюється більше, ніж на 0.2 одиниці. Різке зростання з наступним падінням при вмиканні та вимиканні струму вказує на те, що при йонтофорезі можуть мати місце величезні зміни обсягу переносу. Приклад 4. йонтофорез моногідрохлориду 7(4-метил-1-піперазиніл)-2(3Н)-бензоксазолону при змінних концентраціях діючої речовини у присутності 4г/л NaCI. Готують розчин 55мг/мл моногідрохлориду 7(4-метил-1-піперазиніл)-2(3Н)-бензоксазолону у цитратному буфері (Це 85% максимальної розчинності моногідрохлориду 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону у цитратному буфері при рН 5.5 у присутності 4г/л NaCІ). Цей розчин далі розбавлюють у цитратному буфері при рН 5.5. Випробують концентрації: 20мг/мл, 35мг/мл, 55мг/мл та додають NaCI у кількості 4г/л.. З Фіг.3 видно, що у присутності NaCI йонтофоретичний потік моногідрохлориду 7-(4-метил-1піперазиніл)-2(3Н)-бензоксазолону мало залежить від концентрації. Витрата складає 409 ± 47, 467 ± 74 та 580 ± 87мкг/год/см2 для донорських концентрацій 20, 35 та 55мг/мл відповідно (середня величина ± середня помилка вимірювання). Однак однобічний дисперсійний аналіз не довів статистичну значущість цього тренду (значення р між усіма групами > 0.05). рН донорського розчину протягом експерименту не змінюється більше, ніж на 0.2 одиниці. Приклад 5. Йонтофорез 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолону із змінними концентраціями діючої речовини у 30мМ NaСІ. 19 Готують розчин 10г/мл 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолон-мезилату у фосфатному буфері (Це близько до максимальної розчинності моногідрохлориду 7-(4-метил-1піперазиніл)-2(3Н)-1 бензоксазолону у фосфатному буфері при рН 4.0 у присутності 30мМ NaCI). Цей розчин розбавлюють далі у фосфатному буфері з рН 4.0. Випробують концентрації: 1мг/мл, 5мг/мл та 10мг/мл і додають NaCI до концентрації 30мМ. Фіг.4 показує, що йонтофоретичний потік посилюється при збільшенні концентрації діючої речовини з 1мг/мл до 5мг/мл, але при подальшому підвищенні концентрації діючої речовини до 10мг/мл потік далі не збільшується. 87493 20 Приклад 6. Йонтофорез 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолону при концентрації 5мг/мл із змінною щільністю струму у присутності 30мМ NaCI. Готують розчин 5мг/мл 7-(4-бензил-1піперазиніл)-2(3Н)-бензоксазолонмезилату у фосфатному буфері, як у прикладі 5, для вивчення дії щільності струму. Вимірюють потік при щільностях струму 0, 0.1, 0.3 та 0.5мА. З Фіг.5 видно, що проникнення 7-(4-бензил-1-піперазиніл)-2(3Н)бензоксазолону значно посилюється при йонтофорезі у порівнянні з пасивною дифузією. Також відзначається лінійне співвідношення між витратою та щільністю струму. 21 Комп’ютерна верстка Л. Купенко 87493 Підписне 22 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюTransdermal iontophoretic delivery of piperazinyl-2(3h)-benzoxazolone compounds
Автори англійськоюBouwstra Johanna A, Van Den Berg Dirk-J, Verbaan Frederik J, Conjeevaram R V, van Scharrenburg Gustaaf J.M., Vemulapalli Viswatej, Van Scharrenburg J M, Teunissen Hendrik
Назва патенту російськоюТрансдермальная йонтофоретическая система для введения соединений пиперазинил-2(3н) -бензоксазолона
Автори російськоюБоустра Йоганна А., ван ден Берг Дирк-Ян, Вербаан Фредерик Й., Тониссен Хендрик, ван Шаренбург Густав Й.М., Конживарам Раджкумар В., Банга Аджай К., Вемулапалли Вишватедж
МПК / Мітки
МПК: A61N 1/30, A61P 25/16, A61K 31/496
Мітки: піперазиніл-2(3н)-бензоксазолону, йонтофоретична, трансдермальна, система, введення, сполук
Код посилання
<a href="https://ua.patents.su/11-87493-transdermalna-jjontoforetichna-sistema-dlya-vvedennya-spoluk-piperazinil-23n-benzoksazolonu.html" target="_blank" rel="follow" title="База патентів України">Трансдермальна йонтофоретична система для введення сполук піперазиніл-2(3н)-бензоксазолону</a>
Попередній патент: Регіоспецифічний синтез похідних 42-естеру рапаміцину
Наступний патент: Уловлювач кульок із запобіжною випускною заслінкою
Випадковий патент: Елемент насадки масообмінного апарата