Похідні метилпіперазиназепіну, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі
Формула / Реферат
1. Производные метилпиперазиназепина формулы (I):
в которой X означает атом кислорода, серы или селена, или группу ΝΗ или NR3, где R3 является группой -СОН, -СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, R1 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2- атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, n1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если r1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то n1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d´, и N1 и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, и их фармацевтически приемлемые соли, обладающие активностью на уровне центральной или периферической нервной системы.
2. Производные формулы (I) по пункту 1, отличающиеся тем, что r1 является атомом водорода, хлора, фтора или метилом.
3. Производные формулы (I) по пунктам 1 или 2, отличающиеся тем, что R2 является атомом водорода или хлора.
4. Производные формулы (I) по одному из пунктов 1-3, отличающиеся тем, что они представляют собой соль, выбранную из группы, состоящей из хлоргидратов, бромгидратов, сульфатов, фосфатов, ацетатов, цитратов, малеатов, фумаратов и метансульфонатов.
5. Производные формулы (I) по одному из пунктов 1-4, выбранные из группы, состоящей из:
11-(4-метилпиперазин-1-ил)-5Н-пиридо(4,3-b)бензо-1,5-диазепина,
6-(4-метилпиперазин-1 -ил)-пиридо(2,3-b)бензо-1,4-тиазепина,
8-хлор-6-(4-метилпиперазин-1-ил)-пиридо(2,3-b)бензо-1,4-тиазепинфумарата,
5-(4-метилпиперазин-1-ил)-пиридо(2,3-b)бензо-1,5-оксазепинмалеата,
8-хлор-5-(4-метилпиперазин-1-ил)-пиридо(2,3-b)бензо-1,5-оксазепинфумарата,
5-(4-метилпиперазин-1-ил)-8-метилпиридо(2,3-b)бензо-1,5-оксазепинфумарата,
6-(4-метилпиперазин-1-ил)-пиридо(2,3-b)бензо-1,4-оксазепинфумарата,
8-хлор-6-(4-метилпиперазин-1-ил)-пиридо(2,3-b)бензо-1,4-оксазепинфумарата, 6-(4-метилпиперазин-1-ил)-11 Н-пиридо(2,3-b)бензо-1,4-диазепина,
8-хлор-6-(4-метилпиперазин-1-ил)-11 Н-пиридо(2,3-b)бензо-1,4-диазепина,
6-(4-метилпиперазин-1 -ил)-8-метил-11 Н-пиридо(2,3-b)бензо-1,4-диазепина,
9-хлор-6-(4-метилпиперазин-1-ил)-11 Н-пиридо(2,3-b)бензо-1,4-диазепина,
8-фтор-6-(4-метилпиперазин-1-ил)-11Н-пиридо(2,3-b)бензо-1,4-диазепина,
5-формил-11-(4-метилпиперазин-1-ил)-5Н-пиридо(4,3-b)бензо-1,5-диазепина, 11-формил-5-(4-метилпиперазин-1-ил)-11Н-пиридо(2,3-b)бензо-1,5-диазепина, 11-трифторметилкарбонил-5-(4-метилпиперазин-1-ил)-11 Н-пиридо(2,3-b)бензо-1,5-диазепина,
11 -формил-6-(4-метилпиперазин-1 -ил)-11 Н-пиридо(2,3-b)бензо-1,4-диазепина,
10-(4-метилпиперазин-1 -ил)-пиридо(4,3-b)бензо-1,4-тиазепина,
5-(4-метилпиперазин-1-ил)-дибензо(b, f)-1,4-селеназепина,
6-(4-метилпиперазин-1-ил)-дипиридо(2,3-b:3,2'-f)-1,4-тиазепина,
6-(4-метилпиперазин-1 -ил)-11 -метил-11 Н-пиридо(2,3-b)бензо-1,4-диазепина.
6. Производные метилпиперазиназепина по одному из пунктов 1-5 для получения препаратов, обладающих активностью на уровне центральной или периферической нервной системы, такой как антидепрессивной, антипсихотической, анксиолитической, нейролептической или седативной активностью.
7. Способ получения производных метилпиперазиназепина формулы (I):
в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где R3 является группой -СОН,-СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, r1- атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2-aтом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, N1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если r1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то n1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d´, и N1, и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, отличающийся тем, что подвергают взаимодействию азепинон формулы (II):
в которой X, r1 и R2 имеют указанные выше значения, n1 и N2 каждый означает бензольное или пиридиновое кольцо, с P2S5 в пиридине с получением тиона формулы (III):
который выделяют и обрабатывают третбутилатом калия и паранитробензилхлоридом с получением тиоэфира формулы (IV):
где R' означает паранитробензил, R1 и R2 имеют указанные выше значения, который подвергают взаимодействию с N-метилпиперазином в присутствии ледяной уксусной кислоты с последующим выделением целевого продукта.
8. Способ получения производных метилпиперазиназепина формулы (I):
в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где r3 является группой -СОН, -СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, r1- атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2-атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, N1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если r1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то N1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d', и М1, и М2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, отличающийся тем, что азепинон формулы (II):
в которой X, r1 и R2 имеют указанные выше значения, n1и N2 каждый означает бензольное или пиридиновое кольцо, при нагревании подвергают взаимодействию с N-метилпиперазином в присутствии раствора ТiCl4 в анизоле и выделяют целевой продукт.
9. Способ получения производных метилпиперазиназепина формулы (I):
в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где R3 является группой -СОН, -COCF3 или алкилом с 1-4 атомами углерода разветвленным или неразветвленным, r1 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2- атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, n1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если r1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то n1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d', и N1, и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, отличающийся тем, что азепинон формулы (II):
обрабатывают соединением ОРСl3 в присутствии диметилформамида с получением соответствующего иминохлорида формулы (V):
который подвергают взаимодействию с N-метилпиперазином в среде толуола и выделяют целевой продукт.
10. Способ получения производных метилпиперазиназепина формулы (I):
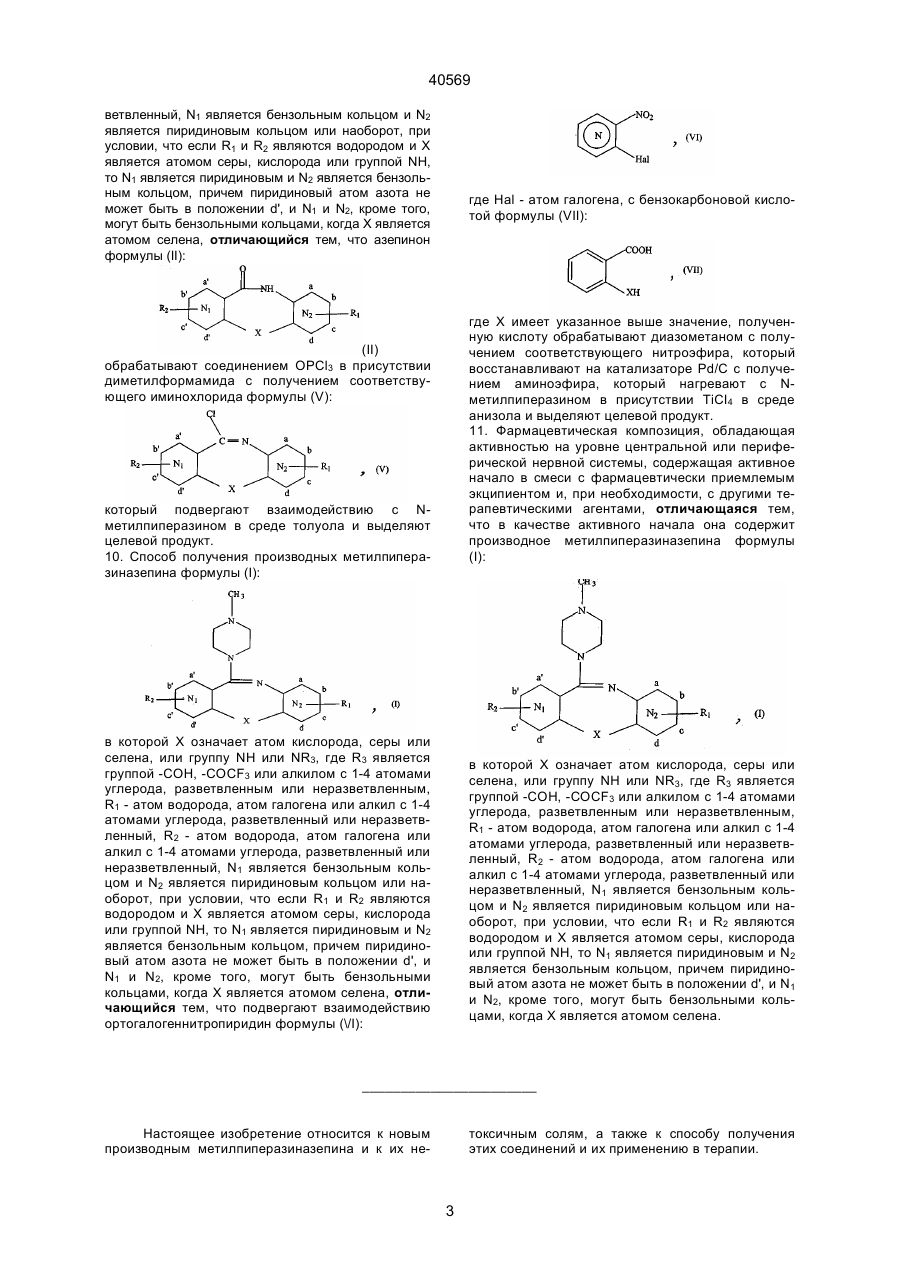
в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где r3 является группой -СОН, -СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, R1 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2- атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, N1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если R1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то n1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d', и N1, и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, отличающийся тем, что подвергают взаимодействию ортогалогеннитропиридин формулы (\/I):
где Hal - атом галогена, с бензокарбоновой кислотой формулы (VII):
где X имеет указанное выше значение, полученную кислоту обрабатывают диазометаном с получением соответствующего нитроэфира, который восстанавливают на катализаторе Pd/C с получением аминоэфира, который нагревают с N-метилпиперазином в присутствии ТіСІ4 в среде анизола и выделяют целевой продукт.
11. Фармацевтическая композиция, обладающая активностью на уровне центральной или периферической нервной системы, содержащая активное начало в смеси с фармацевтически приемлемым экципиентом и, при необходимости, с другими терапевтическими агентами, отличающаяся тем, что в качестве активного начала она содержит производное метилпиперазиназепина формулы (I):
в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где R3 является группой -СОН, -СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, R1 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2- атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, n1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если r1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то N1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d", и N1, и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена.
Текст
1. Производные метилпиперазиназепина формулы (I): C2 (54) ПОХІДНІ МЕТИЛПІПЕРАЗИНАЗЕПІНУ, СПОСІБ ЇХ ОДЕРЖАННЯ (ВАРІАНТИ), ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ НА ЇХ ОСНОВІ 40569 6-(4-метилпиперазин-1-ил)-дипиридо(2,3-b:3',2'-f)1,4-тиазепина, 6-(4-метилпиперазин-1-ил)-11-метил-11Н-пиридо(2,3-b)бензо-1,4-диазепина. 6. Производные метилпиперазиназепина по одному из пунктов 1-5 для получения препаратов, обладающих активностью на уровне центральной или периферической нервной системы, такой как антидепрессивной, антипсихотической, анксиолитической, нейролептической или седативной активностью. 7. Способ получения производных метилпиперазиназепина формулы (I): где R' означает паранитробензил, R1 и R2 имеют указанные выше значения, который подвергают взаимодействию с N-метилпиперазином в присутствии ледяной уксусной кислоты с последующим выделением целевого продукта. 8. Способ получения производных метилпиперазиназепина формулы (I): в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где R3 является группой -СОН, -СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, R1- атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2-атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, N1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если R1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то N1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d', и N1 и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, отличающийся тем, что азепинон формулы (II): в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где R3 является группой -СОН,-СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, R1- атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2-aтом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, N1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если R1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то N1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d´, и N1 и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, отличающийся тем, что подвергают взаимодействию азепинон формулы (II): (II) в которой X, R1 и R2 имеют указанные выше значения, N1 и N2 каждый означает бензольное или пиридиновое кольцо, при нагревании подвергают взаимодействию с N-метилпиперазином в присутствии раствора ТiCl4 в анизоле и выделяют целевой продукт. 9. Способ получения производных метилпиперазиназепина формулы (I): в которой X, R1 и R2 имеют указанные выше значения, N1 и N2 каждый означает бензольное или пиридиновое кольцо, с P2S5 в пиридине с получением тиона формулы (III): который выделяют и обрабатывают третбутилатом калия и паранитробензилхлоридом с получением тиоэфира формулы (IV): в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где R3 является группой -СОН, -COCF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, R1 атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или нераз 2 40569 ветвленный, N1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если R1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то N1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d', и N1 и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, отличающийся тем, что азепинон формулы (II): где Hal - атом галогена, с бензокарбоновой кислотой формулы (VII): где X имеет указанное выше значение, полученную кислоту обрабатывают диазометаном с получением соответствующего нитроэфира, который восстанавливают на катализаторе Pd/C с получением аминоэфира, который нагревают с Nметилпиперазином в присутствии ТіСІ4 в среде анизола и выделяют целевой продукт. 11. Фармацевтическая композиция, обладающая активностью на уровне центральной или периферической нервной системы, содержащая активное начало в смеси с фармацевтически приемлемым экципиентом и, при необходимости, с другими терапевтическими агентами, отличающаяся тем, что в качестве активного начала она содержит производное метилпиперазиназепина формулы (I): (II) обрабатывают соединением ОРСl3 в присутствии диметилформамида с получением соответствующего иминохлорида формулы (V): который подвергают взаимодействию с Nметилпиперазином в среде толуола и выделяют целевой продукт. 10. Способ получения производных метилпиперазиназепина формулы (I): в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где R3 является группой -СОН, -СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, R1 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, N1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если R1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то N1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d', и N1 и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена, отличающийся тем, что подвергают взаимодействию ортогалогеннитропиридин формулы (\/I): в которой X означает атом кислорода, серы или селена, или группу NH или NR3, где R3 является группой -СОН, -СОСF3 или алкилом с 1-4 атомами углерода, разветвленным или неразветвленным, R1 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, R2 - атом водорода, атом галогена или алкил с 1-4 атомами углерода, разветвленный или неразветвленный, N1 является бензольным кольцом и N2 является пиридиновым кольцом или наоборот, при условии, что если R1 и R2 являются водородом и X является атомом серы, кислорода или группой NH, то N1 является пиридиновым и N2 является бензольным кольцом, причем пиридиновый атом азота не может быть в положении d', и N1 и N2, кроме того, могут быть бензольными кольцами, когда X является атомом селена. _______________________ Настоящее изобретение относится к новым производным метилпиперазиназепина и к их не токсичным солям, а также к способу получения этих соединений и их применению в терапии. 3 40569 Производными формулы (I), которые могут находиться в форме нетоксичных солей, являются, в частности, соли неорганических кислот, такие как хлоргидраты, бромгидраты, фосфаты, сульфаты, или органических кислот, такие как ацетаты, цитраты, малеаты, фумараты и метансульфонаты. Примерами производных согласно изобретению являются: 11-/4-метилпиперазин-1-ил/-5H-пиридо/4,3в/бензо-1,5-диазепин, 6-/4-метилпиперазин-1-ил/пиридо/2,3-в/бензо1,4-тиазепин, фумарат 8-хлор-6-/4-метилпиперазин-1-ил/пиридо/2,3-в/бензо-1,4-тиазепина, малеат 5-/4-метилпиперазин-1-ил/пиридо/2,3в/бензо-1,5-оксазепина, фумарат 8-хлор-5-/4-метилпиперазин-1-ил/пиридо/2,3-в/бензо-1,5-оксазепина, фумарат 5-/4-метилпиперазин-1-ил/-8-метилпиридо/2,3-в/бензо-1,5 -оксазепина, фумарат 6-/4-метилпиперазин-1-ил/пиридо/2,3в/бензо-1,4-оксазепина, фумарат 8-хлор-6-/4-метилпиперазин-1-ил/пиридо/2,3-в/бензо-1,4-оксазепина, 6-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3в/бензо-1,4-диазепин, 8-хлор-6-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3в/бензо-1,4-диазепин, 6-/4-метилпиперазин-1-ил/-8-метил-11Н-пиридо/2,3-в/бензо-1,4 -диазепин, 9-хлор-6-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3-в/бензо-1,4-диазепин, 8-фтор-6-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3-в/бензо-1,4-диазепин, 5-формил-11 -/4-метилпиперазин-1-ил/-5Нпиридо/4,3-в/бензо-1,5-диазепин, 11-формил-5 -/4-метилпиперазин-1-ил/-11Нпиридо/2,3-в/бензо-1,5-диазепин, 11-трифторметилкарбонил-5-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3-в/бензо-1,5-диазепин, 11-формил-6 -/4-метилпиперазин-1-ил/-11Нпиридо/2,3-в/бензо-1,4-диазепин, 10-/4-метилпиперазин-1-ил/пиридо/4,3-в/бензо-1,4-диазепин, 5-/4-метилпиперазин-1-ил/дибензо(в,f)-1,4селеназепин, 6-/4-метилпиперазин-1-ил/дипиридо/2,3-в:3', 2'-f/1,4-тиазепин, 6-/4-метилпиперазин-1-ил/-11-метил-11Н-пиридо/2,3-в/бензо-1,4 диазепин. Новые соединения согласно изобретению могут быть получены в соответствии с общим способом, являющимся объектом настоящего изобретения, из известного или легко синтезируемого азепинона формулы (II). Новые метилпиперазиназепины изобретения соответствуют общей формуле (I): в которой Х является атомом кислорода, серы или селена, или группой HN или NR3, где R3 является группой , , или алкилом с 1-4 атома ми углерода, разветвленным или нет; R1 является атомом водорода, атомом галоида или алкилом с 1-4 атомами углерода, разветвленным или нет; R2 является атомом водорода, атомом галоида или алкилом с 1-4 атомами углерода, разветвленным или нет; N1 является бензольным ядром и N2 является пиридиновым ядром или наоборот при условии, если R1 и R2 являются водородом и Х является серой, кислородом или группой NH, a N1 является пиридиновым циклом, а N2 бензольным ядром, причем пиридиновый азот не может находиться в положении d’, и N1 и N2, кроме того, могут быть оба бензольным ядром, если Х является атомом селена. Некоторые представители производных метилпиперазиназепина этого типа описаны в литературе. В этом отношении можно, в частности, упомянуть статьи Дюпона с сотр., Acta, cryst., С43, 716–718, 1987, где описаны кислородсодержащие производные, Хоффманна с сотр. патент США №4163785/1979, где описаны серосодержащие производные и Чакрабарти с сотр., Journal of Medicinal Chemistry, т.32, №10, 2375–2381, 1989, описывающие азотсодержащие производные. Однако в отличие от производных настоящего изобретения ни одно из производных метилпиперазиназепина этого типа, описанных до настоящего времени в литературе, не обладали интересной фармакологической активностью. Как уже говорилось ранее, производные метилпиперазиназепина настоящего изобретения соответствуют общей формуле (I). В приведенной выше общей формуле под алкилом с 1-4 атомами углерода, разветвленным или нет, понимают метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Термин галоид охватывает хлор, фтор, йод и бром. Предпочтительными классами соединений формулы (I) являются, например, те, в которых R1 является атомом водорода, атомом хлора, атомом фтора и метилом, и те, в которых R2 является атомом водорода или атомом хлора. Особенно предпочтительным классом этих соединений являются те, у которых R1 является водородом, хлором, фтором или метилом и одновременно R2 является водородом или хлором. (ІІ) в которой Х, R1 и R2 имеют указанные ранее значения, а N1 и N2 каждый является бензольным или пиридиновым ядром. В этом отношении ниже приведены некоторые азепиноны, уже описанные в литературе: 4 40569 5,11-дигидро-6Н-пиридо/2,3-в/бензо-1,4-диазепин-6-он, 6,11-дигидро-5Н-пиридо/2,3-в/бензо-1,4-диазепин-5-он, 5,10-дигидро-11Н-пиридо/4,3-в/бензо-1,4диазепин-11-он, 5,11-дигидро-11-метил-6Н-пиридо/2,3-в/бензо-1,4-диазепин-6-он, 5Н, 6Н-пиридо/2,3-в/бензо-1,5-оксазепин-5он, 5Н, 6Н-пиридо/2,3-в/бензо-1,4-оксазепин-6он, 5, 11-дигидро-8-метил-6Н-пиридо/2,3-в/бензо-1,4-диазепин-6-он, 9-хлор-5, 11-дигидро-6Н-пиридо/2,3-в/бензо1,4-диазепин-6-он, 10Н, 11Н-дибензо/в, f/1,4-селеназепин-11-он. Последний азепинон, а именно 10Н, 11Ндибензо/в, f/1,4-селеназепин-11-он также может быть получен из 2,2'-дибромбензанилида. Для этого в колбу загружают, например, 150 мл диметилформамида, 0,015 моля селена, 0,050 моля натрия. Смесь нагревают до 100оС при перемешивании в течение 4 часов. Когда все растворится, прибавляют 0,025 моля 2,2'-дибромбензанилида и оставляют при перемешивании в течение 20 часов при 100–110оС. Раствор выливают в смесь соляной кислоты и льда. Отфильтровывают осадок. Полученный продукт обрабатывают кипящим спиртом и фильтруют. Производное перекристаллизовывают из смеси диметилформамида и воды. Точка плавления 275оС. Ниже приводятся синтезы некоторых оригинальных азепинонов, еще не описанных в литературе. Приготовление 1. 8-хлор-5Н,6Н-пиридо/2,3-в/бензо-1,5-оксазепин-5-он/формула II: X = O, R1 = Cl в положении b, R2 = H, N1 = пиридин с N в положении d', N2 = бензол/. Раствор 0,1 моля хлоргидрида 2-хлорпиридин-3-карбоновой кислоты выливают понемногу в раствор 0,2 моля 2-амино-4-хлорфенола в 150 мл тетрагидрофурана. Оставляют при перемешивании и кипячении с обратным холодильником 1 час. Разбавляют 1 л воды. Собирают образовавшийся осадок, промывают и сушат. Сырой продукт используют как таковой для дальнейшей работы. Оксазепин получают обработкой амида теоретическим количеством этилата натрия в абсолютном спирте. При выпариании растворителя выделяется натриевая соль. При кипячении последней с обратным холодильником в течение 3–4 часов в диметилформамиде получают желаемую циклизацию. Концентрируют смесь отгонкой ДМФ в вакууме и оставляют кристаллизоваться при 0оС. Выделенный продукт промывают холодным метанолом и кристаллизуют из смеси ДМФ/метанол. Точка плавления 300оС. Приготовление 2. 5Н,6Н-8-метилпиридо/2,3-в/бензо-1,5-оксазепин-5-он/формула II: X=O, R1 = CH3 в положении b, R2 = H, N1 = пиридин с N в положении d', N2 = бензол/. Это вещество получают по методике приготовления 1, но используя в качестве исходных веществ 2-хлорпиридин-3-карбоновую кислоту и 2амино-4-метилфенол. Точка плавления 203оС. Приготовление 3. 8-хлор-5Н,6Н-пиридо/2,3-в/бензо-1,4-оксазепин-6-он/формула II: X = O, R1 = H, R2 = Cl в положении b', N1 = бензол, N2 = пиридин с N в положении d/. Готовят сложный фенольный эфир 5-хлорсалициловой кислоты, нагревая при кипячении с обратным холодильником 0,1 моля фенолаи 0,1 моля 5-хлорсалициловой кислоты в присутствии избытка OPCl3 в течение 2 часов. Реактив отгоняют в вакууме. Полученную пастообразную массу постепенно обрабатывают водой. Образовавшийся осадок отфильтровывают и промывают водой. Точка плавления 89оС. Нагревая в расплаве до прекращения реакции 0,05 моля полученного выше сложного эфира с 0,1 моля 3-амино-2-хлорпиридина, получают целевое соединение. Массу поглощают 30 мл этанола и тщательно растирают до получения фильтрующего осадка. После отделения продукт промывают этанолом и перекристаллизовывают из диоксана или из смеси ДМФ/метанол. Точка плавления 280оС. Приготовление 4. 5Н,6Н-пиридо/2,3-в/бензо-1,4-тиазепин-6он/формула II: X = S, R1 = R2 = H, N1 = бензол, N2 – пиридин с N в положении d/. Способ 1: а) получение 2-/фенилтио/пиридин-3-карбоновой кислоты. Диспергируют 0,2 моля тиофенола и 0,2 моля гидрида натрия (50%-ного) в 50 мл пропиленгликоля. К этой смеси прибавляют 0,1 моля 2-хлорпиридинкарбоновой кислоты и нагревают до кипения. По окончании реакции выпаривают растворитель. Остаток поглощают водой и устанавливают рН 7. Экстрагируют избыток тиофенола хлорформом. Водную фазу очищают активированным углем и подкисляют. Продукт осаждается в виде белого порошка. Точка плавления 164оС. в) полученное выше соединение превращают в азид при взаимодействии полученного выше хлоргидрида кислоты. Хлорангидрид кислоты выливают в избыток охлажденного раствора азида натрия. По окончании прибавления продолжают перемешивание в течение 1/4 часа и разбавляют водой. Продукт выделяют и используют после сушки как таковой в последующей реакции. Циклизацию соединения проводят по следующей методике. Прибавляют понемногу 1 г сырого азида к раствору AlCl3 в орто-дихлорбензоле при 120оС и при перемешивании. Выдерживают температуру в течение 0,5 часа. Затем смесь поглощают хлороформом и экстрагируют 0,1 Н соляной кислотой. Кислую фазу повторно экстрагируют несколько раз хлороформом. Объединяют хлороформные фазы, сушат и концентрируют в вакууме. Остаток обрабатывают ацетоном и оставляют на 2 часа на холоду. Осадок собирают фильтрованием. Точка плавления 206–208оС. Способ 2: Нагревают в расплаве 0,01 моля 3-амино-2хлорпиридина до прекращения реакции с 0,01 моля 2-тиосалициловой кислоты. После охлаждения осадок поглощают 30 мл этанола. Кипятят несколько минут, потом дают остыть. Отфильтровывают осадок, промывают этанолом и сушат. Точка плавления 205–208оС. Приготовление 5. 5 40569 5Н,6Н-пиридо/4,3-в/бензол-1,4-тиазепин-6он/формула II: X = S, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в положении b/. Нагревают при кипячении с обратным холодильником в течение нескольких часов 0,1 моля тиоасалициловой кислоты и 0,01 моля 3-амино-4хлорпиридина в присутствии орто-дихлорбензола. По окончании реакции удаляют растворитель. Остаток поглощают небольшим количеством воды и устанавливают рН 5–6. Соединение экстрагируют хлороформом. Выпаривают хлороформные экстракты. Остаток поглощают бикарбонатной водой и перемешивают 0,5 часа. Отфильтровывают суспензию соединения и промывают водой. Точка плавления 244оС. Приготовление 6. 8-хлор-5Н,6Н-пиридо/2,3-в/бензо-1,4-тиазепин-6-он/ формула II: Х = S, R1 = H, R2 = Cl в положении b', N1 = бензол, N2 = пиридин с азотом в положении d/. Соединение получают по методике, описанной в Приготовлении 4, способ 1. Точка плавления 314оС. Приготовление 7. 5Н,6Н-дигидро/2,3-в:3',2'/-1,4-тиазепин-5он/формула II: X = S, R1 = R2 = H, N1=N2 = пиридин с N в положении d и d'/. Получают хлорангидрид кислоты из 1,575 г 2хлорпиридин-3-карбоновой кислоты при взаимодействии с тионилхлоридом. После выпаривания избытка реагента остаток обрабатывают 200 мл диоксана и понемногу выливают в раствор 3,12 г 3-амино-2-меркаптопиридина в 50 мл диоксана при хорошем перемешивании. Продолжают перемешивание 1/4 часа, потом разбавляют в 5 раз водой. Все переходит в раствор и среда является слабокислой, в некоторых случаях удаляют осадок. Устанавливают рН 7 бикарбонатом и дают кристаллизоваться. Полученный продукт сушат в сушильном шкафу и перекристализовывают из толуола при необходимости. Точка плавления 183оС. Прибавляют 0,01 ммоля амидного производного в суспензии 0,012 моля трет-бутилата натрия в 50 мл ДМФ. Кипятят с обратным холодильником в течение 10–20 часов, выпаривают ДМФ в вакууме и поглощают остаток 50 мл воды. Отфильтровывают осадок, промывают водой и сушат. После сушки его обрабатывают эфиром и тщательно растирают. После фильтрации и сушки продукт при необходимости может быть перекристаллизован из ДМФ. Точка плавления 305оС. Приготовление 8. 8-хлор-5Н,6Н-пиридо/2,3-в/бензо-1,4-тиазепин-6-он/формула II: X = NH, R1 = Cl в положении b, R2 = H, N1 = бензол, N2 = пиридин с N в положении d/. 1) Обрабатывают 0,01 моля 5-хлор-2-нитробензойной кислоты 20 мл SOCl2 и несколькими каплями ДМФ при кипячении с обратным холодильником в течение 1 часа. Отгоняют избыток SOCl2, остаток поглощают 20 мл диоксана. Этот раствор понемногу прибавляют к раствору 0,015 моля 3-амино-2-хлорпиридина в 20 мл диоксана. После часа перемешивания смесь разбавляют пятикратным объемом воды. Отфильтровывают осадок, промывают холодной водой. При необходимости продукт перекристаллизовывают из изопропанола. Точка плавления 190оС. 2) Растворяют 0,01 моля нитропроизводного в 25 мл концентрированной НСl. К этому раствору прибавляют понемногу 11 г SnCl2 ×2H2O растворенного в 20 мл концентрированной НСl. Затем раствор выдерживают в течение часа на водяной бане. После охлаждения осадок отфильтровывают, поглощают 10%-ным NaOH и экстрагируют хлороформом. Хлороформную фазу сушат и концентрируют до малого объема в присутствии петролейного эфира 100–140. Кристаллический продукт фильтруют и промывают петролейным эфиром 40–60. Точка плавления 173оС. 3) Растворяют 0,01 моля аминопроизводного, полученного в 2), в 18 мл монометилового эфира диэтиленгликоля. Прибавляют 0,2 мл 5%-ной НСl. Смесь нагревают до 130оС при перемешивании. После 2–3 часов нагревания получают суспензию. По окончании реакции смесь охлаждают и фильтруют. Выделенный продукт промывают холодным метанолом и перекристаллизовывают из диоксана при необходимости. Точка плавления 296оС. Приготовление 9. 5,1-дигидро-8-фтор-6Н-пиридо/2,3-в/бензо1,4-диазепин-6-он/формула II: Х = NH, R1 = F в положении d', R2 = H, N1 = бензол, N2 = пиридин с N положении d/. Это соединение получают по способу Приготовления 8, но исходя из 5-фтор-2-нитробензойной кислоты и 3-амино-2-хлорпиридина. Точка плавления 270оС. Общий способ получения метилпиперазиназепинов формулы (I) изобретения из азепинонов формулы (II) может быть осуществлен в соответствии с тремя вариантами реализации, схемы которых даны и прокомментированы ниже. 6 40569 зилхлорид для получения тиоэфира (IV). Соединение формулы (I) получают при взаимодействии тиоэфира в присутствии N-метилпиперазина и ледяной уксусной кислоты. (Смотри в этом отношении Ханзиккер с сотр., Helv. Chim. Acta, 50, 1588, 1967). R' = пара-нитробензил R = N-метилпиперазинил. Из азепинона (II) синтезируют соответствующий тион (III) при действии Р2S5 в пиридине. Выделяют сырой продукт, используют его как таковой и прибавляют трет-бутилат калия и паранитробенСхема В: R=N-метилпиперазинил Смешивают азепинон (II) с N-метилпиперазином в присутствии раствора TiCl4 в анизоле. Эта смесь позволяет получить при перемешивании и нагревании соединение (I) изобретения (Смотри в этом отношении Чакрабарти Дж. К. с сотр., J. Med. Chem.), 878, 1980 и Пресс Дж. с сотр., J. Med. Chem. 22, 725, 1979). Схема С: адекватном растворителе, как, например, в спирте, потом, при необходимости, для осаждения соли добавляют другой растворитель, смешивающийся с первым и в котором соль нерастворима, например, простой эфир, или нейтрализуют эфирный раствор кислоты или основания основанием или кислотой. Использование кислоты являются или органическими кислотами или неорганическими кислотами. В качестве неорганических кислот используют предпочтительно соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфорную кислоту, хлорную кислоту и т.п. Органические кислоты являются или карбоновыми кислотами или сульфоновыми кислотами, например, уксусной, лимонной, малеиновой, фумаровой, пропионовой, гликолевой, молочной, аскорбиновой, янтарной, винной, фенилуксусной, бензойной, п-аминобензойной, антраниловой, п-оксибензойной, салициловой, метансульфоновой, этансульфоновой, глюкуроновой и т.п. Ниже приводятся детальные примеры получения некоторых производных метилпиперазиназепинов согласно изобретению. Пример 1. 11-/4-метилпиперазин-1-ил/-5Н-пиридо/4,3в/бензо-1,5-диазепин / формула I: X = NH, R1 = R2 = =H, N1 = пиридин с N положении b', N2 = бензол/. Способ А: 1) Обрабатывают 0,01 моля 5,10-дигидро11Н-пиридо/4,3-в/бензо-1,5-диазепин-11-она избытком Р2S5 в пиридине при кипячении с обратным холодильником. После нескольких часов наг R = N-метилпиперазинил. Азепинон (II) обрабатывают ОРСl3, и ДМФ, чтобы получить соответствующий иминохлорид (V), который без выделения вводят в реакцию и последующую конденсацию с N-метилпиперазином в толуоле, чтобы получить соединение (I) /Смотри в этом отношении Ханзиккер с сотр., Helv. Chim. Acta, 49/5/, 1938, 1966/. Можно также синтезировать соединения изобретения без использования азепинона (II) как исходного или промежуточного продукта, как будет показано далее в рамках синтеза метилпиперазиназепина Примера 21, из продукта реакции орто-галоиднитропиридина формулы (V). (V) в которой Hal является атомом галоида, таким как Cl, F, 1 или Br, и бензолкарбоновой кислоты формулы (VI): (VI) в которой Х имеет указанные ранее значения. Соли метилпиперазиназепинов формулы I могут быть получены по хорошо известным на практике способам. Обычно эти соли могут быть получены при взаимодействии эквимолекулярного количества метилпиперазиназепина с кислотой в 7 40569 ревания удаляют избыток реагентов и растворителя. Остаток осторожно обрабатывают льдом. Выделяют образовавшийся осадок и используют как таковой для дальнейшей работы. 2) Прибавляют 5,2 г тиолактама к суспензии трет-бутилата калия в 80 мл диоксана (приготовленной следующим образом: 1,64 г калия растворяют в 40 мл трет-бутанола, после окончания выделения газов удаляют растворитель и остаток поглощают 80 мл диоксана). Смесь час кипятят с обратным холодильником. Затем прибавляют 4,1 г пара-нитробензилхлорида. Кипятят с обратным холодильником 4 часа. Удаляют растворитель. Остаток поглощают хлороформом и промывают щелочью. Хлороформную фазу сушат и выпаривают досуха. Остаток перекристаллизовывают из смеси петролейный эфир/ацетон. Точка плавления 127оС. 3) Кипятят с обратным холодильником 4,3 г тиоэфира, полученного в 2), в течение 24 часов в присутствии 10 мл N-метилпиперазина и 0,1 мл ледяной уксусной кислоты. После выпаривания досуха остаток поглощают разбавленной уксусной кислотой. При необходимости фильтруют осадок. Фильтрат обесцвечивают обработкой активированным углем. Осаждают основание добавлением концентрированного гидрата окиси аммония, фильтруют, промывают водой и сушат. Продукт может быть перекристаллизован из смеси дихлорметан/гексан. Точка плавления 216оС. Способ В: Перемешивают 0,01 моля 5,10-дигидро-11Нпиридо/4,3-в/бензо-1,5-диазепин-11-она в 10 мл Nметилпиперазина. При перемешивании осторожно добавляют к суспензии диазепинона раствор 1,2 мл TiCl4 в 5 мл анизола. Реакционную смесь выдерживают при перемешивании при 120оС в течение 2–3 часов. Смесь охлаждают и поглощают ледяной водой. рН раствора должно быть щелочным. Тогда продукт экстрагируют дихлорметаном. После выпаривания растворителя очищают остаток на колонке с кизельгуром (элюент: ацетон/петролейный эфир 40-60:9/1). После удаления элюента перекристаллизовывают продукт из гексана. Точка плавления 216оС. Пример 2. 6-/4-метилпиперазин-1-ил/пиридо/2,3-в/бензо-1,4-тиазепин/ формула I: X = S, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в положении d/. Обрабатывают 3 г 5Н, 6Н-пиридо/2,3-в/бензо-1,4-тиазепин-6-она избытком оксихлорида фосфора и 5 каплями N,N-диметиланилина при кипячении с обратным холодильником в течение 20 часов. Раствор обрабатывают безводным толуолом и выпаривают досуха. Остаток поглощают 50 мл безводного толуола и прибавляют избыток N-метилпиперазина. Потом эту смесь кипятят с обратным холодильником в течение 2–4 часов. Сразу по окончании реакции удаляют растворитель. Окрашенную массу обрабатывают хлороформом и промывают два раза водой. Хлороформную фазу обесцвечивают углем и сушат. После концентрирования до малого объема смесь пропускают через колонку с оксидом кремния (Woelm act III). Элюируют ацетоном. Сразу после отделения различные фазы, содержащие целевой продукт, выпаривают досуха. Остаток перекристаллизовы вают из петролейного эфира 100–140. Точка плавления 134оС. Пример 3. Фумарат 8-хлор-6-/4-метилпиперазин-1-ил/пиридо/2,3-в/бензо-1,4-тиазепин/ формула I: X = S, R1 = =H, R2 = Cl в b', N1 = бензол, N2 = пиридин с N в положении d'/. Исходя из 5Н, 6Н-пиридо/2,3-в/бензо-1,4-оксазепин-6-она получают метилпиперазиназепиновое основание, указанное в названии, согласно способу примера 2. После выпаривания хлороформных фракций растворяют остаток в минимальном количестве кипящего спирта. Прибавляют эквимолекулярное количество фумаровой кислоты, предварительно растворенной в горячем спирте. Раствор охлаждают. Если продукт не кристаллизуется при стоянии, прибавляют эфир для кристаллизации. После отстоя получают белый порошок, который отделяют и промывают эфиром. Точка плавления 198оС. Пример 4. Малеат 5-/4-метилпиперазин-1-ил/пиридо/2,3в/бензо-1,5-оксазепин/формула I: X = O, R1 = R2 = H, N1 = пиридин с N в положении d', N2 = бензол/. Продукт получают из 5Н,6Н-пиридо/2,3в/бензо-1,5-оксазепин-5-она и по методике примера 2. Хлороформные фракции затем выпаривают досуха. Остаток поглощают метилэтилкетоном. Прибавляют эквимолекулярное количество малеиновой кислоты, растворенной в метилэтилкетоне, потом безводный простой эфир. Продукт кристаллизуется. Его выделяют и промывают эфиром. Точка плавления 206оС. Пример 5. Фумарат 8-хлор-5-/4-метилпиперазин-1-ил/пиридо/2,3-в/бензо-1,5-оксазепин/ формула I: X = O, R1 = Cl в положении b, R2 = H, N1 = пиридин с N в положении d'/, N2 = бензол/. Из оксазепина, описанного в Приготовлении 1, и используя методику примера 2, выделяют соединение в виде фумарата также, как и в примере 3. Точка плавления 260оС. Пример 6. Фумарат 5-/4-метилпиперазин-1-ил/-8-метилпири-до/2,3-в/бензо-1,5-оксазепин/ формула I: X = O, R1 = CH3 в b, R2 = H, N1 = пиридин с N в положении d', N2 = бензол/. Из оксазепина, описанного в Приготовлении 2, и используя методику примера 2, выделяют соединение в виде фумарата, также, как в примере 3. Точка плавления 235оС. Пример 7. Фумарат 6-/4-метилпиперазин-1-ил/-пиридо/2,3в/бензо-1,4-оксазепин/ формула I: X = O, R1 = R2 = H, N1 = =бензол, N2 = пиридин с N в положении d/. Исходя из 5Н,6Н-пиридо/2,3-в/бензо-1,4-оксазепин-6-она и используя методику примера 2, выделяют соединение в виде фумарата. Точка плавления 183оС. Пример 8. Фумарат 8-хлор-6-/4-метилпиперазин-1-ил/пиридо/2,3-в/бензо-1,4 -оксазепина/ формула I: X = O, R1 = Н, R2 = Cl в положении b', N1 = бензол, N2 = пиридин с N в положении d/. Исходя из 8-хлор-5Н,6Н-пиридо/2,3-в/бензо1,4-оксазепин-6-она Приготовления 3, получают 8 40569 соединение по способу примера 2. Соединение выделяют в виде фумарата также, как в примере 3. Точка плавления 250оС. Пример 9. 6-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3в/бензо-1,4-диазепин/ формула I: X = NH, R1 = R2 = =H, N1 = бензол, N2 = пиридин с N в положении d/. Исходя из 5,11-дигидро-6Н-пиридо/2,3в/бензо-1,4-диазепин-6-она, проводят конденсацию согласно способу В примера 1. Точка плавления 141оС. Пример 10. 8-хлор-6-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3-в/бензо-1,4-диазепин/ формула I: X = NH, R1 = Cl в b', R2 = H, N1 = бензол, N2 = пиридин с N в d/. Исходя из тиазепинона Приготовления 8, получают целевой продукт, согласно условиям работы, описанным в примере 1, способ В. Точка плавления 180оС. Пример 11. 6-/4-метилпиперазин-1-ил/-8-метил-11Н-пиридо/2,3-в/бензо-1,4 -диазепин/ формула I: X = NH, R1 = CH3 в b', R2 = H, N1 = бензол N2 = пиридин с N в d/. Исходя из 5,11-дигидро-8-метил-6Н-пиридо/2,3-в/бензо-1,4-тиазепин-6-она, получают соединение, указанное в заглавии, согласно методике примера 1, способ В. Точка плавления 157оС. Пример 12. 9-хлор-6-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3-в/бензо-1,4-диазепин/ формула I: X = NH, R1 = Cl в с', R2 = H, N1 = бензол, n2 = пиридин с N в d/. Исходя из 9-хлор-5,11-дигидро-6Н-пиридо/2,3в/бензо-1,4-диазепин-6-она, получают продукт, указанный в названии, по методике примера 1, способ В. Точка плавления 186оС. Пример 13. 8-фтор-6-/4-метилпиперазин-1-ил/-11Н-пиридо/2,3-в/бензо-1,4-диазепин/ формула I: X = NH, R1 = F в b', R2 = H, N1 = бензол, N2 = пиридин с N в d/. Исходя из диазепинона Приготовления 9, получают соединение, указанное в заглавии, по методике примера 1, способ В. Точка плавления 188оС. Пример 14. 5-формил-11-/4-метилпиперазин-1-ил/-5Hпиридо/4,3-в/бензо-1,5 -диазепин/формула I: X = = N 11-формил-5 -/4-метилпиперазин-1-ил/-11Нпиридо/2,3-в/бензо-1,5-диазепин/ формула I: X = =N , R1 = R2 = H, N1 = пиридин с N в d', N2 = =бензол/. Исходят из соединения, описанного в статье Чакрабарти с сотр. J. Med. Chem., 32, №10, 2375– 2381, 1981, и проводят формилирование по методике примера 14. Точка плавления 194оС. Пример 16. 11-трифторметилкарбонил-5- /4-метилпиперазин-1-ил/-11Н-пиридо/2,3-в/бензо-1,5-диазепин/ формула I: X = R1 = R2 = H, N1 = пиридин с N в d', N2 = бензол/. Исходят из соединения, описанного в статье, указанной в примере 15. Перемешивают 0,02 моля соединения с 15 мл ангидрида трифторуксусной кислоты и несколькими каплями N,N-диметиланилина при хорошем охлаждении, потом кипятят с обратным холодильником в течение 5 минут и оставляют при перемешивании на ночь. Выливают на лед, подщелачивают, экстрагируют хлороформом. Очищают на колонке с оксидом кремния и концентрируют. Перекристаллизовывают из гексана. Точка плавления 183оС. Пример 17. 11-формил-6- /4-метилпиперазин-1-ил/-11Нпиридо/2,3-в/бензо-1,4-диазепин/ формула I: X = =N , R1 = R2 = H, N1 = бензол, N2 = пиридин с N в d/. Исходят из соединения примера 9 и проводят формилирование по методике примера 14. Точка плавления 202оС. Пример 18. 10-/4-метилпиперазин-1-ил/пиридо/4,3-в/бензо-1,4-тиазепин/ формула I: X = S, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в b/. Исходят из тиазепинона Приготовления 5, получают соединение, указанное в названии, используя способ примера 2. Точка плавления 143– 144оС. Пример 19. 5-/4-метилпиперазин-1-ил/дибензо/в,f/1,4селеназепин/ формула I: X = Se, R1 = R2 = H, N1 = N2 = бензол/. Исходят из 10Н, 11Н-дибензо/в,f/1,4-селеназепин-11-она и получают соединение, указанное в заглавии, используя способ примера 2. Точка плавления 107оС. Пример 20. 6-/4-метилпиперазин-1-ил/дипиридо/2,3-в:3', 2'-f/1,4-тиазепин/ формула I: X = =S, R1=R2=H, N1=N2 = пиридин с N в d в d'/. Продукт получают из соединения Приготовления 7, используя способ примера 2. Точка плавления 170оС. Пример 21. 6-/4-метилпиперазин-1-ил/-11-метил-11Н-пиридо/ 2,3-в/бензо-1,4-диазепин/ формула I: X = =N-CH3, R1=R2=H, N1 = бензол, N2 = пиридин с N в положении d/. Кипятят с обратным холодильником в течение 24 часов 0,02 моля 2-хлор-3-нитропиридина, 0,01 моля N-метилантраниловой кислоты, 5 г безводного К2СО3 и 50 мл сухого изопропанола. Пос , R1 = R2 = H, N1 = пиридин с N в b', N2 = бензол/. Исходят из соединения примера 1. Охлаждают 15 мл уксусного ангидрида и прибавляют туда понемногу при перемешивании 7 мл 99%-ной муравьиной кислоты. Смесь нагревают в течение 15 минут при 50оС, потом охлаждают на ледяной бане. Прибавляют 0,02 моля соединения примера 1, оставляют при перемешивании на ночь. Смесь обрабатывают льдом, подщелачивают и экстрагируют дихлорметаном. Сушат и концентрируют в вакууме, перекристаллизовывают из гексана. Точка плавления 196оС. Пример 15. 9 40569 ле выпаривания растворителя остаток поглащают водой и доводят до кипения в присутствии активированного угля. После охлаждения раствор подкисляют до рН 3. Продукт осаждается в виде желтого порошка, его отфильтровывают, промывают водой и сушат. Точка плавления 174оС. Суспендируют в безводном эфире 0,005 моля полученной кислоты. Соединение этерифицируют диазометаном, который получают из 4 г нитрозометилмочевины при разложении его едким натром в присутствии эфира. Эфирный раствор диазометана понемногу приливают к эфирному раствору нитрокислоты. Сразу по окончании реакции выпаривают растворитель. Остаток поглощают раствором NaHCO3 и экстрагируют два раза СНСl3. Хлороформный раствор сушат и концентрируют в присутствии петролейного эфира 100– 140. Затем отфильтровывают кристаллический продукт и промывают петролейным эфиром 40– 60. Точка плавления 71оС. Каталитически восстанавливают 0,01 моля производного нитроэфира (растворенного в 150 мл этанола) на 1г 10%-ного палладия на угле /Pd/C/ в гидрогенизаторе низкого давления. Через 2 часа реакция заканчивается и растворитель выпаривают. Остаток (аминоэфир) поглощают 50 мл анизола и переносят в колбу. Прибавляют 20 мл N-метилпиперазина. Смесь нагревают при перемешивании до 120оС. Осторожно приливают к смеси раствор 5 мл TiCl4 в 10 мл анизола. Реак ционную смесь 12 часов кипятят с обратным холодильником. Затем смесь охлаждают и обрабатывают 10 мл изопропанола, 10 мл концентрированного гидрата окиси аммония и 2 г оксида кремния. Смесь фильтруют и собранный осадок промывают тщательно хлороформом. Фильтрат промывают один раз водой, потом экстрагируют 2н. НСl. Этот раствор обесцвечивают активированным углем и подщелачивают гидратом окиси аммония. Образовавшийся осадок экстрагируют хлороформом. Хлороформные фракции объединяют и концентрируют до малого объема. Полученный остаток очищают на колонке с кизельгуром, элюируя смесью 9/1 ацетона и петролейного эфира 40–60. Сразу после выделения перекристаллизовывают продукт из смеси дихлорметана и гексана. Точка плавления 146оС. Соединения изобретения были изучены в соответствующих фармакологических тестах, чтобы показать активность на уровне центральной или периферической нервной системы. Были получены следующие результаты на веществах примеров 1, 10, 11, 17, 18 и 19. Они подтверждают антидепрессивную, антипсихотическую, анксиолитическую, нейролептическую или седативную активность соединений изобретения. Ин витро: Тесты сродства к допаминэргтическим рецепторам Д2 и мускаринэргетическим рецепторам. Код Ингибирование, % (связывание 3 Н-спиперона) Ингибирование, % 3 (связывание Н Q, B) Клозапин Клотиапин Галоперидол Пример 1 Пример 10 Пример 11 Пример 17 Пример 18 Пример 19 57,3 94,6 100 56,2 31,5 24,8 22,8 50,2 26,7 80,35 38,05 0 4,48 62,08 67,3 43,38 57,61 78,31 0,2 мг белка), 100 мкл (10-6 М) испытуемого вещества и 600 мкл буфера для конечного объема 1 мл. Контрольные трубки, взятые для контроля неспецифического связывания, содержат также 1 мкМ (+)-бутакламола. Содержимое (в трех повторах) затем инкубируют с 0,5 нМ 3Н/спироперона при 25оС в течение 60 минут. Манипуляцию прекращают, быстро фильтруя в вакууме суспензию через фильтр из стекловолокна CF/C. Фильтр три раза промывают 5 мл ледяного буфера. Измеряют радиоактивность на спектрометре с жидкой сцинтилляцией /ZKB Rack Beta 1219/. Результаты приведены как разница в процентах между контролем (1mМ)+(бутакламола) и испытуемым веществом. Характеристика мускариновых рецепторов: Допаминэргетические рецепторы Д2: Характеристика опытами по замещению (3Н/спиперона). Приготовление мембран: Изымают мозг у самцов крыс Вистар (200– 250 г ). Полосатое тело быстро иссекают и гомогенизируют в 20 мл ледяного буфера (50 нМ Трис/HCl, рН = 7,4, 25оС), используя тефлоновый гомогенизатор. Гомогенат центрифугируют при 4оС и 10000g в течение 10 минут, донную часть два раза промывают ледяным буфером и повторно центрифугируют. Конечную донную часть суспендируют в ледяном буфере (50 нМ/HCl, рН = =7,4), содержащем 5 нМ MgSO4, 0,5 нМ ЕДТА. После повторной гомогенизации суспензию устанавливают на 1 мг белка/мл. Определяют количество белка по методу Лоури с сотр. /J. Biol. Chem. 193, 265–275 (1951), используя в качестве стандарта бычий сывороточный альбумин. Опыт по связыванию. Используют метод, разработанный Текоттом с сотр. (Biol. Psychiatry 21, 1114–1122 (1986). Оценивают связывание 3Н/-спироперона по следующей смеси: 200 мкл мембранного препарата (0,1– Связи рецепторов: Cпособ основан на методике, описанной Ямамура и Снайдером (Proc. Natl. Sci, USA, 71, 1725 (1974). После быстрого изъятия мозг крысы CFY (130–180 г) рассекают для удаления мозжечка. Другие ткани гомогенизируют с "Поттером" в растворе 0,32 М сахарозы, 50 мМ буфера Трис/HCl, рН 7,5. Концентрацию белка опреде 10 40569 ляют по методике Петерсона (Anal. Biochem, 83, 346 (1977). Опыт по связыванию проводили три раза при 25оС. Среда инкубации (1 мл) состоит из 60 мМ NaCl, буфера Трис/HCl рН 7,5 и 1,5 нМ /3H/QNB/Нью Инглэнд Ньюклеар, опред. активность: 1,18 ТВq/моль). Реакционную смесь выдерживают с гомогенатом в течение 60 минут, гомогенaт содержит 250–400 мкг белка. Неспецифическое связывание осуществляется 10-5 М атропина. Прекращение манипуляции осуществляют быстрой фильтрацией через стеклянный фильтр Ватмана CF/C. Свободный лиганд также удаляют. Каждый образец промывают 2х10 мл холодного буфера. Фильтры сушат, переводят в толуольный раствор для сцинтилляции и помещают в счетчик с компьютером Паккард Трикарб жидкий сцинтилляционный счетчик/ на день. Связь с рецептором прямо пропорциональна концентрации белка до 700 мкг белка/мл. Ин виво: Тест на антагонизм к апоморфину. При 20 мг/кг большинство соединений снижает подвижность у животных и обладает седативным действием. В большинстве случаев соединения обладают активностью, интенсивность которой находится между активностью клозапина (20 мг/кг) (+) и активностью галоперидола (0,63 мг/кг (+++++). Следующие результаты приводятся в качестве примера. Пример 1 ++ Пример 5 + Пример 7 + Пример 8 +++ Пример 10 +++ Пример 11 +++ Пример 12 + Пример 13 + Пример 19 ++ Тест на каталепсию. См., например, Грей У.Д., Остерберг А.Ч., Раух Ч.Е., Arch. Int. Pharmacod у n. 134, 198, 1981, и Костолл В., Оллей Дж. Neuropharmacology 10, 297, 1971. Этот тест показывает уровень экстрапирамидальных эффектов, которые имеются у многих нейролептиков (побочный нежелательный эффект). Соединения изобретения провоцируют очень низкую каталепсию и, следовательно, кажутся лишенными этого побочного нежелательного действия. Однако некоторые продукты обладают слабой каталепсией: Пример 4: слабый каталептический эффект, начиная с 20 мг/кг. Клозапин; незначительный каталептический эффект, начиная с 20 мг/кг. Объектом настоящего изобретения являются также фармацевтические композиции, которые содержат в качестве активного составляющего одно или несколько соединений формулы (I), одних или с другими активными веществами подобного или другого действия, в смеси с фармацевтически приемлемыми экципиентами. Эти фармацевтические композиции могут быть твердыми, например, таблетки с покрытием и без него, покрытие может быть в один или несколько слоев, облатки, капсулы, диспергируемые или растворимые порошки, суппозитории, или жидкими, например, растворы, суспензии, эмульсии, сиропы, препараты для парентеpального введения, например, в виде аэрозоля. Твердые композиции для орального применения могут быть приготовлены при смешивании одного или нескольких веществ согласно изобретению, например, с молочным сахаром, сахарным порошком, крахмалом, тальком, с продуктами, предназначенными для замедления или пролонгирования эффекта, например, ацетофталатом целлюлозы, стеаратами глицина, ионообменными смолами. Суппозитории могут быть приготовлены при введении одного или нескольких веществ согласно изобретению в масло какао, например, или в любое другое подходящее вещество, например, моно-, ди- и триглицериды насыщенных жирных кислот. Жидкие композиции могут быть приготовлены, например, при растворении, суспендировании или переведении в эмульсию в момент приготовления или непосредственно перед введением одного или нескольких веществ согласно изобретению и, кроме того, любого другого продукта, присутствие которого является желательным или необходимым, например, консервантов, таких как метил-п-оксибензоаты и пропил-н-оксибензоаты, загустители и эмульгаторы, например, производные целлюлозы и сложные эфиры полиоксиэтиленсорбитан, пищевые и ароматизирующие добавки, например, сахар, сахарин, сорбит, природные или синтетические эссенции, изотонизаторы, например, хлористый натрий, или буферы, например, фосфаты натрия, в дистиллированной воде, в других приемлемых гидроксилсодержащих жидкостях, таких как этанол, глицерин, некоторые гликоли, в смесях этих растворителей или в фармацевтически приемлемых маслах. Примеры 1 и 3: каталепсия при дозах выше 40 мг/кг. Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 11 40569 12
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of methylpiperazineazepine , method for obtaining thereof (variants), pharmaceutical composition based thereon
Автори англійськоюLiegeois Jean-Francois Fernand, Delarge Jacques Eli
Назва патенту російськоюПроизводные метилпиперазиназепина, способ их получения (варианты), фармацевтическая композиция на их основе
Автори російськоюЛьежуа Жан-Франсуа Фернан, Деларж Жак Эли
МПК / Мітки
МПК: C07D 513/04, C07D 471/04, C07D 498/04, A61K 31/4353, C07D 517/00, A61K 31/496, A61P 25/02
Мітки: фармацевтична, одержання, основі, варіанти, метилпіперазиназепіну, композиція, спосіб, похідні
Код посилання
<a href="https://ua.patents.su/12-40569-pokhidni-metilpiperazinazepinu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні метилпіперазиназепіну, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі</a>
Попередній патент: Комплексна сіль гематопорфірину і його похідних для виявлення і/або лікування новоутворень, спосіб її отримання і фармацевтична композиція, яка її містить
Наступний патент: Спосіб виробництва м’яса свиней, великої та малої рогатої худоби, що має поліпшені органолептичні властивості, і набір для анти-лгрг вакцинації
Випадковий патент: Пристрій для вирізування бокових отворів в циліндричних деталях