Комплексна сіль гематопорфірину і його похідних для виявлення і/або лікування новоутворень, спосіб її отримання і фармацевтична композиція, яка її містить
Формула / Реферат
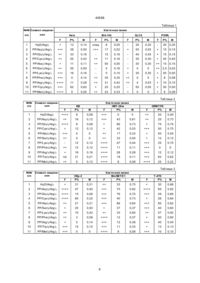
1. Комплексная соль гематопорфирина и его производных формулы (1):
, (1)
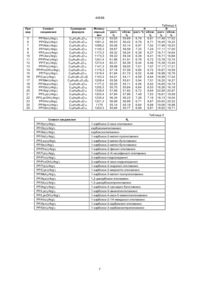
где R1 и R2 одинаковые или различные и обозначают группу -СН=СН2, группу -СН(ОН)СН3, группу -СН(ОR3)СН3, где R3 обозначает группу, образующую олигомер, содержащий связи эфирные и/или сложноэфирные, составленную из 1 до 5 одинаковых или разных единиц, происходящих от мономера формулы (2):
, (2)
или R1 и R2 одинаковые и обозначают группу -СН(R4)СН3, где R4 обозначает карбоксиметиламиновую группу, 1-карбоксиэтиламиновую группу, 1-карбокси-2-метил-пропиламиновую группу, 1-карбокси-2-метил-бутиламиновую группу, 1-карбокси-3-метил-бутиламиновую группу, 1-карбокси-бутиламиновую группу, 1-карбокси-пентиламиновую группу, 1-карбокси-2-гидрокси-этиламиновую группу, 1-карбокси-2-гидрокси-пропиламиновую группу, 1-карбокси-2-меркапто-этиламиновую группу, 1-карбокси-3-метилтио-пропиламиновую группу, 1,2-дикарбокси-этиламиновую группу, 1-карбокси-2-карбамоил-этиламиновую группу, 1,3-дикарбокси-пропиламиновую группу, 1-карбокси-3-карбамоил-пропиламиновую группу, 1-карбокси-2-фенил-этиламиновую группу, 1-карбокси-2-(4-гидрокси-фенил)-этиламиновую группу, 1-карбокси-2-индолил-этиламиновую группу, 2-карбокси-пиролидиновую группу, 2-карбокси-4-гидрокси-пиролидиновую группу, 1-карбокси-5-амино-пентиламиновую группу, 1-карбокси-4-гуанидилобутиламиновую группу, 1-карбокси-4-гидрокси-5-амино-пентиламиновую группу или 1-карбокси-2-(1Н-имидазол)-этиламиновую группу;
А обозначает основную аминокислоту;
m равняется 2-4;
n равняется 1-5,
для обнаружения и/или лечения новообразований.
2. Соль по п. 1, отличающаяся тем, что А обозначает аргинин, лизин, гистидин или гидроксилизин.
3. Соль по п. 1, отличающаяся тем, что R1 или R2 одинаковые и обозначают группу -СН(R4)СН3.
4. Соль по любому из пп. 1-3, отличающаяся тем, что в ней m = 2, n = 1.
5. Способ получения новых комплексных солей гематопорфирина и его производных формулы (1):
, (1)
где R1 и R2 одинаковые или различные и обозначают группу -СН=СН2, группу -СН(ОН)СН3, группу -СН(ОR3)СН3, где R3 обозначает группу, образующую олигомер, содержащий связи эфирные и/или сложноэфирные, составленную из 1 до 5 одинаковых или разных единиц, происходящих от мономера формулы (2):
, (2)
или R1 и R2 одинаковые и обозначают группу -СН(R4)СН3, где R4 обозначает карбоксиметиламиновую группу, 1-карбоксиэтиламиновую группу, 1-карбокси-2-метил-пропиламиновую группу, 1-карбокси-2-метил-бутиламиновую группу, 1-карбокси-3-метил-бутиламиновую группу, 1-карбокси-бутиламиновую группу, 1-карбокси-пентиламиновую группу, 1-карбокси-2-гидрокси-этиламиновую группу, 1-карбокси-2-гидрокси-пропиламиновую группу, 1-карбокси-2-меркапто-этиламиновую группу, 1-карбокси-3-метилтио-пропиламиновую группу, 1,2-дикарбокси-этиламиновую группу, 1-карбокси-2-карбамоил-этиламиновую группу, 1,3-дикарбокси-пропиламиновую группу, 1-карбокси-3-карбамоил-пропиламиновую группу, 1-карбокси-2-фенил-этиламиновую группу, 1-карбокси-2-(4-гидрокси-фенил)-этиламиновую группу, 1-карбокси-2-индолил-этиламиновую группу, 2-карбокси-пиролидиновую группу, 2-карбокси-4-гидрокси-пиролидиновую группу, 1-карбокси-5-амино-пентиламиновую группу, 1-карбокси-4-гуанидилобутиламиновую группу, 1-карбокси-4-гидрокси-5-амино-пентиламиновую группу или 1-карбокси-2-(1Н-имидазол)-этиламиновую группу;
А обозначает основную аминокислоту;
m равняется 2-4;
n равняется 1-5, отличающийся тем, что производное гематопорфирина с общей формулой (4)
, (4)
в которой R1 и R2 имеют указанные выше значения, с тем, что
если R1 и R2 обозначают группу -СН(R4)СН3, то карбоксиловые группы заместителя R могут быть свободными или защищенными,
подвергают реакции с основной аминокислотой со свободными или защищенными карбоксильными группами или с ее монохлоргидридом, или устраняют группы, обеспечивающие карбоксильные функции и выделяют продукт, являющийся солью формулы (1).
6. Способ по п. 5, отличающийся тем, что реакцию проводят в органическом растворителе, в смеси органических растворителей или в среде, содержащей органический растворитель и воду, или содержащий смесь органических растворителей и воду.
7. Способ по п. 5, отличающийся тем, что в качестве аминокислоты применяют аргинин, лизин, гистидин или гидроксилизин.
8. Способ по п. 5, отличающийся тем, что соль выделяют, добавляя в реакционную смесь низкополярный растворитель или смесь этих растворителей, образующих гомогенный раствор с растворителем, применяемым в реакции.
9. Фармацевтическая композиция для диагностики и/или лечения новообразований, включающая действующее средство на основе гематопорфирина и носитель, отличающаяся тем, что в качестве действующего средства она содержит еффективное количество соединения формулы (1), где R1, R2, А, m, n имеют значение, указанное в п. 1.
10. Фармацевтическая композиция по п. 9, отличающаяся тем, что в качестве действующего средства она включает смесь по крайней мере двух солей формулы (1) в эффективном количестве.
11. Фармацевтическая композиция по п. 10, отличающаяся тем, что в качестве действующего средства она содержит смесь, включающую основные аминокислотные соли эфиров гематопорфирина, протопорфирина, винилдейтеропорфирина и дигематопорфирина.
Текст
1. Комплексная соль гематопорфирина и его производных формулы (1): C2 (54) КОМПЛЕКСНА СІЛЬ ГЕМАТОПОРФІРИНУ І ЙОГО ПОХІДНИХ ДЛЯ ВИЯВЛЕННЯ І/АБО ЛІКУВАННЯ НОВОУТВОРЕНЬ, СПОСІБ ЇЇ ОТРИМАННЯ І ФАРМАЦ ЕВТИЧНА КОМПОЗИЦІЯ, ЯКА ЇЇ МІСТИТЬ (ІІ) Зоя (І) 40568 где R1 и R2 одинаковые или различные и обозначают группу -СН=СН 2, группу -СН(ОН)СН3, группу СН(ОR3)СН3, где R3 обозначает группу, образующую олигомер, содержащий связи эфирные и/или сложноэфирные, составленную из 1 до 5 одинаковых или разных единиц, происходящих от мономера формулы (II): (IV) в которой R1 и R2 имеют указанные выше значения, с тем, что если R1 и R2 обозначают группу CH(R4)-СН3, то карбоксиловые группы заместителя R4 могут быть свободными или защищенными, подвергают реакции с основной аминокислотой со свободными или защищенными карбоксильными группами или с ее монохлоргидридом, или устраняют группы, обеспечивающие карбоксильные функции и выделяют продукт, являющийся солью формулы (I). 6. Способ по п. 5, отличающийся тем, что реакцию проводят в органическом растворителе, в смеси органических растворителей или в среде, содержащей органический растворитель и воду, или содержащей смесь органических растворителей и воду. 7. Способ по п. 5, отличающийся тем, что в качестве аминокислоты применяют аргинин, лизин, гистидин или гидроксилизин. 8. Способ по п.5, отличающийся тем, что соль выделяют, добавляя в реакционную смесь низкополярный растворитель или смесь этих растворителей, образующих гомогенный раствор с растворителем, применяемым в реакции. 9. Фармацевтическая композиция для диагностики и/или лечения новообразований, включающая действующее средство на основе гематопорфирина и носитель, отличающаяся тем, что в качестве действующего средства она содержит еффективное количество соединения формулы (I), где R1, R2, A, m, n имеют значение, указанное в п.1. 10. Фармацевтическая композиция по п. 9, отличающаяся тем, что в качестве действующего средства она включает смесь по крайней мере двух солей формулы (I) в эффективном количестве. 11. Фармацевтическая композиция по п. 10, отличающаяся тем, что в качестве действующего средства она содержит смесь, включающую основные аминокислотные соли эфиров гематопорфирина, протопорфирина, винилдейтеропорфирина и дигематопорфирина. (II) или R1 и R2 одинаковые и обозначают группу СН(R4)СН3, где R4 обозначает карбоксиметиламиновую гр уппу, 1-карбоксиэтиламиновую группу, 1карбокси-2-метил-пропиламиновую группу, 1карбокси-2-метил-бутиламиновую группу, 1-карбокси-3-метил-бутиламиновую гр уппу, 1-карбоксибутиламиновую гр уппу, 1-карбокси-пентиламиновую гр уппу, 1-карбокси-2-гидрокси-этиламиновую гр уппу, 1-карбокси-2-гидрокси-пропиламиновую гр уппу, 1-карбокси-2-меркапто-этиламиновую группу, 1-карбокси-З-метилтио-пропиламиновую группу, 1,2-дикарбокси-этиламиновую гр уппу, 1карбокси-2-карбамоил-этиламиновую группу, 1,3дикарбокси-пропиламиновую группу, 1-карбокси-3карбамоил-пропиламиновую группу, 1-карбокси-2фенил-этиламиновую группу, 1-карбокси-2-(4-гидрокси-фенил)-этиламиновую группу, 1-карбокси-2индолил-этиламиновую группу, 2-карбокси-пиролидиновую гр уппу, 2-карбокси-4-гидрокси-пиролидиновую гр уппу, 1-карбокси-5-амино-пентиламиновую гр уппу, 1-карбокси-4-гуанидилобутиламиновую гр уппу, 1-карбокси-4-гидрокси-5-амино-пентиламиновую гр уппу или 1-карбокси-2-(1Н-имидазол)-этиламиновую гр уппу; А обозначает основную аминокислоту; m равняется 2-4; n равняе тся 1-5 , отл ича ющийся тем, что производное гема топор фирина с общей форм улой (IV) _______________________ Предмет изобрете ния – это комплексные соли гемато порфи рина и его производных, способ их производства и фармацевтическое средство. Новые соли гемато порфи рина и его производных предназначены для обнаружения и лечения новообразований. Уже более десяти лет как гематопорфирин и его производные (HpD) применяют как фотосенсибилизато ры для обнаружения и уничто жения новообразований в организмах людей и животных. Соединения эти подаются во внутривенной инъекции и они переносятся активным транспортом к разным органам тела. В здоровой ткани нахо дятся они относительно короткий период, так как они метаболизируются и выделяются, зато в ткани но вообразования они аккумулируются и на почти неизменном уровне остаются на протяжении нескольких суток. Это было использовано в фо тодинамическом методе диагноза и селективного уничтожения ткани новообразования. Так как все производные гемато порфи рина трудно растворимые в во де, способ приго товления их водяных растворов был до сих пор весьма тяжелый. В Cancer Research том 44, стр. 1924, 1984 г. (см. то же, том 45, стр. 635, 1985 г.) описан метод получения гематопорфириновых препаратов для инъекций. Он состоит в том, что производные гематопорфи рина растворяют в растворе NaOH, смешивают один час и после того нейтрализуют до рН около 7,1 и титрованием 0,1 NHCl. Метод 2 40568 этот весьма неудобный, так как в случае небольшого перехо да рН ниже 7 имеет место вы падение осадка. Конечный раствор приготавливают, добавляя соответственное количество физиологической соли. Раствор стерилизуют и хранят в закрытых ампулах. Та кие препараты в ви де водяных растворов неустойчивые вви ду большой тенденции всех производных ге матопорфирина к агрегации. Как подано в выше упомянутой публикации, изготовленные раство ры сохраняют свою ста бильность в течение около 3-х месяцев при условии, что их хранят в темном и хо лодном месте (при температуре -20оС). Предметом изобретения являются новые, растворимые в воде комплексные соли гемато порфи рина и его производных, которые в зависимости от концентрации дают рН от 7,2 до 7,8, что дает возможность быстро изготовить раствор хорошо растворимый в воде или в физиологической соли и получить лучшую биодоступ ность лечебного средства. Неожиданно оказалось, что новые комплексные соли проявляют большую терапевтическую активность, чем, например, известные натриевые соли гематопорфи рина и его производных (HpD Na2). Кроме того, новые соли задерживают без облучения развитие клеток новообразований, что было подтверждено в исследованиях на клеточных ли ниях. Согласно изобретению соли гематопорфи рина и его производных имеют общую формулу 1 (фиг. 1), в кото рой R1 и R2 такие же самые или разные и обозначают груп пу -СН=СН 2, груп пу -СН(ОН)СН3, группу -СН(OR3)CH3, где R3 обозначает груп пу создающую олигомер, содержащий связь эфирную и/или сложноэфирную, составленную из 1 до 5 одинаковых или разных единиц, происхо дящи х от мономера по формуле II (фиг.2), или R1 и R2 одинаковые и обозначают группу -СН(R4)-CH3, где R4 обозначает группу карбоксиметиламиновую, 1-карбоксиэтиламиновую, 1карбокси-2-метилпропиламиновую, 1-карбокси-3метилбутиламиновую, 1-карбокси-2-метилбутиламиновую, 1-карбоксибутиламиновую, 1-карбоксипентиламиновую, 1-карбокси-2-гидроксиэтиламиновую, 1-карбокси-2-гидроксипропиламиновую, 1-карбокси-2-меркаптоэтиламиновую, 1-карбокси-3-метилотиопропилоаминовую, 1,2-дикарбоксиэтиламиновую, 1-карбокси-2-карбамоилэтиламиновую, 1,3-дикарбоксипропиламиновую, 1-карбокси-3-карбамоилпропиламиновую, 1-карбокси-2-фенил-этиламиновую, 1-карбокси-2-(4-гидроксифенил)-этиламиновую, 1-карбокси-2-индолилэтиламиновую, 2-карбоксипиролидиновую, 2-карбокси-4-гидроксипиролидиновую, 1-карбокси-5-амино-пентиламиновую, 1-карбокси-4-гуанидил-бутиламиновую, 1-карбокси4-гидрокси-5-амино-пентиламиновую или группу 1карбокси-2-(1Н-имидазол)-этиламиновую, А обозначает основную аминокислоту, m равняется 2-6, n равняется 1-5. В объеме изобретения нахо дятся тоже смеси солей по формуле 1 и комплексы этих солей. Выгодные аминокислоты символа А – это аминокислоты, у которых изоэлектрическая точка есть более чем 7, главным образом аргинин, лизин, гистидин или гидроксилизин. Выгодные соли это соли формулы 1, в которой R1 и R2 одинаковые и обозначают группу -СН(R4)-CН3. Примерами солей с формулой 1 являются тоже соли эфира по формуле III (фиг.3) и соли по формуле V (фиг.5). Выгодной смесью является смесь, в которой содержатся аминокислотные соли гематопорфирина, протопорфирина, винилдейтерийпорфи рина и дигемато порфи ринового эфира и, возможно, их агрегаты. Способ изготовления новых комплексных солей гематопорфирина и его производных общей формулы I или смесей солей общей формулы I, в которой символы имеют вышеуказанное значение, основан согласно изобретению на том, что гематопорфириновую производную общей формулы IV (фиг.4) или смесь не менее чем двух производных общей формулы IV, в которой R1 и R2 имеют вышеподанное значение, с тем, что если R 1 и R2 обозначают груп пу -СН(R4)-CH3, то карбоксильные груп пы заместите ля R4 могут быть сво бодными или защи щенными, подвергают реакции с основной аминокислотой со свободными или защищенными карбоксильными группами или с его монохлористоводородной солью, выгодно в органическом растворителе, в смеси орга нических растворителей или в среде, содержащей органический раство ритель и воду или смесь органических растворите лей и воду, ли бо устраняют груп пы, защищающие карбоксильные функции изолируют продукт представляющий соль формулы I или смесь солей формулы I, либо содержащий агрегаты солей формулы I. В процессе по изобретению реакции групп аминовых аминокислот с карбоксильными группами производных гемато порфи рина образуют ионные систе мы согласно формуле -COOH+H 2N-R ® -COO-+H 3N-R. В качестве основной аминокислоты применяется аминокислота с изоэлектрической точкой >7, особенно аргинин, лизин, гистидин или гидроксилизин. Для защи ты карбоксильных гр упп в исходных соединениях можно применять разные известные блокирующие груп пы, например, описанные в Protective Groups in Organic Synthesis, T.W. Green, John Wilex and Sons, 1981. Примерами этих групп являются груп пы, образующие сложные эфи ры алкильные, бензиловые, силиловые и другие группы, применяемые для обеспечения карбоксильных функций. Реакция может происхо дить в широком диапазоне температур, вы годно в пределе от комнатной температуры до 100оС, особенно при температуре 50–70оС. Время реакции обыкновенно от нескольких минут до белее десяти часов. Выгодные органические растворители – это амиды, такие как формамид, диметилформамид, диэтилформамид, нитриды, такие как ацето нитрил, пропионитрил, изобутиронитрил, сложные эфи ры, например, ацетат эти ла, кетоны как например, ацетон, сульфоксиды, например, диметилсульфоксид, алкоголи и угольнодиэтиловый эфир или их смеси. Обычно реакция проводится в водноорганической среде. Блокирующие гр уппы, если они присутствуют, устраняются известными способами, например, гидролизом или гидрогенолизом. Соль или соответственную смесь солей с формулой 1 можно выделить из реакционной смеси разными методами, например, осаждением, кристаллизацией и другими известными методами. 3 40568 Особенно выгодный метод основан на том, что до реакционной смеси добавляется растворитель или смесь низкополярных растворите лей, таких, однако, которые с растворите лем, применяемым для реакции, образуют гомогенный раствор с соотношением от 1:1 до 1:5. Соответственными растворителями являются, например, этиловый эфир, ацетон. Полученную смесь оставляют на несколько (до более десяти) часов для медленного осаждения продук та. Осадок после фильтрации и промытия высуши вают в ва кууме над сушильным средством, выгодно Р2О5. Он устойчив и не расплывается на воздухе. Полученные соединения надо защи щать от света. Стадия выделения содержит возможное разделение смеси. Исходные соединения с формулой IV известны. Можно их получить из гемина. Предметом изобретения является также фармацевтическое средство для обнаружения и/или лечения новообразова ний, содержащее соль с общей формулой I, в которой символы имеют вышеприведенное значение или смесь не менее двух со лей формулы I либо их а грегаты. Примерная смесь – это смесь, содержащая аминокислые соли гематопорфи рина, прото порфи рина, винилдейтеропорфирина и дигематопорфиринного эфира либо их агрегаты. Средством по изобретению может быть соль по формуле I или смесь солей по формуле I в виде твердого тела, выгодно нахо дяще гося стерильном, плотном контейнере. Стерильный, плотный контейнер содержит обыкновенно соль или смесь солей в терапевтически эффективной дозе. Терапевтическая эффективная порция – это обычно 1,5 –10 мг/кг веса тела. Из соли, нахо дящейся в контейнере, можно весьма быстро изго товить стерильные водяные растворы для непосредственной внекишечной подачи. Средство по изобретению можно также изготовлять в виде препаратов, гото вых к использованию. В таком случае, активное вещество, т. е. соль или смесь солей по формуле I, смеши вают с фармакологически допусти мым растворителем и/или носителем. Обыкновенно средство подается путем инъекции, главным образом внутренней, хотя можно ее тоже применять внутрибрюшинно или внутри прямой кишки. Примерный препарат – это стерильный водяной раствор. Водяной раствор, кроме соли по формуле I, содержит возможно физиологическую соль и в случае необходимости – пропиленгликоль. Как уже упомянуто, та кие раство ры можно применять непосредственно после их изготовления или можно их хранить в стерильных контейнерах. Средство по изобретению можно применять без облучения, однако более эффективное действие проявляет оно как фотосенсибилизатор в фотодинамическом методе диагноза и терапии новообразований. рата HpD (hematoporphyrin derivatives), полученную по мето ду Липсона и сотрудников. Все использованные в испытании соединения были применены в виде водяных растворов. Их подавали в концентрации 50 мкг/мл. Были исследованы и определены: 1) флуоресценция F клеток после 48-часовой инкубации, после этого клетки отмыва ли и исследовали интенсивность флуо ресценции во флуо ресцентном микроскопе, определяя ее в произвольной шкале от 0 до 4; 2) был определен (Р%) – процентживых клеток после заранее описанного времени инкубации; 3) был определен коэффи циент размножения клеток М под влиянием отдельных препаратов, определяя его следующим образом: М = количество ум ноженных клеток в культуре с препаратом концентрации 50 мкг/мл после 48 ч/количество умноженных клеток в контрольной культуре после 48 ч. Результа ты исследований даны в таблицах 1 –3. Из данных, представленных в таблицах 1 –3, видно, что соединения с формулой I оказывают разное сродство для исследованных клеточных линий, и разным способом влияют на их переживание. Имея выбор разных производных, можно подобрать производную, наиболее активную для данного типа новообразования, что расширяет возможности эффективной терапии. Список примененных в таблицах 1 –3 символов клеточных линий, применяемых в исследованиях антикарциноматозных препаратов, производных прото порфи рина и препарата HpD: Hep – 2 клетки рака гортани Hela – клетки рака шейки матки КВ – клетки рака полости рта НВТ –39/w клетки рака соска Т-47D – клетки рака соска Р3НR1 – клетки лимфа ка Буркитта GLCH – малые клетки рака легких Линии мышиных новообразований. GR MT/F6 – клетки рака соска мыши штамма GR. Mm5MT/Cl – клетки рака соска мыши штамма С3Н МА –104 – клетки рака зародыша почки обезьяны резус В сравнении с известным препаратом HpD новые соли обладают более широким пределом проникновения внутрь разных видов раковых клеток и лучшей эффективностью их уничтожения. Примерно при использовании новой аргининовой соли HpD(HpD Ag2), процент живых клеток после 48 ч инкубации (Р%) для линии Hela равен 13, для линии Ма –104 равен 6; для линии НТВ – 39/w равен 0, в случае же применения известного препарата, т. е. натриевой соли HpD(HpD Na2), величины во много раз больше и равняются для линии Hela – 28; для линии Ма –104 – 17; для линии НВТ –39/w – 10. Новые соединения были испытаны тоже на животных. Выбрано соединение одно из самых активных в испытаниях для клеточной линии Mm5MT/Cl – рак соска мыши штамма С3Н – т.е. Новые соединения по формуле I были исследованы на клеточных ли ниях. Для исследований использова но 9 –10 разных клеточных линий новообразова ний, которые были инкубированы в течение 48 ч разными солями производных протопорфирина и с новой солью применяемого препа 4 40568 РР(Lyz)2 (Arg)2 (соединение из примера XXI) и самое меньшее активное для этого типа рака, т.е. PP(Glu)2 (Arg) 2 (соединение из примера XIX). Исследования произведены на мышах C3H с транспланти рованным раком соска при подаче обоих соединений в дозе 10 мг/кг и в двух ва риантах. Животные были облучены лазером Не-Ne в порции 150 J/см 2, что обозначено буквой L около символа соединения на диаграмме (фиг.6), а в другом варианте они не были облучены. На диаграмме показаны в виде графиков полученные результаты. Они показали, что: 1) итоги исследований на клеточных ли ниях нашли свое подтверждение в исследованиях на животных, 2) препарат РР(Liz)2 (Arg)2 оказался активным и значительно продолжил проживание испытательных животных. 3) аминокислотные производные прото порфи рина действуют цитотоксично на раковые клетки, тоже не возбужденные лазерным светом, хотя слабее, чем под влиянием лазера. Пример 1. HpD – это смесь производных гематопорфи рина, таких как гематопорфи рин, протопорфи рин, винилдейтеропорфи рин, дигематопорфириновый эфир и их агрегаты. 1 г HpD молекулярным весом 600 (1,67 ммоль) растворено в 30 мл диметилформамида (DMF) и добавлено 581,8 г аргинина (3,34 ммоль), растворенного в 2 мл воды. Смесь подогревали 15 –20 мин при температуре 60оС на водяной бане, интенсивно смеши вая. После этого добавлено 100 мл ацетона и далее смесь перемешивали около 3 –5 мин. Раствор был оставлен в покое на 5 –15 ч. В этом времени осаждался осадок смеси солей, обозначенной HpD(Arg). Осадок фильтровали, промывали эфиром и сушили в ва кууме. После сушки в вакууме осадок становится стойким на воздухе и надо его защи щать от све та вви ду со держащихся в нем порфириновых производных. Реакция прохо дит с выхо дом около 75%. Пример 2. 1 г HpD растворено в 20 мл формамида и добавлено 581,8 мг аргинина, растворенного в 2 мл Н2О. Раствор подогревали и смешивали как в примере 1. Затем после охлаждения добавлено 100 мл этилового эфира. Раствор был размешан и оставлен в покое на несколько часов. После фильтрации и промывки эфиром осадок сушили в ва кууме. Получено 126,8 мг осадка смеси солей HpD(Arg)2, что соответствует выхо ду 86%. Пример 3. 1230 мг дилизилпротопорфи рина PPLiz2 (1,4 ммоль) растворено в 40 мл формамида и смешано с 490 мг 1-аргинина (2,8 ммоль), растворенного в 1,5 мл воды. Смесь подогревалась при температуре 60оС на водяной бане в течение около 20 мин. После охлаждения додано 100 мл этилового эфира, смешано и оставлено на несколько часов. Осадок был фильтрован, промыт эфи ром и сушен в вакууме. Получено 1630 мг осадка, что отвечает выхо ду 90%. Данные полученного соединения приведены в примере 21 в таблице 4. Пример 4. 1199,6 мг (1,4 ммоль) диглутамилпротопорфирина растворено в 60 мл формамида и добавлено 409,3 мг 1-лизина, растворенного в 1,5 мл во ды. Смесь подогревалась в течение 30 мин при температуре 60оС, затем добавлено 120 мл ацетон-эфир ной смеси с соотношением 1:3 (30 мл ацетона, 90 мл этилового эфира), смешивалась еще 10 мин, а затем была оставлена в покое на несколько часов. Затем фильтровалась в вакууме, промывалась этиловым эфиром и сушилась в вакууме над Р2О5. Получено 1575 мл продукта, что отвечает 97,8%-ному тео ретическому выхо ду. Пример 5. 1081,8 мг (1,4 ммоль) дисерилпрото порфи рина растворено в 50 мл формамида и добавлено 490 мг 1-аргинина (2,8 ммоль), растворенного в 1,5 мл Н 2О. Смесь подогрева ли при температуре 60оС в течение 30 мин, затем добавлено 120 мл ацетон-эфир ной смеси с соотношением 1:3 (30 мл ацето на и 90 мл этилового эфи ра) и все смешивалось еще 50 мин. Раствор оставлен для кристаллизации на несколько часов. Затем осажденный осадок был фильтрован в вакууме и сушен в вакууме над Р2О5 . Получено 1500 мг осадка, то есть 95,5%. Подобным способом, как описано в примере 5, получены все соли, приведенные в таблице 5. Символы соединений, перечисленных в таблицах 1 –3, строки 2 –11, и в таблице 5 представляют соединения формулы І, где А = аргинин, m = 2, n = 1, R1 = R2 = -CH(R 4)-CH3, где R4 см. в табл. 5. Пример 26. К 1037,12 мг (1,4 ммоль) ди-(N-аланин)протопорфи рина, растворенного в 40 мл диметилформамида, добавляют 434,4 мг (2,8 ммоль) гистидина, растворенного в 3 мл во ды. Смесь нагревают в те чение 40 –50 мин на водяной бане при интенсивном перемешивании. После охлаждения добавляют 100 мл смеси ацетон-эфир (1:3). Затем смесь перемешивают в те чение около 10 мин и дают отстояться несколько часов. После фильтрации в вакууме и вакуумной сушки над Р2О5 получен продукт – соль гистидина – в количестве 1353 мг, что соответствуе т вы хо ду 92%. Спектр УФ vis lmax нm/208/гистидин/, 400, 514, 550, 570, 632. 5 40568 Таблица 1 №№ Символ соединеп/п Клеточная линия ния Hela MA-104 F P% M F GLC4 P% M РЗНR1 F P% M F P% M 1 HpD/Arg/2 + 13 0,14 cлед 6 0,05 30 0,30 30 0,30 2 PP/Asp/2/Arg/ 2 +++ 38 0,50 +++ 17 0,52 + 55 0,55 + 15 0,15 3 4 PP/Glu/2/Arg/ 2 PP/Cys/2/Arg/ 2 ++ ++ 33 55 0,16 0,43 ++ 15 11 0,16 0,16 45 30 0,45 0,30 + + 15 0,15 40 0,40 15 0,15 5 PP/Ala/2 /Arg/2 + 11 0,11 ++ 50 0,50 30 0,30 ++ 6 7 PP/Ser/2/Arg/ 2 PP/Lys/2/Arg/ 2 ++ +++ 55 16 0,50 0,16 0 0 0,16 0,10 + + 0 30 0 0,30 ++ 2,5 0,02 + 50 0,50 8 PP/Phe/2/Arg/2 +++ 5 0,14 ++ 35 0,35 ++ 0 0 + 8 9 10 PP/Arg/ 2/Arg/ 2 PP/Trр/2/Arg /2 ++++ +++ 11 62 0,28 0,62 ++ + 31 25 0,42 0,25 ++ 4 50 0,03 0,50 + + 10 0,10 50 0,50 11 PP/Met/2/Arg /2 ++++ 5 0,05 ++ 22 0,33 + 0 0 + 8 0,08 0,08 Таблица 2 №№ п/п Символ соединения F KB P% Клеточная линия HBT-39/w F P% M M F GRMT/F6 P% M 1 HpD/Arg/2 ++++ 9 0,08 +++ 0 0 ++ 20 0,40 2 PP/Asp/2/Arg/ 2 ++ 16 0,12 +++ 43 0,81 ++ 25 0,73 3 4 PP/Glu/2/Arg/ 2 PP/Cys/2/Arg/ 2 ++++ + 8 12 0,08 0,12 + + 66 42 0,73 0,53 + +++ 75 50 0,75 0,75 5 PP/Ala/2 /Arg/2 +++ 0 0 ++ 17 0,33 + 50 0,50 6 7 PP/Ser/2/Arg/ 2 PP/Lys/2/Arg/ 2 ++ 0 12 0 0,12 ++ ++++ 33 47 0,50 0,44 + +++ 12 25 0,12 0,75 8 PP/Phe/2/Arg/2 ++ 12 0,12 ++++ 11 0,11 +++ 0 0 9 10 PP/Arg/ 2/Arg/ 2 PP/Trр/2/Arg /2 + nd 16 21 0,16 0,21 ++++ ++++ 28 18 0,28 0,11 +++ +++ 12 62 0,12 0,62 11 PP/Met/2/Arg /2 ++ 5 0,12 ++++ 8 0,08 ++++ 25 0,22 №№ п/п Символ соединения Таблица 3 F HEp-2 P% Клеточная линия Mm5MT/C1 F P% M M F T-47D P% M 1 HpD/Arg/2 + 31 0,31 ++ 33 0,75 + 30 0,66 2 PP/Asp/2/Arg/ 2 ++++ 47 0,40 +++ 70 0,92 ++++ 65 0,92 3 4 PP/Glu/2/Arg/ 2 PP/Cys/2/Arg/ 2 ++++ ++++ 15 60 0,08 0,32 +++ +++ 76 40 0,70 0,73 +++ + 49 26 0,80 0,84 5 PP/Ala/2 /Arg/2 ++ 21 0,21 +++ 86 0,84 +++ 85 0,82 6 7 PP/Ser/2/Arg/ 2 PP/Lys/2/Arg/ 2 + ++ 25 10 0,50 0,42 + ++ 37 33 0,37 0,80 +++ ++ 40 57 0,60 0,92 8 PP/Phe/2/Arg/2 ++ 3 0,08 ++++ 12 0,37 + 60 0,60 9 10 PP/Arg/ 2/Arg/ 2 PP/Trр/2/Arg /2 + +++ 5 15 0,14 0,15 +++ +++ 12 11 0,38 0,33 +++ + 40 13 0,40 0,13 11 PP/Met/2/Arg /2 +++ 0 0 ++++ 8 0,08 +++ 10 0,10 6 40568 Таблица 4 Пример Символ соединения Суммарная формула Молекулярный вес 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 PP/Ser/2/Arg/ 2 PP/Gly/2/Arg /2 PP/Ala/2 /Arg/2 PP/Val/2 /Arg/2 PP/Leu/2/Arg/2 PP/Jle/2/Arg/2 PP/Phe/2/Arg/2 PP/Tyr/2 /Arg/2 PP/Pro/2/Arg/ 2 PP/ProOH/2/Arg/ 2 PP/Trp/2/Arg /2 PP/Cys/2/Arg/ 2 PP/Met/2/Arg /2 PP/Asp/2/Arg/ 2 PP/Glu/2/Arg/ 2 PP/Arg/ 2/Arg/ 2 PP/Lys/2/Arg/ 2 PP/LysOH/2/Arg/ 2 PP/His/2/Arg/2 PP/Asn/2/Arg/ 2 PP/Gln/2/Arg/ 2 C52H76N14O 12 C50H72N14O 12 C52H76N14O 12 C55H84N14O 12 C56H75N14O 12 C58H75N14O 12 C64H84N14O 12 C64H84N14O 12 C56H80N14O 12 C56H80N14O 12 C68H86N16O 12 C52H76N14O 12S C56H84N14O 12S2 C54H76N14O 16 C56H80N14O 16 C58H90N20O 12 C58H90N16O 12 C58H90N16O 14 C58H82N18O 12 C54H78N16O 12 C56H84N16O 14 1121,2 1061,2 1089,2 1145,3 1173,3 1173,3 1241,4 1273,4 1141,3 1175,3 1319,4 1153,3 1209,4 1177,2 1205,3 1339,4 1203,4 1235,4 1221,3 1175 1203,3 С расч. % 55,65 56,53 55,09 58,67 59,32 59,32 61,86 60,31 58,88 57,18 61,84 54,01 55,56 55,05 55,75 51,96 57,84 56,34 56,99 55,14 55,85 H N обозн. расч. % обозн. расч. обозн. % % % % 55,69 56,42 55,14 58,58 59,24 59,34 61,91 60,39 58,93 57,09 61,72 54,11 55,61 55,11 55,64 51,82 57,89 56,23 56,89 55,19 55,77 6,78 6,78 6,97 7,33 6,39 6,39 6,78 6,44 7,01 6,80 6,52 6,59 5,94 6,46 6,64 6,72 7,48 7,28 6,71 6,64 6,89 6,81 6,71 7,02 7,24 6,27 6,41 6,72 6,46 7,07 6,72 6,46 6,64 7,01 6,52 6,53 6,64 7,53 7,19 6,67 6,68 6,81 17,48 18,45 17,99 17,11 16,71 16,71 15,78 15,39 17,17 16,67 16,98 16,99 16,20 16,65 16,26 20,90 18,61 18,13 20,63 19,06 18,62 Таблица 5 Символ соединения PP/Ser/2/Arg/ 2 PP/Gly/2/Arg /2 PP/Ala/2 /Arg/2 PP/Val/2 /Arg/2 PP/Leu/2/Arg/2 PP/Іle/2/Arg/ 2 PP/Phe/2/Arg/2 PP/Tyr/2 /Arg/2 PP/Pro/2/Arg/ 2 PP/ProOH/2/Arg/ 2 PP/Trp/2/Arg /2 PP/Cys/2/Arg/ 2 PP/Met/2/Arg /2 PP/Asp/2/Arg/ 2 PP/Glu/2/Arg/ 2 PP/Arg/ 2/Arg/ 2 PP/Lys/2/Arg/ 2 PP/LysOH/2/Arg/ 2 PP/His/2/Arg/2 PP/Asn/2/Arg/ 2 PP/Gln/2/Arg/ 2 R4 1-карбокси-2-окси-этиламино карбоксиметиламино карбоксиэтиламино1-карбокси-2-метил-пропиламино 1-карбокси-3-метил-бути ламино 1-карбокси-2-метил-бути ламино 1-карбокси-2-фенил-этиламино 1-карбокси-2-/4-оксифенил/-этиламино 2-карбокси-пирролидинил 2-карбокси-4-окси-пирролидинил 1-карбокси-2-индолил-эти ламино 1-карбокси-2-меркапто-этиламино 1-карбокси-3-метил-тиопропиламино 1,2-дикарбокси-этиламино 1,3-дикарбоксипропиламино 1-карбокси-4-гуа нидил-бути ламино 1-карбокси-5-аминопентиламино 1-карбокси-4-окси-5-аминопентиламино 1-карбокси-2-1Н-имидазол-этиламино 1-карбокси-2-карбамоил-этиламино 1-карбокси-3-карбамоилпропиламино 7 17,52 18,22 18,03 17,00 16,64 16,68 15,74 15,45 17,21 16,59 16,79 17,04 16,27 16,74 16,18 20,97 18,58 18,04 20,52 18,98 18,71 40568 Фиг. 1 Фиг. 2 8 40568 Фиг. 3 Фиг. 4 9 40568 Фиг. 5 10 40568 Фиг. 6 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 11
ДивитисяДодаткова інформація
Назва патенту англійськоюComplex salt of hematoporphyrin and derivatives thereof for revelation and/or treatment of neoplasms, method for the preparation thereof and pharmaceutical composition containing it
Автори англійськоюGraczyk Alfreda, Konarski Jerzy
Назва патенту російськоюКомплексная соль гематопорфирина и его производных для выявления и/или лечения новообразований, способ ее получения и фармацевтическая композиция, которая ее содержит
Автори російськоюГрачик Альфреда, Конарски Ежи
МПК / Мітки
МПК: C07D 233/64, A61K 41/00, C07D 519/00, C07D 487/22, A61K 49/00
Мітки: новоутворень, спосіб, виявлення, похідних, сіль, композиція, лікування, гематопорфірину, комплексна, містить, фармацевтична, отримання, яка
Код посилання
<a href="https://ua.patents.su/11-40568-kompleksna-sil-gematoporfirinu-i-jjogo-pokhidnikh-dlya-viyavlennya-i-abo-likuvannya-novoutvoren-sposib-otrimannya-i-farmacevtichna-kompoziciya-yaka-mistit.html" target="_blank" rel="follow" title="База патентів України">Комплексна сіль гематопорфірину і його похідних для виявлення і/або лікування новоутворень, спосіб її отримання і фармацевтична композиція, яка її містить</a>
Попередній патент: Похідні фосфоліпідів, спосіб отримання похідних фосфоліпідів, фармацевтична композиція та спосіб її отримання
Наступний патент: Похідні метилпіперазиназепіну, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі
Випадковий патент: Спосіб рівноканального кутового пресування