Лікарський засіб для регулювання мейозу
Номер патенту: 51622
Опубліковано: 16.12.2002
Автори: Андерсен Клаус Ідінг, Дірс Іван Вернер, Нордхольм Ларс, Бісков Анне Грете, Гуддал Ерлінг, ТЬОГЕРСЕН Хеннінг, Вассманн Оле
Формула / Реферат
1. Применение соединения общей формулы (I)
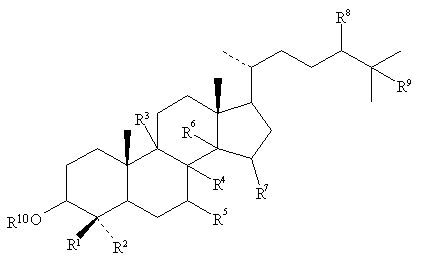 , (I)
, (I)
где R1 и R2 независимо выбраны из группы, включающей водород, неразветвленный или разветвленный C1-С6 алкил, который может быть замещен галогеном или гидрокси, или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое или циклогексановое кольцо,
R3 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, и в этом случае R5 представляет собой водород, а R6 и R7 либо представляют собой водород, либо вместе представляют дополнительную связь между атомами углерода, к которым они присоединены,
или R5 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, и в этом случае R3 представляет собой водород, а R6 и R7 либо представляют собой водород, либо вместе представляют дополнительную связь между атомами углерода, к которым они присоединены, или
R6 и R4 вместе представляют собой связь между атомами углерода, к которым они присоединены, и в этом случае R3, R5 и R7 все представляют собой водород,
R8 и R9 представляют собой водород или вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, и
R10 представляет собой водород или ацильную группу, сульфогруппу, фосфоногруппу, или группу, которая вместе с остальной частью молекулы образует простой эфир в качестве лекарственного средства для регулирования мейоза в половой клетке млекопитающего.
2. Применение по п. 1, отличающееся тем, что R1 представляет собой водород или метил.
3. Применение по п. 1, отличающееся тем, что R1 выбран из группы, содержащей этил и неразветвленный и разветвленный C1-С6 алкил.
4. Применение по п. 1, отличающееся тем, что R1 представляет собой неразветвленную или разветвленную гидроксиалкильную группу, содержащую до шести атомов углерода.
5. Применение по п. 1, отличающееся тем, что R1 представляет собой неразветвленную или разветвленную ![]() -гидроксиалкильную группу, содержащую до шести атомов углерода.
-гидроксиалкильную группу, содержащую до шести атомов углерода.
6. Применение по п. 1, отличающееся тем, что R1 представляет собой неразветвленную или разветвленную алкильную группу, замещенную галогеном.
7. Применение по п. 1, отличающееся тем, что R2 представляет собой трифторметил.
8. Применение по п. 1, отличающееся тем, что R2 представляет собой водород или метил.
9. Применение по п. 1, отличающееся тем, что R2 выбран из группы, включающей этил, неразветвленный и разветвленный C1-С6 алкил.
10. Применение по п. 1, отличающееся тем, что R2 представляет собой неразветвленную или разветвленную гидроксиалкильную группу, содержащую до шести атомов углерода.
11. Применение по п. 1, отличающееся тем, что R2 представляет собой неразветвленную или разветвленную ![]() -гидроксиалкильную группу, содержащую до шести атомов углерода.
-гидроксиалкильную группу, содержащую до шести атомов углерода.
12. Применение по п. 1, отличающееся тем, что R2 представляет собой неразветвленную или разветвленную алкильную группу, замещенную галогеном.
13. Применение по п. 1, отличающееся тем, что R2 представляет собой трифторметил.
14. Применение по п. 1, отличающееся тем, что R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо.
15. Применение по п. 1, отличающееся тем, что R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклогексановое кольцо.
16. Применение по п. 1, отличающееся тем, что R3 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, а R5 представляет собой водород.
17. Применение по п. 1, отличающееся тем, что R5 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, а R3 представляет собой водород.
18. Применение по п. 1, отличающееся тем, что R6 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, a R3, R5 и R7 представляют собой водород.
19. Применение по п. 1, отличающееся тем, что R6 и R7 представляют собой водород.
20. Применение по п. 1, отличающееся тем, что R6 и R7 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены.
21. Применение по п. 1, отличающееся тем, что R8 и R9 представляют собой водород.
22. Применение по п. 1, отличающееся тем, что R8 и R9 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены.
23. Применение по п. 1, отличающееся тем, что R10 представляет собой водород.
24. Применение по п. 1, отличающееся тем, что R10 представляет собой ацильную группу, производную от кислоты, содержащей от 1 до 20 атомов углерода.
25. Применение по п. 24, отличающееся тем, что R10 представляет собой ацильную группу, выбранную из группы, включающей ацетил, бензоил, пивалоил, бутирил, никотиноил, изоникотиноил, гемисукциноил, гемиглутароил, бутилкарбамоил, фенилкарбамоил, бутоксикарбонил, трет-бутоксикарбонил и этоксикарбонил.
26. Применение по п. 1, отличающееся тем, что R10 представляет собой алкильную, аралкильную, алкилоксиалкильную или алканоилоксиалкильную группу, содержащую в сумме до 10 атомов углерода, предпочтительно до 8 атомов углерода, которая вместе с остальной частью молекулы образует простой эфир.
27. Применение по п. 26, отличающееся тем, что R10 представляет собой метоксиметильную или пивалоилоксиметильную группу.
28. Применение по п. 1, отличающееся тем, что R10 представляет собой сульфогруппу.
29. Применение по п. 1, отличающееся тем, что R10 представляет собой фосфоногруппу.
30. Применение по п. 1, отличающееся тем, что соединение общей формулы (I) представляет собой 4,4-диметил-5![]() -холеста-8,14,24-триен-3
-холеста-8,14,24-триен-3![]() -ол.
-ол.
31. Применение по п. 1, отличающееся тем, что соединение общей формулы (I) представляет собой 4,4-диметил-5![]() -холеста-8,24-диен-3
-холеста-8,24-диен-3![]() -ол.
-ол.
32. Применение по п. 1 отличающееся тем, что половой клеткой является ооцит.
33. Применение по п. 1, отличающееся тем, что соединение обшей формулы (I) вводят в ооцит ex vivo.
34. Применение по п. 1, отличающееся тем, что половой клеткой является мужская половая клетка.
Текст
1 Применение соединения общей формулы (I) RO lO где R1 и R2 независимо выбраны из группы, включающей водород, неразветвленный или разветвленный С1-С6 алкил, который может быть замещен галогеном или гидрокси, или R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое или циклогексановое кольцо, R3 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, и в этом случае R5 представляет собой водород, a R6 и R7 либо представляют собой водород, либо вместе представляют дополнительную связь между атомами углерода, к которым они присоединены, или R5 и R4 вместе представляют собой дополни тельную связь между атомами углерода, к которым они присоединены, и в этом случае R3 представляет собой водород, a R6 и R7 либо представляют собой водород, либо вместе представляют дополнительную связь между атомами углерода, к которым они присоединены, или R6 и R4 вместе представляют собой связь между атомами углерода, к которым они присоединены, и в этом случае R3, R5 и R7 все представляют собой водород, R8 и R9 представляют собой водород или вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, и R10 представляет собой водород или ацильную группу, сульфогруппу, фосфоногруппу, или группу, которая вместе с остальной частью молекулы образует простой эфир в качестве лекарственного средства для регулирования мейоза в половой клетке млекопитающего 2 Применение по п 1, отличающееся тем, что R1 представляет собой водород или метил 3 Применение по п 1, отличающееся тем, что R1 выбран из группы, содержащей этил и неразветвленный и разветвленный С1-С6 алкил 4 Применение по п 1, отличающееся тем, что R1 представляет собой неразветвленную или разветвленную гидроксиалкильную группу, содержащую до шести атомов углерода 5 Применение по п 1, отличающееся тем, что R1 представляет собой неразветвленную или разветвленную а -гидроксиалкильную группу, содержащую до шести атомов углерода 6 Применение по п 1, отличающееся тем, что R1 представляет собой неразветвленную или разветвленную алкильную группу, замещенную галогеном 7 Применение по п 1, отличающееся тем, что R2 представляет собой трифторметил 8 Применение по п 1, отличающееся тем, что R2 представляет собой водород или метил 9 Применение по п 1, отличающееся тем, что R2 выбран из группы, включающей этил, неразветвленный и разветвленный С1-С6 алкил 10 Применение по п 1 , отличающееся тем, что R2 представляет собой неразветвленную или разветвленную гидроксиалкильную группу, содержащую до шести атомов углерода О (О ю 11 Применение по п 1 , отличающееся тем, что R2 представляет собой неразветвленную или разветвленную а -гидроксиалкильную группу, содержащую до шести атомов углерода 12 Применение по п 1 , отличающееся тем, что R2 представляет собой неразветвленную или разветвленную алкильную группу, замещенную галогеном 13 Применение по п 1 , отличающееся тем, что R2 представляет собой трифторметил 14 Применение по п 1 , отличающееся тем, что R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклопентановое кольцо 15 Применение по п 1 , отличающееся тем, что R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют циклогексановое кольцо 16 Применение по п 1 , отличающееся тем, что R3 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, a R5 представляет собой водород 17 Применение по п 1 , отличающееся тем, что R5 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, a R3 представляет собой водород 18 Применение по п 1 , отличающееся тем, что R6 и R4 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены, a R3, R5 и R7 представляют собой водород 19 Применение по п 1 , отличающееся тем, что R6 и R7 представляют собой водород 20 Применение по п 1, отличающееся тем, что R6 и R7 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены 21 Применение по п 1, отличающееся тем, что R8 и R9 представляют собой водород 22 Применение по п 1, отличающееся тем, что R8 и R9 вместе представляют собой дополнительную связь между атомами углерода, к которым они присоединены Область техники, к которой относится изобретение Настоящее изобретение относится к некоторым производным стерина и к их применению в качестве лекарственных средств В частности, было обнаружено, что некоторые производные стерина могут быть использованы для регулирования мейоза Предпосылки создания изобретения Мейоз - это исключительное важное событие у половых клеток, на котором основано половое размножение Мейоз содержит два мейотических деления Во время первого деления происходит обмен между материнскими и отцовскими генами, прежде чем пары хромосом разделятся на две 51622 23 Применение по п 1, отличающееся тем, что R10 представляет собой водород 24 Применение по п 1, отличающееся тем, что R10 представляет собой ацильную группу, производную от кислоты, содержащей от 1 до 20 атомов углерода 25 Применение по п 24, отличающееся тем, что R10 представляет собой ацильную группу, выбранную из группы, включающей ацетил, бензоил, пивалоил, бутирил, никотиноил, изоникотиноил, гемисукциноил, гемиглутароил, бутилкарбамоил, фенил карбамоил, бутоксикарбонил, третбутоксикарбонил и этоксикарбонил 26 Применение по п 1, отличающееся тем, что R10 представляет собой алкильную, аралкильную, алкилоксиалкильную или алканоилоксиалкильную группу, содержащую в сумме до 10 атомов углерода, предпочтительно до 8 атомов углерода, которая вместе с остальной частью молекулы образует простой эфир 27 Применение по п 26, отличающееся тем, что R10 представляет собой метоксиметильную или пивалоилоксиметильную группу 28 Применение по п 1, отличающееся тем, что R10 представляет собой сульфогруппу 29 Применение по п 1, отличающееся тем, что R10 представляет собой фосфоногруппу 30 Применение по п 1, отличающееся тем, что соединение общей формулы (I) представляет собой 4,4-диметил-5а -холеста-8,14,24-триен-3 рол 31 Применение по п 1, отличающееся тем, что соединение общей формулы (I) представляет собой 4,4-диметил-5а -холеста-8,24-диен-Зр-ол 32 Применение по п 1 отличающееся тем, что половой клеткой является ооцит 33 Применение по п 1, отличающееся тем, что соединение обшей формулы (I) вводят в ооцит ех VIVO 34 Применение по п 1, отличающееся тем, что половой клеткой является мужская половая клетка дочерние клетки Они имеют только половитну количества(1п) хромосом и 2с ДНК Второе меотическое деление происходит без синтеза ДНК Это деление, таким образом, приводит к образованию гаплоидных половых клеток только с 1с ДНК Мейотические события одинаковы у мужских и женских половых клеток, но временная программа и процессы дифференцировки, приводящие к образованию яйцеклеток и сперматозоидов, совершенно различны Все женские половые клетки входят в профазу первого мейотического деления в начале жизни, часто до рождения, но задерживаются в развитии в виде ооцитов на более позднем этапе профазы(диктиатное состояние) вплоть до овуляции после наступления половой зрело 51622 содержащей водород, неразветвленныи или разветвленный Сі-Сє алкил, который может быть за1 2 мещен галогеном или гидрокси, или R и R вместе с углеродным атомом, к которому они присоединены, образуют циклопентановое или циклогексановое кольцо; 3 4 R и R вместе представляют дополнительную связь между углеродными атомами к которым они присоединены, и в этом случае R представляет 6 7 водород и R и R либо представляют водород, либо вместе представляют дополнительную связь между углеродными атомами, к которым они присоединены, или 5 4 R и R вместе представляют дополнительную связь между углеродными атомами к которым они присоединены, и в этом случае R представляет 6 7 водород и R и R либо представляют водород, либо вместе представляют дополнительную связь между углеродными атомами, к которым они присоединены, или R4 и R6 вместе представляют дополнительную связь между углеродными атомами, к которым они присоединены, и в этом случае R3, R5 и R7 все представляют водород, R8 и R9 представляют водород или вместе представляют дополнительную связь между углеродными атомами, к которым они присоединены, и R10 представляет либо водород, либо ацильную группу, включающую фосфоногруппу или сульфогруппу, или R10 представляет группу, которая вместе с остальной частью молекулы образует простой эфир, для применения в качестве лекарственного средства Настоящее изобретение касается также новых соединений общей формулы(1) В настоящем контексте выражение "регулирование мейоза" понимается как означающее то, что соединения могут быть использованы для стимуляции мейоза in vitro, in vivo, и ex vivo Таким образом, более конкретно настоящее изобретение касается применения соединения приведенной выше общей формулы(1) в регулировании мейоза И еще настоящее изобретение относится к способу регулирования мейоза в половой клетке млекопитающего, включающему введение эффективного количества соединения приведенной выше общей формулы(1) в половую клетку, нуждающуюся в таком лечении Подробное описание изобретения Было обнаружено, что мейоз - индуцирующие вещества, экстрагированные как из бычьих семенников, так и из фолликулярной жидкости человека, способны вызывать возобновление мейоа в культурированных ооцитах мыши(ооцитный тест), а также стимулировать мейоз в мужских половых клетках культурированных семенников плодной мыши(гонадный тест) Мейоз - индуцирующее вещество вырабатывается зрелыми семенниками различных млекопитающих, включая мужчину, а также обнаружено в зрелых яичниковых фолликулах некоторых видов млекопитающих, включая женщину Из примеров 1 и 2 видно, что мейоз индуцирующим веществом, найденным в бычьих семенниках, является 4,4-диметилзимостерин, а где R1 и R2 независимо выбраны из группы, мейоз - индуцирующим веществом, обнаружен сти Таким образом в начале жизни самка имеет запас ооцитов, который расходуется, пока не будет исчерпан Мейоз у самок не заканчивается до самого оплодотворения и в результате дает только одну зрелую яйцеклетку и два недоразвитых полярных тельца на половую клетку В противоположность этому лишь некоторые из мужских половых клеток входят в мейоз с момента наступления половой зрелости и уходят из родовой популяции половых клеток на протяжении всей жизни Раз начавшись, мейоз у мужской клетки продолжается без существенной задержки и дает 4 сперматозоида Лишь немного известно о механизмах, которые управляют возникновением мейоза у самцов и самок Новые исследования показывают, что ответственными за остановку мейоза могут быть фолликулярные пурины - гипоксантин или аденозин [Downs, s m etal Dev Biol 82(1985) 454 458; Eppid, J J et al Dev Biol 119(1986) 313 321; и Downs, S M Мої Repvod Dev 35(1993)82-94] Наличие диффундируемого мейоз - регулирующего вещества первоначально было описано [By Byskov et al] в связи с культуральной системой из половых желез плодных мышей [Byskov, A G et al Dev Biol 52(1976)193-200] Яичником плодной мыши, в котором проходил мейоз, было скретировано мейоз - индуцирующее вещество(МІЗ), а из морфологически дифференцированного семенника с оставшимися, немейотическими половыми клетками было выделено мейоз - предотвращающее вещество(МРЗ) Было предположено, что относительные концентрации MIS и MPS регулировали начало, остановку и возобновление мейоза в мужских и женских половых клетках [Byskov, A G et al in the Physiologi of Reproduction(eds Knobil, E and Neill, J D, Raven Press, NewYark(1994)] Очевидно, что если мейоз можно регулировать, что можно управлять размножением К сожалению до сих пор невозможно идентифицировать мейоз - индуцирующее вещество Краткое изложение существа изобретения Неожиданно было обнаружено, что некоторые стерины, известные как промежуточные продукты в биосинтезе холестерина и некоторые новые, структурно родственные синтетические стерины могут быть использованы для регулирования мейоза Таким образом, настоящее изобретение относится к соединению общей формулы(1) 51622 8 транспортировку активного соединения к месту его действия Так, при необходимости введения млекопитающему соединений по настоящему изобретению их удобно изготавливать в виде фармацевтической композиции, содержащей по крайней мере одно соединение общей формулы(1) в сочетании с фармацевтически приемлемым носителем Для перорального применения такие композиции изготавливают в форме капсул или таблеток Из сказанного выше понятно, что требуемая схема введения композиции зависит от того состояния, которое нужно вылечить Так, при лечении бесплодия введение может быть только разовое или в течение ограниченного периода, например до наступления беременности При использовании в качестве контрацептива мейоз индуцирующее вещество общей формулы(1) принимают либо непрерывно, либо периодически Когда женщина принимает его в качестве контрацептива не непрерывно, то важно соблюдать согласование во времени относительно менструального цикла Фармацевтические композиции могут содержать носители, наполнители, усилители всасывания, консерванты, буферы, вещества для регулирования осмотического давления, вещества для улучшения распадаемости таблеток и другие компоненты, которые традиционно используют в данной области техники Примерами твердых носителей являются карбонат магния, стеарат магния, декстрин, лактоза, сахар, тальк, желатин, пектин, трагакант, метил целлюлоза, натрийкарбоксиметилцеллюлоза, низкоплавящиеся воски и масло какао Жидкие композиции включают стерильные растворы, суспензии и эмульсии Такие жидкие композиции могут быть пригодными для инъекции Нормальный менструальный цикл, видимо, не или для использования в связи с оплодотворенибудет осуществлен В этой связи важно отметить, ем ex vivo и in vitro Жидкие композиции могут сочто присутствие мейоз - индуцирующего вещества держать другие компоненты, традиционно испольне влияет на биосинтез прогестерона в культуризуемые в данной области техники, некоторые из рованных зернистых клетиках(соматические клеткоторых упомянуты в приведенном выше переки фолликула) человека, тогда как эстрогены и числении гестагены, используемые в до сих пор применяемых гормональных контрацептивах, оказывают Далее, композиция для чрезкожного введения вредное влияние на биосинтез прогестерона соединения по настоящему изобретению может быть изготовлена в форме пластыря, а композиВ соответствии с другим аспектом настоящего ция для введения через нос - в виде аэрозоля в изобретения мейоз - индуцирующее вещество жидкой или порошкообразной форме общей формулы(1) может быть использовано для лечения некоторых случаев бесплодия у самок, Применяемая доза соединения по настоящевключая женщину, путем введения его самкам, му изобретению определяется лечащим врачом и которые вследствие недостаточного собственного зависит, кроме всего прочего, от конкретного исвырабатывания MIS не способны продуцировать пользуемого соединения, от способа введения и зрелые ооциты Кроме того, при осуществлении от цели применения оплодотворения in vitro лучшие результаты достиПредпочтительными соединениями формулы гаются при добавлении к среде, в которой содер(1) являются следующие жатся социты, мейоз - индуцирующего вещества Холест-7-ен-Зр-ол, общей формулы(1) 4-Метилхолест-7-ен-Зр-ол, Кроме того, при бесплодии у самцов(включая 4-Этилхолест-7-ен-Зр-ол, мужчин), вызванном недостаточным собственным 4,4-Диметилхолест-7-ен-Зр-ол, вырабатыванием мейоз - индуцирующего вещест4а-Метил-4р-этилхолест-7-ен-Зр-ол, ва, введение мейоз - индуцирующего вещества 4а-Этил-4р-метилхолест-7-ен-Зр-ол, общей формулы(1) может смягчить проблему 4,4-Диэтилхолест-7-ен-Зр-ол, Введение композиций, содержащих соедине4-Пропилхолест-7-ен-Зр-ол, ние формулы(1), может быть осуществлено лю4-Бутилхолест-7-ен-Зр-ол, бым способом, эффективно обеспечивающим ным в фолликулярной жидкости человека, - 4,4диметил-5а-холеста-8, 14, 24-триен-Зр-ол О существовании мейоз - индуцирующих веществ известно уже некоторое время Но до сих пор ничего не известно об идентификации мейоз индуцирующего вещества или веществ Насколько известно создателям настоящего изобретения, до сих пор еще соединения общей формулы(1) не нашли практического применения в медицине В частности, соединения общей формулы(1) до сих пор еще не были использованы в качестве лекарственных средств для регулирования мейоза Существует несколько видов влияния на мейоз В соответствии с предпочтительным вариантом осуществления настоящего изобретения соединения общей формулы(1) используют для стимуляции мейоза В соответствии с другим предпочтительным вариантом настоящего изобретения соединения общей формулы(1) используют для стимуляции мейоза у людей Так, соединения формулы(1) много обещают как новые средства регулирования плодовитости без обычных побочных эффектов на соматические клетки, которые известны из использования до настоящего времени гормональных контрацептивов, изготовленных на основе экстрагенов и/или гестагенов При применении в качестве противозачаточного средства у самок мейоз - индуцирующее вещество может быть введено, чтобы вызвать преждевременное возобновление мейоза в доцитах, когда они еще находятся в растущем фолликуле, до овуляционного пика гонадотропинов У женщины возобновление мейоза может, например, быть, вызвано через неделю после прекращения предыдущей менструации Будучи овулированы, полученные перезрелые ооциты наиболее вероятно не будут оплодотворены 51622 4-Изобутилхолест-7-ен-Зр-ол, 4,4-Тетраметиленхолест-7-ен-Зр-ол, 4,4-Пентаметиленхолест-7-ен-Зр-ол, Холест-8-ен-Зр-ол, 4-Метилхолест-8-ен-Зр-ол, 4-Этилхолест-8-ен-Зр-ол, 4,4-Диметилхолест-8-ен-Зр-ол, 4а-Метил-4р-этилхолест-8-ен-Зр-ол, 4а-Этил-4р-метилхолест-8-ен-Зр-ол, 4,4-Диэтилхолест-8-ен-Зр-ол, 4-Пропилхолест-8-ен-Зр-ол, 4-Бутилхолест-8-ен-Зр-ол, 4-Изобутилхолест-8-ен-Зр-ол, 4,4-Тетраметиленхолест-8-ен-Зр-ол, 4,4-Пентаметиленхолест-8-ен-Зр-ол, Холест-8(14)-ен-Зр-ол, 4-Метилхолест-8(14)-ен-Зр-ол, 4-Этилхолест-8(14)-ен-Зр-ол, 4,4-Диметилхолест-8(14)-ен-Зр-ол, 4а-Метил-4р-этилхолест-8(14)-ен-Зр-ол, 4а-Этил-4р-метилхолест-8(14)-ен-Зр-ол, 4,4-Диэтилхолест-8(14)-ен-Зр-ол, 4-Пропилхолест-8(14)-ен-Зр-ол, 4-Бутилхолест-8(14)-ен-Зр-ол, 4-Изобутилхолест-8(14)-ен-Зр-ол, 4,4-Тетраметиленхолест-8(14)-ен-Зр-ол, 4,4-Пентаметиленхолест-8(14)-ен-Зр-ол, Холеста-8,14-диен-Зр-ол, 4-Метилхолеста-8,14-диен-Зр-ол, 4-Этилхолеста-8,14-диен-Зр-ол, 4,4-Диметилхолеста-8,14-диен-Зр-ол, 4а-Метил-4р-этилхолеста-8,14-диен-Зр-ол, 4а-Этил-4р-метилхолеста-8,14-диен-Зр-ол, 4,4-Диэтилхолеста-8,14-диен-Зр-ол, 4-Пропилхолеста-8,14-диен-Зр-ол, 4-Бутилхолеста-8,14-диен-Зр-ол, 4-Изобутилхолеста-8,14-диен-Зр-ол, 4,4-Тетраметиленхолеста-8,14-диен-Зр-ол, 4,4-Пентаметиленхолеста-8,14-диен-Зр-ол, Холеста-8,24-диен-Зр-ол, 4-Метилхолеста-8,24-диен-Зр-ол, 4-Этилхолеста-8,24-диен-Зр-ол, 4,4-Диметилхолеста-8,24-диен-Зр-ол, 4а-Метил-4р-зтилхолеста-8,24-диен-Зр-ол, 4а-Зтил-4р-метилхолеста-8,24-диен-Зр-ол, 4,4-Диэтилхолеста-8,24-диен-Зр-ол, 4-Пропилхолеста-8,24-диен-Зр-ол, 4-Бутилхолеста-8,24-диен-Зр-ол, 4-Изобутилхолеста-8,24-диен-Зр-ол, 4,4-Тетраметиленхолеста-8,24-диен-Зр-ол, 4,4-Пентаметиленхолеста-8,24-диен-Зр-ол, Холеста-8,14,24-триен-Зр-ол, 4-Метилхолеста-8,14,24-триен-Зр-ол, 4-Этилхолеста-8,14,24-триен-Зр-ол, 4,4-Диметилхолеста-8,14,24-триен-Зр-ол, 4а-Метил-4р-этилхолеста-8,14,24-триен-Зр-ол, 4а-Этил-4р-метилхолеста-8,14,24-триен-Зр-ол, 4,4-Диэтилхолеста-8,14,24-триен-Зр-ол, 4-Пропилхолеста-8,14,24-триен-Зр-ол, 4-Бутилхолеста-8,14,24-триен-Зр-ол, 4-Изобутилхолеста-8,14,24-триен-Зр-ол, 4,4-Тетраметиленхолеста-8,14,24-триен-Зр-ол, 10 4,4-Пентаметиленхолеста-8,14,24-триен-Зр-ол и их сложные и простые эфиры Предпочтительными сложными эфирами 10 формулы(1) являются те, в которых R представляет ацильную группу карбоновой кислоты, которая может быть разветвленной или неразветвленной или циклической и может содержать необязательно замещенную аминогруппу и/или 1 или 2 атома кислорода в дополнение к карбонильному кислороду сложноэфирной группы, который 10 10 связывает R со стериновым скелетом Когда R представляет ацильную группу, она содержит предпочтительно от 1 до 20 углеродных атомов, более предпочтительно от 1 до 12 углеродных атомов, еще более предпочтительно от 1 до 10 углеродных атомов и еще более предпочтительно от 1 до 7 углеродных атомов Кислота, от которой произведен радикал R10, может быть дикарбоновой кислотой Примерами R10 являются ацетил, бензоил, пивалоил, бутирил, никотиноил, изоникотиноил, гемисукциноил, геминлутароил, гемималоил, гемифталоил, бутилкарбамоил, фенилкарбамоил, бутоксикарбонил, трет-бутоксикарбонил, этоксикарбонил, 4-диметиламинометилбензоил, 4диэтиламинометилбензоил, 4дипропиламинометилбензоил, 4(морфолинометил)-бензоил, 4-(4-метил-1пиперазинилметил)-бензоил, 3диметиламинометилбензоил, 3диэтиламинометилбензоил, 3дипропиламинометилбензоил, 3(морфолинометил)бензоил, 3-(4-метил-1пиперазинилметил)бензоил, сульфо(в этом случае(1) означает сложный эфир или соль - сульфат) или фосфоно(в этом случае(1) означает сложный эфир или соль -фосфат) Предпочтительными простыми эфирами формулы(1) являются те, в которых R10 представляет метильную, метоксиметильную, бензильную или пивалоилоксиметильную группу Соединения по настоящему изобретению, встречающиеся в природе, могут быть получены из природных источников известными сами по себе способами В соответствии с другим вариантом их можно - подобно родственным структурно синтетическим стеринам по настоящему изобретению - получить путем синтеза известными как таковыми способами Далее настоящее изобретение проиллюстрировано на следующих примерах, которые не следует считать ограничивающими объем защиты Признаки, раскрытые в предшествующем описании, и в следующих далее примерах, могут служить - раздельно или в любом их сочетании - материалом для реализации изобретения в различных его видах Примеры Пример 1 Выделение, очистки и идентификация мейоз индуцирующего вещества(МІЗ) из бычьих семенников Семенники шестилетнего старого 6biKa(Damsh Landrace) были извлечены сразу же после убоя Удалив белочную оболочку, текстикулярную ткань поместили на сухой лед и хранили при -80°С, Замороженную тестикулярную ткань(92г) измельча 51622 12 11 ли на кусочки менее 1мм и подвергали лиофильголовкой с градиентной катушкой Химические 13 ной сушке(вымораживанием) в темноте до полносдвиги С-ЯМР в м д (5) для выделенного MIS го высыхания(приблизительно 90ч) Лиофилизиданы в таблице 1 для сравнения с соответствуюрованную ткань экстрагировали 400мл н-гептана щими данными для зимостерина [Taulor V t et al [Lichrosolv, Merck 4390, Германия] под азотом с J Lipid Res 22(1981) 171] и ланостерина [Emmons, перемешиванием в течение 24ч при 20°С СуспенG T et al Magn Res Chem 27(1989)1012] зию фильтровали и твердый материал экстрагировали еще раз так же, как описано выше Таблица 1 Объединенные органические фазы упаривали досуха на роторном испарителе при комнатной Углерод Зимостерин Ланостерин MIS температуре, получив в результате 981мг экстра1 35,1 35,5 35,8 гированного материала Этот материал растворя2 31,5 27,8 28,0 ли в н-гептане и распределяли по 15 пробиркам, 3 70,9 79,0 79,0 из которых выпаривали н-гептан Пробирки храни4 38,2 38,9 38,9 ли под азотом при 4°С в темноте 5 40,7 50,4 50,2 Для экстрктов использовали трехслойную 6 25,5 18,2 18,4 очистку путем ВЭЖХ(высокоэффективная жидко7 27,1 26,5 28,5 стная хроматография) 8 128,0 134,4 128,0 На первой стадии содержимое одной пробир9 134,8 134,4 135,8 ки растворяли в 50мкл 50%-ного(объем/объем) 10 35,6 37,0 37,0 тетрагидрофуранаЛТФ) в воде и переносили на 11 22,8 21,0 22,1 колонку для обращенно - фазовой ВЭЖХ(1_юпго 12 36,9 30,9 29,7 Spher 100 RP-8, заглушённая, 5мкм 250 х 4мм вн 13 42,0 44,4 42,1 диаметр, Merck) Элюирование осуществляли при 14 51,8 49,8 51,9 40°С с использованием линейного градиента ТГФ, проходящего от 50% до 100% за 15мин(расход 15 23,7 30,8 23,8 1 мл/мин) Собирали 18 фракций по 1мл и испыты16 28,7 28,2 28,8 вали их на MIS - активность 17 54,7 50,4 54,8 18 11,2 15,7 11,3 На второй стадии фракции с первой стадии, которые были найдены активными при социтном 19 17,8 19,1 19,8 тесте, растворяли в 50 - ЮОмкл 70%-ного ТГФ и 20 36,0 36,2 36,0 переносили на колонку, аналогичную той, что бы21 18,6 18,6 18,6 ла использована на первой стадии Элюирование 22 36,0 36,3 36,1 осуществляли при 40°С с использованием линей23 24,7 24,9 24,8 ного градиента ТГФ, проходящего от 60% до 78% 24 125,0 125,2 125,2 за 16минут(Расход 1 мл/мин) Собирали 8 фрак25 130,6 130,9 130,9 ций по 1 мл и испытывали их на MIS - активность 26 17,6 17,6 17,6 На третьей стадии фракции с второй стадии, 27 25,7 25,7 25,7 которые были найдены активными при социтном 28 15,4 15,4 тесте, растворяли в 100мл смеси и н-гептан 229 27,9 27,9 пропанол(98 2, объем/объем) и переносили на ЗО 24,2 колонку для полупрепаративной B3>KX(Chrom Spher Si 5MKM, 250 х 10мм вн диаметр, Chrompack) Элюирование осуществляли при комнатной температуре с использованием подвижной фазы, состоящей из смеси н-гептан 2-пропанол, 98 2(объем/объем) (расход 5мл/мин) Собирали 5 фракций по 2,5мл и испытывали их на MIS - активность На всех стадиях элюирование контролировали УФ - детектированием при 220нм Материал, прошедший через описанную выше процедуру трехстадийной очистки, использовали для исследования молекулярной структуры активного соединения путем спектрометрии ядерного магнитного резонанса(ЯМР) и путем масс - спектрометрии Для получения ЯМР - спектра приблизительно 1мг очищенного материала растворяли в 0,6мл дейтерохлороформа Расщепленный ЯМР - спектр на протоне 13С-1Н-ЯМР - спектр(с увеличением разрешения или без) и 20 TOCSV - спектр были записаны на ЯМР - спектрометре Druker AMX2 400, снабженном инверсной широкополосной 5мм Мас - спектрометрию осуществляли с использованием прибора YG Тпо 1000 для ЖХ и МС с интерфейсом L1NC для пучка частиц и программой LAB-BASE 21(Fisons Instruments) и с системой ВЭЖХ, содержащей колонку(Спготраск), ChromSpher Si, Змкм, 100 х 4,6мм ВЭЖХ осуществляли при комнатной температуре с использованием смеси н-гептан 2-пропанол, 98 2(объем/объем) в качестве подвижной фазы(расход 0,6мл/мин) Образец вводимого MIS растворяли в н-гептане Масс - спектрометр работал в режиме электронного удара Результаты даны в таблице 2, где относительные высоты пиков для выделенного продукта сравниваются с данными для 4,4-диметилзимостерина из ссылки 1 Под ссылкой 2 "+" означает, что о соответствующем пике сообщено также в этом исследовании "-" под ссылкой 1 или 2 означает, что о соответствующем пике в этих исследованиях не сказано 13 51622 14 Таблица 2 M/z 412 397 379 301 299 274 259 241 Интерпретация + [М] [М-СНзГ + [М-СН3-Н2О] + [M-SC] + [M-SC-2H] + [M-SC-C2H3] + [M-SC-C3H6] + [M-SC-C3H6-H2O] MIS 100 60 24 11 22 8 21 44 SC = боковая цепь, С2Нз = положения 16 и 17, СзНб = положения 15, 16 и 17 Ссылка 1 Baloch et al Photochemistry 23(1984)2219 Ссылка 2 Monmoto et al Libigs Ann Chem 708(1967)230 На основа 13С-ЯМР-спектра и молекулярной массы 412, определенной путем масс - спектроскопии(МС), было предположено, что структура MIS, выделенного из бычих семенников, представляет собой 4,4-диметил-5а-холесте-8,24диен-Зр-ол, также обозначенный как 4,4диметилзимостерин(ОМ2) Химические сдвиги отдельных углеродных атомов MIS активного материала с третьей стадии очистки путем ВЭЖХ сравнивали с химическими сдвигами структурно очень близко родственных соединений ланостерина и зимостерина Наблюдаемые протонные химические сдвиги, константы взаимодействия и ТОС У-корреляции окончательно подтверждают, что выделенное соединение является 4,4диметилзимостерином Пример 2 Выделение, очистка и идентификация мейоз индуцирующего вещества(МІЗ) из человеческой фолликулярной жидкости Человеческую фолликулярную ж и д к о с т ь ^ ) получали из фолликулов, отсосанных для сбора доцитов при лечении бесплодия путем оплодотворения in vitro Жидкость лиофилизировали и экстрагировали н-гептаном и экстакт очищали, используя такие же продукты, как описанные в примере 1 Соединение активного пика имело молекулярной ион с m/z = 410 и масс - спектр показал, что химическая структура молекулы FF-MIS 4,4-диметил-5а(-холеста-8,14,24-триен-Зр - ол Методы Масс - спектрометрию осуществляли с использованием прибора YG- Тпо 1000 для ЖХ и МС с интерфейсом L1NC для пучка частиц и программой LAB-BASE 2 1(Fisons Instruments), соединенного с системой прямофазной ВЭЖХ, содержащей KonoHKy(Chrompack), ChromSpher Si, Змкм, 100 х 4мм в д и смесь н-гептан 2-пропанол метанол аммиак(68 30 2 0,2) в качестве подвижной фазы(расход 0,5мл/мин) Образец вводимого MIS растворяли в н-гептане Масс - спектрометр работал в режиме электронного удара Результаты даны в таблице 3 Таблица 3 M/z Интерпретация Ссылка 1 100 42 17 13 8 33 33 410 395 392 377 349 381 279 257 255 239 =М М-15 М-18 М-33 М-61 М-129 М-131 М-153 М-155 М-171 Ссылка 2 + + + + + + + [М] (М\л/для FF-MIS) [М-СНзГ + [М-Н20] [М-СН3-Н2О]+ [М-43-Н2О]+ [M-SC-H2O]+ (SC = 111) [M-SC-2H-H2O]+ [M-SC-42]+ [M-154-H]+ [M-SC-42-H2O]+ SC = боковая цепь Пример 3 Получение 4р-метилзимостерина путем ферментации Стадия А Штамм дрожжей Kluyreromyces bulgancus А3410 засевали на скошенный агар YPG и выращивали Здня при 30°С в термостатированном инкубаторе Добавляли в скошенный агар 5мл стерильной среды УЕ и дрожжевые колонии суспендировали в жидкой среде путем взбалтывания пробирки на вихревом смесителе Затем суспензию клеток засасывали в 5мл стерильный шприц и вводили в колбу для взбалтывания с двумя отражателями на дне Колба содержала 200мл среды ZYM Колба закрепляли на вращающемся столе и обеспечивали размножение дрожжей в течение 24часов при 250об/мин, 30°С Добавляли в колбу 0,4мл стерильного профильтрованного раствора амфотерицина В и продолжали размножение еще 25часов Дрожжевые клетки собирали путем центрифугирования(Модель 6 Бекмана, 5°С, Юмин, 4000об/мин) и промывали один раз в воде Суспензию клеток закрывали в небольшом пластмассовом контейнере и хранили при -18°С до окончательной экстракции стеринов Упомянутые выше питательные среды и раствор амфотерицина В имели следующий состав Агар yPG Дрожжевой экстракт 4г КН2РО4 1г MgSO4-7H2O 0,5г Глюкоза 15г Агар 20г Деионизированная вода 1000 мл рН регулировали до 5,8 перед автоклавированием при 121 °С, 20мин Среда УЕ Дрожжевой экстракт Юг Деионизированная вода 1000мл 16 15 51622 Автоклавирование 121 °С, 20мин сано by Schroepfer et a l ; Chem; Stry and Physics of Среда ZYM Lipids 47(1988) 187, и показали такие физические константы, какие описаны в литературе Дрожжевой экстракт, Difco 20г Пептон, Bacto Юг Пример 5 Водопроводная вода 1000мл Получение 4,4-диметилхолест-8-ен-Зр-ола рН регулировали до 6,5 - 6,6 перед автоклаСтадия А вированием при 121 °С, 20мин ГлюкоВ 20мл пиридина растворяли при 0°С 2,48г за(добавляли отдельно после автоклавирования) 4,4-диметилхолеста-8,14-диен-Зр-ола(пример 4) К 60г полученному раствору добавляли 1,7г бензоилРаствор амфотерицина В хлорида и смесь перемешивали при окружающей 1мг Фунгизона(лиофилизированный брикет из температуре всю ночь После упаривания досуха 50мг амфотерицина В, 41мг дезоксихолата натрия добавляли 25мл толуола и после стандартной и 20,2мг фосфата натрия производства ф водной обработки, упаривания и растирания с "Squibb") растворяли в 1мл деионизированной ацетоном получили 2,3г(74%) кристаллического воды бензоата 1 Стадия В Н-ЯМР-спектр(СО СІ_з, 5) показал характериКультивированные клетки со стадии А суспенстические сигналы при 8,1 (д, 2Н), 7,55(т, 1Н), дировали в 10мл воды и добавляли 10мл 40%7,4(т, 2Н), 5,4(с, широкий, 1Н), 4,2(дд, 1Н) ного КОН в метаноле Смесь нагревали с обратСтадия В ным холодильником в течение 4часов, оставляли В 50мл ТГФ растворяли 2,04г 3-бензоилоксина ночь при комнатной температуре и затем два4,4-диметилхолеста-8,14-диена(стадия А) и дожды экстрагировали 20мл н-гептана Объединенбавляли по каплям при 0°С 360мл 1М раствора ные экстракты промывали 10%-ным раствором борана в ТГФ Смесь перемешивали при окрухлорида натрия и затем водой до нейтральной жающей температуре всю ночь, охлаждали до 0°С реакции(пять раз) и высушивали После испареи добавляли к ней по каплям 140мл воды, а затем ния растворителя осталось 40мг неочищенных добавляли 360мл 10%-ного гидроксида натрия и стеринов 378мл 30%-ного пероксида водорода После пеСтадия С ремешивания в течение ЭОминут к смеси добавНеочищенные стерины со стадии В растворяляли 100мл диэтилового эфира и водную фазу ли в 1мл смеси н-гептана 2-пропанол(98 2) и дважды экстрагировали диэтиловым эфиром взбалтывали на вихревом смесителе, центрифуОбъединенные органические фазы промывали гировали при 5000об/мин в течение Юмин и затем два раза раствором бисульфита натрия и затем подвергали ВЭЖХ водой После упаривания продукт очищали путем хроматографии на SiO2(2%-Hbm диэтиловыи эфир Колонка Lien vo Sorb DIOL Юмкм, 250 x 4мм в толуоле) и в результате получили 0,62г 3внут диаметр(Мегск) бензоилокси-4,4-диметилхолест-8-ен-15-ола Элюент смесь н-гептан 2-пропанол(98 2) МС(молекулярный ион) 534,4 Расход 1,1 мл/мин, 20°С 1 Детектирование УФ при 220нм Н-ЯМР-спектр(СО СІ_з, 5) показал характериОт нескольких проходов собирали пиковые стические сигналы при 8,0(д, 2Н), 7,5(т, 1Н), 7,4(т, фракции после 6,8мин элюирования Собранные 2Н), 4,75(м, 1Н), 4,1 (м, 1Н) фракции объединяли и выпаривали растворитель, Стадия С что дало остаток, который подвергали масс - спекВ 2,7мл пиридина при 0°С растворяли 0,54г 3трометрии и социтному тесту бензоилокси-4,4-диметилхолест-8-ен-15-ола и к Данные масс - спектра, приведенные в таблиполученному раствору осторожно добавляли 33мг це 4, идентичны с данными для 4(3диметиламинопиридина и 287мг фенилхлортиометилзимостерина, зарегистрированными в бибформиата Смесь перемешивали 20часов при оклиотеке Национального бюро стандартов ружающей температуре После добавления 25мл диэтилового эфира смесь промывали браз насыТаблица 4 щенным раствором сульфата меди, водой, дважды 10%-ным гидроксидом натрия, водой и рассоn/z Интерпретация лом и упаривали с получением 0,68г неочищенного 3-бензоил-4,4-диметилхолест-8-ен398 = М [М]+(М\л/для 4р-метил зимостерина) 15-фенилтиокарбоната, который дополнительно 383 М-15 [М-СНз]+ обрабатывали путем растворения в 20мл толуола 380 М-18 [М-Н2О]+ и обработки 370мг гидрида трибутилолова и 20мг 365 М-33 [М-СН3-Н2О]+ + азоизобутиронитрила Смесь нагревали при 90°С 269 М-129 [M-SC-H2O] (SC = 111) в течение 20минут и повторяли ту же самую обра267 М-131 [M-SC-H2O-2H]+ ботку После упаривания смесь подвергали грубой 245 М-153 [M-SC-СзНє] очистке путем хроматографии на ЭЮ2(гептан 227 М-171 [M-SC-C3H6-Hp2O]+ метиленхлорид = 70 30) и в результате получили 4 + 213 М-185 [M-SC-C H8-H2O] 150мг сырого 3-бензоилокси-4,4-диметилхолест-8ена с примесью соответствующего 8,14SC = боковая цепь диена(стадия А) Пример 4 Получение 4,4-диметилхолестаСтадия D 8,14-диен-Зр-ола В 2мл метиленхлорида, охлажденного до 0°С, Это соединение было получено так, как опирастворяли 150мг смеси, полученной на стадии С 18 17 51622 Добавляли по каплям 0,7мл диизобутилалюми75минут Охладив смесь на ледяной бане, добавнийгидрида и через 15минут осторожно добавляли ляли 15мл в 2 н хлороводородной кислоты, раз0,15мл воды Затем добавляли 25мл диэтилового деляли фазы и органическую фазу промывали два эфира и органическую фазу промывали насыщенраза 7,5мл 2 н хлороводородной кислоты Водную ным раствором виннокислого калий-натрия два фазу экстрагировали толуолом и объединенные раза, водой и рассолом и упаривали с получением органические фазы промывали водой и рассолом, 130мг смеси, которую подвергали хроматографии сушили и упаривали с получением 1,18г неочина смеси AgNO3/SiO2 U2 [полученной так, как опищенного холеста 5,7-диен-З-она в виде вязкого сано в Спет 2 Phys Of Lipids 63(1992) 115] с масла 1 элюированием толуолом Кристаллизация из смеН-ЯМР-спектр показал характеристические си эфир-метанол дала 49мг целевого соединения сигналы при 5,8(с, 1Н), 5,2(м, 1Н), 3,2(д, 1Н), Температура плавления 154 155°С 2,7(д,д, 1Н) МС(молекулярный ион) 414,4 Стадия В 13С-ЯМР-спектр(СО СІ_з 100,6МГц) показал В 16мл трет-бутанола при 45°С растворяли характеристические сигналы при 78,49(Сз), 0,67гтрет-бутоксида калия, добавляли 0,57гхоле127,49(С8), 135,35(С9) ста-5,7-диен-3-она и смесь перемешивали Юминут Добавляли 0,47г 1,4-дииодбутана и Пример 8 смесь перемешивали ЗОминут Выпаривали расПолучение 3-ацетокси-4,4-диметилхолестатворитель, остаток вновь растворяли в толуоле и 8,14-диена воде и добавляли немного рассола, чтобы выВ 7,5мл пиридина и 7,5мл уксусного ангидрида звать разделение фаз Органическую фазу прорастворяли 1,3г 4,4-диметилхолеста-8,14-диен-3мывали четыре раза водой и объединенные водола [Schroepfer et al , Chem, stru and Phys of Lipids ные фазы экстрагировали один раз толуолом 47(1988) 187] и раствор перемешивали при 23°С Объединенные толуоловые экстракты сушили и всю ночь Смесь упаривали в вакууме, десорбироупаривали с получением 0,45г вспененного матевали два раза толуолом и очищали путем флэш риала, который после кристаллизации из смеси хроматографии на SiC^Cronyon) Первые 300мл диэтиловый эфир-метанол дал 0,35г кристалличеэлюата упаривали и продукт кристаллизовали из ского 4,4-тетраметиленхолета-5,7-диен-3-она диэтилового эфира с получением 140мг 3МС(молекулярный ион) 436,4 ацетокси-8,14-диметилхолестадиена Температура плавления 120 - 125°С(с разложением) МС(молекулярный ион) 454,4 1 Н-ЯМр-спектр(СО СІ_з 5) показал характеристические сигналы при 5,4(с, широкий, 1Н), 4,5(дд, 1Н), 2,0(с, ЗН) Пример 7 Получение холеста-8,14-диен-3[3-ола В смеси 2,7мл бензола, 19мл этанола и 2,7мл концентрированной хлороводородной кислоты растворяли 770мг дегидрохолестерина и раствор нагревали при температуре кипения с обратным холодильником в течение Зчасов Смесь охлаждали на ледяной бане, получив в результате первый сбор(110мг) кристаллов Выпаривание фильтрата досуха и кристаллизация из смеси эфир/метанол дали второй сбор(220мг) кристаллов, который объединяли с первым сбором и хроматографировали на смеси Адг\ІОз/ЗіО2(полученной так, как описано в примере 5, стадия D) с элюированием 2,5%-ным ацетоном в толуоле, получив в результате 94мг чистого холеста-8,14-диен-3[3-ола Температура плавления 113 - 114,5°С МС(молекулярный ион) 384,4 1 Н-ЯМР-спектр(СО СІ_з, 5 ) продукта показал характеристические сигналы при 5,35(с, широкий, 1Н), 3,6(м, 1Н) 13 С-ЯМР-спектр(СО СІ_з 50,3МГц) показал характеристические сигналы при 70,99(Сз), 117,42(Сі5), 123,1(С8), 140,8(С9), 151,1 (Си) Пример 8 Получение 4,4-тетраметиленхолеста-8,14диен-3-ола Стадия А В 15мл 2-бутанола растворяли 1,15г дегидрохолестерина, добавляли 0,34г изопропоксида алюминия и смесь нагревали при температуре кипения с обратным холодильником в течнеие 1Н-ЯМР-спектр(СО СІ_з 5) показал характеристические сигналы при 5,75(д, 1Н), 5,5(м, 1Н) Стадия С В 6мл ТГФ суспендировали 130мг Li АІ_ЬЦ и к суспензии добавляли по каплям в течение ЗОминут 1,97г 4,4-тетраметиленхолеста-5,7-диен3-она, растворенного в 40мл ТГФ Спустя 15минут после окончания добавления все еще оставалась некоторая часть непрореагировавшего исходного материала(ТСХ) и потому добавляли еще 65мг LiALhU После перемешивания в течение ЗОминут реакция закончилась, после чего добавляли по каплям 0,9мл воды, растворенной в 5мл ТГФ После ЗОминут перемешивания добавляли избыточное количество сульфата магния и смесь перемешивали еще ЗОминут, фильтровали и упаривали досуха Остаток растворяли в 25мл диэтилового эфира и 25мл метанола и эфир осторожно удаляли в вакууме После перемешивания на протяжении ночи, выделяли путем фильтрования 1,75г кристаллического 4,4-тетраметиленхолеста5,7-диен-З-ола МС(молекулярный ион) 438,4 1 Н-ЯМР-спектр показал характеристические сигналы при 5,8(д, 1Н), 5,5(м, 1Н), 3,5(м, 1Н) Стадия D В смеси 2,38мл бензола, 17,5мл этанола и 2,38мл концентрированной хлороводородной кислоты растворяли 770мг соединении, полученного на стадии С, и раствор нагревали с обратным холодильником в течение 16часов и упаривали в вакууме Остаток вновь растворяли в 5мл толуола, фильтровали и хроматографировали на колонке среднего давления с АдІЧОз/ЗіОгСгептан толуол = 10 90), получив в результате 35мг 4,4тетраметиленхолеста-8,14-диен-3-ола МС(молекулярный ион) 438,4 20 19 51622 Н-ЯМР-спектр(СО СІ_з 5) продукта показала Сбор и культивирование ооцитов характеристические сигналы при 5,35(с, широкий, После извлечения яичников помещали их в 1Н)3,3(дд, 1Н) НХ - среду(смотри ниже) и освобождали от инородной ткани Среда для сбора и культивирования С-ЯМР-спектр(СО CL3, 100,6МГц) показал состояла из минимально необходимой среды Игхарактеристические сигналы при 79,0(Сз), neca(Flow, США), содержащей 4 мМ гипоксантина, 117,4(015), 122,9(С8), 141,3(С9), 151,1 (Си) Змг/мл бычьего сывороточного альбемина, Пример 9 0,23мМ пирувата натрия, 2мМ глутамина, Получение 4,4-диметилхолест-8(14)-ен-Зр-ола ЮОЕД/мл пенициллина и 100мкг/мл стрептомициВ 20мл диэтилового эфира и 20мл уксусной на(все Sigma, США) Эту среду называют НХ кислоты растворяли 580мг 4,4-диметилхолест-8средой Такую же среду, но без НХ использовали ен-3р,-ола Добавляли 60мг 10%-ного Pd/C катав качестве контрольной среды лизатора и смесь оставляли при перемешивании на ночь под водородом при 3,5атм Удаляли катаАнтральные фолликулы яичников прокалывализатор и фильтрат концентрировали до 10мл, в ли под препаровальной лупой иглой калибра 27 результате чего началась кристаллизация ДобавОтбирали заключенные в кумулус(совокупность ляли 10мл метанола и через 16часов собирали оболочек) клетки(СЕО) одинакового размера и кристаллы Перекристаллизация из метанола дапромывали их три раза-в свежей НХ - среде ла 230мг материала, который, как показали 1 Н- и Ооциты, освобожденные от клеток кумулуса, 13 С-ЯМР-спектры был смесью 8(9)- и 8(14)т е денудированные(оголенные) ооциты(ОО) поизомеров лучали путем осторожной продувки СЕО через ротовую пипетку с отверстием очень малого диаСмесь вновь растворяли в 10мл диэтилового метра СЕО и DO культивировали в тарелках с 4 эфира и 10мл уксусной кислоты Добавляли 75мг ячейками(І\ІипсІоп, Дания), содержащих 0,5мл НХ5%-ного Pt/C катализатора и смесь обрабатывали среды, кроме контрольных, которые культивировсю ночь водородом при атмосферном давлении вали в контрольной среде Каждая ячейка содерУдалив катализатор, выпаривали растворитель и жала 35 - 50 ооцитов Культуры для испытания кристаллический остаток растирали с 5мл метабыли приготовленыс разными концентрациями нола, получив в результате 190мг чистого 4,4испытуемых соединений, как указано в таблице 5 диметилхолест-8(14)-ен-Зр-ола МС(молекулярный ион) 414,4 Культуры приготавливали при 37°С и 100%13 ной влажности с 5% СОг в воздухе Время культиС-ЯМР-спектр(СО СІ_з 100,6МГц) показал хавирования составляло 24 часа рактеристические сигналы при 79,24(Сз) I 126,11(С8), 142,20(Си) Проверка ооцитов Пример 10 По окончании периода культивирования подсчитывали число ооцитов с ядром(С\/) или с разИспытание мейоз - индуцирующего вещества рушением ядра(С\/ВО) и ооцитов с полярным в ооцитном тесте, тельцем (РВ) под инвертационным микроскопом с Животные дифференциальной интерференционно - контраНедоразвитых мышей - самок(В6О 2-F1, линия стной аппаратурой Вычисляли процент ооцитов с C57B1/2J) держали при регулируемых освещеGVBD от общего числа ооцитов и процент ооцитов нии(14ч света, 10ч темноты) и температуре с с РВ от GVBD Результаты для DO и СЕО, вычисупотреблением пищи и воды по желанию Когда ленные в виде единиц активности MIS, даны в животные достигли массы 13 - 16г(что соответсттаблице 5 Одну единицу активности MIS опредевует возрасту 20 - 22дня отроду), им сделали одну ляют как инъекцию(внутрибрюшинно) человеческого менолаузального гонадотропина(Нитедоп, Organon, Nerherlands), содержащего приблизительно 20 МЕД FS Н(фолликулостимулирующий гормон) и и число единиц активности MIS вычисляють 20 МЕД ]Н(лютеинизирующий гормон) (Ziebe, S et как al, Hum Rerod 8(1993) 385 - 88) Спустя 8часов %GVBDH(;n -%GVBD, животных убивали путем цервикального(шейного) смещения 1 Таблица 5 Вещество 4,4-Диметилзимостерин 4,4-Диметил-5а-холеста8,14,24-триен-Зр-ол Зимостерин 4р-Метилзимостерин DO 2,7 1,8 0,6 1,5 0,9 0,6 1,6 1,2 0,6 6,2 СЕО 2,9 2,7 1,3 1,3 1,0 2,3 0,5 1,1 0,4 0,2 3,5 Концентрация мкг/мл 1,2 0,3 0,2 0,02 0,002 0,3 0,03 0,1 0,01 0,001 3,9 21 22 51622 Продовження таблиці 5 4,4-Диметилхолест-8-ен-Зр-ол 4,4-Диметилхолеста-8,14-диен-Зр-ол Пример 11 Испытание мейоз - индуцирующего вещества в гонадном тесте Гонадный тест выполняли, по существу, так, как описано by Byskov.A G et al Мої Repvod, Dev 34(1993) 47 - 52 Результаты приведенные в 0,8 0,8 2,25 2,4 12,8 0 0,13 0,03 3,0 таблице 6, оценивали полуколичественно, как описано by Westergaard, L et al Fertil Stenl 41(1984)377-84 Таблица 6 Вещество 4,4-Диметил-зимостерин 4,4-Диметил-5а-холеста-8,14,24-триен-Зр-ол Пример 12 Получение моно (5а-холеста-8,14-диен) -Зрсукцината В 10мл ТГФ растворяли 0,50г 5а-холеста-8,14диен-Зр-ола, а затем 0,39г янтарного ангидрида и 16мг 4-диметиламинопиридина Раствор нагревали с обратным холодильником всю ночь и затем упаривали досуха Остаток суспендировали в 10мл воды и осадок отфильтровывали и промывали водой и высушивали, получив в результате 0,48г целевого соединения, которое можно было дополнительно очистить путем растворения в смеси водного раствора гидрокарбоната натрия и этанола, добавить хлороводородную кислоту до рН2 и затем концентрировать раствор с получением осадка Температура плавления 128 - 131 °С МС(молекулярный ион) 484,4 1 Н-ЯМР-спектр(СО СІ_з 5) продукта показал характеристические сигналы при 5,36(с, 1Н), 4,75(м, 1Н), 2,67(м, 2Н), 2,6(М, 2Н) С-ЯМР-спектр(СО СІ_з 100,6МГц) показал характеристические сигналы при 73,4, 117,1, 122,7, 140,0, 150,5, 171,2, 177,2 Пример 13 Получение Зр-этоксикарбонилокси-5ахолеста-8,14-диена В смеси 5мл толуола и 5мл пиридина растворяли с охлаждением в ледяной бане 0,50г 5рхолеста-8,14-диен-Зр-ола Добавляли в течение 5мин 2,3мл этилхлорформиата, растворенного в 5мл толуола Через 30 минут ледяную баню убирали и продолжали перемешивать 20 часов при комнатной температуре и затем 2 часа при 60°С Реакционную смесь упаривали досуха в вакууме и остаток растирали с 10мл этанола, получив в результате 0,505г целевого соединения, которое может быть дополнительно очищено путем перекристаллизации из этанола Температура плавления 101 - 106°С МС(молекулярный ион) 456,3 1 Н-ЯМР-спектр(СО СІ_з 5) продукта показал характеристические сигналы при 5,30(с, 1Н), 4,50(м, 1Н), 4,12(кв, 2Н), 1,24(т, ЗН) 13 -С-ЯМР-спектр(СО СІ_з 100,6МГц) показал характеристические сигналы при 62,6, 116,6, 122,2, 139,4, 150,0, 153,6 Пример 14 Концентрация мкг/мл 10 30 Результат ++ + Получение Зр-фосфоноксо-4,4-диметил-5ахолеста-8,14-диена ВЮмл сухого пиридина растворяли 2,00г 4,4диметил-5а-холеста-8,14-диен-Зр-ола и полученный раствор добавляли к раствору 1,66мл оксихлорида фосфора в течение 5минут при охлаждении в ледяной бане После перемешивания при комнатной температуре в течение ЗОминут осадок отфильтровывали и промывали сухим ацетоном Остаток суспендировали в 70мл воды и нагревали с обратным холодильником в течение 1 1/4часа После охлаждения при комнатной температуре осадок отфильтровывали, промывали водой и высушивали с получением 0,93г неочищенного продукта 0,70г неочищенного продукта растворяли в 75мл 0,1 М водного раствора гидроксида калия и раствор фильтровали через Юг смолы Амберлит IR-120(Н) и упаривали в вакууме досуха Остаток растирали с 10мл воды и, отфильтровав осадок, промывали его водой и высушивали, получив в результате 0,48г целевого соединения Температура плавления 183-185°С 1 Н-ЯМР-спектр(СОС13 + 2капли CD3OD) продукта показал характеристические сигналы при 5,36(с, 1Н), 3,89(м, 1Н) С-ЯМР-спектр(СОСІ3 + 2капли CD3OD, 100,6МГц) продукта показал характеристические сигналы при 85,1, 116,9, 122,3, 140,9, 150,5 Пример 15 Получение Зр-изоникотиноил-5ахолеста-8,14-диена В 5мл пиридина растворяли 0,50г 5а-холеста8,14-диен-Зр-ола, а затем 1,16г изоникотиноилхлоридгидрохлорида Суспензию нагревали с обратным холодильником всю ночь и затем упаривали досуха Остаток суспендировали в 100мл воды при охлаждении в ледяной бане Осадок отфильтровывали, промывали водой и высушивали, получив в результате 0,97г неочищенного продукта, который перекристаллизовывали из смеси ацетон - вода с получением 0,40г целевого соединения Температура плавления 129-131 °С 1 Н-ЯМР-спектр(СО СІ_з 5) продукта показал характеристические сигналы при 8,77(д, 2Н), 7,84(д, 2Н), 5,39(с, 1Н), 4,49(м, 1Н) С-ЯМР-спектр(СО СІ_з 50,3МГц) показал характеристические сигналы при 75,0, 117,7, 122,8, 23 123,3, 138,0, 140,3, 150,5, 150,9, 164,6 51622 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 24
ДивитисяДодаткова інформація
Назва патенту англійськоюDrug for controlling meiosis
Назва патенту російськоюЛекарственное средство для регулирования мейоза
МПК / Мітки
МПК: A61P 15/00, A61K 31/575, C07C 13/00, A61K 31/075, A61B 17/425
Мітки: засіб, лікарський, мейозу, регулювання
Код посилання
<a href="https://ua.patents.su/12-51622-likarskijj-zasib-dlya-regulyuvannya-mejjozu.html" target="_blank" rel="follow" title="База патентів України">Лікарський засіб для регулювання мейозу</a>
Попередній патент: Похідні 3-аміно-2-меркаптобензойної кислоти та способи їх одержання
Наступний патент: Похідні хіноліну як антагоністи nk3 рецептора, спосіб їх одержання, фармацевтична композиція на їх основі та спосіб лікування захворювань
Випадковий патент: Спосіб лікування хворих на виразкову хворобу дванадцятипалої кишки, асоційовану з helicobacter pylory












