Лептин як стримувач швидкого збільшення пухлини клітини
Формула / Реферат
1. Застосування активного агента, вибраного з групи, що складається з лептину, лептинзлитих білків, лептинових мутеїнів, агоністів лептинового рецептора, активних фрагментів або фракцій будь-якого з них, активних аналогів або похідних будь-якого з них, солей будь-якого з них і будь-яких їх сумішей як інгібіторів проліферації пухлинних клітин.
2. Застосування активного агента за п.1 як інгібітора клітинної проліферації для лікування злоякісних утворень у ссавців.
3. Застосування активного агента за пп. 1 або 2 як інгібітора пухлин, залежних від фактора росту.
4. Застосування активного агента за будь-яким з пп. 1-3 як інгібітора клітинної проліферації карциноми молочної залози людини.
5. Застосування активного агента за п. 4 для лікування карцином молочної залози людини.
6. Застосування активного агента за п. 1 або п. 3 як інгібітора, стимулюючого ріст дії інсуліну на пухлинні клітини, опосередковане, принаймні частково, каскадом субстрат-1 рецептора інсуліну (IRS-1)/асоційований з рецептором фактора росту зв'язуючий білок-2 (GRB-2).
7. Застосування активного агента за п. 1 або п. 3 як інгібітора мітогенних відповідей в пухлинних клітинах на одну або більше рецепторні кінази, ростові фактори і цитокіни групи, що складається з IGF-1, ІЛ-4 і ІЛ-9, для всіх з яких IRS-1 є субстратом, для лікування пухлин.
8. Застосування активного агента за одним з пп. 1-7 як інгібітора базальної і інсулін-індукованої проліферації пухлинних клітин для лікування злоякісних утворень молочної залози людини.
9. Застосування активного агента за одним з пп. 1-8, в якому вказаним активним інгредієнтом є лептин і вказаний лептин використовують як вказаний інгібітор або для вказаного лікування.
Текст
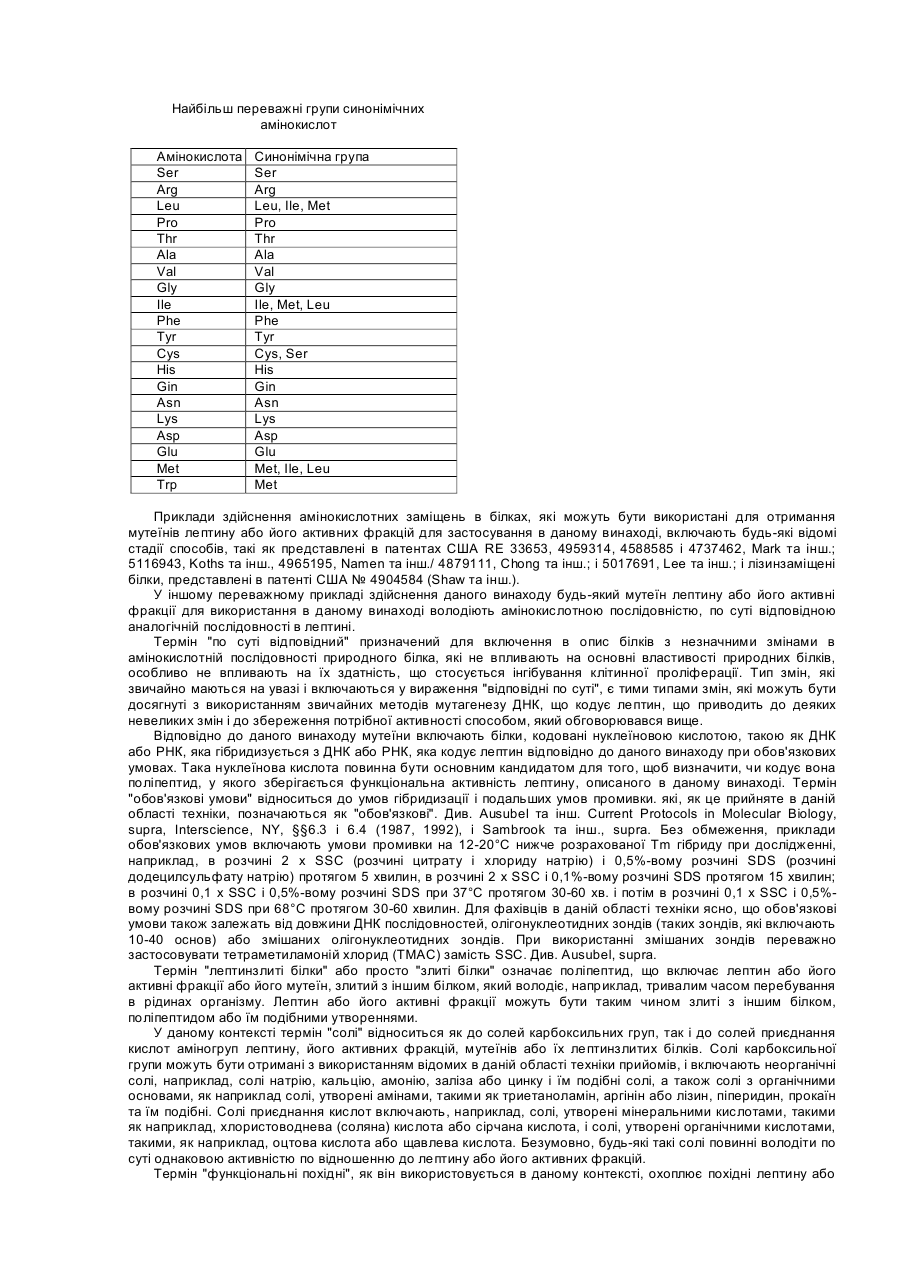
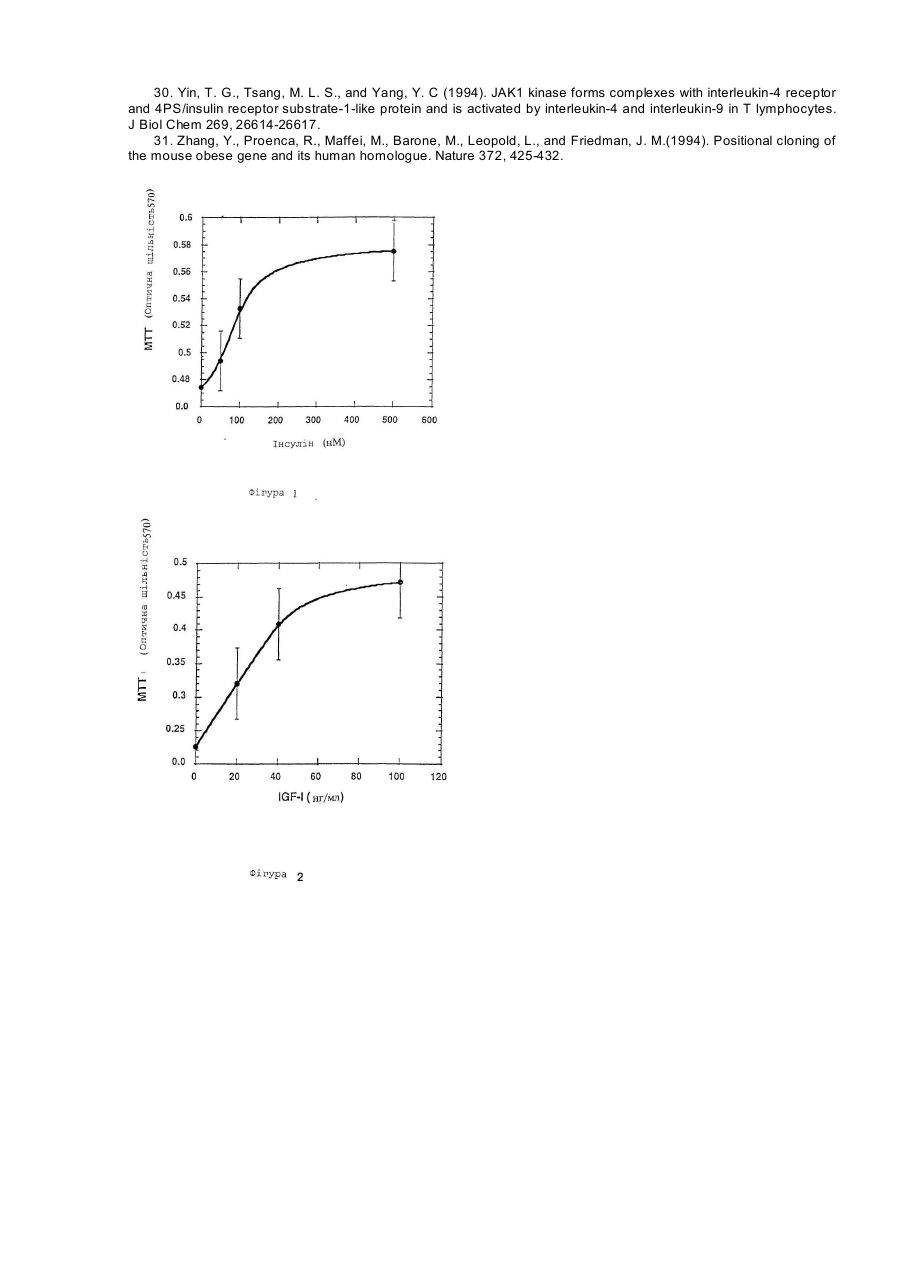
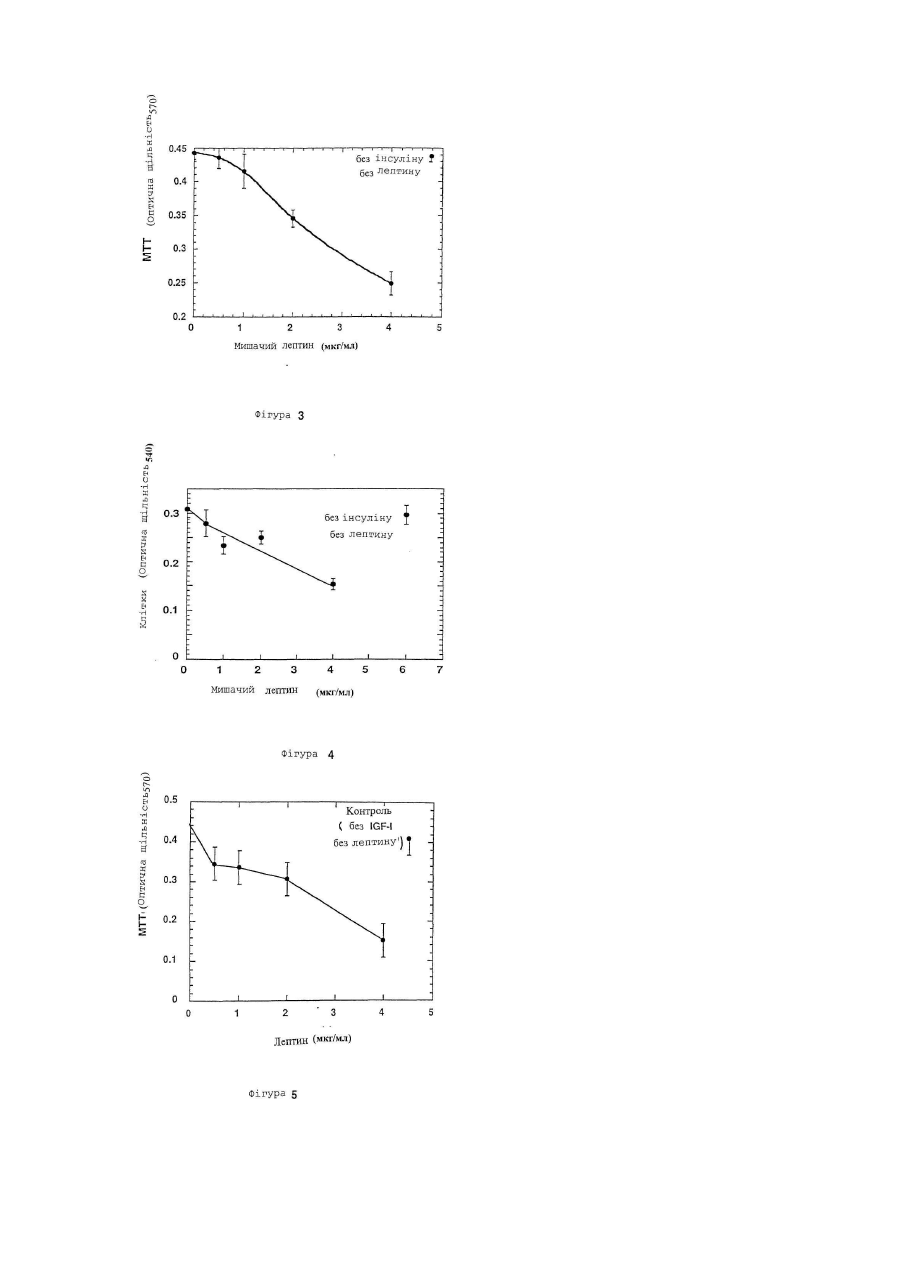
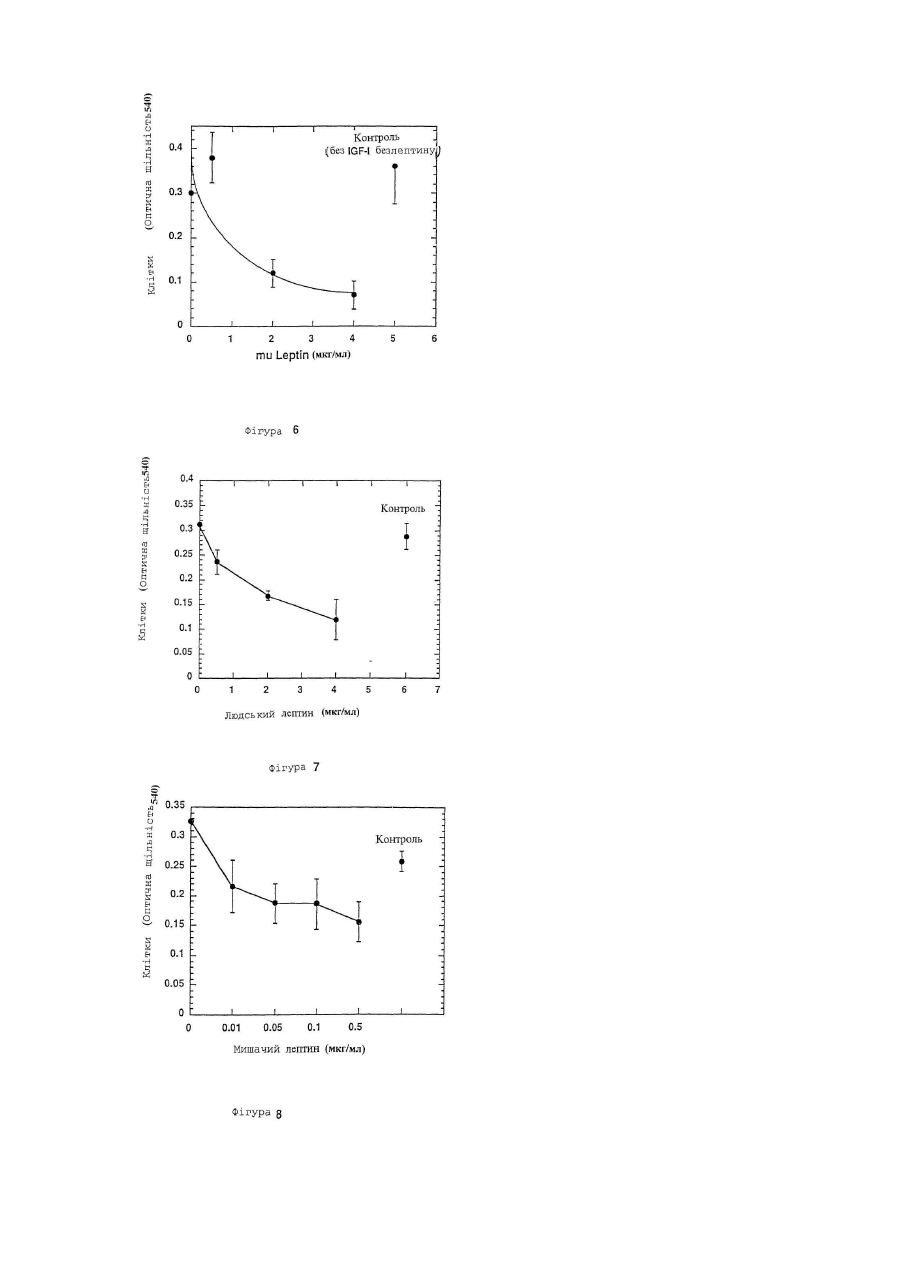
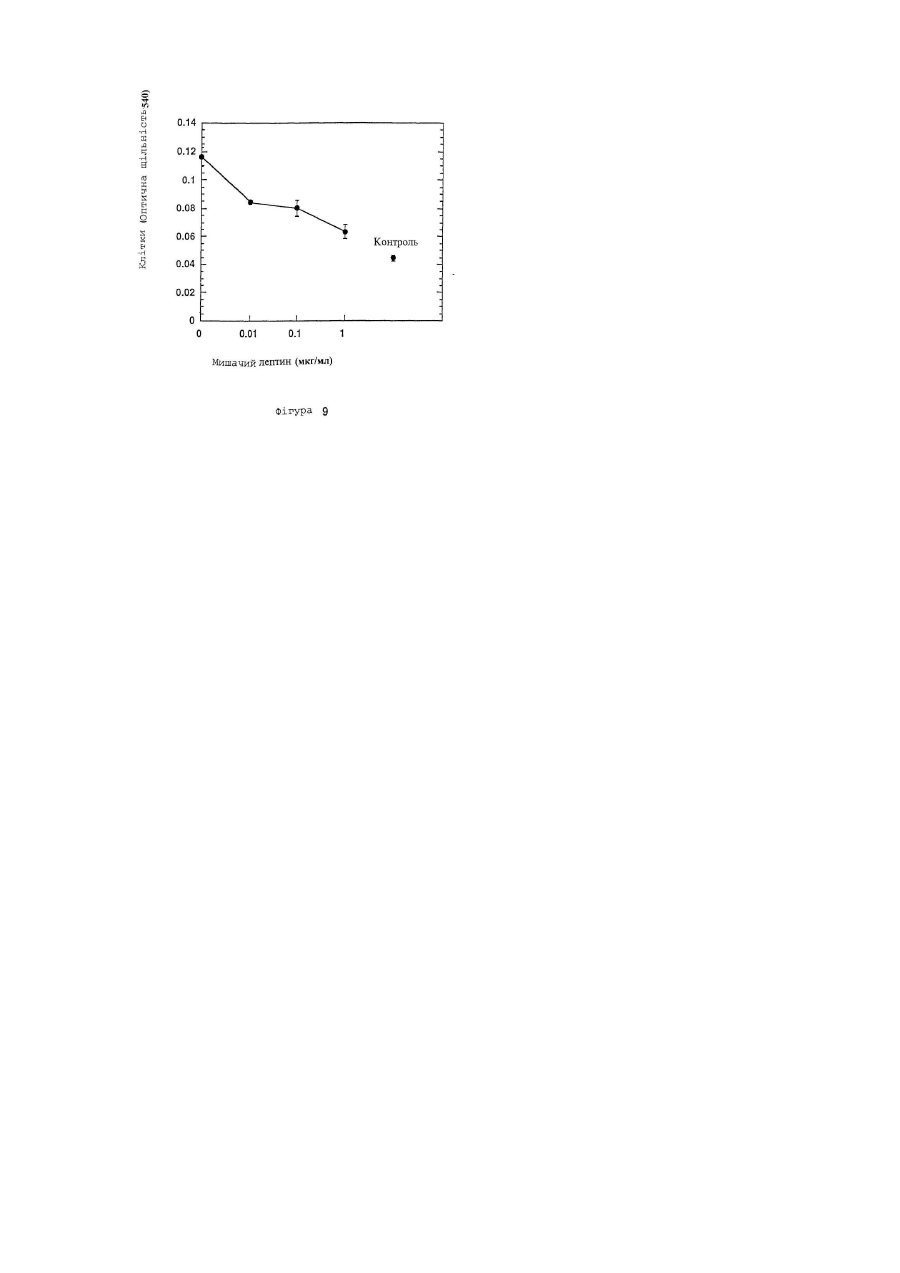
Даний винахід відноситься до лептину, цитокіну, продукуємому адипоцитами і що чинить вплив на різні типи кліток і тканин. У більш окремому плані цей винахід відноситься до принципово нових застосувань лептину в області онкології. Лептин, продукуємий адипоцитом цитокін, регулюючий масу тіла, був ідентифікований позиційним клонуванням мишачого ob гена (Zhang та інш., 1994), і була виявлена його дія як на споживання їжі, так і на термогенез (Campfield та інш., 1995; Collins та інш., 1996; Halaas та інш., 1995; Pelleymounter та інш., 1995; Weigle та інш., 1995). Дільниці, що володіють високою спорідненістю до скріплення лептину, локалізуються в хориоїдальному сплетенні; експресійне клонування кДНК з цієї тканини дає лептиновий рецептор (OB-R) (Tartaglia та інш., 1995). Відома активність лептину передається через його рецептор в гіпоталамус. Лептинові рецептори проте експресують ще і в інші органи, особливо в нирку, легень і печінку (Cioffi та інш., 1996; Lee та інш., 1996; Tartaglia та інш., 1995). Крім того, інша роль лептинових рецептор-сплайсингових варіантів, що розрізняються своїм цитоплазматичним доменом, полягає в специфічній дії на тканину миші (Lee та інш., 1996) . Тому в доповнення до контролю за споживанням їжі і температурою тіла, лептин може впливати і на інші фізіологічні функції. Незважаючи на те, що лептин продукується адипоцитами, нещодавній висновок про залежність між надлишком жиру і високими рівнями лептину в сироватці крові знаходиться в суперечності з уявленням про те, що лептин знижує споживання їжі і масу тіла (Considine та інш., 1996; Frederich та інш., 1995/ Lonnqvist та інш., 1995; Maffei та інш., 1995). Ця залежність і твердо встановлений зв'язок між ожирінням і резистентністю до інсуліну (Ferber і Golay, 1995), підтверджують, що лептин здатний модулювати інсулін-регульовані відповіді. Дійсно, нещодавно було опубліковано, що лептин значно зменшує базальне та інсулін-індуковане тирозинфосфорилування субстрату-1 інсулінового рецептора (IRS-1). Ця дія лептину на IRS-1 фосфорилування є специфічною, оскільки не зменшується тирозин-фосфорилування β - ланцюга інсулінового рецептора (IR) (Cohen та інш., 1996). Тирозин-фосфорилування IRS-1 за допомогою IR кінази є ключовою стадією в рецепторній сигнальній системі інсуліну, що приводить до багатьох з відомих інсулінових активностей (Araki та інш., 1994; Cheatham і Kahn, 1995; Myers та інш., 1994; Myers та інш., 1994; Myers і White, 1993; Rose та інш.,-1994; Tamemoto та інш., 1994; White і Kahn, 1994). Передача сигналу IRS-1 в прямому напрямі по ходу транскрипції опосередується декількома асоційованими білками, один з яких є зв'язуючим білком-2, асоційованим з рецептором фактора росту (GRB2) (Cheatham і Kahn, 1995). Інсуліновий рецептор (IR) розглядають як метаболічний рецептор, що передає дію інсуліну на гомеостаз глюкози. Як такий, він експресується на термінаційні тканини, що диференціюються (terminally differentiated), такі як жирова тканина, печінка і м'язова тканина. Однак багато які дослідження показали, що IR є потенційно мітогенним рецептором in vitro і in vivo, коли експресується в пухлинні клітки. Наприклад, функціональні інсулінові рецептори (IRs) були виявлені в декількох клітинних лініях раку молочної залози, як було встановлено тирозин-фосфорилуванням IR у відповіді на лікування інсуліном. Крім того, IR передає мітогенну відповідь в ці клітки, що встановлено введенням [3H]-тимідину (Milazzo та інш., 1997;Millazzo та інш., 1992). Досі не було описане використання лептину в області онкології в загальному плані; лептин досі не був описаний як корисний початок для інгібування проліферації кліток, особливо проліферуючих ракових кліток. Метою даного винаходу є використання лептину в якості інгібітора клітинної проліферації, наприклад, використання лептину як інгібітора проліферації ракових кліток. Іншою метою даного винаходу є використання одного лептину або лептину в поєднанні з іншими терапевтичними агентами для лікування різних злоякісних утворень. Ще однією метою даного винаходу є використання лептину, злитих з лептином білків, лептинових мутеїнів, агоністів лептинового рецептору, будь-яких їх активних фрагментів або фракцій, будь-яких їх активних аналогів або похідних, будь-яких їх солей та їх сумішей, для лікування різних злоякісних утворень. І ще однією метою даного винаходу є використання фармацевтичних композицій, що містять один або більш з вищезгаданих лептинів, білків, злитих з лептином, лептинових мутеїнів, агоністів лептинового рецептору, будь-яких їх активних фрагментів або фракцій, будь-яких їх активних аналогів або похідних, і будьяких їх солей для лікування різних злоякісних утворень. Інші цілі даного винаходу будуть вказані нижче або вони будуть очевидні з нижченаведеного розкриття. Даний винахід пропонує використати лептин в якості інгібітора клітинної проліферації. Лептин може бути використаний для лікування різних злоякісних утворень або сам по собі, або в поєднанні з іншими терапевтичними агентами або способами. Переважне втілення даного винаходу полягає у використанні лептину для інгібування клітинної проліферації карциноми молочної залози людини. Проліферація багатьох типів пухлинних кліток збільшується в присутності різних факторів росту, таких, як інсулін і інсуліноподібні фактори росту (IGF-I). Стимулююча ріст дія інсуліну і IGF-I на клітки опосередується, принаймні, частково IRS1/GRB2 каскадом реакцій (Myers та інш., 1993). Цей каскад реакцій інгібується лептином. Крім того, IRS-1 є субстратом рецепторних кіназ додаткових факторів росту і цитокінів, що включають IL-4 (ІЛ-4, інтерлейкін-4) і IL-9 (IJ1-9, інтерлейкін-9) (Pernis та інш., 1995/ Yin та інш., 1995/ Yin та інш.,'1994). Тому лептин може інгібувати мітогенні відповіді деяких або всіх вищезазначених факторів росту і цитокінів, також як і інших факторів росту, тим самим інгібуючи проліферацію різних типів пухлинних кліток. Представлені приклади включають інгібування IGF-1-індукованої проліферації та інсулін-індукованої проліферації ліній T-4 7D і MCF7 кліток раку молочної залози людини. даний винахід також пропонує використання для лікування різних злоякісних утворень лептину, лептинзлитих білків, лептинових мутеїнів, агоністів лептинового рецептору або будь-яких їх активних фрагментів або фракцій, і будь-яких їх солей, також як і фармацевтичних композицій, що містять лептин, лептинзлиті білки, лептинові мутеїни, агоністи лептинового рецептора, їх будь-які активні фрагменти або фракції, або їх будь-які солі. Більш конкретно даний винахід пропонує як інгібітори проліферації пухлинних кліток використання активного агента, вибраного з групи, що складається з лептину, лептинзлитих білків, лептинових мутеїнів, агоністів лептинового рецептора, будь-яких їх активних фрагментів або фракцій, будь-яких їх активних аналогів або похідних, будь-яких їх солей і будь-яких їх сумішей. Приклади здійснення вищезгаданих аспектів даного винаходу включають: (1) застосування вказаного активного агента в якості інгібітора клітинної проліферації для лікування злоякісних утворень у ссавців. (2) застосування вищезгаданого активного агента як інгібітора пухлин, залежних від фактора росту. (3) застосування вищезгаданого активного агента як інгібітора клітинної проліферації карциноми молочної залози людини. (4) застосування вказаного активного агента для лікування карциноми молочної залози людини. (5) застосування вказаного активного агента для інгібітора стимулюючого ріст дії інсуліну і IGF-I на пухлинні клітки, як опосередоване, принаймні частково, каскадом реакцій зв'язуючого білка-2, рецепторасоційованого з субстратом-1 інсулінового рецептора (IRS-1)/ростовим фактором (GRD2). (6) застосування для лікування пухлин вищезгаданого активного агента як інгібітора мітогенних відповідей в пухлинних клітках на одну або більше рецепторні кінази, фактори росту і цитокіни груп, що складаються з ІЛ4 і ІЛ-9, для яких IRS-1 є субстратом. (7) застосування вищезгаданого активного агента як інгібітора базальної, IGF-1-індукованої і інсулініндукованої проліферації пухлинних кліток для лікування злоякісних захворювань молочної залози людини. (8) застосування вказаного активного агента, в якому вказаним активним інгредієнтом є лептин і в якому вказаний лептин використовують в якості названого вище інгібітора або для вказаного лікування. Подібним же образом, даний винахід також пропонує в якості активного агента, вибраного з групи, що складається з лептину, лептинзлитих білків, лептинових мутеїнів, агоністів лептинового рецептора, будь-яких їх активних фрагментів або фракцій, будь-яких їх активних аналогів або похідних, будь-яких їх солей і будьяких їх сумішей для використання в приготуванні лікарського засобу для інгібування проліферації пухлинних кліток. Приклади здійснення цього аспекту винаходу включають: (1) активний агент, як вказано вище, для застосування в приготуванні лікарського засобу для лікування злоякісних утворень у ссавців. (2) активний агент, як вказано вище для використання в приготуванні лікарського засобу для інгібування пухлин, залежних від фактора росту. (3) активний агент, як вказано вище, для застосування в приготуванні лікарського засобу для інгібування клітинної проліферації карциноми молочної залози людини. (4) активний агент, як вказано вище, для застосування в приготуванні лікарського засобу для лікування карцином молочної залози людини. (5) активний агент, як вказано вище, для застосування в приготуванні лікарського засобу для інгібування рістстимулюючої дії IGF-I та інсуліну на клітки пухлини, як опосередованого, принаймні частково, каскадом реакцій IRS-1/GRB2. (6) активний агент, як вказано вище, для застосування в отриманні лікарського засобу для інгібування мітогенних відповідей в пухлинних клітках на одну або більше рецепторну кіназу, ростові фактори і цитокіни групи, що складається з IGF-I, IЛ-4 і ІЛ-9, для кожного з яких IRS-1 є субстратом, для лікування пухлин. (7) активний агент, як вказано вище, для застосування в отриманні лікарського засобу для інгібування базальної IGF-1-індукованої та інсулініндукованоі проліферації пухлинних кліток, для лікування злоякісних захворювань молочної залози людини. (8) активний агент, як вказано вище, в якому вказаним активним агентом є лептин. і вказаний лептин використовується. Подібним же образом, в іншому аспекті, даний винахід пропонує фармацевтичну композицію, що включає в якості активного інгредієнту активний агент, як відмічено вище, і фармацевтично прийнятний носій, розріджувач або наповнювач, для інгібування проліферації пухлинних кліток. Переважні приклади цього аспекту даного винаходу включають: (1) фармацевтичну композицію для лікування злоякісних захворювань у ссавців. (2) фармацевтичну композицію для інгібування пухлин, залежних від факторів росту. (3) фармацевтичну композицію для інгібування клітинної проліферації карциноми молочної залози людини і, тим самим, для лікування карциноми молочної залози людини. (4) фармацевтичну композицію для інгібування стимулюючої ріст дії IGF-I та інсуліну на клітки пухлин, як опосередованого, принаймні частково, каскадом реакцій IRS-1/GRB2. (5) фармацевтичну композицію для інгібування мітогенних відповідей в пухлинних клітках на одну або більше рецепторні кінази, ростові фактори і цитокіни групи, що складається з ІЛ-4 і ІЛ-9, для кожного з яких IRS-1 є субстратом, і, тим самим, для лікування пухлин. (6) фармацевтичну композицію для інгібування базальної IGF-1-індукованої та інсулін-індукованої проліферації пухлинних кліток і, тим самим, для лікування злоякісних захворювань молочної залози людини. (7) фармацевтичну композицію, в якій вказаним активним інгредієнтом є лептин. Даний винахід також пропонує спосіб для лікування пухлин у ссавців або для інгібування проліферації пухлинних кліток у ссавців, що включає введення пацієнту фармацевтичної композиції згідно з даним винаходом, як це відмічене вище, у відповідальній лікарській формі і за допомогою відповідного шляху введення. Такі лікарські форми і шляхи введення звичайно визначаються лікарями після обстеження пацієнта. Інші аспекти і переважні приклади даного винаходу представлені нижчими або будуть очевидні з нижченаведеного детального опису даного винаходу. Фіг.1 ілюструє залежність T-47D клітинної проліферації від інсуліну, що визначалося МТТ-забарвленням. Фіг.2 ілюструє залежність T-47D клітинної проліферації від IGF-I, що визначалося МТТ-забарвленням. Фіг.3 ілюструє інгібування інсулін-індукованої T-47D клітинної проліферації в 10% фетальній сироватці корови мишачим лептином, що визначалося МТТ-забарвленням. Фіг.4 ілюструє інгібування інсулін-індукованої T-47D клітинної проліферації в 2% фетальній сироватці корови (FBS) мишачим лептином, що визначалося по забарвленню кристалвіолетом. Фіг.5 ілюструє інгібування IGF-1-індукованої T-47D клітинної проліферації в 10% фетальній сироватці корови (FBS) мишачим лептином, що визначалося МТТ-забарвленням. Фіг.6 ілюструє інгібування IGF-1-індукованої T-47D клітинної проліферації в 2% фетальній сироватці корови (FBS) мишачим лептином, що визначалося по забарвленню кристалвіолетом. Фіг.7 ілюструє інгібування IGF-1-індукованої T-47D клітинної проліферації в 2% фетальній сироватці корови (FBS) лептином людини, що визначалося по забарвленню кристалвіолетом. Фіг.8 ілюструє інгібування інсулін-індукованої MCF/ клітинної проліферацзї в середовищі, вільному від сироватки, мишачим лептином, що визначалося по забарвленню кристалвіолетом. Фіг.9 ілюструє інгібування IGF-1-індукованої MCF7 клітинної проліферації в середовищі, вільному від сироватки, мишачим лептином, що визначалося по забарвленню кристалвіолетом. Даний винахід стосується використання лептину в якості інгібітора проліферації пухлинних кліток. Звичайно клітинні лінії людського походження, отримані з різних пухлин, можуть бути вирощені на культурі в присутності ростового середовища, доповненого фетальною сироваткою теляти в концентрації приблизно 10% по об'єму. Клітинна проліферація в цих умовах тут і далі визначається як "базальна клітинна проліферація". Ріст клітинних ліній багатьох пухлинних кліток значно збільшується при додаванні різних факторів росту, таких як інсулін, епідермальний фактор росту або інсуліноподібнии фактор-І росту (IGF-I) до вищезгаданого культивуємого середовища, доповненого сироваткою. Включення лептину в ростове середовище з концентраціями в області від 3 до 600нМ знижує як базальну клітинну проліферацію, так і клітинну проліферацію, що залежить від фактора росту. Результати експериментів на клітинній культурі, приведені нижче на прикладах, показують, що лептин може бути корисним для інгібування росту різних пухлин. Отже, лептин може бути корисний для лікування різних злоякісних утворень. У переважному прикладі здійснення даного винаходу лептин використовують для інгібування клітинної проліферації раку молочної залози. Коли лептин додають до культур T-4 7D кліток карциноми протоків молочної залози (American Type Culture Collection, Rockville, MD; штамм № АТСС НТВ 133), поширення їх проліферації знижується. Подібним же образом, при доданні лептину до культур MCF7 кліток аденокарциноми молочної залози людини (American Type Culture Collection, Rockville, MD; штамм № АТСС НТВ 22), поширення їх проліферації зменшується. Лептин інгібує як базальну, IGF-I-індуковану, так і інсулін-індуковану проліферацію T-47D і MCF7 кліток. Тому лептин може бути особливо корисний для лікування карциноми молочної залози. Ростова стимулююча дія інсуліну і IFI-I на клітки опосредована, принаймні, частково тирозинфосфорилуванням IRS-I і подальшою асоціацією IRS-1 з GRB2, що приводить до мітогенної відповіді. Антимітогенна дія лептину викликана його здатністю зменшувати базальне, інсулін-індуковане і IGF-I-індуковане тирозин-фосфорилування IRS-1, що приводить до скріплення GRB2 з IGF-I. Крім того, IRS-1 є субстратом рецепторних кіназ інших факторів росту і цитокінів, включаючи ІЛ-4 і ІЛ-9 (Pernis та інш., 1995; Yin та інш., 1994). Тому лептин може інгібувати мітогенні відповіді деяких або всіх вищезазначених факторів росту і цитокінів, так само як і інших мітогенів, тим самим інгібуючи проліферацію різних типів пухлинних кліток. Далі даний винахід відноситься до похідних лептину і його аналогів, включаючи лептинзлиті білки, лептинові мутеїни, агоністи лептинового рецептора, або їх активні фрагменти або фракції, або солі їх всіх і фармацевтичні композиції, що містять лептин, лептинзлиті білки, лептинові мутеїни, агоністи лептинового рецептора, їх активні фракції або солі їх всіх для лікування різних типів онкологічних захворювань. При використанні в тексті даного винаходу, термін "мутеїн" відноситься до аналогів лептину, в якому один або більше з амінокислотних залишків заміщений іншими амінокислотними залишками, або виключений один або більше амінокислотний залишок, або один або більше амінокислотний залишок доданий до першопочаткової лептинової послідовності без значної зміни активності отриманих в результаті продуктів в порівнянні з базовим типом лептину або його активними фрагментами або фракціями. Ці мутеїни отримують відомим синтезом і/або за допомогою сайт-направленої техніки мутагенезу або за допомогою якого-небудь іншого відповідного для цього способу, відомого в даній області техніки. Будь-який такий мутеїн переважно має послідовність амінокислот, задовільно дублікатну послідовності такого лептину, який володіє по суті однаковою активністю з лептином або його активними фрагментами або фракціями. Таким чином, можна визначити, чи володіє будь-який даний мутеїн в значній мірі тією ж самою активністю як і лептин, звичайними експериментальними методиками, об'єктами якого є такий мутеїн, наприклад, при аналізі простої клітинної проліферації, якою володіє мутеїн, який блокує клітинну проліферацію, зберігаючи значну активність лептину і тому має, принаймні, одне з розкритих застосувань лептину, і, таким чином, володіє в значній мірі однаковою з ним активністю. У переважних варіантах даного винаходу, будь-який такий мутеїн володіє, принаймні, 40%-вою ідентичністю або гомологічністю в послідовності одного з лептинів. Більш переважно, щоб він володів, принаймні, 50%-вою, принаймні, 60%-вою, принаймні, 70%-вою, принаймні, 80%-вою або, більш переважно, принаймні, 90%-вою ідентичністю або гомологічністю. Мутеїни лептину або його активних фрагментів або фракцій, які можуть використовуватися відповідно до даного винаходу, або кодуючі нуклеїнові кислоти, включають кінцевий набір в значній мірі відповідних послідовностей у вигляді пептидів заміщення або полінуклеотидів, які можливо, як правило, отримані одним із загальноприйнятих в даній області способів без використання додаткових способів експеримента, заснованих на способах і керівництві, представлених в даному винаході. Для детального опису хімії і структури протеїнів див. Монографії Schuiz, G.E. та інш., Principles of Protein Structure, Springer-Verlag, New York, 1978; і Creigton Т.Е., Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, 1983, які включені в даний винахід як посилання. Для представлення нуклеотичних послідовних заміщень, таких як кодонові послідовності, див. монографії Ausubel та інш., supra, в §§ А. 1.1- А. 1.24, і Sambrook та інш., Current Protocols in Molecular Biology, Interscience N.Y. §§ 6.3 і 6.4 (1987, 1992) в розділі Appendices 3 і D. Переважними змінами для мутеїнів відповідно до даного винаходу є зміни, відомі як "консервативні" заміщення. Консервативні амінокислотні заміщення лептинових поліпептидів або білків або його активних фрагментів або фракцій можуть включати в межах групи синонімічні амінокислоти, які володіють досить схожими фізико-хімічними властивостями, і таке заміщення між членами цієї групи буде зберігати біологічну функцію молекули, Grantham, Science, Vol.185, pp.862-864 (1974). Ясно, що, інсерції і делеції амінокислот можуть бути також зроблені у визначеній вище послідовності без зміни їх функцій, особливо, якщо інсерції або делеції включають тільки декілька амінокислот, наприклад, до тридцяти, і особливо, до десяти і не видаляють або замінюють амінокислоти, які є суттєвими відносно функціональної конформації, наприклад, цистеинових залишків, Anfinsen, "Principles That Govern The Folding of Protein Chains", Science, Vol. 181, pp. 223-230 (1973). Білки і мутеїни, отримані такими делеціями і/або інсерціями, включені в об'єм границі даного винаходу. Переважно, щоб синонімічні амінокислотні групи були тими групами, які вказані в Таблиці І. Більш переважними синонімічними амінокислотними групами є групи, вказані в Таблиці II./ і більш переважно, щоб синонімічні амінокислотні групи були тими, які вказані в Таблиці III. Таблиця І Переважні групи синонімічних амінокислот Амінокислота Ser Arg Leu Pro Thr Ala Val Gly Ile Phe Tyr Cys His Gln Asn Lys Asp Glu Met Trp Синонімічна група Ser, Thr, Gly, Asn Arg, Gin, Lys, Glu, His He, Phe, Tyr, Met, Val, Leu Gly, Ala, Thr, Pro Pro, Ser, Ala, Gly, His, Gin, Thr Gly, Thr, Pro, Ala Met, Tyr, Phe, Ile, Leu, Val Ala, Thr, Pro, Ser, Gly Met, Tyr, Ph.e, Val, Leu, Ile Trp, Met, Tyr, Ile. Val, Leu, Phe Trp, Met, Phe. Ile, Vai, Leu, Tyr Ser. Thr, Cys Glu, Lys, Gin, Thr, Arg, His Glu, Lys, Asn, His, Thr, Arg, Gln Gin, Asp, Ser, Asn Glu, Gin, His, Arg, Lys Glu, Asn, Asp Asp, Lys, Asn, Gin, His, Arg, Glu Phe, He, Val, Leu, Met Trp Таблиця II Більш переважні групи синонімічних амінокислот Амінокислота Ser Arg Leu Pro Thr Ala Val Gly He Phe Tyr Cys His Gln Asn Lys Asp Glu Met Trp Синонімічна група Ser His, Lys, Arg Leu, Ile, Phe, Met Ala, Pro Thr Pro, Ala Val, Met, Ile Gly He, Met, Phe, Val, Leu Met, Tyr, Ile, Leu, Phe Phe, Tyr Cys, Ser His, Gin, Arg Glu. Gln. His Asp, Asn Lys, Arg Asp, Asn Glu, Gin Met, Phe, Ile, Val, Leu Trp Таблиця III Найбільш переважні групи синонімічних амінокислот Амінокислота Ser Arg Leu Pro Thr Ala Val Gly Ile Phe Tyr Cys His Gin Asn Lys Asp Glu Met Trp Синонімічна група Ser Arg Leu, Ile, Met Pro Thr Ala Val Gly Ile, Met, Leu Phe Tyr Cys, Ser His Gin Asn Lys Asp Glu Met, Ile, Leu Met Приклади здійснення амінокислотних заміщень в білках, які можуть бути використані для отримання мутеїнів лептину або його активних фракцій для застосування в даному винаході, включають будь-які відомі стадії способів, такі як представлені в патентах США RE 33653, 4959314, 4588585 і 4737462, Mark та інш.; 5116943, Koths та інш., 4965195, Namen та інш./ 4879111, Chong та інш.; і 5017691, Lee та інш.; і лізинзаміщені білки, представлені в патенті США № 4904584 (Shaw та інш.). У іншому переважному прикладі здійснення даного винаходу будь-який мутеїн лептину або його активні фракції для використання в даному винаході володіють амінокислотною послідовністю, по суті відповідною аналогічній послідовності в лептині. Термін "по суті відповідний" призначений для включення в опис білків з незначними змінами в амінокислотній послідовності природного білка, які не впливають на основні властивості природних білків, особливо не впливають на їх здатність, що стосується інгібування клітинної проліферації. Тип змін, які звичайно маються на увазі і включаються у вираження "відповідні по суті", є тими типами змін, які можуть бути досягнуті з використанням звичайних методів мутагенезу ДНК, що кодує лептин, що приводить до деяких невеликих змін і до збереження потрібної активності способом, який обговорювався вище. Відповідно до даного винаходу мутеїни включають білки, кодовані нуклеїновою кислотою, такою як ДНК або РНК, яка гібридизується з ДНК або РНК, яка кодує лептин відповідно до даного винаходу при обов'язкових умовах. Така нуклеїнова кислота повинна бути основним кандидатом для того, щоб визначити, чи кодує вона поліпептид, у якого зберігається функціональна активність лептину, описаного в даному винаході. Термін "обов'язкові умови" відноситься до умов гібридизації і подальших умов промивки. які, як це прийняте в даній області техніки, позначаються як "обов'язкові". Див. Ausubel та інш. Current Protocols in Molecular Biology, supra, Interscience, NY, §§6.3 і 6.4 (1987, 1992), і Sambrook та інш., supra. Без обмеження, приклади обов'язкових умов включають умови промивки на 12-20°С нижче розрахованої Тm гібриду при дослідженні, наприклад, в розчині 2 х SSC (розчині цитрату і хлориду натрію) і 0,5%-вому розчині SDS (розчині додецилсульфату натрію) протягом 5 хвилин, в розчині 2 х SSC і 0,1%-вому розчині SDS протягом 15 хвилин; в розчині 0,1 х SSC і 0,5%-вому розчині SDS при 37°С протягом 30-60 хв. і потім в розчині 0,1 x SSC і 0,5%вому розчині SDS при 68°С протягом 30-60 хвилин. Для фахівців в даній області техніки ясно, що обов'язкові умови також залежать від довжини ДНК послідовностей, олігонуклеотидних зондів (таких зондів, які включають 10-40 основ) або змішаних олігонуклеотидних зондів. При використанні змішаних зондів переважно застосовувати тетраметиламоній хлорид (ТМАС) замість SSC. Див. Ausubel, supra. Термін "лептинзлиті білки" або просто "злиті білки" означає поліпептид, що включає лептин або його активні фракції або його мутеїн, злитий з іншим білком, який володіє, наприклад, тривалим часом перебування в рідинах організму. Лептин або його активні фракції можуть бути таким чином злиті з іншим білком, поліпептидом або їм подібними утвореннями. У даному контексті термін "солі" відноситься як до солей карбоксильних груп, так і до солей приєднання кислот аміногруп лептину, його активних фракцій, мутеїнів або їх лептинзлитих білків. Солі карбоксильної групи можуть бути отримані з використанням відомих в даній області техніки прийомів, і включають неорганічні солі, наприклад, солі натрію, кальцію, амонію, заліза або цинку і їм подібні солі, а також солі з органічними основами, як наприклад солі, утворені амінами, такими як триетаноламін, аргінін або лізин, піперидин, прокаїн та їм подібні. Солі приєднання кислот включають, наприклад, солі, утворені мінеральними кислотами, такими як наприклад, хлористоводнева (соляна) кислота або сірчана кислота, і солі, утворені органічними кислотами, такими, як наприклад, оцтова кислота або щавлева кислота. Безумовно, будь-які такі солі повинні володіти по суті однаковою активністю по відношенню до лептину або його активних фракцій. Термін "функціональні похідні", як він використовується в даному контексті, охоплює похідні лептину або його активні фрагменти або фракції, і його мутеїни і лептинзлиті білки, які можуть бути отримані з функціональних груп, присутніх як бокові ланцюги на амінокислотних залишках або в N-або С-термінальних групах, способами, відомими в даній області техніки, і ці похідні включаються в даний винахід доти, поки вони залишаються фармацевтично придатними, тобто доти, поки вони не порушують активність білка, яка є по суті рівною активності лептину, і не надають токсичних властивостей композиціям, що містять їх. Ці похідні можуть, наприклад, включати поліетиленглікольні бічні ланцюги, які можуть маскувати антигенні сайти і збільшувати перебування лептину або його активних фракцій в рідинах організму. Інші похідні включають аліфатичні складні ефіри карбоксильних груп, аміди карбоксильних груп, отриманих реакцією з аміаком або з первинними або вторинними амінами, N-ацилпохідні вільних аміногруп амінокислотних залишків, утворені ацильними фрагментами (наприклад, алканоїльними або карбо-циклічними ароїльними групами) або О-ацильні похідні вільних гидроксильних груп (наприклад таких, як серил- або треоніл амінокислотні залишки), утворені ацильними фрагментами. При використанні терміну "активні фрагменти або фракції" лептину, лептинових мутеїнів і лептинзлитих білків даний винахід охоплює будь-який фрагмент або будь-які попередники поліпептидного ланцюга лептину, або злитих білків, що містить будь-який такий фрагмент лептину, сам по собі або разом з асоційованими молекулами або пов’язаними з ними залишками, наприклад, залишками цукру або фосфатними залишками, або агрегатами будь-якого з вказаних похідних, при умові що вказана фракція по суті має ту ж активність, що і активність лептину. Далі даний винахід відноситься до застосування природних і синтетичних агоністів лептинового рецептора, які по суті подібні лептину в їх здатності інгібувати клітинну проліферацію. Такі агоністи можуть бути вибрані з бібліотеки пептидів, з бібліотеки аналогів пептидів або з випадкової (рандомізованої) бібліотеки органічних молекул. Вибір здійснюється способами, відомими в даній області техніки, фактично по здатності вибраних агоністів зв'язуватися лептиновим рецептором. Наприклад, бібліотека випадкових пептидів може бути отримана як прохроматична (prokaryotic) експресія плазмід, що здійснюють ДНК кодування для випадкового пептиду, злитого з білком-носієм. Іншим прикладом є система фагового фенотипу, в якій фенотип експресії є фагом, що включає ДНК-кодування випадкового пептиду, і яка включена в один із зовнішніх фагових білків. Фаги, що кодують агоністи або антагоністи злитих пептидів, виділяють з фагових бібліотек, наприклад, пенінгом на підкладках, покритих лептиновим рецептором. Зчленовані (bound) фаги виділяють і потім ампліфікують в бактеріях. Потрібно, як правило, декілька повторів процедури (проходжень) - пенінгамлліфікація, для того, щоб отримати фаги, експресуючі злиті пептиди (expressing fused peptides), що володіють високою спорідненістю до лептинового рецептора. Потім виділений фаг піддають ампліфікації і визначають послідовність ДНК, що кодує пептид. Альтернативно, бібліотеки випадкових пептидів або бібліотеки інших молекул отримують твердофазним синтезом на полімерних матрицях з використанням способів, відомих в даній області техніки. Матриці, що несуть пептид або іншу молекулу, яка володіє спорідненістю до лептинового рецептора, вибирають з бібліотеки, наприклад, шляхом скріплення (фіксації) міченого лептинового рецептора, наприклад, флуоресцентно міченого лептинового рецептора. Потім відбирають позитивні матриці і визначають структуру пептиду або іншої молекули, присутньої на матриці. Якщо матриця несе пептид, послідовність в пептиді визначають аналізом послідовності . (амінокислотної) білка. Якщо матриця є звичайною органічною молекулою з бібліотеки (випадкової), то молекулу відділяють від матриці і визначають її структуру способами, відомими в даній області техніки, такими як мас-спектрометрія, ядерний магнітний резонанс і ним подібні. ' Потім вибрані пептиди, ідентифіковані по спорідненості до лептинового рецептора, далі відбирають вищеописаним способом по їх здатності інгібувати клітинну проліферацію. Відповідно до цього, лептин, його активні фракції, лептинові мутеїни, лептинові злиті білки, агоністи лептинового рецептора і їх солі, їх функціональні похідні і їх активні фрагменти або фракції пропонуть для лікування різних злоякісних утворень, переважно для лікування пухлин, залежних від ростового фактора, і більш переважно, для лікування карцином молочної залози. Крім того, даний винахід відноситься до застосування фармацевтичних композицій, що включають фармацевтично прийнятний носій і лептин даного винаходу, або його активні мутеїни, злиті протеїни, агоністи лептинового рецептора і їх солі, їх функціональні похідні або їх активні фракції. Фармацевтичні композиції даного винаходу отримують для введення в якості лікарського засобу змішенням лептину або його похідних, або агоністів лептинового рецептора з фізіологічно прийнятними носіями і/або стабілізаторами, і/або наповнювачами, і їх отримують в лікарських формах, наприклад, ліофілізацією в дозовочних флаконах. Метод введення може бути вибраний з будь-яких прийнятних способів введення для подібних агентів, що буде залежати від порушень, які потрібно лікувати, наприклад, внутрішньовенно, внутрішньом'язово, підшкірно, за допомогою локальної ін'єкції або місцевого нанесення або за допомогою безперервного вливання, і т.д. Кількість введеного активного з'єднання буде залежати від способу введення, хвороби, яку лікують, і стану пацієнта. Локальне введення, наприклад, вимагає більш низької кількості білка по відношенню до маси тіла, ніж внутрішньовенне введення. Типові активні кількості лептину для ін'єкції становлять 0,1-1000 мікрограм/кг маси тіла і переважно складають від 1 до 10 мікрограм/кг. Активні кількості похідних лептину і агоністів лептинового рецептора можуть бути по суті тими ж, які застосовуються у випадку лептину в розрахунку на молі. Лептин може вводитися хворим на рак, наприклад, шляхом ін'єкцій, або окремо, або в поєднанні з іншими терапевтичними агентами або в поєднанні з іншими терапевтичними підходами. Далі даний винахід проілюстрований наступними необмежуючими його прикладами: Приклад 1. Визначення клітинної проліферації МТТ-забарвленням. Реагенти: МТТ-розчин: бромід (3-[4,5-диметилтіазол-2-іл]-2,5-дифенілтетразолію, 5мг/мл в розчині хлориду натрію з фосфатним буфером. До використання зберігається при -20°С. Розчинник: Конц. НСl (450 мікролітрів) в 2-пропанолі (100мл). Методика: Вирощують клітки на 96 ямкових планшетах в присутності різних стимуляторів ріст і інгібіторів росту. У певний час в кожну ямку додають МТТ-розчин (10 мікролітрів). Інкубують 2,5-3 години при 37°С. Супернатант відстоюють у вакуумі, використовуючи голку з точним калібруванням. Додають розчинник (100 мікролітрів) і знімають показники, що характеризують поглинання, за допомогою мікропланшетного зчитуючого пристрою, використовуючи 570нМ фільтр, з вирахуванням фону при 630нм. Приклад 2: Визначення клітинної проліферації забарвленням кристалвіолетом Методика: Вирощують клітки на 96 ямкових планшетах в присутності різних стимуляторів ріст і інгібіторів росту. У певний час в кожну ямку додають 12,5%-вий розчин глутарового альдегіду (40 мікролітрів). Інкубують 30 хвилин при кімнатній температурі. Потім промивають мікропланшет водою, сушать і додають в кожну ямку водний розчин кристалвіолету (0,1%, 0,1мл). Потім мікропланшет інкубують протягом 30хв., промивають водою і знімають показники при 540нм з вирахуванням фону при 630нм. Приклад 3: Визначення інсулін-залежної T-47D клітинної проліферації T-47D клітки людини (American Type Culture Collection, Rockville, MD; штамм № АТСС НТВ 133), були висіяні в 96 ямкові планшети, 3х105 кліток на мл в DMEM (в модифікованому за способом Дульбекко середовищі Голка) і в 10%-ву фетальну сироватку корови (FBS), 0,1мл на ямку. У різні ямки додавали людський інсулін в концентраціях, що збільшуються, планшети інкубували протягом 72 годин і потім визначали число кліток МТТ-забарвленням (Фіг.1). Приведені середні результати з 8 реплікацій. Для подальших досліджень, засновуючись на ступені клітинної проліферації, приведеній на Фіг.1, була використана концентрація інсуліну, рівна 50нМ. Приклад 4: Визначення IGF-1-залежної T-47D клітинної проліферації T-47D клітки людини були висіяні в 96 ямкові планшети, 3х105 кліток на мл в DMEM і в 10%-ву фетальну сироватку корови (FBS), 0,1мл на ямку. У різні ямки додавали людський IGF-I в концентраціях, що збільшуються, планшети інкубували протягом 3-х днів, і потім визначали число кліток МТТ-забарвленням (Фіг.2). Приведені середні результати з 8 реплікацій. Для подальших досліджень, засновуючись на ступені клітинної проліферації, приведеній на Фіг.2, була використана концентрація IGF-I, рівна 50нг/мл. Приклад 5: Інгібування лептином інсулін-індукованої T-47D клітинної проліферації T-47D клітки (3х105 кліток на мл) в DMEM з 10%-вої FBS були висіяні в 96 ямкові планшети (0,1мл на ямку). Клітки оброблялися інсуліном (50нМ) в присутності або у відсутності певних концентрацій мишачого лептину. Планшети інкубувались при 37 °С в 5%-вому СО2 протягом 48 годин. Потім клітки забарвлювалися МТТ. Отримані дані приведені з урахуванням (±) стандартної помилки досліду (SE, n=8). Результати показують, що лептин значно інгібує інсулін-індуковану клітинну проліферацію (Фіг.3). T-47D клітки (3х105 кліток на мл) в DMEM доповненій 10%-вою FBS висіювалися в 96 ямкові планшети (0,1мл на ямку). Через день середовище замінювалося DMEM, доповненою 2%-вою FBS, і через день була проведена обробка інсуліном (50нМ) в присутності і у відсутності певних концентрацій мишачого лептину в DMEM-2%FBS. Планшети інкубувалися при 37°С в 5% СО2 протягом 48 годин. Потім клітки забарвлювалися кристалвіолетом. Дані приведені з урахуванням стандартної помилки досліду, ±SE, (n=8). Результати показують, що лептин значно інгібує інсулін-індуковану клітинну проліферацію (Фіг.4). Приклад 6: Інгібування лептином IGF-1-індукованої T-47D клітинної проліферації T-47D клітки (3х105 кліток на мл) в DMEM, доповненій 10%-вою FBS, були висіяні в 96 ямкові планшети (0,1мл на ямку). Клітки оброблялися IGF-I (50нг/мл) в присутності або у відсутності певних концентрацій мишачого лептину. Планшети інкубувалися при 37°С в 5%-вому СО2 протягом 48 годин. Потім клітки забарвлювалися МТТ. Отримані дані приведені з урахуванням (±) стандатрной помилки досліду (SE, n=8). Результати показують, що лептин значно інгібує IGF-1-індуковану клітинну проліферацію (Фіг.5). T-47D клітки (3x105 кліток на мл) в DMEM, доповненій 10%-вою FBS, висіювалися в 96 ямкові планшети (ОД мл на ямку). Через день середовище замінювалося DMEM, доповненою 2%-вою FBS, і через день була проведена обробка IGF-I (50нг/мл) в присутності і у відсутності певних концентрацій мишачого лептину в DMEM-2%FBS. Планшети інкубувалися при 37°С в 5% СО2 протягом 48 годин. Потім клітки забарвлювалися кристалвіолетом. Дані приведені з урахуванням стандартної помилки досліду, (±SE, n=8). Результати показують, що лептин значно інгібує IGF-1-індуковану клітинну проліферацію (Фіг.6). T-47D клітки (3x105 кліток на мл) в DMEM, доповненій 10%-вою FBS, висіювалися в 96 ямкові планшети (0,1мл на ямку). Через день середовище замінювалося DMEM з 2%-вою FBS і через день була проведена обробка IGF-I (50нг/мл) в присутності і у відсутності певних концентрацій людського лептину в DMEM-2%FBS. Планшети інкубувались при 37°С в 5% СО2 протягом 48 годин. Потім клітки забарвлювалися кристалвіолетом. Дані приведені з урахуванням стандартної помилки досліду, (±SE, n=8). Результати показують, що лептин значно інгібує IGF-1-індуковану клітинну проліферацію (Фіг.7). Приклад 8: Інгібування лептином MCF7 клітинної проліферації MCF7 клітки аденокарциноми молочної залози людини (3x105 кліток на мл, American Type Culture Collection, Rockville, MD; штамм № ATCC HTD 22), доповненої 6%-вою FBS, були висіяні в 96 ямкові планшети (0,1мл на ямку). Через день середовище було замінене вільним від DMEM і ще через день клітки були оброблені інсуліном (50нМ) в присутності або у відсутності певних концентрацій мишачого лептину у вільному від сироватки середовищі. Планшети інкубувалися при 37°С в 5%-вому СО2 протягом 48 годин. Потім клітки забарвлювалися кристалвіолетом. Отримані дані приведені з обліком ± SE (n=8). Результати показують, що лептин значно інгібує інсулін-індуковану клітинну проліферацію (Фіг.8). Приклад 9: Інгібування лептином lGF-I-індукованої MCF7 клітинної проліферації MCF7 клітки аденокарциноми молочної залози людини в DMEM з 10%-вою FBS були висіяні в 96 ямкові планшети (3x104 кліток на мл, 0,1мл на ямку). Через день середовище було замінене вільним від сироватки середовищем. Ще через день клітки були оброблені IGF-I (50нг/мл) в присутності або у відсутності певних концентрацій мишачого лептину у вільному від сироватки середовищі. Планшети інкубувалися при 37°С в 5% вому СО2 протягом 96 годин. Потім клітки забарвлювалися кристалвіолетом. Отримані дані приведені з обліком ± SE (n=8). Результати показують, що лептин значно інгібує інсулін-індуковану клітинну проліферацію (Фіг.9). Література: 1. Агакі, Е., Lipes, Μ. Α., Patti, Μ. Ε., Bruning, J. С, Haag, В. г., Johnson, R. S., and Kahn. C, R. (1994). Alternative pathway of insulin signalling in mice with targeted disruption of the IRS-1 gene [see comments]. Nature 372, pl86-90. 2. Ausubel, F.M. et al., eds., Current Protocols In Molecular Biology. 3. Campfield, L. Α., Smith, F. J., Guisez, Y., Devos, R., and Burn, P. (1995) . Recombinant mouse OB protein: Evidence for a peripheral signal linking adiposity and central neural networks. Science 269, 546-549. 4. Cheatham, В., and Kahn, Insulin action and the insulin signaling network. Endocr Rev 16, p117-42. 5. Cioffi. J. Α., Shafer, A. W., Zupancic, T. J., Smith-Gbur. J., Mikhail, Α., Platika, D., and Snodgrass, Novel B219/OB receptor isoforms: Possible role of leptin in hematopoiesis and reproduction. Nature Medicine 2, 585-589. 6. Cohen, В., Novick, D., and Rubinstein, M. (1996). Modulation of insulin activities by leptin. Science 274, 11851188. 7. Collins, S., Kuhn, С Μ., Petro, A. E., Swick, A. G., Chrunyk, Β. Α., and Surwit, R.S.(1996). role of leptin in fat regulation. Nature 380, 677. 8. Considine, R. V., Sinha, M. K., Heiman, M. L., Kriauciunas, Α., Stephens, T. W., Nyce, M. R., Ohannesian, J. P., Marco, C. C, Mckee, L. J., Bauer, T. L., and Caro, Serum immunoresctive leptin concentrations in normal-weight and obese humans. N Engl J Med 334, 292-295. 9. Felber, J. P., and Golay, A. (1995). Regulation of nutrient metabolism and energy expenditure. Metabolism 44, Suppl 2) p4-9. 10. Frederich, R. c, Hamann, Α., Anderson, S., Lollmann, В., Lowell, B.B., and Flier. J.S (1995). Leptin levels reflect body lipid content in mice: Evidence for diet-induced resistance to leptin action. Nature Med 1, 1311-1314. 11. Halaas, J. L., Gajiwala, K. S., Maffei, M., Cohen, S. L., Chait, В. Т., Rabinowitz, D., Lallone, R. L., В urley, S. K., and Friedman, Weight-reducing effects of the plasma protein encoded by the obese gene [see comments]. Science 269, p543-6. 12. Lee, G. H., Proenca, R., Montez, J. Μ., Carroll, К. М., Darvishzadeh, J. G., Lee, J. I., and Friedman, J. M. (1996) . Abnormal splicing of the leptin receptor in diabetic mice. Nature 379, 632-635. 13. Lonnqvist, F., Arner, P., Nordfors, L., and Schalling, M. (1995) . Overexpression of the obese (ob) gene in adipose tissue of human obese subjects. Nature Med 1, 950-953. 14. Maffei, M, Halaas, J., Ravussin, E., Pratley, R. E., Lee, G. H., Zhang, Y., Fei. H.. Kirn, S., Lallone, R., Ranganathan, S., Kern, P. Α., and Friedman, J. M. (1995). Leptin levels in human and rodent: Measurement of plasma leptin and ob RNA in obese and weight-reduced subjects. Nature Med 1, 1155-1161. 15. Milazzo, G., Sciatta, L., Papa, V, Goldfine, I. D., and Vigneri, R. (1997). ASPB-10 insulin induction of increased mitogenic responses and phenotypic changes in human breast epithelial cells: evidence for enhanced interactions with the insulin-like growth factor-1 receptor. Molec. Carcinogenesis 18, 19-25. 16. Millazzo, G., Giorgino, F., Damante, G., Sung, C, Stampfer, M. R., Vigneri, R., Goldfine, I., and Belfiore, A. (1992). Insulin receptor expression in human breast cancer cell lines. Cancer Res. 52, 3924-3930. 17. Myers, M. G., Jr., Sun, X. J., Cheatham, В., Jachna, B. R., Glasheen, E. M., Backer. J. M., and White, M. F. (1993). IRS-1 is a common element in insulin and insulin-like growth factor-I signaling to the phosphatidylinositol 3'kinase. Endocrinology 132, p1421-30. 18. Myers, M. G., Jr., Sun, X. J., and White, M. F. (1994). The IRS-1 signaling system. Trends Biochem Sci 19, p289-93. 19. Myers, M. G., Jr., Wang, L. M, Sun, X. J., Zhang, Y., Yenush, L., Schlessinger, J., Pierce, J. H., and White, M. F. (1994). Role of IRS-l-GRB-2 complexes in insulin signaling. Мої Cell Biol 14, p3577-87. 20. Myers, MG., Jr., and White, M. F. (1993). The new elements of insulin signaling. Insulin receptor substrate-1 and proteins with SH2 domains. Diabetes 41, p643-50. 21. Pelleymounter, Μ. Α., Cullen, Baker. M. В., Hecht, R., Winters, D., Boone, Т., and Collins, F. (1995). Effects of the obese gene product on body weight regulation in ob/ob mice [see comments]. Science 269, p540-3. 22. Pernis, Α., Witthuhn, В., Keegan, A. D., Nelms. K., Garfein. E.. Ihle, J. N., Paul, W. E., Pierce, J. H., and Rothman, P. (1995). Interleukin 4 signals through two related pathways. Proc Nati Acad Sci USA 92, 7971-7975. 23. Rose, D. W., Saltiel, A. R., Majumdar, M., Decker, S. J., and Olefsky, J. M.(1994). Insulin receptor substrate 1 is required for insulin-mediated mitogenic signal transduction. Proc Nati Acad Sci USA91, p797-801. 24. Sarnbrook et al., (1989) Molecular cloning: A laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. 25. Tamemoto, H., Kadowaki, Т., Tobe, K, Yagi, Т., Sakura, H., Hayakawa, Т., Terauchi, Y., Ueki, К., К aburagi, Y., Satoh, S., and et al. (1994). Insulin resistance and growth retardation in mice lacking insulin receptor s ubstrate-1 [see comments]. Nature 372, p182-6. 26. Tartaglia, L. Α., Dembski, M., Weng, X., Deng, N. H., Culpepper, J., Devos, R., Richards, G. J., Campfield, L. Α., Clark, F. Т., Deeds, J., Muir, C, Sanker, S., Moriarty, Α.. Moore, K. J. , Smutko, J. S., Mays, G. G., Woolf, Ε. Α., Monroe, C. Α.. and Tepper, R.I. (1995). Identification and expression cloning of a leptin receptor, OB-R. Cell 83, 1263-1271. 27. Weigle, D. S., Bukowski, T. R., Foster, D. C, Holderman, S., Kramer, J. M., Lasser, G., Loftonday, С. Е., Prunkard, D. E., Raymond, 3., and Kuijper, J. L.(1995). Recombinant ob protein reduces feeding and body weight in the ob/ob mouse. J Clin Invest 96, 2065-2070. 28. White, M. F., and Kahn, C. R. (1994). The insulin signaling system. J Biol Chem 269, p1-4. 29. Yin, T. G., Keller, S. R., Quelle, F. W., Witthuhn, B. Α., Tsang, M. L. S., Lienhard, G. E., Ihle, J. N., and Yang, Y. C.(1995). Interleukin-9 induces tyrosine phosphorylation of insulin receptor substrate-1 via JAK tyrosine kinases. J Biol Chem 270, 20497-20502. 30. Yin, T. G., Tsang, M. L. S., and Yang, Y. С (1994). JAK1 kinase forms complexes with interleukin-4 receptor and 4PS/insulin receptor substrate-1-like protein and is activated by interleukin-4 and interleukin-9 in Τ lymphocytes. J Biol Chem 269, 26614-26617. 31. Zhang, Y., Proenca, R., Maffei, M., Barone, M., Leopold, L., and Friedman, J. M.(1994). Positional cloning of the mouse obese gene and its human homologue. Nature 372, 425-432.
ДивитисяДодаткова інформація
Назва патенту англійськоюLeptin as inhibitor of tumor growth
Назва патенту російськоюЛептин как ингибитор роста опухолевых клеток
МПК / Мітки
МПК: A61K 38/33
Мітки: стримувач, лептин, пухлини, збільшення, швидкого, клітині
Код посилання
<a href="https://ua.patents.su/12-66793-leptin-yak-strimuvach-shvidkogo-zbilshennya-pukhlini-klitini.html" target="_blank" rel="follow" title="База патентів України">Лептин як стримувач швидкого збільшення пухлини клітини</a>
Попередній патент: Спосіб ліквідації відкладень в насосно-компресорних трубах свердловини під тиском
Наступний патент: Спосіб виготовлення вакцини проти стрептококових та/або стафілококових інфекцій у тварин
Випадковий патент: Застосування n,n'-(етан-1,2-діїл)біс(хінолін-2-карбоксаміду) як засобу з гіпоглікемічною дією