Циклогексилсульфони
Номер патенту: 76491
Опубліковано: 15.08.2006
Автори: Нейдін Алан Джон, Уілльямс Сузанна, Керрад Соня, Оуклі Пол Джозеф, Харрісон Тімоті, Черчер Ян, Шо Дункан Едвард, Діннелл Кевін, Уілльямс Брайан Джон, Тілл Мартін Річард
Формула / Реферат
1. Сполука формули І:
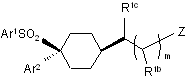 , І
, І
де:
m дорівнює 0 або 1;
Z являє собою CN, OR2а, CO2R2а або CON(R2а)2;
R1b являє собою Н, С1-4-алкіл або ОН;
R1c являє собою Н або С1-4-алкіл;
Аr1 являє собою феніл або піридил, кожний з яких має 0-3 замісники, незалежно вибрані з галогену, CN, NO2, СF3, ОН, ОСF3, С1-4-алкокси або С1-4-алкілу, який, необов'язково, має замісник, вибраний з галогену, CN, NO2, СF3, ОН і С1-4-алкокси;
Аr2 являє собою феніл, який заміщений галогеном у положеннях 2 і 5;
R2a являє собою Н, С1-6-алкіл, С3-6-циклоалкіл, С3-6-циклоалкіл-С1-6-алкіл, С2-6-алкеніл, будь-який з них, необов'язково, має замісник, вибраний з галогену, CN, NO2, СF3, OR2b, CO2R2b, N(R2b)2, CON(R2b)2, Аr і COAr, або R2a являє собою Аr, або дві групи R2a разом з атомом азоту, до якого вони взаємно приєднані, можуть замкнути N-гетероциклільну групу, що має 0-4 замісники, незалежно вибрані з =O, =S, галогену, С1-4-алкілу, CN, NO2, СF3, ОН, С1-4-алкокси, С1-4-алкоксикарбонілу, СO2Н, аміно, С1-4-алкіламіно, ді(С1-4-алкіл)аміно, карбамоїлу, Аr і COAr;
R2b являє собою Н, С1-6-алкіл, С3-6-циклоалкіл, С3-6-циклоалкіл-С1-6-алкіл, С2-6-алкеніл, будь-який з них, необов'язково, має замісник, вибраний з галогену, CN, NO2, СF3, ОН, С1-4-алкокси, С1-4-алкоксикарбонілу, СО2Н, аміно, С1-4-алкіламіно, ді(С1-4-алкіл)аміно, карбамоїлу, Аr або COAr, або R2b являє собою Аr, або дві групи R2b разом з атомом азоту, до якого вони взаємно приєднані, можуть замкнути N-гетероциклільну групу, що має 0-4 замісники, незалежно вибрані з =O, =S, галогену, С1-4-алкілу, CN, NO2, СF3, ОН, С1-4-алкокси, С1-4-алкоксикарбонілу, СО2Н, аміно, С1-4-алкіламіно, ді(С1-4-алкіл)аміно, карбамоїлу, Аr і COAr;
Аr являє собою феніл або гетероарил, що має 0-3 замісники, вибрані з галогену, С1-4-алкілу, CN, NO2, СF3, ОН, С1-4-алкокси, С1-4-алкоксикарбонілу, аміно, С1-4-алкіламіно, ді(С1-4-алкіл)аміно, карбамоїлу, С1-4-алкілкарбамоїлу і ді(С1-4-алкіл)карбамоїлу;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де Аr1 вибраний з фенільних груп, заміщених у положенні 4 галогеном, метилом або трифторметилом, і фенільних груп, заміщених галогеном у положеннях 3 і 4.
3. Сполука за п. 1 або п. 2, де Аr1 являє собою 4-фторфеніл або 4-трифторметилфеніл і Аr2 являє собою 2,5-дифторфеніл.
4. Сполука за будь-яким з пп. 1-3, де Z являє собою СО2R2a, i R2a являє собою Н або С1-4-алкіл.
5. Сполука за п. 1, де m дорівнює 1, Аr1 являє собою 4-хлорфеніл, Аr2 являє собою 2,5-дифторфеніл, R1b і R1c, обидва, являють собою Н і Z являє собою CO2H, або її фармацевтично прийнятна сіль.
6. Сполука за п. 1, де m дорівнює 1, Аr1 являє собою 4-трифторметилфеніл, Аr2 являє собою 2,5-дифторфеніл, R1b і R1c, обидва, являють собою Н, і Z являє собою СО2Н, або її фармацевтично прийнятна сіль.
7. Сполука за п. 1, де m дорівнює 0, Аr1 являє собою 4-хлорфеніл, Аr2 являє собою 2,5-дифторфеніл, R1c являє собою Н, і Z являє собою CONH2, або її фармацевтично прийнятна сіль.
8. Сполука за п. 1, де m дорівнює 0, Аr1 являє собою 4-трифторметилфеніл, Аr2 являє собою 2,5-дифторфеніл, R1c являє собою Н, і Z являє собою CONH2, або її фармацевтично прийнятна сіль.
9. Сполука за п. 1, де m дорівнює 0, Аr1 являє собою 4-хлорфеніл, Аr2 являє собою 2,5-дифторфеніл, R1c являє собою Н, і Z являє собою СОNНСН2СН3, або її фармацевтично прийнятна сіль.
10. Сполука за п. 1, де m дорівнює 0, Аr1 являє собою 4-хлорфеніл, Аr2 являє собою 2,5-дифторфеніл, R1c являє собою Н, і Z являє собою CN, або її фармацевтично прийнятна сіль.
11. Сполука за будь-яким з пп. 1-10 або її фармацевтично прийнятна сіль для використання у способі лікування організму людини.
12. Фармацевтична композиція, що містить сполуку, вказану в будь-якому з пп. 1-10, або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
13. Застосування сполуки, вказаної в будь-якому з пп. 1-10, або її фармацевтично прийнятної солі при виготовленні лікарського засобу для лікування або профілактики хвороби Альцгеймера.
14. Спосіб лікування суб'єкта, який страждає хворобою Альцгеймера або схильний до хвороби Альцгеймера, при якому вводять вказаному суб'єкту ефективну кількість сполуки формули І за п. 1 або її фармацевтично прийнятної солі.
Текст
1. Сполука формули І: R1c C2 2 (19) 1 3 76491 4 2. Сполука за п. 1, де Аr1 вибраний з фенільних 9. Сполука за п. 1, де m дорівнює 0, Аr1 являє согруп, заміщених у положенні 4 галогеном, метилом бою 4-хлорфеніл, Аr2 являє собою 2,5або трифторметилом, і фенільних груп, заміщених дифторфеніл, R1c являє собою Н, і Z являє собою галогеном у положеннях 3 і 4. СОNНСН2СН3, або її фармацевтично прийнятна 3. Сполука за п. 1 або п. 2, де Аr1 являє собою 4сіль. 2 1 фторфеніл або 4-трифторметилфеніл і Аr являє 10. Сполука за п. 1, де m дорівнює 0, Аr являє 2 собою 2,5-дифторфеніл. собою 4-хлорфеніл, Аr являє собою 2,54. Сполука за будь-яким з пп. 1-3, де Z являє содифторфеніл, R1c являє собою Н, і Z являє собою бою СО2R2a, i R2a являє собою Н або С1-4-алкіл. CN, або її фармацевтично прийнятна сіль. 5. Сполука за п. 1, де m дорівнює 1, Аr1 являє со11. Сполука за будь-яким з пп. 1-10 або її фармабою 4-хлорфеніл, Аr2 являє собою 2,5цевтично прийнятна сіль для використання у сподифторфеніл, R1b і R1c, обидва, являють собою Н і собі лікування організму людини. Z являє собою CO2H, або її фармацевтично при12. Фармацевтична композиція, що містить сполуйнятна сіль. ку, вказану в будь-якому з пп. 1-10, або її фарма6. Сполука за п. 1, де m дорівнює 1, Аr1 являє соцевтично прийнятну сіль і фармацевтично прийнябою 4-трифторметилфеніл, Аr2 являє собою 2,5тний носій. дифторфеніл, R1b і R1c, обидва, являють собою Н, і 13. Застосування сполуки, вказаної в будь-якому з Z являє собою СО2Н, або її фармацевтично припп. 1-10, або її фармацевтично прийнятної солі йнятна сіль. при виготовленні лікарського засобу для лікування 7. Сполука за п. 1, де m дорівнює 0, Аr1 являє соабо профілактики хвороби Альцгеймера. бою 4-хлорфеніл, Аr2 являє собою 2,514. Спосіб лікування суб'єкта, який страждає хводифторфеніл, R1c являє собою Н, і Z являє собою робою Альцгеймера або схильний до хвороби CONH2, або її фармацевтично прийнятна сіль. Альцгеймера, при якому вводять вказаному су8. Сполука за п. 1, де m дорівнює 0, Аr1 являє соб'єкту ефективну кількість сполуки формули І за п. бою 4-трифторметилфеніл, Аr2 являє собою 2,51 або її фармацевтично прийнятної солі. дифторфеніл, R1c являє собою Н, і Z являє собою CONH2, або її фармацевтично прийнятна сіль. Даний винахід відноситься до нового класу сполук, їх солей, фармацевтичних композицій, що містять їх, способів їх одержання і застосування у терапії організму людини. Зокрема, винахід відноситься до нових сульфонів, які модулюють процесинг АРР під дією -секретази і тому є корисними при лікуванні або профілактиці хвороби Альцгеймера. Хвороба Альцгеймера (AD) є найбільш переважною формою деменції. Хоча дана хвороба головним чином є захворюванням літніх людей, що уражає до 10% населення у віці понад 65 років, AD уражає також значне число більш молодих пацієнтів з генетичною схильністю. AD є нейродегенеративним захворюванням, що клінічно характеризується прогресивною втратою пам'яті і пізнавальної функції та патологічно характеризується відкладенням позаклітинних білкових бляшок у кортикальних і асоціативних ділянках мозку людей, які страждають таким захворюванням. Вказані бляшки в основному включають фібрилярні агрегати амілоїдного пептиду (Α ). Роль секретаз, у тому числі передбачуваної -секретази, у процесингу амілоїдного білка-попередника (АРР) з утворенням Α добре описана у літературі, огляд літератури про неї приводиться, наприклад, у WO 01/70677. У літературі є відносно мало повідомлень про сполуки з інгібуючою активністю відносно секретази, що вимірюється в аналізі на клітинній основі. Огляд приведений у WO 01/70677. Багато з відповідних сполук є пептидами або похідними пептидів. Даний винахід відноситься до нового класу непептидних сполук, які корисні при лікуванні або профілактиці AD модуляцією процесингу АРР під дією передбачуваної -секретази, таким чином пригнічуючи продукування Α . Даний винахід відноситься до сполуки формули І: де: m дорівнює 0 або 1; Ζ являє собою CN, OR2a, CO2R2a або CON(R2a)2; R1b являє собою Η, С1-4-алкіл або ОН; R1c являє собою Η або С1-4-алкіл; Аг1 являє собою феніл або піридил, кожний з яких має 0-3 замісники, незалежно вибрані з галогену, CN, NO2, CF3, OH, OCF3, С1-4-алкокси або С14-алкілу, який, необов'язково, має замісник, вибраний з галогену, CN, NO2, CF3, OH і С1-4-алкокси; Аr2 являє собою феніл, який заміщений галогеном у положеннях 2 і 5; R2a являє собою Н, С1-6-алкіл, С3-6-циклоалкіл, С3-6-циклоалкіл-С1-6-алкіл, С2-6-алкеніл, будь-який з яких, необов'язково, має замісник, вибраний з галогену, CN, NO2, CF3, OR2b, CO2R2b, N(R2b)2, CON(R2b)2, Аr і СОАr, або R2a являє собою Аr або дві групи R2a разом з атомом азоту, до якого вони взаємно приєднані, можуть замкнути Nгетероциклільну групу, що має 0-4 замісники, не 5 76491 6 залежно вибрані з =O, =S, галогену, С1-4-алкілу, один атом циклу, який відрізняється від вуглецю. CN, NO2, CF3, ОН, С1-4-алкокси, С1-4Переважними гетероарильними групами є моноалкоксикарбонілу, СО2Н, аміно, С1-4-алкіламіно, циклічні системи, що містять 5 або 6 членів, такі як ді(С1-4-алкіл)аміно, карбамоїлу, Аr і СОАr; піридинільна, піридазинільна, піримідинільна, піR2b являє собою Н, С1-6-алкіл, С3-6-циклоалкіл, разинільна, піролільна, фурильна, тієнільна, піраС3-6-циклоалкіл-С1-6-алкіл, С2-6-алкеніл, будь-який з золільна, оксазолільна, ізоксазолільна, тіазолільяких, необов'язково, має замісник, вибраний з гана, ізотіазолільна, імідазолільна, оксадіазолільна, логену, CN, NO2, CF3, ОН, С1-4-алкокси, С1-4триазолільна і тіадіазолільна групи. Наступні прикалкоксикарбонілу, СО2Н, аміно, С1-4-алкіламіно, лади гетероарильних груп включають тетразол, ді(С1-4-алкіл)аміно, карбамоїлу, Аr або СОАr, або 1,2,4-триазин і 1,3,5-триазин. R2b являє собою Аr або дві групи R2b разом з атоТермін «галоген», що використовується тут, мом азоту, до якого вони взаємно приєднані, мовключає фтор, хлор, бром і йод, переважними з жуть замкнути N-гетероциклільну групу, що має 0яких є фтор і хлор. 4 замісники, незалежно вибрані з =O, =S, галогену, Для застосування у медицині сполуки формуС1-4-алкілу, CN, NO2, CF3, ОН, С1-4-алкокси, С1-4ли І можуть бути переважно у формі фармацевтиалкоксикарбонілу, СО2Н, аміно, С1-4-алкіламіно, чно прийнятних солей, але інші солі можуть бути ді(С1-4-алкіл)аміно, карбамоїлу, Аr і СОАr; корисними при одержанні вказаних сполук або їх Аr являє собою феніл або гетероарил, що має фармацевтично прийнятних солей. Придатні фар0-3 замісники, вибрані з галогену, С1-4-алкілу, CN, мацевтично прийнятні солі сполук даного винахоNO2, CF3, ОН, С1-4-алкокси, С1-4-алкоксикарбонілу, ду включають кислотно-адитивні солі, такі як солі, аміно, С1-4-алкіламіно, ді(С1-4-алкіл)аміно, карбамоутворені хлористоводневою, сірчаною, метансуїлу, С1-4-алкілкарбамоїлу і ди(С1-4льфоновою, фумаровою, малеїновою, бурштиноалкіл)карбамоїлу; вою, оцтовою, бензойною, щавлевою, лимонною, або її фармацевтично прийнятної солі. винною, вугільною або фосфорною кислотою, і, Коли у формулі І або в її заміснику символ зуколи сполуки винаходу мають кислотну частину, стрічається більше ніж один раз, окремі такі симсолі натрію, калію, кальцію або магнію і солі, утвоволи є незалежними один від одного, якщо не рені з відповідними органічними лігандами, наприобумовлено особливо. клад, четвертинні амонієві солі або піридинієві Вираз «С1-x-алкіл»,що використовується тут, солі. де x дорівнює цілому числу, яке більше, ніж 1, відКоли сполуки за винаходом мають, щонайменоситься до алкільних груп з нерозгалуженим і нше, один асиметричний центр, вони можуть відрозгалуженим ланцюгом, де число атомів вуглецю, повідно існувати у вигляді енантіомерів. Коли споякі складають вказаний алкіл, знаходиться у діапалуки за винаходом володіють двома або більше зоні від 1 до х. Конкретні алкільні групи включають асиметричними центрами, вони можуть додатково метил, етил, н-пропіл, ізопропіл і трет-бутил. Наіснувати у вигляді діастереоізомерів. Має бути зви похідних, таких як «С2-6-алкеніл», «гідрокси-С1зрозумілим, що всі такі ізомери і суміші їх у будьякій пропорції включені в обсяг даного винаходу. 6-алкіл», «гетероарил-С1-6-алкіл», «С2-6-алкініл» і «С1-б-алкокси», потрібно тлумачити аналогічним Незалежно від присутності або відсутності чином. асиметричних центрів, деякі сполуки за даним виВираз «С3-6-циклоалкіл», що використовується находом можуть існувати у вигляді енантіомерів тут, відноситься до системи неароматичних моновнаслідок асиметрії молекули загалом. Має бути циклічних або конденсованих біциклічних вуглевозрозумілим, що у таких випадках обидва енантіодневих кілець, що включають від 3 до 6 атомів мери і їх суміші у будь-якій пропорції включені в вуглецю. Приклади його включають циклопропіл, обсяг винаходу і що структурні формули, які зоциклобутан, циклопентил, циклогексил і циклогекбражають молекули такого типу, повинні бути сеніл. представлені обома з можливих енантіомерів, якВираз «С3-6-Циклоалкіл-С1-6-алкіл», що викощо не обумовлено особливо. ристовується тут, включає циклопропілметил, цикУ сполуках формули І, Аr1 являє собою необолобутилметил, циклопентилметил і циклогексилв'язково заміщений феніл або піридил, зокрема, метил. необов'язково заміщений феніл або 3-піридил. Аr1, Вираз «N-гетероцикліл», що використовується переважно, вибраний з фенільних груп, заміщених тут, означає циклічну або поліциклічну систему, у 4-положенні галогеном, метилом або трифторяка містить до 10 атомів у циклі, вибраних з С, Ν, метилом, і фенільних груп, заміщених галогеном у Ο і S, де жоден з циклів, що складають систему, не положеннях 3 і 4. є ароматичним і де, щонайменше, один атом цикАr2 являє собою, переважно, 2,5-дифторфеніл. лу є азотом і зв'язування здійснюється через вкаУ конкретних варіантах здійснення Аr1 являє заний атом азоту циклу. Переважними Nсобою 4-хлорфеніл або 4-трифторметилфеніл і Аr2 гетероциклільними групами є моноциклічні систеявляє собою 2,5-дифторфеніл. ми з 4-6 членів, такі як азетидиніл, піролідиніл, R1b у типовому випадку являє собою Н, метил піперидиніл, піперазиніл, морфолініл, тіоморфоліабо ОН, переважно, Н. ніл, імідазолідиніл, оксазолідиніл і тіазолідиніл. R1c у типовому випадку являє собою Η або меВираз «гетероарил», що використовується тут, тил, переважно, Н. означає циклічну або поліциклічну систему, що Коли m дорівнює 1, R1b і R1c, переважно, не містить аж до 10 атомів у циклі, вибраних з С, Ν, Ο являють собою одночасно С1-4-алкіл. і S, де, щонайменше, один з циклів, що складають Конкретні значення R2a включають Н, феніл, систему, є ароматичним і включає, щонайменше, піридил, С3-6-циклоалкіл (такий як циклопропіл, 7 76491 8 циклобутил і циклопентил), С3-6-циклоалкіл-С1-6введення або для введення інгаляцією або інсуфалкіл (такий як циклопропілметил), С2-6-алкеніл ляцією. Для одержання твердих композицій, таких (такий як аліл) і нерозгалужений або розгалужений як таблетки, головний активний інгредієнт змішуС1-6-алкіл, який необов'язково заміщений CF3, Ar, ють з фармацевтичним носієм, таким як загальноOR2b, N(R2b)2, CO2R2b або CON(R2b)2. прийняті таблетувальні інгредієнти, відомі фахівПриклади N-гетероциклільних груп, представцям у даній області, наприклад, як описано у WO лених N(R2a)2, включають піперидин-1-іл (необо01/70677, і суміш перетворюють у дозовану лікарв'язково заміщений ОН, СО2Н, СО2-С1-4-алкілом, ську форму. Типова дозована лікарська форма Me або Ph), піперазин-1-іл (необов'язково заміщемістить від 0,1 до 500мг, наприклад, 1, 2, 5, 10, 25, ний Me або Ph), морфолін-4-іл, тіоморфолін-4-іл, 50, 100 або 200мг, активного інгредієнта. Таблетки 1,1-діоксотіоморфолін-4-іл, 2-оксоімідазолідин-1або пілюлі нової композиції можуть бути покриті іл, 5,5-диметил-2,2-діоксооксазолідин-3-іл, 2,5або по-іншому сформовані з утворенням лікарсьдіоксоімідазолідин-1-іл, 2-оксооксазолідин-3-іл, 2кої форми, що забезпечує перевагу пролонгованої оксопіридин-1-іл і 2-оксопіролідин-1-іл. дії, як описано, наприклад, у WO 01/70677. R2b у типовому випадку являє собою Η або С1Рідкі форми, в які нові композиції даного винаходу можуть бути включені для введення перора4-алкіл. Коли Ζ являє собою OR2a, R2a відповідно явльно або ін'єкцією, включають водні розчини, ароляє собою Н, Аr (особливо піридил), алкіл (такий матизовані сиропи, водні або масляні суспензії і як метил, етил, пропіл або бутил) або заміщений ароматизовані харчові олії, як описано в WO алкіл (особливо, СН2Аr, такий як бензил або піри01/70677. дилметил). Даний винахід відноситься також до сполуки Коли Ζ являє собою CO2R2a, R2a відповідно формули І або її фармацевтично прийнятної солі являє собою Η або алкіл (такий як метил, етил, для застосування у способі лікування організму пропіл або бутил). людини. Лікування пов'язане, переважно, зі стаКоли Ζ являє собою CON(R2a)2, групи R2a неном, асоційованим з відкладенням -амілоїду. залежно являють собою Η або необов'язково заСтан, переважно, являє собою неврологічне заміщений алкіл, циклоалкіл, циклоалкілалкіл або хворювання, що має асоційоване -амілоїдне відалкеніл або разом замикають N-гетероциклільну кладення, таке як хвороба Альцгеймера. групу. Дуже можливо, що один R2a являє собою Η Даний винахід далі відноситься до застосута інший являє собою Н, алкіл (такий як метил, вання сполуки формули І або її фармацевтично етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, прийнятної солі при виготовленні лікарського затрет-бутил або 1-етилпропіл), алкеніл (такий як собу для лікування або профілактики хвороби аліл), циклоалкіл (такий як циклопропіл, циклобуАльцгеймера. тил або циклопентил), циклоалкілалкіл (такий як Описаний також спосіб лікування суб'єкта, циклопропілметил) або заміщений алкіл (такий як який страждає хворобою Альцгеймера або схильалкіл, заміщений Аr, особливо, 2-піридилетил, 3ний до хвороби Альцгеймера, що включає введен(імідазол-1-іл)пропіл або 2-фенілетил; або алкіл, ня вказаному суб'єкту ефективної кількості сполуки заміщений CF3, CO2R2b або CO2N(R2b)2, особливо, відповідно до формули І або її фармацевтично 2,2,2-трифторетил, метоксикарбонілметил або прийнятної солі. карбамоїлметил). В альтернативному випадку, дві Для лікування або профілактики хвороби Альгрупи R2a замикають N-гетероциклільну групу, таку цгеймера відповідний рівень дозування складає як морфолін, тіоморфолін, тіоморфолін-1,1приблизно від 0,01 до 250мг/кг на день, переваждіоксид, 4-метилпіперазин, 4-фенілпіперазин, піно, приблизно від 0,05 до 100мг/кг на день і, особперидин, 4-гідроксипіперидин або піперидин, який ливо, приблизно від 0,1 до 50мг/кг маси тіла на заміщений у 3- або 4-положенні CO2R2b і/або С1-4день. Сполуки можуть бути введені при режимі від алкілом, особливо 3- або 4-карбоксипіперидин, 31 до 4 разів на день. У деяких випадках, однак, або 4-етоксикарбонілпіперидин, 3-карбокси-3може бути використана доза, що знаходиться поза метилпіперидин і 3-етоксикарбоніл-3вказаними обмеженнями. метилпіперидин. Сполуки формули І, в якій m дорівнює 0 і Ζ явПриклади індивідуальних сполук відповідно до ляє собою CO2R2a або CON(R2a)2, можна одержати формули І наведені у доданому до опису розділі поєднанням карбонової кислоти (1) відповідно з прикладів. R2aOH або HN(R2a)2, Сполуки формули І володіють активністю як модулятори процесингу АРР під дією -секретази. Винахід відноситься також до фармацевтичних композицій, що включають одну або декілька сполук формули І або їх фармацевтично прийнятних солей і фармацевтично прийнятний носій. Вказані композиції, переважно, знаходяться у ви1 2 1c 2a гляді дозованих лікарських форм, таких як таблетде Аr , Аr , R і R мають вказані вище знаки, пілюлі, капсули, порошки, гранули, стерильні чення. Може бути використаний будь-який із станпарентеральні розчини або суспензії, дозовані дартних способів поєднання, включаючи викорисаерозолі або рідкі спреї, краплі, ампули, черезшкітання агентів поєднання, таких як рні пластири, автоін'єкторні пристрої або супозидиметиламінопіридин, гідроксибензотриазол, диторії, для перорального, парентерального, інтрациклогексилкарбодіімід, карбонілдіімідазол і тому назального, сублінгвального або ректального подібні. В одному переважному способі кислоту 9 76491 10 перетворюють у відповідний хлорангідрид кислоти де Аr1, Аr2 і R мають значення, вказані вище. (наприклад, обробкою оксалілхлоридом у розчині Декарбоксилювання можна виконати нагріванням ДМФ) і піддають взаємодії безпосередньо з потріпри 150°С у ДМСО у присутності хлориду натрію і бним нуклеофілом. В іншому переважному способі води, тоді як взаємодію (6) з (7) можна проводити кислоту перетворюють в активне ефірне похідне, при температурі навколишнього середовища в таке як складний ефір пентафторфенолу (наприінертному розчиннику, такому як ТГФ, у присутносклад, поєднанням з фенолом у присутності дицикті сильної основи, такої як трет-бутоксид калію. логексилкарбодііміду) і вказаний проміжний проСульфони (6) одержують окисленням простих дукт піддають взаємодії з потрібним нуклеофілом. тіоефірів Аr2-CH2-SAr1 (8), які, у свою чергу, одерКислоти (1) можна одержати гідролізом ефірів жують взаємодією тіолів Ar1SH (9) з бензилпохід(2), у типовому випадку у лужних умовах, таких як ними Аr2CH2-L (10), де L являє собою відхідну груобробка LiOH в етанольному розчині: пу, таку як хлорид або бромід і де Аr1 і Аr2 мають значення, вказані вище. Взаємодія між (9) і (10) відбувається в інертному розчиннику, такому як дихлорметан, у присутності основи, такої як триетиламін, тоді як окислення (8) у (6) звичайно проводять м-хлорпероксибензойною кислотою також в інертному розчиннику, такому як дихлорметан. Сполуки формули І, в якій m дорівнює 0 і Ζ яв2 де R являє собою алкіл, такий як метил або ляє собою CN або OR2a, можуть бути одержані 1 2 1c етил, і Аr , Аr і R мають значення, вказані вище. взаємодією сульфонатного ефіру (11), відповідно, Складні ефіри (2) можна одержати відновленз ціанід-іоном або R2aOH: ням алкіліденпохідних (3) з необов'язковим подальшим алкілуванням продукту (С1-4-алкіл)-L, де L являє собою відхідну групу (особливо бромід або йодид), де R1c відрізняється від Н: 1 2 2 де Аr , Аr і R мають такі ж значення, як вказано вище. Відновлення можна проводити з використанням борогідриду натрію і хлориду нікелю (II) в етанолі, тоді як необов'язкове алкілування можна проводити обробкою складного ефіру (2, R1c=H) сильною основою (наприклад, біс(триметилсиліл)амідом натрію) в апротонному розчиннику при низькій температурі з подальшою обробкою (С1-4-алкіл)-L і нагріванням до кімнатної температури. За необхідності, ненасичені складні ефіри (3) можуть бути гідролізовані у відповідні кислоти і перетворені в аміди взаємодією з HN(R2a)2 перед відновленням олефінового зв'язку. Ненасичені складні ефіри (3) є доступним конденсацією кетону (4) з Ph3P=CHCO2R2: де Аr1, Аr2 і R2 мають значення, вказані вище, тоді як кетон (4) одержують декарбоксилюванням енолів (5), які, у свою чергу, одержують взаємодією сульфону (6), щонайменше, з двома еквівалентами акрилату (7): де L1 являє собою сульфонатну відхідну групу (таку як мезилат, тозилат або трифлат) і Аr1, Аr2, R1c і R2a мають значення, вказані вище. Реакцію заміщення можна проводити у ДМФ при підвищеній температурі, наприклад, приблизно при 80°С. Коли нуклеофілом є R2aOH, вигідно генерувати відповідний аніон обробкою гідридом натрію перед взаємодією з (11). Сульфонати (11) одержують взаємодією спиртів (12) з відповідним сульфонілхлоридом (наприклад, у безводних умовах при низькій температурі у присутності третинного аміну). Спирти (12) складно одержати гідроборуванням алкенів (13): де Аr1, Аr2 і Rc мають значення, вказані вище. Спосіб у типовому випадку включає взаємодію з бораном у ТГФ при кімнатній температурі з подальшою обробкою лужним пероксидом водню і відділенням необхідного цис-ізомеру хроматографією. Алкени (13) є доступними з кетонів (4) конденсацією з Рh3Р=СНE1c, де R1c має такі ж значення, які вказані вище. Альтернативний шлях до спиртів (12), в яких R1c являє собою Н, включає відновлення кетону 11 76491 12 (4) (наприклад, з використанням борогідриду) у ні групи у будь-якій з приймаючих участь молекул. відповідний вторинний спирт (14), перетворення Цього можна досягти за допомогою загальноприйвказаного спирту (14) у відповідний мезилат (або нятих захисних груп, таких як групи, описані в еквівалентну відхідну групу), проведення нуклео[Protective Groups in Organic Chemistry, ed. J.F.W. фільного заміщення ціанід-іоном, гідроліз нітрилу, McOmie, Plenum Press, 1973; and T.W. Greene and що утворився, у відповідну карбонову кислоту з P.G.M. Wuts, Protective Groups in Organic подальшим відновленням у первинний спирт. ГідSynthesis, John Wiley and Sons, 1991]. Захисні груроліз у типовому випадку проводять у кислотних пи можуть бути видалені на придатній наступній умовах (наприклад, у суміші оцтової кислоти і стадії з використанням способів, відомих у даній конц. НСl при 110°С) і відновлення у зручному виобласті. падку проводять послідовною обробкою ізобутилПридатні способи аналізу рівня активності хлорформіатом і борогідридом у ТГФ. сполук даного винаходу відносно γ-секретази опиСполуки формули І, в якій m дорівнює 1 і R1b сані у [WO 01/70677 та у Biochemistry, 2000, 39(30), являє собою Η або С1-4-алкіл, можуть бути одер8698-8704]. жані окисленням спирту (12) у відповідний альдеСполуки з прикладів даного винаходу всі магід або кетон і перетворенням його карбонільної ють ED50 менше, ніж 10мкМ, переважно, менше, групи способом, описаним вище у зв'язку з перетніж 1мкМ, і найбільш переважно, менше, ніж воренням кетонів (4) у сполуки формули І, в якій m 100нМ, щонайменше, в одному зі згаданих вище дорівнює 0. Наприклад, окислення спиртів (12), в аналізів. яких R1c являє собою Н, забезпечує одержання Наступні приклади ілюструють даний винахід. відповідних циклогексанкарбоксальдегідів, які моПриклади жуть бути конденсовані з Ph3P=CO2Et з одержанПроміжний продукт 1 ням етилового ефіру 2-циклогексилпропенових кислот. У свою чергу, вони можуть бути гідровані у відповідні етил-2-циклогексилпропіонати, які, необов'язково, можуть бути піддані алкілуванню і/або гідролізу у відповідні кислоти і/або перетворені у різні амідні або альтернативні ефірні похідні. Коли вихідні матеріали і реагенти, що використовуються в описаних вище синтетичних схемах, не є самі комерційно доступними, вони можуть 4-Хлортіофенол (3,6г, 0,025моль) у дихлормебути одержані із застосуванням стандартних спотані (100мл) обробляють 2,5собів органічного синтезу для комерційно доступдихлорбензилбромідом (5,17г, 0,025моль) і триених матеріалів. тиламіном (3,9мл, 0,028моль), реакційну суміш Має бути зрозумілим, що багато з описаних перемішують протягом 2 годин, потім розбавляють вище синтетичних схем можуть давати суміші стедихлорметаном (250мл) і промивають водою реоізомерів. Зокрема, деякі продукти можуть утво(100мл) і насиченим розчином солі (100мл). Віддірюватися у вигляді сумішей цис- і транс-ізомерів, в лений органічний шар сушать (MgSO4) і випарюяких визначений замісник циклу знаходиться на тій ють досуха. Продукт очищають пропусканням чеже або на протилежній стороні від кільця, як арилрез шар діоксиду кремнію, елююючи сумішами сульфонільна група. Такі суміші можуть бути розгексан-етилацетат. 1Н ЯМР CDCl3 7,23 (4Н, с), ділені загальноприйнятими способами, такими як 6,69-6,86 (3Н, м) і 4,04 (2Н, с). фракційна кристалізація і препаративна хроматогВказаний простий тіоефір (5,12г, 0,018моль) рафія. розчиняють у дихлорметані (100мл) і обробляють Деякі сполуки відповідно до винаходу можуть м-хлорпероксибензойною кислотою (14,3г, існувати у вигляді оптичних ізомерів внаслідок 0,042моль (50мас./мас.%)) і перемішують протягом присутності одного або декількох хіральних 2 годин. Реакційну суміш потім промивають центрів або внаслідок загальної асиметрії молекуNa2S2O5 (5% розчин, 100мл), насиченим розчином ли. Такі сполуки можуть бути одержані у рацемічсолі (50мл), сушать (MgSO4) і упарюють досуха. ній формі або індивідуальні енантіомери можуть Одержаний сульфон очищають на діоксиді крембути одержані або енантіоспецифічним синтезом, нію, елююючи сумішами гексан-етилацетат, 3,6 г. або розподілом на ізомери. Нові сполуки можна, 1 Н ЯМР CDCl3 7,61 (2Н, д, J=8,6Гц), 7,45 (2Н, д, наприклад, розділити на складові енантіомери J=8,6Гц), 7,13-7,08 (1Н, м), 7,05-7,01 (1Н, м), 7,05стандартними способами, такими як препаративна 7,00 (1Н, м), 6,99-6,87 (1Н, м) і 4,36 (2Η, с). ВЕРХ або одержання діастереомерної пари утвоПроміжний продукт 2 ренням солі з оптично активною кислотою, такою як (-)-ди-п-толуоїл-d-винна кислота і/або (+)-ди-птолуоїл-1-винна кислота, з подальшою фракційною кристалізацією і регенерацією вільної основи. Нові сполуки можуть бути також розділені утворенням діастереомерних складних ефірів або амідів з подальшим хроматографічним розподілом і видаленням хіральної допоміжної сполуки. Під час виконання будь-якої зі згаданих вище синтетичних послідовностей може бути необхідно і/або бажано захистити чутливі або реакційноздат Одержують, як проміжний продукт 1, з використанням 4-трифторметилтіофенолу, продукт одержаний у вигляді твердої речовини. 1Н ЯМР 13 76491 14 м), 2,63-2,54 (4Н, м) і 2,25-2,16 (2Н,м). (360МГц, CDCl3) 7,85-7,83 (2Н, м), 7,76-7,74 (2Н, Приклад одержання 4 м), 7,15-7,10 (1Н, м), 7,06-7,0 (1Н, м), 6,92-6,86 (1Н, м) і 4,46 (2Н, с). Приклад одержання 1 До проміжного продукту 1 (1г, 3,31моль) і метилакрилату (0,84мл, 9,27моль) у тетрагідрофурані (30мл) по краплях додають трет-бутоксид калію (3,64мл 1Μ розчину у тетрагідрофурані, 3,64моль). Реакційну суміш перемішують протягом 2 годин, розбавляють етилацетатом (100мл) і промивають водою (50мл) і насиченим розчином солі (50мл). Органічну фазу відділяють, сушать (MgSO4) та упарюють досуха і продукт очищають на діоксиді кремнію, елююючи сумішами гексан-етилацетат (1,0 г). 1Н ЯМР CDCl3 12,0 (1Н, с), 7,41 (4Н, с), 7,06-7,0 (2Н, м), 6,87-6,81 (1Н, с), 3,81 (3Н, с), 3,38 (1Н, дд, J=3,2, 15,8Гц), 3,02-2,92 (2Н, м), 2,52 (1Н, дд, J=5,7, 18,5Гц), 2,3-2,2 (1Н, м) і 2,2-2,1 (1Н, м). Приклад одержання 2 Складний ефір з прикладу одержання 1 (1,0г, 2,25моль) у диметилсульфоксиді (10мл) обробляють NaCl (0,3г, 4,96моль) і водою (0,9мл, 4,96моль) і нагрівають при 150°С протягом 2 годин. Охолоджену реакційну суміш розбавляють етилацетатом (100мл), промивають насиченим NH4Cl (100мл) і органічну фазу відділяють, сушать (MgSO4) та упарюють досуха. Продукт очищають на діоксиді кремнію, елююючи сумішами гексанетилацетат, 0,5 г. 1Н ЯМР CDCl3 7,43-7,37 (4Н, м), 7,22-7,1 (2Н, м), 6,97-6,9 (1Н, м), 3,05-2,98 (2Н, м) і 2,61-2,53 (2Н,м). Приклад одержання 3 Синтезують за методиками прикладів одержання 1 і 2 з використанням проміжного продукту 2, одержуючи при цьому продукт у вигляді твердої речовини (0,3г). 1Н ЯМР (360МГц, CDCl3) 7,717,69 (2Н, д, J=7,5Гц), 6,62-6,60 (2Н, д, J=7,4Гц), 7,22-7,11 (2Н, м), 6,95-6,88 (1Н, м), 3,02-2,99 (2Н, Етил(діетоксифосфініл)ацетат (5,16мл, 26моль) додають по краплях до суспензії гідриду натрію (60% дисперсія у мінеральному маслі, 988мг, 24,7моль) у тетрагідрофурані (60мл) і суміш перемішують при кімнатній температурі протягом 1 години. Протягом 20хв. по краплях додають кетон з прикладу одержання 2 (5г, 13моль) у тетрагідрофурані (50мл) і суміш перемішують при кімнатній температурі протягом 18 годин. Додають воду і суміш екстрагують етилацетатом. Об'єднані органічні фракції промивають водою, сушать (MgSO4) і розчинник випарюють при зниженому тиску. Залишок очищають флеш-хроматографією на силікагелі при елююванні сумішшю ізогексан:ЕtOАс (85:15), одержуючи при цьому продукт у вигляді білої твердої речовини (5,2г, 88%). 1 Н ЯМР (360МГц, CDCl3) 7,41-7,36 (4Н, м), 7,18-7,13 (1Н, м), 7,11-7,05 (1Н, м), 6,93-6,86 (1Н, м), 5,64 (1Н, с), 4,14-4,10 (2Н, м), 3,99-3,96 (1Н, м), 2,91-2,80 (2Н, м), 2,42-2,38 (1Н, м), 2,31-2,04 (3Н, м), 1,89-1,78 (1Н, м), 1,28-1,24 (3Н, м). Приклад одержання 5 Кетон з прикладу одержання 2 (0,1г, 0,26моль) у метанолі (2мл) обробляють NaBH4 (0,098г, 0,26моль) і перемішують протягом 1 години. Реакційну суміш гасять НСI (1н, 10мл), розбавляють етилацетатом (20мл), потім органічну фазу відділяють, сушать (MgSO4) та упарюють досуха. Цис- і транспродукти очищають на діоксиді кремнію, елююючи сумішами гексан-етилацетат. (a) (транс) 0,052г. 1Н ЯМР (CDCl3) 7,39-7,33 (4Н, м), 7,11-7,02 (2Н, м), 6,88-6,82 (1Н, м), 3,803,73 (1Н, м), 2,80-2,60 (2Н, м), 2,22-2,16 (2Н, м), 2,08-2,04 (2Н, м), 1,53 (1Н, шир.) і 1,27-1,13 (2Н, м). (b) (цис) 1Н ЯМР (CDCl3) 7,40 (4Н, с), 7,16-7,03 (2Н, м), 6,90-6,83 (1Н, м), 3,97-3,95 (1Н, м), 3,773,68 (1Н, м), 3,51-3,49 (1Н, м), 2,61-2,53 (2Н, м), 1,91-1,83 (2Н, м) і 1,50-1,42 (2Н,м). Приклад одержання 6 15 Транс-циклогексанол з прикладу одержання 5 (2,7г, 6,9моль) і триетиламін (1,45мл, 10,3моль) у дихлорметані (50мл) обробляють метансульфонілхлоридом (0,645мл, 8,9моль) при -30°С. Через 30хв. суміш промивають водою (20мл), 10% водною лимонною кислотою (20мл) і насиченим водним гідрокарбонатом натрію (50мл), сушать (MgSO4) і випарюють досуха. Тверду речовину розтирають з ефіром, одержуючи при цьому мезилат (2,6г). 1Н ЯМР (CDCl3) 7,40-7,37 (4Н, м), 7,127,07 (2Н, м), 6,92-6,83 (1Н, м), 4,78-4,65 (1Н, м), 2,96 (ЗН, с), 2,88-2,52 (2Н, м), 2,29-2,21 (4Н, м) і 1,59-1,47 (2Н, м). Приклад одержання 7 Транс-мезилат з прикладу одержання 6 (103мг, 0,22моль) розчиняють у толуолі (20мл) і додають до заздалегідь підданого азеотропній перегонці зразка ціаніду тетрабутиламонію (354мг, 1,32моль) і суміш нагрівають до 70°С протягом 18 годин і потім охолоджують до кімнатної температури. Розчин розбавляють водою (10мл) і промивають етилацетатом (2 50мл). Органічну фазу промивають насиченим розчином солі (10мл), сушать (MgSO4) і випарюють. Одержане прозоре масло очищають колонковою хроматографією на силікагелі при елююванні 10-20% етилацетатом у гексанах, одержуючи при цьому ціанід. 1Н ЯМР (CDCl3) 7,42-7,36 (4H, с), 7,10-7,05 (2Н, м), 6,896,84 (1Н, м), 2,88-2,86 (1Н, м), 2,76-2,72 (2Н, м), 2,52-2,45 (1Н, м), 2,12-2,07 (1Н, м) і 1,56-1,49 (1Н, м). Приклад одержання 8 Ціанід з прикладу одержання 7 (143мг, 0,36моль) розчиняють/суспендують у суміші льодяної оцтової кислоти (10мл) і конц. НСI (6мл) і нагрівають при 110°С протягом 15 годин. Суміш охолоджують, розбавляють етилацетатом і промивають водою ( 3), сушать (MgSO4) та упарюють 76491 16 досуха. Даний неочищений залишок (153мг) очищають препаративною ТШХ (5% метанол у суміші дихлорметан/1% оцтова кислота). 1Н ЯМР (CDCl3) 7,38-7,35 (4Н, с), 7,08-7,06 (2Н, м), 6,90-6,84 (1Н, м), 2,65-2,58 (2Н, м), 2,38-2,33 (3Н, м) і 1,76-1,49 (4Н, м). Приклад одержання 9 Ціанід з прикладу одержання 8 (50мг, 0,12моль) розчиняють у суміші тетрагідрофурану (4,5мл) і води (0,5мл) і перемішують при 20°С. Суміш обробляють пероксидом водню (20мл, 0,6моль) і потім гідроксидом літію (6мл, 0,25моль) протягом 2 годин. Додають пероксид водню (20мл, 0,6моль) і потім гідроксид літію (6мг, 0,25моль) і суміш перемішують при кімнатній температурі протягом 72 годин. Суміш охолоджують, розбавляють етилацетатом і промивають водою ( 2) і насич. бісульфітом натрію, сушать (MgSO4) та упарюють досуха. Даний неочищений залишок (51мг) очищають препаративною ТШХ (20% етилацетат у гексанах). 1Н ЯМР (CDCl3) 7,37 (4Н, с), 7,10-7,02 (2Н, м), 6,90-6,84 (1Н, м), 5,57 (2Н, шир.с), 2,542,48 (3Н, м), 2,43-2,39 (1Н, м), 2,19-2,15 (2Н, м) і 1,62-1,50 (3Н, м). Приклад 1 Борогідрид натрію (313мг, 8,23моль) додають до суміші ненасиченого складного ефіру з прикладу одержання 4 (3,74г, 8,23моль) і хлориду нікелю (II) (2,67г, 20,6моль) в етанолі (100мл). Суміш перемішують при кімнатній температурі протягом 20хв., потім додають воду (100мл). Суміш фільтрують через Hyflo , промивають етанолом і етилацетатом. Розчинник випарюють при зниженому тиску і залишок розподіляють між етилацетатом і водою. Органічний шар відділяють, сушать (MgSO4) і розчинник випарюють при зниженому тиску. Залишок очищають колонковою флешхроматографією на силікагелі з елююванням сумішшю ізогексан:ЕtOАс (85:15), одержуючи при цьому цис-ізомер, що швидше рухається, у вигляді масла (1,36г, 36%), 1Н ЯМР (400МГц, CDCl3) 7,37-7,30 (4Н, м), 7,09-7,00 (2Н, м), 6,86-6,79 (1Н, м), 4,14 (2Н, кв, J=7,1Гц), 2,47 (2Н, д, J=7,6Гц), 2,46-2,38 (2Н, м), 2,19-2,14 (1Н, м), 1,76-1,71 (2Н, м), 1,57-1,48 (4Н, м), 1,27 (3Н, т, J=7,1Гц); а також транс-ізомер, що повільніше рухається, у вигляді 17 76491 18 масла (200мг, 5,3%). Приклад 2 Гідроксид літію (350мг, 14,57моль) додають до розчину складного цис-ефіру з прикладу 1 (1,33г, 2,91моль) в етанолі (40мл). Суміш дегазують і перемішують при кімнатній температурі в атмосфері газоподібного азоту протягом 5 годин. Суміш виливають у водну хлористоводневу кислоту (1М) і екстрагують етилацетатом. Органічний екстракт сушать (MgSO4) і розчинник випарюють при зниженому тиску, одержуючи при цьому білу тверду речовину, яку потім кристалізують з IPА, одержуючи при цьому продукт у вигляді білої твердої речовини (950мг, 76%). 1Н ЯМР (400МГц, CD3OD) 7,51-7,49 (2Н, м), 7,40-7,37 (2H, м), 7,19-7,10 (2Н, м), 7,00-6,94 (1Н, м), 2,51-2,35 (6Н, м), 2,13-2,10 (1Н, м), 1,78-1,74 (2Н, м), 1,57-1,50 (2Н, м). Приклад 3 Приклади 16-33 Кислоту з прикладу 2 (50мг, 0,117моль), морфолін (30мкл, 0,351моль), 1-гідроксибензотриазол (24мг, 0,176моль) і триетиламін (65мкл, 0,468моль) перемішують у тетрагідрофурані при кімнатній температурі в атмосфері газоподібного азоту протягом 10хв. До суміші додають гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодііміду (45мг, 0,234моль) і суміш перемішують протягом 24 годин. Суміш виливають у водний гідроксид натрію (1М) та екстрагують етилацетатом. Органічний екстракт сушать (MgSO4) і розчинник випарюють при зниженому тиску. Залишок очищають колонковою флеш-хроматографією на силікагелі з елююванням від 5 до 10% метанолом у дихлорметані, одержуючи при цьому продукт у вигляді білої піни (50мг, 86%). 1Н ЯМР (400МГц, CD3OD) 7,50 (2Н, д, J=8,6Гц), 7,37 (2Н, д, J=8,6Гц), 7,19-7,09 (2Н, м), 7,00-6,93 (1Н, м), 3,69-3,63 (4H, м), 3,59-3,56 (4Н, м), 2,55 (2Н, д, J=7,4Гц), 2,47-2,39 (4Н, м), 2,162,07 (1Н, м), 1,78-1,74 (2Н, м), 1,58-1,51 (2Н, м). m/z (ES+) (МИ) 498+500. Приклади 4-15 Наступні сполуки одержують способом прикладу 3 з використанням відповідного аміну замість морфоліну. Сполуки вказаних прикладів одержують наступним способом з використанням відповідної вільної основи аміну або солі аміну з попередньою нейтралізацією. До суспензії, що перемішується, цис-4-(4хлорбензолсульфоніл)-4-(2,5дихлорфеніл)циклогексаноцтової кислоти (приклад 2, 0,15г, 0,35моль) у дихлорметані (5мл) додають оксалілхлорид (0,05мл, 0,57моль) і диметилформамід (1 крапля). Через 30 хвилин розчин випарюють до невеликого об'єму і до розчину залишку у дихлорметані (5мл) додають потрібний амін (1,75моль). Після перемішування розчину протягом 20 хвилин розчинник видаляють у вакуумі і залишок очищають хроматографією на силікагелі, елююючи з концентраціями, що підвищують 19 76491 20 ся, етилацетату в ізогексані (25%, 50%). Фракції, Кислоту з прикладу одержання 8 (153мг) розщо містять продукт, випарюють, одержуючи при чиняють у безводному ТГФ (10мл) і охолоджують цьому амід. Хроматографічне очищення проводо 0°С в атмосфері азоту. Додають триетиламін дять на силікагелі з використанням, де це необхід(61мкл, 0,43моль) та ізобутилхлорформіат (57мкл, но, відповідних концентрацій етилацетату в ізогек43моль) і суміш перемішують при 0°С протягом сані, етилацетату або метанолу в етилацетаті. однієї години. Осад, який утворюється, видаляють фільтруванням і промивають додатково 5мл безводного ТГФ. Об'єднані шари ТГФ знову охолоджують до 0°С і додають борогідрид натрію (70мг, 1,84моль) у вигляді розчину у воді (2мл) (закипання!). Після перемішування протягом 30 хвилин при 0°С реакційну суміш розбавляють етилацетатом, промивають розчином хлориду амонію, розчином бікарбонату натрію і насиченим розчином солі, потім сушать (MgSO4) та упарюють досуха. Залишок очищають колонковою хроматографією з елююванням сумішшю етилацетат:гексан (1:3), одержуючи при цьому потрібний спирт (75мг). 1Н ЯМР (CDCl3) 7,39-7,31 (4Н, м), 7,10-7,01 (2Н, м), 6,88-6,81 (1Н, м), 3,71 (2Н, д, J=7,5Гц), 2,46-2,32 (4Н, м), 1,90-1,85 (2Н, м), 1,78-1,74 (1Н, м) і 1,541,44 (2Н, м). m/z=423 [MNa]+. Приклад 35 Приклад 33 До розчину цис-аміду з прикладу одержання 9 (46мг) і піридину (0,053мл) у тетрагідрофурані (1мл) додають трифтороцтовий ангідрид (0,056мл). Розчин перемішують при кімнатній температурі протягом 2 годин при додаванні 0,5Μ НСI (водний) та етилацетату. Органічну фазу сушать (MgSO4), упарюють до невеликого об'єму і очищають хроматографією на силікагелі при елююванні сумішшю ізогексан:етилацетат (5:1), одержуючи при цьому потрібний продукт у вигляді безбарвної твердої речовини. 1Н ЯМР (360МГц, CDCl3) 1,611,70 (2Н, м), 1,86-1,94 (2Н, м), 2,03-2,10 (1Н, м), 2,42-2,45 (4Н, м), 2,51 (2Н, д, J=8,0Гц), 6,8 (1Н, м), 7,02-7,09 (2Η, м), 7,30 (2Н, д, J=8,6Гц), 7,36 (2Н, д, J=8,7Гц). Приклад 34 Стадія (1) До розчину кислоти з прикладу 2 (1г) у DCM (50мл) та етилацетаті (30мл) додають пентафторфенол (1,5екв.) і DCC (1,5екв.) і перемішують при кімнатній температурі протягом 1 години. Реакційну суміш випарюють у вакуумі, розчиняють в етилацетаті і фільтрують. Фільтрат випарюють у вакуумі, одержуючи при цьому складний ефір пентафторфенолу з достатньою чистотою для використання у наступних реакціях. Стадія (2) До складного ефіру пентафторфенолу, одержаного у стадії (1) (155мг, 0,25моль) і розчиненого у ДМФ (3мл), в атмосфері азоту додають гідрохлорид метилового ефіру гліцину (125мг, 1,0моль) і триетиламін (0,15мл). Через 2 години реакційну суміш розбавляють водою, екстрагують етилацетатом ( 3), промивають водою, насиченим розчином солі, сушать (MgSO4), фільтрують і упарюють. Очищають колонковою флеш-хроматографією (від суміші 1:1 ізогексан/етилацетат до суміші 9:1 етилацетат/метанол), одержуючи при цьому білу тверду речовину (55мг). 1Н ЯМР (CDCl3) 1,08-1,16 (1Н, м), 1,30-1,37 (1Н, м), 1,67-1,71 (1Н, м), 1,751,79 (2Η, м), 1,91-1,95 (1Н, м), 2,20-2,26 (1Н, м), 2,41 (4Н, д, J=7,8Гц), 3,77 (3Н, с), 4,05 (2Н, д, J=5,1Гц), 6,19 (1Н, шир.), 6,79-6,85 (1Н, м), 7,007,07 (2Н, м), 7,30-7,37 (4Н, м). Приклад 36 21 Ефір гліцину, одержаний у прикладі 35 (50мг, 0,1моль), поміщений у герметизовану трубку і розчинений у 2Μ розчині аміаку у метанолі (3мл), нагрівають до 50°С протягом 3 годин. Після охолоджування до кімнатної температури реакційну суміш концентрують і очищають розтиранням з ефіром, одержуючи при цьому білу тверду речовину (28мг). МС(ЕІ+): 485 (МН+). Приклад 37 Спирт прикладу 34 (4г, 10моль) розчиняють у дихлорметані (280мл) і обробляють періодинаном Деса-Мартіна (4,66г, 11моль) і суміш перемішують протягом 45хв. перед додаванням насиченого водного бісульфіту натрію (100мл) і через 5хв. суміш розділяють і органічну фазупромивають насиченим водним бікарбонатом натрію (100мл), сушать (MgSO4) та упарюють досуха. Неочищений залишок (4г) розчиняють у безводному дихлорметані (100мл) і обробляють метилтрифенілфосфіноацетатом (4,7г, 14моль), перемішують при кімнатній температурі протягом 16 годин. Розчинник випарюють і залишок очищають колонковою хроматографією на силікагелі з елююванням 10-20% етилацетатом у гексанах, одержуючи при цьому продукт. 1Н ЯМР (CDCl3) 7,37-7,36 (4Н, м), 7,107,02 (3Н, м), 6,78-6,83 (1Н, м), 5,91 (1Н, д, J=16Гц), 3,77 (3Н, с), 2,55-2,45 (3Н, м), 2,40-2,38 (2Н, м), 1,95-1,90 (2Н, м) і 1,65-1,52 (2Н, м). Приклад 38 Алкен з прикладу 37 (3,6г, 9моль) розчиняють в етилацетаті (350мл). Колбу дегазують і потім додають 10% паладій на вугіллі (400мг) і суміш перемішують в атмосфері водню протягом 45 хвилин. Розчин фільтрують через целіт і упарюють. Одержане прозоре масло очищають препаративною ТШХ, елююючи 5% етилацетатом у гексанах. Одержане масло потім додатково очищають коло 76491 22 нковою хроматографією на силікагелі з елююванням 5-10% етилацетатом у гексані, одержуючи при цьому продукт. 1Н ЯМР (CDCl3) 7,37-7,34 (4Н, м), 7,08-7,00 (2Н, м), 6,85-6,81 (1Н, м), 3,67 (3Н, с), 2,45-2,39 (4Н, м), 2,33 (2Н, т, J=8,4Гц), 1,81 (2Н, кв, J=8,4Гц), 1,72-1,68 (2Н, м) і 1,60-1,43 (3Н, м). Приклад 39 Складний ефір прикладу 38 (104мг, 0,23моль) розчиняють у суміші етанолу (10мл) і води (3мл) і перемішують при 20°С. Колбу дегазують і потім додають гідроксид літію (27мг, 1,15моль). Суміш перемішують протягом 3 годин при кімнатній температурі. Потім додають 1н хлористоводневу кислоту і суміш промивають етилацетатом (2 50мл). Органічну фазу промивають насиченим розчином солі (50мл), сушать (MgSO4) та упарюють. Одержане масло потім додатково очищають препаративною ТШХ з елююванням етилацетатом, одержуючи при цьому кислоту. 1Н ЯМР (CDCl3) 7,377,30 (4Н, м), 7,09-6,99 (2Н, м), 6,85-6,79 (1Н, м), 2,42-2,36 (6Н, м), 1,85-1,79 (2Н, м), 1,73-1,69 (2Н, м), 1,63-1,58 (1Н, м) і 1,53-1,45 (2Н, м). Приклад 40 Кислоту з прикладу 39 (52мг, 0,118моль) у дихлорметані (2мл) обробляють оксалілхлоридом (88мкл, 2Μ розчин у дихлорметані, 0,176моль). Додають краплю Ν,Ν-диметилформаміду і розчин залишають при перемішуванні протягом 2 годин. Після вказаного часу розчинник видаляють у вакуумі і залишок знову розчиняють у дихлорметані (1мл). Даний розчин по краплях додають до розчину аміаку у метанолі (2М, 2мл). Реакційну суміш упарюють у вакуумі і залишок хроматографують на діоксиді кремнію, елююючи 80% етилацетатом у гексанах. Речовину, що утворилася, очищають додатково препаративною ТШХ з елююванням 100% етилацетатом з подальшою перекристалізацією з гарячого гексану, одержуючи при цьому продукт (7,4мг, 14%). 1 Н ЯМР (360МГц, CDCl3) 1,45-1,53 (2Н, м), 1,57-1,65 (1Н, шир.), 1,70-1,75 (2H, м), 1,78-1,84 (2Н, м), 2,32 (2Н, т, J=15,3Гц), 2,38-2,44 (4Н, шир), 2,95 (3Н, с), 3,02 (3Н, с), 6,79-6,86 (1Н, м), 7,007,09 (2Н, м), 7,31-7,37 (4Н, м); MS(ES+), 470 (М+1),294(М+175). 23 76491 24 Одержують з кетону прикладу одержання 3 за методиками прикладу одержання 4 і прикладів 1 і 2. 1Н ЯМР (360МГц, CDCl3), 1,52-1,61 (2H, м), 1,761,81 (2H, м), 2,20-2,26 (1Н, м), 2,39 (2H, д, J=7,6Гц), 2,40-2,50 (4Н, м), 5,37 (1Н, шир.), 5,51 (1Н, шир.), 6,75-6,83 (1Н, м), 7,01-7,08 (2Н, м), 7,51 (2Н, д, J=8,3Гц) і 7,64 (2Н, д, J=8,3Гц). Приклад 43 Приклад 41 Складний цис-ефір з прикладу 1 (669мг, 1,467моль) у тетрагідрофурані (14мл) охолоджують до -78°С, обробляють біс(триметилсиліл)амідом натрію (2,20мл, 1Μ розчин у тетрагідрофурані, 2,20моль) і перемішують при нагріванні до кімнатної температури протягом 2 годин. Потім до суміші при -20°С додають метилйодид (457мкл, 7,36моль) і перемішування продовжують, знову нагріваючи до кімнатної температури протягом 2 годин. Реакційну суміш гасять льодяною оцтовою кислотою (132мкл, 2,20моль), розбавляють хлоридом амонію (50%, водн., 80мл) та екстрагують етилацетатом (3 100мл). Об'єднані органічні шари потім промивають розчином солі (насич., 200мл), сушать (MgSO4) і упарюють у вакуумі, одержуючи при цьому неочищений продукт (670мг). Дану речовину хроматографують на діоксиді кремнію при елююванні 8% етилацетатом у гексанах, одержуючи при цьому продукт (272мг, 40%). 1Н ЯМР (400МГц, CDCl3) 1,16 (3Н, д, J=6,9Гц), 1,28 (3Н, т, J=7,1Гц), 1,45-1,51 (2Н, м), 1,71-1,77 (2Н, м), 1,89-1,94 (1Н, м), 2,28-2,48 (3Н, шир.), 2,54-2,60 (1Н, шир.), 2,70-2,74 (1Н, м), 4,094,18 (2Н, м), 6,77-6,84 (1Н, м), 6,99-7,08 (2Н, м), 7,26-7,36 (4Н, м). Приклад 42 Комп’ютерна верстка О. Гапоненко Одержують з кислоти прикладу 42 за методикою прикладу 35 з використанням аміаку у другій стадії. МС МН+ 462(463). Приклад 44 Одержують з кетону прикладу одержання 3 за методиками прикладів одержання 5-8 і прикладів 34, 37, 38 і 39. 1Н ЯМР (360МГц, CDCl3) 10,1 (1Н, м), 7,64 (2H, д, J=8,3Гц), 7,53 (2Н, д, J=8,3Гц), 7,097,00 (2Н, м), 6,83-6,76 (1Н, м), 2,50-2,37 (6Н, м), 1,85-1,81 (2Н, кв, J=7,4Гц), 1,75-1,70 (2Н, м), 1,631,59 (1Н, м), 1,55-1,45 (2Н, м). МС (EI+) 477 (МН+). Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclohexyl sulphones
Назва патенту російськоюЦиклогексилсульфоны
Автори російськоюNadin, Alan, John
МПК / Мітки
МПК: A61K 31/10, C07C 317/20, C07D 211/46, C07D 211/60, C07D 233/56, C07C 317/44, A61P 25/28, C07D 211/62, C07D 213/40, C07D 295/18
Мітки: циклогексилсульфони
Код посилання
<a href="https://ua.patents.su/12-76491-ciklogeksilsulfoni.html" target="_blank" rel="follow" title="База патентів України">Циклогексилсульфони</a>
Наступний патент: Спосіб лікування ран у ротовій порожнині
Випадковий патент: Геотермальна електростанція












