Похідні 1н-імідазолу, що мають агоністичну активність щодо св1, частково агоністичну активність щодо св1 або антагоністичну активність щодо св1, спосіб їх одержання (варіанти), проміжні сполуки, фармацевтична к
Номер патенту: 77440
Опубліковано: 15.12.2006
Автори: Ланге Йозефус Х.М., Герреманс Арнольдус Г.Й., Крузе Корнеліс Г., ван Стюйвенберг Герман Г.
Формула / Реферат
1. Сполука формули (І)
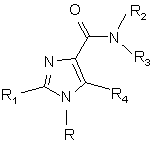 ,(I)
,(I)
де
- R - феніл, тієніл, 2-піридиніл, 3-піридиніл, 4-піридиніл, піримідиніл, піразиніл, піридазиніл або триазиніл, причому ці групи можуть бути заміщені 1, 2, 3 або 4 замісниками Y, які можуть бути однакові або різні, з групи, що містить С1-3-алкіл або алкокси, гідрокси, галоген, трифторметил, трифторметилтіо, трифторметилокси, нітро, аміно, моно- або діалкіл(С1-2)-амін, моно- або діалкіл(С1-2)-амід, (С1-3)-алкоксикарбоніл, карбоксил, ціан, карбамоїл та ацетил, або R представляє нафтил, за умови, що, якщо R - 4-піридиніл, R4 представляє атом галогену або ціан, карбамоїл, форміл, ацетил, трифторацетил, фторацетил, пропіоніл, сульфамоїл, метансульфоніл, метилсульфаніл або розгалужену чи нерозгалужену С1-4 алкільну групу, причому С1-4 алкільна група може бути заміщена 1-3 атомами фтору або бромом, хлором, йодом, ціаном або гідроксигрупою,
- R1 представляє феніл або піридиніл, причому ці групи можуть бути заміщені 1, 2, 3 або 4 замісниками Y, які можуть бути однакові або різні, де Y має вищенаведене значення, або R1 представляє піримідиніл, піразиніл, піридазиніл або триазиніл, і ці групи можуть бути заміщені 1-2 замісниками Y, які можуть бути однакові або різні, або R1 представляє п'ятичленне ароматичне гетероциклічне кільце з одним або двома гетероатомами з групи (N,O,S), які можуть бути однакові або різні, і це п'ятичленне ароматичне гетероциклічне кільце може бути заміщене 1-2 замісниками Y, які можуть бути однакові або різні, або R1 представляє нафтил,
- R2 представляє Н, розгалужений чи нерозгалужений C1-8 алкіл,С3-8 циклоалкіл, С3-8 алкеніл, С5-8 циклоалкеніл, причому ці групи можуть містити атом сірки, кисню або азоту,
- R3 представляє розгалужений чи нерозгалужений С2-8 алкіл, C1-8 алкокси, C5-8 циклоалкокси, С3-8 циклоалкіл, C5-10 біциклоалкіл, С6-10 трициклоалкіл, С3-8 алкеніл, С5-8 циклоалкеніл, причому ці групи можуть також містити один або більше гетероатомів з групи (O,N,S) і можуть бути заміщені гідроксигрупою, або 1-2 С1-3 алкільними групами, або 1-3 атомами фтору, або R3 представляє бензильну чи фенетильну групу, ароматичні кільця якої можуть бути заміщені 1-5 замісниками Z, які можуть бути однакові або різні, з групи С1-3 алкіл або алкокси, гідрокси, галоген, трифторметил, трифторметилтіо, трифторметокси, нітро, аміно, моно- або діалкіл(С1-2)-амін, моно- або діалкіл(С1-2)-амід, (С1-3)-алкоксикарбоніл, (С1-3)-алкілсульфоніл, диметилсульфамід, карбоксил, трифторметилсульфоніл, ціан, карбамоїл, сульфамоїл та ацетил, або R3 представляє фенільну чи піридильну групу, яка може бути заміщена 1-4 замісниками Z, де значення Z наведені вище, або R3 представляє піридинільну групу, або R3 представляє фенільну групу за умови, що R4 представляє атом галогену або ціан, карбамоїл, форміл, ацетил, трифторацетил, фторацетил, пропіоніл, сульфамоїл, метансульфоніл, метилсульфаніл або С1-4 алкільну групу, причому С1-4 алкільна група може бути заміщена 1-3 атомами фтору або бромом, хлором, йодом, ціаном або гідроксигрупою, або R3 представляє групу NR5R6 за умови, що R2 представляє атом водню або метильну групу, де
- R5 та R6 однакові або різні й представляють розгалужену чи нерозгалужену С1-4 алкільну групу, або R5 та R6 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну гетероциклічну групу з 4-10 атомами у кільці, яка містить один чи два гетероатоми з групи (N,O,S), що можуть бути однакові або різні, причому гетероциклічна група може бути заміщена С1-3 алкільною групою або гідроксигрупою, або R2 та R3 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену гетероциклічну групу з 4-10 атомами у кільці, яка містить один чи два гетероатоми з групи (N,O,S), що можуть бути однакові або різні, й може бути заміщена С1-3 алкільною групою або гідроксигрупою,
- R4 представляє атом водню чи галогену або ціан, карбамоїл, форміл, ацетил, трифторацетил, фторацетил, пропіоніл, сульфамоїл, метансульфоніл, метилсульфаніл або розгалужену чи нерозгалужену С1-4 алкільну групу, причому С1-4 алкільна група може бути заміщена 1-3 атомами фтору або бромом, хлором, йодом, ціаном або гідроксигрупою, та її стереоізомери та солі.
2. Сполука за п. 1, яка представляє 2-(2,4-дихлорфеніл)-N-(піперидин-1-іл)-1-(4-(трифторметил)феніл)-1Н-імідазол-4-карбоксамід, що має формулу XI:
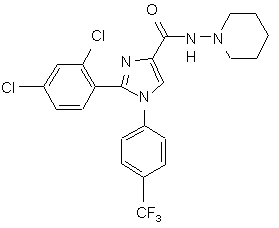 , (XI)
, (XI)
та її солі.
3. Фармацевтична композиція, яка містить фармацевтично діючу кількість принаймні одної зі сполук за п. 1 як діючу речовину.
4. Спосіб приготування фармацевтичної композиції за п. 3, який відрізняється тим, що сполуці за п. 1 надають форму, придатну для введення до організму.
5. Спосіб одержання сполук, що мають формулу (І), який відрізняється тим, що одержують сполуку, де R, R1-R3 мають значення, що наведені у п. 1, а R4 представляє атом водню або галогену або сульфамоїльну, метансульфонільну, метилсульфанільну або С1-4 алкільну групу, причому С1-4 алкільна група може бути заміщена 1-3 атомами фтору, шляхом реакції сполуки формули (II)
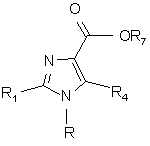 (ІІ)
(ІІ)
або сполуки формули (III)
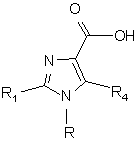 , (III)
, (III)
яку одержують шляхом ефірного гідролізу сполуки формули (II),
або формули (IV)
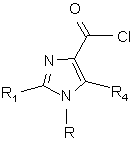 , (IV)
, (IV)
яку одержують реакцією сполуки формули (III) з галогенуючим агентом, наприклад тіонілхлоридом,
зі сполукою формули R2R3NH, яку переважно провадять у присутності органічної основи, наприклад діізопропілетиламіну або триетиламіну.
6. Спосіб одержання сполук, що мають формулу (II)
 , (II)
, (II)
де R4 представляє С1-4 алкільну групу, яка може бути заміщена 1-3 фторними замісниками, або R4 представляє атом галогену або ціано, формільну, ацетильну, трифторацетильну, фторацетильну, метилсульфанільну або пропіонільну групу, який відрізняється тим, що одержують сполуку, в якій R та R1 мають значення, що наведені у п. 1, a R7 представляє розгалужену або нерозгалужену алкільну групу (С1-4) або бензильну групу, шляхом реакції сполуки формули (II), де R4 - атом водню, зі сполукою формули R4'-X, де Х представляє відщеплювану групу, а R4' - алкільну групу С1-4, яка може бути заміщена 1-3 фторними замісниками або в якій R4' представляє атом галогену або ціано, формільну, ацетильну, трифторацетильну, фторацетильну, метилсульфанільну або пропіонільну групу, в присутності міцної ненуклеофільної основи.
7. Спосіб одержання сполук, що мають формулу (II)
 , (II)
, (II)
де R4 представляє розгалужену або нерозгалужену С1-4 алкільну групу, яка може бути заміщена 1-3 фторними замісниками, який відрізняється тим, що одержують сполуку, в якій R та R1 мають значення, що наведені у п. 1, a R7 представляє розгалужену або нерозгалужену алкільну групу (С1-4) або бензильну групу, шляхом реакції сполуки формули (V) або її таутомера
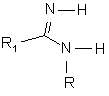 , (V)
, (V)
де R та R1 мають значення, що наведені у п. 1, зі сполукою формули (VI)
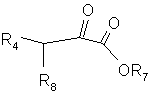 , (VI)
, (VI)
де R4 представляє розгалужену або нерозгалужену С1-4 алкільну групу, яка може бути заміщена 1-3 атомами фтору, R8 представляє так звану відщеплювану групу, а R7 представляє розгалужену або нерозгалужену алкільну групу (С1-4) або бензильну групу.
8. Сполуки формули (IX)
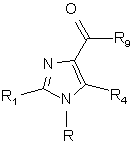 , (IX)
, (IX)
де R та R4 мають значення, що наведені у п. 1, R1 представляє фенільну або піридинільну групу, причому ці групи можуть бути заміщені 1-4 замісниками Y, що можуть бути однакові або різні, а R1 представляє піримідинільну, піразинільну, піридазинільну або триазинільну групи, які можуть бути заміщені 1-2 замісниками Y, що можуть бути однакові або різні, або R1 представляє п'ятичленну ароматичну гетероциклічну групу, що має один або два гетероатоми з групи (N,O,S), які можуть бути однакові або різні, причому ця п'ятичленна ароматична гетероциклічна група може бути заміщена 1-2 замісниками Y, що можуть бути однакові або різні, або R1 представляє нафтил, a R9 - гідроксигрупу, розгалужену або нерозгалужену алкокси (С1-4) групу, бензилоксигрупу або хлорний замісник.
9. Сполуки формули (X) та їхні таутомери
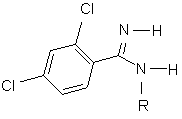 , (X)
, (X)
де R представляє 4-хлорфенільну, 4-бромфенільну або 4-(трифторметил)фенільну групу.
10. Застосування сполук за п. 1 для приготування фармацевтичної композиції для лікування розладів, пов'язаних з нейротрансмісією канабіноїдів.
11. Застосування за п. 10, яке відрізняється тим, що зазначеними розладами є такі психічні розлади, як психози, тривожність, депресія, дефіцит уваги, розлади пам'яті, пізнавальні розлади, розлади апетиту, опасистість, згубні звички, гіперсексуальність, наркозалежність, такі неврологічні розлади, як недоумство, дистонія, м'язова спастичність, дрижавка, травматичне пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, епілепсія, хвороба Гантінгтона, синдром Турета, церебральна ішемія, церебральна апоплексія, черепно-мозкова травма, удар, пошкодження хребта, нейрозапальні хвороби, бляшковий склероз, вірусний енцефаліт, хвороби, пов'язані з демієлінізацією, а також для лікування болів, включаючи невропатичні больові прояви, та інших хвороб, що пов'язані з нейротрансмісією канабіноїдів, як септичний шок, глаукома, рак, діабет, блювання, нудота, астма, респіраторні захворювання, шлунково-кишкові розлади, виразка шлунку, діарея та серцево-судинні розлади.
Текст
1. Сполука формули (І) UA (21) 20040402980 (22) 17.09.2002 (24) 15.12.2006 (86) PCT/EP02/10434, 17.09.2002 (31) 01203851.9 (32) 21.09.2001 (33) EP (46) 15.12.2006, Бюл. № 12, 2006 р. (72) Крузе Корнеліс Г., NL, Ланге Йозефус Х.м., NL, Герреманс Арнольдус Г.й., NL, Ван Стюйвенберг Герман, NL (73) СОЛЬВЕ ФАРМАС'ЮТІКАЛЗ Б.В., NL (56) US 5616601 A, 01.04.1997 WO 0063204 A, 26.10.2000 WO 0046209 A, 10.08.2000 CHEMICAL ABSTRACTS, vol. 133, no. 18, 30.10.2000, abstract no. 252124 TETRAHEDRON LETTERS, vol. 29, no. 36, 1988, pages 4607-4610 CHEM. PHARM. BULL, vol. 47, no. 6, 1999, pages 857-868 JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY. WASHINGTON, US, vol. 40, 1997, pages 1634-1647 JOURNAL OF MEDICINAL CHEMISTRY, vol. 43, no. 16, 2000, pages 3168-3185 2 (19) 1 C2 (54) ПОХІДНІ 1Н-ІМІДАЗОЛУ, ЩО МАЮТЬ АГОНІСТИЧНУ АКТИВНІСТЬ ЩОДО СВ1, ЧАСТКОВО АГОНІСТИЧНУ АКТИВНІСТЬ ЩОДО СВ1 АБО АНТАГОНІСТИЧНУ АКТИВНІСТЬ ЩОДО СВ1, СПОСІБ ЇХ ОДЕРЖАННЯ (ВАРІАНТИ), ПРОМІЖНІ СПОЛУКИ, ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ ТА СПОСІБ ЇЇ ПРИГОТУВАННЯ 3 77440 4 або розгалужену чи нерозгалужену С1-4 алкільну й може бути заміщена С1-3 алкільною групою або групу, причому С1-4 алкільна група може бути загідроксигрупою, міщена 1-3 атомами фтору або бромом, хлором, - R4 представляє атом водню чи галогену або ціан, йодом, ціаном або гідроксигрупою, карбамоїл, форміл, ацетил, трифторацетил, фто- R1 представляє феніл або піридиніл, причому ці рацетил, пропіоніл, сульфамоїл, метансульфоніл, групи можуть бути заміщені 1, 2, 3 або 4 замісниметилсульфаніл або розгалужену чи нерозгалужеками Y, які можуть бути однакові або різні, де Y ну С1-4 алкільну групу, причому С1-4 алкільна група має вищенаведене значення, або R1 представляє може бути заміщена 1-3 атомами фтору або бропіримідиніл, піразиніл, піридазиніл або триазиніл, і мом, хлором, йодом, ціаном або гідроксигрупою, ці групи можуть бути заміщені 1-2 замісниками Y, та її стереоізомери та солі. які можуть бути однакові або різні, або R1 пред2. Сполука за п.1, яка представляє 2-(2,4ставляє п'ятичленне ароматичне гетероциклічне дихлорфеніл)-N-(піперидин-1-іл)-1-(4кільце з одним або двома гетероатомами з групи (трифторметил)феніл)-1Н-імідазол-4-карбоксамід, (N,O,S), які можуть бути однакові або різні, і це що має формулу XI: O п'ятичленне ароматичне гетероциклічне кільце Cl N N може бути заміщене 1-2 замісниками Y, які можуть H N бути однакові або різні, або R1 представляє нафCl N тил, - R2 представляє Н, розгалужений чи нерозгалужений C1-8 алкіл,С3-8 циклоалкіл, С3-8 алкеніл, С5-8 циклоалкеніл, причому ці групи можуть містити CF , (XI) атом сірки, кисню або азоту, та її солі. - R3 представляє розгалужений чи нерозгалужений 3. Фармацевтична композиція, яка містить фармаС2-8 алкіл, C1-8 алкокси, C5-8 циклоалкокси, С3-8 цицевтично діючу кількість принаймні одної зі сполук клоалкіл, C5-10 біциклоалкіл, С6-10 трициклоалкіл, за п.1 як діючу речовину. С3-8 алкеніл, С5-8 циклоалкеніл, причому ці групи 4. Спосіб приготування фармацевтичної композиможуть також містити один або більше гетероатоції за п.3, який відрізняється тим, що сполуці за мів з групи (O,N,S) і можуть бути заміщені гідрокп.1 надають форму, придатну для введення до сигрупою, або 1-2 С1-3 алкільними групами, або 1-3 організму. атомами фтору, або R3 представляє бензильну чи 5. Спосіб одержання сполук, що мають формулу фенетильну групу, ароматичні кільця якої можуть (І), який відрізняється тим, що одержують сполубути заміщені 1-5 замісниками Z, які можуть бути ку, де R, R1-R3 мають значення, що наведені у п.1, однакові або різні, з групи С1-3 алкіл або алкокси, а R4 представляє атом водню або галогену або гідрокси, галоген, трифторметил, трифторметилсульфамоїльну, метансульфонільну, метилсультіо, трифторметокси, нітро, аміно, моно- або діалфанільну або С1-4 алкільну групу, причому С1-4 алкіл(С1-2)-амін, моно- або діалкіл(С1-2)-амід, (С1-3)кільна група може бути заміщена 1-3 атомами алкоксикарбоніл, (С1-3)-алкілсульфоніл, диметилфтору, шляхом реакції сполуки формули (II) сульфамід, карбоксил, трифторметилсульфоніл, O ціан, карбамоїл, сульфамоїл та ацетил, або R3 OR7 представляє фенільну чи піридильну групу, яка N може бути заміщена 1-4 замісниками Z, де значенR4 R1 N ня Z наведені вище, або R3 представляє піридиніR (ІІ) льну групу, або R3 представляє фенільну групу за або сполуки формули (III) умови, що R4 представляє атом галогену або ціан, O карбамоїл, форміл, ацетил, трифторацетил, фтоOH рацетил, пропіоніл, сульфамоїл, метансульфоніл, N метилсульфаніл або С1-4 алкільну групу, причому R4 R1 N С1-4 алкільна група може бути заміщена 1-3 атомами фтору або бромом, хлором, йодом, ціаном R , (III) або гідроксигрупою, або R3 представляє групу яку одержують шляхом ефірного гідролізу сполуки NR5R6 за умови, що R2 представляє атом водню формули (II), або метильну групу, де або формули (IV) - R5 та R6 однакові або різні й представляють розO галужену чи нерозгалужену С1-4 алкільну групу, Cl N або R5 та R6 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, R4 R1 N моноциклічну або біциклічну гетероциклічну групу R , (IV) з 4-10 атомами у кільці, яка містить один чи два яку одержують реакцією сполуки формули (III) з гетероатоми з групи (N,O,S), що можуть бути одгалогенуючим агентом, наприклад тіонілхлоридом, накові або різні, причому гетероциклічна група зі сполукою формули R2R3NH, яку переважно проможе бути заміщена С1-3 алкільною групою або вадять у присутності органічної основи, наприклад гідроксигрупою, або R2 та R3 разом з атомом азодіізопропілетиламіну або триетиламіну. ту, до якого вони приєднані, утворюють насичену 6. Спосіб одержання сполук, що мають формулу або ненасичену гетероциклічну групу з 4-10 ато(II) мами у кільці, яка містить один чи два гетероатоми з групи (N,O,S), що можуть бути однакові або різні, 3 5 77440 6 O O OR7 R9 N R1 N R4 N R , (II) де R4 представляє С1-4 алкільну групу, яка може бути заміщена 1-3 фторними замісниками, або R4 представляє атом галогену або ціано, формільну, ацетильну, трифторацетильну, фторацетильну, метилсульфанільну або пропіонільну групу, який відрізняється тим, що одержують сполуку, в якій R та R1 мають значення, що наведені у п.1, a R7 представляє розгалужену або нерозгалужену алкільну групу (С1-4) або бензильну групу, шляхом реакції сполуки формули (II), де R4 - атом водню, зі сполукою формули R4'-X, де Х представляє відщеплювану групу, а R4' - алкільну групу С1-4, яка може бути заміщена 1-3 фторними замісниками або в якій R4' представляє атом галогену або ціано, формільну, ацетильну, трифторацетильну, фторацетильну, метилсульфанільну або пропіонільну групу, в присутності міцної ненуклеофільної основи. 7. Спосіб одержання сполук, що мають формулу (II) R1 R , (IX) де R та R4 мають значення, що наведені у п.1, R1 представляє фенільну або піридинільну групу, причому ці групи можуть бути заміщені 1-4 замісниками Y, що можуть бути однакові або різні, а R1 представляє піримідинільну, піразинільну, піридазинільну або триазинільну групи, які можуть бути заміщені 1-2 замісниками Y, що можуть бути однакові або різні, або R1 представляє п'ятичленну ароматичну гетероциклічну групу, що має один або два гетероатоми з групи (N,O,S), які можуть бути однакові або різні, причому ця п'ятичленна ароматична гетероциклічна група може бути заміщена 1-2 замісниками Y, що можуть бути однакові або різні, або R1 представляє нафтил, a R9 - гідроксигрупу, розгалужену або нерозгалужену алкокси (С1-4) групу, бензилоксигрупу або хлорний замісник. 9. Сполуки формули (X) та їхні таутомери CI O N OR7 N R1 R4 R , (II) де R4 представляє розгалужену або нерозгалужену С1-4 алкільну групу, яка може бути заміщена 1-3 фторними замісниками, який відрізняється тим, що одержують сполуку, в якій R та R1 мають значення, що наведені у п.1, a R7 представляє розгалужену або нерозгалужену алкільну групу (С1-4) або бензильну групу, шляхом реакції сполуки формули (V) або її таутомера N H N H R , (V) де R та R1 мають значення, що наведені у п.1, зі сполукою формули (VI) O R4 R8 O OR7 , (VI) де R4 представляє розгалужену або нерозгалужену С1-4 алкільну групу, яка може бути заміщена 1-3 атомами фтору, R8 представляє так звану відщеплювану групу, а R7 представляє розгалужену або нерозгалужену алкільну групу (С1-4) або бензильну групу. 8. Сполуки формули (IX) Винахід стосується групи нових похідних 1Німідазолу, способів одержання зазначених сполук та фармаційних композицій, що містять одну або кілька таких сполук в якості діючих речовин Ці похідні 1Н-імідазолу є сильнодіючими агоністами рецепторів СВ1, частковими агоністами або H N CI N R1 R4 N H R , (X) де R представляє 4-хлорфенільну, 4бромфенільну або 4-(трифторметил)фенільну групу. 10. Застосування сполук за п.1 для приготування фармацевтичної композиції для лікування розладів, пов'язаних з нейротрансмісією канабіноїдів. 11. Застосування за п.10, яке відрізняється тим, що зазначеними розладами є такі психічні розлади, як психози, тривожність, депресія, дефіцит уваги, розлади пам'яті, пізнавальні розлади, розлади апетиту, опасистість, згубні звички, гіперсексуальність, наркозалежність, такі неврологічні розлади, як недоумство, дистонія, м'язова спастичність, дрижавка, травматичне пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, епілепсія, хвороба Гантінгтона, синдром Турета, церебральна ішемія, церебральна апоплексія, черепно-мозкова травма, удар, пошкодження хребта, нейрозапальні хвороби, бляшковий склероз, вірусний енцефаліт, хвороби, пов'язані з демієлінізацією, а також для лікування болів, включаючи невропатичні больові прояви, та інших хвороб, що пов'язані з нейротрансмісією канабіноїдів, як септичний шок, глаукома, рак, діабет, блювання, нудота, астма, респіраторні захворювання, шлунково-кишкові розлади, виразка шлунку, діарея та серцево-судинні розлади. антагоністами й придатні для лікування психічних та нервових розладів, а також інших захворювань, пов'язаних з нейротрансмісією канабіноідів. Канабіноіди знаходяться у індійських коноплях Cannabis sativa L й використовуються у медицині протягом століть [Mechoulam R, Fegenbaum J J, 7 77440 8 Prog Med Chem 1987, 24, 159]. Втім, лише в останJagerovic N., Exp. Opin.Ther.Patents 2000, 10, 1529; ньому десятиріччі досліди канабіноідів висвітлили Pertwee R.G., Gut 2001, 48, 859]. ключові дані щодо рецепторів канабіноідів та їхніх Нами несподівано виявлено, що потужний (ендогенних) агоністів та антагоністів Відкриття та агонізм, частковий агонізм або антагонізм до ренаступне клонування двох різних підтипів рецепцепторів канабіноїдів СВ1 виявляють нові похідні торів канабіноідів (СВ1 та СВ2) стимулювали пошу1Н-імідазолу формули (І), їхні пролікарські форми ки нових антагоністів рецепторів канабіноідів та солі [Munro S et al., Nature 1993, 365, 61, Matsuda L. A, Bonner Τ.I., Cannabinoid Receptors, Pertwee R. G. Ed., 1995, 117, Academic Press, London]. Крім того, (I) фармаційні фірми зацікавилися розробкою ліків дляхв.ороб, пов'язаних з розладами канабіноідної системи Велике поширення рецепторів СВ1 у мозде ку поряд з суворо периферійною локалізацією ре- R - феніл, тієніл, 2-піридиніл, 3-піридиніл, 4цепторів СВ2 робить рецептори СВ1 дуже привабпіридиніл, піримідиніл, піразиніл, піридазиніл або ливою молекулярною мішенню для розробки триазиніл, причому ці групи можуть бути заміщені спрямованих на ЦНС ліків від психічних та нерво1, 2, 3 або 4 замісниками Y, які можуть бути однавих розладів [Consroe Ρ, Neurobiology of Disease кові або різні, з групи, що містить С1-3-алкіл або 1998, 5, 534, Pop Ε., Curr Opin in CPNS алкоксі, гідроксі, галоген, трифторметил, трифтоInvestigational Drugs 1999, 1, 587, Greenberg D. A., рметилтіо, трифторметилоксі, нітро, аміно, моноDrug News Perspect 1999, 12, 458, Pertwee R.G., або діалкіл(С1-2)-амін, моно- або діалкіл(С1-2)-амід, Progress in Neurobiology, 2001, 63, 569]. Наразі (С1-3)-алкоксікарбоніл, карбоксил, ціан, карбамоїл відомі кілька типів антагоністів рецепторів СВ1. та ацетіл, або R представляє нафтил, за умови, Фірма "Санофі" встановила, що деякі з її діарилпіщо, якщо R - 4-піридиніл, R4 представляє атом разолів діють як селективні антагоністи рецепторів галогену або ціан, карбамоїл, формил, ацетил, СВ1. Прикладом може бути SR-141716A, який затрифторацетил, фтор ацетил, пропіонил, сульфараз проходить другу фазу клінічних випробувань моїл, метансульфоніл, метилсульфаніл або розгапроти психічних розладів [Dutta А. K. et al., Med лужену чи нерозгалужену С1-4 алкільну групу, приChem Res 1994, 5, 54, Lan R. et al, J. Med Chem чому С1-4 алкільна група може бути заміщена 1-3 1999, 42, 769, Nakamura-Palacios Ε. Μ. et al., CNS атомами фтору або бромом, хлором, йодом, ціаDrug Rev 1999, 5, 43]. CP-272871 - це похідне піраном або гідроксігрупою, золу, подібне до SR-141716А, але менш сильноді- R1 представляє феніл або піридиніл, причому юче й менш селективне до підтипів рецепторів ці групи можуть бути заміщені 1, 2, 3 або 4 замісСВ1, ніж SR-141716А [Meschler J P et al, Biochem никами Y, які можуть бути однакові або різні, де Υ Pharmacol 2000, 60, 1315]. Встановлено, що антамає вищенаведене значення, або R1 представляє гоністами рецепторів СВ1 є аміноалкіліндоли. Припіримідиніл, піразиніл, піридазиніл або триазиніл і кладом є іодоправадолін (АМ-630), впроваджений ці групи можуть бути заміщені 1 -2 замісниками Υ, 1995р. АМ-630 є антагоністом рецепторів СВ1, але які можуть бути однакові або різні, або R1 предіноді поводиться як частковий агоніст [Hosohata K. ставляє п'ятичленне ароматичне гетероциклічне et al, Life Sc. 1997, 61, PL115]. Пізніше дослідники кільце з одним або двома гетероатомами з групи фірми "Елі Лілі" описали арил-ароїлзаміщені бен(N,O,S), які можуть бути однакові або різні, і це зофурани як селективні антагоністи рецепторів п'ятичленне ароматичне гетероциклічне кільце СВ1 (наприклад, LY-320135) [Felder С. С. et al., може бути заміщене 1-2 замісниками Y, які можуть Pharmacol Exp Ther 1998, 284, 291]. Нещодавно бути однакові або різні, або R1 представляє нафз'явилися повідомлення, що 3-алкіл-5,5'тил, діфенілімідазолідиндіони - це ліганди рецепторів - R2 представляє Н, розгалужений чи нерозгаканабіноідів з ознаками антагонізму до канабіноілужений C1-8 алкіл,С3-8 циклоалкіл, С3-8 алкеніл, С5дів [Капуопуо Μ. et al., Bioorg Med Chem Lett 1999, 8 циклоалкеніл, причому ці групи можуть містити 9, 2233]. Фірма "Авентіс-Фарма" заявила аналоги атом сірки, кисню або азоту, діарилметиленазетидіну як антагоністи рецепторів - R3 представляє розгалужений чи нерозгалуСВ1 [Vsgnani S. et al., FR 2783246, Chem Abstr жений С2-8 алкіл, С1-8 алкоксі, С5-8 циклоалкоксі, С32000, 132,236982]. Трициклічні піразоли заявлені 8 циклоалкіл, С5-10 біциклоалкіл, С6-10 трициклоалфірмою "Санофі-Синтелабо" як антагоністі СВ1 кіл, С3-8 алкеніл, С5-8 циклоалкеніл, причому ці гру[BarthF et al., WO 0132663, 2001, Chem Abstr 2001, пи можуть також містити один або більше гетероа134, 340504]. Цікаво, що багато з антагоністів ретомів з групи (O,N,S) і можуть бути заміщені цепторів СВ1 поводяться як зворотні агоністи in гідроксігрупою, або 1-2 С1-3 алкільними групами, vitro [Landsman R. S. et al., Eur J Pharmacol 1997, або 1-3 атомами фтору, або R3 представляє бен334, R1]. В останніх публікаціях містяться непогані зильну чи фенетильну групу, ароматичні кільця огляди сучасного стану досліджень у галузі канаякої можуть бути заміщені 1-5 замісниками Z, які біноідів [Mechoulam R. et al., Prog Med Chem 1998, можуть бути однакові або різні, з групи С1-3 алкіл 35, 199, Lambert D.Μ., Curr Med Chem 1999, 6, 635, або алкоксі, гідроксі, галоген, трифторметил, триMechoulam R. et al., Eur J Pharmacol 1998, 359, 1, фторметилтіо, трифторметоксі, нітро, аміно, моноWilliamson Ε. Μ. and Evans F.J., Drugs 2000, 60, або діалкіл(С1-2)-амін, моно- або діалкіл(С1-2)-амід, 1303, Pertwee R. G, Addiction Biology 2000, 5, 37, (С1-3)-алкоксікарбоніл, (С1-3)-алкілсульфоніл, дімеRobson Ρ., Br. J. Psychiatry 2001, 178, 107, Pertwee тилсульфамід, карбоксил, трифторметилсульфоR.G., Prog.Neurobiol., 2001, 63, 569, Goya P. and ніл, ціан, карбамоїл, сульфамоїл та ацетил, або R 3 9 77440 10 представляє фенільну чи піридильну групу, яка рецептори СВ1 канабіноїдів з [3Н]СР-55,940 в якоможе бути заміщена 1-4 замісниками Z, де значенсті радіоліганду. Після інкубації свіжо приготованих ня Ζ наведені вище, препаратів клітинних мембран з [3Н]-лігандом з або R3 представляє піридинільну групу, або R3 доданням сполук за винаходом або без них зв'япредставляє фенільну групу за умови, що R4 заний та вільний ліганди розділяли фільтрацією на представляє атом галогену або ціан, карбамоїл, фільтрах із скловолокна. Радіоактивність фільтрів формил, ацетил, трифторацетил, фторацетил, вимірювали лічильником рідинних сцинтиляцій. пропіонил, сульфамоїл, метансульфоніл, метилАнтагоністична активність сполук за винахосульфаніл або С1-4 алкільну групу, причому С1-4 дом щодо СВ1 канабіноїдів визначалася функціоалкільна група може бути заміщена 1-3 атомами нальним дослідженням клітин яєчників китайського фтору або бромом, хлором, йодом, ціаном або хом'яка, до яких були стійко впроваджені людські гідроксігрупою, рецептори СВ1. Аденілилциклаза стимулювалася або R3 представляє групу NR5R6 за умови, що форсколином та вимірювалася шляхом квантифіR2 представляє атом водню або метильну групу, кації кількості циклічно накопиченого АМФ. Супутде ня активація рецепторів СВ1 агоністами рецепторів - R5 та R6 однакові або різні й представляють СВ1 (СР-55940, (R)-WIN-55,212-2) може пригнічурозгалужену чи нерозгалужену С1-4 алкільну групу, вати викликане форсколином накопичення цАМФ у або R5 та R6 разом з атомом азоту, до якого вони залежності від концентрації. Ця реакція за посереприєднані, утворюють насичену або ненасичену, дництвом рецепторів СВ1 може антагонізуватися моноциклічну або біциклічну гетероциклічну групу антагоністами рецепторів СВ1, такими, як сполуки з 4-10 атомами у кільці, яка містить один чи два за винаходом. гетероатоми з групи (N,O,S), що можуть бути одАгоністичну або частково агоністчну активність накові або різні, причому гетероциклічна група сполук за винаходом до канабіноїдів можна визнаможе бути заміщена С1-3 алкільною групою або чити за опублікованими методиками, як от визнагідроксігрупою, або R2 та R3 разом з атомом азоту, чення канабіміметичної активності in vivo [Wiley до якого вони приєднані, утворюють насичену або J.L. et al., J.Pharmacol.Exp.Ther. 2001, 296, 1013]. ненасичену гетероциклічну групу з 4-10 атомами у Винахід стосується як рацематів, так і сумішей кільці, яка містить один чи два гетероатоми з групи діастереометрів та окремих стереоізомерів сполук (N,O,S), що можуть бути однакові або різні, й може формули (І). бути заміщена С1-3 алкільною групою або гідроксігСполукам за винаходом можна надавати рупою, форм, придатних до введення, відомими способа- R4 представляє атом водню чи галогену або ми з участю допоміжних речовин та/або рідких або ціан, карбамоїл, формил, ацетил, трифторацетил, твердих носіїв. фторацетил, пропіонил, сульфамоїл, метансульШляхи синтезу сполук за винаходом можуть фоніл, метилсульфаніл або розгалужену чи нерозбути такими: галужену С1-4 алкільну групу, причому С 1-4 алкільШлях синтезу А на група може бути заміщена 1-3 атомами фтору Етап 1: ефірний гідроліз сполуки формули (II), або бромом, хлором, йодом, ціаном або гідроксігде R7 - розгалужена або нерозгалужена (С1-4) алкірупою. льна група або бензильна група Завдяки потужній агоністичній, частково агоністичній або антагоністичній активності щодо СВ1 (II) сполуки за винаходом можуть використовуватися для лікування психічних розладів, як от психози, збентеженість, депресія, дефіцит уваги, розлади Ця реакція дає сполуку формули (III) пам'яті та апетиту, опасистість, алкоголізм, гіперсексуальність, наркозалежність, нервових розладів, як от нейродегенеративні розлади, недоумст(III) во, дистонія, м'язова еластичність, дрижавка, епілепсія, розсіяний склероз, травматичне пошкодження мозку, інсульт,хв.ороба Паркінсоде R, R1 та R4 мають значення, що наведені на,хв.ороба Альцгеймера,хв.ороба Гантінгтона, вище. синдром Турета, церебральна ішемія, церебральПроміжні сполуки формули (II), де R7 предстана апоплексія, черепно-мозкова травма, пошковляє розгалужену або нерозгалужену (С1-4) дження хребта, нейрозапалювальніхв.ороби, бляалкільну групу або бензильну групу, можна шковий склероз, вірусний енцефаліт,хв.ороб, одержати відомими способами, наприклад: пов'язаних з деміелінізацією, а також для лікуванa) I.K.Khanna et al, J.Med.Chem. 2000, 43, ня болів, включаючи невропатичні больові прояви, 3168-3185 та іншиххв.ороб, що пов'язані з нейротрансмісією b) N.Kudo et al., Chem.Pharm.Bull. 1999, 47, канабіноїдів, як от септичний шок, глаукома, рак, 857-868 діабет, блювання, нудота, шлунково-кишкові розc) K.Tsuji et al., Chem.Pharm.Bull. 1997, 45, 987лади, виразка шлунку, діарея та серцево-судинні 995 розлади. d) I.K.Khanna et al., J.Med.Chem. 1997, 40, Спорідненість сполук за винаходом до рецеп1634-1647 торів СВ1 канабіноїдів визначалася за допомогою e) M.Guillemet et al., Tetrahedron Lett. 1995, 36, препаратів з мембран клітин яєчників китайського 547-548 хом'яка, до яких стійко трансфектували людські 11 77440 12 Етап 2: реакція сполуки формули (III) зі сполуде R4 представляє розгалужену або нерозгакою формули R2R3NH, де R2 та R3 мають значенлужену С1-4 алкільну групу, яка може бути заміщеня, що наведені вище, шляхом активації та зв'язуна 1-3 фторними замісниками, R, R1 мають знавання, наприклад, утворення активного ефіру, або чення, що наведені вище, a R7 представляє у присутності зв'язуючої речовини, як от ДКЦ, розгалужену або нерозгалужену С1-4 алкільну груГБТУ, БОФ або подібних. Ця реакція дає цільове пу або бензильну групу, можна синтезувати реакпохідне 1Н-імідазолу формули (І). цією сполуки формули (V) або и таутомера (Детальніше про способи активування та зв'язування [див. M.Bodanszky and A.Bodanszky. The (V) Practice of Peptide Synthesis, Springer-Verlag, New York 1994; ISBN: 0-387-57505-7]). Або ж сполука де R та R1 мають значення, що наведені вище, формули (III) реагує з галогенуючим агентом, назі сполукою формули (VI) приклад, тіонилхлоридом (SOCl3). Ця реакція дає відповідний карбонілхлорид (IV) (VI) (IV) Реакція сполуки формули (IV) зі сполукою формули, R2R3NH, де R2 та R3 мають значення, що наведені вище, дає похідне 1Н-імідазолу формули (І). Цю реакцію переважно провадять у присутності органічної основи, наприклад, діізопропилетиламіну (ДІПЕА) або триетиламіну. Або ж сполука формули (II) вступає до реакції амідування зі сполукою формули R2R3NH, де R2 та R3 мають значення, що наведені вище, даючи похідне 1Н-імідазолу формули (І). Шлях синтезу В Реакція сполуки формули (II), де R4 представляє водень, a R, R1 та R7 мають значення, що наведені вище для сполуки (II), зі сполукою загальної формули R4’-X, де X представляє відщеплювану групу, a R4’ – С1-4 алкільну групу, яка може бути заміщена 1-3 атомами фтору, або IV представляє ціано, формильну, ацетильну, трифторацетильну, фторацетильну, метилсульфанільну або пропіонільну групу, або атом водню Реакцію провадять у присутності міцної ненуклеофільної основи, наприклад, діізопропиламіду літію (ДАЛ), переважно у безводних умовах в інертному органічному розхчиннику, наприклад, тетрогідрофурані, з одержанням сполуки формули (II) (II) де R, R1 та R7 мають значення, що наведені вище, a R4 представляє С1-4 алкільну групу, яка може бути заміщена 1-3 атомами фтору, або R4 представляє ціано, формильну, ацетильну, трифторацетильну, фторацетильну, метилсульфанільну або пропіонильну групу, або атом водню. Сполуки загальної формули (II), одержані шляхом синтезу В, можна перетворити на сполуки загальної формули (І) за способами, що описані для етапу 1 або етапу 2 шляху синтезу А (див вище) Шлях синтезу С Сполуки формули (II) (II) де R4 представляє розгалужену або нерозгалужену С1-4 алкільну групу, яка може бути заміщена 1-3 атомами фтору, R8 представляє відщеплювану групу, наприклад, бромний замісник, a R7 представляє розгалужену або нерозгалужену С1-4 алкільну групу або бензильну групу. Реакцію переважно провадять в органічному розчиннику, наприклад, 2-пропанолі або N-метил-2-піролідиноні (НМЛ). Додання під час реакції кислоти типу трифтороцтової (ТФО) може сприяти утворенню сполук формули (II). (Докладніше про поняття відщеплюваної групи [див. М.В.Smith and J.March: Advanced organic chemistry, p.275, 5th ed. (2001) John Wiley & Sons, New York, ISBN: 0-471-58589-0]). Сполуки загальної формули (II), одержані шляхом синтезу С, можна перетворити на сполуки загальної формули (І) за способами, що описані для етапу 1 або етапу 2 шляху синтезу А (див. вище). Сполуки формули (VI) за винаходом можна одержати за способом, відомим, наприклад, [з P.Seifert et al., Helv.Chim.Acta, 1950, 33, 725] Шлях синтезу D Реакція сполуки формули (II) (II) де R4 представляє метильну групу, R, R1 мають значення, що наведені вище, a R7 представляє розгалужену або нерозгалужену С14 алкільну групу або бензильну групу, з регіоселективною бромуючою сполукою, наприклад, Nбромсукцинімідом (НБС), в органічному розчиннику типу CCl4, у присутності ініціатору вільного радикалу, як от дібензоїлпероксид, дає сполуку формули (VII) (VII) де R, R1 та R7 мають значення, що наведені вище. Реакція сполуки формули (VII) (аналогічно зі способом, [що описаний у Mathews W.B. et al., J.Label.Compds.Radiopharm 1999, 42, 589]), наприклад, з RCl, ΚΘ, KF або KCN дає сполуку формули (VIII) 13 77440 14 тіонилхлориду, нагрівають суміш при температурі флегми 1 годину, концентрують у вакуумі й одер(VIII) жують сирий 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)1Н-імідазол-4-карбонилхлорид. Частина D: 919мг (2,29ммоля) 1-(4де R, R1 та R7 мають значення, що наведені хлорфеніл)-2-(2,4-діхлорфеніл)-1Н-імідазол-4вище, a Nu представляє хлорну, йодну, фторну карбонилхлориду, 0,469г (4,69ммоля) 1або ціаногрупу. Реакцію переважно провадять у амінопіперидину та 0,363г (3,59ммоля) триетилаприсутності слабкої основи типу NaHCO3 або у міну розчиняють у діхлорметані й перемішують 1 присутності краун-етеру або криптанду. (Докладгодину при кімнатній температурі. Суміш тричі ніше про краун-етери та криптанди [див.: MB.Smith промивають по 20мл насиченого водного розчину th and J.March: Advanced organic chemistry, p.105, 5 NaHCO3, сушать над Na2SO4, концентрують у ваed. (2001) John Wiley & Sons, New York, ISBN: 0куумі й далі очищують колоночною хроматографі471-58589-0]). єю (етилацетат, силікагель), одержуючи 356мг 1Сполуки загальної формули (VII) або (VIII), (4-хлорфеніл)-2-(2,4-діхлорфеніл)-N-(піперидин-1одержані шляхом синтезу , можна перетворити на іл)-1Н-імідазол-4-карбоксаміду (вихід 26% відноссполуки загальної формули (І) аналогічно спосоно етил-1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-1Нбам, що описані для етапу 1 або етапу 2 шляху імідазол-4-карбоксилату). синтезу А (див. вище). Mac-спектрометрія (МС) 449. Приклад 1 Аналогічним чином одержують Частина А: До розчину 1М 2 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-Nбіс(триметилсілил)аміду натрію в 70мл ТГФ дода(піролідин-1-іл)-1Н-імідазол-4-карбоксамід МС 435. ють по краплинах розчин 8,86г (69,5ммолів) 43 N-(t-бутоксі)-1-(4-хлорфеніл)-2-(2,4хлоранілину в безводному ТГФ у атмосфері азоту діхлорфеніл)-1H-імідазол-4-карбоксамід МС 438. Суміш перемішують 20хв. і додають розчин 12г 4. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-N(70ммолів) 2,4-діхлорбензонітрилу в ТГФ. Одерфеніл-1Н-імідазол-4-карбоксамід Μ С442. жану суміш перемішують усю ніч, виливають до 5 1-(4-хлорфеніл)-N-циклогексил-2-(2,4400мл крижаної води та екстрагують діхлорметадіхлорфеніл)-1H-імідазол-4-карбоксамід МС 448. ном, сушать над Na2SО4 і концентрують у вакуумі з 6 N-бензил-1-(4-хлорфеніл)-2-(2,4одержанням 15,7г жовтої олії Кристалізація з судіхлорфеніл)-N-метил-1H-імідазол-4-карбоксамід міші діхлорметан-гептан і наступне промивання МС 470. метил-трет-бутилетером дають 8,66г N-(47. 1-[1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-4хлорфеніл)-2,4-діхлорбензол-карбоксамідину (ви(1Н-імідазоліл)карбоніл]гексагідро-1Н-азепш МС хід 42%) у вигляді жовтої твердої маси Точка топ448. лення (ТТ) 93-95°С 8. 2-(4-хлорфеніл)-1-(2,4-діхлорфеніл)-NАналогічним чином одержують: (піперидін-1-іл)-1Н-імідазол-4-карбоксамід (одерN-(4-бромфеніл)-2,4жаний з 2,4-діхлоанілину та 4-хлорбензонітрилу) діхлорбензолкарбоксамідин ТТ 117-119°С. МС 449. Частина В: Суміш 2,00г (6,68ммолів) N-(49. N-(t-бутоксі)-2-(4-хлорфеніл)-1-(2,4хлорфеніл)-2,4-діхлорбензолкарбоксамідину, 2,65г діхлорфеніл)-1Н-імідазол-4-карбоксамід (одержа(13,6ммолів) етил-3-бром-2-оксопропаноату та ний з 2,4-діхлоранілину та 4-хлорбензонітрилу) 1,12г (13,3ммолів) Nа2СО3 у 2-пропанолі переміМС 438. шують при температурі флегми 20 годин Після Приклад 10 охолодження до кімнатної температури суміш конЧастина А: 2,30г (22,8ммоля) діізопропиламіну центрують у вакуумі, осад суспендують у діхлордодають по краплинах до 100мл безводного ТГФ в метані, тричі промивають водою по 50мл і тричі атмосфері азоту при 0°С. Додають по краплинах розсолом по 50мл. Водні фази екстрагують діхло7,34мл (18,4ммолів) 2,5Μ розчину n-BuLi в гексані. рметаном. Об'єднані органічні фази сушать над Одержаний розчин охолоджують до -78°С. ДодаNa2SO4 і концентрують у вакуумі, одержуючи 2,0г ють по краплинах 6,0г (15,2мл) розчину етил-2-(4сирого продукту. Далі продукт очищують колоночхлорфеніл)-1-(2,4-діхлорфеніл)-1Н-імідазол-4ною хроматографією (силікагель, гептан/ЕtOАс карбоксилату в безводному ТГФ. Колір суміші змі90:10обc.%), одержуючи 0,759г етил-1-(4нюється з жовтого на пурпурово-коричневий. Сухлорфеніл)-2-(2,4-діхлорфеніл)-1Н-імідазол-4міш підігрівають з перемішуванням до -40°С, охокарбоксилату (вихід 29%) у вигляді жовтої олії, яка лоджують до -78°С й дають відстоятися 30 хвилин. з плином часу повільно твердне. Точка топлення Додають по краплинах 6,44г (45,4ммолів) метил+ 1 150-152°С, мас-спектрометрія 395 (МН ), Н-ЯМР йодиду й перемішують одержаний розчин 30 хви(400МГц, CDCl3) δ 7,91 (s, 1H), 7,49 (dd, J=8Гц, лин при -78°С, після чого дають досягти кімнатної J=2Гц, 1H), 7,29-7,36 (m, 4H), 7,07 7,49 (dt, J=8Гц, температури. Одержаний розчин охолоджують J=2Гц, 2H), 4,44 (q, J=7Гц, 2H), 1,42 (t, J=7Гц, 3 Η). водним розчином NH4CI, додають діетилетер, суЧастина С: 0,810г (2,06ммоля) етил-1-(4шать органічну фазу над MgSO4, фільтрують та хлорфеніл)-2-(2,4-діхлорфеніл)-1Н-імідазол-4концентрують у вакуумі, одержуючи 6,4г олії. Олію карбоксилату та 0,173г LiOH (7,20ммолів) розчиочищують колоночною хроматографією (толуняють у 20мл 20мл Н2О ТГФ та перемішують при ол/EtOAc=10/2 обсяги, силікагель) і одержують 50°С 16 годин. Суміш концентрують у вакуумі й 5,3г чистого етил-2-(4-хлорфеніл)-1-(2,4одержують 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)діхлорфеніл)-5-метил-1Н-імідазол-4-карбоксилату 1Н-імідазол-4-карбонову кислоту. Додають 60мл (вихід 85%) у вигляді жовтої олії. 15 77440 16 Частина В: 0,250г (0,61ммоля) етил-2-(4(0,0139моля) етил-1-(4-бромфеніл)-2-(2,4хлорфеніл)-1-(2,4-діхлорфеніл)-5-метил-1Ндіхлорфеніл)-1H-імідазол-4-карбоксилату в 70мл імідазол-4-карбоксилату та 0,052г LiOH безводного ТГФ додають 0,67г LiOH (0,0278моля) (2,17ммоля) розчиняють у 50мл суміші 1:1 обсягу та 70мл води. Суміш перемішують 16 годин при Н2О:ТГФ та перемішують при 50°С 1 годину. Су50°С і одержують світлий розчин. Після охоломіш концентрують, одержуючи сиру 2-(4дження до кімнатної температури додають 28мл хлорфеніл)-1-(2,4-діхлорфеніл)-5-метил-1Н1N розчину НСl і одержують оліїстий осад, який імідазол-4-карбонову кислоту. До суміші додають повністю застигає при продовжуваному перемішу50мл SOCl2 і одержану суміш нагрівають при темванні з доданням 70мл води. Осад відбирають пературі флегми 1 годину. Суміш концентрують і фільтрацією, промивають водою та сушать у вакуодержують 2-(4-хлорфеніл)-1-(2,4-діхлорфеніл)-5умі, одержуючи 4,92г 1-(4-бромфеніл)-2-(2,4метил-1H-імідазол-4-карбонилхлорид. діхлорфеніл)-1Н-імідазол-4-карбонової кислоти Частина С: 1,5г (3,75ммоля) 2-(4-хлорфеніл)-1(вихід 85%). Точка топлення 138-142°С. (2,4-діхлорфеніл)-5-метил-1Н-імідазол-4Частина В: До перемішуваної суспензії 1,23г карбонилхлориду, 0,725г (7,25ммоля) 1(2,99ммоля) 1-(4-бромфеніл)-2-(2,4-діхлорфеніл)амінопіперидину та 0,549г (5,44ммоля) триетила1Н-імідазол-4-карбонової кислоти у 40мл сухого міну розчиняють у діхлорметані й перемішують 1 ацетонітрилу послідовно додають 1,15мл годину при кімнатній температурі. Суміш проми(6,6ммолів) діізопропилетиламіну (ДІПЕА), 1,36г вають насиченим водним розчином NаНСО3, су(3,6ммоля) О-бензотриазол-1-іл-N,N,N’,N’шать над Na2SO4, концентрують у вакуумі та очитетраметилуронійгексафторфосфату (ГБТУ) та щують колоночною хроматографією 0,39мл (3,6ммоля) 1-амінопіперидину. Після 16 (гептан/етилацетат =1/1 обсягу, силікагель), одергодин перемішування одержану суміш концентружуючи 0,220г 2-(4-хлорфеніл)-1-(2,4-діхлорфеніл)ють у вакуумі. Осад розчиняють в етилацетаті й 5-метил-N-(піперидин-1-іл)-1Н-імідазол-4додають водний розчин NaНСО3. Етилацетатну карбоксаміду (вихід 13%) у вигляді білої піни фазу відбирають, промивають водою та розсолом, МС 453/ сушать над Na2SO4, фільтрують та концентрують у Аналогічним чином готують: вакуумі, одержуючи сирий твердий осад. Його 11. N-(t-бутоксі)-2-(4-хлорфеніл)-1-(2,4очищують перекристалізацією з ацетонітрилу й діхлорфеніл)-5-метил-1Н-імідазол-4-карбоксамід. одержують 830мг 1-(4-бромфеніл)-2-(2,4МС 452. діхлорфеніл)-N-(піперидин-1-іл)-1Н-імідазол-412. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5карбоксаміду (вихід 56%). метил-N-(піперидин-1-іл)-1Н-імідазол-4Точка топлення 219-221°С). карбоксамід. МС 463; точка топлення 165-167°С Аналогічним чином одержують: 13. N-(t-бутоксі)-2-(2,4-діхлорфеніл)-1-(423. N-(t-бутоксі)-1-(4-бромфеніл)-2-(2,4хлорфеніл)-5-метил-1Н-імідазол-4-карбоксамід МС діхлорфеніл)-1H-імідазол-4-карбоксамід. Аморф452. ний. Тонкошарова рідинна хроматографія (силіка14. N-(t-бутоксі)-1-(4-хлорфеніл)-2-(2,4гель, Еt2О) Rf=0,3. діхлорфеніл)-5-етил-1Н-імідазол-4-карбоксамід. 24. 1-(4-бромфеніл)-2-(2,4-діхлорфеніл)-NАморфний. МС 468. (піролидин-1-іл)-1Н-імідазол-4-карбоксамід. Точка 15. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5топлення 238-240°С. етил-N-(піперидин-1-іл)-1Н-імідазол-4-карбоксамід. 25. N-(азепан-1-іл)-1-(4-бромфеніл)-2-(2,4МС 477. діхлорфеніл)-1Н-імідазол-4-карбоксамід. Точка 16. 1-(4-бромфеніл)-N-(t-бутоксі)-2-(2,4топлення 201-204°С. діхлорфеніл)-5-метил-1Н-імідазол-4-карбоксамід. 26. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-NАморфний. (гексагідроциклопента[с]пірол-2(1H)-іл)-1Н17. 1-(4-бромфеніл)-2-(2,4-діхлорфеніл)-5імідазол-4-карбоксамід. МС 475. метил-N-(піперидин-1-іл)-1Н-імідазол-427. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-N-(4карбоксамід. ТТ>204°С. Тонкошарова рідинна фторбензил)-1H-імідазол-4-карбоксамід. МС 474. хроматографія (силікагель, EtOAc) Rf=0,3. 28. 1-(4-хлорфеніл)-2-(2-метоксі-4-хлорфеніл)18. 1-(4-бромфеніл)-N-(t-бутоксі)-2-(2,4N-(піперидин-1-іл)-1Н-імідазол-4-карбоксамід. Точдіхлорфеніл)-5-етил-1Н-імідазол-4-карбоксамід. ка топлення 220°С. Аморфний. Тонкошарова рідинна хроматографія 29. 1-(4-хлорфеніл)-N-циклогексил-2-(2(силікагель, СН2Сl2/ацетон =9:1 обсягу) Rf=0,45. метоксі-4-хлорфеніл)-1Н-імідазол-4-карбоксамід. 19. 1-(4-бромфеніл)-2-(2,4-діхлорфеніл)-5Точка топлення 177-179°С. етил-N-(піперидин-1-іл)-1Н-імідазол-4-карбоксамід. 30. 1-(4-хлорфеніл)-2-(2-фтор-4-хлорфеніл)-NТТ>140°С. Тонкошарова рідинна хроматографія (піперидин-1-іл)-1Н-імідазол-4-карбоксамід. Точка (силікагель, EtOAc) Rf=0,4. топлення 217-218°С. 20. 1-(4-бромфеніл)-N-циклогексил-2-(2,431. 2-(2,4-діхлорфеніл)-1-(4-фторфеніл)-Nдіхлорфеніл)-5-етил-1Н-імідазол-4-карбоксамід. (піперидин-1-іл)-1Н-імідазол-4-карбоксамід. Точка Точка топлення >135-140°С. топлення 175-176°С. 21. 1-(4-бромфеніл)-2-(2,4-діхлорфеніл)-532. N-циклогексил-2-(2,4-діхлорфеніл)-1-(4етил-N-(n-пентил)-1H-імідазол-4-карбоксамід. Сифторфеніл)-1Н-імідазол-4-карбоксамід. Точка топроп.Тонкошарова рідинна хроматографія (силікалення 184-185°С. гель, СН2Сl2/ацетон =19:1 обсягу) Rf=0,4. 33. N-циклогексил-2-(2-фтор-4-хлорфеніл)-1Приклад 22 (4-хлорфеніл)-1Н-імідазол-4-карбоксамід. Точка Частина А: До перемішуваного розчину 6,10г топлення 157-159°С. 17 77440 18 34. 1-(4-хлорфеніл)-2-(2-метоксі-4-хлорфеніл)(трифторметил)феніл) бензолкарбоксамідину розN-(n-пентил)-1Н-імідазол-4-карбоксамід. Точка чиняють у 2-пропанолі й послідовно додають 20,8г топлення 115°С. (2 мольних еквівалента) етил-3-бром-235. 2-(2,4-діхлорфеніл)-1 -(4-метоксіфеніл)-Nоксобутаноатута NаНСО3. Суміш нагрівають 40 (піперидин-1-іл)-1Н-імідазол-4-карбоксамід Точка годин при температурі флегми і дають охолонути топлення 178-179°С. до кімнатної температури. 2-пропанол відганяють 36. N-циклогексил-2-(2,4-діхлорфеніл)-1-(4у вакуумі, до осаду додають етилацетат і одержаметоксіфеніл)-1Н-імідазол-4-карбоксамід. Точка ну органічну фазу промивають 5% водним розчитоплення 175-176°С. ном NaHCO3. Етилацетатну фазу збирають, су37. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-N,Nшать над Na2SO4, фільтрують та концентрують у діетил-1Н-імідазол-4-карбоксамід. Точка топлення вакуумі. Одержану олію очищують колоночною 177-179°С. хроматографією (діетилетер/петролейний етер 38. 1-(4-хлорфеніл)-N-циклогексил-2-(2=1/3 обсяги, силікагель) та доочищають перекристрифторметил-4-хлорфеніл)-1Н-імідазол-4талізацією з циклогексану, одержуючи 10,45 гетилкарбоксамід. Точка топлення 172°С. 2-(2,4-діхлорфеніл)-5-метил-1-(439. 1-(4-хлорфеніл)-N-(піперидин-1-іл)-2-(2трифторметил)феніл)-1Н-імідазол-4-карбоксилату трифторметил-4-хлорфеніл)-1H-імідазол-4(вихід 52%) у вигляді жовтої твердої маси. Точка карбоксамід. Точка топлення 172°С. топлення 160-162°С. 40. N-(1-адамантил)-1-(4-хлорфеніл)-2-(2Частина D: Одержаний етил-2-(2,4трифторметил-4-хлорфеніл)-1Н-імідазол-4діхлорфеніл)-5-метил-1-(4-трифторметил)феніл)карбоксамід. Точка топлення 288°С. 1Н-імідазол-4-карбоксилат перетворюють на 241. 1-(4-хлорфеніл)-N-(2,2,2-трифторетил)-2(2,4-діхлорфеніл)-5-метил-1-(4(2-трифторметил-4-хлорфеніл)-1Н-імідазол-4трифторметил)феніл)-1H-імідазол-4-карбонову карбоксамід. Точка топлення 149°С. кислоту (точка топлення 224-226°С), а її, в свою 42. 2-(2,4-діхлорфеніл)-1-(піридин-3-іл)-Nчергу, на 2-(2,4-діхлорфеніл)-5-метил-N(піперидин-1-іл)-1Н-імідазол-4-карбоксамід. Точка (піперидин-1-іл)-1-(4-трифторметил)феніл)-1Hтоплення 165-170°С. імідазол-4-карбоксамід (точка топлення 173-174°С) 43. N-циклогексил-2-(2,4-діхлорфеніл)-1за способом, що описаний у прикладі 22. (піридин-3-іл)-1Н-імідазол-4-карбоксамід. Точка Аналогічним чином готують: топлення 195°С. 46. 2-(2,4-діхлорфеніл)-N-(піперидин-1-іл) 1-(444. 2-(2,4-діхлорфеніл)-1-(піридин-3-іл)-N-(nтрифторметил)феніл)-1Н-імідазол-4-карбоксамід. пентил)-1Н-імідазол-4-карбоксамід. Точка топленТочка топлення >200°С (розклад). ня 117°С. 47. N-циклогексил-2-(2,4-діхлорфеніл)-5Приклад 45 метил-1-(4-трифторметил)феніл)-1Н-імідазол-4Частина А: 40,0г (0,19моля) 2,4карбоксамід. Точка топлення 178-179°С. діхлобензоїлхлориду розчиняють віл тетрагідро48. N-циклогексил-2-(2,4-діхлорфеніл)-1-(4фурану. До розчину при постійному перемішуванні трифторметил)феніл)-1H-імідазол-4-карбоксамід. послідовно додають 73,4мл (2,2 мольних еквіваТочка топлення 199-200°С. лента) діізопропилетиламіну (ДІПЕА) та 30,7г Приклад 49 (0,19моля) 4-(трифторметил)феніламіну. За 1 гоЧастина А: 15,0г (50,8ммолів) N-(4дину суміш концентрують у вакуумі й одержують метоксіфеніл)-2,4-діхлорбензолкарбоксамідину олію. Цю олію кристалізують з етанолу, одержуюрозчиняють у 2-пропанолі й послідовно додають чи 53,2г чистого 2,4-діхлор-N-(423,5г (2 мольних еквівалента) 3-бром-2(трифторметил)феніл) бензаміду (вихід 85%). 1Hоксобутаноату та 8,5г NaHCO3 (2 мольних еквіваЯМР (200мгц, ДМСО-d6): δ 10,90 (br s, 1H), 7,91 (br лента). Суміш нагрівають 40 годин при температуd, J=8Гц, 2H), 7,63-7,77 (m, 4H), 7,07 7,57 (dt, рі флегми й дають охолонути до кімнатної темпеJ=8Гц, J=2Гц, 1Н). ратури 2-пропанол відганяють у вакуумі, до осаду Частина В: 19,0г (0,057моля) 2,4-діхлор-N-(4додають етилацетат і промивають органічну фазу (трифторметил)феніл)бензаміду розчиняють у 5% водним розчином NaHCO3. Етилацетатну фазу 150мл бензолу та додають 13,0г РСl5 (1,1 мольновідбирають, сушать над Na2SO4, фільтрують та го еквівалента). Суміш підігрівають при темпераконцентрують у вакуумі. Одержану олію очищують турі флегми 2 години, дають охолонути до кімнатколоночною хроматографією (діетиленої температури та концентрують у вакуумі. Осад тер/петролейний етер =1/3 обсяги, силікагель) і розчиняють у безводному ТГФ, охолоджують до одержують 8,61г етил-2-(2,4-діхлорфеніл)-5-метил0°С та вміщують до автоклава. Швидко додають 1-(4-метоксіфеніл)-1H-імідазол-4-карбоксилату надлишок NH3 та перемішують суміш при кімнатній (вихід 42%) у вигляді твердої маси 1H-ЯМР температурі 50 годин. Додають суміш етилацетату (200мгц, CDCl3) δ 7,33 (d, J=8Гц, 1Н), 7,27 (d, з водним розчином NaHCO3. Збирають етилацетаJ=2Гц, 1H), 7,18 (dd, J=8Гц, J=2Гц, 1Н), 7,03 (dt, тну фазу, сушать над Na2SO4, фільтрують та конJ=8Гц, J=2Гц, 2Н), 6,85 (dt, J=8Гц, J=2Гц, 2Н), 4,42 центрують у вакуумі. Одержану олію очищують (q, J=7Гц, 2H), 3,80 (s, 3H), 2,43 (s, 3H), 1,43 (t, колоночною хроматографією (діетилеJ=7Гц, 3Η). тер/петролейний етер =1/1 обсягу, силікагель), Частина В: До перемішуваного розчину 8,00г одержуючи 16,9г чистого 2,4-діхлор-N-(4(0,0198моля) етил-2-(2,4-діхлорфеніл)-5-метил-1(трифторметил)феніл)бензолкарбоксамідину (ви(4-метоксіфеніл)-1Н-імідазол-4-карбоксилату у хід 89%). Точка топлення 108-109°С. 80мл ТГФ додають 0,59г LiOH (2 мольних еквіваЧастина С: 15,0г (0,0450моля) 2,4-діхлор-N-(4лента) та 80мг води. Одержану суміш перемішу 19 77440 20 ють 16 годин при 80°С. Після охолодження до кімметоксі-4-хлорфеніл)-5-метил-1Н-імідазол-4натної температури додають 12,3мл 2N розчину карбоксамід. Точка топлення 201°С. НСl і одержують оліїстий осад. Додають воду, екс62. 2-(2,4-діхлорфеніл)-1-(4-фторфеніл)-5трагують етилацетатом, етилацетатну фазу збиметил-N-(піперидин-1-іл)-1Н-імідазол-4рають, сушать над Na2SO4, фільтрують та конценкарбоксамід. Точка топлення 223-224°С. трують у вакуумі. Осад кристалізують з 63. 2-(2,4-діхлорфеніл)-5-метил-1-(4дiiзоприпилетеру й сушать, одержуючи 4,04г 2метоксіфеніл)-N-(піперидин-1-іл)-1Н-імідазол-4(2,4-діхлорфеніл)-5-метил-1-(4-метоксіфеніл)-1Нкарбоксамід. Точка топлення 90°С (розклад). імідазол-4-карбоновоі кислоти (вихід 87%) у ви64. N-циклогексил-1-(4-фторфеніл)-2-(2,4гляді блідо-сірої твердої маси. Точка топлення діхлорфеніл)-5-метил-1Н-імідазол-4-карбоксамід. 189-191°С). Точка топлення 229-230°С. Частина С: До 1,00г (2,65ммоля)2-(2,465. 1-(4-хлорфеніл)-5-метил-N-(n-пентил)-2-(2діхлорфеніл)-5-метил-1-(4-метоксіфеніл)-1Hтрифторметил-4-хлорфеніл)-1H-імідазол-4імідазол-4-карбоновоі кислоти у 25мл сухого ацекарбоксамід. Аморфний. тонітрилу послідовно додають 1,02мл (2,2 мольних 66. 1-(4-хлорфеніл)-2-(2-фтор-4-хлорфеніл)-5еквівалента) діізопропилетиламіну (ДІПЕА), 1,21г метил-N-(піперидин-1-іл)-1Н-імідазол-4(1,2 мольних еквівалента) О-бензотриазол-1-ілкарбоксамід. Точка топлення 195°С. N,N,N’,N’-тетраметилуронійгексафторфосфату 67. 1-(4-хлорфеніл)-2-(2-фтор-4-хлорфеніл)-5(ГБТУ) й перемішують одержаний розчин метил-N-(n-пентил)-1H-імідазол-4-карбоксамід. 15хвилин. Додають 0,36мл (1,2 мольних еквівалеТочка топлення 115°С. нта) циклогексаміну Після 50 годин перемішування 68. 1-(4-хлорфеніл)-N-циклогексил-2-(2-фторсуміш концентрують у вакуумі. Осад розчиняють у 4-хлорфеніл)-5-метил-1H-імідазол-4-карбоксамід. діхлорметані й додають водний розчин NaHCO3. Точка топлення 188°С. Збирають діхлорметанову фазу, сушать над 69. 1-(4-хлорфеніл)-N-циклогексил-2-(1,5Na2SO4, фільтрують та концентрують у вакуумі. діметил-1Н-пірол-2-іл)-5-метил-1Н-імідазол-4Осад доочищають колоночною хроматографією карбоксамід. Точка топлення 188-189°С. 70. 1-(4-хлорфеніл)-2-(1,5-діметил-1Н-пірол-2(градієнт діхлорметан діхлорметан/метанол іл)-5-метил-N-(піперидин-1-іл)-1Н-імідазол-4=99/1 обсягу, силікагель), одержуючи 1,03г N-(1карбоксамід. Точка топлення 208-210°С. циклогексил)-2-(2,4-діхлорфеніл)-5-метил-1-(471. 2-(2-хлорфеніл)-1-(3 -фторфеніл)-5-метилметоксіфеніл)-1Н-імідазол-4-карбоксаміду (вихід N-(піперидин-1-іл)-1Н-імідазол-4-карбоксамід. Точ85%). Точка топлення 160-161°С. ка топлення 236-238°С. Аналогічним чином готують: 72. 2-(2-хлорфеніл)-1-(3-фторфеніл)-5-метил50. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-N,N,5N-(n-пентил)-1Н-імідазол-4-карбоксамід. Точка триметил-1Н-імідазол-4-карбоксамід. Точка топтоплення 97-102°С. лення 101-104°С. 73. 2-(2-хлорфеніл)-N-циклогексил-1-(351. 1-(4-хлорпіридин-2-іл)-2-(2,4-діхлорфеніл)фторфеніл)-5-метил-1H-імідазол-4-карбоксамід. 5-метил-N-(піперидин-1-іл)-1Н-імідазол-4Точка топлення 180-182,5°С. карбоксамід. МС 464 (МН+). 74. 2-(2-хлорфеніл)-1-(3-фторфеніл)-N-(2-(452. 1-(4-хлорпіридин-2-іл)-2-(2,4-діхлорфеніл)фторфеніл)етил)-5-метил-1Н-імідазол-45-метил-N-(4-морфолініл)-1Н-імідазол-4карбоксамід. Точка топлення 123,5-126°С. карбоксамід. МС 466 (МН+). 75. 1-(4-хлорпіридин-2-іл)-2-(2,4-діхлорфеніл)53. N-(1-азепанил)-1-(4-хлорпіридин-2-іл)-25-етил-N-(піперидин-1-іл)-1Н-імідазол-4(2,4-діхлорфеніл)-5-метил-1Н-імідазол-4карбоксамід. Точка топлення 146°С. карбоксамід. МС 478 (МН+). 76. 1-(4-хлорпіридин-2-іл)-2-(2,4-діхлорфеніл)54. 1-(4-хлорпіридин-2-іл)-N-циклогексил-25-етил-N-(4-морфолінил)-1Н-імідазол-4(2,4-діхлорфеніл)-5-метил-1Н-імідазол-4карбоксамід. Точка топлення 223°С. карбоксамід. МС 463. 77 N-(1-азепанил)-1-(4-хлорпіридин-2-іл)-255. 1-(4-хлорпіридин-2-іл)-2-(2,4-діхлорфеніл)(2,4-діхлорфеніл)-5-етил-1Н-імідазол-45-метил-N-(n-пентил)-1Н-імідазол-4-карбоксамід. карбоксамід. Точка топлення 177°С. МС 451. 78 1-(4-хлорпіридин-2-іл)-N-циклогексил-2-(2,456. 1-(4-хлорпіридин-2-іл)-2-(2,4-діхлорфеніл)діхлорфеніл)-5-етил-1Н-імідазол-4-карбоксамід. N-(4-фторбензил)-5-метил-1H-імідазол-4Точка топлення 149°С. карбоксамід. МС 489. Точка топлення 123-126°C. 79. 1-(4-хлорпіридин-2-іл)-2-(2,4-діхлорфеніл)57. 1-(4-хлорфеніл)-N-циклогексил-5-метил-25-етил-]N-(n-пентил)-1Н-імідазол-4-карбоксамід. (2-трифторметил-4-хлорфеніл)-1H-імідазол-4Точка топлення: олія. карбоксамід. Точка топлення 212°С. 80. 1-(4-хлорпіридин-2-іл)-2-(2,4-діхлорфеніл)58. 1-(4-хлорфеніл)-5-метил-N-(піперидин-15-етил-N-(4-фторфенілметил)-1Н-імідазол-4іл)-2-(2-трифторметил-4-хлорфеніл)-1H-імідазол-4карбоксамід. Точка топлення: аморфний. карбоксамід. Точка топлення 165°С. 81. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-N59. 1-(4-хлорфеніл)-2-(2-метоксі-4-хлорфеніл)(гексагідроциклопента[с]пірол-2(1Н)-іл)-5-метил5-метил-N-(n-пентил)-1Н-імідазол-4-карбоксамід. ІН-імідазол-4-карбоксамід. Точка топлення 143Точка топлення 131°С. 146°С. 60. 1-(4-хлорфеніл)-2-(2-метоксі-4-хлорфеніл)82. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-55-метил-N-(піперидин-1-іл)-1Н-імідазол-4метил-N-феніл-1Н-імідазол-4-карбоксамід. Точка карбоксамід. Точка топлення >256°С. топлення 91-95°С. 61. N-циклогексил-1-(4-хлорфеніл)-2-(2 21 77440 22 83. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5Точка топлення 188-190°С. метил-N-(тетрагідро-2Н-піран-2-ілоксі)-1Н104. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5імідазол-4-карбоксамід. Точка топлення 128метил-N-(3-(трифторметил)феніл)-1Н-імідазол-4133°С. карбоксамід. Точка топлення 177°С. 84. N-(екзобіцикло[2.2.1]гепт-2-іл)-1-(4105.1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5хлорфеніл)-2-(2,4-діхлорфеніл)-5-метил-1Нметил-N-(трифторметил)бензил)-1H-імідазол-4імідазол-4-карбоксамід. Точка топлення 194карбоксамід. Точка топлення 138-140°С. 195°С. 106. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-585. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-N-(2метил-N-(4-(трифторметил)бензил)-1Н-імідазол-4фторетил)-5-метил-1Н-імідазол-4-карбоксамід. карбоксамід. Точка топлення 232°С. Точка топлення 128-133°С. 107. 1-(4-хлорфеніл)-N-циклопентил-2-(2,486. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-Nдіхлорфеніл)-5-метил-1Н-імідазол-4-карбоксамід. (транс-4-гідроксіциклогексил)-5-метил-1Н-імідазолТочка топлення 172°С. 4-карбоксамід. Точка топлення 160°С (розклад). 108. 1-(4-хлорфеніл)-N-циклогептил-2-(2,487. 1-{[1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5діхлорфеніл)-5-метил-1Н-імідазол-4-карбоксамід. метил-1Н-імідазол-4-іл]карбоніл}-4Точка топлення 154-156°С. гідроксіпіперидин. Точка топлення: аморфний. Приклад 109 88. 1-{[1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5Части на А: Етил-1-(4-бромфеніл)-2-(2,4метил-1Н-імідазол-4-іл]карбоніл}-1,2,3.4діхлорфеніл)-1Н-імідазол-4-карбоксилат перетвотетрагідроізохінолін. Точка топлення 143-146°С. рюють на етил-1-(4-бромфеніл)-5-хлор-2-(2,489. N-(ендобіцикло[2.2.1]гепт-2-іл)-1-(4діхлорфеніл)-1Н-імідазол-4-карбоксилат за відохлорфеніл)-2-(2,4-діхлорфеніл)-5-метил-1Нмим способом [N.Kudo et al., Chem.Pharm.Bull. імідазол-4-карбоксамід. Точка топлення 1941999, 47, 857-868] з надлишком SO2CI2 у діхлоре195°С. тані при температурі флегми протягом 50 годин. 90. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-N-(4Частина В: етил-1-(4-бромфеніл)-5-хлор-2фторбензил)-5-метил-1Н-імідазол-4-карбоксамід. (2,4-діхлорфеніл)-1Н-імідазол-4-карбоксилат переТочка топлення 165-166°С. творюють на 1-(4-бромфеніл)-5-хлор-2-(2,491. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5діхлорфеніл)-N-піперидин-1-іл)-1Н-імідазол-4метил-N-(n-пентил)-1Н-імідазол-4-карбоксамід. карбоксамід (точка топлення >150°С; Rf (силікаОлія. гель, ЕtOАс) ~0,35) за способом, що описаний у 92. N-(азепан-1-іл)-1-(4-хлорфеніл)-2-(2,4прикладі 22. 1H-ЯМР (400МГц, CDCl3): δ 7,85 (br s, діхлорфеніл)-5-метил-1Н-імідазол-4-карбоксамід. 1H), 7,52 (dt, J=8Гц, J=2Гц, 1H), 1,26-1,36 (m, 3H), Точка топлення 147-149°С. 7,01 (dt, J=8Гц, J=2Гц, 2H), 2,85-2,92 (m, 4H), 1,7293. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-51,80 (m, 4H), 1,40-1,44 (m, 2H). метил-N-(піролидин-1-іл)-1Н-імідазол-4Приклад 110 карбоксамід. Точка топлення 205-206°С. Частина А: До перемішуваного розчину 18,38г 94. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5(50ммолів) 1-(4-хлорфеніл)-2-(2,4-дихлорфеніл)метил-N-(морфолін-1-іл)-1Н-імідазол-41Н-імідазол-4-карбонової кислоти у 200мл толуолу карбоксамід. Точка топлення 225°С (розклад). в атмосфері азоту додають 50мл Ν,Ν95. 2-(2,5-діхлорфеніл)-5-метил-1-феніл-Nдіметилформамід-ді-трет-бутилацеталю і одержа(піперидин-1-іл)-1Н-імідазол-4-карбоксамід. Точка ну суміш нагрівають при 80°С 4 години. Після охотоплення 227°С. лодження до кімнатної температури реакційну су96. N-циклoгeкcил-2-(2,5-дixлopфeнiл)-5міш концентрують і додають діетилетер. мeтил-1-фeнiл-1H-iмiдaзoл-4-кapбoкcaмiд. Точка Одержаний розчин двічі промивають водою, сутоплення 236°С. шать над MgSO4, фільтрують та концентрують у 97. N-циклогексил-2-(2,4-діхлорфеніл)-1-(2,5вакуумі. Осад кристалізують з діізопропилетеру, діфторфеніл)-5-етил-1Н-імідазол-4-карбоксамід. одержуючи 10,35 г чистого трет-бутил-1-(4Точка топлення 144-146°С. хлорфеніл)-2-(2,4-діхлорфеніл)-1Н-імідазол-498. N-циклогексил-2-(2,4-діхлорфеніл)-1-(2,5карбоксилату (вихід 49%). Точка топлення 179діфторфеніл)-5-метил-1Н-імідазол-4-карбоксамід. 181°С. Точка топлення 144-146°С. Частина В: 5,25мл розчину 2М діізопропиламі99N-циклогексил-2-(1,5-діметил-1Н-пірол-2-іл)ду літію (ДАЛ) в ТГФ (0,105моля) додають по кра5-етил-1-феніл-1Н-імідазол-4-карбоксамід. Точка плинах до охолоджуваного (-70°С) розчину 4,24г топлення 195-196°С. (0,010моля) трет-бутил-1-(4-хлорфеніл)-2-(2,4100. N-циклогексил-2-(2,5-діхлорфеніл)-5діхлорфеніл)-1Н-імідазол-4-карбоксилату в атмоетил-1-феніл-1Н-імідазол-4-карбоксамід. Точка сфері азоту і одержану суміш перемішують 1 годитоплення 198-199°С. ну. Додають по краплинах розчин 1,88г 101. 2-(2,5-діхлорфеніл)-5-етил-1-феніл-N(0,011моля) р-толуол-сульфонілціаниду в 20мл (піперидин-1-іл)-1Н-імідазол-4-карбоксилат-1Нбезводного ТГФ, одержаний червоний розчин пеімідазол-4-карбоксамід. Точка топлення 207ремішують 1 годину при -70°С і потім дають досяг208°С. ти кімнатної температури. Додають діетилетер, 102. 1-(4-хлорфеніл)-5-метил-2-(3розчин охолоджують і фільтрують на мембраннометилпіридин-2-іл)1H-імідазол-4-карбоксамід. Точму фільтрі. Органічну фазу збирають, промивають ка топлення 211-213°С водою, сушать над MgSO4, фільтрують та концен103. 1-(4-хлорфеніл)-N-циклогексил-5-метил-2трують у вакуумі з одержанням олії. Цю олію очи(3-метилпіридин-2-іл)-1Н-імідазол-4-карбоксамід. щують колоночною хроматографією (діхлорметан, 23 77440 24 силікагель) і одержують 3,4г трет-бутил-1-(41-(4-хлорфеніл)-5-ціан-2-(2,4-діхлорфеніл)-1Нхлорфеніл)-5-ціан-2-(2,4-діхлорфеніл)-1Н-імідазолімідазол-4-карбонової кислоти (вихід 87%). Точка 4-карбоксилату. Перекристалізація з діізопропилетоплення 200-202°С (розклад). теру дає 2, 57г кристалічного трет-бутил-1-(4Частина D: 1-(4-хлорфеніл)-5-ціан-2-(2,4хлорфеніл)-5-ціан-2-(2,4-діхлорфеніл)-1H-імідазолдіхлорфеніл)-1Н-імідазол-4-карбонову кислоту 4-карбоксилату (вихід 57%). Точка топлення 210перетворюють на 1-(4-хлорфеніл)-5-ціан-2-(2,4212°С. діхлорфеніл)-К-(піперидин-1-іл)-1Н-імідазол-4Аналогічним чином одержують: карбоксамід з виходом 60% аналогічно процедурі, трет-бутил-1-(4-хлорфеніл)-2-(2,4що описана у прикладі 22, частина В. Точка топдіхлорфеніл)-5-метил-1Н-імідазол-4-карбоксилат. лення 231-235,5°С. 1 H-ЯМР (400МГц, CDCl3): δ 7,38 (d, J=8Гц, 1Н), Аналогічним чином одержують: 7,34 (dt, J=8Гц, J=2Гц, 2Н), 7,27 (d, J=2Гц, 1H), 7,22 111. 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5(dd, J=8Гц, J=2Гц, 1H), 7,03 (dt, J=8Гц, J=2Гц, 2H), йод-N-(піперидин-1-іл)-1Н-імідазол-4-карбоксамід. 2,40 (s, 3H), 2,43 (s, 3H), 1,63 (s, 9H). Точка топлення 196-201°С. Частина С: До розчину 2,57г (5,73ммолів) трет112. 1-(4-хлорфеніл)-N-циклогексил-2-(2,4бутил-1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5-ціандіхлорфеніл)-5-йод-1Н-імідазол-4-карбоксамід. 1Н-імідазол-4-карбоксилату в 40мл діхлорметану Точка топлення 226-23 0°С. додають трифтороцтову кислоту, перемішують 113. 1-(4-хлорфеніл)-5-ціан-N-циклогексил-2одержаний розчин 20 годин при кімнатній темпе(2,4-діхлорфеніл)-1Н-імідазол-4-карбоксамід. Точратурі та концентрують у вакуумі. Осад кристаліка топлення 157-158°С. зують з діізопропилетеру, одержуючи 1,95г чистої Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1h-imidazole derivatives as potent cannabinoid-cb1 receptor agonists, partial agonists or antagonists, methods of their preparation (variants), intermediates, pharmaceutical composition and method for preparation thereof
Автори англійськоюKruse Cornelis G., Kruse, Cornelis G., Lange, Josephus, H., M.
Назва патенту російськоюПроизводные 1h-имидазола, обладающие агонистической активностью в отношении св1, частично агонистическую активность в отношении св1 или антагонистическую активность в отношении св1, способ их получения (варианты), промежуточные соединения, фармацевтическая композиция и способ ее получения
Автори російськоюКрузе Корнелис Г., Ланге Йозефус Х.М.
МПК / Мітки
МПК: C07D 403/04, A61P 1/12, C07D 403/12, A61K 31/454, A61P 11/00, A61P 25/28, A61P 27/06, C07D 405/04, C07D 401/06, A61P 43/00, A61K 31/4725, A61P 35/00, A61P 25/24, A61K 31/4439, A61P 1/08, C07D 405/12, A61K 31/4164, C07D 233/90, A61K 31/5377, A61P 3/10, C07C 257/00, A61P 25/00, A61P 25/30, A61P 25/18, A61P 25/04, A61P 25/02, C07D 401/04, A61P 25/22, A61P 3/04, A61P 1/04, A61P 25/08, A61P 11/06, A61K 31/4545, A61P 9/10, A61K 31/55, A61K 31/4178, A61P 31/04, A61P 25/16, A61P 25/14, C07D 295/30
Мітки: мають, частково, св1, агоністичну, спосіб, похідні, антагоністичну, одержання, 1н-імідазолу, активність, проміжні, варіанти, сполуки, фармацевтична
Код посилання
<a href="https://ua.patents.su/12-77440-pokhidni-1n-imidazolu-shho-mayut-agonistichnu-aktivnist-shhodo-sv1-chastkovo-agonistichnu-aktivnist-shhodo-sv1-abo-antagonistichnu-aktivnist-shhodo-sv1-sposib-kh-oderzhannya-varian.html" target="_blank" rel="follow" title="База патентів України">Похідні 1н-імідазолу, що мають агоністичну активність щодо св1, частково агоністичну активність щодо св1 або антагоністичну активність щодо св1, спосіб їх одержання (варіанти), проміжні сполуки, фармацевтична к</a>
Попередній патент: Спосіб захисту алітуванням металевих деталей, утворених щонайменше частково стільниковою структурою
Випадковий патент: Робочий орган культиватора












