Похідні 4,5-дигідро-1н-піразолу, що виявляють антагоністичну активність щодо св1, спосіб їх одержання, фармацевтична композиція та спосіб її виготовлення, спосіб лікування захворювань (варіанти)
Номер патенту: 74367
Опубліковано: 15.12.2005
Автори: Ланге Йозефус Г.М., ван Фліт Бернард Ж., Тульп Мартінус Т.М., Тіпкер Якобус, Крузе Корнеліс Г.
Формула / Реферат
1. Похідні 4,5-дигідро-1Н-піразолу формули (І)
 , (І)
, (І)
де
R та R1 є однакові або різні групи, представлені фенілом, тієнілом або піридилом, які можуть бути заміщені 1, 2 або 3 замісниками Y, які можуть бути однаковими або різними, вибраними з: (С1-3)-алкіл- або алкокси, гідрокси, галоген, трифторметил, трифторметилтіо, трифторметокси, нітро, аміно, моно- або діалкіл(С1-2)-аміно, моно- або діалкіл(С1-2)-амідо, (С1-3)-алкілсульфоніл, диметилсульфамідо, С1-3-алкоксикарбоніл, карбоксил, трифторметилсульфоніл, ціано, карбамоїл, сульфамоїл та ацетилгрупи, або ж R та/або R1 представляють нафтил,
R2 - водень, гідрокси, С1-3-алкокси, ацетилокси або пропіонілоксигрупа,
Аа - одна з груп (і), (іі), (ііі), (iv), (v)
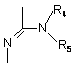 , (i)
, (i)  , (ii)
, (ii)
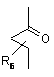 , (iii)
, (iii) ![]() , (iv)
, (iv) 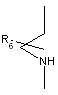 , (v)
, (v)
де
R4 та R5, незалежно один від одного - водень або (С1-8) розгалужений або нерозгалужений алкіл, або (С3-8)-циклоалкіл, або R4 - ацетамід або диметиламін, або 2,2,2-трифторетил, або феніл, або піридил за умови, що R5 - водень,
Bb - сульфоніл або карбоніл,
R6 - водень або С1-3 нерозгалужений алкіл,
R3 - бензил, феніл, триєніл або піридил, які можуть бути заміщені 1, 2 або 3 замісниками Y, що можуть бути однаковими або різними, або являє собою (C1-8) розгалужений або нерозгалужений алкіл або (С3-8)-циклоалкіл, або R3 - нафтил,
і таутомери, попередники лікарських препаратів та солі зазначених сполук.
2. Сполука формули (І) за п.1, де R - група 4-хлорфеніл, R1 - феніл, R2 - водень, Аа - група (і), де R4 - водень, R5 - метил, Bb - сульфоніл, R3 - 4-хлорфеніл, та її солі.
3. Фармацевтична композиція, що містить як діючу речовину принаймні одну сполуку за п.1.
4. Спосіб виготовлення фармацевтичної композиції, який відрізняється тим, що сполуці за п. 1 надають форму, придатну для введення до організму.
5. Спосіб одержання сполук формули (І)
 , (І)
, (І)
де
R - феніл, тієніл або піридил, які можуть бути заміщені замісником, представленим (С1-3)-алкокси або галогеном,
R1 - феніл, який може бути заміщений (С1-3)-алкокси, або піридил,
R2 - водень, гідроксил,
Аа - одна з груп (і), (іі), (ііі), (iv), (v)
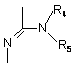 , (i)
, (i)  , (ii)
, (ii)
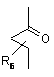 , (iii)
, (iii) ![]() , (iv)
, (iv) 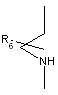 , (v)
, (v)
де
R4 та R5 незалежно один від одного - водень або (С1-8) розгалужений або нерозгалужений алкіл, або R4 - ацетамід або диметиламін, або 2,2,2-трифторетил, або феніл, або піридил за умови, що R5 - водень,
Bb - сульфоніл або карбоніл,
R6 - водень або С1-3 нерозгалужений алкіл,
R3 - бензил, феніл або піридил, які можуть бути заміщені 1, 2 або 3 замісниками Y, що можуть бути однаковими або різними, і вибрані з групи, що містить (С1-3)-алкіл- або алкокси, галоген, трифторметил, або R3 - нафтил,
який відрізняється тим, що одержують сполуку, в якій R, R1-R3 та Bb мають значення, наведені вище, а Аа - група формули (і) або (іі), як зазначено вище, шляхом реакції сполуки формули (III)
 (III)
(III)
зі сполукою формули (VIII)
 , (VIII)
, (VIII)
де R7 - (С1-3)-алкільна група, з одержанням сполуки формули (IX)
 , (ІХ)
, (ІХ)
яку піддають реакції з галогенуючим агентом з одержанням сполуки формули (X)
 , (Х)
, (Х)
де R8 - атом галогену, яку піддають реакції з аміном з одержанням сполуки формули (І).
6. Сполука формули (III)
 , (III)
, (III)
де R2 - гідроксигрупа, а R та R1 мають значення за п. 1.
7. Сполука формули (V)
 , (V)
, (V)
де Аа має значення (і), (іі) або (v) за п. 1, а R, R1 та R2 мають значення за п. 1.
8. Сполука формули (VII)
 , (VII)
, (VII)
де R, R1 і, R2, R3 та Bb мають значення за п. 1.
9. Сполука формули (ІХ)
 , (IX)
, (IX)
де R, R1, R2, R3 та Bb мають значення за п.1.
10. Сполука формули (X)
 , (X)
, (X)
де R, R1, R2, R3 та Bb мають значення за п. 1, a R8 - атом галогену.
11. Сполука формули (XII)
 , (XII)
, (XII)
де R, R1, R2, R3 та Bb мають значення за п. 1, a R9 - (С1-3)-алкільна група.
12. Сполука формули (XVII)
 , (XVII)
, (XVII)
де R, R1 та R2 мають значення за п.1, Аа має значення (v) за п.1, a Prot - так звана захисна група.
13. Спосіб лікування психічних розладів, таких як психоз, бентежність, депресія, дефіцит уваги, розлади пам'яті, відсутність апетиту, ожиріння, неврологічних розладів, таких як недоумство, дистонія, хвороба Паркінсона, хвороба Альцгеймера, епілепсія, хвороба Хантінгтона, синдром Туретта, мозкова ішемія, а також больових синдромів та інших хвороб центральної нервової системи, пов'язаних з нейротрансмісією канабіноїдів, який відрізняється тим, що застосовують сполуку за п.1.
14. Спосіб лікування шлунково-кишкових розладів, пов'язаних з нейтротрансмісією канабіноїдів, який відрізняється тим, що застосовують сполуку за п.1.
15. Спосіб лікування серцево-судинних розладів, пов'язаних з нейтротрансмісією канабіноїдів, який відрізняється тим, що застосовують сполуку за п.1.
Текст
Винахід стосується групи нових похідних 4,5-дігідро-1Н-піразолу, способу одержання цих сполук та фармацевтичних композицій, що містять одну або кілька таких сполук в якості діючої речовини. Зазначені 4,5-дігідро-1Н-піразоли є могутніми антагоністами рецепторів Канабіс-1 (СВ1) і можуть застосовуватися для лікування психічних та неврологічних розладів. Канабіноїди є присутні в індійських коноплях і використовуються в медицині багато сторіч [Mechoulam, R.; Feigenbaum, J.J. Prog.Med.Chem. 1987, 24, 159]. Однак лише протягом останнього десятиріччя досліди канабіноїдів виявили достатню інформацію щодо рецепторів канабіноїдів ті їхніх (ендогенних) агоністів та антагоністів. Відкриття та наступне клонування двох різних підтипів рецепторів канабіноїдів (СВ1 та СВ2) стимулювали пошук нових антагоністів рецепторів канабіноїдів [Munro, S.4 Thomas, K.L.; Abu-Shaar, M. Nature 1993, 365, 61. Matsuda, L.A.: Bonner, T.I. Cannabinoid Receptors, Pertwee, R.G.Ed. 1995, 117, Academic Press, London]. Крім того, фармацевтичні фірми зацікавилися розробкою канабіноїдних препаратів для лікування хвороб, пов'язаних з розладом канабіноїдної системи. Широке розповсюдження рецепторів СВ1 у мозку поряд з суворо периферійною локалізацією рецепторів СВ2 робить рецептор СВ1 дуже цікавою молекулярною ціллю для розробки спрямованих на ЦНС ліків від психіатричних та неврологічних захворювань [Consroe, P. Neurobiology of Disease 1998, 5, 534. Pop, E. Curr. Opin. In CPNS Investigational Drugs 1999, 1, 587. Greenberg, D.A. Drug News Perspect. 1999, 12, 458]. Наразі відомі три типи безумовних антагоністів рецепторів СВ1. Фірма Санофі заявила свої діарилпіразольні конгенери як селективні антагоністи рецепторів СВ1. Прикладом може служити SR-141716A, який зараз проходить другу стадію клінічних випробувань як засіб проти психозів [Dutta А.К.; Sard, Η.; Ryan, W.; Razdan, R К.; Compton, D.R.; Martin, B.R. Med.Chem.Res. 1994, 5, 54. Lan, R.; Liu, Q.; Fan, P.; Lin, S.; Fernando, S.R.; MaCallion, D.; Pertwee, R.; Makriyannis, A. J.Med.Chem. 1999, 42, 769. NakamuraPalacios, E.M.; Moerschbaecher, J.M.; Barker L.A. CNS Drug Rev. 1999, 5, 43]. Відомо, що антагоністами рецепторів СВ1 є аміноалкіліндоли. Як приклад наводимо йодоправадолін (АМ-630), впроваджений у 1995p. AM-630 є антагоністом рецептора СВ1, але іноді поводиться як слабкий частковий агоніст [Hosohata, К.; Quock, R.M.; Hosohata, Y.; Burkey, Т.Н.; Makriyannis, Α.; Consroe, P.; Roeske, W.R.; Yamamura, H.I. Life Sc. 1997, 61, PL 115]. Нещодавно дослідники фірми Елі Ліллі відкрили аріл-ароїлзаміщені бензофурани як селективні антагоністи рецепторів СВ1 [LY-320135)(Felder, С.С.; Joyce, K.E.; Briley, E.J.; Glass, M.; Mackie, K.P.; Fahey, K.J.; Cullinan, G.J.; Hunden, D.C.; Johnson, D.W.; Chaney, M.O.; Koppel, G.A.; Brownstein, M.J. Pharmacol. Exp. Ther. 1998, 284, 291]. Зовсім недавно описані 3-алкіл-5,5'-діфенілімідазолідінедіони як ліганди рецепторів канабіноїдів, що виявляються антагоністами канабіноїдів [Kanyonyo, М.; Govaerts, S.J.; Hermans, E.; Poupaert, J Η.; Lambert, D.M. Bioorg.Med.Chem.Lett. 1999, 9, 2233]. Цікаво, що багато з антагоністів рецепторів СВ1 поводяться як зворотні агоністи in vitro [Landsman, R.S.; Burkey, Т.Н.; Consroe, P.; Roeske, W.R.; Yamamura, H.I. Eur.J.Pharmacol. 1997,334,R1]. В останніх оглядах добре наводиться картина сучасного стану досліджень у галузі канабіноїдів [Mechoulam, R.; Hanus, L.; Fride, E. Prog.Med.Chem. 1999, 6, 635. Mechoulam, R.; Fride, E.; DiMarzo, V. Eur.J.Pharmacol. 1998, 359, 1]. Зараз несподівано виявилося, що нові похідні 4,5-дігідро-1H-піразолу формули (1), первинні препарати з них, їхні таутомери та їхні солі (I) де R та R1 є однакові або різні групи, представлені фенілом, тієнілом або піриділом, які можуть бути заміщені 1,2 або 3 замісниками Y, що можуть бути однаковими або різними, обраними з-серед С 1-3-алкіл- або алкоксі, гідроксі, галоген, трифторметил, трифторметилтіо, трифторметоксі, нітро, аміно, моно-або діалкіл (С1-2)-аміно, моно- або діалкіл (С1-2)-амідо, (С1-3)-алкілсульфоніл, діемтилсульфамідо, С1-3-алкоксікарбоніл, карбоксил, трифторметилсульфоніл, ціано, карбамоїл, сульфамоїл та ацетил-груп, або ж R та/або R1 представляють нафтил, - R2 представляє водень, гідроксі, С1-3-алкоксі, ацетилоксі або пропіонилоксі-групи, - Аа представляє одну з груп (і), (іі), (ііі), (iv), (v) де R4 та R5 незалежно один від одного представляють водень, або С1-8 розгалужений або нерозгалужений алкіл, або С3-8 циклоалкіл, або R4 представляє ацетамід, або діметиламін, або 2,2,2-трифторетил, або феніл, або пиріділ за умови, що R5 представляє водень, - R6 представляє водень або С1-3 нерозгалужений алкіл, - Вb представляє сульфоніл або карбоніл, - R3 представляє бензил, феніл, триєніл або пиріділ, які можуть бути заміщені 1, 2 або 3 замісниками , що можуть бути однаковими або різними, або представляє С1-8 розгалужений або нерозгалужений алкіл або С 3-8 циклоалкіл, або R3 представляє нафтил є могутніми та селективними антагоністами рецептора канабісу СВ1. Завдяки своїй могутній антагоністичній активності щодо СВ1 сполуки за винаходом можуть використовуватися для лікування психічних розладів, як от психоз, бентежність,депресія, дефіцит уваги, розлади пам'яті, відсутність апетиту, опасистість, неврологічних розладів, як от недоумство, дистонія, хвороба Паркінсона, хвороба Альцгеймера, епілепсія, хвороба Гантінгтона, синдром Туретта, мозкова ішемія, а також больових синдромів та інших хвороб центральної нервової системи, пов'язаних з нейротрансмісією канабіноїдів, і для лікування шлунково-кишкових та серцево-судинних розладів. Спорідненість сполук за винаходом до рецепторів СВ 1 канабіноїдів визначалася за допомогою препаратів з мембран клітин яєчників китайського хом'яка, до яких стійко трансфектували людські рецептори СВ1 канабісу з [ЗН]СР-55,940 в якості радіоліганду. Після інкубації свіжо приготованих препаратів клітинних мембран з [ЗН]лігандом з доданням сполук за винаходом або без них зв'язаний та вільний ліганди розділяли фільтрацією на фільтрах із скловолокна. Радіоактивність фільтрів вимірювали лічильником рідинних сцинтиляцій. Антагоністична активність сполук за винаходом щодо СВ1 канабіноїдів визначалася функціональним дослідженням клітин яєчників китайського хом'яка, до яких біли стійко впроваджені рецептори СВ1. Аденілилциклаза стимулювалася форсколином та вимірювалася шляхом квантифікації кількості циклічно накопиченого АМФ. Супутня активація рецепторів СВі агоністами рецепторів СВ1 (СР-55940, ®-WIN-55,212-2) може пригнічувати викликане форсколином накопичення цАМФ у залежності від концентрації. Ця реакція за посередництвом рецепторів СВ1 може антагонізуватися антагоністами рецепторів СВ1, такими, як сполуки за винаходом. У сполуках формули (І) є присутній принаймні один центр хіральності (у позиції С4 основної частини 4,5дігідро-1Н-піразолу). Винахід охоплює як рацемати, суміші діастереомерів, так і окремі стереоізомери сполук формули (І). Винахід також стосується Е-ізомерів, Z-ізомерів та E/Z сумішей сполук з формулою (І), де Аа має значення (і) або (іі), як зазначено вище. Сполукам за винаходом можна надавати форми, придатні для введення до організму, відомими способами з застосуванням допоміжних речовин та/або рідких або твердих носіїв. Сполуки за винаходом, що мають формулу (III) (див. вище), де R2 представляє водень, можна одержати за способом, який відомий, наприклад, з: а) заявки ЕР 0021506; b) заявки DE 2529689. Шляхи синтезу сполук за винаходом можуть бути такими: Шлях синтезу А (для сполук формули (І), де Аа має значення (і) або (іі), як описано вище). Етап 1 шляху А Реакція сполуки формули (II) (II) з гідразином або гідразингідратом. Ця реакція дає сполуку формули (III) (III) де R2 - гідроксігрупа. Цю реакцію бажано проводити в полярному розчиннику, наприклад, етанолі. Сполуки формули (III), де R2 - гідроксігрупа, a R та R1 мають значення, як зазначено вище, є новими. Етап 2 шляху А Реакція сполуки формули (III) зі сполукою формули (IVa) або (IVb) де R7 - нижча алкільна група, наприклад, 2-метил-2-тіопсевдосечовина, або з її сіллю в присутності основи. Ця реакція дає похідне 4,5-дігідро-1Н-піразол-1-карбоксамідину формули (V) (V) де Аа має значення (і) або (іі), як зазначено вище. Сполуки формули (V), де Аа має значення (і) або (іі), як наведено вище, a R, R1 та R2 мають значення, наведені вище для сполуки (І), є новими. Або ж сполука формули (III) реагує з так званим гуанілюючим агентом. Як приклади гуанілюючих агентів можна навести 1Н-піразол-1-карбоксамідин та його солі (наприклад, гідрохлорид) або 3,5-діметил-1Н-піразол1-карбоксамідин та його солі (наприклад, нітрат) і т.ін. Така реакція дає похідне карбоксамідину формули (V). Можна також провести реакцію сполуки формули (III) з так званим захисним гуанілюючим агентом. Це можуть бути N-(бензилоксікарбоніл)-1Н-піразол-1-карбоксамідин, N-(трет-бутоксікарбонил)-1Н-піразол-1карбоксамідин, Ν,Ν'-біс-(трет-бутоксікарбонил)-1Н-піразол-1-карбоксамідин та ін. Така реакція дає після зняття захисту сполуку формули (V). Етап 3 шляху А Сполука формули (V) реагує зі сполукою формули R3-SO2X або R3-COX, можливо, заміщеною, де R3 має вищенаведене значення, а X представляє атом галогену. Реакцію бажано вести у присутності основи, наприклад, триетиламіну або апротонного розчинника, наприклад, ацетонітрилу. Реакція дає сполуку (І), де Вb представляє відповідно сульфонил- або карбонил-групу. Шлях синтезу А1 (для сполук формули (І), де Аа має значення (і) або (іі), як зазначено вище). Етап 1 шляху А1 Реакція сполуки формули (III) (III) з похідним тіоціанату формули (VI). (VI) Реакцію бажано вести в інертному органічному розчиннику, наприклад, ацетонітрилі. Ця реакція дає похідне тіокарбоксаміду формули (VII). Сполуки формули (VII), де R, R1, R2, R3 та Вb мають значення, які наведені вище для сполуки (І), є новими. (VII) Етап 2 шляху А1 Реакція сполуки формули (VII) з аміном у присутності солі двовалентної ртуті, наприклад, дає сполуку формули (І), де Аа має значення (і) або (іі), як наведено вище. Цю реакцію бажано вести у полярному органічному розчиннику, наприклад, ацетонітрилі. Шлях синтезу А2 (для сполук формули (І), де Аа має значення (і) або (іі), як описано вище) Етап 1 шляху А2 Реакціясполуки формули (III) (III) з похідним карбаматефіру формули (VIII) (VII) де R7 представляє нижчу алкільну групу, наприклад, метил. Реакцію бажано вести в інертному органічному розчиннику, наприклад, 1,4-діоксані. Реакція дає похідне 4,5-дігідропіразол-1-карбоксаміду формули (IX). Сполуки формули (IX), де R, R1, R2, R3 та Вb мають значення, які наведені вище для сполуки (І), є новими. (IX) Етап 2 шляху А2 Реакція сполуки формули (IX) з галогенуючим агентом, наприклад, РСl3 , дає похідне 4,5-дігідропіразол-1-карбоксімідоїлу формули (X) (X) де R8 представляє атом галогену, наприклад, хлору. Цю реакцію бажано вести в інертному органічному розчиннику, наприклад, хлорбензолі. Сполуки формули (X), де R, R1, R2, R3 та Вb мають значення, які наведені вище для сполуки (І), a R8 представляє атом галогену, є новими. Етап 3 шляху А2 Реакція сполуки формули (X) з аміном дає сполуку формули (І), де Аа має значення (і) або (іі), як описано вище. Цю реакцію бажано вести в інертному органічному розчиннику, наприклад, діхлорметані. Шлях синтезу A3 (для сполук формули (І), де Аа має значення (і) або (іі), як описано вище) Етап 1 шляху A3 Реакція сполуки формули (III) (III) з похідним дітіоімідовугільного ефіру формули (XI) (XI) де R9 представляє С1-3 алкільну групу. Цю реакцію бажано вести у полярному органічному розчиннику, наприклад, ацетонітрилі. Реакція дає похідне карбоксімідотіоефіру формули (XII) (XII) де R9 представляє С1-3 алкільну групу. Сполуки формули (XII), де R, R1, R2, R3 та Вb мають значення, які наведеш вище для сполуки (І), a R9 представляє С1-3 алкільну групу, є новими. Етап 2 шляху A3 Реакція сполуки формули (XII) з аміном дає сполуку формули (І), де Аа має значення (і) або (іі), як описано вище. Цю реакцію бажано вести у полярному органічному розчиннику, наприклад, метанолі. Шлях синтезу В (для сполук формули (І), де Аа має значення (ііі) або (iv), як описано вище) Етап 1 шляху В Реакція сполуки формули (III) (III) зі сполукою формули (XIII) або зі сполукою формули (XIV) відповідно де Bb, R3 та R6 мають вищенаведені значення, a Z являє собою так звану вихідну групу. Ці реакції дають сполуку формули (І), де Аа має значення (ііі) або (iv) відповідно. Шлях синтезу С (для сполук формули (І), де Аа має значення (ν), як описано вище) Етап 1 шляху С Реакція сполуки формули (III) (III) з похідним азіридину формули (XV) або зі сполукою формули (XVI) відповідно де R6 має вищенаведене значення, Ζ представляє так звану вихідну групу, a Prot - так звану захисну групу, наприклад, трет-бутоксікарбонил, бензилоксікарбонил та ін. Ці реакції дають сполуку формули (XVII) (XVII) де Аа має значення (ν), як описано вище. Сполуки формули (XVII), де R, R1, R2, мають значення, які наведені вище для сполуки (І), Аа має значення (ν), як описано вище, a Prot представляє так звану захисну групу, є новими. Після видалення так званої захисної групи відомим чином [див., наприклад, T.W.Greene, P.G.M.Wuts, "Protective Groups in Organic Synthesis", third edition, John Wiley & Sons, Inc., New York, 1999] одержують сполуку (V), де Аа має значення (ν), як описано вище. Сполуки формули (V),де R, R1, R2 мають значення, які наведені вище для сполуки (І), а Аа має значення (V), як описано вище, є новими. Етап 2 шляху С Сполука формули (V), де Аа має значення (ν), як описано вище, реагує зі сполукою формули R3-SO2X або R3-COX, можливо, заміщеною, де R3 має вищенаведене значення, а X представляє атом галогену. Реакцію бажано вести у присутності основи, наприклад, триетиламіну, в апротонному розчиннику, наприклад, ацетонітрилі. Реакція дає сполуку (І), де Вb представляє відповідно сульфоніл- або карбоніл-групу. Або вищезазначена сполука формули (V) може реагувати зі сполукою формули R3-COOH шляхом утворення активного ефіру або в присутності так званого поєднувального реагенту. Одержання сполук ілюструється наступними прикладами. Приклад І 3-(4-хлорфеніл)-4,5-дігідоро-4-гідроксі-4-феніл-1Н-піразол 2-(4-хлорбензоїл)-2-фенілоксіран (112г, 0,43М) розчинюють в етанолі (650мл) при 35°С. До одержаного розчину додають N2H4´H2O при перемішуванні (42мл), і в осад повільно випадає щойно утворений 3-(4хлорфеніл)-4,5-дігідоро-4-гідроксі-4-феніл-1Н-піразол. Кристалам дають вистоятися 16 годин, відфільтровують та промивають послідовно в етанолі, воді, етанолі й нарешті сушать, одержуючи 3-(4-хлорфеніл)-4,5-дігідро-4гідроксі-4-феніл-1Н-піразол (92г, вихід 78%). Точка топлення 195-196°С. Приклад II 3-(4-хлорфеніл)-4,5-дігідро-N-((4-фторфеніл)сульфоніл)-4-феніл-1H-піразол-карбоксамідин Частина А: Суміш 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1H-піразолу (5,13г, 20,0ммоля), гідройодиду 2метил-2-тіопсевдосечовини (5,00г, 23,0ммоля) та пирідіну (10мл) нагрівають з перемішуванням 1 годину при 110°С. Дають відстоятися на ніч при кімнатній температурі, додають діетилетер та відфільтровують осад. Осад тричі промивають порціями діетилетеру й одержують тверду речовину (9г). Точка топлення 230°С. Тверду речовину розчиняють у метанолі (20мл). До розчину по черзі додають розчин 2 N гідроксиду натрію (12мл) та воду (200мл). Осад відфільтровують, промивають двічі діетилетером і потому діізопропилетером. Тверду речовину сушать у вакуумі та одержують 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразолкарбоксамідин (5,1г, вихід 88%). Точка топлення 187-189°С. Частина В: До суміші 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-карбоксамідину (0,50г, 1,68ммоля) та 4-фторфенІлсульфонілхлориду (0,34г, 1,75ммоля) в ацетонітрилі (10мл) додають з перемішуванням N,Nдіметил-4-амінопирідін (0,020г, 0,175ммоля) та триетиламін (1мл). Одержаний розчин перемішують 30 хвилин при кімнатній температурі. Після додання розчину 2N гідроксиду натрію та екстракції етилацетатом (400мл) етилацетатну фазу концентрують у вакуумі. Одержаний брудний осад очищують тонкошаровою хроматографією (1/1об. петролейного етеру та діетилетеру, потому етилацетат). Після концентрування у вакуумі одержують твердий 3-(4-хлорфеніл)-4,5-дігідро-N-((4-фторфеніл)сульфоніл)-4-феніл-1Н-піразолкарбоксамідин (0,55г, вихід 72%). Точка топлення 214-215°С. Аналогічним чином були одержані наступні сполуки формули (І): 4,5-дігідро-N-((4-фторфеніл)сульфоніл)-3-(4-метоксіфеніл)-4-(4-метоксіфеніл)-1Н-піразол-1-карбоксамідин, точка топлення 155-156°С 4,5-дігідро-3-(4-метоксіфеніл)-4-(4-метоксіфеніл)-N-((4-метоксіфеніл)сульфоніл)-1Н-піразол-1карбоксамідин, точка топлення 148-150°С 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-N-((2,4,6-триметилфеніл)сульфоніл)1Н-піразол-карбоксамідин, точка топлення 221-222°С 3-(4-хлорфеніл)-4,5-дігідро-N-((4-фторфеніл)сульфоніл)-4-гідроксі-4-феніл-1Н-піразол-карбоксамідин, точка топлення 227-228°С Приклад IIІ 3-(4-хлорфеніл)-4,5-дігідро-N-(1-нафтоїл)-4-феніл-1Н-піразол-1-карбоксамідин До суміші 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1H-піразол-1-карбоксамідину (0,75г, 2,50ммоля) та 1нафтоїлхлориду (0,4мл, 2,70ммоля) в ацетонітрилі (15мл) додають з перемішуванням триетиламін (1мл). Одержану суміш перемішують при кімнатній температурі 1 годину. Після додання розчину 2N гідроксиду натрію та екстракції етилацетатом етилацетатну фазу концентрують у вакуумі. Одержаний брудний осад очищують тонкошаровою хроматографією (3/1об. петролейного етеру та діетилетеру, потому діетилацетат). Після того концентруванням у вакуумі одержують 3-(4-хлорфеніл)-4,5-дігідрo-N -(1-нафтоїл)-4-феніл-1Ηпіразол-1-карбоксамідин (0,94г, вихід 83%). Точка топлення 206-207°С. Аналогічним чином одержують сполуку формули (І): 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-N-(2-піридоїл)-1Н-піразол-1-карбоксамідин. Точка топлення 118°С. Приклад IV N1,N1-діметил-N2-((4-хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин Частина А: Суміш 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1H-піразолу (12,0г, 46,8ммоля), діметилетеру [(4хлорфеніл)сульфоніл]дітіоімидовугільної кислоти (№ у номенклатурі CAS 13068-12-7) (9,20г, 31,1ммоля) та триетиламіну (15мл) в ацетонітрилі (200мл) нагрівають з перемішуванням при температурі флегми 20 годин. Додають нову порцію 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразолу (12,0г, 46,8ммоля) й нагрівають при температурі флегми ще 16 годин. Після концентрування у вакуумі додають діхлорметан, одержаний розчин двічі промивають водою та сушать над безводним Na2SO4. Після фільтрації та випарювання у вакуумі осад очищують тонкошаровою хроматографією (1/1об. петролейного етеру та діетилетеру), одержуючи 3-(4-хлорфеніл)-Й-((4хлорфеніл) сульфоніл)-4,5-дігідро-4-феніл-1Н-піразол-1-метилетер тіоімідовугільної кислоти (12,5г, вихід 80% відносно діметилетеру [(4-хлорфеніл)сульфоніл]дітіоімідо-вугільної кислоти) у вигляді аморфної твердої речовини. Частина В: До розчину 3-(4-хлорфеніл)-1H-((4-хлорфеніл(сульфоніл)-4,5-дігідро-4-феніл-1Н-піразол-1метилетеру тіоімідовугільної кислоти (4,20г, 8,30ммоля) у метанолі (75мл) додають діметиламін (75мл) і одержаний розчин перемішують при кімнатній температурі 6 годин. Після випарювання у вакуумі та тонкошарової хроматографії (1/1об. петролейного етеру та діетилетеру, потому діетилетер) одержаний твердий осад перекристалізують з діізопропилетеру та одержують Ν1,Ν1-діметил-N2-((4-хлорфеніл) сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин (2,63г, вихід 63%). Точка топлення 182°С. Аналогічним чином одержують сполуки формули (І): N-метил-N'-((4-хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-(3-пиріділ)-1H-піразол-1-карбоксамідин. Точка топлення 101-105°С. N-метил-N'-((4-хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-(4-пиріділ)-1Н-піразол-1-карбоксамідин. Точка топлення 112-115°С. N1,N1-діметил-N2-((4-хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-гідроксі-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення: аморфний. N-етил-N'-((4-хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-гідроксі-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 183-185°С. Приклад V N-метил-N'-(3-(трифторметил)бензоіл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1H-піразол-1-карбоксамідин Частина А: До 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразолу (5,13г, 20,0ммоля) в ацетонітрилі (80мл) додають 3-(трифторметил)бензоїлізотіоціанат (4,62г, 20,0ммоля) при 0°С та перемішують суміш 1 годину. Утворений жовтий осад відфільтровують, промивають невеличкими порціями ацетонітрилу та води відповідно, після чого сушать у вакуумі й одержують 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-N-((3-трифторметил)бензоїл)-1Нпіразол-1-тіокарбоксамід (8,26г, вихід 85%). Точка топлення 180-182°С. Частина В: До суспензії 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-N-((3-трифторметил)бензоїл)-1Н-піразол-1тіокарбоксаміду (4,88г, 10,0ммоля) додають з перемішуванням холодний метиламін (5мл) і одержують зелений розчин. Після додання розчину HgCl2 (3,0г, 11ммолів) у 25мл ацетонітрилу одержану суміш перемішують 3 години. Осад відфільтровують через мембрану, фільтрат концентрують у вакуумі. Після додання етилацетату та 0,5N NaOH етилацетатну фазу відбирають, промивають насиченим водним розчином NaCl та сушать над безводним Na2SO4, фільтрують та концентрують у вакуумі. Хроматографія (9,1об. діхлорметан/ацетон) дає N-метил-N'-(3-(трифторметил) бензоїл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин(0,98г, вихід 20%) у вигляді піни. Точка топлення: аморфний. Rf (силікагель: (9/1об. діхлорметан/ацетон) =0,3. Приклад VI N-мeтил-N'-((4-(xлopфeнiл)cyльфoнiл)-3-(4-xлopфeнiл)-4,5-дiгiдpo-4-фeніл-1H-піразол-1-карбоксамідин Частина А: До розчину метилефіру N-((хлорфеніл)сульфоніл)карбаміновоі кислоти (№ у номенклатурі CAS 34543-04-9) (2,99г, 12,0ммоля) та піридину (4мл) в 1,4-діоксані (20мл) додають 3-(4-хлорфеніл)-4,5-дігідро-4феніл-1Н-піразол (3,39г, 13,2ммоля) і одержану суміш перемішують 4 години при 100°С. Після концентрування у вакуумі осад розчиняють у діхлорметані, послідовно промивають водою, 1N HCl та водою, сушать над безводним Na2SO4, фільтрують та концентрують у вакуумі до обсягу 20мл. Одержані кристали відфільтровують та перекристалізують з метил-трет-бутилетеру, одержуючи 3-(4-хлорфеніл)-N-((4-хлорфеніл)сульфоніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамід (4,75г, вихід 76%). Точка топлення 211-214°С. Частина В: Суміш 3-(4-хлорфеніл)-N-((4-хлорфеніл)сульфоніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксаміду (3,67г, 7,75ммоля) та пентахлориду фосфору (1,69г, 8,14ммоля) у хлорбензолі (40мл) нагрівають при температурі флегми 1 годину. Після ретельного концентрування у вакуумі одержаний N-((4(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксімідоїлхлорид суспендують у діхлорметані та обробляють холодним метиламіном (1,5мл). Після перемішування 1 годину при кімнатній температурі суміш концентрують у вакуумі. Осад кристалізують з діетилетеру та одержують N-метил-N'-((4(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин (2,29г, вихід 61%). Точка топлення 96-98°С (температура розкладу). Аналогічним чином одержують такі сполуки формули (І): N-метил-N'-((3-хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин. Точка топлення 156-160°С. N-метил-N'-((4-(хлорфеніл)сульфоніл)-3-(5-хлор-2-тієніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин. Точка топлення: аморфний. N-пропил-N'-((4-(фторфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин. Точка топлення 129-138°С. N-(2-пропил)-N'-((4-(фторфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1H-піразол-1карбоксамідин. Точка топлення 110-112°С. N-метил-N'-((4-(2-пропил)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин. Точка топлення: аморфний. N-(2-пропил)-N'-((4-(хлорфеніл)сульфоніл)-3-(4-пиріділ)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин. Точка топлення: аморфний. N1-етил-N1-метил-N2 -((4-(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 184°С. N1-етил-N1-метил-N2 -((4-(фторфенІл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 173-176°С. N1,N1-діметил-N2-((4-(трифторметил)феніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 195-196°С. N1,N1-діметил-N2-((3-(метилфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 195-198°С. N1,N1-діметил-N2-((3-(метоксіфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 204-206°С. N-етил-N'-((4-(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин. Точка топлення: аморфний. N-діметиламін-N'-((4-(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 155-159°С. N-метил-N'-((4-)трифторметил)феніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення: аморфний. N1,N1-діметил-N2-((2-(метилфеніл) сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 148-151°С. N-метил-N'-((2,4-(діфторфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1H-піразол-1карбоксамідин. Точка топлення 85°С. N-ацетамід-N'-((4-(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1H-піразол-1-карбоксамідин. Точка топлення: аморфний N-(2,2,2-трифторетил)-N'-((4-(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення: аморфний. N-(2-пиріділ)-N'-((4-(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1H-піразол-1карбоксамідин. Точка топлення 142-146°С. N-(4-пиріділ)-N'-((4-(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1карбоксамідин. Точка топлення 204-206°С. N-феніл-N'-((4-(хлорфеніл)сульфоніл)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразол-1-карбоксамідин. Точка топлення 158-160°С. Приклад VII 3-(4-хлорфеніл)-1-[3-((4-хлорфеніл)сульфоніл)бутаноїл]-4,5-дігідро-4-феніл-1Н-піразол До суміші 3-((4-хлорфеніл)сульфоніл)олійної кислоти (1,85г, 7,00ммоля), діізопропил-етиламіну (3мл) та 1етил-3-(3-діметиламінпропил)карбодіімідгідрохлориду (1,50г, 15,7ммоля) додають з перемішуванням 3(4хлорфеніл)-4-феніл-4,5-дігідро-1Н-піразол (3,00г, 11,7ммоля) і одержану суміш перемішують 16 годин при кімнатній температурі. Після концентрування у вакуумі осад очищують тонкошаровою хроматографією (1/2об. петролейного етеру та діетилетеру, потому діетилетер) та одержують 3-(4-хлорфеніл)-1-[3-((4хлорфеніл)сульфоніл)бутаноїл]-4,5-дігідро-4-феніл-1Н-піразол (3,69г, вихід 63%) у вигляді діастереомерної суміші. Точка топлення: аморфний. Аналогічним чином одержують такі сполуки формули (І): 3-(4-хлорфеніл)-1-[3-(фенілсульфоніл)пропаноїл]-4,5-дігідро-4-феніл-1Н-піразол. Точка топлення 122123°С. 3-(4-хлорфеніл)-1-[3-((4-хлорфеніл)сульфоніл)пропаноїл]-4,5-дігідро-4-феніл-1Н-піразол. Точка топлення 178-181°С. Приклад VIII 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1-[2-((3-(трифторметил)феніл)сульфоніл)етил]-1H-піразол До суміші 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразолу (1,7г, 6,60моля) та колідину (2мл) в ацетонітрилі (25мл) потроху додають з перемішуванням розчин 2-((3-(трифторметил)феніл)сульфоніл)етилхлориду (1,5г, 5,50ммоля) в ацетонітрилі (20мл) і одержаний розчин нагрівають при температурі флегми 16 годин. Після концентрування у вакуумі осад розчинюють в етилацетаті та промивають водним розчином гідрокарбонату натрію. Етилацетатну фазу послідовно промивають розчином IN соляної кислоти та водним розчином гідрокарбонату натрію. Після наступної тонкошарової хроматографії (1/2об. петролейного етеру та діетилетеру) одержують олію, яку кристалізують з діізопропилетеру та одержують 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1-[2-((3(трифторметил)феніл)сульфоніл)етил]-1Н-піразол (0,52г, вихід 19%). Точка топлення 118-119°С. Аналогічним чином одержують такі сполуки формули (І): 3-(4-хлорфеніл)-1-[2-(бензилсульфоніл)етил]-4,5-дігідро-4-феніл-1Н-піразол. Точка топлення 161°С. 3-(4-хлорфеніл)-1-[2-((4-хлорфеніл)сульфоніл)етил]-4,5-дігідро-4-феніл-1Н-піразол. Точка топлення: аморфний. 3-(4-хлорфеніл)-1-[2-((4-хлорфеніл)сульфоніл)етил]-4,5-дігідро-4-гідроксі-4-феніл-1H-піразол. Точка топлення 127-128°С. Приклад IX N-[2-(3-(4-xлopфeнiл)4,5-дiгiдpo-4-фeнiл-1H-пipaзoл-1-iл)eтил]-3-(тpифтopмeтил)-бензолсульфонамід Частина А: Розчин 3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразолу (5,00г, 19,5ммоля) та N-(третбутоксікарбоніл)азіридину (2,00г, 14,0ммоля) у толуолі (100мл) нагрівають з перемішуванням при температурі флегми 16 годин. Після концентрування у вакуумі розчин очищують тонкошаровою хроматографією (3/1об. петролейного етеру та діетилетеру, потому 1/1об. петролейного етеру та діетилетеру). Після концентрування у вакуумі одержаний оліїстий осад кристалізують з діізопропилетеру та одержують 1-[2-(третбутоксікарбоніл)амін)етил]-3-(4-хлорфеніл)4,5-дігідро-4-феніл-1Н-піразол (1,91г, вихід 34%). Завдяки кільком повторним кристалізаціям з маточнику вдається одержати додаткову кількість кристалічного 1-[2-(третбутоксікарбоніл)амін)етил]-3-(4-хлорфеніл)4,5-дігідро-4-феніл-1Н-піразолу (1,19г). Частина В: До розчину 1-[2-(трет-бутоксікарбоніл)амін)етил]-3-(4-хлорфеніл)4,5-дігідро-4-феніл-1Нпіразолу (1,91г, 4,8ммоля) у діхлорметані (50мл) додають трифтороцтову кислоту (5мл) і одержаний розчин перемішують 5 годин при кімнатній температурі. Після концентрування у вакуумі осад розчинюють в етилацетаті та промивають 2N розчином гідроксиду натрію. Етилацетатну фазу висушують над сульфатом магнію, фільтрують та концентрують у вакуумі, одержуючи 1-(2-амінетил)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл1Н-піразол (1,44г, кількісний вихід) у вигляді олії. Частина С: До розчину 1-(2-амінетил)-3-(4-хлорфеніл)-4,5-дігідро-4-феніл-1Н-піразолу (0,56г, 1,87ммоля) та діізопропилетиламіну в ацетонітрилі (20мл) додають 3-трифтор-метил)фенілсульфонілхлорид (0,35мл, 2,18ммоля) і одержаний розчин перемішують 20 хвилин при кімнатній температурі. Після концентрування у вакуумі осад розчиняють в етилацетаті та промивають 2N розчином гідроксиду натрію. Етилацетатну фазу концентрують у вакуумі. Одержану олію кристалізують з невеличкої кількості діізопропилетеру та одержують кристалічний N-[2-(3-(4-хлорфеніл)4,5-дігідро-4-феніл-1Н-піразол-1-іл)етил]-3(трифторметил)бензолсульфонамід (0,44г, вихід 46%). Точка топлення 94-96°С.
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 4,5-dihydro-1н-pyrazole, revealing antagonistic activity relative to св1, a method for producing thereof, pharmaceutical composition and a method for producing thereof, a method for the treatment of diseases (variants)
Автори англійськоюLange Josephus H. M., Kruse Cornelis G., Kruse, Cornelis G., Van Vliet Bernard J.
Назва патенту російськоюПроизводные 4,5-дигидро-1н-пиразола, которые проявляют антагонистическую активность относительно св1, способ их получения, фармацевтическая композиция и способ ее изготовления, способ лечения заболеваний (варианты)
Автори російськоюЛанге Йозефус Г.М., Крузе Корнелис Г., ван Флит Бернард Ж.
МПК / Мітки
МПК: C07D 401/04, A61P 9/10, A61P 1/04, A61P 25/18, A61P 25/14, A61P 9/00, C07D 409/04, C07D 401/12, A61P 3/04, A61P 25/16, A61K 31/415, A61P 25/08, A61P 43/00, A61P 25/22, A61P 25/04, C07D 231/08, A61K 31/4439, A61P 25/24, C07D 231/06, A61P 25/28
Мітки: похідні, виявляють, композиція, фармацевтична, антагоністичну, спосіб, активність, виготовлення, захворювань, лікування, одержання, св1, варіанти, 4,5-дигідро-1н-піразолу
Код посилання
<a href="https://ua.patents.su/8-74367-pokhidni-45-digidro-1n-pirazolu-shho-viyavlyayut-antagonistichnu-aktivnist-shhodo-sv1-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-vigotovlennya-sposib-likuvannya-zak.html" target="_blank" rel="follow" title="База патентів України">Похідні 4,5-дигідро-1н-піразолу, що виявляють антагоністичну активність щодо св1, спосіб їх одержання, фармацевтична композиція та спосіб її виготовлення, спосіб лікування захворювань (варіанти)</a>












