Сіль фосфорної кислоти інгібітора дипептидилпептидази-iv
Номер патенту: 86026
Опубліковано: 25.03.2009
Автори: Ферліта Рассел Р., Чень Алекс Міньхуа, Уенслоу Роберт М., мол., Сайпс Стефен Ховард, Хансен Карл, Відра Вікі К., Лі Айван
Формула / Реферат
1. Дигідрофосфат 4-оксо-4-[3-(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]-1-(2,4,5-трифторфеніл)бутан-2-аміну структурної формули І:
 (І)
(І)
або його фармацевтично прийнятний гідрат.
2. Сіль за п. 1 структурної формули II, що має (R)-конфігурацію хірального центру, позначеного *
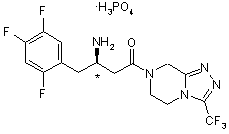 . (ІІ)
. (ІІ)
3. Сіль за п. 1 структурної формули III, що має (S)-конфігурацію хірального центру, позначеного *
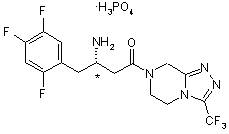 . (ІІІ).
. (ІІІ).
4. Сіль за п. 2, яка відрізняється тим, що вона являє собою кристалічний моногідрат.
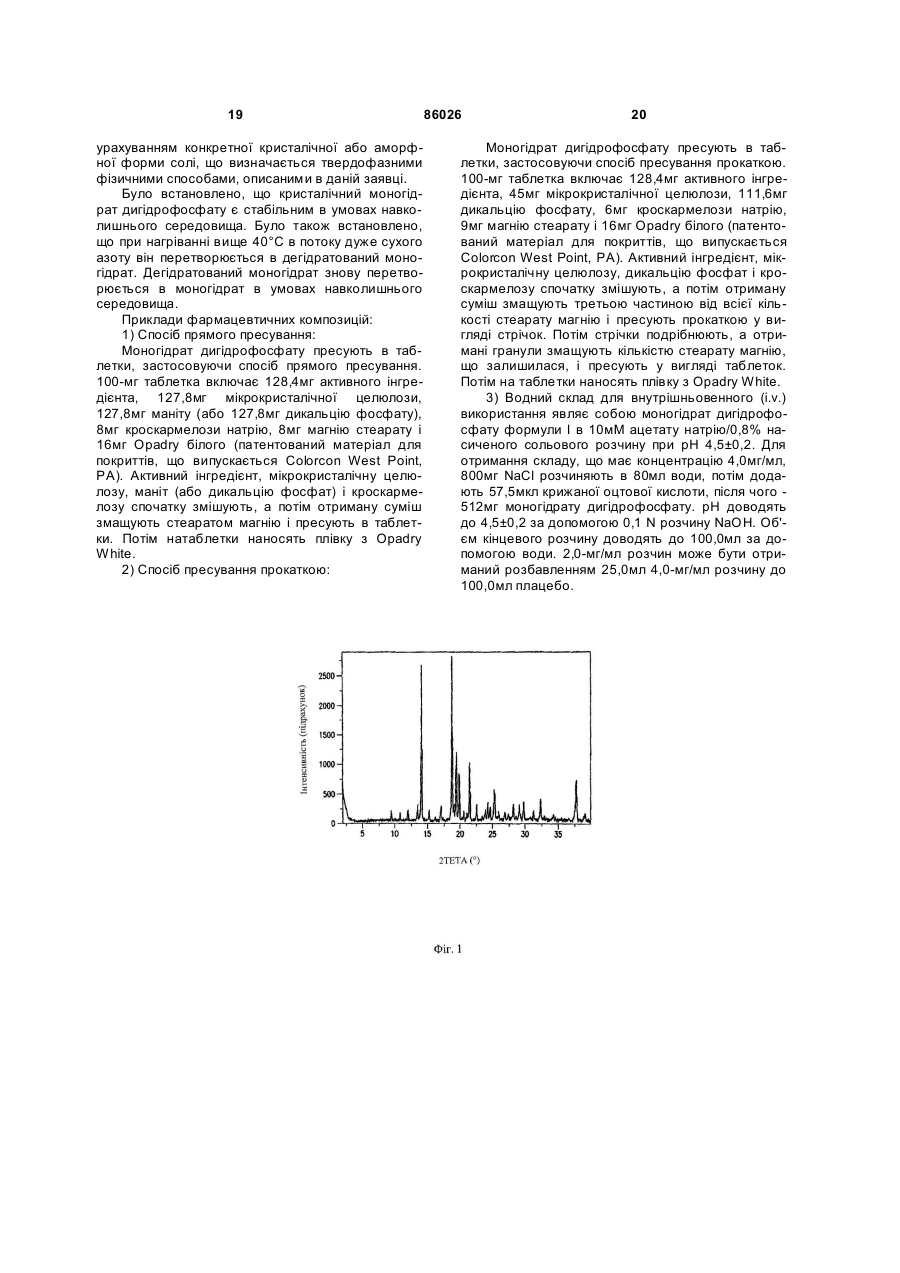
5. Моногідрат за п. 4, який характеризується характерними абсорбційними смугами на рентгенівській порошковій дифракційній картині зі спектральними d-відстанями, що дорівнюють 7,42, 5,48 і 3,96 ангстрем.
6. Моногідрат за п. 5, який додатково характеризується характерними абсорбційними смугами на рентгенівській порошковій дифракційній картині зі спектральними d-відстанями, що дорівнюють 6,30, 4,75 і 4,48 ангстрем.
7. Моногідрат за п. 6, який додатково характеризується характерними абсорбційними смугами на рентгенівській порошковій дифракційній картині зі спектральними d-відстанями, що дорівнюють 5,85, 5,21 і 3,52 ангстрем.
8. Моногідрат за п. 7, який додатково характеризується рентгенівською порошковою дифракційною картиною, представленою на Фіг. 1.
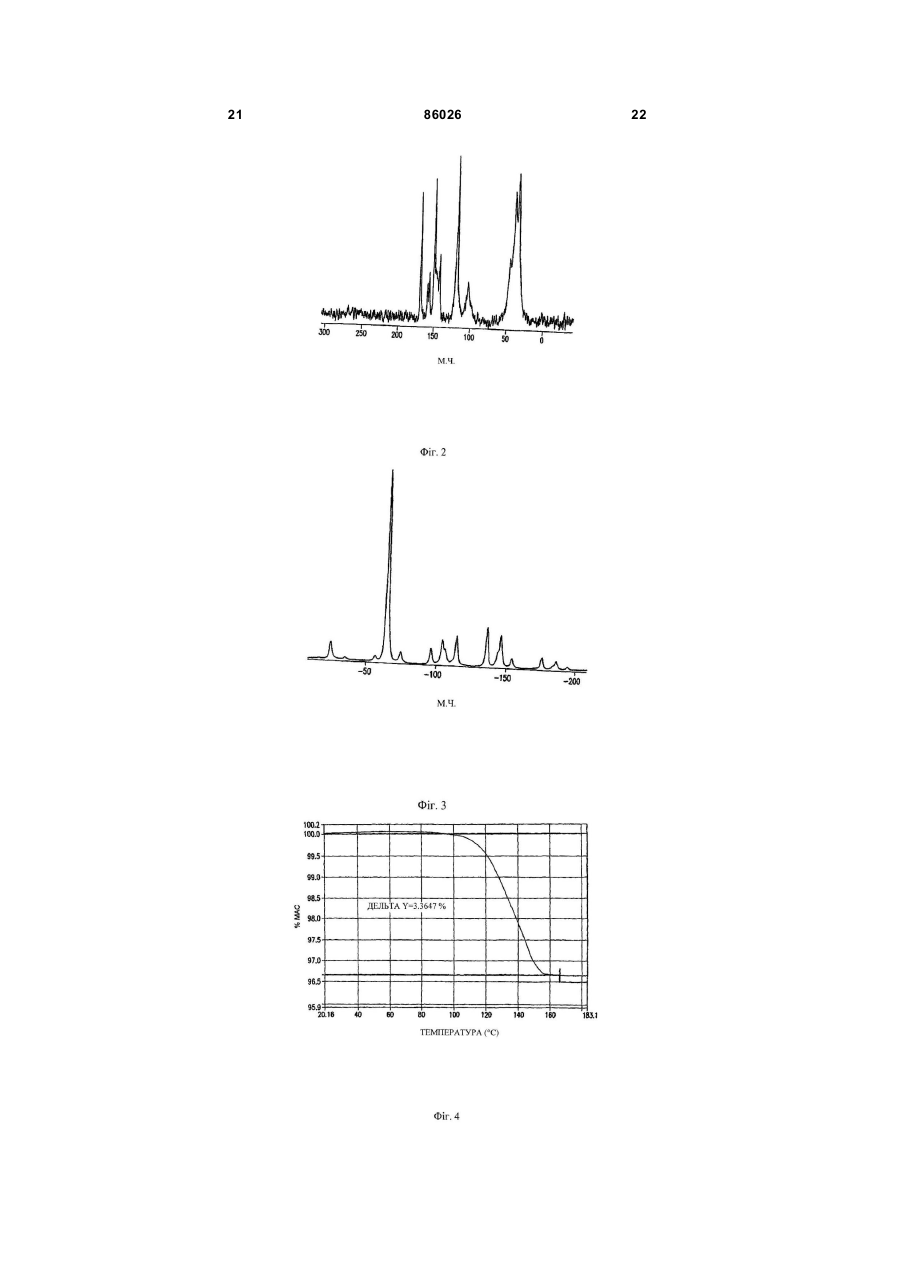
9. Моногідрат за п. 4, який характеризується спектром твердофазного ядерно-магнітного резонансу вуглецю-13 CPMAS, що містить сигнали при 169,1, 120,8 і 46,5 м. ч.
10. Моногідрат за п. 9, який додатково характеризується спектром твердофазного ядерно-магнітного резонансу вуглецю-13 CPMAS, що містить сигнали при 159,0, 150,9 і 40,7 м. ч.
11. Моногідрат за п. 10, який додатково характеризується спектром твердофазного ядерно-магнітного резонансу вуглецю-13 CPMAS, представленим на Фіг. 2.
12. Моногідрат за п. 4, який характеризується спектром твердофазного ядерно-магнітного резонансу фтору-19 MAS, що містить сигнали при -64,5, -114,7, -136,3 і -146,2 м. ч.
13. Моногідрат за п. 12, який додатково характеризується спектром твердофазного ядерно-магнітного резонансу фтору-19 MAS, що містить сигнали при -96,5, -104,4, -106,3 і -154,5 м. ч.
14. Моногідрат за п. 13, який додатково характеризується спектром твердофазного ядерно-магнітного резонансу фтору-19 MAS, представленим на Фіг. 3.
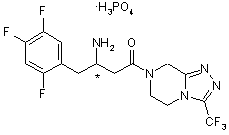
15. Моногідрат за п. 4, який характеризується кривою термогравіметричного аналізу, представленою на Фіг. 4.
16. Моногідрат за п. 4, який характеризується диференціальною скануючою калориметричною кривою, представленою на Фіг. 5.
17. Сіль за п. 4, яка містить детектовану кількість вказаного кристалічного моногідрату.
18. Сіль за п. 4, яка містить від приблизно 5 % до приблизно 100 % мас. вказаного кристалічного моногідрату.
19. Сіль за п. 4, яка містить від приблизно 10 % до приблизно 100 % мас. вказаного кристалічного моногідрату.
20. Сіль за п. 4, яка містить від приблизно 25 % до приблизно 100 % мас. вказаного кристалічного моногідрату.
21. Сіль за п. 4, яка містить від приблизно 50 % до приблизно 100 % мас. вказаного кристалічного моногідрату.
22. Сіль за п. 4, яка містить від приблизно 75 % до приблизно 100 % мас. вказаного кристалічного моногідрату.
23. Сіль за п. 4, вся маса якої по суті являє собою вказаний кристалічний моногідрат.
24. Сіль, яка містить як іони монопротонований катіон 4-оксо-4-[3-(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]-1-(2,4,5-трифторфеніл)бутан-2-аміну і аніон дигідрофосфату.
25. Фармацевтична композиція, яка містить профілактично або терапевтично ефективну кількість солі за п. 1 або її фармацевтично прийнятного сольвату в сполученні з одним або більше фармацевтично прийнятними носіями.
26. Фармацевтична композиція, яка містить профілактично або терапевтично ефективну кількість солі за п. 4 або її фармацевтично прийнятного сольвату в сполученні з одним або більше фармацевтично прийнятними носіями.
27. Спосіб лікування діабету 2 типу, що включає введення пацієнту, потребуючому такого лікування, терапевтично ефективної кількості солі за п. 1 або її фармацевтично прийнятного гідрату.
28. Спосіб лікування діабету 2 типу, що включає введення пацієнту, потребуючому такого лікування, терапевтично ефективної кількості солі за п. 4.
Текст
УКРАЇНА (19) UA (11) 86026 (13) C2 (51) МПК (2009) C07D 487/04 (2006.01) A61K 31/4985 A61P 3/10 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ОПИС ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) СІЛЬ ФОСФОРНОЇ КИСЛОТИ ІНГІБІТОРА ДИПЕПТИДИЛПЕПТИДАЗИ-IV 1 2 N N * F N N CF3 (І) або його фармацевтично прийнятний гідрат. 2. Сіль за п. 1 структурної формули II, що має (R)конфігурацію хірального центру, позначеного * ·H3PO4 F F NH2 * F O N N N N CF3 . (ІІ) N N CF3 . (ІІІ). 4. Сіль за п. 2, яка відрізняється тим, що вона являє собою кристалічний моногідрат. 5. Моногідрат за п. 4, який характеризується характерними абсорбційними смугами на рентгенівській порошковій дифракційній картині зі спектральними d-відстанями, що дорівнюють 7,42, 5,48 і 3,96 ангстрем. 6. Моногідрат за п. 5, який додатково характеризується характерними абсорбційними смугами на рентгенівській порошковій дифракційній картині зі спектральними d-відстанями, що дорівнюють 6,30, 4,75 і 4,48 ангстрем. 7. Моногідрат за п. 6, який додатково характеризується характерними абсорбційними смугами на рентгенівській порошковій дифракційній картині зі спектральними d-відстанями, що дорівнюють 5,85, 5,21 і 3,52 ангстрем. 8. Моногідрат за п. 7, який додатково характеризується рентгенівською порошковою дифракційною картиною, представленою на Фіг. 1. 9. Моногідрат за п. 4, який характеризується спектром твердофазного ядерно-магнітного резонансу вуглецю-13 CPMAS, що містить сигнали при 169,1, 120,8 і 46,5 м. ч. 10. Моногідрат за п. 9, який додатково характеризується спектром твердофазного ядерномагнітного резонансу вуглецю-13 CPMAS, що містить сигнали при 159,0, 150,9 і 40,7 м. ч. 11. Моногідрат за п. 10, який додатково характеризується спектром твердофазного ядерномагнітного резонансу вуглецю-13 CPMAS, представленим на Фіг. 2. 12. Моногідрат за п. 4, який характеризується спектром твердофазного ядерно-магнітного резонан C2 F N N (13) * O 86026 O NH2 (11) NH2 F UA F 3. Сіль за п. 1 структурної формули III, що має (S)конфігурацію хірального центру, позначеного * ·H3PO4 F (19) (21) a200600636 (22) 18.06.2004 (24) 25.03.2009 (86) PCT/US2004/019683, 18.06.2004 (31) 60/482,161 (32) 24.06.2003 (33) US (46) 25.03.2009, Бюл.№ 6, 2009 р. (72) САЙПС СТЕФЕН ХОВАРД, ЧЕНЬ АЛЕКС МІНЬХУА, ФЕРЛІТА РАССЕЛ Р., ХАНСЕН КАРЛ, ЛІ АЙВАН, ВІДРА ВІКІ К., УЕНСЛОУ РОБЕРТ М., МОЛ. (73) МЕРК ЕНД КО., ІНК. (56) WO 03/004498 A 16.01.2003 EDMONDSON, S.D (MERCK)/PROUS SCIENCE: DRUG DATA REPORT, vol. 25, no. 3, 2003, pages 245-246, XP001183238 BARCELONA-SPAIN DATABASE PROUSDDR [Online] 2003, MERCK: XP002295584 Database accession no. 2003:3561 (57) 1. Дигідрофосфат 4-оксо-4-[3-(трифторметил)5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]1-(2,4,5-трифторфеніл)бутан-2-аміну структурної формули І: ·H3PO4 F 3 86026 4 су фтору-19 MAS, що містить сигнали при -64,5, 114,7, -136,3 і -146,2 м. ч. 13. Моногідрат за п. 12, який додатково характеризується спектром твердофазного ядерномагнітного резонансу фтору-19 MAS, що містить сигнали при -96,5, -104,4, -106,3 і -154,5 м. ч. 14. Моногідрат за п. 13, який додатково характеризується спектром твердофазного ядерномагнітного резонансу фтору-19 MAS, представленим на Фіг. 3. 15. Моногідрат за п. 4, який характеризується кривою термогравіметричного аналізу, представленою на Фіг. 4. 16. Моногідрат за п. 4, який характеризується диференціальною скануючою калориметричною кривою, представленою на Фіг. 5. 17. Сіль за п. 4, яка містить детектовану кількість вказаного кристалічного моногідрату. 18. Сіль за п. 4, яка містить від приблизно 5% до приблизно 100% мас. вказаного кристалічного моногідрату. 19. Сіль за п. 4, яка містить від приблизно 10% до приблизно 100% мас. вказаного кристалічного моногідрату. 20. Сіль за п. 4, яка містить від приблизно 25% до приблизно 100% мас. вказаного кристалічного моногідрату. 21. Сіль за п. 4, яка містить від приблизно 50% до приблизно 100% мас. вказаного кристалічного моногідрату. 22. Сіль за п. 4, яка містить від приблизно 75% до приблизно 100% мас. вказаного кристалічного моногідрату. 23. Сіль за п. 4, вся маса якої по суті являє собою вказаний кристалічний моногідрат. 24. Сіль, яка містить як іони монопротонований катіон 4-оксо-4-[3-(трифторметил)-5,6дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]-1(2,4,5-трифторфеніл)бутан-2-аміну і аніон дигідрофосфату. 25. Фармацевтична композиція, яка містить профілактично або терапевтично ефективну кількість солі за п. 1 або її фармацевтично прийнятного сольвату в сполученні з одним або більше фармацевтично прийнятними носіями. 26. Фармацевтична композиція, яка містить профілактично або терапевтично ефективну кількість солі за п. 4 або її фармацевтично прийнятного сольвату в сполученні з одним або більше фармацевтично прийнятними носіями. 27. Спосіб лікування діабету 2 типу, що включає введення пацієнту, потребуючому такого лікування, терапевтично ефективної кількості солі за п. 1 або її фармацевтично прийнятного гідрату. 28. Спосіб лікування діабету 2 типу, що включає введення пацієнту, потребуючому такого лікування, терапевтично ефективної кількості солі за п. 4. Даний винахід стосується конкретної солі інгібітору дипептидилпептидази-IV. Більш конкретно, даний винахід стосується дигідрофосфату 4-оксо4-[3-(трифторметил)-5,6дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]-1(2,4,5-трифторфеніл)бутан-2-аміну, що являє собою сильний інгібітор дипептидилпептидази-IV. Ця нова сіль і її кристалічні гідрати можуть бути використані для лікування і запобігання захворюванням і станам, при яких призначають інгібітор дипептидилпептидази-IV, зокрема, діабету 2 типу, ожиріння і підвищеного кров'яного тиску. Винахід також стосується фармацевтичних композицій, що включають вказаний дигідрофосфат і його кристалічні гідрати, які можуть бути використані для лікування діабету 2 типу, ожиріння і підвищеного кров'яного тиску, а також способів отримання вказаного дигідрофосфату і його кристалічних гідратів і фармацевтичних композицій на їх основі. Інгібування дипептидилпептидази-IV (DP-IV), ферменту, який інактивує як глюкозозалежний інсулінотропний пептид (GIF), так і глюкагоноподібний пептид 1 (GLP-1), являє собою новий підхід до лікування і запобігання діабету 2 типу, також відомого як інсуліннезалежний цукровий діабет (NIDDM). Був зроблений огляд терапевтичного потенціалу інгібіторів DP-IV для лікування діабету 2 типу: C.F. Deacon and JJ. Hoist, "Dipeptidyl peptidase IV inhibition as an approach to the treatment and prevention of Type 2 diabetes: a historical perspective", Biochem. Biophys. Res. Commun., 294: 1-4 (2000); K. Augustyns, et al., "Dipeptidyl peptidase IV inhibition as new therapeutic agents for the treatment of Type 2 diabetes", Expert. Opin. Ther. Patents, 13: 499-510 (2003); andD.J. Drucker, "Therapeutic potential of dipeptidyl peptidase IV inhibitors for the treatment of Type 2 diabetes", Expert Opin. Investig. Drugs, 12: 87-100 (2003). WO 03/004498 (опублікована 16 січня 2003 року) на ім'я Merck & Co., описує клас бетаамінотетрагідротриазоло[4,3-а]піразинів, які являють собою сильні інгібітори DP-IV і тому можуть бути використані для лікування діабету 2 типу. У WO 03/004498 конкретно описаний 4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3а]піразин-7(8Н)-іл]-1-(2,4,5-трифторфеніл)бутан-2амін. Фармацевтично прийнятні солі даної сполуки загалом входять в об'єм WO 03/004498. Однак у вищенаведеному посиланні відсутній опис уперше виявленої одноосновної солідигідрофосфату 4-оксо-4-[3-(трифторметил)-5,6дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]-1(2,4,5-трифторфеніл)бутан-2-аміну, що має структурну формулу І, що приводиться нижче. Даний винахід стосується нового дигідрофосфату інгібітору дипептидилпептидази-IV (DP-IV), тобто 4-оксо-4-[3-(трифторметил)-5,6дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]-1(2,4,5-трифторфеніл)бутан-2-аміну, і його кристалічних гідратів, зокрема кристалічного моногідрату. 5 Дигідрофосфат і кристалічні гідрати згідно з даним винаходом забезпечують переваги при отриманні фармацевтичних композицій 4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3а]піразин-7(8Н)-іл]-1-(2,4,5-трифторфеніл)бутан-2аміну, такі як легкість обробки, транспортування і дозування. Зокрема, вони мають підвищену фізичну і хімічну стабільність, таку як стабільність до навантаження, високих температур і вологості, а також поліпшені фізико-хімічні властивості, такі як розчинність і швидкість розчинення, які роблять їх особливо придатними для отримання різних фармацевтичних препаративних форм. Даний винахід також стосується фармацевтичних композицій, що включають нову сіль і її гідрати, а також способів їх застосування як інгібіторів DP-IV, зокрема, для запобігання або лікування діабету 2 типу, ожиріння і підвищеного кров'яного тиску. Фіг.1 являє собою характерну рентгенівську дифракційну картину кристалічного моногідрату дигідрофосфату структурної формули II. Фіг.2 являє собою спектр ядерно-магнітного резонансу (ЯМР) з крос-поляризаційним обертанням під магічним кутом (CPMAS) вуглецю-13 кристалічного моногідрату дигідрофосфату структурної формули II. Фіг.3 являє собою спектр ядерно-магнітного резонансу (ЯМР) з обертанням під магічним кутом (MAS) фтору-19 кристалічного моногідрату дигідрофосфату структурної формули II. Фіг.4 являє собою типову криву термогравіметричного аналізу (TGA) кристалічного моногідрату дигідрофосфату структурної формули II. Фіг.5 являє собою типову криву диференціальної скануючої калориметрії (DSC) кристалічного моногідрату дигідрофосфату структурної формули II. Даний винахід стосується нової одноосновної солі-дигідрофосфату 4-оксо-4-[3-(трифторметил)5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]1-(2,4,5-трифторфеніл)бутан-2-аміну наступної структурної формули І: або її кристалічного гідрату. Зокрема, даний винахід стосується кристалічного моногідрату дигідрофосфату формули І. Дигідрофосфат згідно з даним винаходом має центр асиметрії біля стереогенного атома вуглецю, позначеного * і тому може існувати у вигляді рацемату, рацемічної суміші і окремих енантіомерів, при цьому всі ізомерні форми входять в об'єм даного винаходу. Окремі енантіомери, по суті вільні від іншого, входять в об'єм даного винаходу, так само як і суміші двох енантіомерів. Один з варіантів даного винаходу стосується дигідрофосфату (2R)-4-okco-4-[3-(трифторметил)5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл] 86026 6 1-(2,4,5-трифторфеніл)бутан-2-аміну формули II: структурної або його кристалічного гідрату. Другий варіант даного винаходу стосується дигідрофосфату (2S)-4-okco-4-[3-(трифторметил)5,6-дигідро[1,2,4]триазоло[4,3-а]піразин-7(8Н)-іл]1-(2,4,5-трифторфеніл)бутан-2-аміну структурної формули III: або його кристалічного гідрату. Більш конкретно, дигідрофосфат згідно з даним винаходом включає один молярний еквівалент моно-протонованого катіону 4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3а]піразин-7(8Н)-іл]-1-(2,4,5-трифторфеніл)бутан-2аміну і один молярний еквівалент аніону дигідрофосфату (біфосфату). Відповідно до іншого варіанту даного винаходу дигідрофосфат формул І-Іll являє собою кристалічний моногідрат. Згідно з однією з категорій даного винаходу, кристалічний гідрат являє собою кристалічний моногідрат. Наступний варіант даного винаходу стосується лікарської речовини з дигідрофосфату формул І-llІ, що включає кристалічний моногідрат, присутній в детектованій кількості. Під "лікарською речовиною" мається на увазі активний фармацевтичний інгредієнт ("АРІ"). Кількість кристалічного гідрату в лікарській речовині може бути визначена за допомогою фізичних способів, таких як рентгенівська порошкова дифракція, твердофазна ядерна магнітно-резонансна спектроскопія з обертанням під магічним кутом (MAS) фтору-19, твердофазна ядерна магнітно-резонансна спектроскопія з кросполяризаційним обертанням під магічним кутом (CPMAS) вуглецю-13, твердофазна інфрачервона спектроскопія з фур'є-перетворенням і спектроскопія комбінаційного розсіювання Рамана. Згідно з першою категорією даного варіанту, в лікарській речовині присутньо від приблизно 5% до приблизно 100% мас. кристалічного моногідрату. Згідно з другою категорією даного варіанту, в лікарській речовині присутньо від приблизно 10% до приблизно 100% мас. кристалічного моногідрату. Згідно з третьою категорією даного варіанту, в лікарській речовині присутньо від приблизно 25% до приблизно 100% мас. кристалічного моногідрату. Згідно з четвертою категорією даного варіанту, в лікарській речовині присутньо від приблизно 50% до приблизно 100% мас. кристалічного моногідрату. Згідно з п'ятою категорією даного варіанту, в лікарській 7 речовині присутньо від приблизно 75% до приблизно 100% мас. кристалічного моногідрату. Відповідно до шостої категорії даного варіанту, по суті вся лікарська речовина з дигідрофосфату являє собою кристалічний моногідрат згідно з даним винаходом, тобто лікарська речовина з дигідрофосфату по суті являє собою моногідрат в чистій фазі. Кристалічний дигідрофосфат згідно з даним винаходом має фармацевтичні переваги перед вільною основою і раніше описаним гідрохлоридом (WO 03/004498) при отриманні фармацевтичного лікарського продукту, що містить фармакологічно активний інгредієнт. Зокрема, підвищена хімічна і фізична стабільність кристалічного моногідрату дигідрофосфату володіє переважними властивостями при отриманні твердих фармацевтичних препаративних форм, що містять фармакологічно активний інгредієнт. Дигідрофосфат згідно з даним винаходом, що виявляє сильні властивості з інгібування DP-IV, особливо підходить для запобігання або лікування діабету 2 типу, ожиріння і підвищеного кров'яного тиску. Інший аспект даного винаходу стосується способу запобігання або лікування клінічних станів, при яких призначають інгібітор DP-IV, що включає введення пацієнту, потребуючому такого запобігання або лікування, профілактично або терапевтично ефективної кількості дигідрофосфату структурної формули І або його гідрату, зокрема кристалічного моногідрату. Такі клінічні стани включають діабет, зокрема, діабет 2 типу, гіперглікемію, інсулінорезистентність і ожиріння. Даний винахід також стосується використання дигідрофосфату структурної формули І або його гідрату, зокрема кристалічного моногідрату, для отримання лікарського засобу для запобігання або лікування клінічних станів, при яких призначають інгібітор DP-IV. Даний винахід також стосується фармацевтичних композицій, що включають дигідрофосфатну сіль структурної формули І або його гідрат, зокрема, кристалічний моногідрат, в сполученні з одним або більше фармацевтично прийнятними носіями або наповнювачами. Згідно з першим варіантом, фармацевтична композиція включає терапевтично ефективну кількість активного фармацевтичного інгредієнту в суміші з фармацевтично прийнятними наповнювачами, в яких активний фармацевтичний інгредієнт включає детектовану кількість кристалічного моногідрату згідно з даним винаходом. Відповідно до другого варіанту, фармацевтична композиція включає терапевтично ефективну кількість активного фармацевтичного інгредієнта в суміші з фармацевтично прийнятними наповнювачами, в яких активний фармацевтичний інгредієнт включає від приблизно 5% до приблизно 100% мас. кристалічного моногідрату згідно з даним винаходом. Відповідно до першої категорії другого варіанту, активний фармацевтичний інгредієнт в таких композиціях включає від приблизно 10% до приблизно 100% мас. кристалічного моногідрату. Відповідно до другої категорії даного варіанту, активний фармацевтичний інгредієнт в таких композиціях включає від приблизно 25% до приблизно 86026 8 100% мас. кристалічного моногідрату. Відповідно до третьої категорії даного варіанту, активний фармацевтичний інгредієнт в таких композиціях включає від приблизно 50% до приблизно 100% мас. кристалічного моногідрату. Відповідно до четвертої категорії даного варіанту, активний фармацевтичний інгредієнт в таких композиціях включає від приблизно 75% до приблизно 100% мас. кристалічного моногідрату. Відповідно до п'ятої категорії даного варіанту, по суті весь активний фармацевтичний інгредієнт являє собою кристалічний моногідрат дигідрофосфату згідно з даним винаходом, тобто активний фармацевтичний інгредієнт по суті являє собою моногідрат дигідрофосфату в чистій фазі. Композиції згідно з даним винаходом переважно мають вигляд разових препаративних форм, таких як таблетки, пілюлі, капсули, порошки, гранули, стерильні розчини або суспензії, дозовані аерозолі або рідкі розпилювачі, краплі, ампули, пристрої для самостійних ін'єкцій або супозиторії. Дані композиції призначені для перорального, парентерального, інтраназального, сублінгвального або ректального введення, або для введення шляхом інгаляції або інсуфляції. Отримання композицій згідно з даним винаходом може бути легко здійснене способами, відомими в даній галузі техніки, наприклад, описаними в Remington's Pharmaceutical Sciences, 17th ed., 1995. Схему прийому вибирають відповідно до різних чинників, включаючи тип, вид, вік, масу, стать і медичний стан пацієнта; тяжкість стану, що піддається лікуванню; спосіб введення, а також ниркову і печінкову функцію пацієнта. Лікар середньої кваліфікації, ветеринар або клініцист може легко визначити і призначити ефективну кількість лікарського засобу, необхідну для запобігання, протидії або затримки розвитку стану. Пероральні дози згідно з даним винаходом, що застосовуються для отримання вищезгаданої дії, варіюються від приблизно 0,01мг на кг масу тіла в день (мг/кг/день) до приблизно 100мг/кг/день, переважно - від 0,01 до 10мг/кг/день, і найбільш переважно - від 0,1 до 5,0мг/кг/день. При пероральному введенні композиції переважно мають вигляд таблеток, що містять 0,01, 0,05, 0,1,0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 200 і 500 міліграмів активного інгредієнта для симптоматичного підбору дози для пацієнта, що піддається лікуванню. Лікарський засіб звичайно містить приблизно від 0,01 до 500мг активного інгредієнта, переважно - приблизно від 1 до 200мг активного інгредієнта. При внутрішньовенному введенні найбільш переважні дози варіюються приблизно від 0,1 до 10мг/кг/хвилина під час вливання з постійною швидкістю. Кристалічні форми композицій згідно з даним винаходом переважно вводять у вигляді разової добової дози, або загальна добова доза може бути введена у вигляді розділених доз два, три або чотири рази на добу. Крім того, кристалічні форми композицій згідно з даним винаходом можуть бути введені інтраназальним способом шляхом місцевого застосування відповідних інтраназальних наповнювачів, або трансдермальними способами, з допо 9 могою трансдермальних накладок на шкіру, добре відомих рядовим фахівцям в даній галузі техніки. При введенні з використанням трансдермальної системи доставки переважним, безумовно, є безперервне, а не переривчасте введення дози при здійсненні всієї схеми прийому композиції. При використанні способів згідно з даним винаходом детально описані тут дигідрофосфат і кристалічні гідрати здатні утворювати активний фармацевтичний інгредієнт, що звичайно вводиться в суміші з відповідними фармацевтичними розріджувачами, наповнювачами або носіями (які загалом називаються тут "матеріалами-носіями"), вибраними з урахуванням передбачуваного виду використання, тобто таблетки для перорального використання, капсули, еліксири, сиропи і т. п., і відповідними відомим фармацевтичним способам. Наприклад, при пероральному введенні у вигляді таблетки або капсули активний фармацевтичний інгредієнт може бути поєднаний з нетоксичним, фармацевтично прийнятним інертним носієм для перорального введення, таким як лактоза, крохмаль, сахароза, глюкоза, метилцелюлоза, стеарат магнію, дикальцію фосфат, кальцію сульфат, маніт, сорбіт і т. п.; при пероральному введенні в рідкому вигляді активний фармацевтичний інгредієнт може бути поєднаний з будь-яким нетоксичним, фармацевтично прийнятним інертним носієм для перорального введення, таким як етанол, гліцерин, вода і т. п. Більше того, при бажанні або необхідності в суміш можуть бути також введені прийнятні зв'язувальні речовини, змащувальні речовини, розщеплювальні агенти і фарбувальні агенти. Прийнятні зв'язувальні речовини можуть включати крохмаль, желатин, природний цукор, такий як глюкоза або бета-лактоза, кукурудзяні підсолоджувачі, природні і синтетичні смоли, такі як аравійська камедь, трагакант або альгінат натрію, карбоксиметилцелюлоза, поліетиленгліколь, віск і т. п. Змащувальні речовини, що використовуються в таких препаративних формах, включають натрію олеат, натрію стеарат, магнію стеарат, натрію бензоат, натрію ацетат, натрію хлорид і т. п. Розщеплювачі включають, без обмежень, крохмаль, метилцелюлозу, агар, бентоніт, ксантанову смолу і т. п. Було встановлено, що дигідрофосфат структурної формули І і кристалічний моногідрат мають високу розчинність у воді, що робить їх особливо придатними для отримання складів, зокрема, складів для інтраназального і внутрішньовенного застосування, які вимагають відносно концентрованих водних розчинів активного інгредієнта. Було встановлено, що розчинність кристалічного моногідрату дигідрофосфату формули І у воді складає близько 72мг/мл. Згідно з наступним аспектом, даний винахід стосується способу отримання дигідрофосфату формули І, що включає взаємодію 4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3а]піразин-7(8Н)-іл]-1-(2,4,5-трифторфеніл)бутан-2аміну наступної структурної формули IV: 86026 10 з приблизно одним еквівалентом фосфорної кислоти у прийнятному С1-С5 алканолі, такому як метанол, етанол, ізопропіловий спирт (IPА), ізоаміловий спирт (ІАА), або водному С1-С5 алканолі. Взаємодію здійснюють в діапазоні температур від приблизно 25°С до приблизно 80°С. Розчин фосфорної кислоти може бути доданий до розчину аміну, або навпаки. Кристалічний моногідрат дигідрофосфату отримують кристалізацією з водного розчину дигідрофосфату згідно з описаною нижче методикою. Загальні способи кристалізації моногідрату дигідрофосфату структурної формули і: (a) У системі вода/етанол при температурі 25°С: (1) кристалізація з суміші сполуки І в етанолі і воді таким чином, що вміст води складає більше 31% мас, (2) витягання твердої фази, що отримується, і (3) видалення з неї розчинника. (b) У системі ізоаміловий спирт (ІАА)/вода при температурі 25°С: (1) кристалізація з суміші сполуки І в ІАА і воді таким чином, що вміст води складає більше 2,9% мас; (2) витягання твердої фази, що отримується; і (3) видалення з неї розчинника. (c) У системі ІАА/вода при температурі 40°С: (1) кристалізація з суміші сполуки І в ІАА і воді таким чином, що вміст води складає більше 3,6% мас; (2) витягання твердої фази, що отримується; і (3) видалення з неї розчинника. (d) У системі ІАА/вода при температурі 60°С: (1) кристалізація з суміші сполуки І в ІАА і воді таким чином, що вміст води складає більше 4,5% мас; (2) витягання твердої фази, що отримується; і (3) видалення з неї розчинника. (є) У системі ізопропіловий спирт (ІРА)/вода при температурі 25°С: (1) кристалізація з суміші сполуки І в ІРА і воді таким чином, що вміст води складає більше 7,0% мас; (2) витягання твердої фази, що отримується; і (3) видалення з неї розчинника. (f) У системі IP А/вода при температурі 40°С: (1) кристалізація з суміші сполуки І в ІРА і воді таким чином, що вміст води складає більше 8,1% мас; (2) витягання твердої фази, що отримується; і (3) видалення з неї розчинника. (g) У системі IP А/вода при температурі 75°С: (1) кристалізація з суміші сполуки І в ІРА і воді таким чином, що вміст води складає більше 20% мас; (2) витягання твердої фази, що отримується; і (3) видалення з неї розчинника. 11 Вихідна сполука структурної формули IV може бути отримана способами, представленими нижче на схемах 1-3 і в прикладі 1. Згідно з наступним аспектом, даний винахід стосується способу лікування і/або запобігання клінічним станам, при яких призначають інгібітор DP-IV, що включає введення пацієнту, потребуючому такого запобігання або лікування, профілактично або терапевтично ефективної кількості солі вищенаведеної формули І або її кристалічного гідрату. Наступні необмежувальні приклади призначені для ілюстрації даного винаходу і не повинні розглядатися як такі, що обмежують об'єм або суть даного винаходу. Описані тут сполуки можуть існувати як таутомери, такі як кето-енольні таутомери. Окремі таутомери, рівно як і їх суміші, відносяться до сполук структурної формули І. Термін "% енантіомерного надлишку" (скорочено "єн") означає процентний вміст основного енантіомеру відносно процентного вмісту другорядного енантіомеру. Таким чином, 70% енантіомерний надлишок відповідає утворенню 85% одного енантіомеру і 15% іншого. Термін "енантіомерний надлишок" синонімічний терміну "оптична чистота". Приклад Моногідрат дигідрофосфату (2R)-4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3а]піразин-7(8H)-іл]-1-(2,4,5-трифторфеніл)бутан-2аміну Отримання гідрохлоріду 3-(трифторметил)5,6,1,8-тетрадигідро[1,2,4]триазоло[4,3-а]піразину (1-4) Стадія А: Отримання бісгідразиду (1-1) Гідразин (20,1г, 35% мас. у воді, 0,22мол) змішують з 310мл ацетонітрилу. Протягом 60 хвилин додають 31,5г етилтрифторацетату (0,22мол). Внутрішня температура підвищується з 14°С до 25°С. Отриманий розчин витримують при температурі 22-25°С протягом 60 хвилин. Розчин охоло 86026 12 джують до 7°С. 17,9г 50% водного NaOH (0,22мол) і 25,3г хлорацетилхлориду (0,22мол) додають одночасно протягом 130 хвилин при температурі нижче 16°С. По завершенні взаємодії суміш піддають вакуумній дистиляції для видалення води і етанолу при температурі 27 ~ 30°С і тиску 26 ~ 27мм рт. стовпа. Під час дистиляції повільно додають 720мл ацетонітрилу, підтримуючи постійний об'єм (приблизно 500мл). Суміш фільтрують, видаляючи хлорид натрію. Осад промивають приблизно 100мл ацетонітрилу. Після видалення розчинника отримують біс-гідразид 1-1 (43,2г, вихід 96,5%, чистота 94,4% по площі внаслідок аналізу ВЕРХ). 1 Н-ЯМР (400 МГц, ДМСО-d6): δ 4,2 (с, 2Н,) 10,7 (с, 1 Η) і 11,6 (с, 1Н) м.ч. 13 С-ЯМР (100 МГц, ДМСО-d6): 6 41,0, 116,1 (к, J = 362 Гц), 155,8 (к, J = 50 Гц) і 165,4 м.ч. Стадія В: Отримання 5-(трифторметил)-2(хлорметил)-1,3,4-оксадіазолу (1-2) Бісгідразид 1-1 зі стадії А (43,2г, 0,21мол) в ацетонітрилі (ACN) (82мл) охолоджують до 5°С. Додають оксихлорид фосфору (32,2г, 0,21мол), підтримуючи температуру нижче 10°С. Суміш нагрівають до 80°С і витримують при даній температурі протягом 4 годин доти, поки ВЕРХ не покаже менше 2% площі 1-1. В окремій посудині змішують 260мл IP Ac і 50мл води і охолоджують до 0°С. Реакційну суспензію завантажують в гасник, підтримуючи внутрішню температуру на рівні нижче 10°С. Після додавання суміш енергійно перемішують протягом 30 хвилин, температуру підвищують до кімнатної температури і водний шар відділяють. Потім органічний шар промивають 215мл 20% мас. водним сольовим розчином. Згідно з аналізом ВЕРХ, вихід після обробки становить 86-92%. Леткі речовини видаляють дистиляцією при тиску 7580мм рт. стовпа і температурі 55°С, отримуючи масло, яке може бути використане безпосередньо на стадії С без подальшого очищення. Продукт також може бути підданий очищенню дистиляцією, при цьому вихід 1-2 становить 70-80%. 1 H-ЯМР (400 МГц, CDCl3): δ 4,8 (с, 2Н) м.ч. 13 С-ЯМР (100 МГц, CDC13): δ 32,1, 115,8 (к, J = 337 Гц), 156,2 (к, J = 50 Гц) і 164,4 м.ч. Стадія С: Отримання N-[(2Z)-піперазин-2іліден]трифтор-ацетогідразиду (1-3) До розчину етилендіаміну (33,1г, 55мол) в метанолі (150мл), охолодженому до -20°С, додають дистильований оксадіазол 1-2 зі стадії В (29,8г, 0,16мол), підтримуючи внутрішню температуру на рівні -20°С. Завершивши додавання, отриману суспензію витримують при температурі -20°С протягом години. Потім додають етанол (225мл) і суспензію повільно нагрівають до -5°С. Через 60 хвилин при температурі -5°С суспензію фільтрують і промивають етанолом (60мл) при температурі -5°С. Отримують амідин 1-3 у вигляді білої твердої речовини з виходом 72% (24,4г, чистота 99,5% мас. по площі внаслідок аналізу ВЕРХ). 1 Н-ЯМР (400 МГц, ДМСО-d6): δ 2,9 (τ, 2Η), 3,2 (τ, 2Η), 3,6 (с, 2Н) і 8,3 (ш, 1Н) м.ч. 13 С-ЯМР (100 МГц, ДМСО-d6): δ 40,8, 42,0, 43,3, 119,3 (к, J = 350 Гц), 154,2 і 156,2 (к, J = 38 Гц) м.ч. 13 Стадія D: Отримання 3-(трифторметил)5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піразину гідрохлориду (1-4) Суспензію амідину 1-3 (27,3г, 0,13мол) в 110мл метанолу нагрівають до 55°С. При даній температурі протягом 15 хвилин додають 37% хлористоводневу кислоту (11,2мл, 0,14мол). Під час додавання всі тверді речовини розчиняються, утворюючи прозорий розчин. Суміш витримують протягом 30 хвилин. Розчин охолоджують до 20°С і витримують при даній температурі до утворення затравкового шару (від 10 хвилин до години). При температурі 20°С протягом години додають 300мл МТВЕ. Отриману суспензію охолоджують до 2°С, витримують протягом 30 хвилин і фільтрують. Тверді речовини промивають 50мл етанолу:МТВЕ (1:3) і сушать у вакуумі при 45°С. Вихід триазолу 14 становить 26,7г (чистота 99,5% мас. по площі внаслідок аналізу ВЕРХ). 1 H-ЯМР (400 МГц, ДМСО-d6): δ 3,6 (τ, 2Н), 4,4 (τ, 2Н), 4,6 (с, 2Н) і 10,6 (ш, 2Н) м.ч.; 13 С-ЯМР (100 МГц, ДМСО-d6): δ 39,4, 39,6, 41,0, 118,6 (к, J = 325 Гц), 142,9 (к, J = 50 Гц) і 148,8 м.ч. Стадія А: отримання 4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло [4,3а]піразин-7(8Н)-іл]-1-(2,4,5-трифторфеніл)бутан-2ону (2-3) 2,4,5-Трифторфенілоцтову кислоту (2-1) (150г,0,789мол), кислоту Meldrum (125г, 0,868мол) і 4-(диметиламіно)-піридин (DMAP) (7,7г, 0,063мол) вміщують в 5-літрову тригорлу колбу. Однією порцією при кімнатній температурі додають Ν,Ν-диметилацетамід (DMAc) (525мл) для розчинення твердих речовин. Ν,Νдіізопропілетиламіну (282мл, 1,62мол) додають однією порцією при кімнатній температурі, підтримуючи температуру нижче 40°С. По краплях протягом 1-2 годин додають півалоїлхлорид (107мл, 0,868мол), підтримуючи температуру від 0 до 5°С. 86026 14 Реакційну суміш витримують при температурі 5°С протягом години. Однією порцією додають триазолгідрохлорид 1-4 (180г, 0,789мол) при температурі 40-50°С. Реакційний розчин витримують при температурі 70°С протягом декількох годин. Потім по краплях додають водний розчин гідрокарбонату натрію (625мл) при температурі 20-45°С. Партію затравлюють кристалами і витримують при температурі 20-30°С протягом 1-2 годин. Потім по краплях протягом 2-3 годин додатково додають 525мл водного розчину гідрокарбонату натрію. Після старіння при кімнатній температурі протягом декількох годин суспензію охолоджують до 0-5°С і витримують протягом години перед фільтрацією твердої речовини. Вологий осад промивають із заміщенням 20% водним DMAc (300мл), потім двома додатковими порціями 20% водного DMAc (400мл) і, нарешті, водою (400мл). Осад сушать всмоктуванням при кімнатній температурі. Виділений вихід кінцевого продукту 2-3 становить 89%. Стадія B: отримання (2Ζ)-4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3а]піразин-7(8H)-іл]-1-(2,4,5-трифторфеніл)бут-2-ен2-аміну (2-4) У 5-л круглодонну колбу вміщують метанол (100мл), кетоамід 2-3 (200г) і ацетат амонію (110,4г). Потім додають метанол (180мл) і 8% водний гідроксид амонію (58,6мл), підтримуючи температуру під час додавання на рівні нижче 30°С. До реакційної суміші додатково додають метанол (100мл). Суміш нагрівають при температурі дефлегмації і витримують протягом 2 годин. Реакційну суміш охолоджують до кімнатної температури, а потім приблизно до 5°С на крижаній бані. Через 30 хвилин тверду частину фільтрують і сушать, отримуючи 2-4 у вигляді твердої речовини (180г); т. пл. 271,2°С. Стадія С: отримання (2R)-4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4] триазоло[4,3а]піразин-7(8H)-іл]-1-(2,4,5-трифторфеніл)бутан-2аміну (2-5) У 500-мл колбу вмішують димер хлор(1,5циклооктадієн)-родію(І) {[Rh(cod)Cl]2} (292мг, 1,18ммол) і (R,S) t-бутил Josiphos (708мг, 1,3ммол) в атмосфері азоту. Потім додають дегазований МеОН (200мл) і суміш перемішують при кімнатній температурі протягом години. У 4-л автоклав для гідрування вміщують енамінамід 2-4 (118г, 0,29мол) разом з МеОН (1л). Суспензію піддають дегазуванню. Потім розчин каталізатора переносять в автоклав для гідрування в атмосфері азоту. Після трикратного дегазування енамінамід гідрують під тиском 200 фунтів на кв. дюйм газоподібного водню при температурі 50°С протягом 13 годин. Результати ВЕРХ показують, що аналітичний вихід становить 93%, а оптична чистота - 94% енантіомерного надлишку. Оптичну чистоту підвищують ще більше таким чином. Розчин метанолу з реакції гідрогенізації (18г в 180мл МеОН) концентрують і замінюють його метил t-бутиловим ефіром (МТВЕ) (45мл). До отриманого розчину додають водний розчин Н3РО4 (0,5 М, 95мл). Після розділення шарів 3N NaOH (35мл) додають до водного шару, який потім екстрагують МТВЕ (180мл + 100мл). Потім розчин 15 МТВЕ концентрують, а розчинник замінюють гарячим толуолом (180мл, температура близько 75°С). Потім розчину гарячого толуолу дають можливість повільно охолодитися до 0°С (5-10 годин). Кристали виділяють фільтрацією (13г, вихід 72%, 98-99% енантіомерного надлишку); т. пл. 114,1-115,7°С. 1 Н-ЯМР (300 МГц, CD3CN): δ 7,26 (м), 7,08 (м), 4,90 (с), 4,89 (с), 4,14 (м), 3,95 (м), 3,40 (м), 2,68 (м), 2,49 (м), 1,40 (шс). Сполука 2-5 існує у вигляді пов'язаних з амідом ротамерів. Якщо не вказано інакше, головні і другорядні ротамери згруповані разом, оскільки сигнали вуглецю-13 розрізнені недостатньо добре. 13 С-ЯМР (CD3CN): δ 171,8, 157,4 (ддд, JCF = 242,4, 9,2, 2,5 Гц), 152,2 (головний), 151,8 (другорядний), 149,3 (ддд, JCF = 246,7, 14,2, 12,9 Гц), 147,4 (ддд, JCF = 241,2, 12,3, 3,7 Гц), 144,2 (к, JCF = 38,8 Гц), 124,6 (ддд, JCF = 18,5, 5,9, 4,0 Гц), 120,4 (дд, JCF =19,1, 6,2 Гц), 119,8 (к, JCF = 268,9 Гц), 106,2 (дд, JCF = 29,5, 20,9 Гц), 50,1, 44,8, 44,3 (головний), 43,2 (другорядний), 42,4, 41,6 (другорядний), 41,4, 39,6, 38,5 (другорядний), 36,9. Кристалічна вільна основа також може бути виділена таким чином: (а) Після завершення стадії гідрогенізації реакційну суміш завантажують 25% мас. Ecosorb C941. Суміш перемішують в атмосфері азоту протягом години, а потім фільтрують. Осад промивають 2л/кг метанолу. Відновлення вільної основи складає близько 95%, а оптична чистота - близько 95% енантіомерного надлишку. (b) розчин вільної основи в метанолі концентрують до об'єму 3,5-4,0л/кг (з розрахунку на завантаження вільної основи), а потім замінюють розчинник ізопропанолом (IPА) до отримання кінцевого об'єму 3,0л/кг ІРА. (c) Суспензію нагрівають до 40°С і витримують при 40°С протягом години, а потім охолоджують до 25°С протягом 2 годин. (d) Протягом 7 годин додають гептан (7л/кг) і суспензію перемішують протягом 7 годин при температурі 22-25°С. Концентрація надосадової рідини до фільтрування складає 10-12мг/г. (e) Суспензію фільтрують, а твердий залишок промивають 30% IP А/гептану (2л/кг). (f) Тверду речовину сушать у вакуумній печі при температурі 40°С. (g) Оптична чистота вільної основи складає близько 99% енантіомерного надлишку. Для визначення процентної величини перетворення в продукт використовують наступні умови високоефективної рідинної хроматографії (ВЕРХ): Waters Symmetry Колонка: С18,250мм x 4,6мм розчинник А: 0,1% об. Елюент: НСlО4/НО розчинник В: ацетонітрил Градієнт: 0 хв. 75% А: 25% В 10 хв. 25% А: 75% В 12,5 хв. 25% А: 75% В 15 хв. 75% А: 25% В Швидкість потоку: 1мл/хв. Об'єм упорскування: 10мкм У Φ детектування: 210нм 86026 16 40°С сполука 2-4: 9,1хв. сполука 2-5: 5,4хв. tBu Josiphos: 8,7хв. Для визначення оптичної чистоти були використані наступні умови високоефективної рідинної хроматографії (ВЕРХ): Chirapak, AD-H, 250ммх Колонка: 4,6мм розчинник А: 0,2% об. діеЕлюент: тиламіну в гептані розчинник В: 0,1% об. діетиламіну в етанолі Ізократичний період: 18хв. Швидкість потоку: 0,7мл/хв. Об'єм упорскування: 7мкм У Φ детектування: 268нм Температура колонки: 35°С Час втримання: (R) - амін 2-5: 13,8хв. (S) - амін 2-5: 11,2хв. Моногідрат дигідрофосфату (2R)-4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3а]піразин-7(8H)-іл]-1-(2,4,5-трифторфеніл)бутан-2аміну У 250-мл круглодонну колбу, обладнану підвісною мішалкою, нагрівним кожухом і термопарою, завантажують 31,5мл ізопропанолу (IPА), 13,5мл води, 15,0г (36,9ммол) (2R)-4-оксо-4-[3(трифторметил)-5,6-дигідро[1,2,4]триазоло[4,3а]піразин-7(8Н)-іл]-1-(2,4,5-трифторфеніл)бутан-2аміну у вигляді вільної основи і 4,25г (36,9ммол) 85% водної фосфорної кислоти. Суміш нагрівають до 75°С. При низьких температурах утворюється густий білий осад, який розчиняється, коли температура досягає 75°С. Розчин охолоджують до 68°С і витримують при даній температурі протягом 2 годин. Під час витримування утворюється зважений шар твердих речовин (розчин може бути затравлений 0,5-5% мас. невеликих часток двічі перемолотого моногідрату). Після цього суспензію охолоджують з швидкістю 4°С/година до 21°С, а потім витримують протягом ночі. Потім до суспензії додають 105мл ІРА. Через годину суміш фільтрують і промивають 45мл IP A (тверді речовини також можуть бути промиті водою/розчином ІРА, щоб уникнути перетворення в інші кристалічні форми). Тверді речовини сушать на фриті з отвором для повітря. Отримують 18,6г твердих речовин. Внаслідок вимірювання за допомогою ВЕРХ процентної величини площі було встановлено, що чистота твердих речовин перевищує 99,8% (умови ВЕРХ описані вище). Аналіз гранулометричного складу отриманих твердих речовин показує, що середній PSD становить 80 мікрон, при цьому 95% - менше 180 мікрон. Рентгенівська порошкова дифракція і термогравіметричний аналіз показують, що кристалічна форма твердих речовин є моногідратною. Дослідження за допомогою рентгенівської порошкової дифракції широко використовуються для характеристики молекулярних структур, кристалічності і поліморфізму. Рентгенівська порошкова Температура колонки: Час втримання: 17 дифракційна картина кристалічного моногідрату дигідрофосфату була отримана на рентгенівській дифракційній системі Philips Analytical X'Pert PRO X-ray Diffraction System з пультом PW3040/60. Як джерело була використана керамічна рентгенівська трубка Cu LEF з К-альфа випромінюванням PW3373/00. Фіг.1 показує рентгенівську дифракційну картину кристалічного моногідрату дигідрофосфату структурної формули II. Моногідрат має характернідифракційні піки, відповідні d-відстаням 7,42, 5,48 і 3,96 ангстрем. Моногідрат більш точно характеризується d-відстанями 6,30, 4,75 і 4,48 ангстрем. Моногідрат ще більш точно характеризується dвідстанями 5,85, 5,21 і 3,52 ангстрем. Крім описаних вище рентгенівських дифракційних картин, кристалічна моногідратна форма дигідрофосфату структурної формули II також характеризується своїм спектром твердофазного ядерного магнітного резонансу (ЯМР) вуглецю-13 і фтору-19. Твердофазний ЯМР спектр вуглецю-13 отримують на системі ЯМР Bruker DSX 400WB, використовуючи 4-мм дворезонансний датчик Bruker CPMAS. ЯМР спектр вуглецю-13 використовує крос-поляризаційне обертання під магічним кутом протона/вуглецю-13 з крос-поляризацією із змінною амплітудою. Зразок обертають при 15,0кГц, загалом отримуючи 2048 розгорток з інтервалом між циклами 20 секунд. Перед здійсненням FT до спектра застосовують розширення лінії, що становить 40Гц. Хімічні зсуви визначають по шкалі TMS, використовуючи карбонільний вуглець гліцину (176,03м.ч.) для повторного порівняння. Твердофазний ЯМР спектр фтору-19 отримують на системі ЯМР Bruker DSX 400WB, використовуючи 4-мм дворезонансний датчик Bruker CPMAS. ЯМР спектр використовує просту імпульсну програму по збору імпульсів. Зразки обертають при 15,0кГц, загалом отримуючи 16 з інтервалом між циклами 30 секунд. Щоб звести до мінімуму фон фтору, застосовують торцеву кришку vespel. Перед здійсненням FT до спектра застосовують розширення лінії, що становить 100Гц. Хімічні зсуви визначають, використовуючи полі(тетрафторетилен) (тефлон) для зовнішнього повторного порівняння, яке показує хімічний зсув, що дорівнює -122м.ч. Фіг.2 показує твердофазний ЯМР спектр CPMAS вуглецю-13 кристалічної моногідратної форми дигідрофосфату структурної формули II. Моногідратна форма має характерні сигнали з величинами хімічного зсуву 169,1, 120,8 і 46,5м.ч. Більш точна характеристика моногідратної форми включає сигнали з величинами хімічного зсуву 159,0, 150,9 і 40,7м.ч. Фіг.3 показує твердофазний ЯМР спектр MAS фтору-19 кристалічної моногідратної форми дигідрофосфату структурної формули II. Моногідратна форма має характерні сигнали з величинами хімічного зсуву -64,5, -114,7 і -146, м.ч. Більш точна характеристика моногідратної форми включає сигнали з величинами хімічного зсуву -96,5, -104,4 і 154,5м.ч. Фіг.4 являє собою характерну криву термогравіметричного аналізу (TGA) кристалічної моногід 86026 18 ратної форми дигідрофосфату структурної формули II. Використовують прилад Perkin Elmer, модель TGA 7, або подібний прилад. Експерименти здійснюють в струмі азоту з швидкістю нагрівання 10°С/хв. до максимальної температури приблизно 250°С. Після автоматичного тарування балансу в платинову чашу вміщують від 5 до 20мг зразка, піч підіймають і включають програму нагрівання. Прилад автоматично збирає дані по масі/температурі. Аналіз результатів здійснюють, вибираючи функцію Delta Y серед математичного забезпечення приладу, а також вибираючи температури, між якими визначають втрату маси. Втрату маси визначають аж до початку розкладання/упарювання. TGA показує втрату маси близько 3,3647%, починаючи від кімнатної температури приблизно до 250°С. Фіг.5 являє собою характерну криву DSC кристалічної моногідратної форми дигідрофосфату структурної формули II. Використовують прилад ТА Instruments DSC 2910 або подібний прилад. Від 2 до 6г зразка зважують у відкритій чаші. Потім чашу затискають і вміщують на місце зразка в осередок калориметра. Пусту чашу вміщують в положення для порівняння. Осередок калориметра закривають і через нього пропускають потік азоту. Програму нагрівання встановлюють на рівні нагрівання зразка з швидкістю 10°С/хв. до температури приблизно 250°С. Включають програму нагрівання. Завершивши серію, дані аналізують за допомогою програми DSC аналізу, що міститься в системі математичного забезпечення. Ендотерму плавлення інтегрують між точками температури базової лінії, що знаходяться вище і нижче температурного діапазону, протягом якого спостерігається ендотерма. Дані, що отримуються, включають температуру початку, пікову температуру і ентальпію. Кристалічний моногідрат дигідрофосфату згідно з даним винаходом має фазову чистоту щонайменше близько 5% форми з описаними вище фізичними характеристиками, що визначаються за допомогою рентгенівської порошкової дифракції, ЯМР фтору -19 MAS, ЯМР вуглецю-13 CPMAS і DCS. Згідно з одним з варіантів, фазова чистота складає щонайменше близько 10% форми з вищезгаданими твердофазними фізичними характеристиками. Згідно з другим варіантом, фазова чистота складає щонайменше близько 25% форми з вищезгаданими твердофазними фізичними характеристиками. Згідно з третім варіантом, фазова чистота складає щонайменше близько 50% форми з вищезгаданими твердофазними фізичними характеристиками. Згідно з четвертим варіантом, фазова чистота складає щонайменше близько 75% форми з вищезгаданими твердофазними фізичними характеристиками. Згідно з п'ятим варіантом, фазова чистота складає щонайменше близько 90% форми з вищезгаданими твердофазними фізичними характеристиками. Згідно з шостим варіантом, кристалічний моногідрат дигідрофосфату являє собою по суті чисту фазову форму з вищеописаними твердофазними фізичними характеристиками. Під терміном "фазова чистота" мається на увазі твердофазна чистота моногідрату дигідрофосфату з 19 урахуванням конкретної кристалічної або аморфної форми солі, що визначається твердофазними фізичними способами, описаними в даній заявці. Було встановлено, що кристалічний моногідрат дигідрофосфату є стабільним в умовах навколишнього середовища. Було також встановлено, що при нагріванні вище 40°С в потоку дуже сухого азоту він перетворюється в дегідратований моногідрат. Дегідратований моногідрат знову перетворюється в моногідрат в умовах навколишнього середовища. Приклади фармацевтичних композицій: 1) Спосіб прямого пресування: Моногідрат дигідрофосфату пресують в таблетки, застосовуючи спосіб прямого пресування. 100-мг таблетка включає 128,4мг активного інгредієнта, 127,8мг мікрокристалічної целюлози, 127,8мг маніту (або 127,8мг дикальцію фосфату), 8мг кроскармелози натрію, 8мг магнію стеарату і 16мг Opadry білого (патентований матеріал для покриттів, що випускається Colorcon West Point, PA). Активний інгредієнт, мікрокристалічну целюлозу, маніт (або дикальцію фосфат) і кроскармелозу спочатку змішують, а потім отриману суміш змащують стеаратом магнію і пресують в таблетки. Потім натаблетки наносять плівку з Opadry White. 2) Спосіб пресування прокаткою: 86026 20 Моногідрат дигідрофосфату пресують в таблетки, застосовуючи спосіб пресування прокаткою. 100-мг таблетка включає 128,4мг активного інгредієнта, 45мг мікрокристалічної целюлози, 111,6мг дикальцію фосфату, 6мг кроскармелози натрію, 9мг магнію стеарату і 16мг Opadry білого (патентований матеріал для покриттів, що випускається Colorcon West Point, PA). Активний інгредієнт, мікрокристалічну целюлозу, дикальцію фосфат і кроскармелозу спочатку змішують, а потім отриману суміш змащують третьою частиною від всієї кількості стеарату магнію і пресують прокаткою у вигляді стрічок. Потім стрічки подрібнюють, а отримані гранули змащують кількістю стеарату магнію, що залишилася, і пресують у вигляді таблеток. Потім на таблетки наносять плівку з Opadry White. 3) Водний склад для внутрішньовенного (i.v.) використання являє собою моногідрат дигідрофосфату формули І в 10мМ ацетату натрію/0,8% насиченого сольового розчину при рН 4,5±0,2. Для отримання складу, що має концентрацію 4,0мг/мл, 800мг NaCl розчиняють в 80мл води, потім додають 57,5мкл крижаної оцтової кислоти, після чого 512мг моногідрату дигідрофосфату. рН доводять до 4,5±0,2 за допомогою 0,1 N розчину NaOH. Об'єм кінцевого розчину доводять до 100,0мл за допомогою води. 2,0-мг/мл розчин може бути отриманий розбавленням 25,0мл 4,0-мг/мл розчину до 100,0мл плацебо. 21 86026 22 23 Комп’ютерна верстка Л. Купенко 86026 Підписне 24 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPhosphoric acid salt of a dipeptidyl peptidase-iv inhibitor
Автори англійськоюCypes Stephen Howard, Chen Alex Minhua, Ferlita Russell R., Hansen Karl, Lee Ivan, Vydra Vicky K., Wenslow Robert M. Jr.
Назва патенту російськоюСоль фосфорной кислоты ингибитора дипептидилпептидазы-iv
Автори російськоюСайпс Стефен Ховард, Чень Алекс Миньхуа, Ферлита Рассел Р., Хансен Карл, Ли Айван, Видра Вики К., Уэнслоу Роберт М., мл.
МПК / Мітки
МПК: C07D 487/04, A61K 31/4985, A61P 3/10
Мітки: інгібітора, кислоти, дипептидилпептидази-iv, фосфорної, сіль
Код посилання
<a href="https://ua.patents.su/12-86026-sil-fosforno-kisloti-ingibitora-dipeptidilpeptidazi-iv.html" target="_blank" rel="follow" title="База патентів України">Сіль фосфорної кислоти інгібітора дипептидилпептидази-iv</a>
Попередній патент: 2-метоксиметил-3-(3,4-дихлорфеніл)-8-азабіцикло[3.2.1]октан тартрат, фармацевтична композиція на його основі
Наступний патент: Похідні пропіонаміду, корисні як модулятори андрогенних рецепторів
Випадковий патент: Упаковка