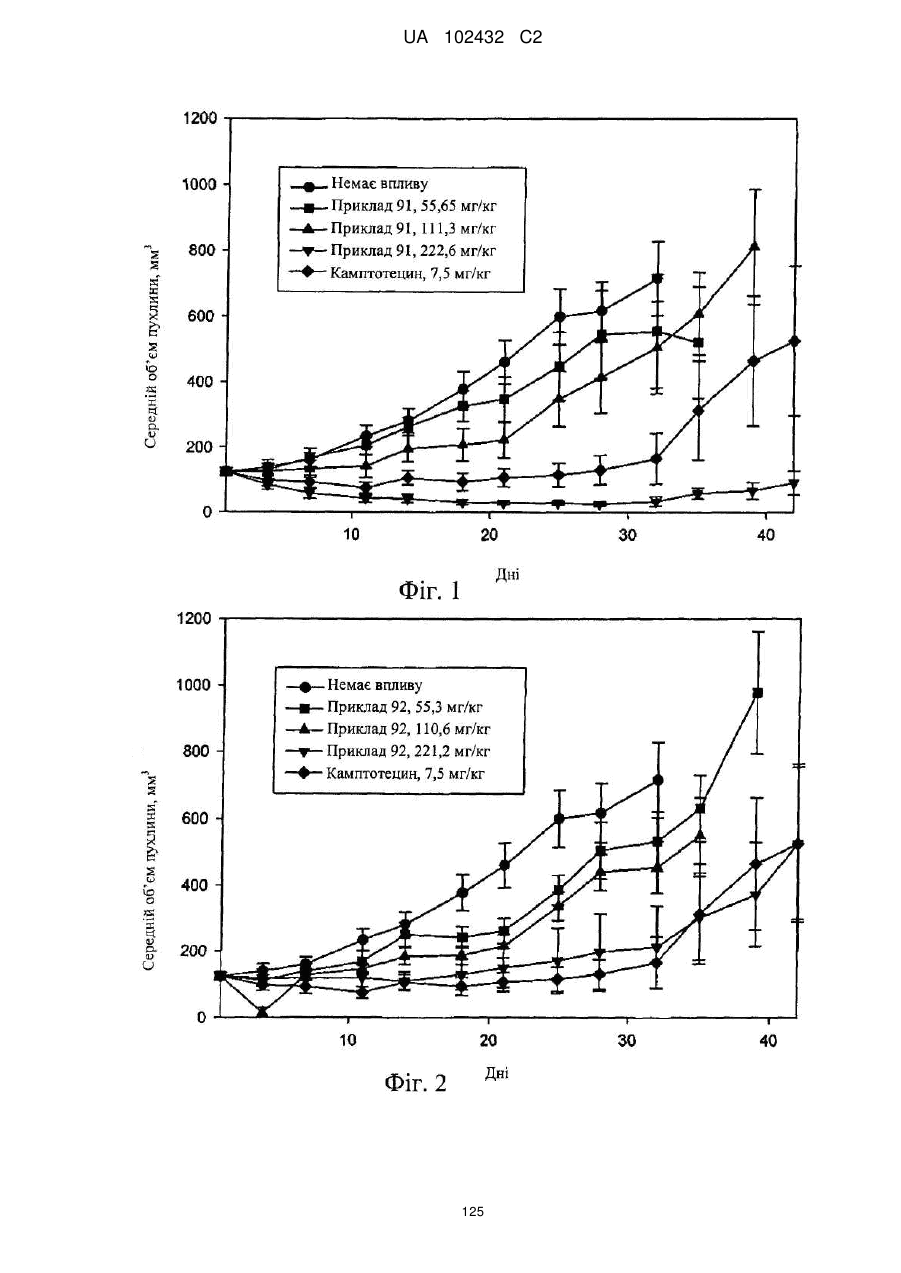
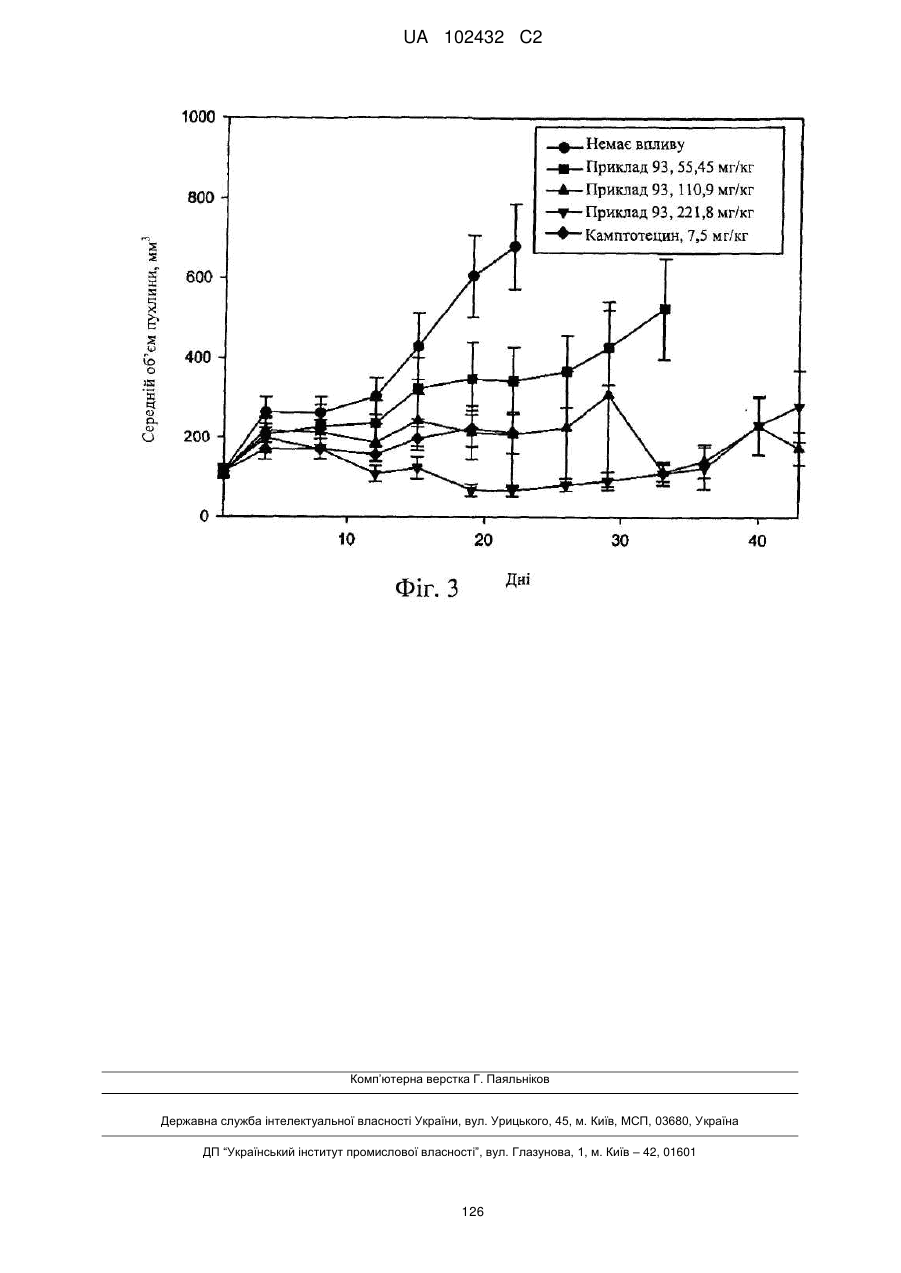
Цитотоксичні кон’югати зі сполукою, яка зв’язує рецептор нейропептиду y
Номер патенту: 102432
Опубліковано: 10.07.2013
Автори: Чжоу Кевін Л., Деолівейра Деніел Б., Дун Чжен Сінь
Формула / Реферат
1. Сполука формули (I):
X-B1-B2-B3-В4-Z, (I)
в якій:
Х є цитотоксичним або цитостатичним засобом;
В1 являє собою rv(амінокислоту);
кожний з B2, B3 і B4, незалежно в кожному випадку, являє собою (Doc)m, (Aepa)n або -C(O)-W1-W2-W3-W4-W5-C(O)-, або відсутній; і
Z являє собою аналог hNPY, відповідний формулі:
A1-A2-A3-A4-A5-A6-A7-A8-А9-А10-A11-А12-А13-А14-А15-А16-А17-А18-А19-А20-A21-A22-A23-A24-A25-A26-A27-A28-A29-A30-A31-A32-A33-A34-A35-A36-A37-R1 (SEQ ID NO:2),
в якій:
A1 являє собою Tyr, (X1, X2, X3, X4, X5)Phe або HN-CH((CH2)q-N(R2R3))-C(O);
A2 являє собою Pro, 3Hyp, cis-3Hyp, 4Hyp або cis-4Hyp;
A3 являє собою Ser, Abu, Aib, Ala, Thr або HN-CH((CH2)q-N(R2R3))-C(O);
A4 являє собою Lys, Arg, hArg, Dab, Dap, Orn або HN-CH((CH2)q-N(R2R3))-C(O);
A5 являє собою Pro, 3Hyp, cis-3Hyp, 4Hyp або cis-4Hyp;
A6 являє собою Asp, Aib, Asn, Gln, Glu або HN-CH((CH2)q-N(R2R3))-C(O);
A7 являє собою Asn, Aib, Gln або HN-CH((CH2)q-N(R2R3))-C(O);
A8 являє собою Pro, 3Hyp, cis-3Hyp, 4Hyp або cis-4Hyp;
A9 являє собою Gly, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A10 являє собою Glu, Aib, Asn, Asp, Gln або HN-CH((CH2)q-N(R2R3))-C(O);
A11 являє собою Asp, Aib, Asn, Gln, Glu або HN-CH((CH2)q-N(R2R3))-C(O);
A12 являє собою Ala, Abu, Aib, Nva, Val або HN-CH((CH2)q-N(R2R3))-C(O);
A13 являє собою Pro, 3Hyp, cis-3Hyp, 4Hyp або cis-4Hyp;
A14 являє собою Ala, Abu, Aib, Nva, Val або HN-CH((CH2)q-N(R2R3))-C(O);
A15 являє собою Glu, Aib, Asn, Asp, Gln або HN-CH((CH2)q-N(R2R3))-C(O);
A16 являє собою Asp, Aib, Asn, Gln, Glu або HN-CH((CH2)q-N(R2R3))-C(O);
A17 являє собою Met, Асс, Aib, Cha, Ile, Leu, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R2R3))-C(O);
A18 являє собою Ala, Abu, Aib, Nva, Val або HN-CH((CH2)q-N(R2R3))-C(O);
A19 являє собою Arg, hArg, Apc, Dab, Dap, Lys, Orn або HN-CH((CH2)q-N(R2R3))-C(O);
A20 являє собою Tyr, (X1, X2, X3, X4, X5)Phe або HN-CH((CH2)q-N(R2R3))-C(O);
A21 являє собою Tyr, (X1, X2, X3, X4, X5)Phe або HN-CH((CH2)q-N(R2R3))-C(O);
A22 являє собою Ser, Abu, Aib, Ala, Thr або HN-CH((CH2)q-N(R2R3))-C(O);
A23 являє собою Ala, Abu, Aib, Nva, Val або HN-CH((CH2)q-N(R2R3))-C(O);
A24 являє собою Leu, Acc, Cha, Ile, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R2R3))-C(O);
A25 являє собою Arg, hArg, Dab, Dap, Lys, Orn або HN-CH((CH2)q-N(R2R3))-C(O);
A26 являє собою His, 2Pal, 3Pal, 4Pal або HN-CH((CH2)q-N(R2R3))-C(O);
A27 являє собою Tyr, (X1, X2, X3, X4, X5)Phe або HN-CH((CH2)q-N(R2R3))-C(O);
A28 являє собою Ile, Acc, Cha, Leu, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R2R3))C(O);
A29 являє собою Asn, Aib, Gln або HN-CH((CH2)q-N(R2R3))-C(O);
A30 являє собою Leu, Acc, Cha, Ile, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R2R3))-C(O);
A31 являє собою Ile, Acc, Cha, Leu, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R2R3))-C(O);
A32 являє собою Thr, Aib, Ser або HN-CH((CH2)q-N(R2R3))-C(O);
A33 являє собою Arg, hArg, Dab, Dap, Lys, Orn або HN-CH((CH2)q-N(R2R3))-C(O);
A34 являє собою Dhp, 4Hyp, Inp, Nip, Tic або HN-CH((CH2)q-N(R2R3))-C(O);
A35 являє собою Arg, Aic, Apc, hArg, Dab, Dap, Lys, Orn, 4NH2Phe, 4NH2CH2Phe або HN-CH((CH2)q-N(R2R3))-C(O);
A36 являє собою Tyr, Aic, (X1, X2, X3, X4, X5)Phe, HN-CH((CH2)q-N(R2R3))-C(O) або відсутній;
A37 являє собою HN-CH((CH2)q-N(R2R3))-C(O) або відсутній;
R1 являє собою OH, NH2, (C1-30)алкокси або NH-X6-CH2-X7, де X6 являє собою (C1-40)алкіл або (C2-40)алкеніл, і де X7 являє собою Н, OH, CO2H або С(О)-NH2;
кожний з W1 і W5, незалежно для кожного випадку, являє собою CR4R5;
кожний з R4 і R5, незалежно для кожного випадку, являє собою Н, F, Br, Cl, I, (C1-30)алкіл, (C2-30)алкеніл, заміщений (C1-30)алкіл, заміщений (C2-30)алкеніл, SR6, S(О)R7 або S(О)2R8; або R4 і R5 разом утворюють (C3-30)циклоалкільне, (C3-30)гетероциклічне або (C5-30)арильне кільце;
кожний з R6, R7 і R8, незалежно для кожного випадку, являє собою (C1-30)алкіл, (C2-30)алкеніл, заміщений (C1-30)алкіл або заміщений (C2-30)алкеніл;
кожний з W2, W3 і W4, незалежно для кожного випадку, являє собою CR9R10, О, S, (CH2)t або відсутній;
кожний з R9 і R10, незалежно для кожного випадку, являє собою Н, F, Br, Cl, I, (C1-30)алкіл, (C2-30)алкеніл, заміщений (C1-30)алкіл, заміщений (C2-30)алкеніл, SR6, S(О)R7 або S(О)2R8; або R9 і R10 разом утворюють кільцеву систему;
m, незалежно для кожного випадку, являє собою 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10;
n, незалежно для кожного випадку, являє собою 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10;
q, незалежно для кожного випадку, являє собою 0, 1, 2, 3, 4 або 5;
t, незалежно для кожного випадку, являє собою 0, 1, 2 або 3;
кожний з X1, X2, X3, X4 і X5, незалежно для кожного випадку, являє собою Н, F, Br, Cl, I, (C1-10)алкіл, заміщений (C1-10)алкіл, арил, заміщений арил, OH, OMe, NH2, NO2 або CN; і
кожний з R2 і R3, незалежно для кожного випадку, являє собою Н, (C1-40)алкіл, (C1-40)гетероалкіл, (C1-40)ацил, (C2-40)алкеніл, (C2-40)алкініл, арил(C1-40)алкіл, арил(C1-40)ацил, заміщений (C1-40)алкіл, заміщений (C1-40)гетероалкіл, заміщений (C1-40)ацил, заміщений (C2-40)алкеніл, заміщений (C2-40)алкініл, заміщений арил(C1-40)алкіл, заміщений арил(C1-40)ацил, (C1-40)алкілсульфоніл або C(NH)-NH2, причому, коли R2 являє собою (C1-40)ацил, арил(C1-40)ацил, заміщений (C1-40)ацил, заміщений арил(C1-40)ацил, (C1-40)алкілсульфоніл або С(NH)-NH2, R3 являє собою Н або (C1-40)алкіл, (C1-40)гетероалкіл, (C2-40)алкеніл, (C2-40)алкініл, арил(C1-40)алкіл, заміщений (C1-40)алкіл, заміщений (C1-40)гетероалкіл, заміщений (C2-40)алкеніл, заміщений (C2-40)алкініл або заміщений арил(C1-40)алкіл;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, в якій:
Х являє собою антрациклін, камптотецин або похідне камптотецину, паклітаксел або похідне паклітакселу або доксорубіцин або похідне доксорубіцину;
B1 являє собою rvAsp, rvD-Asp, rvCha, rvD-Cha або rvGly;
B2 являє собою Suc;
кожний з B3 і B4, незалежно для кожного випадку, являє собою (Doc)m, (Aepa)n або відсутній;
A1 являє собою Tyr або HN-CH((CH2)q-N(R2R3))-C(O);
A2 являє собою Pro;
A3 являє собою Ser, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A4 являє собою Lys або HN-CH((CH2)q-N(R2R3))-C(O);
A5 являє собою Pro;
A6 являє собою Asp, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A7 являє собою Asn, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A8 являє собою Pro;
A9 являє собою Gly, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A10 являє собою Glu, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A11 являє собою Asp, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A12 являє собою Ala, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A13 являє собою Pro;
A14 являє собою Ala, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A15 являє собою Glu, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A16 являє собою Asp, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A17 являє собою Met, A6c, Aib, Nle або HN-CH((CH2)q-N(R2R3))-C(O);
A18 являє собою Ala, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A19 являє собою Arg або HN-CH((CH2)q-N(R2R3))-C(O);
A20 являє собою Tyr або HN-CH((CH2)q-N(R2R3))-C(O);
A21 являє собою Tyr або HN-CH((CH2)q-N(R2R3))-C(O);
A22 являє собою Ser, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A23 являє собою Ala, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A24 являє собою Leu, A6c або HN-CH((CH2)q-N(R2R3))-C(O);
A25 являє собою Arg або HN-CH((CH2)q-N(R2R3))-C(O);
A26 являє собою His або HN-CH((CH2)q-N(R2R3))-C(O);
A27 являє собою Tyr або HN-CH((CH2)q-N(R2R3))-C(O);
A28 являє собою Ile, A6c або HN-CH((CH2)q-N(R2R3))-C(O);
A29 являє собою Asn, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A30 являє собою Leu, A6c або HN-CH((CH2)q-N(R2R3))-C(O);
A31 являє собою Ile, A6c, Leu або HN-CH((CH2)q-N(R2R3))-C(O);
A32 являє собою Thr, Aib або HN-CH((CH2)q-N(R2R3))-C(O);
A33 являє собою Arg або HN-CH((CH2)q-N(R2R3))-C(O);
A35 являє собою Arg, Aic, Apc, Lys, 4NH2Phe, 4NH2CH2Phe або HN-CH((CH2)q-N(R2R3))-C(O);
A36 являє собою Tyr, Aic, HN-CH((CH2)q-N(R2R3))-C(O) або відсутній;
A37 являє собою HN-CH((CH2)q-N(R2R3))-C(O) або відсутній;
R1 являє собою NH2;
кожний з R2 і R3, незалежно для кожного випадку, являє собою Н або (C1-30)ацил;
за умови, що, коли R2 є (C1-30)ацилом, R3 є Н;
кожний з R4 і R5, незалежно для кожного випадку, являє собою Н або (C1-40)ацил;
q являє собою 4; і
кожний з X1, X2, X3, X4 і X5, незалежно для кожного випадку, являє собою Н, CH2NH2 або NH2;
або її фармацевтично прийнятна сіль.
3. Сполука за п. 2, в якій Х являє собою антрациклін; або її фармацевтично прийнятна сіль.
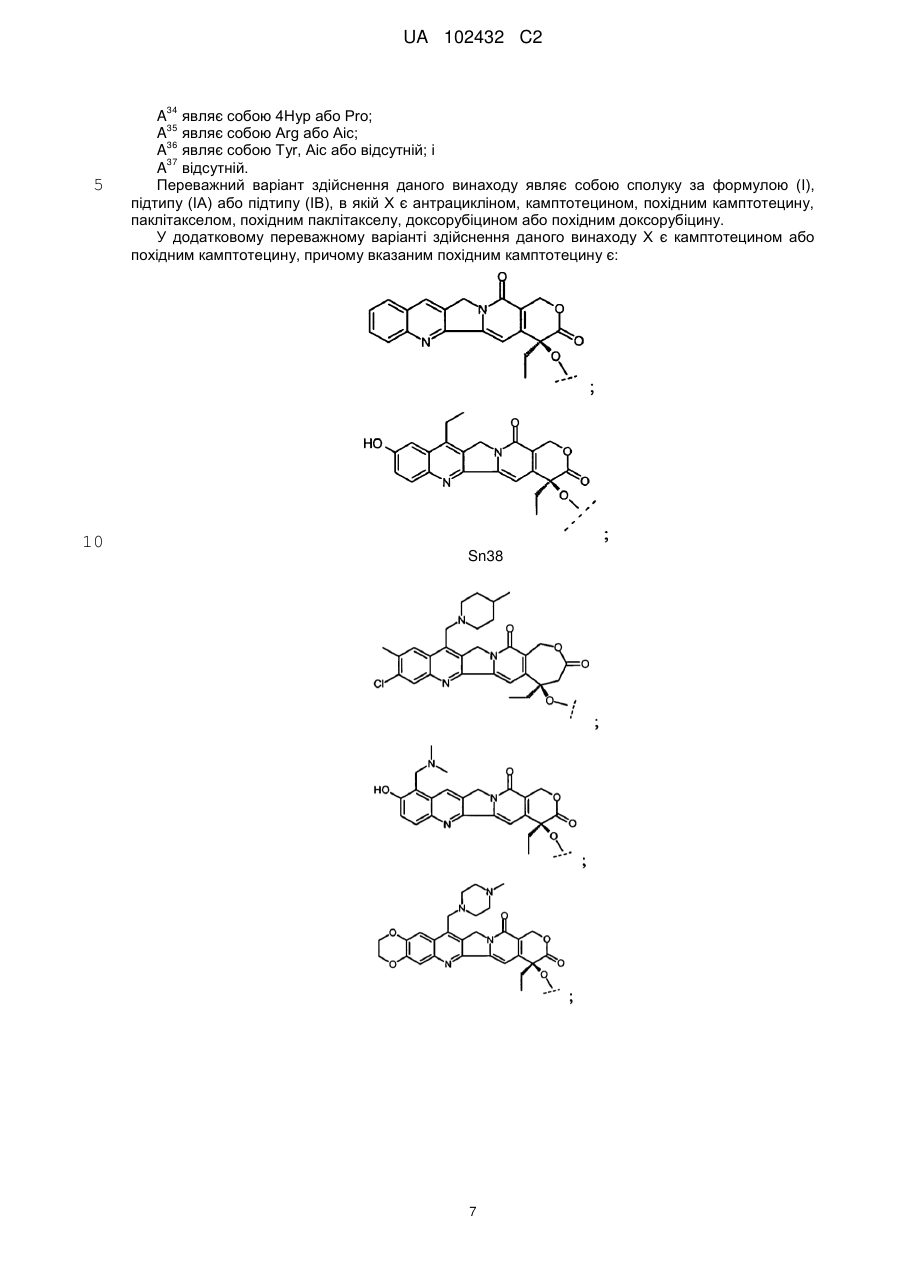
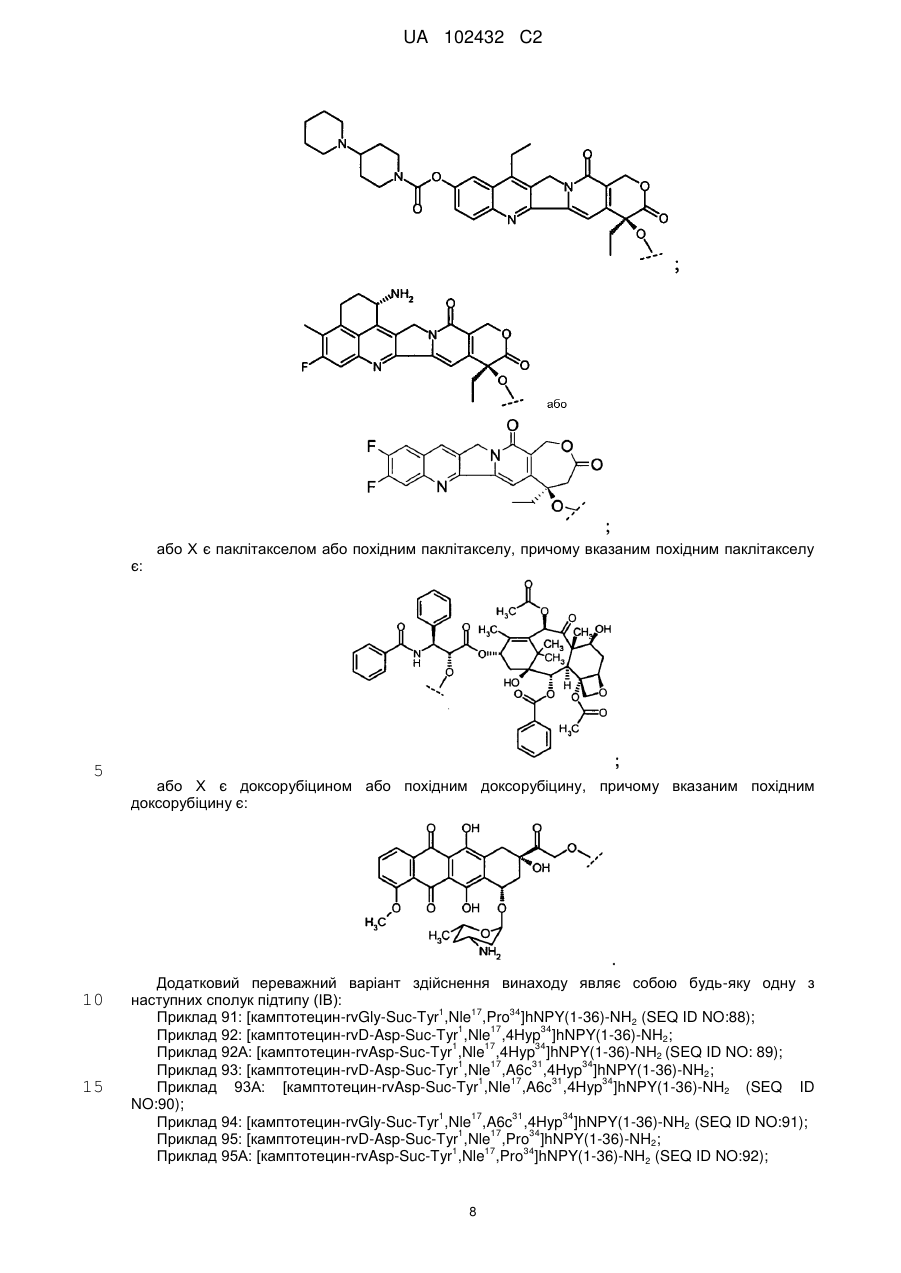
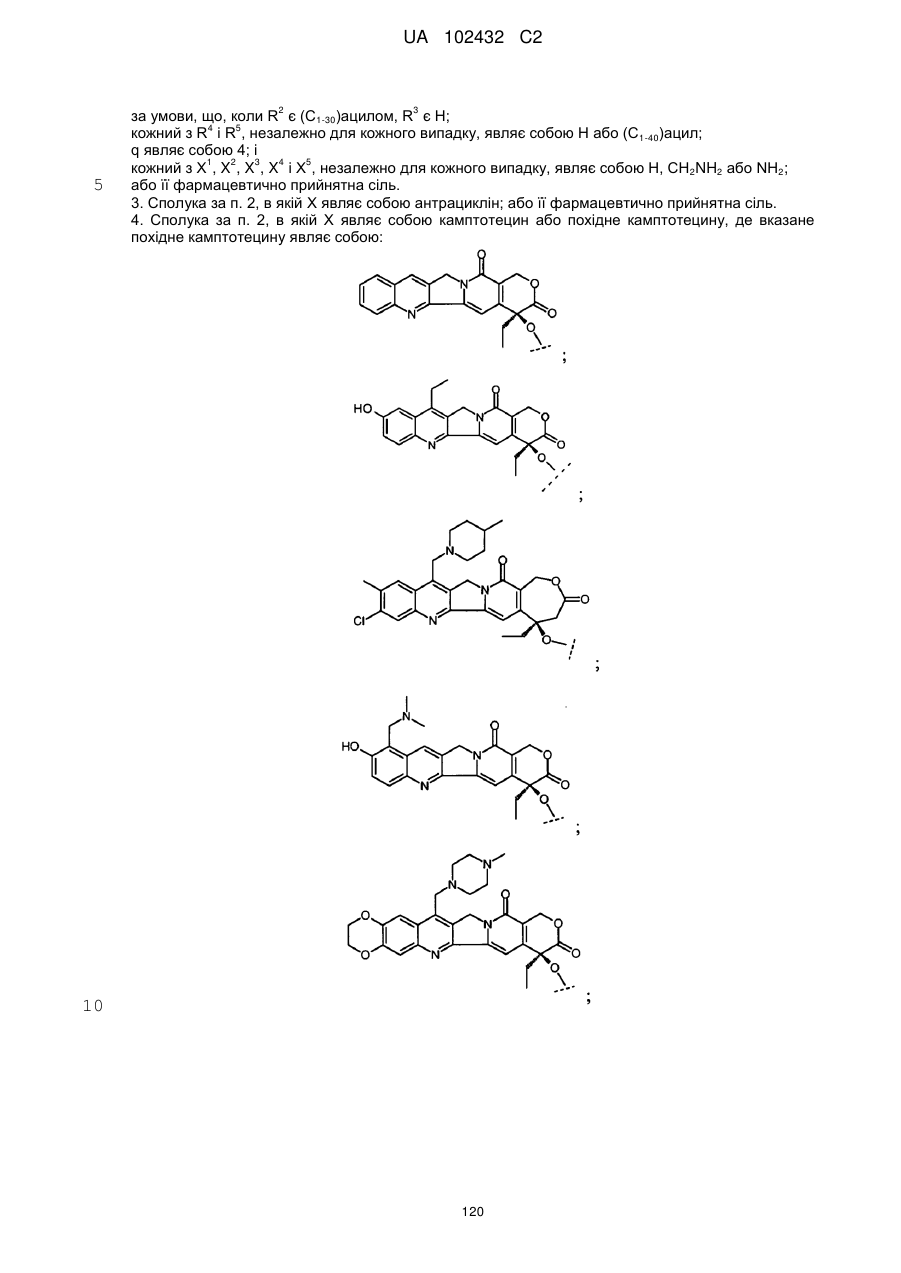
4. Сполука за п. 2, в якій Х являє собою камптотецин або похідне камптотецину, де вказане похідне камптотецину являє собою:
або
;
або її фармацевтично прийнятна сіль.
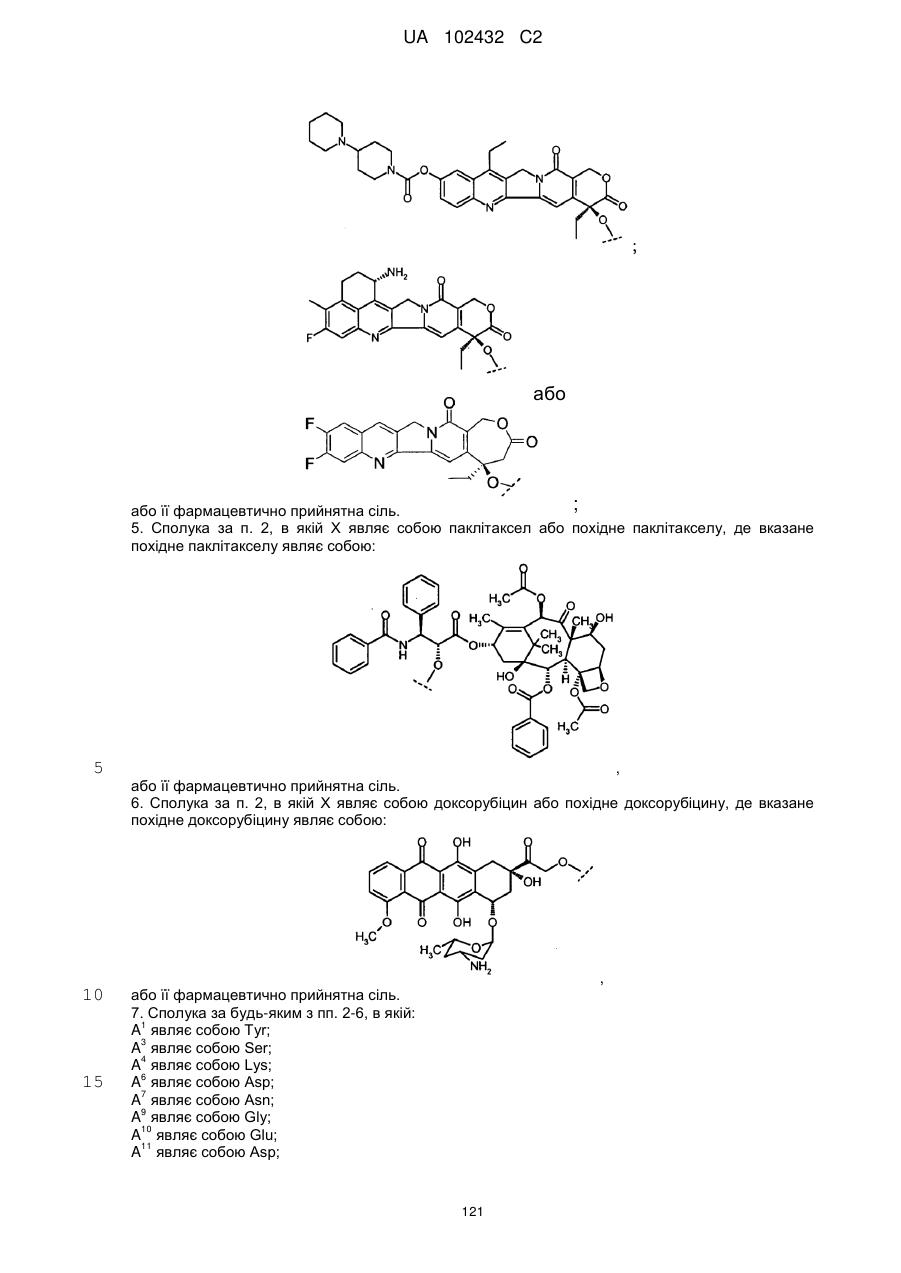
5. Сполука за п. 2, в якій Х являє собою паклітаксел або похідне паклітакселу, де вказане похідне паклітакселу являє собою:
,
або її фармацевтично прийнятна сіль.
6. Сполука за п. 2, в якій Х являє собою доксорубіцин або похідне доксорубіцину, де вказане похідне доксорубіцину являє собою:
,
або її фармацевтично прийнятна сіль.
7. Сполука за будь-яким з пп. 2-6, в якій:
A1 являє собою Tyr;
A3 являє собою Ser;
A4 являє собою Lys;
A6 являє собою Asp;
A7 являє собою Asn;
A9 являє собою Gly;
A10 являє собою Glu;
A11 являє собою Asp;
A12 являє собою Ala;
A14 являє собою Ala;
A15 являє собою Glu;
A16 являє собою Asp;
A17 являє собою Aib або Nle;
A18 являє собою Ala;
A19 являє собою Arg;
A20 являє собою Tyr;
A21 являє собою Tyr;
A22 являє собою Ser;
A23 являє собою Ala;
A24 являє собою Leu;
A25 являє собою Arg;
A26 являє собою His;
A27 являє собою Tyr;
A28 являє собою Ile;
A29 являє собою Asn;
A30 являє собою Leu;
A31 являє собою Ile або A6c;
A32 являє собою Thr;
A33 являє собою Arg;
A34 являє собою 4Hyp;
A35 являє собою Arg або Aic;
A36 являє собою Tyr, Aic або відсутній і
A37 відсутній;
або її фармацевтично прийнятна сіль.
8. Сполука за п. 7, в якій Х являє собою камптотецин; або її фармацевтично прийнятна сіль.
9. Сполука за п. 8, де вказана сполука являє собою:
[камптотецин-rvAsp-Suc-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:89);
[камптотецин-rvD-Asp-Suc-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2;
[камптотецин-rvAsp-Suc-Tyr1,Nle17,A6c31,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:90);
[камптотецин-rvD-Asp-Suc-Tyr1,Nle17,A6c31,4Hyp34]hNPY(1-36)-NH2;
[камптотецин-rvGly-Suc-Tyr1,Nle17,A6c31,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:91);
[камптотецин-rvGly-Suc-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:94);
[камптотецин-rvGly-Suc-(Doc)3-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:95);
[камптотецин-rvGly-Suc-(Doc)3-Aepa-Tyr1, Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:96);
[камптотецин-rvAsp-Suc-(Doc)3-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:97);
[камптотецин-rvD-Asp-Suc-(Doc)3-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2;
[камптотецин-rvGly-Suc-Aepa-(Doc)3-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:98);
[камптотецин-rvAsp-Suc-(Doc)3-Aepa-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:99);
[камптотецин-rvD-Asp-Suc-(Doc)3-Aepa-Tyr1-Nle17,4Hyp34]hNPY(1-36)-NH2;
[камптотецин-rvAsp-Suc-Aepa-(Doc)3-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:100);
[камптотецин-rvD-Asp-Suc-Aepa-(Doc)3-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2;
[камптотецин-rvGly-Suc-Tyr1,Aib17,4Hyp34,Aic36]hNPY(1-36)-NH2 (SEQ ID NO:101);
[камптотецин-rvGly-Suc-Tyr1,Aib17,4Hyp34,Aic35]hNPY(1-35)-NH2 (SEQ ID NO:102);
[камптотецин-rvGly-Suc-(Doc)3-Tyr1,Aib17,4Hyp34,Aic36]hNPY(1-36)-NH2 (SEQ ID NO:103);
[камптотецин-rvGly-Suc-Aepa-(Doc)3-Tyr1,Aib17,4Hyp34,Aic36]hNPY(1-36)-NH2 (SEQ ID NO:104);
[Sn38-rvAsp-Suc-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:89) або
[Sn38-rvAsp-Suc-Tyr1,Nle17,A6c31,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:90);
або її фармацевтично прийнятна сіль.
10. Суміш, яка містить [камптотецин-rvAsp-Suc-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:89) і [камптотецин-rvD-Asp-Suc-Tyr1,Nle17,4Hyp34]hNPY(1-36)-NH2; або їх фармацевтично прийнятні солі.
11. Суміш, яка містить [камптотецин-rvAsp-Suc-Tyr1,Nle17,A6c31,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:90) і [камптотецин-rvD-Asp-Suc-Tyr1,Nle17,A6c31,4Hyp34]hNPY(1-36)-NH2; або їх фармацевтично прийнятні солі.
12. Суміш за будь-яким з пп. 10, 11, яка містить співвідношення (ваги до ваги) приблизно 2:98, приблизно 5:95, приблизно 10:90, приблизно 15:85, приблизно 20:80, приблизно 25:75, приблизно 30:70, приблизно 35:65, приблизно 40:60, приблизно 45:50, приблизно 50:50, приблизно 55:45, приблизно 60:40, приблизно 65:25, приблизно 70:30, приблизно 75:25, приблизно 80:20, приблизно 85:15, приблизно 87:13, приблизно 88:12, приблизно 90:10, приблизно 95:5, приблизно 97:3 або приблизно 98:2 вказаної пари сполук; або їх фармацевтично прийнятних солей.
13. Сполука за п. 1, в якій Z відповідає:
[Aib10,4Hyp34]hNPY(1-36)-NH2 (SEQ DD NO:3);
[Aib17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:4);
[Aib11,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:5);
[4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:6);
[Aib22,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:7);
[A6c31,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:8);
[A6c30,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:9);
[A6c28,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:10);
[Aib3,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:11);
[A6c24,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:12);
[Aib6,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:13);
[Aib18,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:14);
[Aib29,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:15);
[Aib32,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:16);
[Aib23,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:17);
[A6c17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:18);
[Aib11,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:19);
[Aib12,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:20);
[Aib14,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:21);
[Aib15,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:22);
[Aib16,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:23);
[Aib7,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:24);
[Aib9,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:25);
[Aib10,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:26);
[Aib15,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:27);
[Aib11,15,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:28);
[Aib10,15,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:29);
[Aib11,15,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:30);
[Aib12,15,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:31);
[Aib10,15,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:32);
[Aib11,16,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:33);
[Aib10,16,4Hyp34]hNPY(1-36)-NH2 (SEQ ED NO:34);
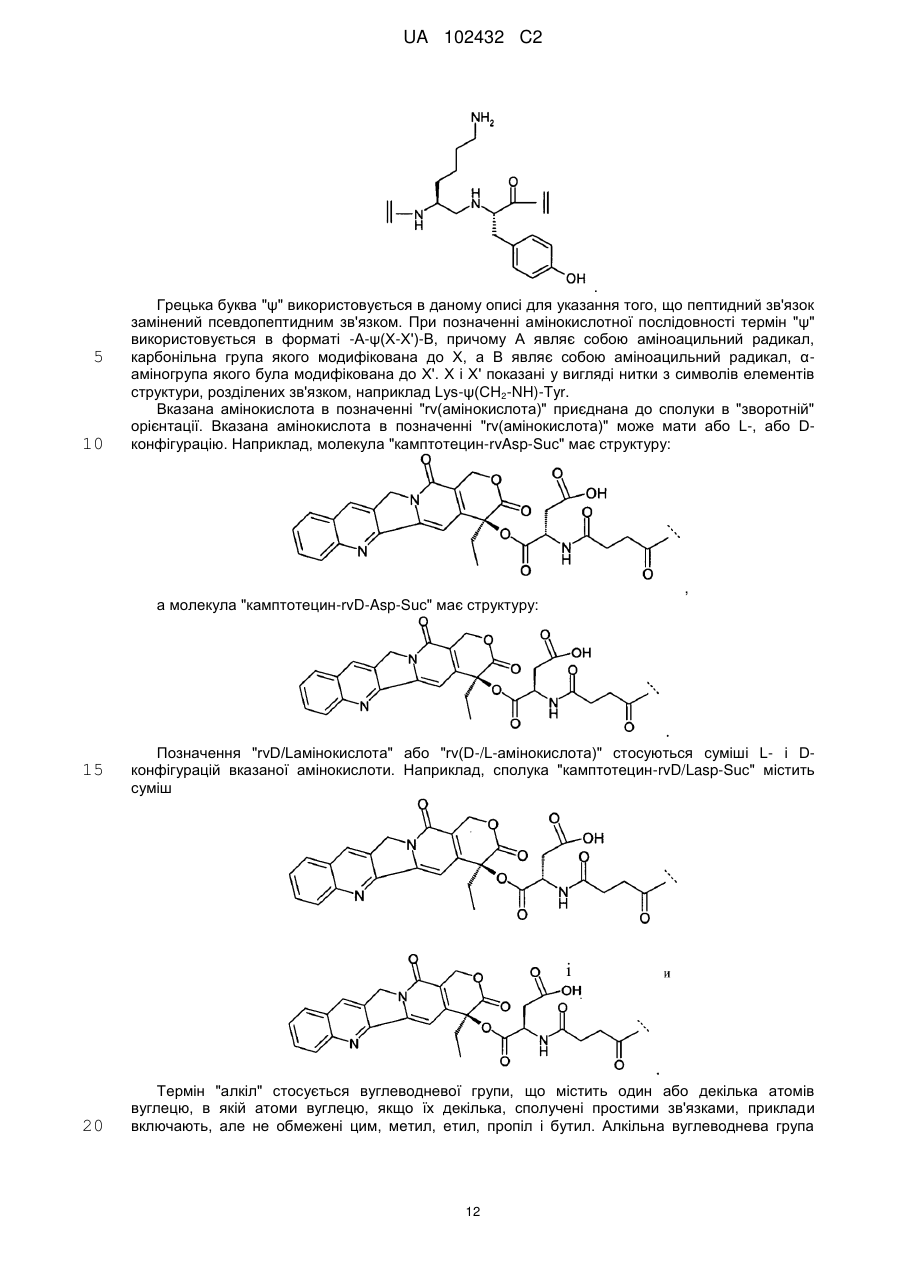
[Aib11,17,4Hyp34,Lys35-ψ(CH2-N(Ac))Tyr36]hNPY(1-36)-NH2 (SEQ ID NO:35);
[Aib17,4Hyp34,Apc35]hNPY(1-36)-NH2 (SEQ ID NO:36);
[Aib17,4Hyp34,Aic36]hNPY(1-36)-NH2 (SEQ ID NO:37);
[Aib17,4Hyp34,4NH2Phe35]hNPY(1-36)-NH2 (SEQ ID NO:38);
[Aib17,4Hyp34,4NH2CH2Phe35]hNPY(1-36)-NH2 (SEQ ID NO:39);
[Aib17,4Hyp34,Lys35-ψ(CH2-NH)Tyr36]hNPY(1-36)-NH2 (SEQ ID NO:40);
[Aib11,17,4Hyp34,Lys35-ψ(CH2-NH)Tyr36]hNPY(1-36)-NH2 (SEQ ID NO:41);
[Nip34]hNPY(1-36)-NH2 (SEQ ID NO:74);
[Inp34]hNPY(1-36)-NH2 (SEQ ID NO:75);
[Dhp34]hNPY(1-36)-NH2 (SEQ ID NO: 76);
[Tic34]hNPY(1-36)-NH2 (SEQ ID NO:78);
[Leu31,Lys34(Nε-C(O)-(CH2)12-CH3)]hNPY(1-36)-NH2 (SEQ ID NO:79);
Des Asn29[Trp28,32,Nva34]-NPY(27-36)-NH2 (SEQ ID NO:85);
димер Bis(31/31'){[Cys31,Trp32,Nva34]-NPY(31-36)-NH2} (SEQ ID NO:87);
або її фармацевтично прийнятна сіль.
14. Сполука за п. 2, в якій A34 є 4Hyp, а A37 відсутній; або її фармацевтично прийнятна сіль.
15. Сполука за п. 14, в якій Z відповідає:
[Aib10,4Hyp34]hNPY(1-36)-NH2 (SEQ DD NO:3);
[Aib17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:4);
[Aib11,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:5);
[4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:6);
[Aib22,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:7);
[A6c31,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:8);
[A6c30,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:9);
[A6c28,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:10);
[Aib3,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:11);
[A6c24,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:12);
[Aib6,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:13);
[Aib18,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:14);
[Aib29,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:15);
[Aib32,4Hyp34]hNPY(1-36)-NH2 (SEQ IDNO:16);
[Aib23,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:17);
[A6c17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:18);
[Aib11,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:19);
[Aib12,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:20);
[Aib14,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:21);
[Aib15,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:22);
[Aib16,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:23);
[Aib7,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:24);
[Aib9,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:25);
[Aib10,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:26);
[Aib15,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:27);
[Aib11,15,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:28);
[Aib10,15,Nle17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:29);
[Aib11,15,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:30);
[Aib12,15,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:31);
[Aib10,15,17,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:32);
[Aib11,16,4Hyp34]hNPY(1-36)-NH2 (SEQ ID NO:33);
[Aib10,16,4Hyp34]hNPY(1-36)-NH2 (SEQ ED NO:34);
[Aib11,17,4Hyp34,Lys35-ψ(CH2-N(Ac))Tyr36]hNPY(1-36)-NH2 (SEQ ID NO:35);
[Aib17,4Hyp34,Apc35]hNPY(1-36)-NH2 (SEQ ID NO:36);
[Aib17,4Hyp34,Aic36]hNPY(1-36)-NH2 (SEQ ID NO:37);
[Aib17,4Hyp34,4NH2Phe35]hNPY(1-36)-NH2 (SEQ ID NO:38) або
[Aib17,4Hyp34,4NH2CH2Phe35]hNPY(1-36)-NH2 (SEQ ID NO:39);
або її фармацевтично прийнятна сіль.
16. Сполука за п. 2, в якій A34 є Pro; або її фармацевтично прийнятна сіль.
17. Сполука за п. 1 або 2, в якій пептидний зв'язок між А35 і А36 замінений псевдопептидним зв'язком; або її фармацевтично прийнятна сіль.
18. Сполука за п. 17, в якій A35-A36 являє собою Lys-ψ(CH2-NH)Tyr або Lys-ψ(CH2-N(Ac))Tyr; або її фармацевтично прийнятна сіль.
19. Сполука за п. 18, в якій Z відповідає:
[Aib11,17,4Hyp34,Lys35-ψ(CH2-N(Ac))Tyr36]hNPY(1-36)-NH2 (SEQ ID NO:35);
[Aib17,4Hyp34,Lys35-ψ(CH2-NH)Tyr36]hNPY(1-36)-NH2 (SEQ ID NO:40) або
[Aib11,17,4Hyp34,Lys35-ψ(CH2-NH)Tyr36]hNPY(1-36)-NH2 (SEQ ID NO:41);
або її фармацевтично прийнятна сіль.
20. Фармацевтична композиція, яка містить ефективну кількість сполуки за будь-яким з пп. 1-9 і 13-19 або її фармацевтично прийнятну сіль, або суміш за будь-яким з пп. 10, 11.
21. Фармацевтична композиція за п. 20, яка додатково містить фармацевтично прийнятний носій.
22. Спосіб лікування захворювання у суб'єкта, що цього потребує, який включає введення вказаному суб'єкту терапевтично ефективної кількості сполуки за будь-яким з пп. 1-9 і 13-19, суміші за будь-яким з пп. 10, 11 або фармацевтично прийнятної композиції за п. 20 або 21, причому вказане захворювання характеризується порушеною або небажаною проліферацією клітин, що експресують рецептор NPY-Y1.
23. Спосіб лікування захворювання у суб'єкта, що цього потребує, за п. 22, в якому вказане захворювання вибране з групи, що складається з раку молочних залоз, раку яєчників, гліальних пухлин, нирковоклітинних карцином, нефробластоми і внутрішньопухлинних кровоносних судин.
Текст
Реферат: Винахід стосується груп нових кон'югатів нейропептиду Υ і цитотоксичних сполук, композицій, що їх містять, і способів, які стосуються їх терапевтичного застосування для лікування захворювання або стану, асоційованого з порушеною або небажаною проліферацією клітин, які експресують рецептори ΝΡΥ-Υ1. UA 102432 C2 (12) UA 102432 C2 UA 102432 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід стосується направлених цитотоксичних сполук, які містять цитотоксичну частину, зв'язану з направляючою частиною, тобто, яка забезпечує направлену дію сполуки. Більш конкретно, даний винахід стосується цитотоксичних кон'югатів з нейропептидом Y, композицій, що їх містять, і способів, пов'язаних з їх терапевтичним застосуванням для лікування захворювань або патологічних станів, асоційованих з порушеною або небажаною клітинною проліферацією, міграцією і/або фізіологічною активністю. Передумови винаходу Більшість цитотоксичних лікарських сполук виявляють небажані токсичні побічні ефекти внаслідок відсутності вибірності відносно тканин або клітин, яким необхідний терапевтичний ефект. Для селективної доставки цитотоксичних агентів в цільовий тип клітин робилися різні підходи. Використання лігандів біологічних рецепторів як носіїв лікарських сполук для направленої доставки цих лікарських сполук в цільові клітини може знизити токсичні побічні ефекти і значно збільшити ефективність доставки лікарських сполук. Наприклад, в публікації № WO 97/19954 за договором про патентну кооперацію (РСТ) розкриті кон'югати антрациклінового цитотоксичного агента, такого як доксорубіцин, з пептидним гормоном, таким як LHRH, бомбезин або соматостатин. Цитотоксичний агент ковалентно приєднаний до пептиду через лінкер, що має структуру: -C(O)-(CH2)n-C(O)-, в якій n=0-7. Аналогічно, в європейській патентній заявці № EP 1118336 розкриті кон'югати соматостатинових аналогів, наприклад октреотиду, ланреотиду і вапреотиду, і цитотоксична лікарська сполука, така як паклітаксел, доксорубіцин або камптотецин, сполучені через спейсер, причому указано, що спейсер має структуру: -C(O)-(CH2)n-C(O)-, в якій n=0-7. У публікації патентної заявки США № 2002/0115596 розкриті кон'югати цитотоксичних агентів і олігопептидів, в яких амінокислотні послідовності пептидів розщеплюються переважно вільним простатичним специфічним антигеном. Стверджують, що такі кон'югати придатні для лікування раку простати і доброякісної гіперплазії простати. У публікації патентної заявки США № 2003/0064984 розкриті кон'югати цитотоксичних аналогів CC-1065 і дуокарміцинів з розщеплюваними лінкерними плечими і направляючим агентом, таким як антитіло або пептид. Цитотоксичні аналоги вивільняються при розщепленні лінкера. У РСТ публікації № WO 02/34237 розкриті кон'югати активних агентів, ковалентно приєднаних напряму до поліпептиду. Стверджують, що поліпептиди стабілізує активний агент, наприклад в шлунку, за допомогою конформаційного захисту. Однак все ще гостро необхідні направлені цитотоксичні лікарські сполуки з поліпшеними властивостями відносно направленої специфічності, системної токсичності і фармакокінетики. Передбачається, що застосування направлених цитотоксичних сполук допомагає лікуванню ряду ракових захворювань або патологічних станів. Наприклад, передбачається, що при лікуванні пухлинних або ракових захворювань, які надекспресують рецептори нейропептиду Y (NPY), використовують направляючу дію і лікарську дію нативного нейропептиду Y людини (hNPY), а саме H-Tyr-Pro-Ser-Lys-Pro-Asp-Asn-Pro-Gly-Glu-Asp-Ala-Pro-Ala-Glu-Asp-Met-Ala-ArgTyr-Tyr-Ser-Ala-Leu-Arg-His-Tyr-Ile-Asn-Leu-Ile-Thr-Arg-Gln-Arg-Tyr-NH2 (SEQ ID NO:1), або його фрагмента або аналога, в комплексі з цитотоксичною частиною. Ефект NPY може бути опосередкований через декілька підтипів NPY-рецепторів, названих Y1-Y6, з яких добре описані Y1, Y2, Y4 і Y5. Огляд NPY і NPY-рецепторів див., наприклад, в Wahlestedt C. and Reis D., Annual Review of Pharmacology and Toxicology, 33:309-352 (1993). Виходячи з високої густини і високої зустрічальності рецептора NPY-Y1 в зразках пухлин молочних залоз і метастазів, як описано в РСТ публікації № WO 02/43776, рак молочних залоз являє собою важливу мішень для NPY-зв'язаних лікарських сполук. Також було знайдено (описано в РСТ публікації № WO 02/43776), що рецептор нейропептиду Y1 експресується виключно в пухлинній тканині або в комбінації з Y2-рецептором, або окремо, в той час як в здоровій тканині експресується тільки Y2-рецептор. Сполука, зв'язуюча Y1-рецептор, розкрита в РСТ публікації № WO 02/43776, вибрана з групи, що складається з наступних сполук: 31 34 31 34 34 "[Leu ,Pro ]-NPY (SEQ ID NO:81), [Leu ,Pro ]-PYY (SEQ ID NO:82), Pro -NPY (SEQ ID 34 NO:83), Pro -PYY (SEQ ID NO:84), NPY (SEQ ID NO:1), PYY (SEQ ID NO:80), Des 29 28,32 34 Asn [Trp ,Nva ]-NPY(27-36) (Balasubramaniam, Peptides 18(3), 445-457 (1997) (SEQ ID 30 32 34 NO:85)), [Pro ,Tyr ,Leu ]-NPY(28-36) (Leban et al., J. Med. Chem. 38, 1150-1157 (1995) (SEQ ID 31 32 34 NO:86)), димер Bis(31/31'){[Cys ,Trp ,Nva ]-NPY(31-36)} (Balasubramaniam, supra, (SEQ ID NO:87)), SR120819A (Serradeil et al., FEBS lett. 225, 209-214 (1987)), BIBP3236 (Rudolf et al., Eur. J. Pharmacol. 271, R11-R13 (1994)), три сполуки, описані в Daniels et al., Proc. Natl. Acad. Sci. USA 92, 9067-9071 (1995): 383U91 формули: 1 UA 102432 C2 1120W91 формули: 1229U91 формули 5 10 15 20 25 30 35 40 45 , і аргінінові міметики". Таким чином, здатність сполуки специфічно взаємодіяти з рецептором NPY-Y1 за допомогою селективних до Y1 аналогів NPY, кон'югованих з цитотоксичною частиною, буде сприяти лікуванню ракових захворювань або станів. Такі ракові захворювання включають, але не обмежені цим, рак молочних залоз, рак яєчників, гліальні пухлини, нирковоклітинні карциноми, нефробластому і внутрішньопухлинні кровоносні судини. Особливі переваги сполук за даним винаходом і їх застосування як способів лікування пухлин і ракових захворювань, які являють собою важливу мішень NPY-направлених лікарських сполук, включають, але не обмежені цим, знижені токсичні побічні ефекти, збільшену ефективність лікування і/або менші ускладнення внаслідок мультилікарської резистентності. Суть винаходу У одному аспекті винахід стосується направлених цитотоксичних сполук з наступною формулою (I): 1 2 3 4 X-B -B -B -В -Z, (I) в якій: Х є цитотоксичним або цитостатичним засобом; 1 В являє собою rv(амінокислоту); 2 3 4 кожний з B , B і B , незалежно в кожному випадку, являє собою (Doc)m, (Aepa)n або -C(O)1 2 3 4 5 W -W -W -W -W -C(O)-, або відсутній; і Z являє собою молекулу, яка зв'язує один або декілька підтипів NPY-рецептора. У формулі (I), Z, переважно, являє собою аналог hNPY, відповідний формулі: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 A -A -A -A -A -A -A -A -А -А -A -А -А -А -А -А -А -А -А -А -A -A -A -A -A -A -A 28 29 30 31 32 33 34 35 36 37 1 A -A -A -A -A -A -A -A -A -A -R (SEQ ID NO:2), в якій: 1 1 2 3 4 5 2 3 A являє собою Tyr, (X ,X ,X ,X ,X )Phe або HN-CH((CH2)q-N(R R ))-C(O); 2 A являє собою Pro, 3Hyp, cis-3Hyp, 4Hyp або cis-4Hyp; 3 2 3 A являє собою Ser, Abu, Aib, Ala, Thr або HN-CH((CH2)q-N(R R ))-C(O); 4 2 3 A являє собою Lys, Arg, hArg, Dab, Dap, Orn або HN-CH((CH2)q-N(R R ))-C(O); 5 A являє собою Pro, 3Hyp, cis-3Hyp, 4Hyp або cis-4Hyp; 6 2 3 A являє собою Asp, Aib, Asn, Gln, Glu або HN-CH((CH2)q-N(R R ))-C(O); 7 2 3 A являє собою Asn, Aib, Gln або HN-CH((CH2)q-N(R R ))-C(O); 8 A являє собою Pro, 3Hyp, cis-3Hyp, 4Hyp або cis-4Hyp; 9 2 3 A являє собою Gly, Aib або HN-CH((CH2)q-N(R R ))-C(O); 10 2 3 A являє собою Glu, Aib, Asn, Asp, Gln або HN-CH((CH2)q-N(R R ))-C(O); 11 2 3 A являє собою Asp, Aib, Asn, Gln, Glu або HN-CH((CH2)q-N(R R ))-C(O); 12 2 3 A являє собою Ala, Abu, Aib, Nva, Val або HN-CH((CH2)q-N(R R ))-C(O); 13 A являє собою Pro, 3Hyp, cis-3Hyp, 4Hyp або cis-4Hyp; 14 2 3 A являє собою Ala, Abu, Aib, Nva, Val або HN-CH((CH2)q-N(R R ))-C(O); 15 2 3 A являє собою Glu, Aib, Asn, Asp, Gln або HN-CH((CH2)q-N(R R ))-C(O); 16 2 3 A являє собою Asp, Aib, Asn, Gln, Glu або HN-CH((CH2)q-N(R R ))-C(O); 17 A являє собою Met, Асс, Aib, Cha, Ile, Leu, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q2 3 N(R R ))-C(O); 18 2 3 A являє собою Ala, Abu, Aib, Nva, Val або HN-CH((CH2)q-N(R R ))-C(O); 2 UA 102432 C2 19 5 10 15 20 25 30 35 40 45 50 55 60 2 3 A являє собою Arg, hArg, Ape, Dab, Dap, Lys, Orn або HN-CH((CH2)q-N(R R ))-C(O); 20 1 2 3 4 5 2 3 A являє собою Tyr, (X ,X ,X ,X ,X )Phe або HN-CH((CH2)q-N(R R ))-C(O); 21 1 2 3 4 5 2 3 A являє собою Tyr, (X ,X ,X ,X ,X )Phe або HN-CH((CH2)q-N(R R ))-C(O); 22 2 3 A являє собою Ser, Abu, Aib, Ala, Thr або HN-CH((CH2)q-N(R R ))-C(O); 23 2 3 A являє собою Ala, Abu, Aib, Nva, Val або HN-CH((CH2)q-N(R R ))-C(O); 24 2 3 A являє собою Leu, Acc, Cha, Ile, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R R ))-C(O); 25 2 3 A являє собою Arg, hArg, Dab, Dap, Lys, Orn або HN-CH((CH2)q-N(R R ))-C(O); 26 2 3 A являє собою His, 2Pal, 3Pal, 4Pal або HN-CH((CH2)q-N(R R ))-C(O); 27 1 2 3 4 5 2 3 A являє собою Tyr, (X ,X ,X ,X ,X )Phe або HN-CH((CH2)q-N(R R ))-C(O); 28 2 3 A являє собою Ile, Acc, Cha, Leu, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R R ))C(O); 29 2 3 A являє собою Asn, Aib, Gln або HN-CH((CH2)q-N(R R ))-C(O); 30 2 3 A являє собою Leu, Acc, Cha, Ile, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R R ))-C(O); 31 2 3 A являє собою Ile, Acc, Cha, Leu, hLeu, Nle, Nva, Tle, Val або HN-CH((CH2)q-N(R R ))-C(O); 32 2 3 A являє собою Thr, Aib, Ser або HN-CH((CH2)q-N(R R ))-C(O); 33 2 3 A являє собою Arg, hArg, Dab, Dap, Lys, Orn або HN-CH((CH2)q-N(R R ))-C(O); 34 A являє собою Gln, Asn, Dhp, 3Hyp, cis-3Hyp, 4Hyp, cis-4Hyp, Inp, Ktp, Nip, Oic, Pro, hPro, 2 3 Tic або HN-CH((CH2)q-N(R R ))-C(O); 35 A являє собою Arg, Aic, Apc, hArg, Dab, Dap, Lys, Orn, 4NH 2Phe, 4NH2CH2Phe або HN2 3 CH((CH2)q-N(R R ))-C(O); 36 1 2 3 4 5 2 3 A являє собою Tyr, Aic, (X ,X ,X ,X ,X )Phe, HN-CH((CH2)q-N(R R ))-C(O) або відсутній; 37 2 3 A являє собою HN-CH((CH2)q-N(R R ))-C(O) або відсутній; 1 6 7 6 R являє собою OH, NH2, (C1-30)алкокси або NH-X -CH2-X , де X являє собою (C1-40)алкіл або 7 (C2-40)алкеніл, і де X являє собою Н, OH, CO2H або С(О)-NH2; 1 5 4 5 кожний з W і W , незалежно для кожного випадку, являє собою CR R ; 4 5 кожний з R і R , незалежно для кожного випадку, являє собою Н, F, Br, Cl, I, (C 1-30)алкіл, (C26 7 8 4 5 30)алкеніл, заміщений (C1-30)алкіл, заміщений (C2-30)алкеніл, SR , S(О)R або S(О)2R ; або R і R разом утворюють (C3-30)циклоалкільне, (C3-30)гетероциклічне або (C5-30)арильне кільце; 6 7 8 кожний з R , R і R , незалежно для кожного випадку, являє собою (C 1-30)алкіл, (C2-30)алкеніл, заміщений (C1-30)алкіл або заміщений (C2-30)алкеніл; 2 3 4 9 10 кожний з W , W і W , незалежно для кожного випадку, являє собою CR R , О, S, (CH2)t або відсутній; 9 10 кожний з R і R , незалежно для кожного випадку, являє собою Н, F, Br, Cl, I, (C 1-30)алкіл, 6 7 8 9 (C2-30)алкеніл, заміщений (C1-30)алкіл, заміщений (C2-30)алкеніл, SR , S(О)R або S(О)2R ; або R і 10 R разом утворюють кільцеву систему; m, незалежно для кожного випадку, являє собою 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10; n, незалежно для кожного випадку, являє собою 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10; q, незалежно для кожного випадку, являє собою 0, 1, 2, 3, 4 або 5; t, незалежно для кожного випадку, являє собою 0, 1, 2 або 3; 1 2 3 4 5 кожний з X , X , X , X і X , незалежно для кожного випадку, являє собою Н, F, Br, Cl, I, (C 110)алкіл, заміщений (C 1-10)алкіл, арил, заміщений арил, OH, OMe, NH2, NO2 або CN; і 2 3 кожний з R і R , незалежно для кожного випадку, являє собою Н, (C1-40)алкіл, (C1(C1-40)ацил, (C2-40)алкеніл, (C2-40)алкініл, арил(C1-40)алкіл, арил(C1-40)ацил, 40)гетероалкіл, заміщений (C1-40)алкіл, заміщений (C1-40)гетероалкіл, заміщений (C1-40)ацил, заміщений (C240)алкеніл, заміщений (C2-40)алкініл, заміщений арил(C1-40)алкіл, заміщений арил(C1-40)ацил, (C12 40)алкілсульфоніл або С(NH)-NH2, причому, коли R являє собою (C1-40)ацил, арил(C1-40)ацил, 3 заміщений (C1-40)ацил, заміщений арил(C1-40)ацил, (C1-40)алкілсульфоніл або С(NH)-NH2, R являє собою Н або (C1-40)алкіл, (C1-40)гетероалкіл, (C2-40)алкеніл, (C2-40)алкініл, арил(C1-40)алкіл, заміщений (C1-40)алкіл, заміщений (C1-40)гетероалкіл, заміщений (C2-40)алкеніл, заміщений (C240)алкініл або заміщений арил(C1-40)алкіл. До підтипу (IA) сполук, описуваних вищезазначеною формулою (I), належать сполуки, у яких: Х є цитотоксичним засобом; 1 B являє собою rvAsp, rvD-Asp, rvCha, rvD-Cha або rvGly; 2 B є Suc; 3 4 кожний з B і B , незалежно для кожного випадку, являє собою (Doc) m, (Aepa)n або відсутній; 1 2 3 A являє собою Tyr або HN-CH((CH2)q-N(R R ))-C(O); 2 A являє собою Pro; 3 2 3 A являє собою Ser, Aib або HN-CH((CH2)q-N(R R ))-C(O); 4 2 3 A являє собою Lys або HN-CH((CH2)q-N(R R ))-C(O); 5 A являє собою Pro; 6 2 3 A являє собою Asp, Aib або HN-CH((CH2)q-N(R R ))-C(O); 3 UA 102432 C2 7 5 10 15 20 25 30 35 40 45 50 55 60 2 3 A являє собою Asn, Aib або HN-CH((CH2)q-N(R R ))-C(O); 8 A являє собою Pro; 9 2 3 A являє собою Gly, Aib або HN-CH((CH2)q-N(R R ))-C(O); 10 2 3 A являє собою Glu, Aib або HN-CH((CH2)q-N(R R ))-C(O); 11 2 3 A являє собою Asp, Aib або HN-CH((CH2)q-N(R R ))-C(O); 12 2 3 A являє собою Ala, Aib або HN-CH((CH2)q-N(R R ))-C(O); 13 A являє собою Pro; 14 2 3 A являє собою Ala, Aib або HN-CH((CH2)q-N(R R ))-C(O); 15 2 3 A являє собою Glu, Aib або HN-CH((CH2)q-N(R R ))-C(O); 16 2 3 A являє собою Asp, Aib або HN-CH((CH2)q-N(R R ))-C(O); 17 2 3 A являє собою Met, A6c, Aib, Nle або HN-CH((CH2)q-N(R R ))-C(O); 18 2 3 A являє собою Ala, Aib або HN-CH((CH2)q-N(R R ))-C(O); 19 2 3 A являє собою Arg або HN-CH((CH2)q-N(R R ))-C(O); 20 2 3 A являє собою Tyr або HN-CH((CH2)q-N(R R ))-C(O); 21 2 3 A являє собою Tyr або HN-CH((CH2)q-N(R R ))-C(O); 22 2 3 A являє собою Ser, Aib або HN-CH((CH2)q-N(R R ))-C(O); 23 2 3 A являє собою Ala, Aib або HN-CH((CH2)q-N(R R ))-C(O); 24 2 3 A являє собою Leu, A6c або HN-CH((CH2)q-N(R R ))-C(O); 25 2 3 A являє собою Arg або HN-CH((CH2)q-N(R R ))-C(O); 26 2 3 A являє собою His або HN-CH((CH2)q-N(R R ))-C(O); 27 2 3 A являє собою Tyr або HN-CH((CH2)q-N(R R ))-C(O); 28 2 3 A являє собою Ile, A6c або HN-CH((CH2)q-N(R R ))-C(O); 29 2 3 A являє собою Asn, Aib або HN-CH((CH2)q-N(R R ))-C(O); 30 2 3 A являє собою Leu, A6c або HN-CH((CH2)q-N(R R ))-C(O); 31 2 3 A являє собою Ile, A6c, Leu або HN-CH((CH2)q-N(R R ))-C(O); 32 2 3 A являє собою Thr, Aib або HN-CH((CH2)q-N(R R ))-C(O); 33 2 3 A являє собою Arg або HN-CH((CH2)q-N(R R ))-C(O); 34 2 3 A являє собою Tic, Dhp, 4Hyp, Inp, Nip, Pro, hPro або HN-CH((CH2)q-N(R R ))-C(O); 35 2 3 A являє собою Arg, Aic, Apc, Lys, 4NH2Phe, 4NH2CH2Phe або HN-CH((CH2)q-N(R R ))-C(O); 36 2 3 A являє собою Tyr, Aic, HN-CH((CH2)q-N(R R ))-C(O) або відсутній; 37 2 3 A являє собою HN-CH((CH2)q-N(R R ))-C(O) або відсутній; 1 R являє собою NH2; 2 3 кожний з R і R , незалежно для кожного випадку, являє собою Н або (C1-30)ацил; 2 3 за умови, що, коли R є (C1-30)ацилом, R є Н; 4 5 кожний з R і R , незалежно для кожного випадку, являє собою Н або (C1-40)ацил; q являє собою 4; і 1 2 3 4 5 кожний з X , X , X , X і X , незалежно для кожного випадку, являє собою Н, CH2NH2 або NH2. 35 36 У формулі (I) або підтипі (IA) пептидний зв'язок між A і A може бути заміщений 35 36 псевдопептидним зв'язком, в якому A -A можуть являти собою Lys-ψ(CH2-NH)Tyr або Lysψ(CH2-N(Ac))Tyr. У переважному варіанті формули (I) або підтипу (IA), Z відповідає: 10 34 Приклад 1: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ DD NO:3); 17 34 Приклад 2: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:4); 11,17 34 Приклад 3: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:5); 34 Приклад 4: [4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:6); 22 34 Приклад 5: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:7); 31 34 Приклад 6: [A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:8); 30 34 Приклад 7: [A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:9); 28 34 Приклад 8: [A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 10); 3 34 Приклад 9: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 11); 24 34 Приклад 10: [A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 12); 6 34 Приклад 11: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 13); 18 34 Приклад 12: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 14); 29 34 Приклад 13: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 15); 32 34 Приклад 14: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 16); 23 34 Приклад 15: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 17); 17 34 Приклад 16: [A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 18); 11 34 Приклад 17: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 19); 12 34 Приклад 18: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:20); 14 34 Приклад 19: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:21); 4 UA 102432 C2 15 5 10 15 20 25 30 35 40 45 50 55 60 34 Приклад 20: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:22); 16 34 Приклад 21: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:23); 7 34 Приклад 22: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:24); 9 34 Приклад 23: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:25); 10,17 34 Приклад 24: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:26); 15,17 34 Приклад 25: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:27); 11,15 17 34 Приклад 26: [Aib ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:28); 10,15 17 34 Приклад 27: [Aib ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:29); 11,15,17 34 Приклад 28: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:30); 12,15,17 34 Приклад 29: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:31); 10,15,17 34 Приклад 30: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:32); 11,16 34 Приклад 31: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:33); 10,16 34 Приклад 32: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ED NO:34); 11,17 34 35 36 Приклад 33: [Aib ,4Hyp ,Lys -ψ(CH2-N(Ac))Tyr ]hNPY(1-36)-NH2 (SEQ ID NO:35); 17 34 35 Приклад 34: [Aib ,4Hyp ,Apc ]hNPY(1-36)-NH2 (SEQ ID NO:36); 17 34 36 Приклад 35: [Aib ,4Hyp ,Aic ]hNPY(1-36)-NH2 (SEQ ID NO:37); 17 34 35 Приклад 36: [Aib ,4Hyp ,4NH2Phe ]hNPY(1-36)-NH2 (SEQ ID NO:38); 17 34 35 Приклад 37: [Aib ,4Hyp ,4NH2CH2Phe ]hNPY(1-36)-NH2 (SEQ ID NO:39); 17 34 35 36 Приклад 38: [Aib ,4Hyp ,Lys -ψ(CH2-NH)Tyr ]hNPY(1-36)-NH2 (SEQ ID NO:40); 11,17 34 35 36 Приклад 39: [Aib ,4Hyp ,Lys -ψ(CH2-NH)Tyr ]hNPY(1-36)-NH2 (SEQ ID NO:41); 31 34 36 ε Приклад 40: [Leu ,Pro ,Lys (N -C(O)-(CH2)12-CH3)]hNPY(1-36)-NH2 (SEQ ID NO:42); 31 34 35 ε Приклад 41: [Leu ,Pro ,Lys (N -C(O)-(CH2)12-CH3)]hNPY(1-36)-NH2 (SEQ ID NO:43); 24 ε 31 34 Приклад 42: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:44); 23 ε 31 34 Приклад 43: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:45); 22 ε 31 34 Приклад 44: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:46); 21 ε 31 34 Приклад 45: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:47); 20 ε 31 34 Приклад 46: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:48); 19 ε 31 34 Приклад 47: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:49); 18 ε 31 34 Приклад 48: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:50); 17 ε 31 34 Приклад 49: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:51); 16 ε 31 34 Приклад 50: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:52); 15 ε 31 34 Приклад 51: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:53); 14 ε 31 34 Приклад 52: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:54); 12 ε 31 34 Приклад 53: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:55); 11 ε 31 34 Приклад 54: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:56); 10 ε 31 34 Приклад 55: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:57); 9 ε 31 34 Приклад 56: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:58); 7 ε 31 34 Приклад 57: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:59); 6 ε 31 34 Приклад 58: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:60); 4 ε 31 34 Приклад 59: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:61); 3 ε 31 34 Приклад 60: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:62); 1 ε 31 34 Приклад 61: [Lys (N -C(O)-(CH2)12-CH3), Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:63); 31 34 37 ε Приклад 62: [Leu ,Pro ,Lys (N -C(O)-(CH2)12-CH3)]hNPY(1-37)-NH2 (SEQ ID NO:64); 31 33 ε 34 Приклад 63: [Leu ,Lys (N -C(O)-(CH2)12-CH3),Pro ]hNPY(1-36)-NH2 (SEQ ID NO:65); 31 32 ε 34 Приклад 64: [Leu ,Lys (N -C(O)-(CH2)12-CH3), Pro ]hNPY(1-36)-NH2 (SEQ ID NO:66); 31 ε 34 Приклад 65: [Lys (N -C(O)-(CH2)12-CH3),Pro ]hNPY(1-36)-NH2 (SEQ ID NO:67); 30 ε 31 34 Приклад 66: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:68); 29 ε 31 34 Приклад 67: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:69); 28 ε 31 34 Приклад 68: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:70); 27 ε 31 34 Приклад 69: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:71); 26 ε 31 34 Приклад 70: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:72); 25 ε 31 34 Приклад 71: [Lys (N -C(O)-(CH2)12-CH3),Leu ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:73); 34 Приклад 72: [Nip ]hNPY(1-36)-NH2 (SEQ ID NO:74); 34 Приклад 73: [Inp ]hNPY(1-36)-NH2 (SEQ ID NO:75); 34 Приклад 74: [Dhp ]hNPY(1-36)-NH2 (SEQ ID NO: 76); 34 Приклад 75: [hPro ]hNPY(1-36)-NH2 (SEQ ID NO:77); 34 Приклад 76: [Tic ]hNPY(1-36)-NH2 (SEQ ID NO:78); 31 34 ε Приклад 77: [Leu ,Lys (N -C(O)-(CH2)12-CH3)]hNPY(1-36)-NH2 (SEQ ID NO:79); Приклад 78: NPY-NH2 (SEQ ID NO:1); Приклад 79: PYY-NH2 (SEQ ID NO:80); 5 UA 102432 C2 31 5 10 34 Приклад 80: [Leu ,Pro ]-NPY-NH2 (SEQ ID NO:81); 31 34 Приклад 81: [Leu ,Pro ]-PYY-NH2 (SEQ ID NO:82); 34 Приклад 82: [Pro ]-NPY-NH2 (SEQ ID NO:83); 34 Приклад 82A: [Pro ]-PYY-NH2 (SEQ ID NO:84); 29 28,32 34 Приклад 83: Des Asn [Trp ,Nva ]-NPY(27-36)-NH2 (SEQ ID NO:85); 30 32 34 Приклад 84: [Pro ,Tyr ,Leu ]-NPY(28-36)-NH2 (SEQ ID NO:86); 31 32 34 Приклад 85: димер Bis(31/31'){[Cys ,Trp ,Nva ]-NPY(31-36)-NH2} (SEQ ID NO:87); Приклад 86: SR120819A; Приклад 87: BIBP3236; Приклад 88: сполука 383U91 формули: Приклад 89: сполука 1120W91 формули: ; Приклад 90: сполука 1229U91 формули: 15 20 25 30 35 40 45 або 1 17 34 Приклад 90А: [CH3(CH2)8(CO)-Tyr ,Nle ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO: 105). Іншим підтипом (IB) сполук, описуваних формулою (I) або підтипом (IA), є сполуки, в яких: 1 A являє собою Tyr; 3 A являє собою Ser; 4 A являє собою Lys; 6 A являє собою Asp; 7 A являє собою Asn; 9 A являє собою Gly; 10 A являє собою Glu; 11 A являє собою Asp; 12 A являє собою Ala; 14 A являє собою Ala; 15 A являє собою Glu; 16 A являє собою Asp; 17 A являє собою Aib або Nle; 18 A являє собою Ala; 19 A являє собою Arg; 20 A являє собою Tyr; 21 A являє собою Tyr; 22 A являє собою Ser; 23 A являє собою Ala; 24 A являє собою Leu; 25 A являє собою Arg; 23 A являє собою Ala; 24 A являє собою Leu; 25 A являє собою Arg; 26 A являє собою His; 27 A являє собою Tyr; 28 A являє собою Ile; 29 A являє собою Asn; 30 A являє собою Leu; 31 A являє собою Ile або A6c; 32 A являє собою Thr; 33 A являє собою Arg; 6 UA 102432 C2 34 5 10 A являє собою 4Hyp або Pro; 35 A являє собою Arg або Aic; 36 A являє собою Tyr, Aic або відсутній; і 37 A відсутній. Переважний варіант здійснення даного винаходу являє собою сполуку за формулою (I), підтипу (IA) або підтипу (IB), в якій Х є антрацикліном, камптотецином, похідним камптотецину, паклітакселом, похідним паклітакселу, доксорубіцином або похідним доксорубіцину. У додатковому переважному варіанті здійснення даного винаходу Х є камптотецином або похідним камптотецину, причому вказаним похідним камптотецину є: Sn38 7 UA 102432 C2 або Х є паклітакселом або похідним паклітакселу, причому вказаним похідним паклітакселу є: 5 10 15 або Х є доксорубіцином або похідним доксорубіцину, причому вказаним похідним доксорубіцину є: Додатковий переважний варіант здійснення винаходу являє собою будь-яку одну з наступних сполук підтипу (IB): 1 17 34 Приклад 91: [камптотецин-rvGly-Suc-Tyr ,Nle ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:88); 1 17 34 Приклад 92: [камптотецин-rvD-Asp-Suc-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2; 1 17 34 Приклад 92A: [камптотецин-rvAsp-Suc-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 89); 1 17 31 34 Приклад 93: [камптотецин-rvD-Asp-Suc-Tyr ,Nle ,A6c ,4Hyp ]hNPY(1-36)-NH2; 1 17 31 34 Приклад 93A: [камптотецин-rvAsp-Suc-Tyr ,Nle ,A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:90); 1 17 31 34 Приклад 94: [камптотецин-rvGly-Suc-Tyr ,Nle ,A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:91); 1 17 34 Приклад 95: [камптотецин-rvD-Asp-Suc-Tyr ,Nle ,Pro ]hNPY(1-36)-NH2; 1 17 34 Приклад 95A: [камптотецин-rvAsp-Suc-Tyr ,Nle ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:92); 8 UA 102432 C2 1 5 10 15 20 25 30 35 40 45 50 55 17 34 Приклад 96: [камптотецин-rvCha-Suc-Tyr ,Nle ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:93); 1 17 34 Приклад 96A: [камптотецин-rvD-Cha-Suc-Tyr ,Nle ,Pro ]hNPY(1-36)-NH2; 1 17 34 Приклад 97: [камптотецин-rvGly-Suc-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:94); 1 17 34 Приклад 98: [камптотецин-rvGly-Suc-(Doc)3-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:95); 1 17 34 Приклад 99: [камптотецин-rvGly-Suc-(Doc)3-Aepa-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:96); 1 17 34 Приклад 100: [камптотецин-rvD-Asp-Suc-(Doc)3-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2; 1 17 34 Приклад 100A: [камптотецин-rvAsp-Suc-(Doc)3-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:97); 1 17 34 Приклад 101: [камптотецин-rvGly-Suc-Aepa-(Doc)3-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:98); 1 17 34 Приклад 102: [камптотецин-rvD-Asp-Suc-(Doc)3-Aepa-Tyr -Nle ,4Hyp ]hNPY(1-36)-NH2; 1 17 34 Приклад 102A: [камптотецин-rvAsp-Suc-(Doc)3-Aepa-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:99); 1 17 34 Приклад 103: [камптотецин-rvD-Asp-Suc-Aepa-(Doc)3-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2; 1 17 34 Приклад 103A: [камптотецин-rvAsp-Suc-Aepa-(Doc)3-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO: 100); 1 17 34 36 Приклад 104: [камптотецин-rvGly-Suc-Tyr ,Aib ,4Hyp ,Aic ]hNPY(1-36)-NH2 (SEQ ID NO: 101); 1 17 34 35 Приклад 105: [камптотецин-rvGly-Suc-Tyr ,Aib ,4Hyp ,Aic ]hNPY(1-35)-NH2 (SEQ ID NO: 102); 1 17 34 36 Приклад 106: [камптотецин-rvGly-Suc-(Doc)3-Tyr ,Aib ,4Hyp ,Aic ]hNPY(1-36)-NH2 (SEQ ID NO: 103) і 1 17 34 36 Приклад 107: [камптотецин-rvGly-Suc-Aepa-(Doc)3-Tyr ,Aib ,4Hyp ,Aic ]hNPY(1-36)-NH2 (SEQ ID NO: 104), 1 17 34 Приклад 108: [Sn38-rvGly-Suc-Tyr ,Nle ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:88); 1 17 34 Приклад 109: [Sn38-rvAsp-Suc-Tyr ,Nle ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:89) або 1 17 31 34 Приклад 110: [Sn38-rvAsp-Suc-Tyr ,Nle ,A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:90); або її фармацевтично прийнятну сіль. У додатковому аспекті винахід стосується суміші сполук формули (I), підтипу (IA) або підтипу (IB), в якій лінкер rv(амінокислота) знаходиться в D-формі в деяких сполуках в суміші і в L-формі в деяких сполуках в суміші. Суміш включає в себе (по вазі) приблизно 2:98, приблизно 5:95, приблизно 10:90, приблизно 15:85, приблизно 20:80, приблизно 25:75, приблизно 30:70, приблизно 35:65, приблизно 40:60, приблизно 45:50, приблизно 50:50, приблизно 55:45, приблизно 60:40, приблизно 65:25, приблизно 70:30, приблизно 75:25, приблизно 80:20, приблизно 85:15, приблизно 90:10, приблизно 95:5, приблизно 97:3 або навіть приблизно 98:2 сполук в суміші, в яких лінкер rv(амінокислота) знаходиться в D-формі і в L-формі, відповідно. Короткий опис креслень На фігурі 1 показані криві медіани росту пухлин для сполук з прикладу 91, які показують in vivo ефекти сполуки з прикладу 91 в трьох різних дозуваннях на медіану росту пухлини в дослідженні А в порівнянні з відсутністю лікування або лікуванням тільки камптотецином. На фігурі 2 показані криві медіани росту пухлин для сполук з прикладу 92, які показують in vivo ефекти сполуки з прикладу 92 в трьох різних дозуваннях на медіану росту пухлини в дослідженні А в порівнянні з відсутністю лікування або лікуванням тільки камптотецином. На фігурі 3 показані криві медіани росту пухлин для сполук з прикладу 93, які показують in vivo ефекти сполуки з прикладу 93 в трьох різних дозуваннях на медіану росту пухлини в дослідженні В в порівнянні з відсутністю лікування або лікуванням тільки камптотецином. Докладний опис винаходу Використовуваний в даному описі термін "амінокислота" стосується будь-якої природної або неприродної амінокислоти, включаючи, але не обмежуючись, α-амінокислоти, β-амінокислоти або γ-амінокислоти, і він може стосуватися або D-, або L-амінокислот, якщо не вказане інше. За винятком N-кінцевої амінокислоти, всі амінокислотні скорочення (наприклад, Ala) в цьому описі мають структуру -NH-Cl(R')-CO-, в якій R і R', кожний незалежно, являють собою водень або бічний ланцюг амінокислоти (наприклад, R=CH3 і R'=Н для Ala), або R і R' можуть бути сполучені, утворюючи кільцеву систему. Пептид за цим винаходом також позначають, використовуючи інший формат, наприклад 34 [Pro ]hNPY(1-36)-NH2 (SEQ ID NO:83), із заміщеними 9 UA 102432 C2 5 10 15 20 25 30 35 40 45 50 , в якій паралельні лінії "=" вказують на точки приєднання молекули до іншої молекули або послідовності; Apn-5-амінопентанова кислота; Arg або R - аргінін; hArg - гомоаргінін; Asn або N - луоренілм; Asp або D - аспарагінова кислота; Aun-11-аміноундеканова кислота; Cha - β-циклогексилаланін; Cys або С - цистеїн; Dab-2,4-діаміномасляна кислота; Dap-2,3-діамінопропіонова кислота; Dhp-3,4-дегідропролін; Dmt-5,5-диметилтіазолідин-4-карбонова кислота; Doc-8-аміно-3,6-діоксаоктанова кислота, представлена структурою: ; Gaba-4-аміномасляна кислота; Gln або Q - глутамін; Glu або Е - глутамінова кислота; Gly або G - гліцин; His або Н - гістидин; 3Hyp - транс-3-гідрокси-L-пролін, тобто (2S, 3S)-3-гідроксипіролідин-2-карбонова кислота; cis-3Hyp - цис-3-гідрокси-L-пролін, тобто (2S, 3S)-3-гідроксипіролідин-2-карбонова кислота; 4Hyp-4-гідроксипролін, тобто (2S, 4R)-4-гідроксипіролідин-2-карбонова кислота; cis-4Hyp - цис-4-гідрокси-L-пролін, тобто (2S, 4S)-4-гідроксипіролідин-2-карбонова кислота, Ile або I - ізолейцин; Inc - індолін-2-карбонова кислота; Inp - ізоніпекотинова кислота; Ktp-4-кетопролін; Leu або L - лейцин; hLeu - гомолейцин; Lys або K - лізин; Met або М - метіонін; Nip - ніпекотинова кислота; Nle - норлейцин; ε N вказує, що структура в круглих дужках приєднана до епсилон-азоту бічного ланцюга Lys; Nva - норвалін; Oic - октагідроіндол-2-карбонова кислота; Orn - орнітин; 2-Pal - β-(2-піридил)аланін; 3-Pal - β-(3-піридил)аланін, 4-Pal - β-(4-піридил)аланін; Phe або F - фенілаланін; hPhe - гомофенілаланін; 4NH2CH2Phe-4-амінометилфенілаланін; 4NH2Phe-4-амінофенілаланін; Pro або Р - пролін; hPro - гомопролін; Sar - саркозин або N-метилгліцин; 10 UA 102432 C2 Ser або S - серин; 5 10 15 20 25 30 35 40 45 50 Suc - сукциніл, представлений структурою: ; Thr або Т - треонін; Tic-1,2,3,4-тетрагідроізохінолін-3-карбонова кислота; Tle - трет-лейцин; Val або V - валін. Нижче наведене визначення інших скорочень, використовуваних в цьому документі: Ac - ацетил; Aloc - алілоксикарбоніл; Вос - трет-бутилоксикарбоніл; Bhoc - бензгідрилоксикарбоніл; BSA - бичачий сироватковий альбумін; Bzl - бензил; CPT - камптотецин; DCM - дихлорметан; Dde-1-(4,4-диметил-2,6-діоксоциклогекс-1-илідин)етил; DIC-N, N-діізопропілкарбодіімід; DIЕA - діізопропілетиламін; DMA-N, N-диметилацетамід; Dmab-4-{N-(1-(4,4-диметил-2,6-діоксоциклогексиліден)-3-метилбутил)-аміно}бензил; DMAP-4-(диметиламіно)піридин; DMF - диметилформамід; DNP-2,4-динітрофеніл; D5W-5 %-й розчин декстрози у воді; EDC-1-етил-3-(3-диметиламінопропіл)карбодііміду гідрохлорид; et - етил; EMEM - мінімальне підтримуюче середовище Ігла; Fmoc - флуоренілметоксикарбоніл; HATU - О-(7-азабензотриазол-1-іл)-1,1,3,3-тетраметилуронію гексафторфосфат; HBTU-2-(1Н-бензотриазол-1-іл)-1,1,3,3-тетраметилуронію гексафторфосфат; cHex - циклогексил; HOAT - О-(7-азабензотриазол-1-іл)-1,1,3,3-тетраметилуронію гексафторфосфат; HOВt-1-гідроксибензотриазол; ВЕРХ - високоефективна рідинна хроматографія; ip - внутрішньоочеревинна ін'єкція; iv - ін'єкція в хвостову вену; MBHA-4-метилбензгідриламін; Mmt-4-метокситритил; NMP-N-метил-2-піролідинон; Pbf-2,2,4,6,7-пентаметилдигідробензофуран-5-сульфоніл; qwk×3 - три дози, по одній дозі раз на тиждень; Sc(Otf)3 - трифторметансульфонат скандію(III); tBu - трет-бутил; TEA - триетиламін; TGD - затримка росту пухлини; TGI - інгібування росту пухлини; TIS - триізопропілсилан; TOS - тозил; Trt - тритил; TFA - трифтороцтова кислота; TFFH - тетраметилфторфорамідинію гексафторфосфат; Lys-ψ(CH2-NH)Tyr має структуру: 11 UA 102432 C2 5 10 . Грецька буква "ψ" використовується в даному описі для указання того, що пептидний зв'язок замінений псевдопептидним зв'язком. При позначенні амінокислотної послідовності термін "ψ" використовується в форматі -А-ψ(Х-Х')-В, причому А являє собою аміноацильний радикал, карбонільна група якого модифікована до Х, а В являє собою аміноацильний радикал, αаміногрупа якого була модифікована до Х'. Х і Х' показані у вигляді нитки з символів елементів структури, розділених зв'язком, наприклад Lys-ψ(CH2-NH)-Tyr. Вказана амінокислота в позначенні "rv(амінокислота)" приєднана до сполуки в "зворотній" орієнтації. Вказана амінокислота в позначенні "rv(амінокислота)" може мати або L-, або Dконфігурацію. Наприклад, молекула "камптотецин-rvAsp-Suc" має структуру: , а молекула "камптотецин-rvD-Asp-Suc" має структуру: 15 Позначення "rvD/Lамінокислота" або "rv(D-/L-амінокислота)" стосуються суміші L- і Dконфігурацій вказаної амінокислоти. Наприклад, сполука "камптотецин-rvD/Lasp-Suc" містить суміш і 20 Термін "алкіл" стосується вуглеводневої групи, що містить один або декілька атомів вуглецю, в якій атоми вуглецю, якщо їх декілька, сполучені простими зв'язками, приклади включають, але не обмежені цим, метил, етил, пропіл і бутил. Алкільна вуглеводнева група 12 UA 102432 C2 5 10 15 20 25 30 35 40 45 50 55 60 може являти собою прямий ланцюг або містити одне або декілька відгалужень або циклічні групи, приклади яких включають, але не обмежені цим, ізопропіл і трет-бутил. Термін "заміщений алкіл" стосується алкілу, у якому один або декілька атомів водню вуглеводневої групи заміщені одним або декількома замісниками, вибраними з групи, що складається з галогену (тобто фтору, хлору, брому і йоду), ОН, CN, SH, NH 2, NHCH3, NO2, (C12)алкілу, заміщеного 1-6 атомами галогену, CF3, ОСН3, OCF3 і (СН2)0-4-СООН. У різних варіантах здійснення винаходу присутні 1, 2, 3 або 4 замісники. Присутність (СН 2)0-4-СООН приводить до одержання алкілвмісної кислоти. Приклади алкілвмісних кислот, що містять (СН2)0-4-СООН, включають в себе 2-норборнаноцтову кислоту, трет-масляну кислоту і 3-циклопентилпропіонову кислоту. Термін "гетероалкіл" стосується алкілу, у якому один або декілька атомів вуглецю у вуглеводневій групі заміщені одним або декількома з наступних атомів або груп: аміно, амідо, О, S, N і карбоніл. У різних варіантах здійснення винаходу присутні 1 або 2 гетероатоми. Термін "заміщений гетероалкіл" стосується гетероалкілу, у якому один або декілька атомів вуглецю вуглеводневої групи заміщені одним або декількома замісниками, вибраними з групи, що складається з галогену (тобто фтору, хлору, брому і йоду), ОН, CN, SH, NH 2, NHCH3, NO2, (C1-2)алкілу, заміщеного 1-6 атомами галогену, CF3, ОСН3, OCF3 і (СН2)0-4-СООН. У різних варіантах здійснення винаходу присутні 1, 2, 3 або 4 замісники. Термін "алкеніл" стосується вуглеводневої групи, утвореної двома або декількома атомами вуглецю, в якій присутні один або декілька подвійних зв'язків вуглець-вуглець, приклади якої включають, але не обмежені цим, вініл, аліл, бутеніл і пропеніл. Алкенільна вуглеводнева група може являти собою прямий ланцюг або містити одне або декілька відгалужень або циклічні групи, приклади яких включають, але не обмежені цим, н-бутеніл відносно т-бутенілу і нпентеніл в порівнянні з циклопентенілом. Термін "заміщений алкеніл" стосується алкенілу, в якому один або декілька атомів водню заміщені одним або декількома замісниками, вибраними з групи, що складається з галогену (тобто фтору, хлору, брому і йоду), ОН, CN, SH, NH 2, NHCH3, NO2, (C1-2)алкілу, заміщеного 1-6 атомами галогену, CF3, ОСН3, OCF3 і (СН2)0-4-СООН. У різних варіантах здійснення винаходу присутні 1, 2, 3 або 4 замісники. Термін "арил" стосується необов'язково заміщеної ароматичної групи щонайменше з одним кільцем, що має кон'юговану π-електронну систему, яка містить до двох кон'югованих або конденсованих кільцевих систем. Арил включає в себе, але не обмежений цим, карбоциклічну арильну, гетероциклічну арильну і біарильну групи. Переважно, арил є 5- або 6-членним кільцем. Переважні атоми для гетероциклічного арилу включають, але без обмеження, один або декілька з атомів сірки, кисню і азоту. Приклади арилу включають, але не обмежені цим, феніл, 1-нафтил, 2-нафтил, індол, хінолін, 2-імідазол і 9-антрацен. Замісники арилу вибрані з групи, що складається з (С1-4)алкілу, (С1-4)алкокси, галогену (тобто фтору, хлору, брому і йоду), ОН, CN, SH, NH2, NO2, (C1-2)алкілу, заміщеного 1-5 атомами галогену, CF3, OCF3 і (СН2)0-4-СООН. У різних варіантах здійснення винаходу арил містить 0, 1, 2, 3 або 4 замісники. Термін "алкіларил" стосується "алкілу", сполученого з "арилом", як описано вище. Передбачається, що термін "циклоалкіл" включає моноциклоалкільну групу або біциклоалкільну групу з вказаним числом атомів вуглецю, відомі досвідченим фахівцям в даній галузі. Термін "гетероцикл" включає моноциклічні і біциклічні системи з одним або декількома гетероатомами, такими як кисень, азот і сірка. Кільцева система може бути ароматичною, наприклад піридин, індол, хінолін, піримідин, тіофен (також відомий як тієніл), фуран, бензотіофен, тетразол, дигідроіндол, індазол, N-форміліндол, бензімідазол, тіазол і тіадіазол. Кільцеві системи також можуть бути неароматичними, як, наприклад, але не обмежені цим, піролідин, піперидин, морфолін і т. п. Синтез Сполуки за даним винаходом можна одержати з використанням методик, описаних в прикладах цього документа, а також за допомогою методик, добре відомих в даній галузі. Наприклад, поліпептидну область аналога NPY можна синтезувати і/або модифікувати хімічним або біохімічним способом. Приклади методик біохімічного синтезу, які включають введення нуклеїнової кислоти в клітину і експресію нуклеїнових кислот, можна знайти, наприклад, в Stewart, J. M., et al., Solid Phase Synthesis, Pierce Chemical Co., 2d ed. (1984); і, наприклад, в Sambrook et al., Molecular Cloning: А Laboratоry Manual, 2nd Edition, Cold Spring Harbor Laboratory Press, (1989). Нижченаведені приклади також ілюструють способи синтезу направлених цитотоксичних сполук за даним винаходом. Приклади наведені в ілюстративних цілях і ніяким чином не мають на увазі обмеження обсягу винаходу. 13 UA 102432 C2 10 5 10 15 20 25 30 35 40 45 50 55 60 34 Приклад 1: [Aib ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:3) Вказаний в заголовку пептид синтезували за допомогою Fmoc-хімії. С-кінцеву частину пептиду (залишки 18-36) синтезували на пептидному синтезаторі ABI 433A (Applied Biosystems, Foster City, CA, USA) в масштабі синтезу 1,0 ммоль. 1,37 г Rink-амідної MBHA-смоли із заміщенням 0,73 ммоль (Novabiochem, San Diego, CA, USA) поміщали в реакційну посудину. Смолу обробляли 10 мл NMP протягом 15 хвилин для набухання смоли. Для синтезу пептиду використовували протокол ABI FastMoc 1.0®. Кожний цикл складався з видалення N-кінцевої Fmoc-групи за допомогою 20 %-го піперидину з подальшим багаторазовим промиванням NMP. Готові картриджі для кожної амінокислоти (1 ммоль) потім розчиняли в 0,45 M HOBT/HBTU. Після часу, достатнього для розчинення амінокислоти, її автоматично переносили в активаційну посудину. Ще два амінокислотних картриджі (1 ммоль) розчиняли і переносили в посудину для активації до загальної кількості 3 еквіваленти амінокислоти, що використовуються на стадію приєднання. Потім в реакційну посудину додавали DIPEA (3 мл 2 M розчину) до загальної кількості 6 екв. DIPEA. Всю цю суміш потім додавали до смоли і залишали для перемішування на 15 хвилин. Потім звільняли реакційну посудину, промивали NMP, і потім проводили другу стадію приєднання. Після другої стадії приєднання смолу знов ретельно промивали. Кожну амінокислоту приєднували два рази аналогічним чином. Після стадії приєднання першого залишку Tyr для кожної з наступних 4 стадій приєднання і кожної стадії приєднання Arg смолу блокують 5 мл блокувального розчину (0,5 М оцтового ангідриду/0,13 М DIPEA/0,01 M HOBT) для блокування будь-яких неацильованих ділянок смоли. Для стадій приєднання використовували наступні амінокислотні картриджі: Цикл 1) Fmoc-Tyr(tBu)-OH; Цикл 2) Fmoc-Arg(Pbf)-OH; Цикл 3) Fmoc4Hyp-OH; Цикл 4) Fmoc-Arg(Pbf)-OH; Цикл 5) Fmoc-Thr(tBu)-OH; Цикл 6) Fmoc-Ile-OH; Цикл 7) Fmoc-Leu-OH; Цикл 8) Fmoc-Asn(Trt)-OH; Цикл 9) Fmoc-Ile-OH; Цикл 10) Fmoc-Tyr(tBu)-OH; Цикл 11) Fmoc-His(Trt)-OH; Цикл 12) Fmoc-Arg(Pbf)-OH; Цикл 13) Fmoc-Leu-OH; Цикл 14) Fmoc-AlaOH; Цикл 15) Fmoc-Ser(tBu)-OH; Цикл 16) Fmoc-Tyr(tBu)-OH; Цикл 17) Fmoc-Tyr(tBu)-OH; Цикл 18) Fmoc-Arg(Pbf)-OH і Цикл 19) Fmoc-Ala-OH. Після останньої стадії приєднання смолу промивали NMP, потім ішло стандартне видалення N-кінцевої Fmoc-групи, промивання NMP з подальшим промиванням DCM. Після збирання Скінцевої частини пептидного ланцюга (залишки 18-36) одну десяту смоли (0,1 ммоль) використовували для конструювання N-кінцевої частини пептиду, при цьому залишок зберігали. N-кінцеву частину вказаного в заголовку пептиду (залишки 1-17) синтезували, використовуючи Fmoc-хімію за допомогою мікрохвильового випромінювання, на пептидному синтезаторі Liberty (CEM, Matthews, NC, USA) в масштабі синтезу 0,1 ммоль. Смолу з попереднього синтезу поміщали в конічну пробірку об'ємом 50 мл разом з 15 мл DMF і завантажували в позицію для смоли на синтезаторі. Смола потім кількісно переносилася в реакційну посудину автоматично. Використовували стандартний протокол синтезу Liberty для масштабу 0,1 ммоль. Цей протокол включає в себе зняття N-кінцевої Fmoc-групи першою обробкою 7 мл 20 %-го піперидину, що містить 0,1 M HOBT, в DMF. Перше зняття захисту проводили протягом 30 секунд за допомогою мікрохвиль (45 ват, максимальна температура 75 °C) і продування азотом (3 секунди продування/7 секунд перерва). Потім реакційну посудину осушували і проводили другу обробку піперидином, аналогічну першій обробці, за винятком того, що вона тривала 3 хвилини. Потім смолу осушували і ретельно промивали декілька разів DMF. Потім додавали захищену амінокислоту, Fmoc-Met-OH у вигляді 0,2 М концентрованого розчину в DMF (2,5 мл, 5 еквівалентів), з подальшим додаванням 1,0 мл 0,45 М (4,5 екв.) HBTU в DMF. Після цього додавали 0,5 мл 2 M (10 екв.) DIPEA в NMP. Стадію приєднання проводили протягом 5 хвилин з використанням мікрохвильового випромінювання потужністю 20 ват при максимальній температурі 75 °C, і таким же співвідношенням часу продування азотом і часу перерви. Після першої стадії приєднання вміст реакційної посудини видаляли у відходи і повторювали стадію приєднання. Потім починали цикл 2 аналогічно циклу 1. Всі амінокислоти вводили аналогічним чином і використовували стратегію двократного приєднання для всієї послідовності. При приєднанні залишків 9-10 (Gly-Aib) використовували процедуру блокування негайно після стадії приєднання. Блокування виконували, додаючи 7 мл 0,5 М оцтового ангідриду, що містить 0,015 M HOBT в NMP, спільно з 2 мл 2 M розчину DIPEA, використовуючи багатостадійний протокол обробки мікрохвильовим випромінюванням: при потужності 50 ват протягом 30 секунд (максимальна температура - 65 °C) з подальшою перервою протягом 30 секунд і наступним раундом 30 секундної обробки мікрохвильовим випромінюванням (50 ват), і подальшою 30 секундною перервою. Смолу осушували і ретельно промивали DMF. Використовували наступні 14 UA 102432 C2 5 10 15 20 25 30 35 40 45 амінокислоти (Advanced Chemtech, Louisville, KY, USA): Цикл 20) Fmoc-Met-OH; Цикл 21) FmocAsp(OtBu)-OH; Цикл 22) Fmoc-Glu(OtBu)-OH; Цикл 23) Fmoc-Ala-OH; Цикл 24) Fmoc-Pro-OH; Цикл 25) Fmoc-Ala-OH; Цикл 26) Fmoc-Asp(OtBu)-OH; Цикл 27) Fmoc-Aib-OH; Цикл 28) Fmoc-GlyOH; Цикл 29) Fmoc-Pro-OH; Цикл 30) Fmoc-Asn(Trt)-OH; Цикл 31) Fmoc-Asp(OtBu)-OH; Цикл 32) Fmoc-Pro-OH; Цикл 33) Fmoc-Lys(Boc)-OH; Цикл 34) Fmoc-Ser(tBu)-OH; Цикл 35) Fmoc-Pro-OH; Цикл 36) Fmoc-Tyr(tBu)-OH. Після завершення синтезу пептидного ланцюга для видалення N-кінцевої Fmoc-групи використовували стандартну обробку піперидином за допомогою стандартної процедури зняття захисту, описаної вище. Смолу ретельно промивали DMF і потім поміщали зворотно в 50 мл конічну пробірку, використовуючи DMF як розчинник для перенесення. З пептиду видаляли захист і відщеплювали від смоли за допомогою обробки 5 мл наступного реагенту: 5 % TIS, 2 % води, 5 % (вага/об'єм) DTT і 88 % TFA, і перемішування протягом 3,5 годин. Фільтрат збирали в 45 мл холодного безводного етилового ефіру. Осад осаджували протягом 10 хвилин при 3500 об./хв. в охолоджуваній центрифузі. Ефір декантували, і пептид розчиняли в свіжому ефірі. Обробку етиловим ефіром проводили всього 2 рази. Після останнього промивання ефіром пептид залишали сушитися на повітрі для видалення залишків ефіру. Осад пептиду ресуспендували в 8 мл ацетонітрилу з подальшим додаванням 8 мл деіонізованої води, і залишали до повного розчинення. Розчин пептиду потім аналізували за допомогою мас-спектрометрії. Мас-спектрометричний аналіз з використанням іонізації розпиленням в електричному полі ідентифікував основний продукт з масою 4212,1, що відповідає цільовому продукту. Аналіз за допомогою аналітичної ВЕРХ на колонці С18 250×4,6 мм (Phenomenex, Torrance, CA, USA) в градієнті ацетонітрилу 260 % (0,1 % TFA) за 30 хвилин, ідентифікував основний продукт з чистотою 45 %. Неочищений пептид потім очищали за допомогою препаративної ВЕРХ на оберненофазовій колонці С18 в градієнті ацетонітрилу 10-60 % (0,1 % TFA) за 50 хвилин при швидкості потоку 10 мл/хв. Очищений продукт аналізували за допомогою ВЕРХ на чистоту (>99 %) і за допомогою масспектрометрії для визначення маси (4212,8 Да), причому експериментально визначена маса добре відповідала очікуваній масі 4212,7. Після чого пептид ліофілізували, одержуючи 39 мг очищеного продукту з виходом 9 %. 1 17 34 Приклад 91: [камптотецин-rvGly-Suc-Tyr ,Nle ,Pro ]hNPY(1-36)-NH2 (SEQ ID NO:88) 4482. CPT-rvGly-Boc Камптотецин (CPT) (6,0 г, 17,2 ммоль), Boc-Gly-OH (10,0 г, 57,0 ммоль), DMAP (6,4 г, 52,2 ммоль), Sc(Otf)3 (5,0 г, 10,2 ммоль) і DIEA (6,0 мл, 34,4 ммоль) додавали в 500-мл круглодонну колбу, що містить DCM/DMF (300/30 мл). Після перемішування протягом 10 хвилин додавали EDC (13,0 г, 68,0 ммоль) однією порцією. Реакційну суміш перемішували при кімнатній температурі протягом 16 годин. Вона поступово мінялася від суспензії до прозорого розчину. DCM видаляли на роторному випарнику і розчин, що залишився, в DMF переносили в MeOH (200 мл) і поміщали в холодильник. Жовті кристали (що утворюються за 2-16 годин) відфільтровували і промивали гексаном. Тверду речовину одержували після висушування на повітрі (5,9 г). 2. CPT-rvGly-NH2 До розчину CPT-rvGly-Boc (3,3 г, 6,5 ммоль) в DCM (70 мл) додавали TFA (70 мл). Реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Потім додавали ефір (450 мл) і одержували тверду речовину жовтого кольору після фільтрації, за якою ішло промивання ефіром (3,1 г). 3. CPT-rvGly-Suc-OH 15 UA 102432 C2 Бурштиновий ангідрид 5 10 15 20 25 30 Одержану вище сполуку CPT-rvGly-NH2 (6,5 ммоль) розчиняли в DMF (90 мл). Додавали бурштиновий ангідрид (1,2 г, 11,9 ммоль) і TEA (3,2 мл, 22,7 ммоль). Суміш перемішували при кімнатній температурі протягом 4 годин. Потім суміш виливали в склянку з льодяною водою (1200 мл) і обробляли концентрованою HCl до pH~3. Жовту тверду речовину відфільтровували і промивали водою. Тверду речовину одержували після висушування під глибоким вакуумом (3,77 г). 1 17 34 4. Захищений пептид [Tyr ,Nle ,Pro ]hNPY(1-36)-Rink-амідна MBHA-смола (SEQ ID NO:88) Одержували на пептидному синтезаторі ABI 433a в масштабі 0,25 ммоль з використанням Rink-амідної MBHA-смоли (навантаження 0,69 ммоль/г, 0,365 г) і Fmoc-хімії з двома пролонгованими стадіями приєднання, а також з кінцевим зняттям захисту для видалення 1 Fmoc-групи з Tyr . Після завершення синтезу захищений пептид на смолі висушували на повітрі, в результаті чого одержували тверду речовину (0,455 г). 1 17 34 5. [камптотецин-rvGly-Suc-Tyr ,Nle ,Pro ]hNPY(1-36)NH2 (SEO ID NO:88) До суміші захищеного пептиду на смолі (0,2 г, 0,11 ммоль) і DMF (5 мл) додавали CPT-rvGlySuc-OH (190 мг, 0,38 ммоль), HOBt (85 мг, 0,63 ммоль), DIC (0,098 мл, 0,63 ммоль) і DIEA (1,2 мл, 6,9 ммоль). Після струшування протягом 16 годин суміш осушували і промивали 3 рази DMF і потім 3 рази DCM. Смолу потім обробляли сумішшю TFA:TIS:вода (9,5:0,8:0,85 мл) протягом 3 годин. Після фільтрації для видалення смоли до фільтрату додавали ефір (80 мл). Осад жовтого кольору збирали центрифугуванням. Неочищений продукт повторно розчиняли в суміші 10 мл води з 5 мл ацетонітрилу і очищали за допомогою препаративної ВЕРХ (на колонці С18). Фракції, що містять цільовий продукт (підтверджений за допомогою мас-спектрометрії і ВЕРХ), об'єднували і ліофілізували. Була одержана жовта тверда речовина (28,4 мг). Масспектрометричний аналіз з іонізацією в електричному полі показав молекулярну вагу, що дорівнює 4709,9 (що узгоджується з розрахунковою молекулярною вагою 4709,9). Чистота за результатами ВЕРХ-аналізу становила 97,5 %. 1 17 34 Приклад 92/92A: [камптотецин-rvD/Lasp-Suc-Tyr ,Nle ,4Hyp ]hNPY(1-36)NH2 (SEO ID NO:89) 4482. CPT-rvD/Lasp(OtBu)-Boc 16 UA 102432 C2 5 10 15 CPT (1,5 г, 4,3 моль), Boc-Asp(OtBu)-OH (4,1 г, 14,2 ммоль), DMAP (1,6 г, 13,1 ммоль), Sc(Otf)3 (1,25 г, 2,5 ммоль) і DIEA (1,5 мл, 8,6 ммоль) додавали в 250-мл круглодонну колбу, що містить DCM/DMF (75/20 мл). Після перемішування протягом 10 хвилин додавали EDC (3,25 г, 17,0 ммоль) однією порцією. Реакційну суміш перемішували при кімнатній температурі протягом 2-16 годин. Вона поступово мінялася від суспензії до прозорого розчину. DCM видаляли на роторному випарнику і розчин DMF, що залишився, обробляли льодяною водою. Після фільтрації і висушування під глибоким вакуумом одержували жовту тверду речовину (3,4 г). ВЕРХ-аналіз виявив два піки, що вказують на присутність двох D- і L-ізомерів у співвідношенні 4:1. 2. CPT-rvD/Lasp(OtBu)-NH2 До суспензії неочищеного CPT-rvD/Lasp(OtBu)-Boc (1,1 г, 1,7 ммоль) в t-BuOH (50 мл) додавали 50 мл 4 М розчину HCl в діоксані. Реакційну суміш перемішували при кімнатній температурі протягом 25 хвилин. Потім додавали ефір (900 мл) і одержували дрібнодисперсний осад жовтого кольору. 3. CPT-rvD/Lasp(OtBu)-Suc-OH Бурштиновий ангідрид 20 25 30 35 Одержаний вище CPT-rvD/Lasp(OtBu)-NH2 (1,7 ммоль) розчиняли в 20 мл DMF. Додавали бурштиновий ангідрид (0,28 г, 2,8 ммоль) і TEA (0,8 мл, 5,7 ммоль). Суміш перемішували при кімнатній температурі протягом 16 годин. Потім суміш виливали в склянку з льодяною водою (200 мл) і обробляли концентрованою HCl до pH~3. Одержували дрібнодисперсну тверду речовину жовтого кольору (0,72 г). ВЕРХ-аналіз виявив два піки у співвідношенні 4:1. 1 17 34 4. Захищений пептид [Tyr ,Nle ,4Hyp ]hNPY(1-36)-Rink-амідна MBHA-смола (SEQ ID NO:89) Вказаний пептид одержували за допомогою процедури, аналогічної процедурі з прикладу 81. 1 17 34 5. [камптотецин-rvD/Lasp-Suc-Tyr ,Nle ,4Hyp ]hNPY(1-36)NH2 (SEO ID NO:89) 1 17 34 До суміші захищеного пептиду [Tyr ,Nle ,4Hyp ]hNPY(1-36)-Rink-амідна MBHA-смола (0,125 ммоль) і DMF (5 мл) додавали CPT-rvD/Lasp(OtBu)-Suc-OH (230 мг, 0,37 ммоль), HOBt (84 мг, 0,63 ммоль), DIC (0,097 мл, 0,63 ммоль) і DIEA (1,3 мл, 7,5 ммоль). Додержувалися процедури, аналогічної процедурі з прикладу 81. Кількість очищеної одержаної речовини становила 31,0 мг. Обчислена за допомогою мас-спектрометричного аналізу з іонізацією в електричному полі молекулярна вага становила 4783,8 (що узгодиться з розрахунковою молекулярною вагою 4784,2). Чистота за результатами аналітичної ВЕРХ становила 100 %. 1 17 31 34 Приклад 93: [камптотецин-rvD/L-Asp-Suc-Tyr ,Nle ,A6c ,4Hyp ]hNPY(1-36)-NH2 (SEQ ID NO:90) 17 UA 102432 C2 1 5 17 31 34 [CPT-rvD/Lasp-Suc-Tyr ,Nle ,A6c ,4Hyp ]hNPY(1-36)-NH2 одержували аналогічно прикладу 1 17 31 34 82 з CPT-rvD/Lasp(OtBu)-Suc-OH і відповідного пептиду [Tyr ,Nle ,A6c ,4Hyp ]hNPY(1-36)-Rinkамідна MBHA-смола. Кількість очищеної одержаної речовини становила 23,0 мг. Масспектрометричний аналіз з іонізацією в електричному полі показав, що молекулярна вага становила 4796,0 (що узгоджується з розрахунковою молекулярною вагою 4796,2). Чистота за результатами аналітичної ВЕРХ становила 100 %. Інші сполуки за винаходом середній фахівець в даній галузі може одержати, використовуючи процедури синтезу, аналогічні описаним в наведених вище прикладах. Фізичні параметри сполук з прикладів 1-77 і 91-107 наведені в таблиці 1. 10 18 UA 102432 C2 19 UA 102432 C2 20 UA 102432 C2 5 10 15 20 25 In vitro радіолігандний аналіз зв'язування NPY-Y1 і NPY-Y2 рецептора Клітинні лінії нейробластоми людини, SK-N-MC і SK-N-BE2 (Американська колекція типових культур, Rockville, MD, USA), експресуючі рецептори NPY-Y1 і NPY-Y2, відповідно, культивували в середовищі EMEM, що містить 10 % фетальної бичачої сироватки і 5 % екстракту курячих ембріонів, при 37 °C у вологій атмосфері в 95 % повітря і 5 % СО2. Для радіолігандного аналізу зв'язування in vitro NPY-Y1 і NPY-Y2 відповідні клітини (SK-NMC для NPY-Y1; SK-N-BE2 для NPY-Y2) збирали і гомогенізували в 20 мл льодяного 50 мМ TrisHCl за допомогою Brinkman Polytron (Westbury, NY, USA) (на параметрі 6, 15 сек.). Гомогенати промивали двічі за допомогою центрифугування (39000g протягом 10 хв.), і кінцеві осади ресуспендували в 50 мМ Tris-HCl, що містить 2,5 мМ MgCl2, 0,1 мг/мл бацитрацину (Sigma Chemical, St. Louis, MO, USA) і 0,1 % BSA. 125 Для аналізу аліквоти (0,4 мл) приготованих суспензій інкубували з 0,05 нМ [ I]PYY (2200 Кю/ммоль, Perkin-Elmer, Boston, MA) в присутності або за відсутності 0,05 мл неміченого конкурентного тестованого пептиду або тестованої направленої цитотоксичної сполуки. Після 125 100-хвилинної інкубації (при 25 °C) [ I]PYY, що зв'язався, відділяли від вільного швидкою фільтрацією через GF/С-фільтри (Brandel, Gaithersburg, MD, USA), які попередньо були вимочені в 0,3 %-му розчині поліетиленіміну. Фільтри потім промивали три рази 5-мл аліквотами льодяного 50 мМ Tris-HCl і зв'язану радіоактивність, затриману на фільтрах, вимірювали за допомогою гамма-спектрометрії (Wallac LKB, Gaithersburg,MD, USA). Питоме зв'язування 125 визначали як загальну кількість [ I]PYY, що зв'язався, мінус кількість PYY, що зв'язалася, в присутності 1000 нМ (Bachem, Torrence, CA, USA). Константи інгібування (Ki) обчислювали за допомогою відомого рівняння Ченга-Прусова, і ці дані спільно з селективністю вказаних сполук відносно NPY-Y1 і NPY-Y2 наведені в таблиці 2. Кожну із сполук з прикладів 1-38, 40-61, 64-77 і 91-103 тестували в наведених вище радіолігандних аналізах, і було знайдено, що практично всі з вказаних сполук мали Ki нижче 100 нМ, а також деякі із сполук з прикладів мали Ki в субнаномолярному діапазоні. Також було знайдено, що практично всі з вказаних сполук високовибірно зв'язували NPY-Y1 в порівнянні з NPY-Y2. 30 21 UA 102432 C2 22 UA 102432 C2 23 UA 102432 C2 5 Аналіз росту пухлини in vivo Сполуки з прикладів 91, 92 і 93 оцінювали в двох дослідженнях, "Дослідження А" і "Дослідження В", в кожному з яких використовували одну групу (n=10) тварин, що не одержували вплив, одну групу тварин, що одержували носій, і одну групу тварин, що одержували некон'югований камптотецин в кількості 7,5 мг/кг. Введення проводили один раз на тиждень протягом трьох тижнів за допомогою ін'єкцій в хвостову вену, за винятком випадків, коли погана розчинність лікарської сполуки або некроз хвоста вимагали внутрішньоочеревинних 24 UA 102432 C2 5 10 15 20 25 30 35 40 ін'єкцій. У дослідженні А оцінювали групи мишей, що одержували сполуку з прикладу 91 в кількості 55,65 мг/кг, 111,3 мг/кг і 222,6 мг/кг, і з прикладу 92 в кількості 55,3 мг/кг, 110,6 мг/кг і 221,2 мг/кг. Сполуку з прикладу 93 оцінювали в дослідженні В в кількості 55,45 мг/кг, 110,9 мг/кг і 221,8 мг/кг. Протипухлинну активність оцінювали по затримці росту пухлини (TGD), що визначається як різниця медіанного часу для досягнення кінцевого розміру пухлини в групі, що одержувала досліджуваний вплив, відносно контрольної групи, і по інгібуванню росту пухлини (TGI), що визначається як різниця між медіанними об'ємами пухлин в групах, що одержували досліджуваний вплив, і контрольною групою в такий день дослідження, який забезпечує баланс між відповідями, що піддаються вимірюванню, в групі і великими розмірами груп. Токсичність оцінювали по вазі тіла і клінічних спостереженнях. У день 1 (визначення "Дня 1" надане нижче) вік самиць безтимусних мишей (nu/nu, Harlan) становив 10-11 тижнів, а їх вага знаходилася в діапазоні від 20,2 до 31,1 г і від 21,2 до 29,8 г. Тварини одержували ad libitum воду (очищену за допомогою зворотного осмосу, що містить 1 ppm Cl) і стерилізоване за допомогою радіації харчування "NIH 31 Modified and Irradiated Lab Diet®", що складається з 18,0 % сирого білка, 5,0 % сирого жиру і 5,0 % сирої клітковини. Мишей утримували на стерилізованій за допомогою радіації підстилці для лабораторних тваринних "ALPHA-dri®bed-o'cobs®" в нерухомих мікроізоляторах на 12-годинному світловому циклі при 21-22 °C (70-72 °F) і 40-60 % -й вологості. Клітини карциноми молочних залоз людини MCF-7 ростили в середовищі RPMI 1640, що містить 100 од/мл натрієвої солі пеніциліну G, 100 мкг/мл стрептоміцину сульфату і 25 мкг/мл гентаміцину. У середовище додавали 10 % інактивованої нагріванням фетальної бичачої сироватки і 2 мМ глутаміну. Додаткову буферну місткість забезпечували за допомогою 10 мМ HEPES і 0,075 %-го бікарбонату натрію. Пухлинні клітини культивували у флаконах для культури тканин в зволожуваному інкубаторі при 37 °C в атмосфері, що складається з 95 % повітря і 5 % СО2. За три-сім днів до ін'єкції клітин кожній миші між лопатками імплантували капсулу, що містить 17-β-естрадіол (0,36 мг, вивільнення протягом 60 днів, Innovative Research of America). Використовувані для імплантації пухлинні клітини MCF-7 збирали протягом логарифмічної 7 фази росту і ресуспендували в фосфатно-сольовому буфері в кількості 5×10 клітин/мл. Кожній 7 миші вводили підшкірно за допомогою ін'єкцій в правий бік 1×10 клітин. За розвитком пухлин 3 спостерігали двічі на тиждень і потім щодня після досягнення пухлиною об'єму 80-120 мм . На 18-й день, який в дослідженні А позначали як "День 1", тварин сортували по дев'яти групах (число тварин в групі, n=10) з індивідуальними розмірами пухлин, що варіюють в діапазоні від 3 3 63 до 172 мм , і середнім об'ємом пухлини в групі, що складає 123,7-124,6 мм . Внаслідок поганої приживлюваності пухлин число тварин було недостатнім для додаткових трьох груп, включених у вихідний протокол. Тому було проведене окреме дослідження (Дослідження В), яке включало шість груп (n=10) тварин. У цьому дослідженні між імплантацією клітин і розділенням 3 по групах пройшло 17 днів. Індивідуальні розміри пухлин на день 1 варіювали від 63 до 221 мм , 3 3 а середній об'єм пухлини для груп варіював від 112,7 до 113,6 мм . Розмір пухлини в мм обчислювали за формулою: Об' єм пухлини 45 50 55 w2 l 2 , в якій w=ширина, а l=довжина в мм пухлині MCF-7. Вагу пухлини оцінювали, виходячи з 3 припущення, що 1 мг дорівнює 1 мм об'єму пухлини. Дозування сполук з прикладів 91 і 92 готували в 5 %-му розчині декстрози у воді (D5W) в день 1. Внаслідок поганої розчинності дозування цих агентів в дні 8 і 15 готували в 0,1 N оцтовій кислоті. Дозування для сполуки з прикладу 93 готували свіжими в 0,1 N оцтовій кислоті для кожного дня, коли миші одержували вплив. Для збільшення розчинності найбільш концентрований розчин речовини з прикладу 83 (221,8 мг/кг) приготовляли в половинній концентрації, обробляли ультразвуком у водяній бані при 60 °C і вводили подвоєним об'ємом (0,4 мл на 20 г миші) відносно вказаного в протоколі. Концентровані розчини камптотецину (партія № 034K3648, Sigma) приготовляли в 60 %-му DMA і 40 %-му Tween 80 і зберігали при кімнатній температурі протягом дослідження. Дозування приготовляли свіжими для кожного дня введення шляхом розведення концентрованих розчинів 1:20 в фізіологічному розчині. Загальна схема впливу наведена в таблиці 3А для дослідження А і таблиці 3В для дослідження В. 25 UA 102432 C2 Таблиця 3А Група 1 2 3 4 5 6 7 8 9 10 10 10 10 10 10 10 10 10 Схема впливу мг/кг Шлях введення iv 55,65 iv 111,3 iv 222,6 iv 7,5 iv 55,3 iv 110,6 iv 221,2 iv Агент n Немає впливу Носій* Приклад 91 Приклад 91 Приклад 91 Камптотецин Приклад 92 Приклад 92 Приклад 92 Схема введення qwk×3 qwk×3 qwk×3 qwk×3 qwk×3 qwk×3 qwk×3 qwk×3 *Носій=0,1 N оцтова кислота. Таблиця 3В Схема впливу Група n 1 2 3 4 5 6 10 10 10 10 10 10 Агент мг/кг Немає впливу Носій** Камптотецин Приклад 93 Приклад 93 Приклад 93 7,5 55,45 110,9 221,8 Шлях введення ip або iv iv iv iv iv Схема введення qwk×3 qwk×3 qwk×3 qwk×3 qwk×3 **Миші з групи 2 одержували носій 3 % DMA, 2 % Tween 80, D5W, ip, в день 1 і носій 0,1 N оцтову кислоту в дні 8 і 15. 5 10 15 20 25 30 Всі впливи і носії вводили в кількості трьох доз по одній раз на тиждень (qwk×3). Миші з 1-ої групи не одержували харчування через зонд і не одержували ін'єкцій, і вони служили як контроль розвитку пухлини і токсичності естрогену. Тварини з 2-ої групи одержували носій. У дослідженні А (Таблиця 3А) миші в групах 3, 4 і 5 одержували сполуку з прикладу 91 в кількості 55,65 мг/кг, 111,3 мг/кг і 222,6 мг/кг, відповідно, за допомогою внутрішньоочеревинних ін'єкцій (ip) в 1-й день і за допомогою ін'єкцій в хвостову вену (iv) на 8-й і 15-й дні. Камптотецин в кількості 7,5 мг/кг вводили мишам в групі 6, ip в день 1 і iv в дні 8 і 15. Мишам в групах 7, 8 і 9 вводили сполуку з прикладу 92 в кількості 55,3 мг/кг, 110,6 мг/кг і 221,2 мг/кг, відповідно, ip в день 1 і iv в дні 8 і 15. У дослідженні В (Таблиця 3В) тварини в групі 3 одержували камптотецин, 7,5 мг/кг, iv в дні 1 і 8, і ip в день 15. Мишам з груп 4, 5 і 6 вводили сполуку з прикладу 93 в кількості 55,45 мг/кг, 110,9 мг/кг і 221,8 мг/кг, iv в дні 1 і 8, і ip в день 15. Кожну дозу вводили в об'ємі 0,2 мл на 20 г ваги тіла, і масштабували залежно від ваги тіла тварини. Криві медіани росту пухлини на фіг. 1-3 показують медіану об'єму пухлини як функцію від часу. Якщо тварина виводилася з експерименту внаслідок розміру пухлини, то кінцевий об'єм пухлини, зареєстрований для тварини, включали разом з даними, використовуваними для обчислення медіанного об'єму пухлини для групи в подальших часових точках. Криві закінчувалися після того, як 50 % тварин в групі виводилося з експерименту. На фіг. 1 показані криві медіани росту пухлин для сполуки з прикладу 91, які показують in vivo ефекти сполуки з прикладу 91 в трьох різних дозуваннях на медіану росту пухлини в дослідженні А в порівнянні з відсутністю лікування і лікуванням тільки камптотецином. На фіг. 2 показані криві медіани росту пухлин для сполуки з прикладу 92, які показують in vivo ефекти сполуки з прикладу 92 в трьох різних дозуваннях на медіану росту пухлини в дослідженні А в порівнянні з відсутністю лікування і лікуванням тільки камптотецином. На фіг. 3 показані криві медіани росту пухлин для сполуки з прикладу 93, які показують in vivo ефекти сполуки з прикладу 93 в трьох різних дозуваннях на медіану росту пухлини в порівнянні з відсутністю лікування і лікуванням тільки камптотецином. 26 UA 102432 C2 Вихідні дані з дослідження А наведені в таблиці 4А, в якій стовпці D1-D39 стосуються днів 139, описаних вище, і в якій рядки G1-G9 стосуються груп 1-9, описаних в таблиці 3А, і в якій 3 середній об'єм пухлини (мм ) реєстрували відповідно до дня і групи, вказаних в таблиці 4А. ТАБЛИЦЯ 4А 5 Вихідні дані для дослідження В наведені в таблиці 4В, в якій стовпці D1-D40 стосуються днів 1-40, описаних вище, в якій G1-G6 стосуються груп 1-6, описаних в таблиці 3В, і в якій середній 3 об'єм пухлини (мм ) реєстрували відповідно до дня і групи, вказаних в таблиці 4В. ТАБЛИЦЯ 4В ТАБЛИЦЯ 4В 10 15 20 25 30 У дослідженні А кон'югат з прикладу 91 давав дозозалежну TGD, яка ставала статистично значущою при найбільш високій дозі, 222,6 мг/кг, і 4/4 регресії пухлин в TGD-оцінюваному зразку. TGI-аналіз на 18-й день виявив дозозалежну протипухлинну активність, що має потенційну терапевтичну значущість при найбільш високому дозуванні. У дослідженні А кон'югат з прикладу 92 давав дозозалежну TGD, яка ставала статистично значущою і давала 3/5 регресії пухлин при найбільш високій дозі, 221,2 мг/кг. TGI на 18-й день також було дозозалежне, статистично значуще при 110,6 і 221,2 мг/кг, і вказувало на потенційну терапевтичну значущість при найбільш високому дозуванні. У дослідженні В оцінювали кон'югат з прикладу 93. Криві росту пухлини вказували на явне уповільнення росту пухлин при всьому дозуванні, хоч TGD-аналіз не відрізняв відповіді на сполуку з прикладу 93 від росту пухлини в контрольній групі, що не одержувала вплив. Аналіз на 15-й день виявив 71 %-не і 77 %-не TGI при дозуванні 110,9 і 221,8 мг/кг, відповідно, що мають потенційне терапевтичне значення. Загалом, три кон'югати, що оцінюються в дослідженнях А і В, демонстрували потенційні терапевтичні ефекти відносно ксенографта MCF-7 безтимусним мишам. Зокрема, при максимальних досліджуваних дозуваннях активність кон'югатів перевищувала активність некон'югованого камптотецину в кількості 7,5 мг/кг. Аналіз pK Профіль pK для підгрупи сполук був визначений з використанням стандартних лабораторних мишей і стандартних лабораторних методик. Фахівцю в даній галузі відомо і зрозуміло, що для здійснення такого визначення також може бути використана множина ссавців, включаючи мишей, щурів і мавп, і модифікації цього методу, такі як зміна дози, підбір часу або режиму аналізу. 27 UA 102432 C2 5 10 Двом мишам на один момент часу внутрішньовенно вводили дозу 4 мг/кг сполук згідно з прикладами 91, 92, 93 або 96. Зразки крові відбирали через 5, 15, 30, 60, 120, 180, 240, 360 хвилин після введення. Зразки плазми (20 мкл) підкисляли 2 мкл 20 % оцтової кислоти і осаджували за допомогою 60 мкл ацетонітрилу. Одержаний розчин піддавали центрифугуванню. Надосадову рідину (20 мкл) розводили в 100 мкл 0,1 % водної оцтової кислоти і 50 мкл вводили для аналізу LC-MS (рідинна хроматографія з мас-спектрометричним детектором) в мас-спектрометричній системі API-4000. Умови рідинної хроматографії були наступними: буфер А являв собою 1 % мурашину кислоту у воді і буфер В являв собою 1 % мурашину кислоту в ацетонітрилі. Градієнт від 15 % В до 90 % В протягом 10 хвилин проходив при швидкості потоку 0,3 мл/хв. з використанням колонки Luna С8(2) 2×30 мм 3u. Час напіввиведення, площа під кривою (AUC) і виведення (СL) представлені в Таблиці 5. Таблиця 5 15 20 25 30 35 40 45 50 Приклад 91 Приклад 92 Приклад 93 Приклад 96 Т1/2, години 0,31 0,20 Дані відсутні 0,32 AUC, мкг-год./мл 1,9 3,4 Дані відсутні 26,3 СL, мл/год. 2132 1166 Дані відсутні 150 Введення Пептиди за даним винаходом можна надати у формі фармацевтично прийнятних солей. Приклади таких солей включають, але не обмежені, солі, утворювані органічними кислотами (наприклад, оцтовою, молочною, малеїновою, лимонною, яблучною, аскорбіновою, бурштиновою, бензойною, метансульфоновою, толуолсульфоновою або памовою кислотами), неорганічними кислотами (наприклад, хлористоводневою кислотою, сірчаною кислотою або фосфорною кислотою) і полімерними кислотами (наприклад, дубильною кислотою, карбоксиметилцелюлозою, полімолочною, полігліколевою кислотами або співполімерами полімолочної-гліколевої кислот). Звичайний спосіб виготовлення солі пептиду за даним винаходом добре відомий в даній галузі і може бути виконаний стандартними способами обміну солей. Відповідно, сіль трифтороцтової кислоти і пептиду за даним винаходом (TFA-сіль утворюється в результаті очищення пептиду з використанням препаративної ВЕРХ з елюцією буферними розчинами, що містять TFA) можна перетворити в іншу сіль, таку як ацетатна сіль, шляхом розчинення пептиду в невеликій кількості 0,25 N водного розчину оцтової кислоти. Одержаний в результаті розчин наносять на напівпрепаративну ВЕРХ-колонку (Zorbax, 300 SB, С-8). Колонку елююють (1) 0,1 N водним розчином ацетату амонію протягом півгодини, (2) 0,25 N водним розчином оцтової кислоти протягом півгодини і (3) лінійним градієнтом (від 20 % до 100 % розчину В за 30 хвилин) при швидкості потоку 4 мл/хв. (розчином А є 0,25 N водний розчин оцтової кислоти; розчином В є 0,25 N розчин оцтової кислоти в суміші ацетонітрил/вода, 80/20). Фракції, що містять пептид, збирають і ліофілізують. Дозування діючого інгредієнта в композиціях за даним винаходом може варіювати, однак, необхідно, щоб кількість діючого інгредієнта була достатньою для одержання відповідної лікарської форми. Конкретне дозування залежить від бажаного терапевтичного ефекту, шляху введення і тривалості лікування. Загалом, ефективне дозування для активності за даним 7 4 винаходом знаходиться в діапазоні від 1×10- до 200 мг/кг/день, переважно від 1×10- до 100 мг/кг/день, яке можна вводити однією дозою або розділеним на декілька доз. Сполуки за даним винаходом можна вводити перорально, парентерально (наприклад, за допомогою внутрішньом'язових, внутрішньоочеревинних, внутрішньовенних або підшкірних ін'єкцій або імплантів), назально, вагінально, ректально, сублінгвально або місцево, і сполуки можна ввести в фармацевтичний склад спільно з фармацевтично прийнятними носіями для одержання лікарських форм, придатних для кожного шляху введення. Тверді лікарські форми для перорального введення включають капсули, таблетки, пілюлі, порошки і гранули. У таких твердих лікарських формах діюча сполука змішана щонайменше з одним інертним фармацевтично прийнятним носієм, таким як сахароза, лактоза або крохмаль. Такі лікарські форми також звичайно містять додаткові речовини крім таких інертних розріджувачів, наприклад мастильні речовини, такі як стеарат магнію. У випадку капсул, таблеток і пілюль лікарські форми можуть також містити буферні агенти. Таблетки і пілюлі можна додатково приготувати з кишковорозчинною оболонкою. Рідкі лікарські форми для перорального введення включають, без обмеження, фармацевтично прийнятні емульсії, розчини, суспензії, сиропи, еліксири і т. п., що містять інертні розріджувачі, звичайно використовувані в даній галузі, такі як вода. Крім таких інертних 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNeuropeptide y-cytotoxic conjugates
Автори англійськоюDong, Zheng, Xin, Zhou, Kevin, L., Deoliveira, Daniel, B.
Назва патенту російськоюЦитотоксичные конъюгаты с соединением, которое связывает рецептор нейропептиду y
Автори російськоюДун Чжен Синь, Чжоу Кевин Л., Деоливейра Дениэл Б.
МПК / Мітки
МПК: A61K 38/16, A61P 35/00
Мітки: цитотоксичні, кон'югати, рецептор, нейропептиду, зв'язує, сполукою, яка
Код посилання
<a href="https://ua.patents.su/128-102432-citotoksichni-konyugati-zi-spolukoyu-yaka-zvyazueh-receptor-nejjropeptidu-y.html" target="_blank" rel="follow" title="База патентів України">Цитотоксичні кон’югати зі сполукою, яка зв’язує рецептор нейропептиду y</a>
Попередній патент: Спосіб запобігання обмерзанню теплообмінної поверхні рекуперативного теплоутилізатора вентиляційних викидів тваринницьких приміщень
Наступний патент: Спосіб виготовлення множини курильних виробів, курильний виріб та машина для виготовлення множини курильних виробів
Випадковий патент: Склад пісочного печива "аронія"