Аналог акулячого хондроїтинсульфату і спосіб його одержання
Номер патенту: 110717
Опубліковано: 10.02.2016
Автори: Валетті Марко, Б'янчі Девід, Базза Паола, Велоті Ерманно, Мірагліа Нікколо
Формула / Реферат
1. Аналог акулячого хондроїтинсульфату, який не містить три-, тетра- і 2,4-дисульфатованих дисахаридів, що складається з 60-99 % 6-сульфату, 0,5-30 % 2,6-дисульфату, 0,1-5 % 4,6-дисульфату, 0,1-5 % несульфатованого хондроїтину і 0,1-1% 4-сульфату, причому усі відсотки виражені відносно загального вмісту аналога акулячого хондроїтинсульфату, причому останній має середньочисельну молекулярну масу (Μn) 40-85 кДа і середньомасову молекулярну масу (Mw) 50-95 кДа.
2. Аналог акулячого хондроїтинсульфату за п. 1, який відрізняється тим, що складається з 70-90 % 6-сульфату, 8,5-20 % 2,6-дисульфату, 0,1-5 % 4,6-дисульфату, 0,1-5 % несульфатованого хондроїтину і 0,1-1 % 4-сульфату, причому усі відсотки виражені відносно загального вмісту аналога акулячого хондроїтинсульфату, причому останній має середньочисельну молекулярну масу (Μn) 40-65 кДа і середньомасову молекулярну масу (Mw) 50-70 кДа.
3. Аналог акулячого хондроїтинсульфату за п. 1, який відрізняється тим, що сума 2,6-дисульфату і 4,6-дисульфату складає 10-25 % загального вмісту дисахаридів.
4. Склад, що містить запропонований аналог акулячого хондроїтинсульфату за п. 1 і фармацевтично або нутрицевтично прийнятний носій.
5. Спосіб приготування аналога акулячого хондроїтину за п. 1, який включає такі стадії:
a) стадію, на якій несульфатований хондроїтин як вільну кислоту, попередньо розчинений у водному середовищі, перетворюють на сіль сіллю, вибраною з групи, що складається з тетраметил-, тетраетил- і тетрабутиламонію або тетраметил-, тетраетил- і тетрабутилпіридинію;
b) стадію, на якій несульфатований хондроїтин, перетворений на сіль в результаті стадії (а), сушать до вмісту води 5-15 %;
c) стадію, на якій несульфатований хондроїтин, перетворений на сіль в результаті стадії (b), сушать при температурі 100-170 °С до вмісту води 0,1-3 %;
d) стадію, на якій положення 6 несульфатованого хондроїтину, перетвореного на сіль в результаті стадії (с), солюбілізованого в N-метилпіролідоні або диметилформаміді, вибірково сульфатують при температурі 0-30 °С, додаючи 1-2 еквіваленти комплексу сірчаний ангідрид - піридин або комплексу сірчаний ангідрид - диметилформамід через проміжки часу 1-3 години, поки не додадуть усього 2-15 еквівалентів комплексу сірчаний ангідрид - піридин або комплексу сірчаний ангідрид - диметилфорамід; залишаючи одержаний розчин при перемішуванні на 2-24 години;
e) стадію, на якій реакцію, що проводять на стадії (d), гасять водним розчином бікарбонату або карбонату натрію, одержаний розчин фільтрують і концентрують до одержання висушеної твердої речовини;
f) стадію, на якій висушену тверду речовину розчиняють у водному розчині хлориду натрію, одержаний розчин піддають ультрафільтрації і діалізу;
g) стадію, на якій з розчину, одержаного на стадії (f), одержують продукт;
h) стадію, на якій продукт, одержаний на стадії (g), очищають і одержують його у вигляді кислоти або його натрієвої солі;
і) стадію, на якій продукт, одержаний на стадії (h), вилучають.
6. Спосіб за п. 5, який відрізняється тим, що перетворення несульфатованого хондроїтину на сіль на стадії (а) здійснюють сіллю, вибраною з групи, що складається з тетраметил-, тетраетил- і тетрабутиламонію.
7. Спосіб за п. 5, який відрізняється тим, що перетворення несульфатованого хондроїтину на сіль на стадії (а) здійснюють тетрабутиламонієм.
8. Спосіб за п. 5, який відрізняється тим, що сушіння несульфатованого хондроїтину на стадії (b) здійснюють сублімаційним сушінням або сушінням розпиленням.
9. Спосіб за п. 5, який відрізняється тим, що сушіння солі несульфатованого хондроїтину на стадії (с) здійснюють до вмісту води 0,5-2 %.
10. Спосіб за п. 5, який відрізняється тим, що солюбілізацію солі несульфатованого хондроїтину в результаті стадії (с) здійснюють у диметилформаміді.
11. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють через додавання у цілому 6-12 еквівалентів комплексу сірчаний ангідрид - піридин.
12. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють через додавання у цілому 6-9 еквівалентів комплексу сірчаний ангідрид - піридин.
13. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють через додавання у цілому 1-9 еквівалентів комплексу сірчаний ангідрид - диметилформамід.
14. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють через додавання у цілому 2-4 еквівалентів комплексу сірчаний ангідрид - диметилформамід.
15. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють при температурі 10-20 °С.
16. Спосіб за п. 5, який відрізняється тим, що наприкінці стадії (d) одержаний розчин залишають при перемішуванні на 2-6 годин.
17. Спосіб за п. 5, який відрізняється тим, що на стадії (g) продукт одержують сублімаційним сушінням, сушінням розпиленням або осадженням у спиртовому середовищі.
18. Склад за будь-яким з пп. 1-4, призначений для використання при профілактиці або лікуванні остеоартриту або для підтримування здорового стану опорно-рухового апарату.
Текст
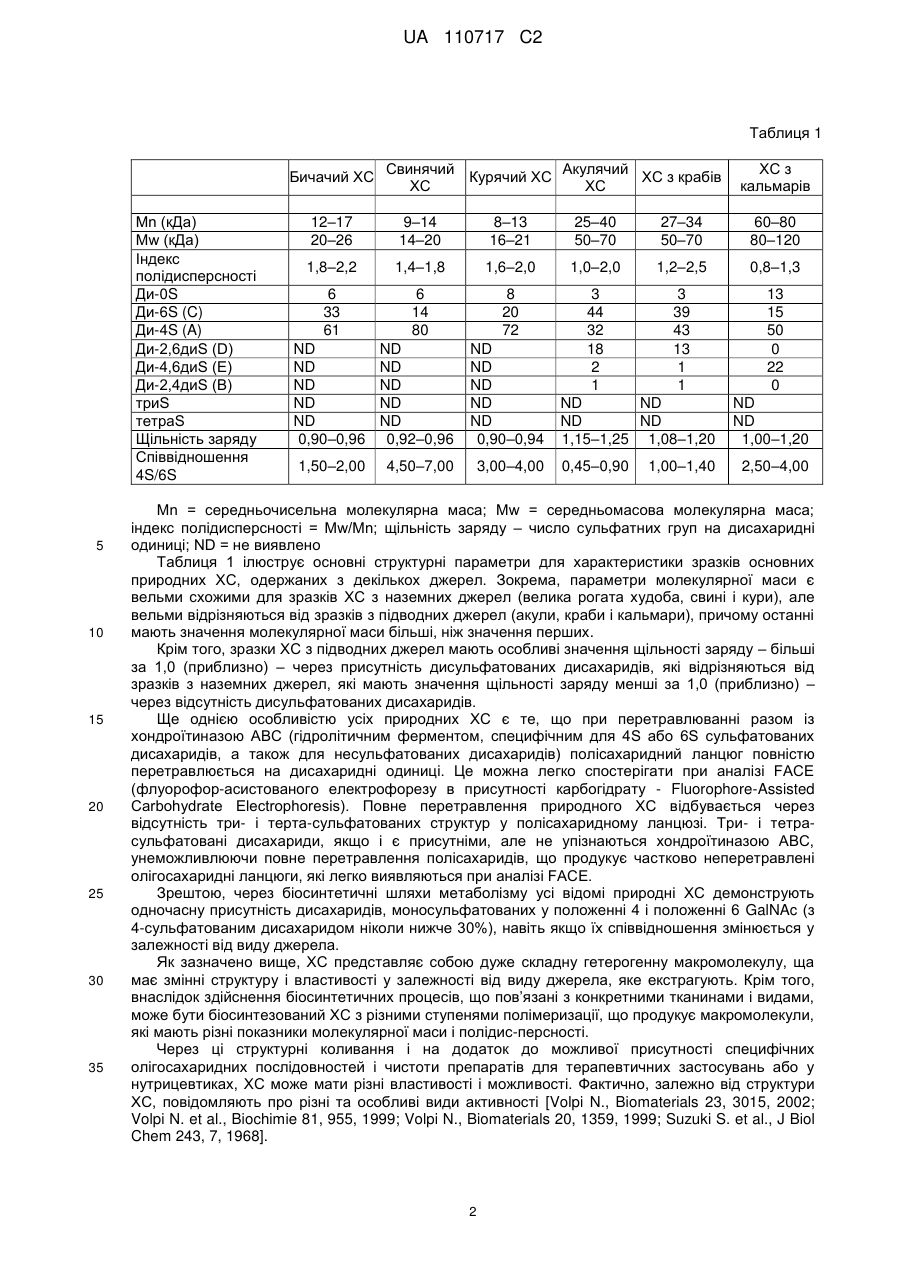
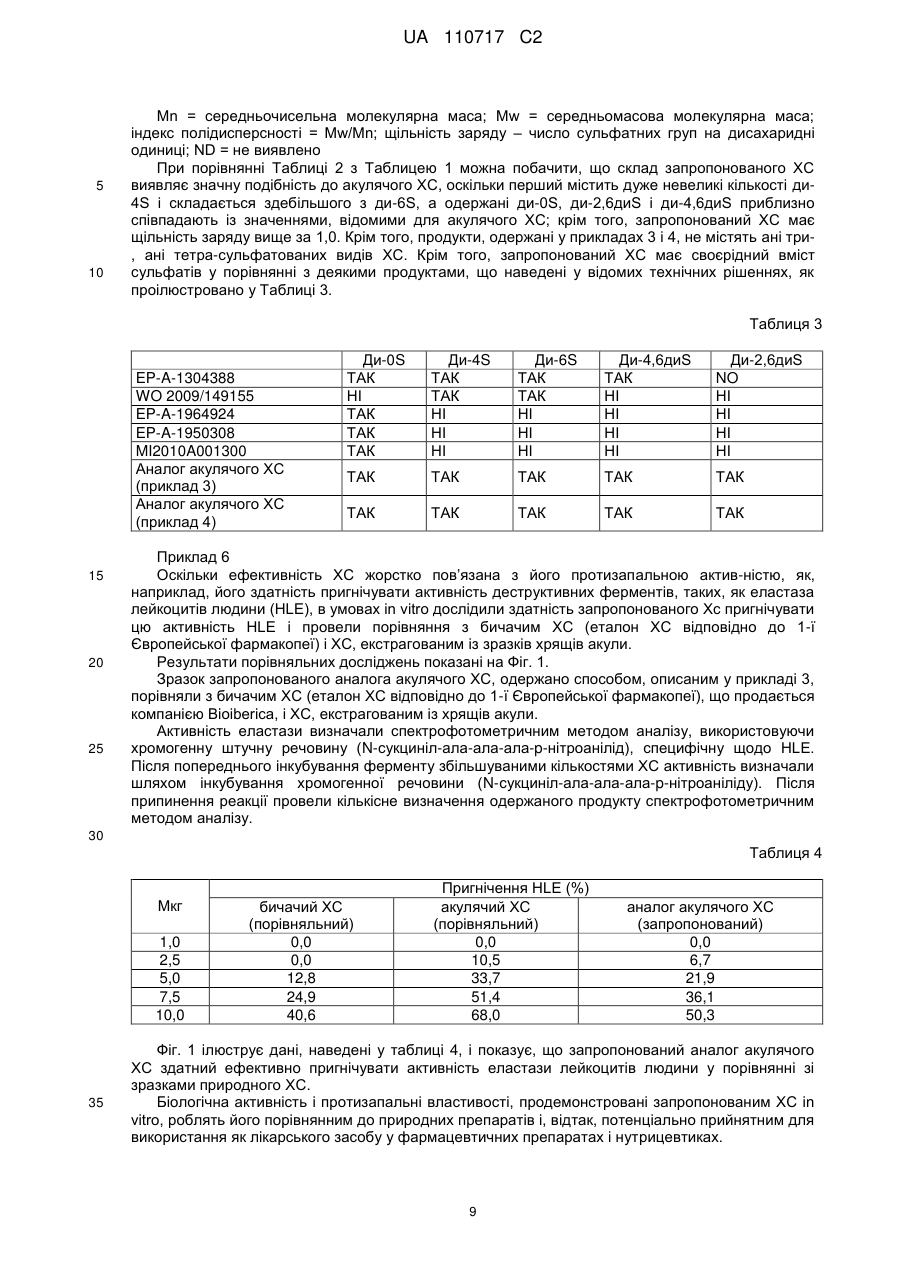
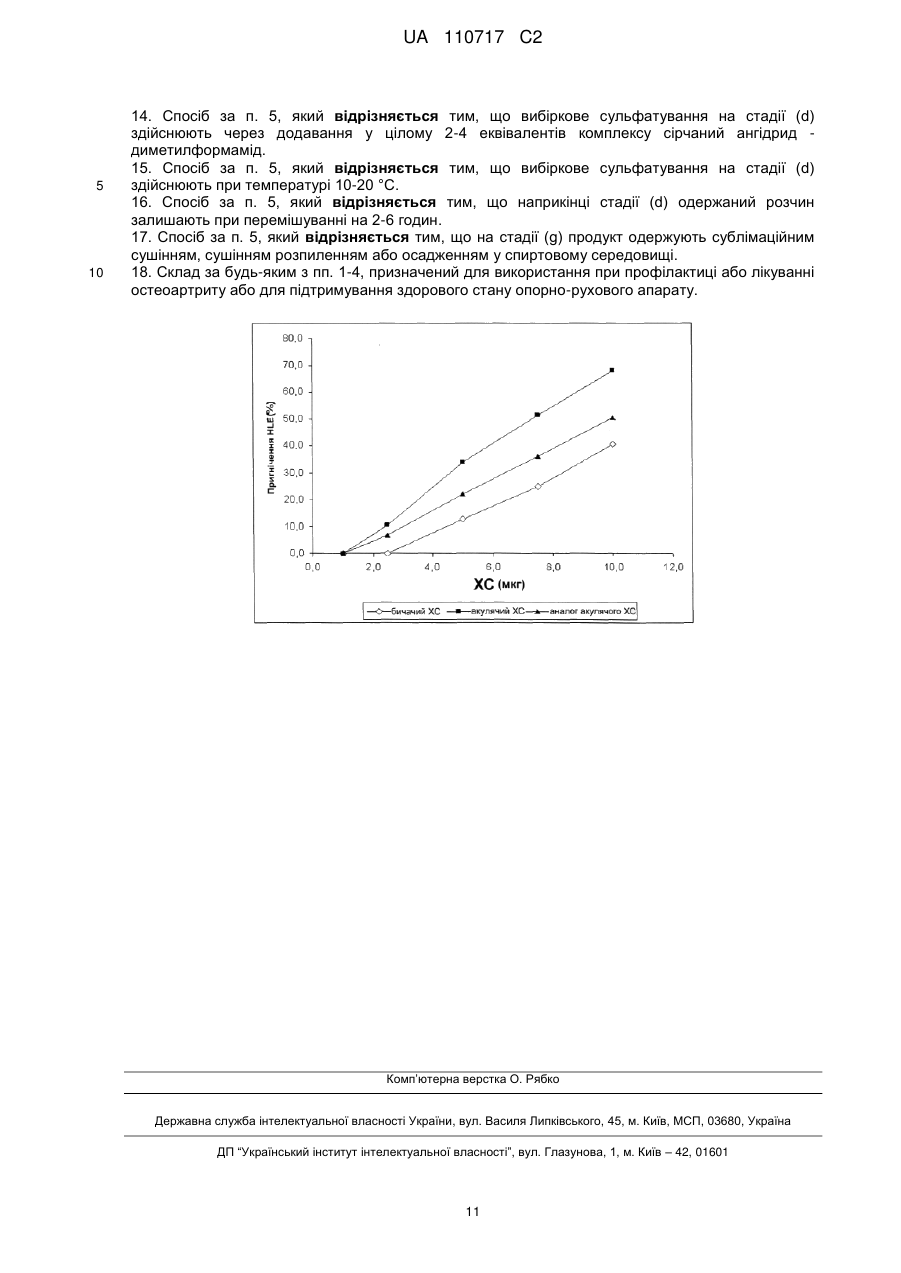
Реферат: Винахід належить до медицини та хіміко-фармацевтичної промисловості, зокрема до створення, виробництва та застосування засобу, що є аналогом хондроїтинсульфату, одержаного з акулячого хряща, який, при дуже малій кількості 4-сульфату, показує високий рівень щільності заряду і біологічної активності, які можна порівняти з природними хондроїтинсульфатами; винахід належить також до способу одержання зазначеного аналога UA 110717 C2 (12) UA 110717 C2 хондроїтинсульфату, одержаного з акулячого хряща. Біологічна активність і протизапальні властивості, продемонстровані запропонованим ХС in vitro, роблять його порівнянним до природних препаратів і, відтак, потенціально прийнятним для використання як лікарського засобу у фармацевтичних препаратах і нутрицевтиках. UA 110717 C2 5 10 15 20 Винахід відноситься до медицини та хіміко-фармацевтичної промисловості, зокрема, до створення, виробництва та застосування засобу, що є аналогом хондроїтинсульфату, одержаного з акулячого хряща, який, при дуже малій кількості 4-сульфату, показує високий рівень щільності заряду і біологічної активності, які можна порівняти з природними хондроїтинсульфатами; винахід відноситься також до способу одержання зазначеного аналогу хондроїтинсульфату, одержаного з акулячого хряща. Хондроїтинсульфат (надалі - ХС), який належить до класу природних складних полісахаридів, що називаються глікозаміногліканами (ГАГ), складається з переміжних дисахаридних послідовностей по-різному сульфатованих залишків D-глюкуронової кислоти (ГлК) і N-ацетил-D-галактозаміну (GalNAc), зв’язаних глікозидним зв'язком β 1 →3. У залежності від характеру дисахаридів, відомі ХС з різними вуглеводними остовами. Фактично, навіть якщо і природні, і синтетичні відомі ХС складаються здебільшого з різних пропорцій двох видів дисахаридних одиниць, тобто, сульфатованих у положенні 4 або 6 GalNAc, дисахариди з різним числом і положенням сульфатних груп можуть знаходитися у різних пропорціях – у полісахаридних ланцюгах. Наприклад, несульфатований дисахарид присутній, зазвичай, у низьких кількостях, в остові ХС, а дисульфатовані дисахариди, що мають дві сульфатні групи, O-зчеплені у різних положеннях, таких, як положення 2 ГлК і положення 6 GalNAc (дисахарид D), або у положенні 4 і 6 N-ацетил-D-галактозаміну (GalNAc) (дисахарид E), і можуть бути присутніми в остові ХС у різних пропорціях відносно до конкретних тваринних джерел [Volpi N., J Pharm Pharmacol 61, 1271, 2009. Volpi N., J Pharm Sci 96, 3168, 2007]. ХС містить дисахаридну одиницю, що повторюється, маючи таку структурну формулу: COOO HO OR4 O OR2 25 30 35 40 45 OR6 O O NHAc де R2, R4 і R6 – незалежно або H, або SO3. Значення деяких з акронімів, що повторюються найчастіше, які вживаються зараз для стислої ідентифікації по-різному сульфатованих залишків переміжних дисахаридних послідовностей, що складають ХС, перелічені нижче: Ди-0S (R2=H; R4=H; R6=H) Ди-6S (C) (R2=H; R4=H; R6= SO3 ) Ди-4S (A) (R2=H; R4= SO3 ; R6=H) Ди-4,6диS (E) (R2=H; R4= SO3 ; R6= SO3 ) Ди-2,6диS (D) (R2= SO3 ; R4=H; R6= SO3 ) Ди-2,4диS (B) (R2= SO3 ; R4= SO3 ; R6=H) Ди-2,4,6триS (R2= SO3 ; R4= SO3 ; R6= SO3 ) Зразки як природного, так і синтетичного ХС можуть характеризуватися і відрізнятися за допомогою чутливих, специфічних, валідованих та опублікованих аналітичних методів, спроможних дати структурну характе-ристику і параметри ХС (наприклад, конкретні сульфатовані групи, щільність заряду, молекулярна маса і чистота), а також види біологічної активності. Природні екстрактивні зразки ХС можуть характеризуватися за структурою та властивостями [Volpi N., J Pharm Pharmacol 61, 1271, 2009; Volpi N., J Pharm Sci 96, 3168, 2007; Mucci A. et al., Carbohydr Polymers 41, 37, 2000; Volpi N., Analyt Biochem 277, 19, 2000]. Щодо три- і тетрасульфатованих видів ХС ("три-S" і "тетра-S" відповідно), слід зазначити, що у природних екстрактивних зразках ХС вони виявляються зрідка, але типово характеризують синтетичний ХС; Ди-2,4,6триS використовують як еталон, щоб оцінити присутність три-S ХС у продуктах синтетичного ХС, оскільки інші теоретично можливі три-S види у природно одержаних продуктах відсутні. Таблиця 1 показує основні дисахариди, ідентифіковані у зразках природного ХС, екстрагованого і очищеного з різних органів і тканин, головним чином, хрящів. 50 1 UA 110717 C2 Таблиця 1 Бичачий ХС Mn (кДа) Mw (кДа) Індекс полідисперсності Ди-0S Ди-6S (C) Ди-4S (A) Ди-2,6диS (D) Ди-4,6диS (E) Ди-2,4диS (B) триS тетраS Щільність заряду Співвідношення 4S/6S 5 10 15 20 25 30 35 Свинячий Акулячий Курячий ХС ХС з крабів ХС ХС ХС з кальмарів 12–17 20–26 9–14 14–20 8–13 16–21 25–40 50–70 27–34 50–70 60–80 80–120 1,8–2,2 1,4–1,8 1,6–2,0 1,0–2,0 1,2–2,5 0,8–1,3 6 33 61 6 14 80 8 20 72 ND ND ND ND ND 0,90–0,96 ND ND ND ND ND 0,92–0,96 ND ND ND ND ND 0,90–0,94 3 44 32 18 2 1 3 39 43 13 1 1 13 15 50 0 22 0 1,50–2,00 4,50–7,00 3,00–4,00 ND ND ND ND 1,15–1,25 1,08–1,20 0,45–0,90 1,00–1,40 ND ND 1,00–1,20 2,50–4,00 Mn = середньочисельна молекулярна маса; Mw = середньомасова молекулярна маса; індекс полідисперсності = Mw/Mn; щільність заряду – число сульфатних груп на дисахаридні одиниці; ND = не виявлено Таблиця 1 ілюструє основні структурні параметри для характеристики зразків основних природних ХС, одержаних з декількох джерел. Зокрема, параметри молекулярної маси є вельми схожими для зразків ХС з наземних джерел (велика рогата худоба, свині і кури), але вельми відрізняються від зразків з підводних джерел (акули, краби і кальмари), причому останні мають значення молекулярної маси більші, ніж значення перших. Крім того, зразки ХС з підводних джерел мають особливі значення щільності заряду – більші за 1,0 (приблизно) – через присутність дисульфатованих дисахаридів, які відрізняються від зразків з наземних джерел, які мають значення щільності заряду менші за 1,0 (приблизно) – через відсутність дисульфатованих дисахаридів. Ще однією особливістю усіх природних ХС є те, що при перетравлюванні разом із хондроїтиназою ABC (гідролітичним ферментом, специфічним для 4S або 6S сульфатованих дисахаридів, а також для несульфатованих дисахаридів) полісахаридний ланцюг повністю перетравлюється на дисахаридні одиниці. Це можна легко спостерігати при аналізі FACE (флуорофор-асистованого електрофорезу в присутності карбогідрату - Fluorophore-Assisted Carbohydrate Electrophoresis). Повне перетравлення природного ХС відбувається через відсутність три- і терта-сульфатованих структур у полісахаридному ланцюзі. Три- і тетрасульфатовані дисахариди, якщо і є присутніми, але не упізнаються хондроїтиназою ABC, унеможливлюючи повне перетравлення полісахаридів, що продукує частково неперетравлені олігосахаридні ланцюги, які легко виявляються при аналізі FACE. Зрештою, через біосинтетичні шляхи метаболізму усі відомі природні ХС демонструють одночасну присутність дисахаридів, моносульфатованих у положенні 4 і положенні 6 GalNAc (з 4-сульфатованим дисахаридом ніколи нижче 30%), навіть якщо їх співвідношення змінюється у залежності від виду джерела. Як зазначено вище, ХС представляє собою дуже складну гетерогенну макромолекулу, ща має змінні структуру і властивості у залежності від виду джерела, яке екстрагують. Крім того, внаслідок здійснення біосинтетичних процесів, що пов’язані з конкретними тканинами і видами, може бути біосинтезований ХС з різними ступенями полімеризації, що продукує макромолекули, які мають різні показники молекулярної маси і полідис-персності. Через ці структурні коливання і на додаток до можливої присутності специфічних олігосахаридних послідовностей і чистоти препаратів для терапевтичних застосувань або у нутрицевтиках, ХС може мати різні властивості і можливості. Фактично, залежно від структури ХС, повідомляють про різні та особливі види активності [Volpi N., Biomaterials 23, 3015, 2002; Volpi N. et al., Biochimie 81, 955, 1999; Volpi N., Biomaterials 20, 1359, 1999; Suzuki S. et al., J Biol Chem 243, 7, 1968]. 2 UA 110717 C2 5 10 15 20 25 30 35 40 45 50 55 60 Природний екстрактивний ХС на даний час рекомендується Європейською лігою проти ревматизму (EULAR) як симптоматичний повільно діючий лікарський засіб проти остеоартриту (Symptomatic Slow Acting Drug for Osteo Arthritis, SYSADOA) у Європі, при лікуванні остеоартриту коліна [Jordan KM et al., Ann Rheum Dis 62, 1145, 2003], стегна [Jordan KM et al., Ann Rheum Dis 62, 1145, 2003] і руки [Zhang W. et al., Ann Rheum Dis 66, 377, 2007] на основі результатів досліджень і мета-аналізу численних клінічних досліджень. Крім того, ХС окремо або у сполученні з іншими інгредієнтами, використовується здебільшого як нутрицевтик, головним чином, у Європі і Сполучених Штатах Америки [McAlindon TE et al., JAMA 283, 1469, 2000. Volpi N. et al., Food Anal Meth 1, 195, 2008. Volpi N. et al., Separation Sc 1, 22, 2009]. Ефективність ХС жорстко пов’язана з його протизапальною активністю, такою, як його здатність пригнічувати активність деструктивних ферментів, таких, як еластаза лейкоцитів людини (HLE) [Ronca F. et al., Osteoarthritis Cartilage 6 Suppl A, 14, 1998. Egea J. et al., Osteoarthritis Cartilage 18 Suppl 1, S24, 2010]. ХС, який використовують у всьому світі у фармацевтичних або нутрицевтичних засобах, одержують шляхом екстракції з тканин декількох видів тварин, таких, як велика рогата худоба і свині [Fuentes EP et al., Acta Farm Bonaerense 17, 135, 1998], птахи [Luo XM et al., Poult Sci 81, 1086-1089, 2002], а також хрящові риби [Sugahara K. et al., Eur J Biochem 239, 871, 1996. Lignot B et al., J Biotechnol 103, 281, 2003] тощо. Однак природне походження цих продуктів створює потенціальні проблеми небезпеки для споживачів, що пов’язані з можливою присутністю трансмісійних інфекційних агентів, таких, як трансмісійні губчасті енцефалопатії (ТГЕ) у великої рогатої худоби, або з обмеженням використання, пов’язаним із релігійними нормами. Крім того, екстрактивна природа цих препаратів робить їх постачання ненадійним з огляду на зростаючий попит та об’єм ринку, що збільшуються. Ці міркування спонукали пошук альтернативних, надійніших джерел ХС, прикладом яких є біотехнологічне виробництво, починаючи з капсульного полісахариду К4 E. coli, як описано у науковій і патентній літературі. У цьому контексті термін «біотехнологічне виробництво» відноситься до способу виробництва, у якому значна частина кінцевого продукту продукується мікроорганізмом або ізольованими клітинами вищих організмів у системі штучного культивування, яке зазвичай і неточно іменується ферментацією. По суті, на даний час у цій галузі використовуються три основних підходи. Перший можна визначити як виробництво сполук, подібних до ХС, з використанням як стартового матеріалу капсульного полісахариду К4 E. coli O5:K4:H4, який потім піддають хімічному перетворенню. Другий підхід можна розглядати як прямий біосинтез подібних до ХС сполук мікроорганізмами, а третій визначається за біосинтетичним виробництвом несульфатованого хондроїтину, після якого здійснюється хімічна або біохімічна сульфатація. Патентний документ EP-A-1304338, об’єкт якого відноситься до вищезазначеного першого підходу, описує виробництво ХС, починаючи з полісахариду К4, одержаного у рідкому середовищі культур, який спочатку екстрагують і очищують, потім повторно розчиняють і піддають кислотному гідролізу, основним ефектом якого є видалення залишків фруктози, зв’язаних із залишками ГлК, що присутні у лінійному полімері. Другорядним ефектом є частковий гідроліз полісахаридного ланцюга, що призводить до одержання продуктів з меншою молекулярною масою. Потім дефруктосильований (позбавлений фруктози) полімер, ідентичний до несульфатованого хондроїтину, по-різному сульфатують у положенні C-4 або C-6 залишків N-ацетилгалактозаміну (GalNAc) хімічними засобами, використовуючи захисні групи у положенні 4 або 6. Крім того, у зазначеному документі описується ХС, принаймні 70% складу якого містять моно- та (або) дисульфатовану у положеннях 4 і 6 галактозамінову частину, положення 2 глюкуронової частини несульфатоване, має Mw 6-25 кДа і співвідношення карбоксильні/сульфатні групи (тобто, щільність заряду) 0,7-2,0. У патентному документі WO 2009/149155, де наводиться приклад другого підходу до одержання ХС, описується пряме продукування подібних до ХС сполук кількома мікроорганізмами – бактеріями і грибками. У цьому документі представлена також сполука, подібна до ХС наземного походження, причому обидва положення 4 і 6 галактозамінової частини є сульфатованими; сполука має молекулярну масу (Mw) приблизно від 300 Да до 35 кДа і співвідношення сульфатів 4S/6S від меншого за 1 до більшого за 1. Третій з вищезазначених підходів включає декілька різних стратегій одержання несульфатованого хондроїтину, основними з яких є ферментативний синтез полімеру у безклітинних структурах, подібний до описаних, наприклад, у документах EP-A-1950308 і EP-A1964924, і біосинтез у рекомбінантних клітинах, одержаних експресією до хазяїв, здатних 3 UA 110717 C2 5 10 15 20 25 30 35 40 45 50 55 продукувати, з УДФ-ГлК (урідиндифосфат-глюкуронової кислоти тринатрієвої солі), генів kfoA і kfoC, екстрагованих з капсульного полісахариду К4 E. coli, описаного, наприклад, у документі WO 2008/133350. Ще один приклад біосинтетичного виробництва несульфатованого хондроїтину показано у патентній заявці Італії № MI2010A001300, винахід з якої, крім усього іншого, відноситься до способу біотехнологічного виробництва хондроїтину, який містить стадію, на якій культивують у відповідному середовищі рекомбінантний мікроорганізм, переважно, Escherichia coli DSM23644, стадію, на якій вилучають і очищують несульфатований хондроїтин, присутній у мікробній культурі, і стадію, на якій останній сульфатують хімічним шляхом. Спільною ознакою процесів виробництва ХС, описаних на даний час, є значне зменшення молекулярної маси вихідного матеріалу на стадіях як видалення залишків фруктози з кислотним каталізом, так і хімічного синтезу, необхідних для сульфатації залишків N-ацетил-Dгалактозаміну (GalNAc). Як один із прикладів, у документі EP-A-1304338 описується ХС з молекулярною масою 6-25 кДа, а молекулярна маса полісахариду К4, який використовують як стартовий матеріал, вказана як 150-400 кДа. Першим аспектом цього винаходу є аналог акулячого хондроїтинсульфату, який не містить три-, тетра- і 2,4-дисульфатованих дисахаридів, що складається з 60-99% 6-сульфату, 0,5-30% 2,6-дисульфату, 0,1-5% 4,6-дисульфату, 0,1-5% несульфатованого хондроїтину і 0,1-1% 4сульфату, причому усі відсотки виражені відносно загального вмісту аналогу акулячого хондроїтинсульфату, який має середньочисельну молекулярну масу (Mn) 40-85 кДа і середньомасову молекулярну масу (Mw) 50-95 кДа. Переважно, запропонований аналог акулячого хондроїтинсульфату складається з 70-90% 6сульфату, 8,5-20% 2,6-дисульфату, 0,1-5% 4,6-дисульфату, 0,1-5% несульфатованого хондроїтину і 0,1-1% 4-сульфату, причому усі відсотки виражені відносно загального вмісту аналогу акулячого хондроїтинсульфату, причому останній має середньочисельну молекулярну масу (Mn) 40-65 кДа і середньомасову молекулярну масу (Mw) 50-70 кДа. Запропонований ХС характеризується високою молекулярною масою та своєрідними сульфатованими групами, головним чином, у положенні 6, а також дуже малою кількістю 4сульфатованого дисахариду. Розглядаючи ознаки запропонованого ХС і порівнюючи їх з наведеними у таблиці 1, що відноситься до зразків природного екстрактивного ХС, можна побачити, що запропонований ХС приблизно нагадує акулячий ХС. Крім того, запропонований ХС не містить будь-яких полісульфатованих дисахаридів, зокрема, він не містить ані три-, ані тетра-сульфатованих дисахаридів, що типово характеризують ХС, одержаний методами синтезу, розкритими у відомих технічних рішеннях, і що може проявлятися – після перетравлення з хондроїтиназою ABC – як недеградований продукт. Крім того, запропонований ХС у результаті є високоочищеним (на основі кількості недеградованого продукту після перетравлення з хондроїтиназою ABC) і безсумнівно відрізняється від ХС, розкритого у документі EP-A-1304338, що має молекулярну масу 6-25 кДа і високу кількість несульфатованого хондроїтину (>10%) і широкий діапазон щільності заряду (0,7-2), в той час як межі щільності заряду пропонованого ХС є вужчими і переважно складають 1,05-1,30. Mn і Mw можна розрахувати звичайними методами, відомими фахівцеві, наприклад, високоефективна ексклюзивна хроматографія (ВЕЕХ); переважно, Mn і Mw можна визначати методом ВЕЕХ, оснащеним інтегрованим спеціалізованим програмним забезпеченням для гельпроникної хроматографії (ГПХ). Переважно, сума 2,6-дисульфату і 4,6-дисульфату у запропонованому ХС складає 10-25% загального вмісту дисахаридів. Відповідно до ще одного аспекту, винахід відноситься до складу, що містить запропонований аналог акулячого хондроїтинсульфату і фармацев-тично або нутрицевтично прийнятний носій, такий, як, наприклад, мікрокристалічна целюлоза, декстрин, мальтодекстрин, циклодекстрин, сульфо-бутил-ефір-бета-циклодекстрин, соєвий лецитин, пальмітолеїнова кислота, ліпосоми, ефіри сахарози тощо. Фахівцеві у цій галузі зрозуміло, що запропонований склад можна готувати у різних лікарських формах: тверді (наприклад, таблетки, тверді капсули, м’які гелеві капсули) або рідкі (наприклад, розчини, питні суміші з розчиненням порошку), переважно, у вигляді парентерального та (або) перорального фармацевтичного та (або) нутрицевтичного препарату, і, крім того, склад може містити інші неактивні та (або) активні інгредієнти. 4 UA 110717 C2 5 10 15 20 25 30 35 40 45 50 55 Серед цих додаткових інгредієнтів пропонований склад може також (і переважно) містити принаймні одну з таких субстанцій: глюкозаміну гідрохлорид, глюкозаміну сульфат, Nацетилглюкозамін, гіалуронова кислота, гепарин, кератан, дерматан, метилсульфонілметан, фолати і відновлені фолати, вітаміни групи В, S-аденозилметионін (SAMe), аскорбінова кислота або марганцю аскорбат, і може вводитися в ефективній дозі суб’єкту, що потребує його, залежно від потреби та обставин, яких може вимагати ситуація. Просто як приклад, аналог акулячого ХС та (або) склад відповідно до цього винаходу може або можуть вводитися у кількості 100-3000 мг/день, переважно, у кількості 1000-2000 мг/день, переважніше, у кількості 1200-1800 мг/день, звичайно поділеній на дві/три дози на добу. Відповідно до ще одного аспекту, запропонований винахід відноситься до аналогу акулячого хондроїтинсульфату або складу відповідно до цього винаходу, призначених для використання при профілактиці або лікуванні остеоартриту або для підтримування здорового стану опорнорухового апарату, наприклад, як активний інгредієнт у лікарському засобі або харчова добавка, або поживна добавка. Просто як приклад, запропонований аналог акулячого ХС або склади, визначені вище, можуть використовуватися для приготування лікарського засобу, харчової добавки або поживної добавки для профілактики та (або) лікування остеоартриту (ОА) стегон, рук та колін і його основних симптомів, таких, як біль, опухання суглобів, запалення, хвороба Альцгеймера, мікробні інфекції, артеріосклероз, остеопороз і як ад’ювант у раковій терапії і відновленні тканин, включаючи відновлення нервових тканих. Відповідно до ще одного аспекту, винахід відноситься до способу одержання вищеназваного аналогу акулячого хондроїтину, який включає такі стадії: a) стадію, на якій несульфатований хондроїтин як вільну кислоту, попередньо розчинений у водному середовищі, перетворюють на сіль сіллю, вибраною з групи, що складається з тетраметил-, тетраетил- і тетрабутил-амонію або тетраетил- і тетрабутилпіридинію; b) стадію, на якій несульфатований хондроїтин, перетворений на сіль в результаті стадії (a), сушать до вмісту води 5-15%; c) стадію, на якій несульфатований хондроїтин, перетворений на сіль в результаті стадії (b), сушать при температурі 100-170 °C до вмісту води 0,1-3%; d) стадію, на якій положення 6 несульфатованого хондроїтину, перетвореного на сіль в результаті стадії (c), солюбілізованого в N-метилпіролідоні або диметилформаміді, вибірково сульфатують при температурі 0-30 °C через додавання 1-2 еквівалентів комплексу сірчаний ангідрид – піридин або комплексу сірчаний ангідрид – диметилформамід через проміжки часу 13 години, доки не додадуть усього 2-15 еквівалентів комплексу сірчаний ангідрид – піридин або комплексу сірчаний ангідрид, залишаючи одержаний розчин при перемішуванні на 2-24 години; e) стадію, на якій реакцію, що проводять на стадії (d), гасять водним розчином натрію бікарбонату або карбонату, одержаний розчин фільтрують і концентрують до одержання висушеної твердої речовини; f) стадію, на якій висушену тверду речовину розчиняють у водному розчині натрію хлориду, одержаний розчин піддають ультрафільтрації і діалізу; g) стадію, на якій з розчину, одержаного на стадії (f), одержують продукт; h) стадію, на якій продукт, одержаний на стадії (g), очищають і одержують його у вигляді кислоти або його натрієвої сілі; i) стадію, на якій продукт, одержаний на стадії (h), вилучають. Перетворення несульфатованого хондроїтину на сіль на стадії (а) переважно здійснюють сіллю, вибраною з групи, що складається з тетраметил-, тетраетил- і тетрабутиламонію, переважно, тетрабутиламонієм, а сушку несульфатованого хондроїтину на стадії (b) можуть здійснювати сублімаційною сушкою або сушкою розпиленням. Сушку солі несульфатованого хондроїтину на стадії (c) переважно здійснюють до 0,5-2% вмісту води, а солюбілізацію солі несульфатованого хондроїтину в результаті цієї стадії переважно здійснюють у диметилформаміді. Вибіркове сульфатування на стадії (d) переважно здійснюють через додавання у цілому 612, переважніше, 6-9, еквівалентів комплексу сірчаний ангідрид – піридин. Альтернативно, якщо вибіркове сульфатування на стадії (d) здійснюють через додавання комплексу сірчаний ангідрид – диметилформамід, у цілому додають 1-9, переважно 2-4, еквіваленти. Крім того, вибіркове сульфатування на стадії (d) переважно здійснюють при температурі 1020 °C, і наприкінці стадії (d) одержаний розчин переважно залишають при перемішуванні на 2-6 годин. 5 UA 110717 C2 5 10 15 20 25 30 35 40 45 50 55 Відповідно до ще одного переважного варіанту здійснення запропонованого способу, продукт із розчину, який одержують на стадії (f), одержують сублімаційною сушкою, сушкою розпиленням або осадженням у спиртовому середовищі. Запропонований спосіб дозволяє підтримувати молекулярну масу нативного полісахариду незмінною. Несподівано зв’ясувалося, що запропонований спосіб дозволяє уникнути здійснення будьякої стадії, спрямованої на захист будь-якої з вторинних гідроксильних груп, можливо, через те, що реактивність первинних гідроксильних груп у положенні 6 GalNAc гарантує вибірковість реакції. Крім того, запропонований спосіб дозволяє досягти значно вищої продуктивності і кращої відтворюваності якості продукту у порівнянні з відомими технологічними рішеннями, наприклад, у порівнянні з документом EP-A-1304388, де стадії сульфатації спричиняють більш широкий діапазон співвідношення карбоксильні/сульфатні групи 0,7-2,0. Крім того, запропонований спосіб дозволяє одержувати продукт, який містить дуже малі кількості 4-сульфатованого дисахариду і практично не містить полісульфатованих дисахаридів; зокрема, він дозволяє одержувати продукт, який не містить ані три-, ані тетра-сульфатованих сахаридів. Типово, що запропонований спосіб можна здійснювати шляхом розчинення несульфатованого хондроїтину, як вільної кислоти або натрієвої солі, одержаної, наприклад, шляхом дефруктозилювання (позбавлення фруктози) капсульного полісахариду К4, одержаного ферментацією у водному середовищі, як описано Манзоні (Manzoni) (Biotechnology Letters 18, 383-6, 1996) і Родригесом (Rodriguez) (Eur. J. of Biochem 177, 117-24, 1988). У випадку, якщо несульфатований хондроїтин перебуває у вигляді своєї натрієвої солі, після його повного розчинення одержаний розчин піддають елююванню, переважно, при температурі 0-30 °C, на колонці, що містить катіонообмінну смолу (таку, як, наприклад, Amberjet 1200 H, Rohm and Haas тощо), збирають промиті частини при pH 1,5-4,0, переважно, 1,5-3,0, і вилучають водні кислотні частини. Альтернативно, цю стадію можуть здійснювати періодично: після розчинення натрієвої солі несульфатованого хондроїтину у воді, розчин якої переважно одержують перемішуванням протягом 20-60 хвилин при температурі 0–30 °C, у цей розчин додають катіонну смолу (Amberjet 1200 H, Rohm and Haas тощо), при цьому pH розчину після додавання смоли складає 1,5-3,0. Потім розчин фільтрують, а одержаний кислотний фільтрат збирають. У кислий розчин несульфатованого хондроїтину, одержаний або безпосередньо шляхом розчинення несульфатованого хондроїтину як вільної кислоти, або шляхом очистки розчину його натрієвої солі, як описано вище, у безперервному або періодичному процесі, потім додають водний розчин іону, вибраного з групи, що складається з тетраметил-, тетраетил- і тетрабутиламонію або тетраметил-, тетраетил- і тетрабутилпіридинію, до pH 6,0-8,0, переважно, 6.0-7,0, розчин випаровують до одержання сухого продукту, наприклад, сублімаційною сушкою або сушкою розпиленням, до 5-15% вмісту води, щоб відновити відповідну сіль хондроїтину. Одержану сіль хондроїтину потім піддають другій стадії сушки при температурі 100-170 °C до вмісту води 0,1-3%, щоб остаточно одержати відповідну сіль несульфатованого хондроїтину. Відповідну сіль несульфатованого хондроїтину, одержану, як описано вище, потім вибірково сульфатують у положенні 6 без потреби у захисті будь-якої функціональної частини шляхом солюбілізації її у розчиннику, вибраному з N-метилпіролідону або диметилформаміду, при температурі 0-30 °C, переважно, 10-20 °C, піддаючи елююванню повністю розчинену сіль несульфатованого хондроїтину на колонці, що містить катіонообмінну смолу (таку, як, наприклад, Amberjet 1200 H, Rohm and Haas тощо), через додавання 1-2 еквівалентів комплексу сірчаний ангідрид – піридин або комплексу сірчаний ангідрид – диметилформамід через проміжки часу 1-3 години, доки не додадуть усього 2-15 еквівалентів комплексу сірчаний ангідрид – піридин або комплексу сірчаний ангідрид; залишаючи одержаний розчин при перемішуванні на 2-24 години, переважно, 2-6 годин. Після цього одержану реакційну масу гасять у водному розчині натрію бікарбонату або карбонату, і потім відновлюють, наприклад, обробкою натрію бікарбонатом і фільтруванням одержаних нерозчинних солей, випаровують до одержання сухого продукту і знову розчиняють у водному розчині натрію хлориду, відновлюють і остаточно обробляють, наприклад, ультрафільтрацією і діалізом, для видалення солей і домішок низької молекулярної маси, що залишилися, та одержують цільовий продукт, наприклад, сублімаційною сушкою, сушкою розпиленням або осадженням у спиртовому середовищі. В результаті хондроїтин-6-сульфат, одержаний, як проілюстровано вище, потім очищають, наприклад, методом хроматографії на колонці, що містить катіонообмінну смолу, для 6 UA 110717 C2 5 10 15 20 25 30 35 40 45 50 55 одержання його у вигляді кислоти, і, можливо, згодом одержують його у вигляді натрієвої солі додаючи, наприклад, натрію гідроксид. Хондроїтин-6-сульфат, одержаний, як проілюстровано вище, остаточно одержують, наприклад, сушкою у печі, під вакуумом при температурі 50-70 °C або очищають хроматографічним методом, одержуючи аналог акулячого хондроїтинсульфат, що не містить три-, тетра- і 2,4-дисульфатованих дисахаридів і має Mn 40-85 кДа і Mw 50-95 кДа. Винахід ілюструється такими прикладами. Приклад 1 Утворення солі 20 г натрієвої солі хондроїтину, одержаної шляхом дефруктозилювання (позбавлення фруктози) капсульного полісахариду К4, одержаного ферментацією, як описано Манзоні (Biotechnology Letters 18, 383-6, 1996) і Родригесом (Eur. J. of Biochem 177, 117-24, 1998), розчиняють у демінералізованій воді (500 мл). Після повного розчинення одержаний розчин піддають елююванню при температурі 5 °C на колонці, що містить катіонообмінну смолу (160 мл Amberjet 1200 H, Rohm and Haas), попередньо гідратовану і приготовлену у вигляді кислоти. Елюйовані частини вилучають при pH 1,9, збираючи водні кислотні частини і додаючи до них 16% водний розчин тетрабутиламонію до pH 7,0; потім розчин випаровують до одержання сухого продукту сублімаційною сушкою, щоб одержати 20,8 г хондроїтину у вигляді тетрабутиламонієвої солі. Одержану сіль піддають другій тепловій обробці у статичній сушарці при температурі 105 °C протягом 4 годин під вакуумом до залишкової вологості нижче 0,2%. У такий спосіб одержують 18,5 г хондроїтину у вигляді тетрабутиламонієвої солі. Приклад 2 Утворення солі 12 г несульфатованого хондроїтину, одержаного шляхом дефруктосилювання (позбавлення фруктози) капсульного полісахариду К4, одержаного ферментацією, як описано Манзоні (Biotechnology Letters 18, 383-6, 1996) і Родригесом (Eur. J. of Biochem 177, 117-24, 1998), розчиняють у 20 мл демінералізованої води, і після окислення до pH 2,5 на 1M розчином HCl і додавання 80 мл етанолу несульфатований хондроїтин осаджують у вигляді вільної кислоти. Після фільтрування і промивання етанолом одержують 10,3 г продукту у вигляді білої твердої речовини, яка після висушування під вакуумом при температурі 50 °C, має кислотний титр 90%, розрахований на продукті як такому і містить 8% залишкової води. Одержану тверду речовину суспендують у 20 мл води і додають 40 мас. % водного розчину тетрабутиламонію гідроксиду до pH 8. Одержаний розчин висушують сублімаційною сушкою до 2,5% залишку води, щоб одержати 15,9 г твердого хондроїтину у вигляді тетрабутиламонієвої солі. Одержану сіль піддають другій тепловій обробці у статичній сушарці при температурі 105 °C протягом 4 годин під вакуумом до залишкової вологості нижче 0,2%. В результаті одержують 15,4 г тетрабутилхондроїтину. Приклад 3 Сульфатація 1,4 г тетрабутилхондроїтину, одержаного, як проілюстровано у прикладі 1, і 84 мл ДМФ (диметилформаміду) завантажують у колбу з чотирма горловинами ємністю 250 мл, яку тримають в інертній атмосфері (N2), при механічному перемішуванні у присутності системи охолодження бульбашок, уловлювача з кальцію хлоридом і термометра. Одержану суспензію перемішують до повного розчинення, згодом відрегульовують температуру до позначки 23 °C. Після регулювання температури у розчин частками додають твердий комплекс сірчаний ангідрид – піридин (1,07 г, 3 рівними частками), підтримуючи реакцію при перемішуванні протягом 1 години і потім додають твердий комплекс сірчаний ангідрид – піридин (1,07 г, 3 рівними частками). Після подальшого перемішування протягом 1 години при такій самій температурі реакційну суміш переносять до колби ємністю 500 мл, що містить насичений розчин натрію гідрокарбонату, і охолоджуть до температури 10 °C. Залишивши температуру підвищуватися до 20 °C, здійснюють фільтрування на лійці Бюхнера, вилучають фільтрат і випаровують його під вакуумом до одержання сухого продукту. Одержану висушену тверду речовину (2,3 г) подрібнюють і знову розчиняють у 0,3M розчині NaCl (130 мл). Одержаний розчин піддають ультрафільтрації з використанням мембрани, що відділяє, з розміром пор 3 кДа, і підтримують pH ретентату на рівні 7,0. Після ультрафільтрації розчин піддають діалізу для видалення солей і шляхом ліофілізації одержують продукт. Одержаний продукт остаточно висушують при температурі 50 °C і тиску 10 мбар до одержання 1 г субстанції, яка має титр (розрахований шляхом визначення глюкуронової кислоти – імпульсним амперметричним детектуванням "ІАД") 95%, Mn 60 кДа і Mw 67,3 кДа, визначені 7 UA 110717 C2 5 10 15 20 25 30 35 високоефективною ексклюзивною хроматографією (ВЕЕХ), оснащеною інтегрованим спеціалізованим програмним забезпеченням для ГПХ. Приклад 4 Сульфатація 1,21 г хондроїтину у вигляді тетрабутиламонієвої солі, одержаного, як проілюстровано у прикладі 1, і 72 мл ДМФ, завантажують у колбу з чотирма горловинами ємністю 250 мл, яку тримають в інертній атмосфері азоту (N2), при механічному перемішуванні у присутності системи охолодження бульбашок, уловлювача з кальцію хлоридом і термометра. Одержану суспензію перемішують до повного розчинення, після чого відрегульовують температуру до позначки 10 °C. Після регулювання температури у розчин додають твердий комплекс сірчаний ангідрид – ДМФ (0,88 г, 3 рівними частками), підтримуючи реакцію при перемішуванні протягом 1 години. Додають натрію гідрокарбонат (0,97 г, 6 рівними частками), підтримуючи таку саму температуру, і продовжують перемішування протягом 1 години, після чого залишають продукт для підвищення температури до позначки 20 °C. Одержану суспензію відфільтрувують на лійці Бюхнера, а одержаний фільтрат випаровують під вакуумом до одержання сухого продукту. Одержану висушену тверду речовину (2,05 г) подрібнюють і знову розчиняють у 0,3M розчині NaCl (130 мл). Одержаний розчин піддають ультрафільтрації з використанням мембрани, що відділяє, з розміром пор 3 кДа, і підтримують pH ретентату на рівні 7,0. Після ультрафільтрації розчин піддаютьдіалізу для видалення солей і шляхом ліофілізації одержують продукт. Одержаний продукт остаточно висушують при температурі 50 °C і тиску 10 мбар до одержання 0,95 г субстанції, яка має титр (розрахований шляхом визначення глюкуронової кислоти – ІАД) 94%, Mn 62 кДа і Mw 68,3 кДа, оснащеною інтегрованим спеціалізованим програмним забезпеченням для ГПХ. Приклад 5 Аналіз хондроїтин-6-сульфату Склад ХС, одержаний, як описано у прикладах 3 і 4, досліджують високоефективною ексклюзивною хроматографією (ВЕЕХ) його продуктів травлення, шляхом обробки ХС, одержаного, як описано вище, хондроїтиназою ABC за методом, розкритим у роботі Joon-Soo Sim et al. (J. Chromatography B, 2005 vol. 818, pages 133-139). Аналіз провели з використанням колонки ВЕЕХ SAX, 250 x 4,6 мм, 10 мкм, елюючи з градієнтом, починаючи з вихідної фази 3,5 мМ HCl (pH=3,5) (100%) до концентрації, що дорівнювала 1M NaCl у HCl 3,5 мМ (pH=3,5) (100%). Такі самі продукти, одержані при перетравленні з хондроїтиназою ABC, проаналізували за допомогою аналізу FACE (флуорофор-асистованого електрофорезу в присутності карбогідрату), щоб виявити присутність неперетравленого полісахариду. Результати показують ступінь травлення понад 95%. Висока ступінь травлення вказує, по суті, на відсутність у структурі одержаного ХС три- й (або) тетра-сульфатованих дисахаридів. Таблиця 2 показує основні дисахариди, ідентифіковані для продуктів, одержаних у прикладах 3 і 4. Таблиця 2 ХС (приклад 3) 55,2 67,3 1,2 62 68,3 1,2 3,5 72,1 0,1 18,9 3,5 Молекулярна маса: Mn (кДа) Mw (кДа) Індекс полідисперсності Дисахариди: Ди-0S Ди-6S Ди-4S Ди-2,6диS Ди-4,6диS Ди-2,4диS триS тетраS Щільність заряду ХС (приклад 4) 2,8 83,1 0,2 13,8 0,1 ND ND ND ND ND ND 1,21 40 8 1,10 UA 110717 C2 5 10 Mn = середньочисельна молекулярна маса; Mw = середньомасова молекулярна маса; індекс полідисперсності = Mw/Mn; щільність заряду – число сульфатних груп на дисахаридні одиниці; ND = не виявлено При порівнянні Таблиці 2 з Таблицею 1 можна побачити, що склад запропонованого ХС виявляє значну подібність до акулячого ХС, оскільки перший містить дуже невеликі кількості ди4S і складається здебільшого з ди-6S, а одержані ди-0S, ди-2,6диS і ди-4,6диS приблизно співпадають із значеннями, відомими для акулячого ХС; крім того, запропонований ХС має щільність заряду вище за 1,0. Крім того, продукти, одержані у прикладах 3 і 4, не містять ані три, ані тетра-сульфатованих видів ХС. Крім того, запропонований ХС має своєрідний вміст сульфатів у порівнянні з деякими продуктами, що наведені у відомих технічних рішеннях, як проілюстровано у Таблиці 3. Таблиця 3 EP-A-1304388 WO 2009/149155 EP-A-1964924 EP-A-1950308 MI2010A001300 Аналог акулячого ХС (приклад 3) Аналог акулячого ХС (приклад 4) 15 20 25 Ди-0S ТАК НІ ТАК ТАК ТАК Ди-4S ТАК ТАК НІ НІ НІ Ди-6S ТАК ТАК НІ НІ НІ Ди-4,6диS ТАК НІ НІ НІ НІ Ди-2,6диS NO НІ НІ НІ НІ ТАК ТАК ТАК ТАК ТАК ТАК ТАК ТАК ТАК ТАК Приклад 6 Оскільки ефективність ХС жорстко пов’язана з його протизапальною актив-ністю, як, наприклад, його здатність пригнічувати активність деструктивних ферментів, таких, як еластаза лейкоцитів людини (HLE), в умовах in vitro дослідили здатність запропонованого Хс пригнічувати цю активність HLE і провели порівняння з бичачим ХС (еталон ХС відповідно до 1-ї Європейської фармакопеї) і ХС, екстрагованим із зразків хрящів акули. Результати порівняльних досліджень показані на Фіг. 1. Зразок запропонованого аналога акулячого ХС, одержано способом, описаним у прикладі 3, порівняли з бичачим ХС (еталон ХС відповідно до 1-ї Європейської фармакопеї), що продається компанією Bioiberica, і ХС, екстрагованим із хрящів акули. Активність еластази визначали спектрофотометричним методом аналізу, використовуючи хромогенну штучну речовину (N-сукциніл-ала-ала-ала-p-нітроанілід), специфічну щодо HLE. Після попереднього інкубування ферменту збільшуваними кількостями ХС активність визначали шляхом інкубування хромогенної речовини (N-сукциніл-ала-ала-ала-p-нітроаніліду). Після припинення реакції провели кількісне визначення одержаного продукту спектрофотометричним методом аналізу. 30 Таблиця 4 Мкг 1,0 2,5 5,0 7,5 10,0 35 бичачий ХС (порівняльний) 0,0 0,0 12,8 24,9 40,6 Пригнічення HLE (%) акулячий ХС (порівняльний) 0,0 10,5 33,7 51,4 68,0 аналог акулячого ХС (запропонований) 0,0 6,7 21,9 36,1 50,3 Фіг. 1 ілюструє дані, наведені у таблиці 4, і показує, що запропонований аналог акулячого ХС здатний ефективно пригнічувати активність еластази лейкоцитів людини у порівнянні зі зразками природного ХС. Біологічна активність і протизапальні властивості, продемонстровані запропонованим ХС in vitro, роблять його порівнянним до природних препаратів і, відтак, потенціально прийнятним для використання як лікарського засобу у фармацевтичних препаратах і нутрицевтиках. 9 UA 110717 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Аналог акулячого хондроїтинсульфату, який не містить три-, тетра- і 2,4-дисульфатованих дисахаридів, що складається з 60-99 % 6-сульфату, 0,5-30 % 2,6-дисульфату, 0,1-5 % 4,6дисульфату, 0,1-5 % несульфатованого хондроїтину і 0,1-1% 4-сульфату, причому усі відсотки виражені відносно загального вмісту аналога акулячого хондроїтинсульфату, причому останній має середньочисельну молекулярну масу (Μn) 40-85 кДа і середньомасову молекулярну масу (Mw) 50-95 кДа. 2. Аналог акулячого хондроїтинсульфату за п. 1, який відрізняється тим, що складається з 7090 % 6-сульфату, 8,5-20 % 2,6-дисульфату, 0,1-5 % 4,6-дисульфату, 0,1-5 % несульфатованого хондроїтину і 0,1-1 % 4-сульфату, причому усі відсотки виражені відносно загального вмісту аналога акулячого хондроїтинсульфату, причому останній має середньочисельну молекулярну масу (Μn) 40-65 кДа і середньомасову молекулярну масу (Mw) 50-70 кДа. 3. Аналог акулячого хондроїтинсульфату за п. 1, який відрізняється тим, що сума 2,6дисульфату і 4,6-дисульфату складає 10-25 % загального вмісту дисахаридів. 4. Склад, що містить запропонований аналог акулячого хондроїтинсульфату за п. 1 і фармацевтично або нутрицевтично прийнятний носій. 5. Спосіб приготування аналога акулячого хондроїтину за п. 1, який включає такі стадії: a) стадію, на якій несульфатований хондроїтин як вільну кислоту, попередньо розчинений у водному середовищі, перетворюють на сіль сіллю, вибраною з групи, що складається з тетраметил-, тетраетилі тетрабутиламонію або тетраметил-, тетраетилі тетрабутилпіридинію; b) стадію, на якій несульфатований хондроїтин, перетворений на сіль в результаті стадії (а), сушать до вмісту води 5-15 %; c) стадію, на якій несульфатований хондроїтин, перетворений на сіль в результаті стадії (b), сушать при температурі 100-170 °С до вмісту води 0,1-3 %; d) стадію, на якій положення 6 несульфатованого хондроїтину, перетвореного на сіль в результаті стадії (с), солюбілізованого в N-метилпіролідоні або диметилформаміді, вибірково сульфатують при температурі 0-30 °С, додаючи 1-2 еквіваленти комплексу сірчаний ангідрид піридин або комплексу сірчаний ангідрид - диметилформамід через проміжки часу 1-3 години, поки не додадуть усього 2-15 еквівалентів комплексу сірчаний ангідрид - піридин або комплексу сірчаний ангідрид - диметилфорамід; залишаючи одержаний розчин при перемішуванні на 2-24 години; e) стадію, на якій реакцію, що проводять на стадії (d), гасять водним розчином бікарбонату або карбонату натрію, одержаний розчин фільтрують і концентрують до одержання висушеної твердої речовини; f) стадію, на якій висушену тверду речовину розчиняють у водному розчині хлориду натрію, одержаний розчин піддають ультрафільтрації і діалізу; g) стадію, на якій з розчину, одержаного на стадії (f), одержують продукт; h) стадію, на якій продукт, одержаний на стадії (g), очищають і одержують його у вигляді кислоти або його натрієвої солі; і) стадію, на якій продукт, одержаний на стадії (h), вилучають. 6. Спосіб за п. 5, який відрізняється тим, що перетворення несульфатованого хондроїтину на сіль на стадії (а) здійснюють сіллю, вибраною з групи, що складається з тетраметил-, тетраетил- і тетрабутиламонію. 7. Спосіб за п. 5, який відрізняється тим, що перетворення несульфатованого хондроїтину на сіль на стадії (а) здійснюють тетрабутиламонієм. 8. Спосіб за п. 5, який відрізняється тим, що сушіння несульфатованого хондроїтину на стадії (b) здійснюють сублімаційним сушінням або сушінням розпиленням. 9. Спосіб за п. 5, який відрізняється тим, що сушіння солі несульфатованого хондроїтину на стадії (с) здійснюють до вмісту води 0,5-2 %. 10. Спосіб за п. 5, який відрізняється тим, що солюбілізацію солі несульфатованого хондроїтину в результаті стадії (с) здійснюють у диметилформаміді. 11. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють через додавання у цілому 6-12 еквівалентів комплексу сірчаний ангідрид - піридин. 12. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють через додавання у цілому 6-9 еквівалентів комплексу сірчаний ангідрид - піридин. 13. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють через додавання у цілому 1-9 еквівалентів комплексу сірчаний ангідрид диметилформамід. 10 UA 110717 C2 5 10 14. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють через додавання у цілому 2-4 еквівалентів комплексу сірчаний ангідрид диметилформамід. 15. Спосіб за п. 5, який відрізняється тим, що вибіркове сульфатування на стадії (d) здійснюють при температурі 10-20 °С. 16. Спосіб за п. 5, який відрізняється тим, що наприкінці стадії (d) одержаний розчин залишають при перемішуванні на 2-6 годин. 17. Спосіб за п. 5, який відрізняється тим, що на стадії (g) продукт одержують сублімаційним сушінням, сушінням розпиленням або осадженням у спиртовому середовищі. 18. Склад за будь-яким з пп. 1-4, призначений для використання при профілактиці або лікуванні остеоартриту або для підтримування здорового стану опорно-рухового апарату. Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюShark-like chondroitin sulphate and process for the preparation thereof
Автори англійськоюValoti, Ermanno, Miraglia, Niccolo, Bianchi, Davide, Valetti, Marko, Bazza, Paola
Автори російськоюВелоти Эрманно, Мираглиа Никколо, Бьянчи Дэвид, Валетти Марко, Базза Паола
МПК / Мітки
МПК: C08B 37/00, A61K 31/737
Мітки: хондроїтинсульфату, одержання, спосіб, акулячого, аналог
Код посилання
<a href="https://ua.patents.su/13-110717-analog-akulyachogo-khondrotinsulfatu-i-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Аналог акулячого хондроїтинсульфату і спосіб його одержання</a>
Попередній патент: Жирова композиція, що уповільнює посивіння
Наступний патент: Спосіб визначення реостабільності сумішей з невизначеними теплофізичними властивостями в реальних теплогідродинамічних, біо- і хіміко-технологічних процесах
Випадковий патент: Спосіб морфологічної діагностики хронічної інтоксикації алкалоїдами опію та психотропними медикаментами седативної дії