Лікарський засіб
Формула / Реферат
1. Лікарський засіб, що включає активну речовину і цільові добавки, який відрізняється тим, що як активну речовину він містить N-(6-метил-2,4-діоксо-1,2,3,4-тетрагідро-5-піримідинсульфон)-N'-ізонікотиноілгідразид формули (III)
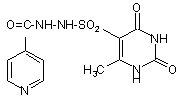 (III)
(III)
або його фармацевтично прийнятні солі чи ізомери в ефективній кількості.
2. Лікарський засіб за п. 1, який відрізняється тим, що він додатково містить щонайменше один протитуберкульозний засіб.
3. Лікарський засіб за п. 2, який відрізняється тим, що як протитуберкульозні засоби він містить ізоніазид, рифампіцин, піразинамід.
4. Лікарський засіб за будь-яким з пп. 1-3, який відрізняється тим, що він виготовлений у вигляді таблеток, комбінованих таблеток, капсул, сиропу та ін'єкцій.
Текст
Корисна модель, що заявляється, належить до лікарського засобу, який може бути використано в медицині у комплексній терапії мікробактеріозів (туберкульоз, лепра і т.д.), неспецифічних захворювань легень, хламідіозі та герпетичній інфекції, що проходять на фоні вторинного імунодефіцитного стану організму. В даний час з рівня техніки відомо велику кількість лікарських препаратів того ж призначення. Так, наприклад, відомо препарат ізоніазид (гідразид ізонікотинової кислоти - ГІНК) [див. Машковский М. Д., Лекарственные средства, т.2, Харьков, «Торсинг». 1997, с. 332-333] формули (І) O=C-NH-NH 2 N (І) Суттєвим недоліком ізоніазиду є його висока токсичність (LDso дорівнює 150 мг/кг), а також виникаючі при тривалому лікуванні розлади травлення, порушення діяльності нирок, нервово-психічні, гематологічні, алергічні прояви та токсичні гепатити. Відомо препарат феназид [див. патент РФ №2080114], який являє собою хелатний комплекс двовалентного заліза ізоніазиду формули (II) O=C-NH-NH 2 . . FeSO 4 2H2 O N (ІІ) Хоча цей препарат має меншу токсичність у порівнянні з ізоніазидом, проте її рівень досить високий (LDso дорівнює 250-833 мг/кг). Крім того, великим недоліком є те, що феназид не може застосовуватися при серцеволегеневій недостатності та важких формах ішемічної хвороби серця. Задачею даної корисної моделі є розробка нового лікарського засобу, який зберігав би ті ж самі лікувальні властивості, але мав би більш низьку (приблизно у 50 разів меншу) токсичність, був стабільним у процесі зберігання, побічні ефекти якого також були б зведені до мінімуму. Задача вирішується запропонованим лікарським засобом, що включає активну речовину і цільові добавки, відмінність якого полягає в тому, що як активну речовину він містить N-(6-метил-2,4-діоксо-1,2,3,4-тетрагідро-5піримідинсульфон)-N'-ізонікотиноілгідразид формули (III) O O=C-NH-NH-SO2 NH H 3C N H O N (ІІІ) або його фармацевтично прийнятні солі чи ізомери в ефективній кількості. Переважно лікарський засіб додатково містить, щонайменше, один протитуберкульозний засіб. Переважно лікарський засіб як протитуберкульозний засіб може містити ізоніазид, рифампіцин, піразинамід. Переважно лікарський засіб може бути виго товлений у вигляді таблеток, комбінованих таблеток, капсул, сиропу та ін'єкцій. Одержують N-(6-метил-2,4-діоксо-1,2,3,4-тетрагідро-5-піримідинсульфон)-N'-ізонікотиноілгідразид формули (III) відомою реакцією шляхом взаємодії 6-метилурацил-5-сульфохлориду з ізоніазидом в сухому ацетонітрилі кип'ятінням при перемішуванні. Сполуки за корисною моделлю можуть вводитися звичайним способом перорально або парентерально (підшкірно, внутрішньовенно, внутрішньом'язово, внутрішньочеревинно). Дозування залежить від віку, стану та ваги пацієнта, а також від виду введення. Згідно з корисною моделлю, запропонований лікарський засіб містить активну речовину в кількості від 0,1 до 4г. Запропоновані лікарські засоби виготовляються звичайним способом. Разом з активною речовиною лікарські засоби можуть при цьому містити звичайні допоміжні речовини, прийняті в технології приготування ліків, такі як зв'язуючи для таблеток, наповнювачі, консерванти, речовини, що розбризкуються на таблетки, регулятори плинності, пом'якшувальні та змочувальні засоби, диспергатори, емульгатори, розчинники, пролонгатори дії, антиокисники і/або пропелпенти [див. Н. Sucker et al: Pharmazeutische Technologie, Thieme - Verlag, Stuttgard, 1991]. Крім того, запропоновані лікарські засоби замість окремих активних речовин можуть містити комбінації різних активних речовин, щоб використовувати спільно якості окремих активних речовин при застосуванні, або також тому, що окремі активні речовини у поєднанні володіють синергізмом, тобто дають в результаті суперадитивне підсилення дії. Клінічні випробування. Були проведені клінічні випробування на хворих на туберкульоз органів дихання, при лікуванні загострень хронічного гнійно-обструктивного бронхіту, при лікуванні хворих на пневмонії, а також на хворих на запальні захворювання респіраторного тракту, викликані внутрішньоклітинними збудниками (хламідіями). 1. Клінічні випробування на хворих на туберкульоз органів дихання. Під спостереженням знаходилися 62 хворих з різними формами туберкульозу легенів. Контрольну груп у складали 20 хворих на туберкульоз органів дихання, схожих за статтю, зростом, клініко-лабораторними та рентгенологічними характеристиками процесу з досліджуваною групою. Переважна більшість хворих у досліджуваній групі (55 осіб - 88,8 %) були чоловіки, жінки склали тільки 11,2 % (7 осіб). Віковий склад хворих коливався від 18 до 70 років. Всі пацієнти були з вперше виявленими формами туберкульозу. Найчастішими клінічними формами були інфільтративний туберкульоз, туберкульозний плеврит, казеозна пневмонія. У більшості спостережуваних хворих туберкульозний процес носив поширений характер. Порожнини розпаду визначалися у 93,5% випадків, найчастіше вони були множинні або з розмірами каверн більш 4-х см в діаметрі. Бактеріовиділення визначалося у 42 осіб (67,7%), яке у 53,2% випадків було масивним. В одного хворого виявлена лікарська стійкість до всіх протитуберкульозних препаратів. У хворих при надходженні виявився синдром інтоксикації, який у 42,0% випадків мав виражений характер (лихоманка, запальні зміни крові, зниження маси тіла). Імунологічне обстеження, проведене хворим, включало оцінку складу субпопуляції лімфоцитів з використанням моноклональних антитіл до СD3+, CD4+, CD8+, СD16+, CD20+, CD25+ і визначення концентрації імуноглобулінів методом радіальної імунодифузії згідно з Манчині. Функціональну активність Т-клітин визначали в РБТЛ на ФТА і РТМЛ з ФГА і ППД. Специфічна гуморальна та клітинна відповідь оцінювалася за рівнем протитуберкульозних антитіл в серологічних реакціях (РПК, РНГА, ІФА) і в РБТЛ з ППД. Дослідження імунного статусу хворих на туберкульоз показало, що практично у всіх них були ті або інші порушення імунітету. У більшості з них процес проходив на фоні зниженого абсолютного або відносного числа лімфоцитів, початкове низьких показників та дефіциту Т-хелперів і Т-супресорів. Відзначені більш високі початкові показники ЕК (СD16+, що, мабуть, компенсує недолік Т-лімфоцитів. У 40 хворих (70,0 %) були знижені показники імуноглобулінів, особливо класів А і G. Хіміотерапія хворим проводилася за традиційною схемою із застосуванням 4-х протитуберкульозних препаратів (рифампіцин, піразинамід, стрептоміцин або етамбутол, замість ізоніазиду хворим в досліджуваній групі призначалася сполука за корисною моделлю по 800 мг на добу). Інші препарати, що мають імуномодулювальну дію, не застосовувалися. Результати дослідження: Ефективність комплексної поліхіміотерапії оцінювалася через 1, 2, 4 і 6 місяців лікування. Позитивний результат лікування у найближчі терміни спостереження (1-2 місяці) відзначений у 58 (93,5 %) хворих в досліджуваній групі та у 12 (60,0 %) в контрольній групі. Дезинтоксикація настала у 42 (67,7 %) хворих в досліджуваній групі через 1 місяць і через 2 місяці ще у 17 (27,4 %) осіб, в контрольній групі 45,0 % і 25,0 % відповідно. Зменшилася інтенсивність бактеріовиділення у 19 (30,6 %) в досліджуваній групі і у 4 осіб (20,0 %) у контрольній групі. Позитивна рентгенологічна динаміка процесу виявлена через 1 місяць у 51,8 % спостережень і ще через 2 місяці у 42,5 % в досліджуваній групі, а в контрольній групі у 35,0 % і 30,0 % відповідно. Вона проявлялася розсмоктуванням інфільтрації і частини вогнищ, значним зменшенням в розмірах порожнин розпаду. Найбільш значні рентгенологічні зміни виявлені у хворих з вираженою ексудативною реакцією та стійкими змінами імунного статусу. Серед хворих, що закінчили чотирьохмісячний курс хіміотерапії, негативація мокротиння настала у 95 % в досліджуваній групі та у 80 % в контрольній групі. У 51,6 % випадків в досліджуваній групі і у 40,0 % в контрольній групі закрилися порожнини розпаду. Після 6 місяців лікування тільки у одного хворого в досліджуваній групі і у двох хворих в контрольній групі зберігалося бактеріовиділення та порожнини розпаду в легенях. Переносність хворими сполуки за корисною моделлю була задовільна, у трьох хворих в досліджуваній групі спостерігалася побічна реакція у вигляді шкірного висипу, інших побічних реакцій не помічено. Водночас у двох хворих в гр упі, де застосовувалася сполука за корисною моделлю, з клінічними ознаками персистувального хронічного гепатиту, підвищенням рівня білірубіну і трансаміназ в сироватці крові, через 1 місяць хіміотерапії відбулася нормалізація лабораторних показників. Після курсу хіміотерапії з сполукою за корисною моделлю протягом 1-2 місяців аналіз імунологічних зсувів виявив різноспрямованість змін показників імунітету. В досліджуваній групі відзначені тенденції до збільшення вмісту CD4+. При початкове зниженому вмісті CD8+ зміни їх числа не спостерігалося. При початково високих показниках ЕК (СD6+, відзначалася динаміка їх нормалізації. Виявлена позитивна дія на функціонування Всистеми, збільшення початкове знижених показників імуноглобулінів. У 44,0 % випадків відзначено підвищення рівня Ig G і А. У контрольній групі на перших етапах лікування відзначалися деякі ознаки імунодепресії як наслідок дії протитуберкульозних препаратів: зниження кількості Е і В-лімфоцитів, особливо за рахунок Т-супресорів. Однак через 6 місяців поліхіміотерапії відмінності в імунному статусі хворих у досліджуваній та контрольній групах були не значними. Імуномодулювальна дія сполуки за корисною моделлю виявляється на початкових етапах лікування туберкульозу (див. Таблиці 1 і 2). Оцінка результатів лікування показала перспективність використання сполуки за корисною моделлю у комплексному лікуванні хворих з вираженими порушеннями імунного статусу, поширеними та деструктивними формами туберкульозу легенів. Препарат виявляється ефективним і за наявності важких супутні х захворювань, коли ізоніазид протипоказаний або викликає неминучі побічні реакції. Таблиця 1 Динаміка імунологічних показників у хворих на туберкульоз легенів при застосуванні сполуки за корисною моделлю (М±м) Показники Лейкоцити 109/л Т-лімфоцити, % Терміни лікування до лікування через 2 місяці через 6 місяців до лікування через 2 місяці Групи спостереження досліджувана п=62 контрольна п=20 10,9±0,309* 9,8±0,04* 7,01±0,274* 8,0±0,021* 6,61±0,21* 7,02±0,281* 27,58±1,02 26,74±1,1* 31,0±1,03 28,0±1,1* CD4+-лімфоцити, % СD8+-лімфоцити, % CD4+/CD8+ В-лімфоцити, % CD+16-NK через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців 32,59±0,105* 42,15±0,024* 44,29±3,09 46,68±1,408 26,96±1,3 28,57±0,32* 27,08±0,87* 1,49±0,002* 1,5±0,130* 2,0±0,125* 11,2±0,068* 27,08±0,292* 30,72±0,873 35,6±1,2 20,8±0,77* 16,73±0,94* 24,2±0,120* 39,62±1,49 34,48±0,88* 41,83±1,292 28,57±0,012* 26,2±1,8 28,01±0,22* 1,32±1,133 1,43±1,023* 1,93±0,092* 18,6±0,346* 12,2±0,335* 29,82±1,048 25,8±0,94* 22,7±1,45 18,02±1,21 Примітка: * - відмінність достовірна (р менше 0,05) відносно до норми. Таблиця 2 Динаміка імунологічних показників у хворих на туберкульоз легенів при застосуванні сполуки за корисною моделлю (М±м) Показники Т-лімфоцити (норма 33,1±0,953) Ig А (норма 1,9±0,21) Ig M (норма 1,35±0,243) IgG (норма 10,5±0,9) Е-РОК % (норма 63,9± 1,2) РБТЛ з ФГА, % (норма 59,2±2,1) Еа-РОК % (норма 18,4±3,2) Терміни лікування до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців до лікування через 2 місяці через 6 місяців Групи спостереження досліджувана п=62 контрольна п=20 27,58±1,2* 26,74±1,1* 31,0±1,3* 28,0±1,1 32,591±0,105* 24,2±0,1205* 2,0±0,22 1,9±0,17* 2,38±0,19* 1,8±0,06* 2,21±0,18 1,9±0,21* 1,32±0,158* 1,29±0,115* 1,68±0,272* 1,24±0,218* 1,42±0,085* 1,38±0,036* 9,9±0,10* 9,8±0,21* 11,0±0,204** 10,2±0,06* 10,98±1,02 10,58±0,3* 42,2±0,9* 36,0±0,8б 49,8±1,4 47,2±0,08* 49,6±1,2 46,3±0,5* 46,0±0,82* 46,6±0,908* 47,2±1,2 46,2±1,3 47,1±1,123 46,6±0,603* 14,8±0,37* 14,0±1,04 18,2±2,1 13,1±0,9* 17,6±0,35* 14,2±1,18 Примітка:* - відмінність достовірна (р
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition
Назва патенту російськоюЛекарственное средство
Автори російськоюРЕШЕТОВ Александр Леонидович
МПК / Мітки
МПК: A61K 31/513, A61P 31/04, A61K 31/455
Мітки: засіб, лікарський
Код посилання
<a href="https://ua.patents.su/13-23063-likarskijj-zasib.html" target="_blank" rel="follow" title="База патентів України">Лікарський засіб</a>
Попередній патент: Балансувальний верстат
Наступний патент: Захищена повітряна лінія електропередавання від галопування проводів
Випадковий патент: Спосіб лікування остеоартрозу в підлітків