Похідні 5-піридиніл-1-азабіцикло[3.2.1]октану, їх одержання і їх застосування у терапії
Номер патенту: 92917
Опубліковано: 27.12.2010
Автори: Локхед Алістер, Леклерк Оділь, Галлі Фредерік, Ваше Жюльєн
Формула / Реферат
1. Сполука загальної формули (І)
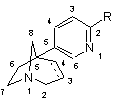 , (I)
, (I)
в якій
R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, ізотіазолілу, тіадіазолілу, тетразолілу, причому вказана група, можливо, заміщена однією або декількома групами, вибраними з галогенів, (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1-С6)алкіламіно;
зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним;
у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що
R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, ізотіазолілу, тіадіазолілу, тетразолілу, причому ця група може бути заміщена однією або декількома групами (С1-С6)алкілу; і
зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним,
у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що
R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, тетразолілу, причому ця група може бути заміщена однією або декількома групами, вибраними з галогенів, (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1-С6)алкіламіно; і
зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним;
у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату.
4. Сполука формули (І) за п. 1 або 3, яка відрізняється тим, що
R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, тетразолілу, причому ця група може бути заміщена однією або декількома (С1-С6)алкільними групами; і
зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним.
у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату.
5. Сполука формули (І) за п. 1 або 2, яка відрізняється тим, що
R означає групу піразолілу, можливо, заміщену однією або декількома групами (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1-С6)алкіламіно; і
зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним,
у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату.
6. Сполука формули (І) за будь-яким з пп. 1-5, яка відрізняється тим, що
R означає групу піразолілу, можливо, заміщену однією або декількома (С1-С6)алкільними групами; і
зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним;
у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату.
7. Сполука формули (І) за будь-яким з пп. 1-6, яка відрізняється тим, що
R означає групу піразолілу, можливо, заміщену однією або декількома (С1-С6)алкільними групами, і
зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим;
у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату.
8. Сполука формули (І) за будь-яким з пп. 1-4, яка відрізняється тим, що її вибирають з наведених нижче сполук:
5-[2-(1-метил-1Н-піразол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(1Н-піразол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(1Н-піразол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]окт-3-ен;
5-[2-(1-метил-1Н-піразол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]окт-3-ен;
5-[2-(1Н-імідазол-1-іл)піридин-5-іл]-1-азабіцикло[3.2.1]окт-3-ен;
5-[2-(1Н-імідазол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]окт-3-ен;
5-[2-(1Н-імідазол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(1Н-імідазол-1-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(1Н-імідазол-2-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(3,5-диметил-1Н-піразол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(1Н-1,2,4-триазол-3-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(5-метил-1,2,4-оксадіазол-3-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(1,3-оксазол-2-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(тіазол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(піразол-3-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(2-метилтіазол-5-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(тетразол-5-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(1-ізобутил-1Н-піразол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
5-[2-(1-н-пропіл-1Н-піразол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октан;
у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату;
у вигляді чистого енантіомера або суміші енантіомерів.
9. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-8, який відрізняється тим, що піддають взаємодії сполуку формули (V) або (VI)
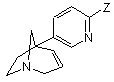 , (V)
, (V) 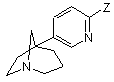 , (VI)
, (VI)
в якій Z означає атом брому,
або з бороновою кислотою формули R-B(OH)2, в якій R є таким, як визначено для загальної формули (І), у присутності каталізатора, що містить паладій,
або зі сполукою формули R-H, в якій R є таким, як визначено для загальної формули (І), у присутності сильної основи у розчиннику,
або з похідним формули R-Sn[(CH2)3CH3]3, що містить двовалентне олово, в якій R є таким, як визначено для загальної формули (І), у присутності каталізатора, що містить паладій,
або зі сполукою формули R-H, в якій R є таким, як визначено для загальної формули (І), у присутності н-бутиллітію, хлориду цинку і каталізатора, що містить паладій.
10. Спосіб одержання сполуки формули (І)
 , (I)
, (I)
в якій:
R означає групу, вибрану з триазолілу, оксадіазолілу, тетразолілу, причому ця група, можливо, заміщена однією або декількома групами, вибраними з галогенів, (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1-С6)алкіламіно; і
зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим,
який відрізняється тим, що
піддають взаємодії сполуку формули (VI)
 , (VI)
, (VI)
в якій Z означає атом брому,
у присутності ціаніду калію і тетракис(трифенілфосфіно)паладію у розчиннику,
з одержанням сполуки формули (VII)
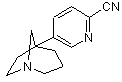 , (VII)
, (VII)
потім:
якщо R означає триазоліл, піддають взаємодії сполуку формули (VII) у присутності сильної основи з мурашиним гідразином у розчиннику;
якщо R означає оксадіазоліл, перетворюють сполуку формули (VII) в N-гідроксикарбоксамідин формули (VIII)
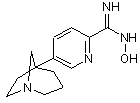 (VIII)
(VIII)
у присутності гідроксиламінхлоргідрату у лужному середовищі, потім піддають взаємодії сполуку формули (VIII) з оцтовим ангідридом у розчиннику,
якщо R означає тетразоліл, піддають взаємодії сполуку формули (VII) з азидом натрію у присутності хлориду амонію у розчиннику.
11. Сполука формули (VII)
 (VII).
(VII).
12. Сполука формули (VIII)
 (VIII).
(VIII).
13. Лікарський засіб, який відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-8 або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або гідрат, або сольват.
14. Фармацевтична композиція, яка відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-8 або фармацевтично прийнятну сіль, гідрат або сольват вказаної сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
15. Застосування сполуки формули (І) за будь-яким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування і профілактики когнітивних змін, порушення уваги, порушень функцій виконання, пов'язаних з хворобою Альцгеймера, патологічним або нормальним старінням, з синдромом Паркінсона, з трисомією 21, з психічними патологіями, корсаківським алкогольним синдромом, судинною деменцією, черепно-мозковими травмами, рухових порушень, що спостерігаються при хворобі Паркінсона, або інших неврологічних захворювань або анатомогістопатологічних уражень, пов'язаних зі згаданими вище нейродегенеративними захворюваннями.
16. Застосування сполуки формули (І) за будь-яким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування і профілактики порушення мозкового кровообігу, нападів церебральної гіпоксії, психіатричних патологій.
17. Застосування сполуки формули (І) за будь-яким з пп. 1-8 для одержання лікарського засобу, призначеного для профілактики симптомів, пов'язаних з тютюнопалінням, алкоголізмом, вживанням різних речовин, що викликають залежність.
18. Застосування сполуки формули (І) за будь-яким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування болю.
19. Застосування сполуки формули (І) за будь-яким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування ішемії нижніх кінцівок, облітеруючого артриту нижніх кінцівок, ішемічної хвороби серця, інфаркту міокарда, серцевої недостатності, недостатнього загоювання шкірного покриву у хворих діабетом, варикозних виразок при венозній недостатності.
20. Застосування сполуки формули (І) за будь-яким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування запальних процесів.
Текст
1. Сполука загальної формули (І) 2 (19) 1 3 R означає групу піразолілу, можливо, заміщену однією або декількома (С1-С6)алкільними групами; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним; у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату. 7. Сполука формули (І) за будь-яким з пп. 1-6, яка відрізняється тим, що R означає групу піразолілу, можливо, заміщену однією або декількома (С1-С6)алкільними групами, і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим; у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату. 8. Сполука формули (І) за будь-яким з пп. 1-4, яка відрізняється тим, що її вибирають з наведених нижче сполук: 5-[2-(1-метил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]окт-3-ен; 5-[2-(1-метил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]окт-3-ен; 5-[2-(1Н-імідазол-1-іл)піридин-5-іл]-1азабіцикло[3.2.1]окт-3-ен; 5-[2-(1Н-імідазол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]окт-3-ен; 5-[2-(1Н-імідазол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-імідазол-1-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-імідазол-2-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(3,5-диметил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-1,2,4-триазол-3-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(5-метил-1,2,4-оксадіазол-3-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1,3-оксазол-2-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(тіазол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(піразол-3-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(2-метилтіазол-5-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(тетразол-5-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1-ізобутил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1-н-пропіл-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; у вигляді основи або адитивної солі з кислотою або у вигляді гідрату або сольвату; у вигляді чистого енантіомера або суміші енантіомерів. 9. Спосіб одержання сполуки формули (І) за будьяким з пп. 1-8, який відрізняється тим, що піддають взаємодії сполуку формули (V) або (VI) 92917 4 R Z N R Z N N N , (V) , (VI) в якій Z означає атом брому, або з бороновою кислотою формули R-B(OH)2, в якій R є таким, як визначено для загальної формули (І), у присутності каталізатора, що містить паладій, або зі сполукою формули R-H, в якій R є таким, як визначено для загальної формули (І), у присутності сильної основи у розчиннику, або з похідним формули R-Sn[(CH2)3CH3]3, що містить двовалентне олово, в якій R є таким, як визначено для загальної формули (І), у присутності каталізатора, що містить паладій, або зі сполукою формули R-H, в якій R є таким, як визначено для загальної формули (І), у присутності н-бутиллітію, хлориду цинку і каталізатора, що містить паладій. 10. Спосіб одержання сполуки формули (І) 3 R 4 8 2 5 6 N 7 1 N 4 5 1 6 3 2 , (I) в якій: R означає групу, вибрану з триазолілу, оксадіазолілу, тетразолілу, причому ця група, можливо, заміщена однією або декількома групами, вибраними з галогенів, (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1С6)алкіламіно; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим, який відрізняється тим, що піддають взаємодії сполуку формули (VI) R Z N N , (VI) в якій Z означає атом брому, у присутності ціаніду калію і тетракис(трифенілфосфіно)паладію у розчиннику, з одержанням сполуки формули (VII) CN N N , (VII) потім: якщо R означає триазоліл, піддають взаємодії сполуку формули (VII) у присутності сильної основи з мурашиним гідразином у розчиннику; 5 якщо R означає оксадіазоліл, перетворюють сполуку формули (VII) в N-гідроксикарбоксамідин формули (VIII) NH NH N OH N (VIII) у присутності гідроксиламінхлоргідрату у лужному середовищі, потім піддають взаємодії сполуку формули (VIII) з оцтовим ангідридом у розчиннику, якщо R означає тетразоліл, піддають взаємодії сполуку формули (VII) з азидом натрію у присутності хлориду амонію у розчиннику. 11. Сполука формули (VII) CN N N (VII). 12. Сполука формули (VIII) NH NH N OH N (VIII). 13. Лікарський засіб, який відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-8 або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або гідрат, або сольват. 14. Фармацевтична композиція, яка відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-8 або фармацевтично прийнятну сіль, гідрат або сольват вказаної сполуки, а також щонай Даний винахід стосується похідних 5піридиніл-1-азабіцикло[3.2.1]октану, їх одержання і застосування у терапії. З рівня техніки відомі похідні 5-піридиніл-1азабіцикло[2.3.1]октану, описані у документі WO03/057697, що володіють in vitro спорідненістю до нікотинових рецепторів типу 4 2 і 7. Але, як і раніше, існує потреба у пошуку і розробці продуктів, що володіють спорідненістю до нікотинових рецепторів і є селективними відносно нікотинових рецепторів, які містять підгрупу 7. Мета винаходу полягає у пропонуванні нових сполук, які володіють спорідненістю до нікотинових рецепторів і селективністю відносно нікотинових рецепторів, що містять підгрупу 7. Об'єктом даного винаходу є сполуки загальної формули (І) 92917 6 менше один фармацевтично прийнятний ексципієнт. 15. Застосування сполуки формули (І) за будьяким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування і профілактики когнітивних змін, порушення уваги, порушень функцій виконання, пов'язаних з хворобою Альцгеймера, патологічним або нормальним старінням, з синдромом Паркінсона, з трисомією 21, з психічними патологіями, корсаківським алкогольним синдромом, судинною деменцією, черепно-мозковими травмами, рухових порушень, що спостерігаються при хворобі Паркінсона, або інших неврологічних захворювань або анатомогістопатологічних уражень, пов'язаних зі згаданими вище нейродегенеративними захворюваннями. 16. Застосування сполуки формули (І) за будьяким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування і профілактики порушення мозкового кровообігу, нападів церебральної гіпоксії, психіатричних патологій. 17. Застосування сполуки формули (І) за будьяким з пп. 1-8 для одержання лікарського засобу, призначеного для профілактики симптомів, пов'язаних з тютюнопалінням, алкоголізмом, вживанням різних речовин, що викликають залежність. 18. Застосування сполуки формули (І) за будьяким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування болю. 19. Застосування сполуки формули (І) за будьяким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування ішемії нижніх кінцівок, облітеруючого артриту нижніх кінцівок, ішемічної хвороби серця, інфаркту міокарда, серцевої недостатності, недостатнього загоювання шкірного покриву у хворих діабетом, варикозних виразок при венозній недостатності. 20. Застосування сполуки формули (І) за будьяким з пп. 1-8 для одержання лікарського засобу, призначеного для лікування запальних процесів. в якій R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, ізотіазолілу, тіадіазолілу, тетразолілу, причому вказана група, можливо, заміщена однією або декількома групами, вибраними з галогенів, (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1С6)алкіламіно або ді(С1-С6)алкіламіно; 7 зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним. До того ж, атом вуглецю у положенні 5 азабіцикло[3.2.1]октанового кільця є асиметричним, так що сполуки за винаходом можуть мати форму двох енантіомерів або їх суміші. Ці енантіомери, а також їх суміші, включаючи рацемічні суміші, є частиною винаходу. Сполуки формули (І) можуть також бути у вигляді основ або адитивних солей з кислотами. Такі адитивні солі є частиною винаходу. Ці солі можна одержувати за допомогою фармацевтично прийнятних кислот, але солі інших кислот, придатних, наприклад, для очищення або виділення сполук формули (І), також є частиною винаходу. Сполуки формули (І) можуть також бути у вигляді гідратів або сольватів, а саме, у вигляді асоціацій або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати або сольвати також є частиною винаходу. В об'ємі даного винаходу розуміють під: атомом галогену: атом фтору, хлору, брому або йоду; алкільною групою: аліфатичну насичену групу, лінійну або розгалужену. Як приклади можна назвати групи: метил, етил, пропіл, ізопропіл, бутил, ізобутил, третбутил, пентил і т.д.; групою алкокси: радикал -О-алкіл, алкільна група якого є такою, як визначена вище. Зі сполук формули (І), які є об'єктом винаходу, перша підгрупа сполук складається зі сполук, в яких R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, ізотіазолілу, тіадіазолілу, тетразолілу, причому ця група може бути заміщена однією або декількома групами (С1-С6)алкілу, більш конкретно - метилу; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним. Зі сполук формули (І), відповідно до винаходу, друга підгрупа сполук складається зі сполук, в яких R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, ізотіазолілу, тіадіазолілу, тетразолілу, причому ця група може бути заміщена однією або декількома групами (С1-С6)алкілу, більш конкретно - метилу, ізобутилу і н-пропілу; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним. Зі сполук формули (І), відповідно до винаходу, третя підгрупа сполук складається зі сполук, в яких R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, тетразолілу, причому ця група може бути заміщена однією або декількома групами, вибраними з галогенів, (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1С6)алкіламіно; і 92917 8 зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним. Зі сполук формули (І), відповідно до винаходу, четверта підгрупа сполук складається зі сполук, в яких R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, тетразолілу, причому ця група може бути заміщена однією або декількома групами (С1С6)алкілу, більш конкретно - метилу; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним. Зі сполук формули (І), відповідно до винаходу, п'ята підгрупа сполук складається зі сполук, в яких R означає групу, вибрану з піразолілу, імідазолілу, триазолілу, оксазолілу, оксадіазолілу, тіазолілу, тетразолілу, причому ця група може бути заміщена однією або декількома групами (С1С6)алкілу, більш конкретно - метилу, ізобутилу і нпропілу; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним. Зі сполук формули (І), відповідно до винаходу, шоста підгрупа сполук складається зі сполук, в яких R означає групу піразолілу, можливо, заміщену однією або декількома групами (С1-С6)алкілу, (С1-С6)алкокси, трифторметокси, трифторметилу, нітро, ціано, гідрокси, аміно, (С1-С6)алкіламіно або ді(С1-С6)алкіламіно; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним. Зі сполук формули (І), відповідно до винаходу, сьома підгрупа сполук складається зі сполук, в яких R означає групу піразолілу, можливо, заміщену однією або декількома групами (С1-С6)алкілу, більш конкретно - метилу, ізобутилу або н-пропілу; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим або подвійним. Зі сполук формули (І), відповідно до винаходу, восьма підгрупа сполук складається зі сполук, в яких R означає групу піразолілу, можливо, заміщену однією або декількома групами (С1-С6)алкілу, більш конкретно - метилу, ізобутилу або н-пропілу; і зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим. Зі сполук формули (І), відповідно до винаходу, можна назвати сполуки формули: 5-[2-(1-метил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]окт-3-ен; 5-[2-(1-метил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]окт-3-ен; 9 5-[2-(1Н-імідазол-1-іл)піридин-5-іл]-1азабіцикло[3.2.1]окт-3-ен; 5-[2-(1Н-імідазол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]окт-3-ен; 5-[2-(1Н-імідазол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-імідазол-1-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1Н-імідазол-2-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(3,5-диметил-1Н-піразол-4-іл)піридин-5іл]-1-азабіцикло[3.2.1]октан; 5-[2-(1Н-1,2,4-триазол-3-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(5-метил-1,2,4-оксадіазол-3-іл)піридин-5іл]-1-азабіцикло[3.2.1]октан; 5-[2-(1,3-оксазол-2-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(тіазол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(піразол-3-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(2-метилтіазол-5-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(тетразол-5-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; 5-[2-(1-ізобутил-1Н-піразол-4-іл)піридин-5-іл]1-азабіцикло[3.2.1]октан; 5-[2-(1-н-пропіл-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан; у вигляді основи або адитивної солі з кислотою, а також у вигляді гідрату або сольвату; у вигляді чистого енантіомеру або суміші енантіомерів. Далі у тексті під захисною групою розуміють групу, яка дозволяє, з одного боку, захищати реакційноздатну функціональну групу, таку як гідрокси або амін під час синтезу і, з іншого боку, регенерувати інертну функціональну групу у кінці синтезу. Приклади захисних груп, а також способи захисту і зняття захисту наведені у "Protective Groups in Organic Synthesis", Green et al., 2 видання (John Wiley & Sons, Inc. New York), 1991. Далі у тексті під відхідною групою розуміють групу, яка може легко відщеплюватися від молекули гетеролітичним розривом зв'язку з відділенням електронної пари. Таким чином, цю групу можна легко замінити іншою групою, наприклад, за реакцією заміщення. Такими відхідними групами, наприклад, є галогени або активовані гідроксигрупи, такі як метансульфонат, бензолсульфонат, птолуолсульфонат, трифлат, ацетат і т.д. Приклади відхідних груп, а також посилання на їх одержання наведені в "Advances in Organic Chemistry", J.March, 3 видання, Wiley Interscience, 1985, стор. 310-316. Сполуки формули (І) можна одержувати способом, наведеним на показаній нижче схемі 1. Проводять реакцію приєднання до літійвмісного аніону гетероциклічної сполуки загальної формули (III), в якій Ζ означає атом брому і W означає атом галогену у присутності 3-оксо-1азабіцикло[2.2.2]октану формули (II). Літійвмісний аніон гетероциклічної сполуки загальної формули 92917 10 (III) одержують обміном галоген-метал з похідним алкіллітію. Одержують сполуку формули (IV), з якої обробкою у кислому середовищі при нагріванні одержують сполуку формули (V). Каталітичне гідрування подвійного зв'язку приводить до сполуки формули (VI). Сполуки загальної формули (І), в якій зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового циклу є подвійним і R означає групу: піразоліл, імідазоліл, триазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізотіазоліл, тіадіазоліл або тетразоліл, можливо заміщену, одержують зі сполуки формули (V), в якій Ζ означає атом брому. Сполуки загальної формули (І), в якій зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового циклу є простим і R означає групу: піразоліл, імідазоліл, триазоліл, оксазоліл, оксадіазоліл, тіазоліл, ізотіазоліл, тіадіазоліл або тетразоліл, можливо заміщену, одержують зі сполуки формули (VI), в якій Ζ означає атом брому. Замісник R можна, таким чином, вводити у сполуку формули (V) або (VI), в якій Ζ означає атом брому, будь-якими відомими фахівцеві способами, наприклад: 11 з використанням боронової кислоти формули R-B(OH)2, в якій R є таким, як визначено для загальної формули (І), у присутності каталізатора, що містить паладій, наприклад, тетракістрифенілфосфінпаладію; з використанням сполуки формули R-H, в якій R є таким, як визначено для загальної формули (І), у присутності сильної основи, наприклад, гідриду натрію, у розчиннику, наприклад, диметилформаміді; з використанням похідного формули RSn[(CH2)3CH3]3, що містить двовалентне олово, в якій R є таким, як визначено для загальної формули (І), у присутності каталізатора, що містить паладій, наприклад, біс(трифенілфосфіно)дихлорпаладію; з використанням сполуки формули R-H, в якій R є таким, як визначено для загальної формули (І), у присутності н-бутиллітію, хлориду цинку і каталізатора, що містить паладій, наприклад, тетракістрифенілфосфінпаладію; Сполуки загальної формули (І), в якій зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового циклу є простим і R означає групу: триазоліл, оксадіазоліл або тетразоліл, можливо, заміщену, одержують зі сполуки формули (VII) Наприклад: якщо R означає триазоліл, сполуку формули (І) можна одержати зі сполуки формули (VII) у присутності такої сильної основи, як розчин метилату натрію, і мурашиного гідразину у розчиннику, такому як метанол. якщо R означає оксадіазоліл, сполуку формули (І) можна одержати у дві стадії зі сполуки формули (VII), спочатку перетворенням в Nгідроксикарбоксамідин формули (VIII) наприклад, у присутності гідроксиламінхлоргідрату у лужному середовищі, з подальшою взаємодією одержаної таким чином сполуки формули (VIII) з оцтовим ангідридом у такому розчиннику, як піридин, для одержання цільової сполуки формули (І), якщо R означає тетразоліл, сполуку формули (І) можна одержати зі сполуки формули (VII) у присутності азиду натрію і хлориду амонію у такому розчиннику, як диметилформамід. Сполуку формули (VII) одержують зі сполуки формули (VI), в якій Ζ означає атом брому, у при 92917 12 сутності, наприклад, ціаніду калію і тетракістрифенілфосфінопаладію у такому розчиннику, як диметилформамід. Одержання сполуки формули (V), в якій R означає атом брому, описане у WO 03057697. 3-оксо-1-азабіцикло[2.2.2]октан формули (II) є комерційно доступним. Сполуки формули (III) є комерційно доступними або їх можна одержати способами, описаними у літературі. На схемі 1 представлені вихідні сполуки і реагенти, якщо спосіб їх одержання не описаний, вони є комерційно доступними або описані у літературі, або їх можна одержати способами, відомими фахівцеві. Відповідно до іншого з аспектів винаходу, об'єктом винаходу є також сполуки формул (IV), (V), (VI), (VII) і (VIII). Ці сполуки придатні як проміжні продукти синтезу сполук загальної формули (І). У наведених нижче прикладах описане одержання деяких сполук за винаходом. Ці приклади не мають на меті обмеження даного винаходу, а представлені тільки в ілюстративних цілях. Номери сполук, наведені у дужках у назвах, відповідають номерам у першій колонці наведеної нижче таблиці, в якій представлені хімічні структури і фізичні властивості деяких сполук за винаходом. Приклад 1 (сполука 1) (-)-Бромгідрат (2:1) 5-[2-(1-метил-1Н-піразол-4іл)піридин-5-іл]-1-азабіцикло[3.2.1]октану 1.1 бромгідрат (1:1) 5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану У колбу для проведення гідрування вносять 1,95 г (7,354 ммоль) 5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]окт-3-ену (WO 03057697) у 40 мл метанолу, потім 195 мг оксиду платини суспендують. Середовище перемішують при кімнатній температурі і тиску водню 26 psi протягом 45 хвилин. Фільтрують реакційне середовище через діатоміт і розчинник видаляють випарюванням при зниженому тиску. Одержаний осад очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 95/5/0,5. Одержують 1,4 г 5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану у вигляді воскоподібного масла. Потім одержують сіль бромгідрату (1:1) 5-(2бромпіридин-5-іл)-1-азабіцикло[3.2.1]октану додаванням 1 еквіваленту розчину 5,7 N бромистоводневої кислоти в оцтовій кислоті. Одержують 1,82 г цільового продукту. 1.2 (+) і (-)-бромгідрати (1:1) 5-(2-бромпіридин5-іл)-1-азабіцикло[3.2.1]октану Рацемічну суміш бромгідрату (1:1) 5-(2бромпіридин-5-іл)-1-азабіцикло[3.2.1]октану, одержану на стадії 1.1, розділяють рідинною хроматографією на хіральному носії до одержання правообертальних і лівообертальних енантіомерів відповідно, (+)бромгідрат (1:1) 5-(2-бромпіридин-5іл)-1-азабіцикло[3.2.1]октану і (-)бромгідрат (1:1) 5(2-бромпіридин-5-іл)-1-азабіцикло[3.2.1]октану. (+)Бромгідрат (1:1) 5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану: [ 20D]=+24,4° (c=1, CH3OH) (-)Бромгідрат(1:1) 5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану: [ 20D]=-23,1° (c=1, CH3OH) 13 1.3 (-)Бромгідрат (2:1) 5-[2-(1-метил-1Нпіразол-4-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октану У тригорлу колбу, об'ємом 10 мл, послідовно вносять 0,162 г (0,78 ммоль) 1-метил-4піразолілборонової кислоти, 0,160 г (0,6 ммоль) ()5-(2-бромпіридин-5-іл)-1-азабіцикло[3.2.1]октану (одержаного взаємодією (-)-бромгідрату (1:1) 5-(2бромпіридин-5-іл)-1-азабіцикло[3.2.1]октану, одержаного на стадії 1.2, з насиченим водним розчином карбонату натрію) у розчині у 3 мл толуолу і 0,3 мл етанолу. Потім додають 0,035 г (0,03 ммоль) тетракіс(трифенілфосфіно)паладію і 0,6 мл водного розчину 2М карбонату натрію і нагрівають суміш до 105°С протягом 18 годин. Охолоджують до кімнатної температури, випарюють розчинник при зниженому тиску і залишок обробляють у 10 мл хлороформу і фільтрують через діатоміт. Концентрують розчинник при зниженому тиску і залишок очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 95/5/0,5. Одержують 0,15 г (-) 5-[2-(1-метил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октану, який розчиняють у 2 мл ізопропілового спирту, і додають 0,196 мл розчину 5,7 N бромистоводневої кислоти в оцтовій кислоті. Одержані кристали збирають фільтруванням і сушать у вакуумі. Одержують 0,163 г продукту. Температура плавлення: 259-261°С. 1 Н-ЯМР (DMSO) (ч/млн): 8,50 (1Н, с); 8,45 (1Н, с); 8,15 (1Н, с); 8,10 (1Н, д); 7,95 (1Н, д); 4,00 (3Н, с); 3,85-3,10 (6Н, м); 2,50-1,80 (6Н, м). [ 20D]=-24,4° (c=1, CH3OH) Сполука 2 була одержана способом, описаним у прикладі 1. Сполуки 3 і 4 були одержані способом, описаним у прикладі 1, з 5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]окт-3-ену (WO 03057697). Сполуки 12, 13 і 15 були одержані способом, описаним у прикладі 1, з (+)5-(2-бромпіридин-5-іл)1-азабіцикло[3.2.1]октану, одержаного на стадії 1.2. Приклад 2 (сполука 24) (+)-(S,S)-дибензоїлтартрат (1:1) 5-[2-(1-метил1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октану 2.1 (+/-)-5-[2-(1-метил-1Н-піразол-4-іл)піридин5-іл]-1-азабіцикло[3.2.1]октан (сполука 28) У тригорлу колбу, об'ємом 250 мл, послідовно вносять 7,08 г (34,06 ммоль) 1-метил-4піразолілборонової кислоти, 7,0 г (26,20 ммоль) (+/-)-5-(2-бромпіридин-5-іл) азабіцикло[3.2.1]октану, одержаного на стадії 1.1. прикладу 1 у розчині в 140 мл толуолу і 14 мл етанолу. Потім додають 1,82 г (1,57 ммоль) тетракіс(трифенілфосфіно)паладію і 26,20 мл (52,40 ммоль) водного розчину 2М карбонату натрію і нагрівають суміш до 90°С протягом 12 годин. Реакційне середовище охолоджують до кімнатної температури, виливають у 50 мл води, двічі екстрагують хлороформом і об'єднані органічні фази сушать над сульфатом натрію, фільтрують і випарюють у вакуумі. Одержаний залишок очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропо 92917 14 рціях 95/5/0,5. Одержують 5,30 г цільового продукту у вигляді порошку світло-жовтого кольору. Температура плавлення: 138-140°С 1 Н-ЯМР (DMSO) (ч/млн): 8,37 (1Н, д); 8,19 (1H, с); 7,90 (1Н, с); 7,58 (1Н, дд); 7,50 (1Н, дд); 3,87 (3Н, с); 3,09-2,60 (6Н, м); 2,21-1,31 (6Н, м). 2.2 (+)-(S,S)-дибензоїлтартрат (1:1) 5-[2-(1метил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан У колбі, об'ємом 250 мл, розчиняють 9,70 г (36,15 ммоль) (+/-)-5-[2-(1-метил-1Н-піразол-4іл)піридин-5-іл]-1-азабіцикло[3.2.1]октану, одержаного на стадії 2.1, у 100 мл етанолу, додають 13,08 г (36,51 ммоль) (S,S)-дибензоїлвинної кислоти, реакційне середовище перемішують при кімнатній температурі протягом 5 хвилин і концентрують при зниженому тиску. Одержану тверду речовину розчиняють у 50 мл етанолу, потім нагрівають зі зворотним холодильником до повного розчинення. Середовище повільно доводять до кімнатної температури. Одержані кристали фільтрують, потім сушать у вакуумі і одержують 7,10 г цільового продукту з оптичною чистотою 95,4%. Ці кристали перекристалізовують в описаних вище умовах у 25 мл етанолу і одержують 5,54 г (+)-(S,S)-дибензоїлтартрат (1:1) 5-[2-(1-метил-1Н-піразол-4-іл)піридин-5-іл]-1азабіцикло[3.2.1]октану у вигляді кристалів білого кольору з оптичною чистотою 98,8%. Температура плавлення: 156-158°С. [ 20D]=+78,5° (c=0,558, СН3ОН) 1 Н-ЯМР (DMSO) (ч/млн): 8,39 (с, 1Н,); 8,22 (с, 1Н,); 7,92 (с, 1Н,); 7,90-7,78 (м, 4Н); 7,65-7,35 (м, 8Н); 5,60 (с, 2Н); 3,86 (с, 3Н); 3,62-2,96 (м, 8Н); 2,54-1,65 (м, 6Н). Приклад 3 (сполука 5) Бромгідрат (1:1) 5-[2-(1Н-імідазол-1-іл)піридин5-іл]-1-азабіцикло[3.2.1]окт-3-ену У тригорлу колбу, об'ємом 10 мл, вводять 0,64 г (9,42 ммоль) імідазолу у розчині в 3 мл диметилформаміду. Потім додають 0,415 г (10,4 ммоль) 60%-ної дисперсії гідриду натрію у маслі і перемішують при кімнатній температурі протягом 1 години. Потім у суміш вводять розчин 5-(2бромпіридин-5-іл)-1-азабіцикло[3.2.1]окт-3-ену (WO03057697) (0,5 г, 1,89 ммоль) у диметилформаміді і реакційне середовище нагрівають до 85°С протягом 15 годин, потім - до 110°С протягом 24 годин, і розчинник випарюють при зниженому тиску. Залишок обробляють у 10 мл хлороформу і 10 мл насиченого водного розчину карбонату натрію. Водну фазу знову екстрагують 10 мл хлороформу і об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Залишок очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 95/5/0,5. Одержують 0,235 г 5-[2-(1Н-імідазол-1іл)піридин-5-іл]-1-азабіцикло[3.2.1]окт-3-ену, який розчиняють у 3 мл ізопропілового спирту і додають 0,327 мл розчину бромистоводневої кислоти 5,7 N в оцтовій кислоті. Утворені кристали збирають фільтруванням і сушать у вакуумі. Температура плавлення: 233-235°С. 15 1 Н-ЯМР (DMSO) (ч/млн): 8,55 (1Н, с); 8,50 (1Н, с); 8,05 (1Н, д); 7,95 (1Н, с); 7,85 (1Н, д); 7,15 (1Н, с); 6,15 (1Н, д); 5,75 (1Н, д); 4,20-4,10 (1Н, д); 4,00-3,40 (5Н, м); 2,80-2,60 (1Н, т); 2,45-2,30 (1Н, т). Сполука 8 була одержана способом, описаним у прикладі 3 з (-)-5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану, одержаного на стадії 1.2 прикладу 1. Сполука 11 була одержана методом, описаним у прикладі 3 з (+)-5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану, одержаного на стадії 1.2 прикладу 1. Приклад 4 (сполука 6) Хлоргідрат (3:1) 5-[2-(1Н-імідазол-4-іл)піридин5-іл]-1-азабіцикло[3.2.1]окт-3-ену 4.1 5-[2-(1-трифенілметилімідазол-4іл)піридин-5-іл]-1-азабіцикло[3.2.1]окт-3-ен У тригорлу колбу, об'ємом 10 мл, послідовно вносять 0,25 г (0,94 ммоль) 5-(2-бромпіридин-5-іл)1-азабіцикло[3.2.1]окт-3-ену (WO03057697) у розчині у 3 мл тетрагідрофурану, 1,24 г (2,07 ммоль) 1-трифенілметил-4-трибутилстанілімідазолу і 0,06г (0,08 ммоль) біс(трифенілфосфіно)дихлорпаладію. Суміш нагрівають до 85°С протягом 15 годин, потім розбавляють 10 мл хлороформу і 10 мл насиченого водного розчину карбонату натрію. Водну фазу знову екстрагують 10 мл хлороформу і об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Залишок очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 97/3/0,3. Одержують 0,36 г цільового продукту у вигляді твердої аморфної речовини. 4.2 Хлоргідрат (3:1) 5-[2-(1Н-імідазол-1іл)піридин-5-іл]-1-азабіцикло[3.2.1]окт-3-ену У тригорлу колбу, об'ємом 10 мл, вносять 0,36 г (0,733 ммоль) 5-[2-(1-трифенілметилімідазол-4іл)піридин-5-іл]-1-азабіцикло[3.2.1]окт-3-ену, одержаного на стадії 4.1, у розчині у 4 мл метанолу. Потім додають 0,8 мл розчину 6N соляної кислоти в ізопропіловому спирті і реакційне середовище нагрівають до 80°С протягом 3 годин. Розчинник концентрують при зниженому тиску і залишок розтирають у простому діетиловому ефірі. Одержані кристали збирають фільтруванням і сушать у вакуумі. Температура плавлення: 306-308°С. 1 Н-ЯМР (DMSO) (ч/млн): 11,95 (1Н, с); 9,20 (1Н, с); 8,65 (1Н, с); 8,40 (1Н, с); 8,10 (1Н, д); 8,00 (1Н, д); 6,20 (1Н, д); 5,75 (1Н, дт); 4,15 (1Н, д); 3,95-3,35 (5Н, м); 2,80-2,60 (1Н, т); 2,45-2,30 (1Н, т). Сполука 7 була одержана способом, описаним у прикладі 4, з (-)-5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану, одержаного на стадії 1.2 прикладу 1. Сполука 9 була одержана способом, описаним у прикладі 4, з (+)-5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану, одержаного на стадії 1.2 прикладу 1. Приклад 5 (сполука 10) 92917 16 (-)-Хлоргідрат (2:1) 5-[2-(1Н-імідазол-2іл)тридин-5-іл]-1-азабіцикло[3.2.1]октану 5.1 (-)-5-[2-(1Н-імідазол-2-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан У тригорлу колбу, об'ємом 25 мл, вводять 1 г (5,7 ммоль) 1-(диметиламіносульфоніл)імідазолу у розчині у 9 мл тетрагідрофурану. Реакційне середовище охолоджують до -78°С і додають протягом 20 хвилин по краплях 4 мл розчину 1,6 Μ нбутиллітію у гексані. Потім додають 0,73 г (5,4 ммоль) хлориду цинку у розчині в 4 мл тетрагідрофурану. Перемішують, при цьому температура підіймається до 20°С, потім додають послідовно 1,5 г (11,1 ммоль) хлориду цинку, 0,1 г (0,09 ммоль) тетракіс(трифенілфосфіно)паладію і 0,56 г (2,1 ммоль) (-)-5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану (одержаного способом, описаним у стадії 1.2 прикладу 1) у розчині в 5 мл тетрагідрофурану. Потім суміш нагрівають зі зворотним холодильником протягом 24 годин, після чого охолоджують до кімнатної температури. Додають 30 мл 30%-ного водного розчину гідроксиду натрію і 50 мл хлороформу. Водну фазу екстрагують хлороформом, потім об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Залишок очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 95/5/0,5 і використовують на наступній стадії. 5.2. (-)-Хлоргідрат (2:1) 5-[2-(1Н-імідазол-2іл)піридин-5-іл]-1-азабіцикло[3.2.1]октану Продукт, одержаний на стадії 5.1, розчиняють у 10 мл діоксану і 1,5 мл водного розчину соляної кислоти 2N. Середовище перемішують протягом 2 годин при кімнатній температурі, потім розчинник випарюють при зниженому тиску. Залишок обробляють 30 мл хлороформу і 30 мл насиченого водного розчину карбонату натрію. Водну фазу екстрагують хлороформом і об'єднані органічні фази сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Одержаний залишок розчиняють у 5 мл ізопропілового спирту і обробляють надмірною кількістю соляної кислоти у розчині в ізопропіловому спирті. Одержані кристали збирають фільтруванням і сушать у вакуумі. Одержують 0,23 г продукту. Температура плавлення: 231-233°С. 1 Н-ЯМР (DMSO) (ч/млн): 11,45 (1Н, с); 8,75 (1Н, с); 8,55 (1Н, д); 8,05 (1Н, д); 7,80 (2Н, с); 3,75 (1Н, д); 3,60-3,10 (5Н, м); 2,55-1,75 (6Н, м). [ 20D]=-34,2° (c=0,26, СН3ОН) Сполуку 19 одержують способом, описаним у прикладі 5. Сполуку 20 одержують способом, описаним на стадії 5.1 у прикладі 5, з подальшою стадією зняття захисту у лужному середовищі у присутності 35%-ного водного розчину ізохорного гідроксиду натрію і діоксану при кімнатній температурі. Сполуки 18 і 21 одержують способом, описаним на стадії 5.1 у прикладі 5. Сполуку 14 одержують способом, описаним у прикладі 5, з 17 (+)-5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану, одержаного на стадії 1.2 прикладу 1. Приклад 6 (сполука 16) (-)-бромгідрат (2:1) 5-[2-(1Н-1,2,4-триазол-3іл)піридин-5-іл]-1-азабіцикло[3.2.1]октану 6.1 (-)-(1-азабіцикло[3.2.1]окт-5-iл)піридин-2карбонітрил У реактор, об'ємом 25 мл, послідовно вводять 1,5 г (4,3 ммоль) бромгідрату (-)-5-(2-бромпіридин5-іл)-1-азабіцикло[3.2.1]октану (одержаного способом, описаним на стадії 1.2 у прикладі 1) у розчині в 12 мл диметилформаміду, 0,42 г (6,46 ммоль) ціаніду калію і 5 г (4,3 ммоль) тетракіс(трифенілфосфіно)паладію. Потім суміш нагрівають протягом 3 годин до 90°С, після чого нейтралізують насиченим водним розчином карбонату натрію. Водну фазу екстрагують хлороформом і об'єднані органічні фази сушать над сульфатом натрію, фільтрують і концентрують при зниженому тиску. Залишок очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 95/5/0,5, одержують, таким чином, 0,705 г цільового продукту у вигляді твердої аморфної речовини. 6.2 (-)-бромгідрат (2:1) 5-[2-(1Н-1,2,4-триазол3-іл)піридин-5-іл]-1-азабіцикло[3.2.1]октану У реактор, об'ємом 10 мл, послідовно вводять 0,22 г (1,03 ммоль) (-)-(1-азабіцикло[3.2.1]окт-5іл)піридин-2-карбонітрилу, одержаного на стадії 6.1 у розчині в 3 мл метанолу. Продувають аргоном і потім додають 0,04 мл (0,26 ммоль) розчину 5,25 N метилату натрію у метанолі і перемішують протягом 15 хвилин при кімнатній температурі, додають 0,065 г (1,08 ммоль) мурашиного гідразиду. Потім середовище нагрівають до 85°С протягом 24 годин і розчинник випарюють. Залишок очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 85/15/1,5. Одержують, таким чином, 0,155 г (-)-5-[2-(1Н-1,2,4-триазол-3-іл)піридин-5-іл]1-азабіцикло[3.2.1]октану, який обробляють 0,19 мл розчином 5,7 N бромистоводневої кислоти в оцтовій кислоті. Одержані кристали збирають фільтруванням і сушать у вакуумі. Температура плавлення: 215-217°С. 1 Н-ЯМР (DMSO) (ч/млн): 10,15 (1Н, с); 8,65 (1Н, с); 8,40 (1Н, с); 8,10 (1Н, д); 7,95 (1Н, д); 3,803,10 (6Н, м); 2,30-1,75 (6Н, м). [ 20D]=-19,9° (c=1, CH3OH) Сполуку 22 одержують способом, описаним у прикладі 6, з (+)-(1-азабіцикло[3.2.1]окт-5іл)піридин-2-карбонітрилу, одержаного з (+)-5-(2бромпіридин-5-іл)-1-азабіцикло[3.2.1]октану (одержаного способом, описаним на стадії 1.2 у прикладі 1). Приклад 7 (сполука 17) (-)-Бромгідрат (1:1) 5-[2-(5-метил-1,2,4оксадіазол-3-іл)піридин-5-іл]-1азабіцикло[3.2.1]октану 7.1 (-)-5-(1-азабіцикло[3.2.1]окт-5-іл)-Nгідроксипіридин-2-карбоксамідин У реактор, об'ємом 10 мл, послідовно вводять 0,3 г (1,4 ммоль) (-)-(і-азабіцикло[3.2.1]окт-5іл)піридин-2-карбонітрилу, одержаного способом, 92917 18 описаним на стадії 6.1 у прикладі 5, 0,39 г (5,63 ммоль) гідроксиламінхлоргідрату, 0,78 г (5,65 ммоль) карбонату калію і 5 мл етилового спирту. Суміш нагрівають зі зворотним холодильником протягом 3 годин, потім фільтрують. Фільтрат концентрують при зниженому тиску, залишок обробляють 10 мл води. Водну фазу екстрагують хлороформом і об'єднані органічні фази промивають насиченим водним розчином карбонату натрію, сушать над сульфатом натрію і випарюють у вакуумі. Одержують таким чином 0,29 г продукту у вигляді твердої аморфної речовини. 7.2 (-)-Бромгідрат (1:1) 5-[2-(5-метил-1,2,4оксадіазол-3-іл)піридин-5-іл]-1азабіцикло[3.2.1]октану У реактор, об'ємом 10 мл, вводять 0,28 г (1,14 ммоль) (-)-5-(азабіцикло[3.2.1]окт-5-іл)-Nгідроксипіридин-2-карбоксімідаміду, одержаного на стадії 7.1, у розчині в 10 мл піридину. Потім додають 0,1 мл (1,13 ммоль) оцтового ангідриду і середовище перемішують при кімнатній температурі протягом 15 годин, потім нагрівають до 110°С протягом 5 годин. Розчинник концентрують при зниженому тиску і залишок обробляють насиченим водним розчином карбонату натрію. Водну фазу екстрагують хлороформом і об'єднані органічні фази сушать над сульфатом натрію, фільтрують і випарюють у вакуумі. Залишок очищають хроматографією на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 96/4/0,4. Одержують таким чином 0,077 г (-)-5-[2(5-метил-1,2,4-оксадіазол-3-іл)піридин-5-іл]-1азабіцикло[3.2.1]октану, який розчиняють в 1 мл ізопропілового спирту і вводять 0,05 мл розчину бромистоводневої кислоти 5,7 N в оцтовій кислоті. Одержані кристали збирають фільтруванням і сушать при зниженому тиску. Температура плавлення: 321-323°С. 1 Н-ЯМР (DMSO) (ч/млн): 8,70 (1Н, с); 8,05 (1Н, д); 7,95 (1Н, д); 3,80-3,20 (6Н, м); 3,70 (3Н, с); 2,35-1,75 (6Н, м). [ 20D]=-26,4° (c=1, СН3ОН) Приклад 8 (сполука 23) (+)-5-[2-(2Н-тетразол-5-іл)піридин-5-іл]-1азабіцикло[3.2.1]октан У реактор, об'ємом 10 мл, послідовно вводять 0,350 г (4,64 ммоль) (+)-(1-азабіцикло[3.2.1]окт-5іл)піридин-2-карбонітрилу, (одержаного способом, аналогічним описаному на стадії 6.1 у прикладі 6, з (+)-5-(2-бромпіридин-5-іл)-1азабіцикло[3.2.1]октану, одержаного на стадії 1.2 прикладу 1), 0,117 г (1,80 ммоль) азиду натрію, 0,022 г (0,4 ммоль) хлориду амонію і 2 мл диметилформаміду. Потім суміш нагрівають до 80°С протягом 15 годин, потім розчинник випарюють при зниженому тиску. Залишок обробляють метанолом при кімнатній температурі. Нерозчинену речовину, що утворилася, відфільтровують і фільтрат концентрують при зниженому тиску. Залишок піддають хроматографії на колонці силікагелю, елююючи сумішшю хлороформу, метанолу і аміаку у пропорціях 80/20/2. Одержують таким чином 0,368 г продукту у вигляді кристалів. Температура плавлення: 319-321°С. 19 92917 1 Н-ЯМР (DMSO) (ч/млн): 8,45 (1Н, с); 7,95 (1Н, д); 7,70 (1Н, д); 3,60-3,10 (6Н, м); 2,45-1,70 (6Н, м). [ 20D]=+25,2° (c-0,06, DMSO) У таблиці 1 представлені хімічні структури і фізичні властивості декількох прикладів за винаходом. У цій таблиці: у колонці "DL" «=» означає, що зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є подвійним, і «-» означає, що зв'язок вуглець-вуглець між положеннями 3 і 4 азабіциклооктанового кільця є простим; 20 у колонці «Сіль» «-» означає сполуку у вигляді основи, "HBr" означає бромгідрат і "HCl" означає хлоргідрат. Молярні співвідношення кислота до основи вказані у колонці «Сіль» навпроти кислоти; 20 у колонці [ D] (CH3OH) вказана величина означає здатність сполуки до обертання, причому концентрація у г/100мл у метанолі, при якій це вимірювання було виконане, вказана у дужках; сполуки, навпроти яких у цій колонці стоїть прочерк, є рацематами. Таблиця 1 N D1 R Сіль 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 = == = 1-СН3-4-піразоліл 4-піразоліл 4-піразоліл 1-СН3-4-піразоліл 1-імідазоліл 4-імідазоліл 4-імідазоліл 1-імідазоліл 4-імідазоліл 2-імідазоліл 1-імідазоліл 4-піразоліл 1-СН3-4-піразоліл 2-імідазоліл 3,5-(СН3)2-4-піразоліл 3-(1,2,4-триазоліл) 3-(5-СН3-1,2,4-оксадіазоліл) 2-(1,3-оксазоліл) 4-тіазоліл 3-піразоліл 2-СН3-5-тіазоліл 3-(1,2,4-тіазоліл) 5-тетразоліл 1-СН3-4-піразоліл 1-СН3-4-піразоліл 1-СН3-4-піразоліл 1-СН3-4-піразоліл 1-СН3-4-піразоліл 1-ізобутил-4-піразоліл 1-н-пропіл-4-піразоліл HBr 2:1 HBr 1:1 HBr 2:1 HBr 2:1 HBr 1:1 HCl 3:1 HCl 3:1 HBr 1:1 HCl 2:1 HCl 2:1 HBr 1:1 HBr 2:1 HBr 2:1 HBr 2:1 HBr 2:1 HBr 2:1 HBr 1:1 HBr 1:1 HBr 1:1 HBr 1:1 HBr 2:1 (S,S)-дибензоїлтартрат 1:1 Фумарат 1:1 HCl 2:1 HBr 2:1 HBr 2:1 [ 20 D] (СН3ОН) -24,4 (с=1) -24,8 (с=0,8) -14,2(с=0,9) +23,6 (с=1) -34,2 (с=0,26) +22,2 (с=1) +23,6 (с=1) +22,1 (с=1) +18,3 (с=1) +19,6 (с=1) -19,9 (с=1) -26,4 (с=1) -37,5 (с=0,4) -27,7 (с=1) +23,8 (с=0,38) -23,2 (с=0,36) +20,5 (с=1) +25,2 (с=0,06)* +78,5 (с=0,558) +36,1 (с=0,49) +17,4 (с=0,55) +29,4 (с=0,48) -24,7 (с=1) -21,8 (с=1) ТК (°С) (точка кипіння) 259-261 293-295 322-324 294-296 233-235 306-308 292-294 191-193 288-290 231-233 233-235 285-287 247-249 234-236 321-323 215-217 321-323 115-117 272-274 273-275 267-269 215-217 319-321 156-158 142-144 200-202 191-193 138-140 104-106 190-192 *розчинник: DMSO Сполуки за винаходом були піддані фармакологічним випробуванням, які представляють інтерес як активні лікарські засоби. Таким чином, вивчали їх спорідненість до нікотинових рецепторів, які містять підгрупу 7, способами, описаними Mark et Collins у 21 92917 J.Pharmacol.Exp.Ther.1982, 22, 564 і Marks et coll. у Mol.Pharmacol. 1986,30,427. Обезголовлюють самців турів OFA вагою від 150 до 200 г, швидко дістають весь мозок, гомогенізують гомогенізатором Polytron в 15 об'ємах розчину сахарози 0,32 М при 4°С, потім центрифугують при 1000G протягом 10 хвилин. Видаляють осад і рідину, що відстоялася, центрифугують при 8000G протягом 20 хвилин при 4°С. Осад рекуперують і гомогенізують гомогенізатором Polytron в 15 об'ємах бідистильованої води при 4°С, потім центрифугують при 8000G протягом 20 хвилин. Видаляють осад і центрифугують рідину, що відстоялася, і шар шкіри ("buffy coat") при 40000G протягом 20 хвилин. Осад рекуперують, суспендують в 15 об'ємах бідистильованої води при 4°С і центрифугують повторно при 40000G протягом 20 хвилин до початку зберігання при -80°С. У день експерименту повільно розморожують тканину і суспендують в 5 об'ємах буфера. Заздалегідь інкубують 150 мл цієї мембранної суспензії при 37°С протягом 30 хв. у темряві у присутності або за відсутності сполуки, що тестується. Потім мембрани інкубують протягом 60 хвилин при 37°С у темряві у присутності 50 мкл [3Н]- бунгаротоксину 1 нМ у кінцевому об'ємі 250 мкл буфера HEPES 20 мМ, що містить поліетиленімін 0,05%. Реакцію зупиняють фільтруванням через фільтри Whatman GF/C , заздалегідь оброблені протягом 3 годин поліетиленіміном 0,05%. Фільтри обполіскують двічі 5 мл буфера при 4°С і вимірюють радіоактивність на кожному фільтрі рідинною сцинтиграфією. Визначають неспецифічний зв'язок у присутності -бунгаротоксину з кінцевою концентрацією 1 мкМ; неспецифічний зв'язок становить приблизно 60% загального зв'язку, одержаного на фільтрі. Для кожної концентрації досліджуваної сполуки визначають процент інгібування специфічного зв'язку [3Н]- -бунгаротоксину, потім обчислюють СІ50, концентрацію сполуки, що інгібує специфічний зв'язок на 50%. СІ50 сполук за винаходом, які володіють найбільшою спорідненістю, складає від 0,001 до 1 мкМ. Вивчали також спорідненість сполук за винаходом до нікотинових рецепторів, що містять підгрупу 4 2, способами, описаними Anderson et 22 Americ в Eur.J.Pharmacol. 1994, 253, 261 і Hall et coll. у Brain Res.1993, 600, 127. Обезголовлювали самців щурів Sprague Dawley вагою 150 - 200 г, швидко діставали весь мозок, гомогенізували в 15 об'ємах розчину сахарози 0,32 Μ при 4°С, потім центрифугували при 1000G протягом 10 хвилин. Видаляли осад і рідину, що відстоялася, центрифугували при 20000G протягом 20 хвилин при 4°С. Осад рекуперували і гомогенізували гомогенізатором Polytron в 15 об'ємах бідистильованої води при 4°С, потім центрифугували при 8000G протягом 20 хвилин. Видаляли осад і центрифугували рідину, що відстоялася, і шар шкіри ("buffy coat") при 40000G протягом 20 хвилин, осад рекуперували, суспендували в 15 об'ємах бідистильованої води і центрифугували повторно при 40000G до початку зберігання при -80°С. У день експерименту повільно розморожували тканину і суспендували у 3 об'ємах буфера. Інкубували 150 мл цієї мембранної суспензії при 4°С протягом 120 хв. у присутності 100 мкл [3Н]цитизину 1 нМ у кінцевому об'ємі 500 мкл буфера, у присутності або за відсутності сполуки, що тестується. Реакцію зупиняли фільтруванням через фільтри Whatman GF/B , заздалегідь оброблені поліетиленіміном, фільтри обполіскували двічі 5 мл буфера при 4°С і вимірювали радіоактивність на кожному фільтрі рідинною сцинтиграфією. Визначали неспецифічний зв'язок у присутності (-)нікотину 10 мкМ; неспецифічний зв'язок складав приблизно від 75 до 85% загального зв'язку, одержаного на фільтрі. Для кожної концентрації досліджуваної сполуки визначали процент інгібування специфічного зв'язку [3Н]-цитизину у дозах 1 мкМ і 10 мкМ. Для сполук за винаходом, що володіють найбільшою спорідненістю, обчислювали СІ50, концентрацію сполуки, яка інгібує специфічний зв'язок на 50%. СІ50 сполук за винаходом, які володіють найбільшою спорідненістю, складає від 0,2 до 10 мкМ. Експериментальні дані відносно декількох специфічних сполук вказані у наведеній нижче таблиці 2. Таблиця 2 Сполука N 11 14 9 СІ50 7 (мкМ) 0,083 0,099 0,3 Процент інгібування специфічного зв'язку [3Н]-цитизину при дозі 1 мкМ відносно підгрупи 4 36 45 24 Досліджували також спорідненість сполук за винаходом відносно периферичних нікотинових рецепторів вузлового типу способом, описаним Houghtling et coll. у Моl.Pharmacol. 1995, 48, 280. Розморожували бичачі надниркові залози, що зберігалися при -80°С, і гомогенізували гомогенізатором Polytron у 20 об'ємах буфера Tris-HCl 50 мМ, рН 7,4 при 4°С, потім центрифугували при 35000G протягом 10 хвилин. Видаляли рідину, що 2 (%) відстоялася, і суспендували осад в 30 об'ємах буфера Tris-HCl 50 мМ при 4°С і повторно гомогенізували перш ніж повторно центрифугувати при 35000G протягом 10 хвилин. Останній осад вмішували у 10 об'ємів буфера Tris-HCl при 4°С. Інкубували 100 мкл мембрани, тобто 10 мг свіжої тканини при 24°С протягом 3 годин у присутності 50 мкл [3Н]-епібатидину у кінцевій концентрації 0,66 нМ у кінцевому об'ємі 250 мкл буфера у присутності або 23 за відсутності сполуки, що тестується. Реакцію зупиняли розбавленням зразків буфером Tris-HCl 50 мМ, рН 7,4 при 4°С, потім фільтрували через фільтри Whatman GF/C , заздалегідь оброблені протягом 3 годин 0,5%-ним поліетиленіміном. Фільтри обполіскували двічі 5 мл буфера при 4°С і вимірювали радіоактивність на кожному фільтрі рідинною сцинтиграфією. Визначали неспецифічний зв'язок у присутності (-)-нікотину у кінцевій концентрації 2 мМ; неспецифічний зв'язок складав приблизно від 30 до 40% загального зв'язку, одержаного на фільтрі. Для кожної концентрації досліджуваного продукту визначали процент інгібування специфічного зв'язку [3Н]-епібатидину, потім обчислювали СІ50, концентрацію сполуки, яка інгібує специфічний зв'язок на 50%. СІ50 сполук за винаходом складає від 1 до 10 мкМ. Одержані результати показують, що деякі сполуки за винаходом є селективними лігандами для підгрупи 7 нікотинового рецептора, а інші є змішаними 4 2 і 7. Ці результати показують, що сполуки за винаходом можна використовувати для лікування або попередження розладів, пов'язаних з дисфункцією нікотинових рецепторів, зокрема, центральної нервової системи. До цих розладів належать когнітивні зміни, більш конкретно - мнезичні (сприйнятливість, консолідація, відгук), а також порушення уваги і порушення функцій виконання, пов'язані з хворобою Альцгеймера, патологічним (Age Associated Memory Impairment, AAMI) або нормальним (стареча деменція) старінням, з синдромом Паркінсона, трисомією 21 (синдром Дауна), з психічними патологіями (зокрема, з когнітивними порушеннями, асоційованими з шизофренією), корсаковським алкогольним синдромом, судинною деменцією (multi-infarct dementia, MDI), черепно-мозковими травмами. Сполуки за винаходом можуть також застосовуватися у лікуванні рухових порушень, що спостерігаються при хворобі Паркінсона або інших неврологічних захворюваннях, таких як хорея Гентінггона, синдром Турета, пізня дискінезія і гіперкінезія. Вони можуть також володіти терапевтичною нейрозахисною активністю відносно анатомо-гістопатологічних уражень, пов'язаних з вказаними нейродегенеративними захворюваннями. Сполуки за винаходом можуть також застосовуватися при терапевтичному або симптоматичному лікуванні порушення мозкового кровообігу і нападів церебральної гіпоксії. Їх можна застосовувати у випадку психіатричних патологій: шизофренії (позитивні і/або негативні симптоми), біполярних порушень, депресії, тривоги, панічних атак, порушень уваги, що супроводжуються гіперактивністю, компульсивних і нав'язливих станів. Вони можуть попереджати симптоми, пов'язані з тютюнопалінням, алкоголізмом, різними речовинами, що викликають залежність, такими як кокаїн, ЛСД, коноплі, бензодіазепіни. 92917 24 Вони можуть бути корисні при лікуванні болів різного походження (включаючи болі хронічного, неврологічного і запального характеру). До того ж, сполуки за винаходом можна використовувати при лікуванні ішемії нижніх кінцівок, облітеруючого артриту нижніх кінцівок (PAD: peripheral arterial disease), ішемічної хвороби серця (стійка стенокардія), інфаркту міокарда, серцевої недостатності, варикозних виразок при венозній недостатності. Сполуки відповідно до винаходу можуть також бути застосовані для лікування запальних станів різного походження, зокрема, для станів, пов'язаних з центральною нервовою системою. Сполуки за винаходом можна використовувати для одержання лікарських засобів, зокрема, лікарських засобів, придатних для лікування і попередження порушень, пов'язаних з дисфункцією нікотинових рецепторів, зокрема, порушень, вказаних вище. Так, відповідно до одного з аспектів, даний винахід стосується лікарських засобів, що містять сполуку формули (І), або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або гідрат, або сольват сполуки формули (І). Ці лікарські засоби застосовуються у терапії, зокрема, для лікування або профілактики порушень, пов'язаних з дисфункцією нікотинових рецепторів, зокрема, порушень, вказаних вище. Відповідно до іншого з аспектів, даний винахід стосується фармацевтичних композицій, що містять як активну речовину сполуку за винаходом. Ці фармацевтичні композиції містять ефективну дозу щонайменше однієї сполуки за винаходом або фармацевтично прийнятну сіль або гідрат, або сольват вказаної сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт. Вказані ексципієнти вибирають в залежності від фармацевтично прийнятної форми і необхідного способу введення з традиційних ексципієнтів, відомих фахівцеві. У фармацевтичних композиціях за даним винаходом для орального, сублінгвального, підшкірного, внутрішньом'язового, внутрішньовенного, місцевого, локального, інтратрахеального, через ніс, черезшкірного або ректального введення активну речовину вказаної вище формули (І) або, можливо, її сіль, сольват або гідрат можна вводити у разовій формі у суміші з класичними фармацевтичними ексципієнтами тваринам або людям для профілактики або лікування порушень або захворювань, вказаних вище. Відповідні разові форми введення містять форми перорального введення, такі як таблетки, м'які або тверді желатинові капсули, порошки, гранули, розчини або суспензії для перорального введення; форми введення: сублінгвальну, через рот, інтратрахеальну, через очі, через ніс, шляхом інгаляції, форми введення: місцеву, черезшкірну, підшкірну, внутрішньом'язову або внутрішньовенну; форми введення: ректальну та імплантати. Для місцевого застосування можна використовувати сполуки за винаходом у складі кремів, гелів, мазей і лосьйонів. 25 92917 Як приклад, форма для разового введення сполуки за винаходом у вигляді таблетки може містити наступні компоненти: Сполука за винаходом 50,0 мг Маніт 223,75 мг Натрієва кроскармелоза 6,0 мг Кукурудзяний крохмаль 15,0 мг Гідроксипропілметилцелюлоза 2,25 мг Стеарат магнію 3,0 мг. Вказані разові форми мають дозування, що забезпечує добове введення від 0,01 до 20 мг активної речовини на кг ваги тіла в залежності від галенової форми. Комп’ютерна верстка О. Гапоненко 26 В окремих випадках може бути потрібно збільшити або зменшити дозування, що не виходить за межі винаходу. Відповідно до звичайної практики, дозування для кожного пацієнта визначає лікар в залежності від способу введення, ваги тіла і відповіді даного пацієнта. Відповідно до одного з аспектів, даний винахід стосується також методу лікування вказаних вище патологій, що включає введення пацієнту ефективної дози сполуки за винаходом або однієї з її фармацевтично прийнятних солей або гідратів, або сольватів. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 5-pyridinyl-1-azabicyclo[3.2.1]octane, preparationmethod thereof and use of same in therapeutics
Автори англійськоюGalli Frederic, Leclerc Odile, Lochead Alistair, Vache Julien
Назва патенту російськоюПроизводные 5-пиридинил-1-азабицикло[3.2.1]октана, их получение и их применение в терапии
Автори російськоюГалли Фредерик, Леклерк Одиль, Локхед Алистер, Ваше Жюльен
МПК / Мітки
МПК: C07D 471/18, A61P 25/00, A61K 31/439
Мітки: застосування, похідні, одержання, терапії, 5-піридиніл-1-азабіцикло[3.2.1]октану
Код посилання
<a href="https://ua.patents.su/13-92917-pokhidni-5-piridinil-1-azabiciklo321oktanu-kh-oderzhannya-i-kh-zastosuvannya-u-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні 5-піридиніл-1-азабіцикло[3.2.1]октану, їх одержання і їх застосування у терапії</a>
Попередній патент: Охоплюючий швидкорознімний з’єднувальний елемент для труб
Наступний патент: Широкоформатний екран, що транспортується
Випадковий патент: Безперервнодіючий підземний генератор біоводню












