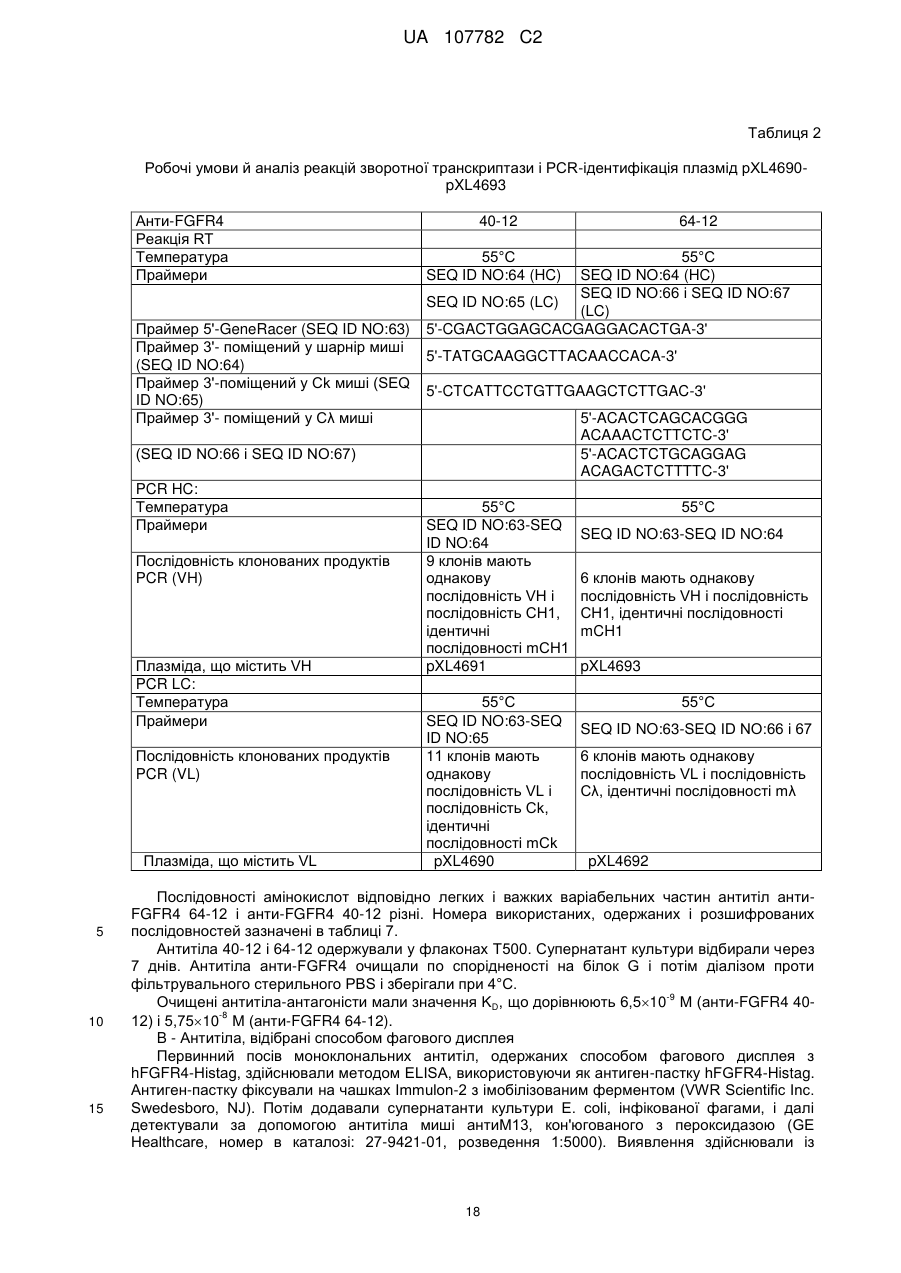
Антагоніст рецептора fgf-r4
Номер патенту: 107782
Опубліковано: 25.02.2015
Автори: Камерон Беатріс, Дабдубі Тарік, Міколь Венсан, Боно Франсуаз, Борен Ніколя, Ремі Елізабет, Ербер Корантен, Берн П'єр-Франсуа, Бланш Франсіс
Формула / Реферат
1. Антагоніст рецептора FGF-R4, який являє собою антитіло, що містить CDR послідовності SEQ ID NO:9, 10, 11, 12, 13 і 14 або 73, 74, 75, 78, 79 і 80, або 83, 84, 85, 88, 89 і 90, або 93, 94, 95, 98, 99 і 100, або 103, 104, 105, 108, 109 і 110, де один з CDR може відрізнятися однією або двома амінокислотами, у порівнянні щонайменше з однією із зазначених вище послідовностей, при тому, що антитіло зберігає свою специфічність зв'язування.
2. Антагоніст рецептора FGF-R4, який являє собою антитіло, у якому варіабельна частина його важкого ланцюга містить нуклеотидну послідовність, ідентичну щонайменше на 80 % послідовності SEQ ID NO:5, 76, 86, 96 або 106, і в якому варіабельна частина його легкого ланцюга містить нуклеотидну послідовність, ідентичну щонайменше на 80 % послідовності SEQ ID NO:7, 71, 81, 91 або 101, при тому, що антитіло зберігає свою специфічність зв'язування.
3. Антагоніст рецептора FGF-R4, який являє собою антитіло, послідовність якого містить поліпептидні послідовності SEQ ID NO:2 і 4 або 6 і 8, або 72 і 77, або 82 і 87, або 92 і 97, або 102 і 107, або послідовності, що відповідають таким послідовностям і ідентичні їм щонайменше на 80 %, при тому, що антитіло зберігає свою специфічність зв'язування.
4. Антагоніст рецептора FGF-R4 за будь-яким з пп. 1-3, який відрізняється тим, що він являє собою гуманізоване антитіло.
5. Антагоніст рецептора FGF-R4 за п. 4, який відрізняється тим, що він містить варіабельний легкий ланцюг, ідентичний щонайменше на 80 % одній з поліпептидних послідовностей SEQ ID NO:30 або 32, і варіабельний важкий ланцюг, ідентичний щонайменше на 80 % послідовності SEQ ID NO:34, 36 або 38.
6. Антагоніст рецептора FGF-R4 за будь-яким з пп. 1-5, який відрізняється тим, що він являє собою антитіло, кон'юговане з цитотоксичним агентом.
7. Фармацевтична композиція, яка містить антагоніст за будь-яким з пп. 1-6 і ексципієнти.
8. Спосіб лікування зв'язаного з патологічним ангіогенезом захворювання, який відрізняється тим, що він включає введення пацієнту антитіла за будь-яким з пп. 1-6.
9. Спосіб лікування раку, який відрізняється тим, що він включає введення пацієнту антитіла за будь-яким з пп. 1-6.
10. Клітинна лінія, яка продукує антитіла за пп. 1-5.
11. Спосіб одержання антитіла за будь-яким з пп. 1-6, який відрізняється тим, що він включає культивування клітинної лінії за п. 10.
12. Лікарський засіб, який містить антитіло-антагоніст рецептора FGF-R4 за будь-яким з пп. 1-6.
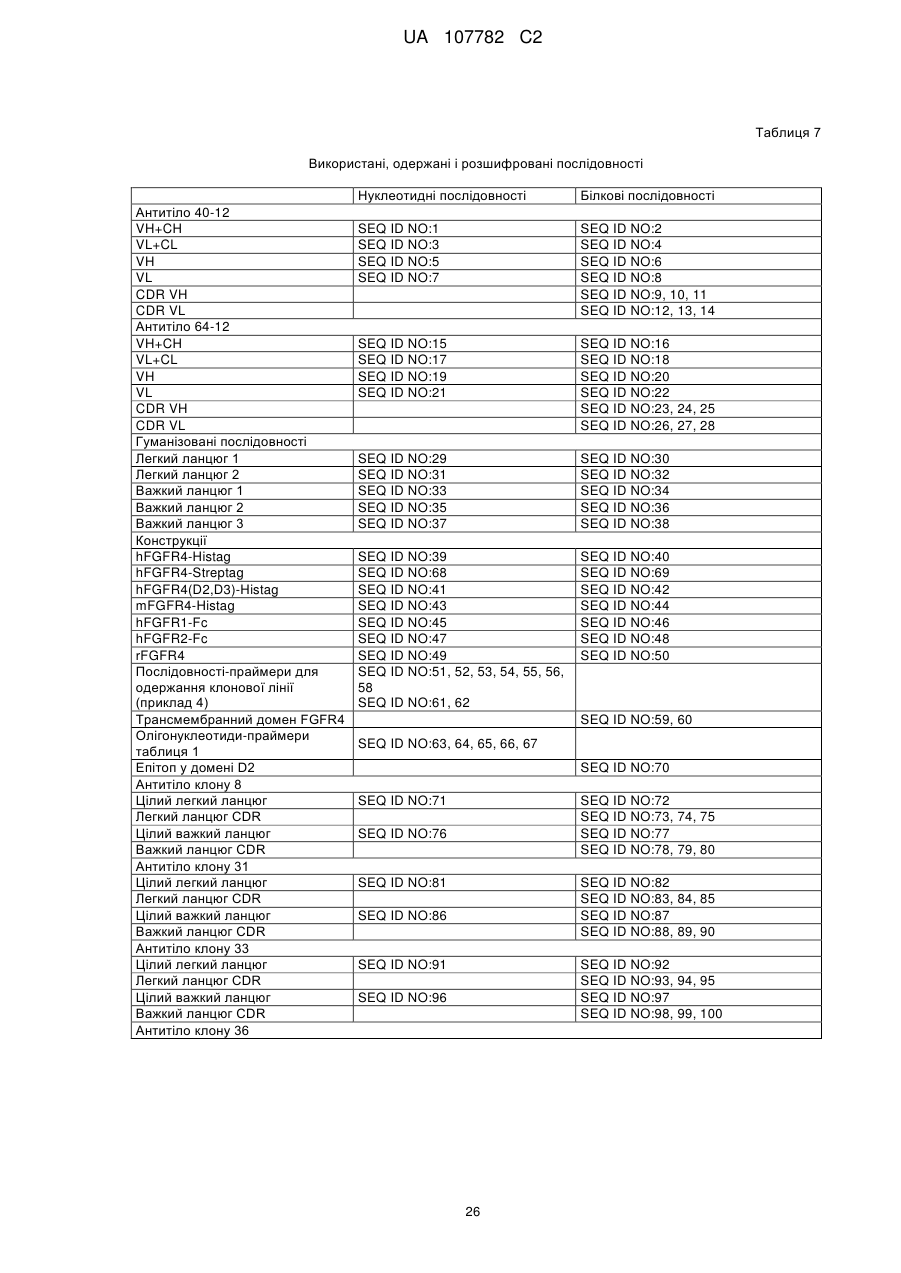
13. Полінуклеотид, який кодує поліпептид і є щонайменше на 80 % ідентичним одній з послідовностей SEQ ID NO:2, 4, 6, 8, 9, 10, 11, 12, 13, 14, 30, 32, 34, 36, 38, 72, 73, 74, 75, 77, 78, 79, 80, 82, 83, 84, 85, 87, 88, 89, 90, 92, 93, 94, 95, 97, 98, 99, 100, 103, 104, 105, 107, 108, 109 або 110, при тому, що кодований ним поліпептид зберігає свою специфічність зв'язування.
14. Полінуклеотид, який відрізняється тим, що він являє собою послідовність, ідентичну щонайменше на 80 % одній з послідовностей SEQ ID NO:1, 3, 5, 7, 29, 31, 33, 35 або 37, 71, 76, 81, 86, 91, 96, 101 або 106, при тому, що кодований ним поліпептид зберігає свою специфічність зв'язування.
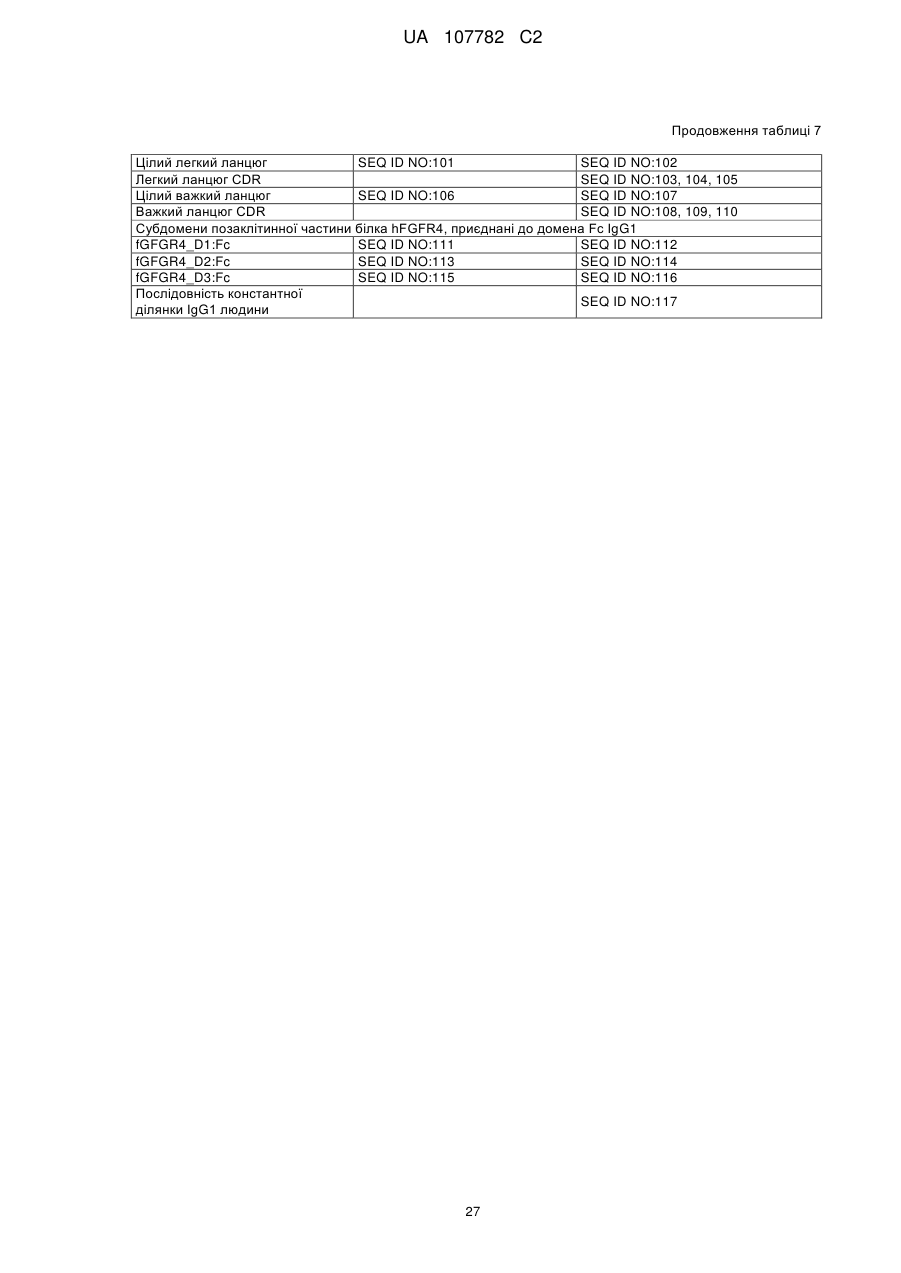
15. Рекомбінантний вектор, який містить нуклеїнову кислоту за будь-яким з пп. 13 і 14.
16. Клітина-хазяїн, яка містить вектор за п. 15.
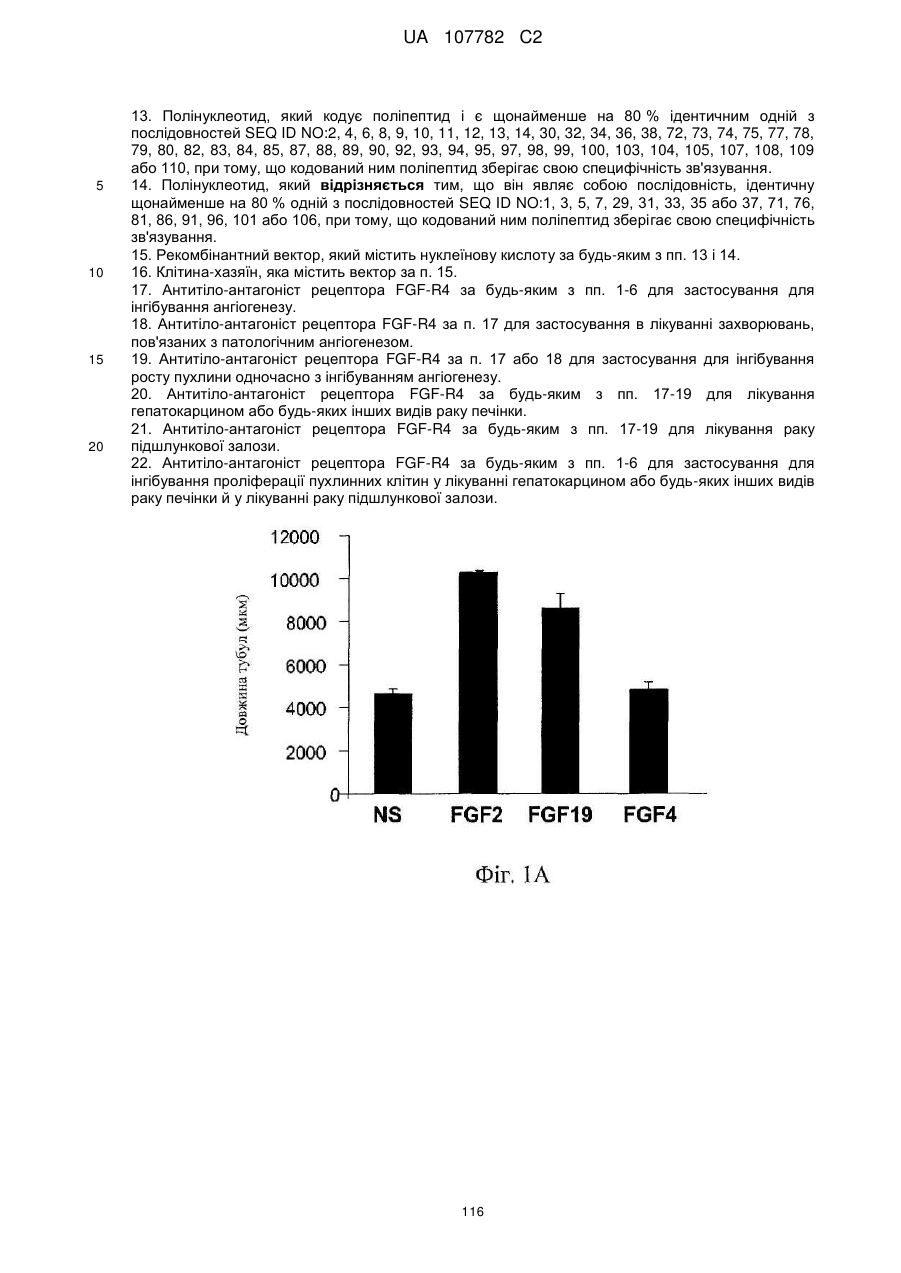
17. Антитіло-антагоніст рецептора FGF-R4 за будь-яким з пп. 1-6 для застосування для інгібування ангіогенезу.
18. Антитіло-антагоніст рецептора FGF-R4 за п. 17 для застосування в лікуванні захворювань, пов'язаних з патологічним ангіогенезом.
19. Антитіло-антагоніст рецептора FGF-R4 за п. 17 або 18 для застосування для інгібування росту пухлини одночасно з інгібуванням ангіогенезу.
20. Антитіло-антагоніст рецептора FGF-R4 за будь-яким з пп. 17-19 для лікування гепатокарцином або будь-яких інших видів раку печінки.
21. Антитіло-антагоніст рецептора FGF-R4 за будь-яким з пп. 17-19 для лікування раку підшлункової залози.
22. Антитіло-антагоніст рецептора FGF-R4 за будь-яким з пп. 1-6 для застосування для інгібування проліферації пухлинних клітин у лікуванні гепатокарцином або будь-яких інших видів раку печінки й у лікуванні раку підшлункової залози.
Текст
Реферат: Винахід стосується молекул, що є специфічними антагоністами рецептора FGF-R4 і дозволяють інгібувати активність цього рецептора. Ці антагоністи являють собою, зокрема, антитіла, що специфічно спрямовані до рецептора FGF-R4 і дозволяють інгібувати активність зазначеного рецептора. Винахід стосується також терапевтичного застосування таких антитіл, переважно, в галузі ангіогенезу й у лікуванні деяких видів раку. UA 107782 C2 (12) UA 107782 C2 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 Опис Даний винахід стосується специфічних антагоністів рецептора 4 FGF (FGF-R4), що дозволяють інгібувати активність цього рецептора. Такі антагоністи являють собою, зокрема, антитіла, специфічно спрямовані до рецептора 4 FGF (FGF-R4). Даний винахід стосується також терапевтичного застосування таких антагоністів переважно в галузі ангіогенезу й у лікуванні деяких видів раку. FGF (фактори росту фібробластів) вважаються першими сполуками, описаними як сполуки, здатні стимулювати проліферацію, міграцію і диференціювання клітин судин in vitro і in vivo. У багатьох наукових статтях описана індукція ангіогенезу й утворення кровоносних капілярів in vitro і in vivo, зумовлювана FGF. FGF також беруть участь в ангіогенезі пухлин, сприяючи утворенню кровоносних судин, що живлять пухлини. Сімейство FGF людини містить у собі щонайменше 23 члени, що мають консервативний центральний домен з 120 амінокислот. Вони виявляють свою біологічну активність, взаємодіючи зі своїми рецепторами, що мають високу спорідненість типу тирозинкінази (FGF-R) і гепарансульфатів протеогліканів, що представляють собою сполуки, що містяться на поверхні більшої частини клітин і позаклітинних матриць (сайти зв'язування з низькою спорідненістю), з утворенням потрійного комплексу. Деякі FGF мають високу спорідненість до декількох FGF-R, тоді як інші фактори специфічно активують один рецептор або одну ізоформу рецептора. Специфічний ліганд FGF-R4 був ідентифікований Xie et al. (Cytokine, 1999, 11:729-35). Цей ліганд, що називається FGF19, являє собою ліганд, що має винятково високу спорідненість до FGF-R4 і зв'язок якого з рецептором залежить від гепарину або гепарансульфатів. FGF19 був ідентифікований у дорослої тварини тільки на рівні гепатоцитів і тонкого кишечнику, де він регулює синтез жовчної кислоти печінкою. Він може являти собою фактор росту, що діє під час ембріонального розвитку, і може брати участь у розвитку зародкового головного мозку риб, зебри і людини. Інші ліганди FGF-R4 описані як FGF1 або FGF2. Ці ліганди сильно активують FGF-R4, але не є специфічними стосовно FGF-R4: вони зв'язуються також з іншими FGF-R (Ornitz et al., J. Biol. Chem., 1996, 271:15292-7). Активація рецептора FGF-R4 приводить до декількох типів клітинної сигналізації. Серед таких типів найбільш традиційна форма відповідає здійсненню шляху сигналізації по каскаду фосфорилування в продовження стимуляції FGF-R4 за допомогою FGF. Така індукція приводить до аутофосфорилування домена тирозинкінази FGF-R4 і служить ініціації шляху внутрішньоклітинної сигналізації, що залежить від фосфорилування інших білків сигналізації, таких як AKT, p44/42, JNK і т. д. Така сигналізація фосфорилуванням змінюється в залежності від типу клітин і корецепторів або адгезійно зв'язаних молекул, що присутні на поверхні даних клітин (Cavallaro et al., Nat. Cell Biol. 3/7, 650-657 (2001); Stadler et al., Cell Signal. 18/6, 783-794 (2006); Lin et al., J. Biol. Chem., 2007, 14:27277-84 (2007)). Іншим варіантом сигналізації, що представляється важливим для FGF-R, є варіант, у якому FGF-R4 являє собою об'єкт інтерналізації рецептора після активації в сполученні з його лігандом. Даний механізм залежить не від активності тирозинкінази рецептора, а від короткої послідовності в C-кінцевому домені FGF-R4 (Klingenberg et al., J. Cell Sci., 113/Pt10:1827-1838 (2000)). У літературі описані чотири різні форми FGF-R4: повнорозмірна форма з 2 поліморфними варіантами в положенні 388, а саме FGF-R4 Gly388, що представляє собою нормальну форму рецептора, і форма Arg388, описана у відношенні декількох пухлин (Bange et al., Cancer Res. 62/3, 840-847 (2002); Spinola et al., J. Clin. Oncol. 23, 7307-7311 (2005); Stadler et al., Cell Signal. 18/6, 783-794 (2006)). Також була виявлена розчинна форма, що експерсується в пухлинних клітинах молочних залоз (Takaishi et al., Biochem. Biophys. Res. Commun., 2000, 267:658-62). Четверта форма, усічена в позаклітинній частині, була описана у випадку деяких гіпофізарних аденом (Ezzat et al., J. Clin. Invest., 2002, 109:69-78). FGF-R4 експресується головним чином у тканинах, що представляють собою похідні ендодерми, таких як шлунково-кишковий тракт, підшлункова залоза, печінка, м'язи і надниркова залоза. З літературних джерел FGF-R4 відомий як рецептор, що відіграє в клітинах кілька ролей, з числа яких три головні ролі описані нижче. По-перше, цей рецептор бере участь у регуляції різних процесів диференціювання клітин in vitro і in vivo, таких як диференціювання і регенерація кістякових м'язів, диференціювання мезенхіматозних тканин, остеогенез, а також у формуванні альвеол під час постнатального розвитку печінки. 1 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 По-друге, описана причетність FGF-R4 до регуляції гомеостазу жовчної кислоти і холестерину й участь у регуляції ожиріння. Крім того, рівновага між продукуванням жовчної кислоти і холестерину регулюється FGF-R4 in vitro і in vivo. По-третє, FGF-R4 бере участь у деяких пухлинних феноменах, таких як розвиток гепатоцелюлярних карцином або ракових пухлин товстої кишки, у проліферації клітин фіброаденом молочних залоз, епітеліальних клітин ракових пухлин молочних залоз, у рухливості клітин карцином молочних залоз або колоректальних карцином. Причетність FGF-R4 до пухлин переважно зв'язана з явищем поліморфізму (Gly388Arg), що корелює з прогресуванням розвитку пухлин молочних залоз і колоректальних пухлин (Bange et al., Cancer Res. 62/3, 840-847, 2002), пухлин предміхурової залози (Wang et al., Clin. Cancer Res. 10/18, 6169-6178, 2004) або пухлин печінки (Nicholes et al., Am. J. Pathol. 160/6, 2295-307, 2002). Даний поліморфізм зв'язаний також з поганим прогнозом у випадку сарком (Morimoto et al., Cancer, 98/10, 2245-2250, 2003), аденокарцином легені (Spinola et al., J. Clin. Oncol. 23, 7307-7311, 2005) або сквамозних сарком (da Costa Andrade et al., Exp. Mol. Pathol. 82, 53-7, 2007). Надекспресія FGF-R4 описана також у випадку деяких ліній ракових пухлин підшлункової залози (Shah et al., Oncogene, 21/54, 8251-61, 2002) і корелюється зі злоякісністю астроцитом (Yamada et al., Neurol. Res. 24/3, 244-8, 2002). Крім того, використання моноклонального антитіла анти-FGF19 у моделях in vivo ксенотрансплантатів пухлин товстої кишки або в моделях гепатоцелюлярних карцином, показує, що інактивація FGF19 і, таким чином, блокування активації FGF-R4 може бути сприятливим у лікуванні раку товстої кишки або печінки. У літературних джерелах допускають, що пари FGF/FGF-R1 і FGF/FGF-R2 беруть участь в утворенні нових кровоносних судин у контексті норми або патології. Однак потенційна причетність FGF-R4 до регуляції цього клітинного феномену дотепер не була досліджена. На практиці, дотепер передбачалося, що активація ангіогенезу опосередкована через FGF-R1 і/або FGF-R2 (Presta et al., Cytokine Growth Factor Rev., 2005, 16:159-78). Приклади антагоністів FGF-R4 описані в літературі, зокрема, малі молекули, не націлені спеціально на FGF-R4, але також викликають небажані ефекти. Так, наприклад, малі хімічні молекули, що є інгібіторами домена тирозинкінази і інгібує деякі рецептори FGF-R, а також інші рецептори тирозинкінази, були описані Thompson et al., (Thompson et al., J. Med. Chem., 2000, 43:4200-11.). Малі хімічні молекули, що інгібують FGF-R за рахунок асоціації з їх позаклітинною частиною, також були описані в WO 2007/080325. Були досліджені також антитіла, такі як антитіла анти-FGFR1 і/або анти-FGFR4, описані в міжнародних заявках WO 2005/066211 і WO 2008052796 або Chen et al., (Hybridoma, 24/3, 152159, 2005). У WO 2005/037235 описані антитіла-антагоністи FGF-R для лікування ожиріння і діабету. З іншого боку, антитіла-агоністи анти-FGF-R4 описані в WO 03/063893. Об'єктом даного винаходу є антагоніст рецептора FGF-R4, що відрізняється тим, що він специфічно зв'язується з цим рецептором. Зазначений антагоніст переважно являє собою специфічне антитіло до рецептора FGF-R4. В одному з варіантів здійснення антагоніст, що є об'єктом даного винаходу, зв'язується з доменом D2-D3 рецептора FGF-R4. У переважному варіанті здійснення антагоніст, що є об'єктом даного винаходу, зв'язується з доменом D2 рецептора FGF-R4. У більш переважному варіанті здійснення антагоніст зв'язується з послідовністю SEQ ID NO:70. Специфічний антагоніст рецептора FGF-R4 відносно рецептора FGF-R4 переважно має -8 -9 -9 значення KD, визначене за методикою Biacore, менше 10E M, менше 510E M, менше 210E -9 M або менше 110E M. У переважному варіанті здійснення специфічний антагоніст рецептора FGF-R4 одночасно є активним проти FGF-R4 людини і FGF-R4 миші. В іншому переважному варіанті здійснення специфічний антагоніст рецептора FGF-R4 одночасно є активним проти FGF-R4 людини, FGF-R4 миші і FGF-R4 щура. У переважному варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить щонайменше один CDR, що представляє собою послідовність, ідентичну послідовності SEQ ID NO:9, 10, 11, 12, 13, 14, 73, 74, 75, 78, 79, 80, 83, 84, 85, 88, 89, 90, 93, 94, 95, 98, 99, 100, 103, 104, 105, 108, 109 або 110, або щонайменше один CDR, послідовність якого відрізняється однією або двома амінокислотами, у порівнянні з послідовностями SEQ ID NO:9, 10, 11, 12, 13, 14, 73, 74, 75, 78, 79, 80, 83, 84, 85, 88, 89, 90, 93, 94, 95, 98, 99, 100, 103, 104, 105, 108, 109 або 110, при тому, що антитіло зберігає свою специфічність зв'язування. В особливо переважному варіанті здійснення антитіло, що є специфічним антагоністом FGFR4, містить CDR послідовності SEQ ID NO:9, 10, 11, 12, 13, 14, 73, 74, 75, 78, 79, 80, 83, 84, 85, 88, 89, 90, 93, 94, 95, 98, 99, 100, 103, 104, 105, 108, 109 або 110, або CDR, послідовності яких відрізняються однією або двома амінокислотами, у порівнянні - відповідно - із зазначеними 2 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовностями, якщо тільки ця обставина не змінює специфічність зв'язування антитіла з рецептором FGF-R4. У переважному варіанті здійснення антитіла за даним винаходом містять щонайменше один важкий ланцюг і щонайменше один легкий ланцюг, причому важкий ланцюг містить три послідовності CDR, що має послідовності амінокислот, вибрані з групи, у яку входять SEQ ID NO:9, 10 і 11 або 73, 74 і 75, 83, 84 і 85, або 93, 94 і 95, або 103, 104 і 105, причому зазначений легкий ланцюг містить три послідовності CDR, що має послідовності амінокислот, вибрані з групи, у яку входять SEQ ID NO:12, 13 і 14 або 78, 79 і 80, або 88, 89 і 90, або 98, 99 і 100, або 108, 109 і 110. У переважному варіанті здійснення варіабельні частини важкого ланцюга антитіла, що є специфічним антагоністом FGF-R4, містять послідовність, ідентичну щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:6, 77, 87, 97 або 107. У переважному варіанті здійснення варіабельні частини легкого ланцюга антитіла, що є специфічним антагоністом рецептора FGF-R4, містять послідовність, ідентичну щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:8, 72, 82, 92 або 102. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і має важкий ланцюг, що містить варіабельну частину, що кодується нуклеотидною послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:5, 76, 86, 96 або 106. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і має легкий ланцюг, що містить варіабельну частину, що кодується нуклеотидною послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:7, 71, 81, 91 або 101. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і має важкий ланцюг, що містить варіабельну частину поліпептидної послідовності SEQ ID NO:6, 77, 87, 97 або 107. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і має легкий ланцюг, що містить варіабельну частину поліпептидної послідовності SEQ ID NO:8, 72, 82, 92 або 102. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і містить послідовності, що кодуються нуклеотидними послідовностями SEQ ID NO:5 і 7 або 71 і 76, або 81 і 86, або 91 і 96, або 101 і 106. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і містить поліпептидні послідовності SEQ ID NO:6 і 8, або 72 і 77, або 82 і 87, або 92 і 97, або 102 і 107. У переважному варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить послідовності, ідентичні щонайменше на 80, 90, 95 або 99 % послідовностям SEQ ID NO:2 і/або SEQ ID NO:4, або SEQ ID NO:72 і/або SEQ ID NO:77, або SEQ ID NO:82 і/або SEQ ID NO:87, або SEQ ID NO:92 і/або SEQ ID NO:97, або SEQ ID NO:102 і/або SEQ ID NO:107. В особливо переважному варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить важкий ланцюг, що кодується нуклеотидною послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:1. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і мстить важкий ланцюг поліпептидної послідовності, ідентичної щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:2. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і містить легкий ланцюг, що кодується нуклеотидною послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:3. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і містить легкий ланцюг поліпептидної послідовності, ідентичної щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:4. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і містить послідовності, що кодуються нуклеотидними послідовностями SEQ ID NO:1 і 3. У більш переважному варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить важкий ланцюг, що містить послідовність SEQ ID NO:2, і легкий ланцюг, що містить послідовність SEQ ID NO:4. Антитіло, що складається з важкого ланцюга послідовності SEQ ID NO:2 і легкого ланцюга послідовності SEQ ID NO:4, надалі в описі позначається як 40-12. В одному з варіантів здійснення даного винаходу специфічні антитіла до FGF-R4 активні одночасно відносно FGF-R4 людини, FGF-R4 миші і FGF-R4 щура. 3 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 У переважному варіанті здійснення специфічний антагоніст рецептора FGF-R4 індукує інгібування клітинних шляхів AKT/p38. У переважному варіанті здійснення специфічний антагоніст рецептора FGF-R4 індукує інгібування клітинних шляхів Erk1/2. У переважному варіанті здійснення специфічний антагоніст рецептора FGF-R4 індукує інгібування шляхів клітинної сигналізації, регульованих FGF-R4. В іншому переважному варіанті здійснення специфічний антагоніст рецептора FGF-R4 індукує інгібування клітинної проліферації пухлин. В іншому переважному варіанті здійснення специфічний антагоніст рецептора FGF-R4 індукує інгібування ангіогенезу. В іншому особливо переважному варіанті здійснення специфічний антагоніст рецептора FGF-R4 має спорідненість до FGF-R4, що у 10 разів перевищує його спорідненість до інших рецепторів FGF. В особливо переважному варіанті здійснення антитіло за даним винаходом являє собою гуманізоване антитіло, що є специфічним антагоністом рецептора FGF-R4. В одному з варіантів здійснення гуманізоване антитіло, що є специфічним антагоністом рецептора FGF-R4, містить легкий ланцюг, варіабельна частина якого кодується нуклеотидною послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:29 або послідовності SEQ ID NO:31. В іншому варіанті здійснення гуманізоване антитіло, що є специфічним антагоністом рецептора FGF-R4, містить легкий ланцюг, варіабельна частина якого ідентична щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:30 або послідовності SEQ ID NO:32. В іншому варіанті здійснення гуманізоване антитіло, що є специфічним антагоністом рецептора FGF-R4, містить легкий ланцюг, варіабельна частина якого кодується послідовністю, ідентичною нуклеотидній послідовності SEQ ID NO:29 або послідовності SEQ ID NO:31. Даний винахід стосується також гуманізованого антитіла, що є специфічним антагоністом рецептора FGF-R4 і містить важкий ланцюг, варіабельна частина якого кодується послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:33, послідовності SEQ ID NO:35 або послідовності SEQ ID NO:37. Даний винахід стосується також гуманізованого антитіла, що є специфічним антагоністом рецептора FGF-R4 і містить важкий ланцюг, варіабельна частина якого ідентична щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:34, послідовності SEQ ID NO:36 або послідовності SEQ ID NO:38. Даний винахід стосується також гуманізованого антитіла, що є специфічним антагоністом рецептора FGF-R4 і містить важкий ланцюг, що кодується нуклеотидною послідовністю SEQ ID NO:33 і/або SEQ ID NO:35, і/або SEQ ID NO:37. Даний винахід стосується також гуманізованого антитіла, що є специфічним антагоністом рецептора FGF-R4, і послідовності якого, гуманізовані послідовністю SEQ ID NO:30 або 32, використовують у комбінації з послідовностями, гуманізованими послідовністю SEQ ID NO:34, 36 або 38. В іншому варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить CDR послідовності SEQ ID NO:73, 74, 75, 78, 79 і 80, або CDR, послідовності яких відрізняються однією або двома амінокислотами, у порівнянні - відповідно - із зазначеними послідовностями, якщо тільки ця обставина не змінює специфічність зв'язування антитіла з рецептором FGF-R4. В іншому варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить CDR послідовності SEQ ID NO:83, 84, 85, 88, 89 і 90, або CDR, послідовності яких відрізняються однією або двома амінокислотами, у порівнянні - відповідно - із зазначеними послідовностями, якщо тільки ця обставина не змінює специфічність зв'язування антитіла з рецептором FGF-R4. В іншому варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить CDR послідовності SEQ ID NO:93, 94, 95, 98, 99 і 100, або CDR, послідовності яких відрізняються однією або двома амінокислотами, у порівнянні - відповідно - із зазначеними послідовностями, якщо тільки ця обставина не змінює специфічність зв'язування антитіла з рецептором FGF-R4. В іншому варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить CDR послідовності SEQ ID NO:103, 104, 105, 108, 109 і 110, або CDR, послідовності яких відрізняються однією або двома амінокислотами, у порівнянні - відповідно - із зазначеними послідовностями, якщо тільки ця обставина не змінює специфічність зв'язування антитіла з рецептором FGF-R4. 4 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 У переважному варіанті здійснення даного винаходу антитіло, що є специфічним антагоністом рецептора FGF-R4, містить CDR послідовності SEQ ID NO:83, 84, 85, 88, 89 і 90. У переважному варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, являє собою антитіло людини, у якому варіабельні частини важкого ланцюга містять нуклеотидну послідовність, ідентичну щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:76,86, 96 або 106. У переважному варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, являє собою антитіло людини, у якому варіабельні частини легкого ланцюга містять нуклеотидну послідовність, ідентичну щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:71, 81, 91 або 101. Даний винахід стосується також антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і має важкий ланцюг, що містить варіабельну частину, що кодується білковою послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:77, 87, 97 або 107. Даний винахід стосується також антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і має легкий ланцюг, що містить варіабельну частину, що кодується білковою послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:72, 82, 92 або 102. Даний винахід стосується також антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і містить послідовності, що кодуються нуклеотидними послідовностями SEQ ID NO:71 і 76 або нуклеотидними послідовностями SEQ ID NO:81 і 86, або нуклеотидними послідовностями SEQ ID NO:91 і 96, або нуклеотидними послідовностями SEQ ID NO:101 і 106. Даний винахід стосується також антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і містить поліпептидні послідовності SEQ ID NO:72 і 77 або поліпетидні послідовності SEQ ID NO:82 і 87, або поліпетидні послідовності SEQ ID NO:92 і 97, або поліпетидні послідовності SEQ ID NO:102 і 107. У переважному варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, містить послідовності, ідентичні щонайменше на 80, 90, 95 або 99 % послідовностям SEQ ID NO:72 і/або SEQ ID NO:77. В іншому переважному варіанті здійснення антитіло людини, що є специфічним антагоністом рецептора FGF-R4, містить послідовності, ідентичні щонайменше на 80, 90, 95 або 99 % послідовностям SEQ ID NO:82 і/або SEQ ID NO:87. В іншому переважному варіанті здійснення антитіло людини, що є специфічним антагоністом рецептора FGF-R4, містить послідовності, ідентичні щонайменше на 80, 90, 95 або 99 % послідовностям SEQ ID NO:92 і/або SEQ ID NO:97. В іншому переважному варіанті здійснення антитіло людини, що є специфічним антагоністом рецептора FGF-R4, містить послідовності, ідентичні щонайменше на 80, 90, 95 або 99 % послідовностям SEQ ID NO:102 і/або SEQ ID NO:107. У переважному варіанті здійснення даний винахід стосується антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і містить легкий ланцюг, що кодується нуклеотидною послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:82, і легкий ланцюг поліпептидної послідовності, ідентичної щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:87. Більш переважно даний винахід стосується антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і містить послідовності, що кодуються нуклеотидними послідовностями SEQ ID NO:82 і 87. Антитіло, що складається з важкого ланцюга послідовності SEQ ID NO:77 і легкого ланцюга послідовності SEQ ID NO:72, надалі в описі позначається як клон 8. Антитіло, що складається з важкого ланцюга послідовності SEQ ID NO:87 і легкого ланцюга послідовності SEQ ID NO:82, надалі в описі позначається як клон 31. Антитіло, що складається з важкого ланцюга послідовності SEQ ID NO:97 і легкого ланцюга послідовності SEQ ID NO:92, надалі в описі позначається як клон 33. Антитіло, що складається з важкого ланцюга послідовності SEQ ID NO:107 і легкого ланцюга послідовності SEQ ID NO:102, надалі в описі позначається як клон 36. Обсяг охорони даного винаходу не обмежується антитілами, що містять ці послідовності. На практиці, будь-які антитіла, що специфічно зв'язуються з FGF-R4, здійснюючи антагоністичний вплив на цей рецептор, входять в обсяг охорони даного винаходу. Даний винахід стосується також антитіла, що є специфічним антагоністом рецептора FGFR4 і кон'югованим з цитотоксичним агентом. 5 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується застосування специфічного антагоніста рецептора FGF-R4 у лікуванні захворювань, зв'язаних з ангіогенезом. Даний винахід стосується застосування специфічного антагоніста рецептора FGF-R4 у лікуванні раку. Даний винахід стосується застосування специфічного антагоніста рецептора FGF-R4 у лікуванні гепатокарцином або будь-яких інших видів раку печінки. Даний винахід стосується застосування специфічного антагоніста рецептора FGF-R4 у лікуванні раку підшлункової залози. Даний винахід стосується специфічного антитіла до рецептора FGF-R4, що може бути використаний одночасно в лікуванні захворювань, зв'язаних з ангіогенезом, і в лікуванні гепатокарцином або будь-яких інших видів раку печінки. Даний винахід стосується специфічного антитіла до рецептора FGF-R4, що може бути використаний одночасно в лікуванні захворювань, зв'язаних з ангіогенезом, у лікуванні гепатокарцином або будь-яких інших видів раку печінки, у лікуванні раку підшлункової залози, органів шлунково-кишкового або тракту будь-яких інших органів, що експресують FGF-R4. Даний винахід стосується фармацевтичної композиції, що містить специфічний антагоніст рецептора FGF-R4 і ексципієнти. Даний винахід стосується способу лікування раку, що включає введення пацієнту антитіла, що є специфічним антагоністом рецептора FGF-R4. Даний винахід стосується способу лікування захворювання, зв'язаного з патологічним збільшенням ангіогенезу, що включає введення пацієнту антитіла, що є специфічним антагоністом рецептора FGF-R4. Даний винахід стосується способу селекції моноклонального антитіла, що є специфічним антагоністом рецептора FGF-R4, що включає наступні стадії: a. імунізацію мишей; b. добір у мишей лімфатичних вузликів; c. посів супернатантів гібридом. Даний винахід стосується клітинної лінії, що продукує антитіла, що є специфічними антагоністами рецептора FGF-R4. Даний винахід стосується способу одержання антитіла, що є специфічним антагоністом рецептора FGF-R4, що включає культивування клітинної лінії, що продукує антитіла, що є антагоністами рецептора FGF-R4. Даний винахід стосується лікарського засобу, що містить специфічний антагоніст рецептора FGF-R4. Даний винахід стосується також полінуклеотиду, що кодує поліпептид, вибраний із групи, у яку входять послідовності SEQ ID NO:2, 4, 6, 8, 9, 10, 11, 12, 13, 14, 30, 32, 34, 36, 38, 72, 73, 74, 75, 77, 78, 79, 80, 82, 83, 84, 85, 87, 88, 89, 90, 92, 93, 94, 95, 97, 98, 99, 100, 102, 103, 104, 105, 107, 108, 109, 110 і послідовності, ідентичні щонайменше на 80, 90, 95 або 99 % одній з зазначених послідовностей. Даний винахід стосується рекомбінантного вектора, що містить описаний вище полінуклеотид або кодує описаний вище поліпептид. Для забезпечення експресії важких і/або легких ланцюгів антитіла, що є антагоністом рецептора FGF-R4 і представляє собою об'єкт даного винаходу, полінуклеотиди, що кодують зазначені ланцюги, вбудовують у експресійні вектори. Такі експресійні вектори можуть являти собою плазміди, YAC, косміди, ретровіруси, епісоми, що є похідними EBV, і будь-які вектори, що фахівцями в даній галузі техніки можуть бути прийняті прийнятними для експресії зазначених ланцюгів. Даний винахід стосується клітини-хазяїна, що містить рекомбінантний вектор, описаний вище. Докладний опис винаходу Даний винахід стосується застосування антитіла, специфічно спрямованого до FGF-R4 (без перехресної реакції з FGF-R1, R2 або R3), для інгібування ангіогенезу і росту пухлин. Несподіваним чином, авторами було виявлено, що FGF-R4 грає активну і специфічну роль у регуляції ангіогенезу. Така функція FGF-R4 раніше не була виявлена або запропонована. Таким чином, цей рецептор може бути використаний як мішень для лікування патологій, при яких має місце ангіогенна дисфункція. Ліганди FGF-R4, здатні модулювати його активність, являють собою, таким чином, потенційні речовини терапевтичної дії у випадку багатьох патологій, пов'язаних з ангіогенезом. 6 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, даний винахід може бути використаний в лікуванні будь-яких патологій, що викликають порушення регуляції ангіогенезу і вимагають його інгібування. Релевантні патології можуть являти собою рак, що вимагає застосування антагоністів за даним винаходом як інгібіторів ангіогенезу пухлин або патології, при яких порушення регуляції ангіогенезу описується як вікова дегенерація жовтої плями або DMLA, запальні захворювання, такі як ревматоїдний артрит, остеоартрит, коліти, виразки або будь-які запальні захворювання кишечнику, атеросклероз або ожиріння. Застосування таких антитіл також пояснено у випадку інгібування росту пухлин. Таким чином, антагоністи за даним винаходом можуть бути використані для лікування деяких ракових захворювань, що викликають порушення регуляції FGF-R4, і більш переважно ракових захворювань печінки, товстої кишки, молочної залози, легені, предміхурової залози, підшлункової залози, шкіри або стравоходу. Одним з найбільших переваг антагоністів за даним винаходом є вибір як специфічної мішені рецептора FGF, у даному випадку FGF-R4. Така специфічність дозволяє обмежити небажані ефекти, що можуть викликати малі хімічні молекули, що є інгібіторами домена тирозинкінази. Крім того, оскільки FGF-R4 експресується не повсюдно, а експресується, зокрема, на ендотеліальних клітинах, таких як клітини печінки, жовчного міхура, молочних залоз, предміхурової залози, яєчника, підшлункової залози, нирок, ця обставина надає в розпорядження спосіб лікування захворювань, зв'язаних з порушенням регуляції активності FGF-R4, з обмеженням вторинних явищ. Під "антагоністом" розуміють будь-який ліганд, здатний зменшити або цілком інгібувати активність FGF-R4. Таку сполука-антагоніст також називають інгібітором FGF-R4. Такий антагоніст може являти собою будь-який ліганд FGF-R4, такий як хімічна молекула, рекомбінантний білок, олігосахарид, полісахарид, олігонуклеотид або антитіло, здатні специфічно зв'язуватися з рецептором FGF-R4, що виключають будь-які інші FGFR. Таким чином, об'єктом даного винаходу є специфічний антагоніст FGF-R4. Згідно із даним винаходом під антагоністом, що специфічно зв'язується з FGF-R4, розуміють ліганд, що не зв'язується з іншими рецепторами FGF, а саме з FGF-R1, FGF-R2 або FGF-R3. Зокрема, специфічне антитіло до FGF-R4 являє собою антитіло, що не вступає в перехресну реакцію з FGF-R1, FGF-R2 або FGF-R3. Під специфічним зв'язком розуміють щонайменше 10-кратне розходження між силою зв'язку з одним рецептором у порівнянні з іншим, у даному випадку між зв'язком з FGF-R4 і можливими зв'язками з FGF-R1, FGF-R2 або FGF-R3. В одному з варіантів здійснення даного винаходу ліганд FGF-R4 являє собою олігосахарид або полісахарид. Під олігосахаридом розуміють будь-який сахаридний полімер, що містить від трьох до десяти простих сахаридних ланок. Існують природні олігосахариди, такі як, наприклад, фруктоолігосахариди (FOS), і синтетичні олігосахариди, такі як, наприклад, антитромботичні міметичні похідні гепарину. Під "полісахаридом" розуміють будь-який полімер, утворений більше ніж десятьма моносахаридами, зв'язаними між собою глікозидними зв'язками. Існують природні полісахариди, такі як, наприклад, мукополісахариди, фукоїди, карагінани, мікробні екзополісахариди і синтетичні полісахариди. Так, наприклад, фукоїдани з низькою молекулярною масою або високосульфатовані екзополісахариди виявили проангіогенну активність (Chabut et al., Mol. Pharmacol., 2003, 64:696-702; Matou et al., Biochem. Pharmacol., 2005, 69:751-9.). Навпроти, низькосульфатовані олігосахариди, що представляють собою похідні гепарину, сульфатовані або фосфоманопентози можуть мати антиангіогені властивості (Parish et al., 1999, 15:3433-41; Casu et al., J. Med. Chem., 2004, 12:838-48). В одному з варіантів здійснення даного винаходу ліганд FGF-R4 являє собою антитіло. Під "антитілом" розуміють антитіла або похідні молекули будь-якого типу, такі як поліклональні і моноклональні антитіла. У число похідних молекул моноклональних антитіл входять гуманізовані антитіла, антитіла людини, мультиспецифічні антитіла, химерні антитіла, фрагменти антитіл, нанотіла. В одному з варіантів здійснення даного винаходу специфічний антагоніст FGF-R4 являє собою поліклональне антитіло. "Поліклональне антитіло" являє собою антитіло, одержане в суміші антитіл, що походять від декількох клонів лімфоцитів B і розпізнають серію різних епітопів. У переважному варіанті здійснення специфічний антагоніст FGF-R4 являє собою моноклональне антитіло. "Моноклональне антитіло" являє собою антитіло, одержане виходячи з популяції власне кажучи однорідних антитіл, що походить від одного типу лімфоцитів B і ампліфікована 7 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 клонуванням. Антитіла, що утворюють таку популяцію, є ідентичними, за винятком можливих природних мутацій, що можуть міститися в дуже малій кількості. Такі антитіла спрямовані проти одного епітопу і, таким чином, є високоспецифічними. Під "епітопом" розуміють сайт антигену, з яким зв'язується антитіло. Якщо антиген являє собою полімер, такий як білок або полісахарид, то епітоп може бути утворений суміжними або несуміжними залишками. У переважному варіанті здійснення за даним винаходом антитіло-антагоніст анти-FGF-R4 зв'язується з епітопом, що належить домену D2-D3 рецептора FGF-R4. У більш переважному варіанті антитіло зв'язується з епітопом, який входить у домен, що містить амінокислоти 144-365 рецептора FGF-R4. У найбільш переважному варіанті антитіло зв'язується з епітопом, який входить у домен D2 рецептора FGF-R4, причому цей епітоп відповідає амінокислотам 145-242, описаним у послідовності SEQ ID NO:70. Антитіло, що називається також імуноглобуліновим, складається з двох однакових важких ланцюгів ("VH") і двох однакових легких ланцюгів ("VL"), зв'язаних дисульфідним містком. Кожен ланцюг містить константну і варіабельну області. Кожна варіабельна область містить три сегменти, що називаються "областями, що визначають комплементарність" ("CDR") або "гіперваріабельними областями", що є принципово відповідальними за зв'язок антигену з епітопом. Термін "VH" стосується варіабельних областей важкого ланцюга імуноглобуліну антитіла, що включає в себе важкі ланцюги фрагментів Fv, scFv, dsFv, Fab, Fab' або F(ab)'. Термін "VL" стосується варіабельних областей легкого ланцюга імуноглобуліну антитіла, що включає в себе легкі ланцюги фрагментів Fv, scFv, dsFv, Fab, Fab' або F(ab)'. Під "фрагментом антитіла" розуміють будь-яку його частину: Fab (антигензв'язувальний фрагмент), Fv, scFv (одинарнний ланцюг Fv), Fc (кристалізовний фрагмент). Дані функціональні фрагменти переважно являють собою фрагменти типу Fv, scFv, Fab, F(ab') 2, Fab', scFv-Fc або димерні тіла, що мають, у загальному випадку, таку ж специфічність зв'язування, що і моноклональне, химерне або гуманізоване антитіло, від якого вони походять. Згідно із даним винаходом фрагменти антитіл за даним винаходом можуть бути одержані виходячи з моноклональних, химерних або гуманізованих антитіл такими способами, як гідроліз ферментами, такими як пепсин або папаїн, і/або розщепленням дисульфідних містків хімічним відновленням. Під "областю або областями CDR" розуміють гіперваріабельні області важких і легких ланцюгів імуноглобулінів, такі як області, визначені Kabat et al. (Kabat et al., Sequences of proteins of immunological interest, 5t" Ed., US Department of Health and Human Services, NIH, 1991, і наступні видання). Існують 3 CDR важкого ланцюга і 3 CDR легкого ланцюга. Термін область або області CDR використовується в даному описі для позначення у відповідних випадках однієї або декількох з таких областей або сукупності таких областей, що містять більшість залишків амінокислот, відповідальних за афінний зв'язок антитіла з антигеном або епітопом, що розпізнається ним. Найбільш консервативні області варіабельних доменів називають областями або послідовностями FR ("framework" (каркас)), або "каркасними областями". В одному з варіантів здійснення даного винаходу специфічний антагоніст FGF-R4 являє собою химерне антитіло. Під "химерним антитілом" розуміють антитіло, у якому константна область або її частина змінена, замінена або заміщена, так що варіабельна область виявляється зв'язаною з константною областю, що відрізняється виглядом або належить до іншого класу або підкласу антитіл. Під "химерним антитілом" розуміють також антитіло, у якому варіабельна область або її частина змінена, замінена або заміщена, так що константна область виявляється зв'язаною з варіабельною областю, що відрізняється виглядом або належить до іншого класу або підкласу антитіл. Способи одержання химерних антитіл відомі фахівцям у даній галузі техніки: див., наприклад, Morrison, 1985, Science, 229:1202; Oi et al., 1986, Bio Techniques, 4:214; Gillies et al., 1989, J. Immunol. Methods, 125:191-202; патенти US 5807715, US 4816567 і US 4816397. Такі химерні версії антитіл можуть являти собою злиття варіабельних частин VL і VH з константними частинами Ckappa і CH (IgG1) людської природи для одержання моноклонального химерного антитіла. Частина CH (IgG1) також може бути модифікована точковими мутаціями для підвищення спорідненості фрагмента Fc до рецептора FcγRIIIa і, тим самим, підвищення ефекторних 8 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 функцій антитіла (Lazar et al., 2006, Proc. Natl. Acad. Sci. USA, 103: 4005-4010; Stavenhagen et al., 2007, Cancer Res. 67: 8882-8890). Даний винахід стосується гуманізованих версій антитіл. Під "гуманізованим антитілом" розуміють антитіло, що містить головним чином імуноглобулінові послідовності людини. Цей термін у загальному випадку стосується відмінного від людського імуноглобуліну, модифікованого введенням послідовностей людини або залишків, що містяться в послідовностях людини. У загальному випадку гуманізовані антитіла містять один або, як правило, два варіабельних домени, у яких усі або частина областей CDR відповідають вихідним частинам спорідненої послідовності, відмінної від послідовності людини, і в який усі або частина областей FR являють собою області, що походять від імуноглобулінової послідовності людини. При цьому гуманізоване антитіло може містити щонайменше частину константної ділянки імуноглобуліну (Fc), зокрема константної ділянки вибраного референтного імуноглобуліну людини. Таким чином, намагаються одержати антитіло, що є найменш імуногенним відносно людини. Також можна заміняти одну або дві амінокислоти одного або декількох CDR амінокислотами, що є менш імуногенними відносно людини, істотно не зменшуючи специфічність зв'язування антитіла з FGF-R4. Залишки каркасних областей також можуть не являти собою людські, і їх можна не модифікувати, якщо вони не сприяють імуногенному потенціалу антитіла. Існує декілька відомих фахівцям у даній галузі техніки способів гуманізації для модифікації спорідненого антитіла, що відрізняється від антитіла людини, до антитіла, що є менш імуногенним відносно людини. Глобальна ідентичність послідовностей антитілам людини не є обов'язково необхідною. На практиці глобальна ідентичність послідовності необов'язково є передбачуваним індикатором зниженої імуногенності, а модифікація обмеженого числа залишків може приводити до гуманізованих антитіл, що мають імуногенний потенціал, що є сильно ослабленим відносно людини (Molecular Immunology (2007) 44, 1986-1998). До різних способів відносяться, наприклад, упровадження CDR (трансплантація) (EPO 0239400, WO 91/09967, US 5530101 і US 5585089), ресурфейсинг (EPO 0592106, EPO 0519596; Padlan, 1991, Molec. Imm. 28(4/5):489-498; Studnicka et al., 1994, Prot. Eng. 7(6):805-814; Roguska et al., 1994, PNAS 91:969-973) або також змішування ланцюгів (US 5565332). Даний винахід, переважно, стосується гуманізованих антитіл, варіабельні частини яких модифіковані відповідно до описаного нижче технологій. Легкі і важкі ланцюги, що є найбільш подібними з відповідними ланцюгами антитіла миші анти-FGF-R4 40-12, ідентифікують порівнянням з базою Protein Data Bank (H.M. Berman, J. Westbrook, Z. Feng, G. Gilliland, T.N. Bhat, H. Weissig, I.N. Shindyalov, P.E. Bourne. Nucleic Acids Research, 2000, 28:235-242). Вирівнювання послідовностей здійснюють, використовуючи алгоритм BLAST (J. Mol. Biol. 1990, Oct 215:403-410). Мова йде про тривимірні структури, що відповідають кодам PDB 1NDM & 1ETZ і відповідно використовуваних для конструювання моделей по гомології легких і важких ланцюгів варіабельних доменів. Такі тривимірні моделі потім уточнюють, мінімізуючи їх потенційну енергію за стандартною методикою, реалізованою в програмі MOE (Molecular Operating Environment, Chemical Computing Group, Квебек, Канада). Потім за допомогою програми Amber здійснюють молекулярно-динамічне моделювання (DM), виходячи з таких мінімізованих тривимірних моделей антитіл (D.A. Case, T.E. Cheatham, III, T. Darden, H. Gohlke, R. Luo, K.M. Merz, Jr., A. Onufriev, C. Simmerling, B. Wang and R. Woods. J. Computat. Chem. 2005, 26:1668-1688). Таке моделювання здійснюють з гармонійними напруженнями, прикладеними до атомів білкового каркаса, при температурі 500 K протягом 1,1 наносекунди в моделі неявного розчинника, такого як розчинник, реалізований в узагальненому способі Борна (Gallicchio & Levy, J. Comput. Chem. 2004, 25:479-499). Таким чином, таким первинним моделюванням одержують десять різних конформацій з розрахунку однієї тривимірної конформації на кожні сто пікосекунд протягом останньої наносекунди моделювання. Потім з кожної з одержаних десяти різних конформацій здійснюють молекулярно-динамічне моделювання без прикладання напружень до білкового каркаса при температурі 27°C протягом 2,3 наносекунди в моделі неявного розчинника, такого як розчинник, реалізований в узагальненому способі Борна. До зв'язків, що залучають атоми водню, прикладають напруження по алгоритму SHAKE (Barth et al., J. Comp. Chem., 1995, 16:1192-1209), один крок триває 1 фемтосекунду, і моделювання здійснюють відповідно до рівняння Ланжевена при постійному обсязі і температурі 27°C. Потім у кожній з десяти молекулярно-динамічних моделей останні дві тисячі конформацій, одержаних з частотою в одну пікосекунду, використовують для кількісного визначення зсуву положень атомів для кожної амінокислоти гуманізовного антитіла, у порівнянні із середньою конформацією (що називається медоїдом) амінокислоти. Сукупність аналізу, описаного нижче, здійснюють на скриптовій мові Scientific Vector Language (SVL) 9 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 програми MOE. Конформація-медоїд амінокислоти являє собою вихідну молекулярно-динамічну конформацію, що є найбільш близькою до середньої конформації, розрахованої, виходячи з положень атомів усіх конформацій амінокислоти. Відстань, використовувана для детектування конформації-медоїду, дорівнює середньоквадратичному відхиленню скалярних відстаней між атомами двох конформацій амінокислоти. Аналогічним способом, зсув положень атомів конформації амінокислоти в порівнянні з конформацією-медоїдом кількісно визначають, розраховуючи середньоквадратичне відхилення скалярних відстаней між атомами амінокислоти змодельованої конформації і тих же атомів конформації-медоїду. Далі, порівнюючи середньоквадратичне відхилення положень атомів амінокислоти (і), що є середньою в сукупності десяти молекулярно-динамічних моделей (Fi), із середньоквадратичним відхиленням положень всіх амінокислот антитіла, що є середнім для сукупності десяти молекулярнодинамічних моделей (Fm), приймають рішення, чи є амінокислота досить гнучкою, щоб розглядати її як кислоту, що може потенційно взаємодіяти з рецепторами T-клітин і провокувати активацію імунної системи. Амінокислоту і розглядають як гнучку, якщо її показник гнучкості Zi перевищує 0,15 при розрахунку по формулі: Zi=(Fi-Fm)/Fm. Таким чином, були ідентифіковані як гнучкі 45 амінокислот у варіабельному домені антитіла, за винятком ділянки, що визначає комплементарність до антигену (RDC), і його безпосереднього оточення. Безпосереднє оточення RDC визначають як будь-яку амінокислоту, у якій атом вуглецю в альфа положенні розташовується на відстані 5 ангстрем (A) або менше від атома вуглецю в альфа положенні RDC. Потім переміщення 60 найбільш гнучких амінокислот антитіла протягом 20 наносекунд (102 нс) моделювання порівнюють з переміщеннями амінокислот, що відповідають 49 моделям по гомології гермінальних послідовностей антитіла людини, для кожної з яких були реалізовані десять молекулярно-динамічних моделей (102 нс) по тій же методиці. 60 найбільш гнучких амінокислот не входять в область, що визначає комплементарність до антигену (RDC), і її безпосереднє оточення. 49 моделей гермінальних послідовностей антитіла людини були побудовані систематичним комбінуванням 7 легких ланцюгів людини (vk1, vk2, vk3, vk4, vlambda1, vlambda2, vlambda3), що найчастіше зустрічаються і 7 важких ланцюгів людини (vh1a, vh1b, vh2, vh3, vh4, vh5, vh6), що найчастіше зустрічаються (Nucleic Acids Research, 2005, Vol. 33, Database issue D593-D597). Подібність гуманізовного антитіла з 49 моделями гермінальних послідовностей людини кількісно визначають, калібруючи положення деяких атомів 60 гнучких амінокислот антитіла, під час десяти варіантів молекулярно-динамічного моделювання за допомогою однієї і тієї же тривимірної кубічної решітки з дозволом 1 Ǻ. У даному випадку, мається на увазі чотиривимірна подібність. Використовувана тривимірна решітка містить 445740 точок, і її ініціалізують, виходячи з тривимірної структури антитіла людини, що відповідає коду PDB 8FAB. Структуру 8FAB використовують також для позиціонування всіх конформацій антитіла, що калібруються у тривимірній решітці. З цією метою, молекулярно-динамічну конформацію-медоїд антитіла накладають на структуру 8FAB. Таке накладення являє собою вирівнювання моментів інерції двох конформацій з наступною оптимізацією скалярних відстаней між атомами вуглецю в альфа положенні обох конформацій. Всі інші молекулярно-динамічні конформації антитіла накладають на конформацію-медоїд таким же способом. Здійснюють два типи калібрування, з одержанням двох варіантів подібності (електростатична подібність і подібність по ліпофільності) для пари порівнюваних антитіл, що підсумовують для одержання тотальної подібності. При першому, електростатичному, калібруванню розглядають всі атоми бічного ланцюга амінокислоти. Значення в точці x решітки розраховують, використовуючи відносно атомів бічного ланцюга амінокислоти тривимірну функцію Гаусса f(x), що врівноважують з електростатичним зарядом атома, відповідно до опису в силовому полі Amber99 (Cieplak J. et al., J. Comp. Chem. 2001, 22: 1048-1057). Функція f(x) орієнтована по 3 осям декартових координат і відповідає формулі: , де x і u являють собою декартові координати точки x решітки й еталонний атом, відповідно, s=r/1,6 (r означає ковалентний радіус атома). Калібрування повторюють для всіх конформацій амінокислоти, і одержані результати усереднюють по всіх точках х тривимірної решітки. При другому калібруванні по ліпофільності розглядають тільки ліпофільні атоми бічного ланцюга амінокислоти. Значення в точці x решітки розраховують за допомогою такої ж функції Гаусса f(x) без зрівноважування. Таким чином, обидві множини молекулярно-динамічних конформацій обох порівнюваних антитіл калібрують по одній і тій же тривимірній решітці. Електростатична подібність (sim-elec) 2 антитіл a і b розраховують по 10 UA 107782 C2 формулі: 5 10 15 20 25 30 35 40 45 50 55 . Подібність по ліпофільності розраховують по такій же формулі по кінцевим даним калібрування по ліпофільності, описаній вище. Таким чином, модель гермінальних послідовностей людини vlambda2-vh2 показує найбільш сильна чотиривимірна подібність (тотальна подібність складає 58 %) 60 гнучких амінокислот у порівнянні з гнучкими амінокислотами антитіла миші 40-12. Таким чином, для гуманізації гуманізовного антитіла була використана модель гермінальної послідовності людини vlambda2vh2 з фокусуванням на 45 гнучких амінокислотах. Для визначення мутацій, що підлягають виконанню, тривимірну структуру моделі антитіла миші 40-12 накладають на модель, одержану для гермінальних послідовностей, що мають найбільш сильна подібність, оптимізуюча положення атомів вуглецю в альфа положенні амінокислот. Амінокислоти, ідентифіковані як гнучкі, заміняють відповідними амінокислотами в модельній послідовності, що має найбільш сильну подібність. До розглянутих небажаних мотивів послідовностей відносяться: аспартат-пролін (пептидний зв'язок, що є нестійким в кислому середовищі), аспарагін-х-серин/треонін (сайт глікозилування, X означає будь-яку амінокислоту, за винятком проліну), аспартат-гліцин/серин/треонін (потенційне утворення ланки сукцинімід/ізоаспартат у гнучких зонах), аспарагінгліцин/гістидин/серин/аланін/цистеїн (сайти, піддані деамідуванню), метіонін (окислювання в експонованих зонах). Одержані в такий спосіб гуманізовані послідовності в підсумку порівнюють по алгоритму BLAST порівняння послідовностей з послідовностями бази даних IEDB (http://www.immuneepitope.org/ The immune epitope database and analysis resource: from vision to blueprint. PLo Biol. 2005, Mar., 3(3):e91) для перевірки того, що послідовності не містять відомих епітопів, що забезпечують розпізнавання клітинами лімфоцитів B і T. Якщо послідовність містить залишки, що являють собою небажані послідовності, то їх також модифікують. Якщо комбінована послідовність містить відомий епітоп, описаний у IEDB, то як модель використовують іншу референтну гермінальну структуру, що має сильну подібність. Більш переважно антитіло за даним винаходом містить послідовності, ідентичні щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:30 або SEQ ID NO:32, у комбінації з послідовностями, ідентичними щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:34, послідовності SEQ ID NO:36 або послідовності SEQ ID NO:38. В одному з варіантів здійснення антитіло за даним винаходом містить варіабельні легкі ланцюги послідовності SEQ ID NO:30 і варіабельні важкі ланцюги послідовності SEQ ID NO:34. В іншому варіанті здійснення антитіло за даним винаходом містить варіабельні легкі ланцюги послідовності SEQ ID NO:32 і варіабельні важкі ланцюги послідовності SEQ ID NO:38. В іншому варіанті здійснення антитіло за даним винаходом містить варіабельні легкі ланцюги послідовності SEQ ID NO:30 і варіабельні важкі ланцюги послідовності SEQ ID NO:36. В іншому варіанті здійснення антитіло за даним винаходом містить варіабельні легкі ланцюги послідовності SEQ ID NO:32 і варіабельні важкі ланцюги послідовності SEQ ID NO:34. В іншому варіанті здійснення антитіло за даним винаходом містить варіабельні легкі ланцюги послідовності SEQ ID NO:32 і варіабельні важкі ланцюги послідовності SEQ ID NO:36. В іншому варіанті здійснення антитіло за даним винаходом містить варіабельні легкі ланцюги послідовності SEQ ID NO:30 і варіабельні важкі ланцюги послідовності SEQ ID NO:38. Даний винахід стосується також антитіл людини, що є специфічними антагоністами FGF-R4. Такі антитіла можуть бути одержані способами фагового відображення, відомими фахівцям у даній галузі техніки (McCafferty J. et al., 1990; Hoogenboom H.R. et al., 2005). Можуть бути використані інші технології одержання антитіл людини, такі як технологія XenoMouse, описана в US 5939598. У переважному варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, являє собою антитіло людини, у якому варіабельні частини важкого ланцюга містять послідовність, ідентичну щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:76, 86, 96 або 106. В іншому варіанті здійснення антитіло, що є специфічним антагоністом рецептора FGF-R4, являє собою антитіло людини, у якому варіабельні частини легкого ланцюга містять послідовність, ідентичну щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:71, 81, 91 або 101. Даний винахід стосується також антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і має важкий ланцюг, що містить варіабельну частину, що кодується 11 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 нуклеотидною послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:77, 87, 97 або 107. Даний винахід стосується також антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і має легкий ланцюг, що містить варіабельну частину, що кодується нуклеотидною послідовністю, ідентичною щонайменше на 80, 90, 95 або 99 % послідовності SEQ ID NO:72, 82, 92 або 102. Даний винахід стосується також антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і містить послідовності, що кодуються нуклеотидними послідовностями SEQ ID NO:71 і 76 або нуклеотидними послідовностями SEQ ID NO:81 і 86, або нуклеотидними послідовностями SEQ ID NO:91 і 96, або нуклеотидними послідовностями SEQ ID NO:101 і 106. Даний винахід стосується також антитіла людини, що є специфічним антагоністом рецептора FGF-R4 і містить поліпептидні послідовності SEQ ID NO:72 і 77 або поліпетидні послідовності SEQ ID NO:82 і 87, або поліпетидні послідовності SEQ ID NO:92 і 97, або поліпетидні послідовності SEQ ID NO:102 і 107. Більш переважно антитіло людини, що є специфічним антагоністом рецептора FGF-R4, містить поліпептидні послідовності SEQ ID NO:82 і 87. Модифіковані в такий спосіб послідовності амінокислот можуть бути модифіковані також за допомогою посттрансляційних змін під час продукування в клітині ссавця. Зокрема, використання неповних стабільних ліній у біосинтезі фукози може забезпечувати одержання моноклональних антитіл, у яких N-глікан Fc (положення № 297) або частково цілком не містить фукозу і забезпечує посилення дії ефектора ADCC (Kanda et al., 2006, Biotechnol. Bioeng. 94:680-688 і Ripka et al., 1986, Arch. Biochem. Bioph. 249: 533-545). В іншому варіанті здійснення даного винаходу специфічний антагоніст FGF-R4 являє собою кон'юговане антитіло. Антитіла можуть бути кон'юговані з цитотоксичним агентом. Термін "цитотоксичний агент", у даному випадку, означає речовину, що утрудняє або блокує функціонування або ріст клітин або викликає руйнування клітин. В одному з варіантів здійснення антитіло або його єднальний фрагмент може бути кон'югований з лікарським засобом, таким як маїтансиноїд, для утворення "проліків", що мають цитотоксичність стосовно клітин, що експресують антиген. Цитотоксичний агент за даним винаходом може являти собою будь-яку сполуку, наслідком дії якої є загибель клітини або яка індукує загибель клітини, або яка різними способами знижує життєздатність клітин. У число переважних цитотоксичних агентів входять, наприклад, маїтинсиноїди й аналоги маїтинсиноїдів, таксоїди, CC-1065 і аналоги CC-1065, доластатин і аналоги доластатину, визначені вище. Такі цитотоксичні агенти кон'юговані з антитілами, фрагментами антитіл, функціональними еквівалентами, поліпшеними антитілами і їх аналогами, як описано в даному описі. Кон'юговані антитіла можуть бути одержані способами in vitro. Для зв'язування лікарського засобу або проліків з антитілом використовують сполучну групу. Придатні сполучні групи добре відомі фахівцям у даній галузі техніки і включають, зокрема, дисульфідні групи, тіоефірні групи, лабільні кислотні групи, фотонестабільні групи, лабільні пептидазні групи і лабільні естеразні групи. Переважні сполучні групи являють собою дисульфідні і тіоефірні групи. Наприклад, кон'югована сполука може бути одержана по реакції дисульфідного обміну або за рахунок утворення тіоефірного містка між антитілом і лікарським засобом або проліками. Такі сполуки як метотраксетат, даунорубіцин, вінкристин, вінбластин, мелфалан, мітоміцин C, хлорамбуцил, каліхеаміцин, тубулізин і аналоги тубулізину, дуокарміцин і аналоги дуокарміцину, доластатин і аналоги доластатину, є також придатними для одержання кон'югованих сполук за даним винаходом. Молекули також можуть бути зв'язані з молекулами антитіла за допомогою проміжної молекули, такої як сироватковий альбумін. Доксорубіцин і сполуки доксорубіцину, як описано, наприклад, у US 09/740991, також можуть являти собою придатні цитотоксичні агенти. Антитіла, що представляють собою об'єкт даного винаходу, можуть бути зв'язані з цитотоксичною молекулою або сполукою. Вони також можуть бути зв'язані з антиангіогенною сполукою, що діє на інші шляхи ангіогенезу. Під "клітинами, що експресують FGF-R4" розуміють будь-яку еукаріотну клітину, зокрема, ссавців і переважно людини, що експресує рецептор FGF-R4 у його нативній мутантній або формі. FGF-R4 також може знаходитися у своїй повнорозмірній або усіченій формі, що містить, наприклад, позаклітинний домен FGR-R4, зокрема домени D2-D3. FGF-R4 також може бути рекомбінований у химерну форму. 12 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки за даним винаходом можуть бути введені у фармацевтичні композиції для введення топічним, пероральним, парентеральним, інтраназальним, внутрішньовенним, внутрішньом'язовим, підшкірним, інтраокулярним і т. д. шляхами Фармацевтичні композиції переважно містять фармацевтично прийнятні носії для сполуки, призначеної для ін'єкцій. Мова може йти, зокрема, про сольові розчини (мононатрійфосфат, динатрійфосфат, хлориди натрію, калію, кальцію або магнію і т. д. або суміші таких солей), стерильних розчинах, ізотонічних розчинах або сухих композиціях, зокрема ліофілізованих композиціях, що при відповідному додаванні стерилізованої води або фізіологічного розчину дають можливість одержання розчинів для ін'єкцій. Релевантні патології можуть являти собою будь-які захворювання, зв'язані з ангіогенезом пухлинної або непухлинної природи. Релевантні патології можуть являти собою рак (що потребує використання антагоністів за даним винаходом як інгібіторів ангіогенезу пухлин), зокрема, рак печінки, товстої кишки, молочної залози або легенів, предміхурової залози, підшлункової залози або шкіри, або такі патології, при яких порушення регуляції ангіогенезу описується як вікова дегенерація жовтої плями або DMLA, запальні захворювання, такі як ревматоїдний артрит, остеоартрит, коліти, виразки або будь-які запальні захворювання кишечнику, атеросклероз або ожиріння. Антитіла анти-FGF-R4 також можуть бути використані для лікування раку, зокрема гепатокарциноми й інших ракових захворювань печінки, і раку підшлункової залози як інгібітор, що здійснює вплив безпосередньо на ріст пухлини. Даний винахід пояснюється наведеними далі прикладами без обмеження обсягу охорони. Опис фігур Фігури 1A і 1B. Ендотеліальні клітини людини типу HUVEC здатні in vitro (Фіг. 1A) утворювати мережу псевдотубул, що називається ангіогенною. Цю мережу стимулюють додаванням 1 нг/мл FGF2. Така індукція може бути одержана також додаванням 10 нг/мл FGF19, що представляє собою специфічний ліганд FGF-R4, тоді як додавання 10 нг/мл FGF4 (неактивуючий ліганд FGFR4) не здатне стимулювати ангіогенез. Аналогічно in vivo (Фіг. 1B), на мишачій моделі індукції ангіогенезу в імплантаті губки на спині миші, FGF2 здатний індукувати збільшення числа нових судин, що є функціональними стосовно губки, що характеризується збільшенням рівня гемоглобіну в таких губках, у порівнянні з контролем. FGF19 також здатний індукувати такий ангіогенез у губці. Фіг. 2A. Карта плазміди pXL4614, що забезпечує експресію hFGFR4-Histag (SEQ ID NO:40) Фіг. 2B. Карта плазміди pXL4613, що забезпечує експресію hFGFR4-Streptag (SEQ ID NO:69) Фіг. 3. Карта плазміди pXL4615, що забезпечує експресію hFGFR4(D2,D3)-Histag (SEQ ID NO:42) Фіг. 4. Карта плазміди pXL4621, що забезпечує експресію mFGFR4-Histag (SEQ ID NO:44) Фіг. 5. Карта плазміди pXL4328, що забезпечує експресію hFGFR1-Fc (SEQ ID NO:46) Фіг. 6. Карта плазміди pXL4327, що забезпечує експресію hFGFR2-Fc (послідовність SEQ ID NO:48) Фіг. 7. Пластини ELISA, покриті 4 рецепторами людини FGF. Здатність антитіл анти-FGFR4 40-12 і 64-12 розпізнавати різні FGF-R визначають аналізом ELISA. Клон 40-12 (гістограма чорного кольору) є специфічним до FGF-R4. Крім того, клон 64-12 (гістограма сірого кольору) розпізнає в дуже малій мірі FGF-R3. Фіг. 8A і 8B. Активне антитіло-антагоніст 40-12 і його інактивний контроль 64-12 не здійснюють власного впливу на базальний ангіогенез. Навпроти, при дозі 30 мкг/мл (приблизно 200 нM) моноклональне антитіло анти-FGFR4 40-12 здатно інгібувати ангіогенез клітин HUVEC, індукований FGF2, тоді як контрольне антитіло 64-12 не здатне на таку дію (Фіг. 8A). ® FGF2, мічений реактивом AlexaFluor 488 нм, здатний зв'язуватися з FGF-R4, що експресується клітинами 300-19 (гістограма білого кольору). Ця взаємодія може бути зруйнована неміченим FGF2 (гістограми чорного кольору) або антитілом анти-FGFR4 40-12 (гістограми темно-сірого кольору), тоді як антитіло-свідок 64-12 не здатне на таку дію (гістограми ясно-сірого кольору) (Фіг. 8B). Фіг. 8C і 8D. Дія антитіл анти-FGFR4, що походять від клонів 8, 31, 33 і 36, при 10 мкг/мл на ангіогенез in vitro, індукований 3 нг/мл FGF-2. Клони 8 (Фіг. 8C) і 31, 33 і 36 (Фіг. 8D) інгібують ангіогенез клітин HUVEC, індукований FGF-2. Фіг. 9A і 9B. Клітини гепатокарциноми людини Hep3b стимулюють за допомогою FGF19 при 30 нг/мл. Така стимуляція індукує специфічну клітинну сигналізацію FGF-R4, що приводить до синтезу білків cFos і JunB і до фосфорилування Erk1/2, що спостерігається способом вестернблотингу (Фіг. 9A). При цьому для кожної смуги здійснюють кількісне визначення. Таке кількісне визначення представлене у вигляді гістограми (Фіг. 9B). Антитіло 40-12 при 100 мкг/мл цілком 13 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 інгібує індукцію специфічної клітинної сигналізації за допомогою FGF-R4, тоді як контрольне антитіло не здійснює якого-небудь впливу. На практиці, антитіло 40-12 цілком блокує синтез JunВ і cFos, а також фосфорилування Erk1/2, індуковане за допомогою FGF19 після стимуляції протягом 3 год. Фіг. 9C. Інгібуючий вплив антитіла анти-FGFR4 40-12 на фосфорилування Erk1/2, індуковане в клітинах Hep3b за допомогою FGF-19 (30 нг/мл), підтверджено за методикою ELISA з антифосфоERk1/2. Антитіло 40-12 також здатне інгібувати фосфорилування Erk1/2 у клітинах Hep3b, стимульоване за допомогою FGF-2 (1 нг/мл) або 10 %-й сироваткою (SVF). Фіг. 9D. Процентна міра інгібування фосфорилування Erk1/2, індукованого за допомогою FGF-19 (30 нг/мл), за методикою ELISA у клітинах Hep3b з використанням антитіл, що походять від клонів 8, 31, 33 і 36 Фіг. 10A і 10B. Проліферація клітин Hep3b може бути стимульована додаванням сироватки (Фіг. 10A) або FGF19 (Фіг. 10B). Індукція сироваткою частково інгібована антитілом 40-12 при 100 мкг/мл, тоді як контрольне антитіло не здійснює такого впливу (Фіг. 10A). Проліферація, індукована за допомогою FGF19, цілком блокована антитілом анти-FGFR4 40-12 при 10 мкг/мл, тоді як контрольне антитіло при такій же дозі не здатне на таку дію (Фіг. 10B). Фіг. 11A-11D. Антитіло анти-FGFR4 40-12 здатне зменшити розвиток пухлин підшлункової залози на мишачій моделі RipTag, інгібуючи ангіогенез пухлини. Модель Rip1-Tag2 являє собою мишачу модель, у якій трансгенні миші експресують антиген T SV40 у β-клітинах острівців підшлункової залози, що продукують інсулін (Hanahan D. Nature, 1985, 9-15:115-22.). Такий антиген T експресується під час ембріонального розвитку підшлункової залози до 4-5 тижнів життя без очевидної дії. При цьому частина острівців підшлункової залози, що експресують антиген T, прогресує протягом наступних 5 тижнів з утворенням ангіогенних острівців, зв'язаних з активацією судинної мережі, і потім з розвитком невеликих пухлин типу аденоми. Після кількох тижнів деякі аденоми розвиваються з утворенням інвазивних карцином (Фіг. 11A). Мишам Rip1Tag2 підшкірно вводили один раз на тиждень у проміжку від 10 до 13 тижнів дози 25 мг/кг антитіла 40-12 або контрольного антитіла. Через 13 тижнів мишей умертвляли. Визначали обсяг пухлин, а також число пухлин підшлункової залози і чисельну щільність судин. Обробка антитілом анти-FGFR4 40-12 дозволяє значно зменшити обсяг пухлин на 55 %, тоді як антитілосвідок не здійснює жодного впливу (Фіг. 11B). Антитіло 40-12 дозволяє також зменшити на 34 % число пухлин підшлункової залози, у порівнянні зі свідком (Фіг. 11C). Таке зменшення обсягу пухлин супроводжується зменшенням чисельної щільності судин, як у відношенні числа дрібних судин, так і числа середніх або великих судин (Фіг. 11D). Фіг. 12. Здатність антитіл 40-12 і 64-12 розпізнавати повнорозмірний позаклітинний домен FGF-R4 людини або миші, а також позаклітинний домен FGF-R4, усічений в області D1, визначають за методикою ELISA. Клон 40-12 здатний також добре зв'язуватися з 3 конструкціями FGF-R4, тоді як клон 64-12 погано розпізнає мишачу форму FGF-R4. Фіг. 13A-13C. Антагоністичний вплив антитіла анти-FGFR4 клону 40-12 на зв'язок FGF2/FGFR4 визначають у порівняльних дослідженнях на зв'язування з FGF2, міченим реактивом ® AlexaFluor 488 нм. Клон 40-12 здатний блокувати зв'язування з FGF2 людини (Фіг. 13A), миші (Фіг. 13B) і щура (Фіг. 13C) на клітинах 300-19 миші, трансфекованих за допомогою кДНК, що кодує людські, мишачі або щурячі форми рецептора FGF-R4, причому з однаковою ефективністю (3500, 4110 і 3940 нг/мл або 23, 27 і 26 нм для комплексів людини, миші або щура, відповідно). Фіг. 14A. Карта плазміди pXL4794, що забезпечує експресію hFGFR4_D1:Fc. Фіг. 14B. Послідовність амінокислот білка hFGFR4_D1:Fc, що секретується лінією HEK293, трансфекованою плазмідою pXL4794. Фіг. 15A. Карта плазміди pXL4796, що забезпечує експресію hFGFR4_D2:Fc. Фіг. 15B. Послідовність амінокислот білка hFGFR4_D2:Fc, що секретується лінією HEK293, трансфекованою плазмідою pXL4796. Фіг. 16A. Карта плазміди pXL4799, що забезпечує експресію hFGFR4_D3:Fc Фіг. 16B. Послідовність амінокислот білка hFGFR4_D3:Fc, що секретується лінією HEK293, трансфекованою плазмідою pXL4799. ПРИКЛАДИ Приклад 1. З'ясування ролі FGF-R4 у регуляції ангіогенезу Для демонстрації ролі FGF-R4 у регуляції ангіогенезу проводили дослідження по ангіогенезу in vitro з ендотеліальними клітинами людини типу HUVEC, стимульованими деякими FGF. FGF2 являє собою ліганд, що активує значну частину рецепторів FGF. FGF19 являє собою специфічний ліганд, що активує FGF-R4, і FGF4 являє собою ліганд, що не активує FGF-R4. 14 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 З цією метою, одержували гелі, вносячи в кожну з ямок слайд-камери (колаген Biocoat Cellware, тип I, 8-ямкові слайд-камери для культивування: Becton Dickinson 354630), 160 мкл матригелю, розведеного в співвідношенні 1/6 (матригель без фактора росту: Becton Dickinson 356230) у колагені (колаген із хвоста щура, тип I: Becton Dickinson 354236). Гель витримували протягом 1 години при 37°C для забезпечення його полімеризації. Потім клітини венозного 3 ендотелію людини (HUVEC, номер в каталозі: C-12200-Promocell) висівали з розрахунку 1510 клітини/ямку в 400 мкл середовища EBM (Clonetics C3121)+2 % FBS+hEGF, 10 мкг/мл. Дана методика може бути адаптована до 96-ямкових планшетів: 60 мкл на ямку 96-ямкових планшетів (планшети Biocoat collagen cellware, Becton Dickinson 354407). Матрицю готували, змішуючи 1/3 матригелю, колаген до кінцевої концентрації 1 мг/мл, NaOH (0,026 колагену в мкл), PBS 1, потім обсяг суміші доводили водою. Ендотеліальні клітини стимулюють за допомогою 1 нг/мл FGF2 (R&D, 133-FB-025) або 10 нг/мл FGF4 (R&D, 235-F4-025), або FGF19 (R&D, 969-FG-025) протягом 24 год. при 37°C в атмосфері з 5 % CO2. Через 24 години вимірюють довжину мережі утворених мікротубул за допомогою комп'ютерної системи аналізу зображень (Imagenia Biocom, Куртабеф, Франція) і визначають загальну довжину псевдотубул у кожній з ямок. Середнє значення загальної довжини мережі мікрокапілярів розраховують у мкм для кожного режиму, що відповідає середньому з 6 повторів. Стимуляція за допомогою FGF2 або FGF19 забезпечує індукцію утворення нових тубул, тоді як FGF4 не здійснює такого впливу (Фіг. 1A). Одержані результати показують, що специфічнаактивація FGF-R4 забезпечує індукцію формування нових судин, і, таким чином, дозволяють зробити висновок, що FGF-R4 регулює ангіогенез in vitro. Кореляція даних in vivo з даними in vitro була одержана за допомогою моделі індукції ангіогенезу in vivo в імплантатах целюлози на мишах. Дана модель являє собою адаптацію моделі, описаної Andrade et al. (Microvascular Research, 1997, 54, 253-61). Тварин, близькоспоріднених білих мишей BALB/c, анестезували уведенням ® внутрішньочеревинно суміші "ксилазин (Rompun , 10 мг/кг)/кетамін (Imalgene 1000, 100 мг/кг)". ® Спину тварини голили і дезінфікували засобом Héxomédine . На спині миші створювали повітряний мішок ін'єкцією підшкірно 5 мл стерильного повітря. На спині тварини виконували розріз приблизно 2 см довжиною для введення імплантату зі стерильної целюлози (диск ® діаметром 1 см, товщиною 2 мм, Cellspon , номер в каталозі: 0501), просоченої 50 мкл стерильного розчину, що містить білок або випробовувану речовину. Потім розріз зашивали і ® дезінфікували засобом Héxomédine . У наступні після впровадження імплантату дні мишам вводили в імплантат білок або випробовувану речовину ін'єкцією черезшкірно (50 ® мкл/імплантат/день) після інгаляційної анестезії (5 %-й ізофлюран (Aerrane , Baxter)). Через сім днів після впровадження губки мишей умертвляли уведенням внутрішньочеревинно летальної дози пентобарбіталу натрію (CEVA santé animale). Потім шкіру розрізали на відстані приблизно 1 см навколо губки, уникаючи шва, для вилучення шкіри і губки. Потім губку розрізали на кілька ® шматків і поміщали в пробірки Ribolyser , що містять 1 мл лізуючого буферного розчину (Cell Death Detection ELISA, Roche). Пробірки перемішували послідовно 4 рази протягом 20 сек. у ® режимі 4 на подрібнювачі клітин (FastPrep FP 120). Потім пробірки центрифугували протягом 10 хв. при 2000 g і 20°C і супернатанти заморожували при -20°C до проведення кількісного визначення гемоглобіну. У день аналізу після розморожування пробірки знову центрифугували і визначали концентрацію гемоглобіну з реактивом Драбкіну (Sigma, об./об.) на спектрофотометрі при 405 нм у порівнянні з еталонною серією бичачого гемоглобіну (Sigma). Концентрацію гемоглобіну в кожному зразку виражали в мг/мл відповідно до поліноміальної регресії, одержаної виходячи з еталонної серії. Результати виражали як середнє значення (±СКВ) для кожної групи. Розходження між групами перевіряли методом ANOVA за критерієм Даннета щодо квадратного кореня значень. У даній моделі FGF19 у кількості 50 нг на одне місце при 5 повторних ін'єкціях здатний індукувати значну колонізацію губки зрілими судинами, знову утвореними з такою же ефективністю, як і у випадку FGF2 у кількості 5 нг на одне місце. Наявність функціональних кровоносних судин у губці було виявлено по присутності гемоглобіну (Фіг. 1B). Одержані результати показують, що специфічна активація FGF-R4 забезпечує збільшення числа функціональних кровоносних судин, що вказує на те, що FGF-R4 регулює ангіогенез також in vivo. Приклад 2. Опис білків FGFR, використаних як імуногени і антигени. Рецептори факторів росту FGFR і, зокрема, їх позаклітинні домени FGF-R1, FGF-R2, FGFR3, FGF-R4, з'єднували з міткою (Histag) або з доменом Fc імуноглобуліну. 15 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 кДНК, що кодує позаклітинний домен FGF-R4 людини, являє собою білок, описаний у SwissProt FGF-R4_HUMAN, положення 1-365 з мутацією L136P. Її клонували в експресіному еукаріотичному векторі pXL4614, показаному на Фіг. 2, для експресії білка, що містить Histag у C-кінцевому положенні в позаклітинному домені. Білки, що називаються hFGFR4-Histag, послідовності SEQ ID NO:40 одержували транзиторною трансфекцією у лінії HEK293 EBNA (Invitrogen) за допомогою плазміди pXL4614 і допоміжних плазмід pXL4544 і pXL4551, що забезпечують експресію двох ферментів глікозилування N-гліканів, тобто α-2,3-сіалілтрансферази і β-1,4-галактозилтрансферази, як описано в WO 2008/065543. Білок hFGFR4-Histag, експресований у супернатант культури клітин HEK293 EBNA, очищали хроматографією на колонці з Ni-хелатуючою сефарозою (Amersham Biosciences, номер в каталозі: 17-0575-01) при елююванні буферним розчином імідазолу і потім змішували з буферним розчином PBS (Invitrogen, номер в каталозі: 14190-094). Аналіз композиції моносахаридів і кількісне визначення сіалових кислот N-гліканів, як описано Saddic et al. (2002, Methods Mol. Biol. 194:23-36) і Anumula et al. (1998, Glycobiology, 8:685-694), дозволили показати, що білок був у значній мірі сіалілований (91 %). Отже, білок мав усі характеристики для того, щоб мати достатні фармакокінетичні властивості. Для порівняння білок hFGFR4-Streptag (SEQ ID NO:69) очищали хроматографією на колонці Strep-Tactin Superflow (IBA, номер в каталозі: 2-0575-01) при елююванні буферним розчином дезтіобіотину і потім змішували з буферним розчином PBS. Білок hFGFR4(D2,D3)-Histag відповідає послідовності SEQ ID NO:42. кДНК клонували в експресійній еукаріотичній плазміді pXL4615, показаній на Фіг. 3, і білок одержували й очищали в умовах, порівнянних з умовами одержання білка hFGFR4-Histag. кДНК, що кодує білок mFGFR4-Histag (SEQ ID NO:43), клонували в експресійній еукаріотичній плазміді pXL4621, показаній на Фіг. 4, і білок одержували й очищали в умовах, порівнянних з умовами одержання білка hFGFR4-Histag. Білок hFGFR1-Fc (SEQ ID NO:46) містить позаклітинний домен FGF-R1 IIIc людини, приєднаний C-кінцевою ділянкою до домену Fc IgG1 людини. кДНК клонували в експресійній еукаріотичній плазміді pXL4728, показаній на Фіг. 5, і білок одержували в умовах, порівнянних з умовами одержання білка hFGFR4-Histag, потім очищали афінною хроматографією на колонці з протеїн-G-сефарозою (Amersham Biosciences) при елююванні буферним розчином 100 мм гліцин/HCl, p=2,7 і потім змішували з буферним розчином PBS. Білок hFGFR2-Fc послідовності SEQ ID NO:48 містить позаклітинний домен FGF-R2 IIIc людини, приєднаний C-кінцевою ділянкою до домену Fc IgG1 людини. кДНК клонували в експресійній еукаріотичній плазміді pXL4327, показаній на Фіг. 6, і білок одержували і потім очищали в умовах, порівнянних з умовами одержання білка hFGFR1-Fc. Білок hFGFR3-Fc, що представляє собою білок, який приєднує позаклітинний домен FGF-R3 IIIc людини до домену Fc IgG1 людини, одержували в системі R&D (номер в каталозі: 760-FR). Білок hFGFR4-Fc, що представляє собою білок, який приєднує позаклітинний домен FGF-R4 людини до домену Fc IgG1 людини, одержували в системі R&D (номер в каталозі: 685-FR). Різні субдомени позаклітинної частини білка hFGFR4 приєднували до домену Fc IgG1 людини. Субдомен D1 міститься в конструкції SABVA4794 (SEQ ID NO:112, Фіг. 14A і 14B). Субдомен D2 міститься в конструкції SABVA4796 (SEQ ID NO:114, Фіг. 15A і 15B). Субдомен D3 міститься в конструкції SABVA4799 (SEQ ID NO:116, Фіг. 16A і 16B). Зазначені три субдомени поширюються відповідно на положення 1-179 для SABVA4794, 1-32 і 145-242 для SABVA4796 і 1-32 і 228-360 для SABVA4799 (положення, описані в SwissProt FGF-R4_HUMAN). Дані білки одержували виходячи з плазміди pXL4794 (кодуюча послідовність SEQ ID NO:111), pXL4796 (кодуюча послідовність SEQ ID NO:113) і pXL4799 (кодуюча послідовність SEQ ID NO:115) в умовах, порівнянних з умовами одержання білка FGFR1-Fc. Приклад 3. Генерування і посів моноклональних антитіл анти-FGF-R4 A - Антитіла, одержані імунізацією Моноклональні антитіла одержували імунізацією імуногеном hFGFR4-Histag п'яти мишей BALB/c (Charles River) у віці від 6 до 8 тижнів, кожна з який була імунізована загальною дозою 24 мкг hFGFR4-Histag способом RIMMS, описаним Kilpatrick et al. (1997, Hybridoma, 16:381389), і за методикою злиття, описаною в наборі ClonaCell™-HY Hybridoma Cloning (StemCell Technologies, номер в каталозі: 03800). Через два дні після останньої ін'єкції мишей умертвляли, і лімфатичні вузли змішували з клітинами мієломи P3X63-AG8.653 (ATCC, CRL-1580) у співвідношенні 5:1 у присутності поліетиленгліколю (ClonaCell™-HY, номер в каталозі: 03806). Суспензію клітин розподіляли в стерильних умовах по чашках Петрі, інкубованих при 37°C в атмосфері з 5 % CO2. Колонії, що 16 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 з'явилися через 12 днів інкубування, виділяли і культивували в середовищі E (ClonaCell™-HY, номер в каталозі: 03805) у 96-ямкових планшетах. Первинний посів моноклональних антитіл, одержаних імунізацією за допомогою hFGFR4Histag, здійснювали методом ELISA, використовуючи як антиген-пастку hFGFR4-Streptag. Антиген-пастку фіксували на чашках Immulon-4 з імобілізованим ферментом (VWR Scientific Inc. Swedesboro, NJ). Потім додавали супернатанти культури гібридом і детектували за допомогою антимишачого антитіла кролика IgG, кон'югованого з пероксидазою (Sigma, номер в каталозі: A9044 - розведення 1:50000). Виявлення здійснювали із субстратом TMB-H2O2 (Interchim, номер в каталозі: UP664780), і вимірювання проводили за допомогою мікропланшетного фотометра при 450 нм. З 444 випробуваних гібридом 129 були позитивними при аналізі ELISA у випадку антигену hFGFR4-Streptag, причому з цього числа 120 гібридом були позитивними також у випадку димерного білка hFGFR4-Fc. Вторинний посів здійснювали для селекції тільки антитіл, що є специфічними стосовно FGFR4, методом ELISA, використовуючи як антиген-пастку білок hFGFR4-Streptag, потім білки hFGFR1-Fc, hFGFR2-Fc і hFGFR3-Fc, описані в прикладі 2. Антиген-пастку фіксували на чашках Immulon-4 з імобілізованим ферментом (VWR Scientific Inc. Swedesboro, NJ). Потім додавали супернатанти культури гібридом і детектували за допомогою антимишачого антитіла кролика IgG, кон'югованого з пероксидазою (Sigma, номер в каталозі: A9044 - розведення 1:50000). Виявлення здійснювали із субстратом TMB-H2O2 (Interchim, номер в каталозі: UP664780), і вимірювання проводили за допомогою мікропланшетного фотометра при 450 нм. З 129 випробуваних гібридом, що були позитивними при аналізі ELISA у випадку антигену, 84 гібридоми були позитивними у випадку hFGFR4-Streptag і не мали спорідненості ні до hFGFR1-Fc, ні до hFGFR2-Fc, ні до hFGFR3-Fc. У залежності від здатності до росту і морфології 39 гібридом були законсервовані. Їх ізотип визначали за допомогою набору SEROTEC (номер в каталозі: MMT1); 95 % належали до IgG1. Третинний посів здійснювали в дослідженні на проліферацію модифікованих клітин Baf/3, індуковану FGF2, для характеризування інгібування антитілами анти-FGFR4. Гібридоми миші, що експресують антитіла-антагоністи анти-FGFR4, клонували граничним розведенням. Виходячи з культивованих клітин гібридом у фазі експонентного росту, кодуючи послідовність (кДНК) визначали після екстракції мРНК за допомогою набору Oligotex (Qiagen, номер в каталозі: 72022); одержання й ампліфікація кДНК способом RACE-RT з набором Gene Racer, зворотна транскриптаза SuperScript III (Invitrogen, номер в каталозі: L1500) і ініціатори (праймери) описані в таблиці 2, наведеній нижче; ампліфікація фрагментів кДНК за допомогою полімерази Phusion (Finnzymes, номер в каталозі: F-530S), ініціатори (праймери) і умови температури описані в таблиці 2. Ампліфіковані фрагменти, які містять частини, що кодують VH (варіабельну частину важкого ланцюга HC) або VL (варіабельну частину легкого ланцюга LC), клонували у векторі pGEM-T Easy компанії Promega, номер в каталозі: A137A, вставки одержаних плазмід секвенували так, щоб кодуюча послідовність кожного варіабельного домена була досліджена в напрямку 5'-3' і 3'-5' щонайменше для 6 плазмід, що відповідають антитілам анти-FGFR4 40-12 і анти-FGFR4 64-12. Аналіз послідовностей, суміжностей і вирівнювань здійснювали за допомогою програми, доступної в Vector NTI (Invitrogen). Плазміди, що містять консенсусні послідовності, що кодують варіабельні частини антитіл анти-FGFR4, консервували. Плазміда pXL4691 містить послідовність, що кодує VH послідовності SEQ ID NO:5 антитіла анти-FGFR4 40-12, і плазміда pXL4693 містить послідовність, що кодує VH послідовності SEQ ID NO:19 антитіла анти-FGFR4 64-12, відповідно, представлені в наведеній нижче таблиці 2. Плазміда pXL4690 містить нуклеотидну послідовність SEQ ID NO:7, що кодує VL послідовності SEQ ID NO:8 антитіла анти-FGFR4 40-12, і плазміда pXL4692 містить нуклеотидну послідовність SEQ ID NO:21, що кодує VL послідовності SEQ ID NO:22 антитіла анти-FGFR4 6412, відповідно, представлені в наведеній нижче таблиці 2. 17 UA 107782 C2 Таблиця 2 Робочі умови й аналіз реакцій зворотної транскриптази і PCR-ідентифікація плазмід pXL4690pXL4693 Анти-FGFR4 Реакція RT Температура Праймери Праймер 5'-GeneRacer (SEQ ID NO:63) Праймер 3'- поміщений у шарнір миші (SEQ ID NO:64) Праймер 3'-поміщений у Ck миші (SEQ ID NO:65) Праймер 3'- поміщений у Cλ миші 40-12 55°C SEQ ID NO:64 (HC) 55°C SEQ ID NO:64 (HC) SEQ ID NO:66 і SEQ ID NO:67 SEQ ID NO:65 (LC) (LC) 5'-CGACTGGAGCACGAGGACACTGA-3' 5'-TATGCAAGGCTTACAACCACA-3' 5'-CTCATTCCTGTTGAAGCTCTTGAC-3' 5'-ACACTCAGCACGGG ACAAACTCTTCTC-3' 5'-ACACTCTGCAGGAG ACAGACTCTTTTC-3' (SEQ ID NO:66 і SEQ ID NO:67) PCR HC: Температура Праймери Послідовність клонованих продуктів PCR (VH) Плазміда, що містить VH PCR LC: Температура Праймери Послідовність клонованих продуктів PCR (VL) Плазміда, що містить VL 5 10 15 64-12 55°C SEQ ID NO:63-SEQ ID NO:64 9 клонів мають однакову послідовність VH і послідовність CH1, ідентичні послідовності mCH1 pXL4691 55°C SEQ ID NO:63-SEQ ID NO:65 11 клонів мають однакову послідовність VL і послідовність Ck, ідентичні послідовності mCk pXL4690 55°C SEQ ID NO:63-SEQ ID NO:64 6 клонів мають однакову послідовність VH і послідовність CH1, ідентичні послідовності mCH1 pXL4693 55°C SEQ ID NO:63-SEQ ID NO:66 і 67 6 клонів мають однакову послідовність VL і послідовність Cλ, ідентичні послідовності mλ pXL4692 Послідовності амінокислот відповідно легких і важких варіабельних частин антитіл антиFGFR4 64-12 і анти-FGFR4 40-12 різні. Номера використаних, одержаних і розшифрованих послідовностей зазначені в таблиці 7. Антитіла 40-12 і 64-12 одержували у флаконах T500. Супернатант культури відбирали через 7 днів. Антитіла анти-FGFR4 очищали по спорідненості на білок G і потім діалізом проти фільтрувального стерильного PBS і зберігали при 4°C. -9 Очищені антитіла-антагоністи мали значення KD, що дорівнюють 6,510 M (анти-FGFR4 40-8 12) і 5,7510 M (анти-FGFR4 64-12). B - Антитіла, відібрані способом фагового дисплея Первинний посів моноклональних антитіл, одержаних способом фагового дисплея з hFGFR4-Histag, здійснювали методом ELISA, використовуючи як антиген-пастку hFGFR4-Histag. Антиген-пастку фіксували на чашках Immulon-2 з імобілізованим ферментом (VWR Scientific Inc. Swedesboro, NJ). Потім додавали супернатанти культури E. coli, інфікованої фагами, і далі детектували за допомогою антитіла миші антиM13, кон'югованого з пероксидазою (GE Healthcare, номер в каталозі: 27-9421-01, розведення 1:5000). Виявлення здійснювали із 18 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 субстратом TMB-H2O2 (Interchim, номер в каталозі: UP664780), і вимірювання проводили по оптичній густині (O.D.) при 450 нм. Вторинний посів здійснювали для селекції тільки антитіл, що є специфічними стосовно FGFR4, методом ELISA, використовуючи як антиген-пастку білок hFGFR4-Histag, потім білки hFGFR1-Fc, hFGFR2-Fc і hFGFR3-Fc, описані в прикладі 2. Антиген-пастку фіксували на чашках Immulon-2 з імобілізованим ферментом (VWR Scientific Inc. Swedesboro, NJ). Потім додавали супернатанти культури E. coli, інфікованої фагами, і далі детектували за допомогою антитіла миші антиM13, кон'югованого з пероксидазою (GE Healthcare, номер в каталозі: 27-9421-01, розведення 1:5000). Виявлення здійснювали із субстратом TMB-H2O2 (Interchim, номер в каталозі: UP664780), і вимірювання проводили по оптичній густині (O.D.) при 450 нм. Відібрані клони, що є специфічними стосовно FGF-R4, секвенували і реклонували в експресійному векторі для транзиторною трансфекції клітин HEK293. З цією метою, на першій стадії області, що кодують Fab, тобто легкий ланцюг антитіла, сайт зв'язування бактеріальної рибосоми і варіабельну область важкого ланцюга антитіла, витягали з фагміди рестрикцією і вставляли в плазміду експресії IgG клітин ссавців у вихідній частині сигнальної послідовності еукаріотичного антитіла і у вхідній частині константної області важкого ланцюга IgG1 людини. На другій стадії область, що містить сайт зв'язування бактеріальної рибосоми і бактеріальний сигнальний пептид важкого ланцюга, заміняли послідовністю IRES і еукаріотичною сигнальною послідовністю. IgG експресували транзиторною трансфекцією клітин HEK293. Цей процес докладно описаний T. Jostock et al., Journal of Immunological Methods, 289 (2004), 65-80. Приклад послідовності константної області IgG1 людини, що може бути використана в даному винаході, являє собою послідовність SEQ ID NO:117. Третинний посів здійснювали в дослідженні на проліферацію модифікованих клітин Baf/3, індуковану FGF2 і описану в прикладі 4, для характеризування інгібування антитілами антиFGFR4, використовуючи супернатанти культур клітин HEK293, транзиторно трансфекованих експресійними векторами антитіл. Даний посів дозволив ідентифікувати антитіла клонів 8, 31, 33 і 36. Відповідні послідовності описані в таблиці 7. Приклад 4. Одержання клонової лінії мишачих клітин Ba/3 FGF-R4-hMpI і методика клітинної проліферації Позаклітинну і трансмембранну частину FGF-R4 клонували транслюючим злиттям із внутрішньоклітинним доменом hMpI у мутантному векторі pEF6/V5-His A для одержання в положенні 5' мітки HA перед химерним рецептором FGF-R4-hMpI. Конструкція мутантного pEF6A Вектор pEF6/V5-His A (Invitrogen, номер в каталозі: V961-20) поліпшували для інтеграції полілінкера MCS (сайт множинного клонування), зв'язаного з міткою HA, розміщеною в сигнальному пептиді IgGk pDisplay (Invitrogen, номер в каталозі: V660-20). З цією метою, MCS, зв'язані з міткою HA і її сигнальним пептидом, ампліфікували за допомогою PCR між прямим праймером послідовності SEQ ID NO:51 і зворотним праймером послідовності SEQ ID NO:52, що дозволяє вставляти сайти рестрикції KpnI у положення 5' і XbaI у положення 3'. Фрагмент PCR гідролізували ферментами KpnI і XbaI і потім клонували у векторі pEF6/V5-His A, розкритому тими ж ферментами. Нарешті, перший сайт BamHI MCS заміняли сайтом BsrGI, гидролизуя знову утворений вектор ферментами KpnI і Spe і вставляючи між даними сайтами праймери послідовностей SEQ ID NO:53 і SEQ ID NO:54, гібридизовані між собою й які містять ферментативний сайт BsrGI. Одержаний вектор був названий pEF6mut-HA. Конструкція вектора pEF6mut-HA-FGF-R4-hMpI Внутрішньоклітинний домен MpI ампліфікували у векторі pEF6/V5-His TOPO (Invitrogen, номер в каталозі: K9610-20) між прямим праймером послідовності SEQ ID NO:55, що дозволяє вбудовувати гідролізуючий сайт SacI, і зворотним праймером послідовності SEQ ID NO:56, що називається традиційно revBGH. Потім одержані фрагменти PCR гідролізували ферментами SacI і NotI. Позаклітинний і трансмембранний домен FGF-R4 ампліфікували за допомогою пари праймерів (прямий праймер: послідовність SEQ ID NO:57; зворотний праймер: послідовність SEQ ID NO:58). Дані праймери забезпечують вставку ферментативних сайтів BamHI у положення 5' і SacI у положення 3'. Потім одержаний фрагмент PCR гідролізували ферментами BamHI і SacI. Потім ампліфікації ДНК, що кодує hMpI і FGF-R4, клонували одночасно у векторі pEF6mutHA, розкритому BamHI-Not. Одержана в результаті конструкція була названа "pEF6mut-HA-FGFR4αIIIc-hMpI2". Потім цю конструкцію поліпшували спрямованим мутагенезом для заміни трансмембранного домена FGF-R4 (білкова послідовність SEQ ID NO:59) послідовністю SEQ ID 19 UA 107782 C2 ® 5 10 15 20 25 30 35 40 45 NO:60. З цією метою, використовували набір "QuickChange Site-directed mutagenesis" (Clontech, номер в каталозі: 200518) із прямим праймером послідовності SEQ ID NO:61 і зворотним праймером послідовності SEQ ID NO:62. Одержана нова химерна конструкція була названа pEF6mut-HA-FGF-R4αIIIcmut-hMpI2. Створення стабільної лінії трансфекцією лінії мишачих клітин BaF/3 за допомогою конструкції FGF-R4αIIIcmut-hMpI2 Конструкцію "pEF6mut-HA-FGF-R4αIIIcmut-hMpI2" стабільно вставляли електропорацією у геном мишачих клітин BaF/3. Одержану лінію відбирали в присутності FGF2 при 20 нг/мл (R&D, номер в каталозі: 234-FSE-025) і гепарину при 100 нг/мл (Sigma, номер в каталозі: H3149). При цьому трансфекована і відібрана лінія має клональний тип. Методика клітинної проліферації клітин лінії BaF/3-FGFR4-hMpI Клітини BaF/3-FGFR4-hMpI культивували і зберігали в повному середовищі RPMI 1640 (Invitrogen, номер в каталозі: 32404-014) (10 % SVF (Hyclone, номер в каталозі: SH30070.03), глутамін, 2 мM, MEM Non Essential Amino Acid 1 (замінна амінокислота, Gibco, номер в каталозі: 11 140-035), MEM Sodium Pyruvate 1x (піруват натрію, Gibco, номер в каталозі: 11360039)), доповнений FGF2, 20 нг/мл (R&D System, номер в каталозі: 234-FSE), і гепарином, 3 нг/мл 6 (Sigma, номер в каталозі: H3149). Наприкінці дня клітини висівали в кількості 0,410 клітин/мл у повне середовище RPMI 1640, доповнену FGF2, 20 нг/мл, і гепарином, 3 нг/мл. Наступного дня по 50 мкл суспензії клітин BaF/3-FGFR4-hMpI у повному середовищі RPMI 1640, доповненому 6 FGF2, 20 нг/мл, і гепарином, 3 нг/мл, з концентрацією 0,210 клітин /мл вносили в ямки 96ямкового планшета (Porvair, номер в каталозі: 214006) з наступним додаванням 50 мкл супернатанта гібридоми, що містить випробуване антитіло. Потім планшети інкубували при 37°C в атмосфері з 5 % CO2 протягом від 24 до 30 год. Для визначення рівня клітинної проліферації вміст АТФ кількісно визначали, додаючи 100 мкл реактиву Cell Titer Glo Luminesent Cell Viability Assay (Promega, номер в каталозі: G7571) і вимірюючи люмінесценцію люмінометром. Враховували клони, що дали в даному дослідженні сигнал на 50 % менше сигналу в повному середовищі RPMI 1640, що містить добавки FGF2, 20 нг/мл, і гепарину, 3 нг/мл. У випадку, коли антитіла анти-FGFR4, що є специфічними стосовно FGF-R4, інкубували з клітинами Baf/3-FGFR4-hMpI з наступним додаванням FGF2, 20 нг/мл, і гепарину, 3 нг/мл, був помічений антагоністичний вплив на клітинну проліферацію. З 39 випробуваних гібридом 14 здатно інгібувати клітинну проліферацію, індуковані FGF, клітин Baf/3-FGFR4-hMpI у присутності FGF2. Аналізом ELISA (Фіг. 12) було доведено, що антитіла-антагоністи анти-FGFR4 40-12 і 64-12 мають спорідненість до білка mFGFR4 миші і hFGFR4(D2,D3) людини. На закінчення здійснювали останній посів за методикою Surface Plasmon Resonance (BIAcore 2000) для визначення констант спорідненості антитіл анти-FGFR4. Взаємодія між білком FGF-R4 і антитілом анти-FGFR4, що відбувається в супернатанті культури гібридоми, досліджували після фіксації антитіла анти-FGFR4 антитілом анти-Fc, у свою чергу зафіксованого на чіпах CM. Вимірювання кінетики здійснювали за методикою Canziani et al., 2004. Anal. Biochem. 325: 301-307. -8 -9 Були обрані два антитіла з числа антитіл, що мають константи спорідненості від 10 до 10 -3 -5 -1 M і константи швидкості дисоціації від 10 до 10 з . Характеристики даних антитіл представлені в таблиці 1, наведеній нижче. Як стандартний спосіб для визначення KD була використана методика Surface Plasmon Resonance (BIAcore). Таблиця 1A Константи спорідненості й асоціації/дисоціації очищених антитіл-антагоністів анти-FGFR4 40-12 і 64-12 Анти-FGFR4 40-12 64-12 -1 -1 -1 kon (M ·с ) 1,94E+05 1,05E+04 koff (с ) 1,26E-03 6,02E-04 20 KD (M) 6,50E-09 5,75E-08 UA 107782 C2 Таблиця 1B Кінетичні параметри зв'язування антитіл анти-FGFR4 клонів 8, 31, 33 і 36, обмірювані за методикою Surface Plasmon Resonance (BIAcore 3000) -1 -1 Клон 8 Клон 31 Клон 33 Клон 36 5 10 15 20 Kon (M с ) 8,93E+05 6,48E+05 8,05E+05 2,44E+05 h-FGFR4-Histag -1 Koff (с ) 2,92E-04 9,80E-04 6,17E-04 6,31E-04 KD (M) 3,27E-10 1,52E-09 7,71E-10 2,62E-09 -1 -1 Kon (M с ) 1,20E+06 9,14E+05 1,01E+06 3,30E+05 m-FGFR4-Histag -1 Koff (с ) 1,36E-04 1,80E-03 7,04E-04 7,52E-04 KD (M) 1,15E-10 1,97E-09 6,92E-10 2,28E-09 Приклад 5. Специфічність антитіл анти-FGFR4 A - Специфічність антитіла анти-FGFR4 40-12 стосовно FGF-R4 Специфічність кожного антитіла визначали способом ELISA за методикою, описаною в прикладі 4. З цією метою досліджували здатність кожного антитіла зв'язуватися з кожним з FGFR. Даний експеримент ясно показує, що антитіло 40-12 розпізнає тільки FGF-R4 і, отже, є специфічним стосовно FGF-R4. Антитіло 64-12 здатне зв'язуватися, головним чином, з FGF-R4, а також слабко зв'язуватися з FGF-R3 (Фіг. 7). B - Специфічність антитіл анти-FGFR4 клонів 8, 31, 33 і 36 стосовно FGF-R4 Специфічність кожного антитіла визначали способом ELISA по описаній нижче методиці. Суспензії фагів, що мають на своїй поверхні антитіла формату Fab, одержували інфікуванням бактерій E. coli. Антигени-пастки фіксували на чашках Immulon-2 з імобілізованим ферментом (VWR Scientific Inc. Swedesboro, NJ). Потім додавали суспензії фагів і далі детектували за допомогою антифагового антитіла миші M13, кон'югованого з пероксидазою (GE Healthcare, номер в каталозі: 27-9421-01, розведення 1:5000). Виявлення здійснювали із субстратом TMBH2O2 (Interchim, номер в каталозі: UP664780), і вимірювання проводили по оптичній густині (O.D.) при 450 нм. У таблиці 2 коротко представлені одержані результати. З цією метою, досліджували здатність кожного антитіла зв'язуватися з кожним з FGF-R. Даний експеримент ясно показує, що антитіла клонів 8, 31, 33, 36 розпізнають тільки FGF-R4 і, отже, є специфічними стосовно FGF-R4. Таблиця 2 Специфічність антитіл анти-FGF-R4, що відбуваються від клонів 8, 31, 33 і 36, при визначенні по способі ELISA (сигнал=O.D. при 450 нм) Клон 8 Клон 31 Клон 33 Клон 36 25 30 35 h-FGFR4(D2,D3)-histag 2,55 2,52 2,73 1,87 h-FGFR1-Fc 0,05 0,00 0,00 -0,01 h-FGFR2-Fc 0,00 0,00 0,00 -0,01 h-FGFR3-Fc 0,00 0,01 -0,01 -0,02 Приклад 6. Антагоністична дія антитіла 40-12 і антитіл, що походять від клонів 8, 31, 33, 36, на ангіогенез (in vitro) Для визначення біологічної активності моноклонального антитіла 40-12 анти-FGFR4 під час ангіогенезу ендотеліальних клітин людини проводили дослідження по ангіогенезу in vitro із клітинами HUVEC, стимульованими за допомогою FGF2, у присутності антитіла 40-12 або антитіла-свідка в дозах, що збільшуються від 1 до 30 мкг/мл (Фіг. 8A і 8B). У підсумку показано, що активне моноклональне антитіло-антагоніст анти-FGFR4 40-12 здатне інгібувати ангіогенез клітин HUVEC, індукований FGF2, причому при дозі 30 мкг/мл або 200 нм, тоді як антитіло-свідок 64-12 не здійснює жодного впливу. Крім того, антитіло 40-12 не здійснює жодного власного впливу на базальний ангіогенез. Одержані результати вказують на те, що антитіло, що є специфічним антагоністом FGF-R4, здатне інгібувати ангіогенез. Як і у випадку антитіла 40-12, антитіла анти-FGFR4 клонів 8, 31, 33 і 36, одержаних способом фагового дисплея, оцінювали щодо їх здатності інгібувати ангіогенез ендотелиальних клітин людини типу HUVEC, індукований FGF-2. Ці 4 антитіла блокують стимуляцію ангіогенезу in vitro, викликану за допомогою FGF-2, причому при дозі 10 мкг/мл (Фіг. 8C і 8D). 21 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 7. Антагоністична дія антитіла 40-12 і антитіл, що походять від клонів 8, 31, 33, 36, на клітини гепатокарциноми людини (in vitro) Для визначення протипухлинної дії моноклонального антитіла-антагоніста анти-FGFR4 4012 проводили дослідження на клітинах гепатокарциноми людини Hep3b, у випадку якої проліферація і шляхи сигналізації, що приводять до неї, залежать від пари ліганд-рецептор FGF19/FGF-R4. По-перше, дослідження шляхів сигналізації, що залежать від FGF-R4 і приводять до проліферації клітин Hep3b, здійснювали способом вестерн-блотингу. Така клітинна сигналізація відбувається за допомогою неосинтезу білків cFos і JunВ, а також фосфорилування Erk1/2 (Lin 5 et al., J. Biol. Chem., 2007, 14:27277-84). З цією метою, 510 клітин висівали в чашку діаметром 35 мм у 2 мл повні середовища (DMEM, 10 % SVF, 2 мM глутаміну). Через 24 год. клітини поміщали в умови дефіциту харчування на 24 год. у 1,8 мл безсироваткового середовища. Потім клітини стимулювали протягом 3 год. за допомогою 200 мкл FGF19, сконцентрованого в 10 разів, під час відсутності або в присутності контрольного антитіла анти-FGFR4 або антитіла 40-12. Далі середовище видаляли, клітини промивали один раз холодним PBS і лізирували в чашці протягом 30 хв при 4°C за допомогою 75 мкл буферного розчину RIPA, доповненого інгібітором протеази. Потім загальний білковий екстракт центрифугували протягом 10 хв при 4°C і 13000 об/хв, і супернатант аналізували способом вестерн-блотингу. Далі мембрани інкубували протягом 2 год. при кімнатній температурі в суміші TBS, 0,05 % твін, 5 % молока, і потім додавали первинне антитіло анти-cFos (Cell Signaling Technology, номер в каталозі: 2250), анти-JunВ (Cell Signaling Technology, номер в каталозі: 3746) і анти-фосфоЕrк1/2 (Cell Signaling Technology, номер в каталозі: 4377) зі співвідношенням 1/1000 і інкубували протягом ночі при 4°C і повільному перемішуванні. Мембрану промивали три рази сумішшю TBS і 0,05 % твін, і вторинне антитіло, кон'юговане з HRP, інкубували протягом 4 год. при 4°C при співвідношенні 1/2000 у суміші TBS, 0,05 % твін, 5 % молока. Потім результати вестерн-блотингу виражали кількісно за допомогою програми Chemigenius (Syngene). Інтенсивність смуг, одержаних з різними антитілами, порівнювали з інтенсивністю смуг, одержаних з антиактиновим антитілом, безпосередньо зв'язаним з HRP і використовуваним при співвідношенні 1/3000 (Santa Cruz Biotechnology, номер в каталозі: Sc-8432-HRP). FGF19 при 30 нг/мл індукує синтез білків JunВ і cFos, а також фосфориловані Erk1/2 у клітинах Hep3b. Неосинтез білка і фосфориловані Erk цілком інгібується антитілом анти-FGFR4 40-12 при 100 мкг/мл, тоді як контрольне антитіло не здійснює жодного інгібую чого впливу. Ефекти, що проявилися на мембранах вестерн-блотингу (Фіг. 9A), виражали кількісно, і інтенсивність смуг кожної мембрани відображали графічно (Фіг. 9B). По-друге, проводили дослідження у відношенні власне клітинної проліферації. 5000 клітин висівали в ямки 96-ямкового планшета в 100 мкл середовища DMEM, 10 % SVF, 2 м глутаміну. Через 24 год. клітини поміщали в умови дефіциту харчування на 24 год. у культуральне безсироваткове середовище. Потім клітини Hep3b стимулювали протягом 72 год. за допомогою 100 мкл безсироваткового середовища, доповненого FGF19, 10 нг/мл (продукція для власних нестатків Sanofi-Aventis R&D), або 10 % сироватки, під час відсутності або в присутності або свідка моноклонального антитіла-антагоніста анти-FGFR4 40-12. Через 3 дні клітинну проліферацію кількісно визначали за допомогою набору CellTiter Glo (Promega, Франція). З даних досліджень випливає, що сироватка, а також FGF19 здатні стимулювати проліферацію Hep3b. Антитіло-антагоніст анти-FGFR4 40-12 інгібує частково при 100 мкг/мл таку проліферацію, індуковану сироваткою, тоді як антитіло-свідок не виявляє інгібуючої активності (Фіг. 10A). Крім того, антитіло 40-12 при 10 мкг/мл цілком блокує проліферацію, індуковану FGF19 (Фіг. 10B). Антитіло-свідок не здійснює такого впливу. Ці обставини доводять, що антагоніст анти-FGFR4, що представляє собою об'єкт даного винаходу, може бути використаний як протипухлинний терапевтичний засіб у випадку пухлин, що залежать від FGF19 або FGF-R4, і це антитіло може бути особливо ефективним у лікуванні гепатокарцином. Для спрощення дослідження дії антитіл анти-FGFR4 на клітини Hep3b спосіб ELISA був дороблений для детектування фосфорилування Erk1/2 з наступною стимуляцією цих клітин за допомогою FGF-19 (у кореляції з дослідженнями, описаними в прикладі 8), FGF-2 або фетальної телячої сироватки. З цією метою, 50000 клітин Hep3b висівали в ямки 96-ямкового планшета з чорним прозорим дном (COSTAR, номер в каталозі: 3603) у 100 мкл середовища DMEM, 10 % SVF, 2 м глутаміну. Через 24 год. клітини поміщали в умови дефіциту харчування на 24 год. у середовище DMEM, 10 % SVF, 2 мM глітаміну. Потім середовище видаляли аспірацією і замінювали 100 мкл попередньо кондиціонованого при 37C дефіцитного середовища, що 22 UA 107782 C2 5 10 15 20 25 30 35 40 45 50 55 містить FGF або SVF, а також випробувані антитіла в різних дозах. Клітини інкубували протягом 3 год. при 37°C в атмосфері з 5 % CO2. Потім стимулююче середовище видаляли аспірацією, ямки промивали PBS при 4°C і клітини фіксували додаванням 200 мкл 4 %-го розчину PFA (параформальдегід) у PBS протягом 15 хв. при кімнатній температурі. PFA видаляли і клітини промивали PBS три рази по 200 мкл. Мічені антитілами для детектування фосфо-Erk1/2 безпосередньо на клітинах Hep3b починали насиченням неспецифічних сайтів 100 мкл насичуючого буферного розчину, (21,25 мл PBS, 1,25 мл 10 %-ої неімунної козячої сироватки (Zymed, номер в каталозі: 50-062Z), 75 мкл тритону X100) протягом 2 год. Насичуючий буферний розчин заміняли 50 мкл первинного антитіла анти-фосфо-Еrк1/2 (Cell Signaling Technology, номер в каталозі: 4377), розведеного при співвідношенні 1/100 у суміші буферного розчину PBS, 1 % BSA, 0,3 % тритону X100. Первинне антитіло інкубували з клітинами протягом ночі при 4C. Потім промивали 3 порціями по 200 мкл PBS і виявляли за допомогою вторинного антикролячого антитіла, кон'югованого з реактивом AlexaFluor 488 (Molecular Probes, номер в каталозі: A11008), розведеного при співвідношенні 1/5000 у суміші буферного розчину PBS, 1 % BSA, 0,3 % тритону X100, протягом 4 год. Потім вторинне антитіло промивали 3 порціями по 200 мкл PBS і далі в кожну ямку додавали по 100 мкл PBS. Флюоресценцію вимірювали в положенні зверху мікропланшетним фотометром типу EnVision 2103 Multilabel Reader (Perkin Elmer), використовуючи фільтр FITC. Така методика дозволяє підтвердити, що FGF-19 при 30 нг/мл індукує фосфорилування Erk1/2 у клітинах Hep3b, і антитіло 40-12 здатне блокувати цю стимуляцію при дозі 3 мкг/мл (Фіг. 9C). Як FGF-2, так і сироватка також здатні індукувати систему. У випадку 2 останніх речовин антитіло 40-12 інгібує ефект FGF-2 і сироватки при дозах більш високих (30-100 мкг/мл; Фіг. 9C). Детектування фосфо-Erk1/2 способом ELISA також дозволило показати, що активні антитіла анти-FGFR4 на моделі ангіогенезу in vitro також здатні на 70-95 % блокувати фосфорилування Erk1/2, індуковане FGF-19 з дозою 3 мкг/мл (Фіг. 9D). Антитіла за даним винаходом переважно мають антагоністичний вплив одночасно у відношенні патологічного ангіогенезу, пов'язаного з розвитком пухлини, і у відношенні власне росту пухлини печінки, зокрема, на моделі гепатокарциноми. Приклад 8. Антагоністичний вплив антитіла 40-12 на мишачій моделі раку підшлункової залози У даній фармакологічній моделі використовували самок мишей Rip1-Tag2 (Charles River Laboratory, Франція) генетичного фонду C57BI/6J. Тваринам, починаючи з 9-й тижня після народження, давали для пиття воду, що містить 5 % сахарози. Мишей обробляли в період з 10й тижня до 12,5 тижнів відповідно до методики втручання, виконуючи один раз у тиждень підшкірно ін'єкцію антитіла анти-FGFR4 40-12 або контрольного антитіла з дозою 25 мг/кг (Фіг. 14A). Дана методика затверджена Комітетом з експериментів на тварин (Animal Care and Use Committee) підрозділу Sanofi-Aventis Recherche. Зоотехнічний комплекс авторів, догляд за тваринами, а також методики обробки відповідають обов'язковим принципам Європейської конвенції по захисту хребетних тварин і евтаназії після періоду обробки або у випадку ваги пухлин і/або вторинних явищ, що зобов'язують виключати тварин з дослідження. В міру тяжкості пухлин тварин піддавали евтаназії наприкінці експерименту, і пухлини мікротомували, 3 використовуючи підшлункову залозу безпосередньо після видалення. Обсяг пухлини в мм 2 визначали за допомогою штангенциркуля по формулі [об'єм=0,52(ширина) (довжина)] для зіставлення з обсягом сфероїда. Тяжкість пухлин мишей розраховували по об'ємів пухлин кожної з мишей. Для гістохімічного аналізу чисельної щільності судин тварин анестезували, відбирали ® підшлункову залозу, фіксували протягом ночі в засобі accustain (Sigma) і потім покривали парафіном. Для кожного зразка готували зрізи товщиною 5 мкм. Ендотеліальні клітини детектували, витримуючи зрізи з трипсином (Zymed, номер в каталозі: 00-3003) при 37°C протягом 10 хв, потім з антитілом миші анти-CD31, одержаним від щура і розведеним при співвідношенні 1/50 (BD Pharmingen). Для виявлення областей, мічених антитілом, зрізи витримували з антищурячим антитілом, кон'югованим з біотином, протягом 30 хв., потім зі ® стрептавідином, кон'югованим з HRP, протягом також 30 хв (Vectastain ABC kit, Vector) і, нарешті, з DAB протягом 5 хв. (Vector, номер в каталозі: SK4100). Потім зрізи мітили гематоксиліном, розведеним при співвідношенні 1/10 (Dako, S-3309). Знімки робили за допомогою камери, встановленої на мікроскоп (Nikon, E-800) з 200-кратним загальним збільшенням. Зображення аналізували за допомогою комп'ютерної програми (Visiolab, Biocom). Число кровоносних судин у пухлині підраховували і класифікували в залежності від їх площі 2 2 поверхні: дрібні судини - від 5 до 20 мкм , середні судини - від 21 до 100 мкм і великі судини 23 UA 107782 C2 2 5 10 15 20 25 30 35 40 45 більш 101 мкм . Два препарати підшлункової залози каналізували для визначення чисельної щільності судин, що відповідає загальному числу мічених елементів у поле зору. У даній моделі введення підшкірно антитіла анти-FGFR4 40-12 з дозою 25 мг/кг один раз у тиждень у проміжку від десятої по дванадцятий тиждень дозволяє зменшити тяжкість пухлин на 55 %, тобто значним способом (Фіг. 11B), і з тенденцією зменшення на 34 % числа пухлин підшлункової залози (Фіг. 11C), тоді як контрольна обробка здійснює жодного впливу. Інгібування розвитку пухлин за допомогою антитіла анти-FGFR4 40-12 супроводжується значним зменшенням на 31 % загальної чисельній щільності судин (Фіг. 11D), що відповідає зменшенню числа кровоносних судин, що спостерігається, у сукупності груп по розмірах судин, мічених антитілом анти-CD31 (Фіг. 11D). Одержані результати in vivo чітко показують, що антитіло-антагоніст анти-FGFR4 здатне інгібувати збільшення числа й утворення кровоносних судин у пухлині. Таке інгібування васкуляризації пухлин супроводжується зменшенням числа пухлин підшлункової залози і загального обсягу пухлин. Антитіла за даним винаходом переважно мають антагоністичний вплив одночасно у відношенні патологічного ангіогенезу й у відношенні росту пухлини печінки (на моделі гепатокарциноми) і підшлункової залози. Приклад 9. Перехресна реактивність антитіла стосовно FGF-R4 людини, миші і щура На першій стадії проводили порівняльні дослідження на зв'язування. З цією метою, FGF2 ® мітили на рівні 2 вільних цистеїнових залишків реактивом AlexaFluor 488 нм, C-5 малеїнімід (Molecular Probes, A10254), відповідно до рекомендацій постачальника. Одержаний FGF2-AF488 при 10 нг/мл здатний зв'язуватися з FGF-R4 людини, що експресується на поверхні трансфекованих клітин 300-19 (Фіг. 8). Таке зв'язування є специфічним, тому що додавання надлишку неміченого FGF2 дозволяє замістити взаємодію FGF2/FGF-R4 (Фіг. 8A). Такий же дослід проводили, додаючи дози антитіла, що збільшуються, 40-12 або антитіла-свідка 64-12. Тільки антитіло-антагоніст 40-12 здатний замінювати зв'язок FGF2-AF488/FGF-R4, причому з IC50, що дорівнює 3500 нг/мл або 23 нM, свідчачи, що антагоністичний вплив цього антитіла, можливо, зобов'язаний його здатності заміняти зв'язок FGF/FGF-R4. На другій стадії для визначення прийнятності клону 40-12 для блокування зв'язку FGF/FGFR4 в інших видів, що відрізняються від людини, проводили дослідження на дисоціацію зв'язків FGF2/FGF-R4 миші і щура в порівнянні з людиною. З цією метою, FGF2 миші (R&D, номер в каталозі: 3139-FB-025) або щура (R&D, номер в каталозі: 3339-FB-025) мітили аналогічно FGF2 людини реактивом AlexaFluor 488. Дослідження на дисоціацію здійснювали, використовуючи лінії 300-19, трансфековані рецепторами FGF-R4 миші або щура. Результати показують, що антитіло-антагоніст анти-FGFR4 40-12 здатне викликати дисоціацію зв'язку FGF2/FGF-R4 у системі миші або щура з такою же ефективністю, що й у системі людини. На практиці IC 50 дорівнює 3500, 4110 і 3940 нг/мл або 23, 27 і 26 нM для комплексів FGF2/FGF-R4 людини, миші або щура, відповідно (Фіг. 13A, 13B і 13C, відповідно). Така здатність зв'язуватися з FGF-R4 гризунів була перевірена способом ELISA. Антитіло 40-12 зв'язується також добре з FGF-R4 людини і миші (Фіг. 12). Одержані результати вказують на те, що антитіло анти-FGFR4 40-12 може бути використане у фармакологічних моделях із гризунами (щонайменше у випадку мишей і пацюків), і одержані результати, можливо, повинні пророкувати ефективність відносно людини. Дослідження, проведені з антитілами, що походять від клонів 8, 31, 33 і 36, також показують, що даного антитіла розпізнають одночасно FGF-R4 людини і FGF-R4 миші (див. таблицю 4). Таблиця 4 Кінетичні параметри зв'язування антитіл анти-FGFR4 клонів 8, 31, 33 і 36, вимірювані за методикою Surface Plasmon Resonance (BIAcore 3000) -1 -1 Клон 8 Клон 31 Клон 33 Клон 36 Kon (M с ) 8,93E+05 6,48E+05 8,05E+05 2,44E+05 h-FGFR4-Histag -1 Koff (с ) 2,92E-04 9,80E-04 6,17E-04 6,31E-04 KD (M) 3,27E-10 1,52E-09 7,71E-10 2,62E-09 -1 -1 Kon (M с ) 1,20E+06 9,14E+05 1,01E+06 3,30E+05 m-FGFR4-Histag -1 Koff (с ) 1,36E-04 1,80E-03 7,04E-04 7,52E-04 Приклад 10. Визначення епітопа, що розпізнається антитілами анти-FGFR4 A - Визначення епітопа, що розпізнається антитілом анти-FGFR4 40-12 24 KD (M) 1,15E-10 1,97E-09 6,92E-10 2,28E-09 UA 107782 C2 5 10 Посів здійснювали способом ELISA для визначення специфічного домена FGFR4, що розпізнається антитілом 40-12. Завдяки використанню в способі ELISA делетованої форми домена D1 FGF-R4, було встановлено, що антитіло 40-12 взаємодіяло на рівні доменів D2-D3 FGF-R4 (Фіг. 12). Другий посів здійснювали способом ELISA, використовуючи як антиген-пастку конструкти, що містять домен D1 (SABVA4794) або домен D2 (SABVA4796), або домен D3 (SABVA4799) білки hFGFR4, як описано в прикладі 2. Антиген-пастку фіксували на чашках Immulon-4 з імобілізованим ферментом (VWR Scientific Inc. Swedesboro, NJ). Потім додавали гібридому 4012 і далі детектували за допомогою антимишачого антитіла кролика IgG, кон'югованого з пероксидазою (Sigma, номер в каталозі: A9044 - розведення 1:50000). Виявлення здійснювали із субстратом TMB-H2O2 (Interchim, номер в каталозі: UP664780), і вимірювання проводили по оптичній густині (O.D.) при 450 нм. У таблиці 5 коротко представлені одержані результати. Таблиця 5 Визначення зв'язування антитіла 40-12 з різними субдоменами FGF-R4 Досліджуваний домен Сигнал (O.D. при 450 нм) 15 20 25 30 D1 SABVA4794 D2 SABVA4796 D3 SABVA4799 D1-D3 FGFR4-Fc 0,185 3,000 0,105 3,000 Таким чином, антитіло анти-FGFR4 розпізнає домен D2 позаклітинної частини білка FGFR4. З іншого боку, білок FGFR4-Fc, денатурований за допомогою SDS, не розпізнається антитілом 40-12 при аналізі способом вестерн-блоттингу, що вказує на те, що епітоп, вибраний як мішень для антитіла 40-12 у домені D2 FGFR4, має конформаційний тип. B - Визначення епітопу, що розпізнається антитілами анти-FGFR4 клонів 8, 31, 33, 36 Посів здійснювали способом ELISA для визначення специфічного домена FGFR4, що розпізнається антитілами клонів 8, 31, 33, 36, використовуючи як антиген-пастку конструкти, що містять як домени D2 і D3 (SEQ ID NO:42), так і білок hFGFR4-Histag (SABVA4614, SEQ ID NO:40). Антиген-пастку фіксували на чашках Immulon-4 з імобілізованим ферментом (VWR Scientific Inc. Swedesboro, NJ). Потім додавали супернатанти культур HEK293, транзиторно трансфекованих плазмідами, що забезпечують секрецію антитіл клонів 8, 31, 33, 36, і далі детектували за допомогою анти-людського антитіла кролика IgG, кон'югованого з пероксидазою (DakoCytomation, номер в каталозі: P0214 - розведення 1:5000). Виявлення здійснювали із субстратом TMB-H2O2 (Interchim, номер в каталозі: UP664780), і вимірювання проводили по оптичній густині (O.D.) при 450 нм. У наведеній нижче таблиці 6 коротко представлені одержані результати. Таблиця 6 Зв'язування антитіл, що походять від клонів 8, 31, 33 і 36, з цілим FGF-R4 або субдоменом D2-D3 (сигнал O.D. при 450 нм) Клон 8 Клон 31 Клон 33 Клон 36 hFGFR4-Histag 3,898 3,859 3,752 3,751 hFGFR4(D2,D3)-Histag 3,860 3,741 3,621 3,616 Таким чином, антитіла клонів 8, 31, 33 і 36 розпізнають домен D2-D3 позаклітинної частини білка FGFR4. 35 25 UA 107782 C2 Таблиця 7 Використані, одержані і розшифровані послідовності Нуклеотидні послідовності Антитіло 40-12 VH+CH VL+CL VH VL CDR VH CDR VL Антитіло 64-12 VH+CH VL+CL VH VL CDR VH CDR VL Гуманізовані послідовності Легкий ланцюг 1 Легкий ланцюг 2 Важкий ланцюг 1 Важкий ланцюг 2 Важкий ланцюг 3 Конструкції hFGFR4-Histag hFGFR4-Streptag hFGFR4(D2,D3)-Histag mFGFR4-Histag hFGFR1-Fc hFGFR2-Fc rFGFR4 Послідовності-праймери для одержання клонової лінії (приклад 4) Трансмембранний домен FGFR4 Олігонуклеотиди-праймери таблиця 1 Епітоп у домені D2 Антитіло клону 8 Цілий легкий ланцюг Легкий ланцюг CDR Цілий важкий ланцюг Важкий ланцюг CDR Антитіло клону 31 Цілий легкий ланцюг Легкий ланцюг CDR Цілий важкий ланцюг Важкий ланцюг CDR Антитіло клону 33 Цілий легкий ланцюг Легкий ланцюг CDR Цілий важкий ланцюг Важкий ланцюг CDR Антитіло клону 36 Білкові послідовності SEQ ID NO:1 SEQ ID NO:3 SEQ ID NO:5 SEQ ID NO:7 SEQ ID NO:2 SEQ ID NO:4 SEQ ID NO:6 SEQ ID NO:8 SEQ ID NO:9, 10, 11 SEQ ID NO:12, 13, 14 SEQ ID NO:15 SEQ ID NO:17 SEQ ID NO:19 SEQ ID NO:21 SEQ ID NO:16 SEQ ID NO:18 SEQ ID NO:20 SEQ ID NO:22 SEQ ID NO:23, 24, 25 SEQ ID NO:26, 27, 28 SEQ ID NO:29 SEQ ID NO:31 SEQ ID NO:33 SEQ ID NO:35 SEQ ID NO:37 SEQ ID NO:30 SEQ ID NO:32 SEQ ID NO:34 SEQ ID NO:36 SEQ ID NO:38 SEQ ID NO:39 SEQ ID NO:68 SEQ ID NO:41 SEQ ID NO:43 SEQ ID NO:45 SEQ ID NO:47 SEQ ID NO:49 SEQ ID NO:51, 52, 53, 54, 55, 56, 58 SEQ ID NO:61, 62 SEQ ID NO:40 SEQ ID NO:69 SEQ ID NO:42 SEQ ID NO:44 SEQ ID NO:46 SEQ ID NO:48 SEQ ID NO:50 SEQ ID NO:59, 60 SEQ ID NO:63, 64, 65, 66, 67 SEQ ID NO:70 SEQ ID NO:71 SEQ ID NO:72 SEQ ID NO:73, 74, 75 SEQ ID NO:77 SEQ ID NO:78, 79, 80 SEQ ID NO:76 SEQ ID NO:81 SEQ ID NO:82 SEQ ID NO:83, 84, 85 SEQ ID NO:87 SEQ ID NO:88, 89, 90 SEQ ID NO:86 SEQ ID NO:91 SEQ ID NO:92 SEQ ID NO:93, 94, 95 SEQ ID NO:97 SEQ ID NO:98, 99, 100 SEQ ID NO:96 26 UA 107782 C2 Продовження таблиці 7 Цілий легкий ланцюг SEQ ID NO:101 SEQ ID NO:102 Легкий ланцюг CDR SEQ ID NO:103, 104, 105 Цілий важкий ланцюг SEQ ID NO:106 SEQ ID NO:107 Важкий ланцюг CDR SEQ ID NO:108, 109, 110 Субдомени позаклітинної частини білка hFGFR4, приєднані до домена Fc IgG1 fGFGR4_D1:Fc SEQ ID NO:111 SEQ ID NO:112 fGFGR4_D2:Fc SEQ ID NO:113 SEQ ID NO:114 fGFGR4_D3:Fc SEQ ID NO:115 SEQ ID NO:116 Послідовність константної SEQ ID NO:117 ділянки IgG1 людини 27 UA 107782 C2 28
ДивитисяДодаткова інформація
Автори англійськоюBaurin, Nicolas, Berne, Pierre-Francois, Blanche, Francis, Bono, Francoise, Cameron, Beatrice, Dabdoubi, Tarik, Herbert, Corentin, Mikol, Vincent, Remy, Elisabeth
Автори російськоюБоно Франсуаз
МПК / Мітки
МПК: C12N 5/18, C07K 16/28, C12N 15/13, A61P 35/00, A61K 39/395
Мітки: fgf-r4, рецептора, антагоніст
Код посилання
<a href="https://ua.patents.su/131-107782-antagonist-receptora-fgf-r4.html" target="_blank" rel="follow" title="База патентів України">Антагоніст рецептора fgf-r4</a>
Попередній патент: Автономний трубопровід для приміщення і вентиляційна система будівлі для вирощування домашньої худоби
Наступний патент: Ізоіндолінові сполуки для застосування при лікуванні раку
Випадковий патент: Спосіб нагрівання води електричною енергією, за допомогою хоча б одного трубчастого електричного нагрівача