Спосіб одержання фармацевтичних проміжних сполук
Номер патенту: 100397
Опубліковано: 25.12.2012
Автори: Молнар Еніко, БАРКОЦІ Йожеф, Волк Балаж, Вайон Марія, Мезей Тібор, Порч-Маккай Марта, Лукаш Дьюла, Суладій Янош
Формула / Реферат
1. Спосіб одержання сполук загальної формули (III)
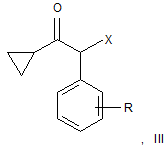
де R є атомом фтору або хлору і X є атомом хлору або брому,
в якому здійснюють галогенування циклопропілбензилкетону загальної формули (II)
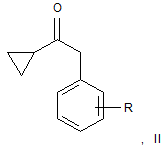
де R є атомом фтору або хлору, що характеризується тим, що
а) галогенування виконують в суміші водного розчину галогеноводню і водного розчину пероксиду водню у присутності розчинника, що змішується з водою, або у присутності каталізатора фазового перенесення, або
б) галогенування виконують в суміші солі лужного металу з водним розчином галогеноводню, водного розчину пероксиду водню і сірчаної кислоти.
2. Спосіб за п. 1, який відрізняється тим, що реакцію проводять у присутності 1-5 мольн. еквівалентів водного розчину галогеноводню і 1-10 мольн. еквівалентів водного розчину пероксиду водню, розрахованих по відношенню до сполук формули (II).
3. Спосіб за п. 1, який відрізняється тим, що реакцію проводять переважно у присутності 2-4 мольн. еквівалентів водного розчину галогеноводню і 4-6 мольн. еквівалентів водного розчину пероксиду водню, розрахованих по відношенню до сполук формули (II).
4. Спосіб за п. 1, який відрізняється тим, що в реакції використовують водний розчин бромоводню або розчин бромоводню в оцтовій кислоті або газоподібний бромоводень, переважно використовують 48 мас. % водний розчин бромоводню.
5. Спосіб за п. 1, який відрізняється тим, що в реакції використовують водний розчин пероксиду водню, переважно 25-40 мас. % водний розчин пероксиду водню.
6. Спосіб за п. 1, який відрізняється тим, що розчинником, що змішується з водою, є діоксан, оцтова кислота, тетрагідрофуран або С1-4спирт, що має розгалужений або нерозгалужений ланцюг, переважно метиловий спирт, етиловий спирт або ізопропіловий спирт.
7. Спосіб за п. 1, який відрізняється тим, що каталізатором фазового перенесення є четвертинна сіль амонію, переважно бензилтриетиламонію хлорид, тетрабутиламонію хлорид, бензилтриетиламонію бромід або тетрабутиламонію бромід.
8. Спосіб за п. 1, який відрізняється тим, що сіллю лужного металу є бромід натрію, хлорид натрію, бромід калію або хлорид калію.
9. Спосіб за п. 1, який відрізняється тим, що в реакції використовують 1-5 мольн. еквівалентів солі лужного металу і 2-10 мольн. еквівалентів водного розчину пероксиду водню.
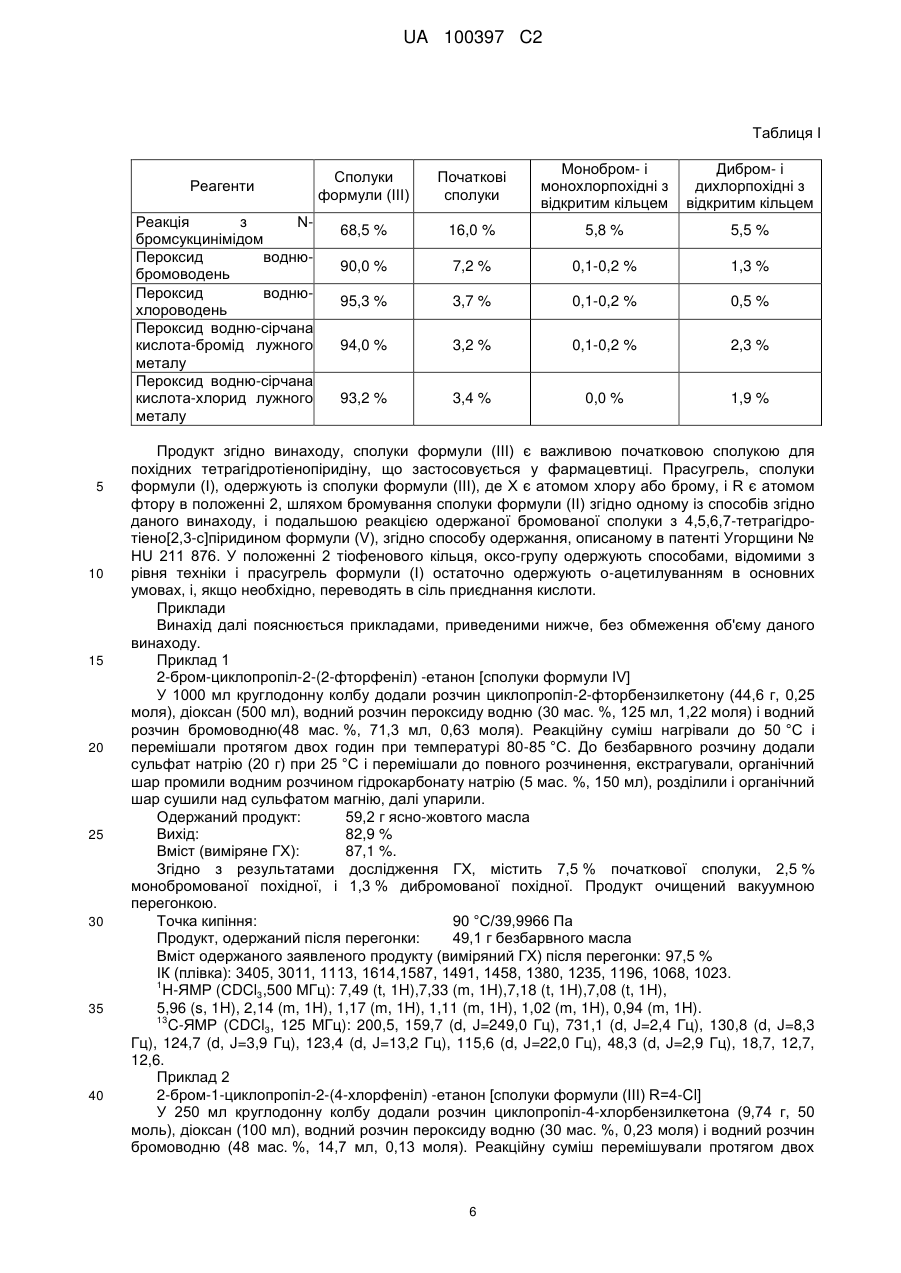
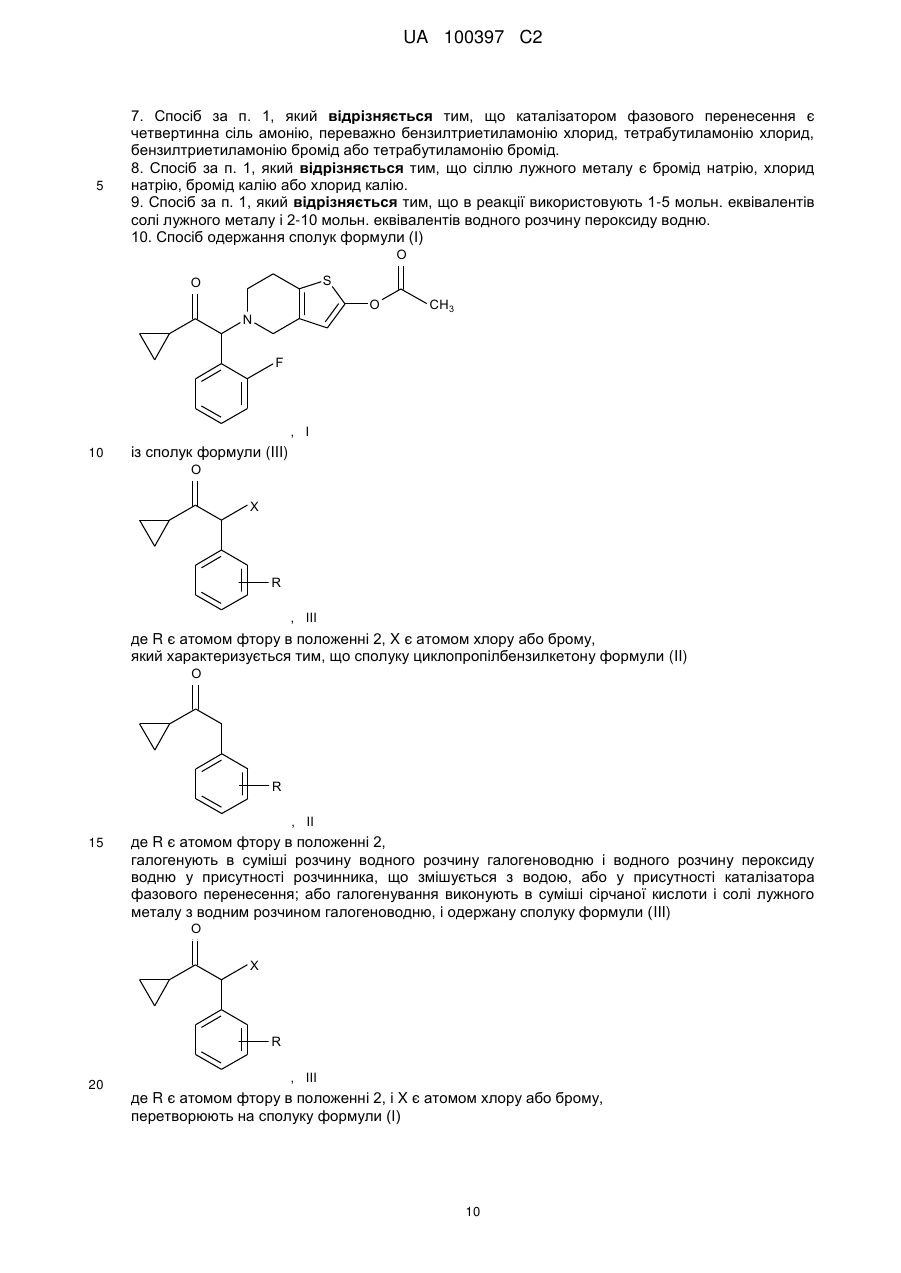
10. Спосіб одержання сполук формули (І)
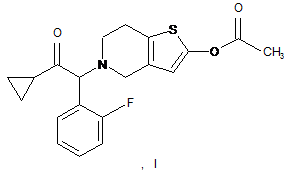
із сполук формули (III)
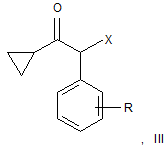
де R є атомом фтору в положенні 2, X є атомом хлору або брому,
який характеризується тим, що сполуку циклопропілбензилкетону формули (II)

де R є атомом фтору в положенні 2,
галогенують в суміші розчину водного розчину галогеноводню і водного розчину пероксиду водню у присутності розчинника, що змішується з водою, або у присутності каталізатора фазового перенесення; або галогенування виконують в суміші сірчаної кислоти і солі лужного металу з водним розчином галогеноводню, і одержану сполуку формули (III)
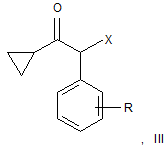
де R є атомом фтору в положенні 2, і X є атомом хлору або брому,
перетворюють на сполуку формули (І)
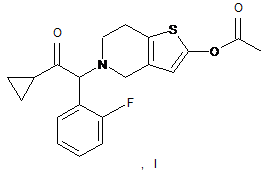
або її сіль приєднання кислоти відповідно до відомих способів.
Текст
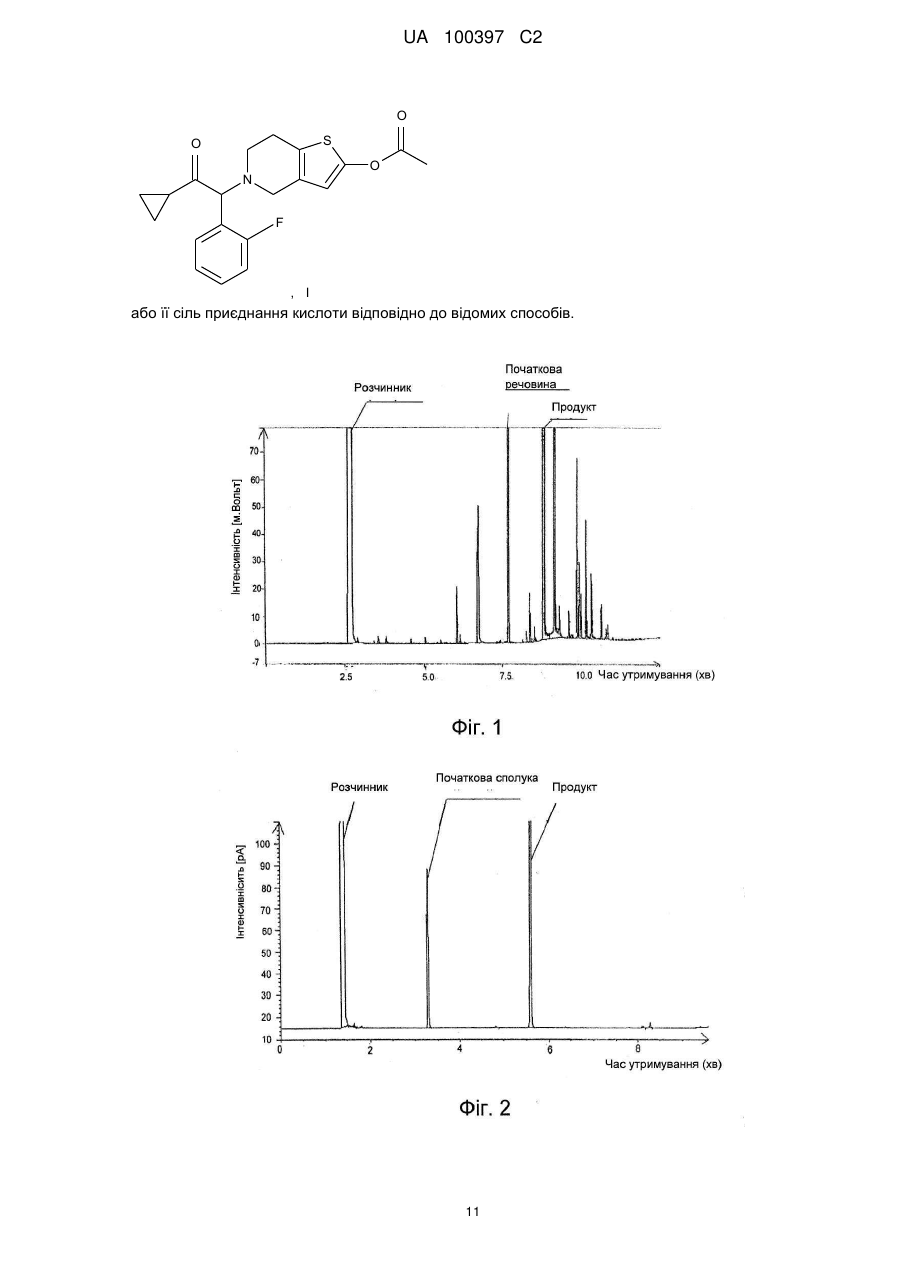
Реферат: Винахід стосується способу одержання сполук загальної формули (III) O X R , III де R є атомом фтору або хлору і X є атомом хлору або брому, шляхом галогенування циклопропілбензилкетону загальної формули (II) UA 100397 C2 (12) UA 100397 C2 O R , II де R є атомом хлору або брому, і галогенування виконують в суміші водного розчину галогеноводню і водного розчину пероксиду водню у присутності розчинника, що змішується з водою, або у присутності каталізатора фазового перенесення; або галогенування виконують в суміші солі лужного металу з водним розчином галогеноводню, водного розчину пероксиду водню і сірчаної кислоти. Спосіб можна здійснювати переважно в промисловому масштабі. Сполука формули (III), де R є атомом фтору в положенні 2, і X такий, як описано вище, є проміжною сполукою у виробництві прасугрелю, що є інгібітором тромбоцитів, що застосовується в терапії. UA 100397 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід відноситься до способу одержання 2-галоген-1-циклопропіл-2-заміщених фенілетанонів формули (III) шляхом галогенування 1-циклопропіл-2-заміщених фенілетанонів загальної формули (II), де галогенування виконують в суміші водного розчину галогеноводню і водного розчину пероксиду водню, у присутності розчинника, що змішується з водою, або у присутності каталізатора фазового перенесення, або галогенування виконують в суміші сірчаної кислоти і солі лужного металу з водним розчином галогеноводню. Спосіб слід застосовувати переважно в промисловому масштабі. Попередній рівень техніки 2-галоген-1-циклопропіл-2-заміщених фенілетаноніві сполуки загальної формули (III) є важливими початковими речовинами похідних тетрагідротіенопіридіну, які використовуються у фармацевтичній терапії. Одними з найбільш важливих представників похідних тетрагідротіенопіридіну є сполуки формули (I), а саме 5-[2-циклопропіл-1-(2-фторфеніл)-2оксоетил]-4,5,6,7-тетрагідротіено[3,2-с]піридін-2-іл ацетат, що має міжнародну непатентовану назву прасугрель, використовується для запобігання і лікування тромбозу і тромоемболії. Інгібітор тромбоцитів прасугрель, його похідні і спосіб його виробництва описаний вперше в патенті Угорщини № 218 785 і патенті Угорщини № 211 876 і їх еквівалентах. Мета даного винаходу відноситься до способу одержання 2-галоген-1-циклопропіл-2-заміщених фенілетанонів формули (III), що є найбільш важливими структурними представниками вищезазначених сполук. Спосіб згідно даного винаходу застосовується в промисловому масштабі і дозволяє одержувати сполуки загальної формули (III) з високим ступенем чистоти. В процесі одержання прасугреля, а також інших ефективних сполук - інгібіторів тромбоцитів, що мають схожу хімічну структуру, ключовими проміжними сполукими є 2-галоген-1циклопропіл-2-заміщені сполуки фенілетанону загальної формули (III), які можуть містити різні замінники в ароматичному кільці. Найбільш важливим представником цих сполук є речовини формули (IV), заміщені фтором в положенні 2. З літератури відомо тільки декілька способів одержання сполук загальної формули (III), і вони лише частково застосовні в промисловому масштабі. Згідно способу одержання, описаному в патенті Угорщини № 218 785 і патенті Угорщини № 211 876, сполуки циклопропіла загальної формули (III) одержують бромуванням циклопропілбензилкетонових сполук формули (II) в чотирихлористому вуглеці, у присутності приблизної еквімолярної кількості N-бромсукциніміду, дибензоілпероксиду при кип'яченні протягом 8 годин. Вихід сполуки загальної формули (III) складає 83 %, де R є атомом в положенні 2 і X є атомом брому. У заявці на патент США № 2003/134872 описаний спосіб одержання сполуки формули (IV) за таких же умов, причому сполуки формули (IV) очищають колоночною хроматографією, вихід реакції складає 68 %. Недоліками вказаних вище способів є те, що N-бромсукцинімід частково розкладається під час бромування, що приводить до утворення елементарного брому. Бром є надзвичайно корозійним, тому використання брому вимагає спеціальних умов і особливих матеріалів. Навіть невелике забруднення заліза може збільшити кількість побічних продуктів, що утворюються, під час галогенування. Згідно способу одержання, описаному в патенті США № US 5 874 581, шляхом активування сполуки формули (II), де R є атомом фтору в положенні 2, одержують сполуки формули (III), де Х заміщений атомом хлору. Реакцію проводять в дихлорметані, при температурі 5 °C, з газоподібним хлорсульфурилом або хлором. Після одержання чистота одержаного неочищеного продукту складала 80 % згідно даних ГХ, далі його використовували для одержання прасугреля без додаткового очищення. Недолік способу полягає в дуже швидкій реакції хлорсульфурилу з водою, газоподібний хлор, що утворюється під час реакції, є токсичним і вибухонебезпечним. Всі дії з хлорсульфурилом і хлором слід виконувати тільки в спеціальних апаратах з додержанням всіх строгих вимог безпеки. Загальним недоліком згаданих вище способів є необхідність виконання галогенування в хлорованих вуглеводнях (чотирихлористому вуглеці або дихлорметані). Ці розчинники, особливо чотирихлористий вуглець, є дуже токсичними і їх застосування в промислових масштабах украй рідко. Інший недолік способів полягає в очищенні неочищеного продукту шляхом колоночної хроматографії. Такий спосіб очищення не підходить для одержання великої кількості кінцевого продукту в промисловому масштабі. Для очищення потрібна велика кількість реагентів, тому спосіб стає дорожчим і неприйнятнішим з погляду дії на навколишнє середовище. Мета даного винаходу полягає в подоланні недоліків вказаних вище способів і розробка економічного, простого способу одержання з добрим виходом, який можна використовувати в 1 UA 100397 C2 5 промисловому масштабі. Додатковою метою даного винаходу є розробка способу очищення, в якому не потрібне використання хлорованих розчинників і інших реагентів, що забруднюють навколишнє середовище, а також розробка способу, що не вимагає очищення колоночною хроматографією. Вказані вище цілі були досягнуті способом одержання згідно даного винаходу. Короткий опис винаходу Метою даного винаходу є спосіб одержання сполук загальної формули (III) III де R є атомом фтору або хлоруу Х циклопропілбензилкетону загальної формули (II) 10 15 20 25 30 35 40 є атомом хлору або брому, із сполук II де R є атомом фтору або хлору, шляхом галогенування. Галогенування виконують в суміші водного розчину галогеноводню і водного розчину пероксиду у присутності розчинника, що змішується з водою, або у присутності каталізатора фазового перенесення; або в суміші сірчаної кислоти і солі лужного металу з водним розчином галогеноводню. Галогенування згідно даного винаходу виконують в суміші водного розчину галогеноводню і водного розчину пероксиду водню у присутності 1-5 моль еквівалентів, переважно 2-4 моль еквівалентів, водного розчину галогеноводню і 1-10 моль еквівалентів, переважно 4-6 моль еквівалентів, водного розчину пероксиду водню. У реакції використовується водний розчин бромоводню або розчин бромоводню в оцетовій кислоті, або газоподібний бромоводень, переважно 48 мас. % водний розчин бромоводню і водного розчину пероксиду водню, переважно 25-40 мас. % водний розчин пероксиду водню. Розчинником, що змішується з водою, використовуваним при галогенуванні, що виконують в суміші з водним розчином галогеноводню і водним розчином пероксиду водню, є переважно діоксан, оцетова кислота, тетрагідрофуран або С1-4 спирт, що мають нерозгалужений або розгалужений ланцюг, переважно метиловий спирт, етиловий спирт або ізопропіловий спирт. Коли спосіб одержання згідно даного винаходу виконують без додавання розчинника, використовуваним каталізатором фазового перенесення є четвертинна сіль амонію, переважно бензилтриетиламонію хлорид, тетрабутиламонію хлорид, бензилтриетиламонію бромід або тетрабутиламонію бромід. Реакцію згідно даного винаходу, де галогенування сполуки загальної формули (III) виконують в суміші сірчаної кислоти і солі лужного металу з водним розчином галогеноводню, переважно сіллю лужного металу є бромід натрію, хлорид натрію, бромід калію або хлорид калію. У способі переважно використовувати 1-5 моль еквівалентів солі лужного металу і 2-10 моль еквівалентів водного розчину пероксиду водню. Галогенування згідно даного винаходу виконують при температурі від 20 до 100 °C. При кімнатній температурі реакція завершується протягом декількох днів і чистота одержуваного неочищеного продукту складає приблизно 90 %, тому його можна використовувати далі без додаткового очищення. При температурі від 70 до 100 °C реакція повністю завершується протягом декількох годин, проте в цьому випадку, неочищений продукт вимагає додаткового очищення, що можна легко виконати перегонкою. Іншим втіленням даного винаходу є спосіб одержання сполук формули (I) 2 UA 100397 C2 I із сполуки формули (III) III де R є атомом фтору в положенні 2, і Х є атомом хлору або брому, де сполуки циклопропілбензилкетону формули (II) 5 10 15 II де R є атомом фтору в положенні 2, піддають галогенуванню в суміші водного розчину галогеноводню і водного розчину пероксиду водню у присутності розчинника, що змішується з водою, або у присутності каталізатора фазового перенесення; або галогенування виконують в суміші сірчаної кислоти і солі лужного металу з водним розчином галогеноводню, далі сполуки формули (III) III де R є атомом фтору в положенні 2, і Х є атомом хлору або брому переводять в сполуки формули (I) I або її сіль приєднання кислоти згідно відомих способів. Докладний опис винаходу Суть даного винаходу полягає у виконанні галогенування без використання молекул елементарного галогену, таких як хлор або бром, або без використання найбільш часто використовуваних агентів галогенування, відомих з літератури і одержуваних з галогенів, наприклад N-бромсукциніміду, бромдіоксану, хлорсульфурилу і ін. Особливою перевагою даного винаходу є відмова від використання шкідливих для навколишнього середовища агентів галогенування, і, в той же час, відсутність необхідності 3 UA 100397 C2 5 10 15 20 25 30 35 40 45 50 55 використання яких-небудь спеціальної апаратури в реакції, спосіб можна виконувати в зазвичай використовуваній апаратурі. Розчинником, використовуваним в реакції, є вода і розчинники, що змішують з водою, є, наприклад, оцетова кислота, діоксан, тетрагідрофуран, або спирти з коротким вуглецевим ланцюгом. Дані розчинники, що змішуються з водою, або каталізатори фазового перенесення забезпечують розчинення більшості сполук формули (III) в реакційній суміші. Порівняльні експерименти Одержання сполуки формули (IV) з циклопропіл-2-фторбензилкетону: Декілька реакцій галогенування, відомих з літератури, виконували для підтвердження переваг способу, що патентувався. Одна з цих реакцій є галогенування бромідом, де початковими сполуками способу є сполуки формули (II), де R є атомом фтору в положенні 2. Декілька реакцій виконували за різних умов, порівнювали вихід реакції і домішки. 1. Одержання сполуки формули (IV) з бромом: Здійснювали реакцію сполуки формули (II) з еквімолярною кількістю брому в дихлорметані, при кімнатній температурі протягом 12 годин, до моменту зникнення брому. Згідно даних Гх/мс реакційна суміш містила: 15 % сполуки формули (IV) 35 % монобромованої сполуки, що унаслідок відкриття циклопропанового кільця 17 % дибромованої сполуки, що одержується унаслідок розкриття циклопропанового кільця, і 19 % початкової сполуки, що не прореагувала. Після додавання піридину до реакційної суміші, одержана кількість сполуки формули (IV) збільшилася до 30 %, проте співвідношення речовин в суміші було таким же, як в суміші, описаній вище. Таку ж реакцію проводили в оцетовій кислоті. Згідно даних Гх/мс, реакційна суміш містила тільки 3,5 % сполуки формули (IV). Склад суміші був наступним: 3,5 % сполуки формули (IV) 15 % монобромованої сполуки, що одержується унаслідок відкриття циклопропанового кільця 47 % дибромованої сполуки, що одержується унаслідок відкриття циклопропанового кільця, і 31 % початкової сполуки, що не прореагувала. Результати вищеописаних експериментів показують, що сполуки формули (IV) неможливо одержати з добрим виходом, використовуючи бром. 2. Одержання сполуки формули (IV) з N-бромсукцинімідом: Повторили спосіб, описаний в заявці на патент США № 2003/134872, де бромування виконували з N-бромсукцинімідом в чотирихлористому вуглеці, неочищений продукт досліджували способом Гх/мс. Згідно даних Гх/мс реакційна суміш містила: 68,5 % сполуки формули (IV) 5,8 % монобромованої сполуки, що одержується унаслідок відкриття циклопропанового кільця 5,5 % дибромованої сполуки, що одержується унаслідок відкриття циклопропанового кільця, і 16,0 % початкової сполуки, що не прореагувала. Фіг. 1 демонструє хроматограму ГС, з якої видно істотна кількість домішок в неочищеному продукті. Таку ж реакцію провели в дихлорметані, замість чотирихлористого вуглецю, реакційну суміш кип'ятили із зворотним холодильником протягом 10 годин. Кількість одержаних домішок була такою ж. Ефективне очищення сполуки (IV) практично неможливе. Перегонка є способом схожим для розділення речовин, що мають істотно різні точки кипіння. Серед продуктів, одержаних в результаті вказаних вище реакцій, сполуки формули (IV) можна добре відокремити від початкової речовини і від дибромсполуки, оскільки їх молекулярні маси істотно розрізняються. Монобромовані домішки, що утворилися унаслідок відкриття циклопропанового кільця, із загальним вмістом 5,8 % неможливо відокремити від сполуки формули (IV), оскільки їх молекулярні маси ідентичні і точки плавлення практично збігаються з точкою кінцевого продукту. Більш того, дані монобромізомери взаємодіють подібно до сполуки (IV) вподальших стадіях хімічної реакції, тому деякі побічні продукти утворюються на наступній стадії реакції. 4 UA 100397 C2 5 10 15 20 25 30 35 40 45 50 Очищення реакційної суміші колоночною хроматографією не є успішним, оскільки різні домішки продукту є ізомерами, що мають дуже схожі хімічні структури, а також унаслідок того, що їх хроматографічні характеристики дуже близькі одна до одної. 3. Одержання сполуки формули (IV) згідно даного винаходу: Несподівано було виявлено, що за допомогою способу одержання згідно даного винаходу, можна одержати сполуки формули (IV) з високим ступенем чистоти в порівнянні із способами, описаними вище (хроматограма ГХ на Фіг. 2). Бромування виконували сумішшю пероксиду водню – броміду водню в діоксані при кімнатній температурі протягом декількох днів. Згідно даних Гх/мс реакційна суміш містила: 90,0 % сполуки формули (IV) 0,1-0,2 % монобромованої сполуки, що одержується унаслідок відкриття циклопропанового кільця 1,3 % дибромованої сполуки, що одержується унаслідок відкриття циклопропанового кільця, і 7,2 % початкової сполуки, що не прореагувала. Монобромовані сполуки з відкритим циклопропановим кільцем були одержані лише в кількості 0,1-0,2 %, вихід продукту склав 90 % і реакційна суміш містила тільки 1,3 % дибромованої сполуки з відкритим циклопропановим кільцем. Кількість сполуки, що не прореагувала, склала 7,2 %. Отже, одержаний неочищений продукт був забруднений сполукими, які можна легко відокремити перегонкою. Початкова сполука формули (II), як домішка, не містить галогеновий замінник в бензильному положенні, тому вона не реагує в наступних стадіях реакції і, отже, не викликає забруднення. Кількісні вимірювання виконували, використовуючи систему Agilent 6890N Net Work GC/MS. У способі згідно винаходу бромування виконують в діоксані. Даний розчинник можна замінити іншим розчинником, що змішується з водою, наприклад спиртами, наприклад етанолом, 2-пропанолом, або оцетовою кислотою і ефірами, наприклад тетрагідрофураном і тому подібне. Сполуки загальної формули (II) не можна розчинити у воді, тому доцільно додавати органічний розчинник, що змішується з водою, або каталізатор фазового перенесення до реакційної суміші для підвищення змішування, як каталізатор фазового перенесення можна використовувати четвертинні солі амонію, переважно бензилтриетиламонію хлорид, тетрабутиламонію хлорид, бензилтриетиламонію бромід або тетрабутиламонію бромід. Застосування даного винаходу додатково підтверджується фактом, що в реакції галогеноводні (наприклад: хлороводень, бромоводень) можна замінити галогенідами лужних металів, наприклад бромідом натрію, бромідом калію, хлоридом натрію або хлоридом натрію. Коли в реакції використовуються галогеніди лужних металів, реакційну суміш слід підкисляти, наприклад, додаванням сірчаної кислоти. Несподівано при виконанні експериментів з бромідами лужних металів (бромід натрію або бромід калію) було виявлено, що кількість одержуваного продукту більше 90 % і забруднення дибромпохідними зменшується до 2 %. У реакції, що виконується з бромідом калію, вихід продукту склав 94,0 %, вміст початкової сполуки, що не прореагувала, склав 3,2 %, окрім 2,3 % дибромсполук, що утворюються в результаті відкриття циклопропанового кільця. Несподівано було виявлено, що чистіший продукт можна одержати при одержані хлорпохідних сполук формули (III), де Х є атомом хлору і R є атомом фтору в положенні 2, причому похідні хлориди лужних металів використовуються в галогенуванні замість похідних бромідів лужних металів. В цьому випадку монохлорпохідні, що одержуються унаслідок відкриття циклопропанового кільця, не забруднюють неочищений продукт і домішки дихлорпохідних складають менше 2,0 %. Описані вище результати наводяться в наступній таблиці I: 5 UA 100397 C2 Таблиця I Реагенти Реакція з Nбромсукцинімідом Пероксид воднюбромоводень Пероксид воднюхлороводень Пероксид водню-сірчана кислота-бромід лужного металу Пероксид водню-сірчана кислота-хлорид лужного металу 5 10 15 20 25 30 35 40 Сполуки формули (III) Початкові сполуки Монобром- і монохлорпохідні з відкритим кільцем Дибром- і дихлорпохідні з відкритим кільцем 68,5 % 16,0 % 5,8 % 5,5 % 90,0 % 7,2 % 0,1-0,2 % 1,3 % 95,3 % 3,7 % 0,1-0,2 % 0,5 % 94,0 % 3,2 % 0,1-0,2 % 2,3 % 93,2 % 3,4 % 0,0 % 1,9 % Продукт згідно винаходу, сполуки формули (III) є важливою початковою сполукою для похідних тетрагідротіенопіридіну, що застосовується у фармацевтиці. Прасугрель, сполуки формули (I), одержують із сполуки формули (III), де Х є атомом хлору або брому, і R є атомом фтору в положенні 2, шляхом бромування сполуки формули (II) згідно одному із способів згідно даного винаходу, і подальшою реакцією одержаної бромованої сполуки з 4,5,6,7-тетрагідротіено[2,3-с]піридином формули (V), згідно способу одержання, описаному в патенті Угорщини № HU 211 876. У положенні 2 тіофенового кільця, оксо-групу одержують способами, відомими з рівня техніки і прасугрель формули (I) остаточно одержують о-ацетилуванням в основних умовах, і, якщо необхідно, переводять в сіль приєднання кислоти. Приклади Винахід далі пояснюється прикладами, приведеними нижче, без обмеження об'єму даного винаходу. Приклад 1 2-бром-циклопропіл-2-(2-фторфеніл) -етанон [сполуки формули IV] У 1000 мл круглодонну колбу додали розчин циклопропіл-2-фторбензилкетону (44,6 г, 0,25 моля), діоксан (500 мл), водний розчин пероксиду водню (30 мас. %, 125 мл, 1,22 моля) і водний розчин бромоводню(48 мас. %, 71,3 мл, 0,63 моля). Реакційну суміш нагрівали до 50 °C і перемішали протягом двох годин при температурі 80-85 °C. До безбарвного розчину додали сульфат натрію (20 г) при 25 °C і перемішали до повного розчинення, екстрагували, органічний шар промили водним розчином гідрокарбонату натрію (5 мас. %, 150 мл), розділили і органічний шар сушили над сульфатом магнію, далі упарили. Одержаний продукт: 59,2 г ясно-жовтого масла Вихід: 82,9 % Вміст (виміряне ГХ): 87,1 %. Згідно з результатами дослідження ГХ, містить 7,5 % початкової сполуки, 2,5 % монобромованої похідної, і 1,3 % дибромованої похідної. Продукт очищений вакуумною перегонкою. Точка кипіння: 90 °C/39,9966 Па Продукт, одержаний після перегонки: 49,1 г безбарвного масла Вміст одержаного заявленого продукту (виміряний ГХ) після перегонки: 97,5 % ІК (плівка): 3405, 3011, 1113, 1614,1587, 1491, 1458, 1380, 1235, 1196, 1068, 1023. 1 H-ЯМР (СDCl3,500 МГц): 7,49 (t, 1H),7,33 (m, 1H),7,18 (t, 1H),7,08 (t, 1H), 5,96 (s, 1H), 2,14 (m, 1H), 1,17 (m, 1H), 1,11 (m, 1H), 1,02 (m, 1H), 0,94 (m, 1H). 13 C-ЯМР (СDCl3, 125 МГц): 200,5, 159,7 (d, J=249,0 Гц), 731,1 (d, J=2,4 Гц), 130,8 (d, J=8,3 Гц), 124,7 (d, J=3,9 Гц), 123,4 (d, J=13,2 Гц), 115,6 (d, J=22,0 Гц), 48,3 (d, J=2,9 Гц), 18,7, 12,7, 12,6. Приклад 2 2-бром-1-циклопропіл-2-(4-хлорфеніл) -етанон [сполуки формули (III) R=4-Cl] У 250 мл круглодонну колбу додали розчин циклопропіл-4-хлорбензилкетона (9,74 г, 50 моль), діоксан (100 мл), водний розчин пероксиду водню (30 мас. %, 0,23 моля) і водний розчин бромоводню (48 мас. %, 14,7 мл, 0,13 моля). Реакційну суміш перемішували протягом двох 6 UA 100397 C2 5 10 15 20 25 30 35 40 45 50 55 60 годин при температурі 60-65 °C. До безбарвного розчину додали розчин сульфату натрію (20 г) при 25 °C і перемішували до повного розчинення, екстрагували і верхній органічний шар сушили над сульфатом магнію, потім упарювали. Одержаний продукт: 15,6 г ясно-жовтого масла Вихід: 87,2 % Вміст (виміряне ГХ): 87,5 %. Згідно з результатами дослідження Гх/мс, містить 3,7 % початкової сполуки, 0,5 % дибромованих домішок. Продукт очищений вакуумною перегонкою. Точка кипіння: 116 °C/40 Па (0,3 мм рт.ст.) Продукт, одержаний після перегонки: 11,0 г масла, що кристалізується при стоянні. Кристалізується з н-гексана. Точка плавлення: 38-40 °C білі кристали, згідно даних ГХ 99,5 %. ІК (KBr): 2978, 1699, 1492, 1415, 1381, 1074, 1016. 1 Н-ЯМР (СDCl3, 200 МГц): 7,40 (d, 2H), 7,35 (d, 2H), 5,56 (s, 1H), 2,15 (m, 1H), 1,12 (m, 2H), 1,00 (m, 2H). 13 С-ЯМР (СDCl3, 50 МГц): 201,3, 135,1, 134,0, 130,3, l29,1, 54,9, 18,7, 13,0, 12,9. Приклад 3 2-бром-1-циклопропіл-2-(2-фторфеніл) етанон [сполуки формули (IV)] У 250 мл круглодонну колбу додали розчин циклопропіл-2-фторбензилкетона (8,91 г, 50 моль), оцетову кислоту (50 мл), водний розчин пероксиду водню (30 мас. %, 15 мл 0,14 моля) і розчин бромоводню в оцетовій кислоті (33 мас. %, 14,7 мл, 0,13 моля). Реакційну суміш перемішали протягом однієї години при температурі 95 °C. Безбарвний розчин розбавили водою (150 г), екстрагували толуолом (100 мл), органічний шар відокремили, просушили і упарили у вакуумі. Одержаний продукт: 11,4 г ясно-жовтого масла Вихід: 75,4 % Вміст (виміряне ГХ): 85,0 %, забруднений 5,2 % початкової сполуки, 7,5 % дибромованої похідної. Продукт очищений вакуумною перегонкою. Точка кипіння: 95 °C/53,3 Па (0,4 мм рт.ст.) Продукт, одержаний після перегонки: 8,3 г безбарвного масла. Вміст заявлений продукту (виміряне ГХ) після перегонки: 98,5 %. Приклад 4 2-бром-1-циклопропіл-2-(2-фторфеніл) етанон [сполуки формули (IV)] У 250 мл круглодонну колбу додали розчин циклопропіл-2-фторбензилкетона (8,91 г, 50 моль), етанол (50 мл), водний розчин пероксиду водню (30 мас. %, 30 мл, 0,29 моля) і водний розчин бромоводню(48 мас. %, 22,6 мл, 0,20 моля). Реакційну суміш кип'ятили протягом півгодини і безбарвний розчин упарили. До залишку додали воду (50 мл) і етилацетат (50 мл) при 25 °C, фази розділили, органічну фазу сушили і упарили. Одержаний продукт: 9,4 г ясно-жовтого масла Вихід: 73,8 % Вміст (виміряне ГХ): 83,4 % заявленого продукту, забруднений 15,2 % початкової сполуки 0,5 % дибромованої похідної. Приклад 5 2-бром-1-циклопропіл-2-(2-фторфеніл) -етанон [сполуки формули (IV)] У 250 мл круглодонну колбу додали розчин циклопропіл-2-фторбензилкетона (8,91 г, 50 моль), N-бензил-тріетил-амонійбромід (2,0 г), водний розчин пероксиду водню (30 мас. %, 40 мл, 0,39 моля) і водний розчин бромоводню(48 мас. %, 28,3 мл, 0,25 моля). Реакційну суміш інтенсивно перемішували протягом двох годин при 85 °C, продукт екстрагували двічі етилацетатом (2 × 50 мл) і об'єднані фази етилацетату сушили і упарили. Одержаний продукт: 10,2 г ясно-жовтого масла Вихід: 67,1 % Вміст (виміряний ГХ): 83,4 % заявленого продукту, який забруднений 7,1 % початкової сполуки 7,5 % дибромованої похідної. Приклад 6 2-бром-1-циклопропіл-2-(2-фторфеніл) -етанон [сполуки формули (IV)] Одержання виконували згідно Прикладу 1, відмінність полягає в тому, що водний розчин бромоводню(48 мас. %, 71,3 мл, 0,63 моля) додали по краплях до початкової суміші при 25 °C при охолоджуванні і інтенсивному перемішуванні. Одержану суміш перемішали протягом 5 днів при кімнатній температурі, і продукт одержували за прикладом 1. 7 UA 100397 C2 5 10 15 20 25 30 35 40 45 50 55 Одержаний продукт: 59,2 г ясно-жовтого масла Вихід: 82,9 % Вміст (виміряний ГХ): 90,0 %. Згідно даних ГХ, неочищений продукт містить 7,2 % початкової сполуки і лише 1,3 % дибромованої похідної, що менше одержаної дибромованої похідної в Прикладі 1. Продукт, при необхідності, може бути очищений перегонкою. Точка кипіння: 90 °C/40 Па (0,3 мм рт.ст.) Одержаний продукт після перегонки: 49,1 г безбарвного масла Вміст (ГХ) після перегонки: 97,5 %. Приклад 7 2-хлор-1-циклопропіл-2-(2-фторфеніл) етанон [сполуки формули (III) Х=cl, R=2-F)] Одержання виконали згідно Прикладу 1, відмінність полягає в тому, що замість бромоводнюдо реакційної суміші додали водний концентрований розчин соляної кислоти (105 мл, 1,24 моля). Даний розчин по краплях додали до початкової реакційної суміші при 25 °C при охолоджуванні і інтенсивному перемішуванні. Одержану суміш перемішали протягом 3 днів при кімнатній температурі, і продукт одержували за прикладом 1. Одержаний продукт: 51,0 г безбарвного масла Вихід: 82,9 % Вміст (виміряний ГХ): 94,5 %. Згідно даних Гх/мс, неочищений продукт містив 3,5 % початкової речовини і 1,4 % дихлорпохідної, тому подальше очищення не було потрібне. Приклад 8 2-хлор-1-циклопропіл-2-(2-фторфеніл) -етанон [речовина формули (III) Х=cl, R=2-F)] У 250 мл круглодонну колбу додали розчин циклопропіл-2-фторбензилкетону (9,74 г, 50 моль), діоксан (100 мл), водний розчин пероксиду водню (30 мас. %, 0,23 моля) і концентрований водний розчин соляної кислоти (11 мл, 0,13 моля). Реакційну суміш перемішували протягом двох годин при температурі 80 °C, далі її охолодили і до безбарвного розчину додали розчин сульфату натрію (20 г) і етилацетат (50 мл) до реакційної суміші. Верхній органічний шар екстрагували водним розчином гідрокарбонату натрію і сушили над сульфатом магнію, потім упарювали. Одержаний продукт: 10,3 г ясно-жовтого масла Вихід: 86,1 % Вміст (виміряний ГХ): 95,3 %. Згідно з результатами ГХ, продукт містить 3,7 % початкової сполуки і 0,5 % дибромованої похідної. Неочищений продукт, при необхідності, можна очистити вакуумною перегонкою. Точка кипіння: 58 °C/26,6 Па (0,2 мм рт.ст.) Одержаний продукт після перегонки: 8,2 г безбарвного масла Вміст (виміряний ГХ) після дистиляції: 98,5 %. Приклад 9 2-бром-1-циклопропіл-2-(2-фторфеніл) -етанон [сполуки формули (IV)] Одержання виконали згідно Прикладу 1, відмінність полягає в тому, що замість водного розчину бромоводню (48 мас. %, 71,3 мл, 0,63 моля) до початкової реакційної суміші додали бромід калію (75,0 г, 0,63 моля) і поступово сірчану кислоту (30,0 г, 0,30 моля). Заявлений продукт одержували згідно Прикладу 1. Одержаний продукт: 48,8 г ясно-жовтого масла Вихід: 86,3 % Вміст (дані ГХ): 94,0 %. Згідно з результатами ГХ, продукт містить 3,2 % початкової речовини і 2,3 дибромпохідної. Приклад 10 2-бром-1-циклопропіл-2-(2-фторфеніл) -етанон [сполуки формули (IV)] Спосіб одержання виконали згідно Прикладу 1 з тією різницею, що замість водного розчину бромоводню (48 мас. %, 71,3 мл, 0,63 моля) до початкової реакційної суміші при охолоджуванні додали бромід калію (52,0 г, 0,50 моля) при 25 °C і поступово сірчану кислоту (30,0 г, 0,30 моля). Реакційну суміш перемішали протягом 3 днів при кімнатній температурі і заявлений продукт обробили згідно Прикладу 1. Одержаний продукт: 48,5 г ясно-жовтої сполуки Вихід: 84,1 % Вміст (за даними ГХ): 92,1 %. 8 UA 100397 C2 5 10 Згідно даних ГХ, неочищений продукт містить 4,3 % початкової сполуки і 1,5 % дибромпохідної. Заявлений продукт, при необхідності, очищали перегонкою. Приклад 11 2-хлор-1-циклопропіл-2-(2-фторфеніл) -етанон [сполуки формули (III) X=Cl, R=2-F)] Спосіб виконали за прикладом 1 з тією різницею, що замість водного розчину бромоводню (48 мас. %, 71,3 мл, 0,63 моля) до початкової реакційної суміші при охолоджуванні додали хлорид натрію (29,5 г, 0,50 моля) при 25 °C і поступово сірчану кислоту (25,0 г, 0,25 моля). Реакційну суміш перемішали 48 годин при кімнатній температурі, вказаний продукт обробили згідно прикладу 1. Одержаний продукт: 60,4 г ясно-жовтого масла Вміст (дані ГХ): 93,2 %. Згідно даних ГХ, неочищений продукт містить 3,4 % початкової сполуки і 1,9 % дихлорпохідної. Вказаний продукт, при необхідності, можна очистити перегонкою. ФОРМУЛА ВИНАХОДУ 15 1. Спосіб одержання сполук загальної формули (III) O X R , III 20 де R є атомом фтору або хлору і X є атомом хлору або брому, в якому здійснюють галогенування циклопропілбензилкетону загальної формули (II) O R , II 25 30 35 40 де R є атомом фтору або хлору, що характеризується тим, що а) галогенування виконують в суміші водного розчину галогеноводню і водного розчину пероксиду водню у присутності розчинника, що змішується з водою, або у присутності каталізатора фазового перенесення, або б) галогенування виконують в суміші солі лужного металу з водним розчином галогеноводню, водного розчину пероксиду водню і сірчаної кислоти. 2. Спосіб за п. 1, який відрізняється тим, що реакцію проводять у присутності 1-5 мольн. еквівалентів водного розчину галогеноводню і 1-10 мольн. еквівалентів водного розчину пероксиду водню, розрахованих по відношенню до сполук формули (II). 3. Спосіб за п. 1, який відрізняється тим, що реакцію проводять переважно у присутності 2-4 мольн. еквівалентів водного розчину галогеноводню і 4-6 мольн. еквівалентів водного розчину пероксиду водню, розрахованих по відношенню до сполук формули (II). 4. Спосіб за п. 1, який відрізняється тим, що в реакції використовують водний розчин бромоводню або розчин бромоводню в оцтовій кислоті або газоподібний бромоводень, переважно використовують 48 мас. % водний розчин бромоводню. 5. Спосіб за п. 1, який відрізняється тим, що в реакції використовують водний розчин пероксиду водню, переважно 25-40 мас. % водний розчин пероксиду водню. 6. Спосіб за п. 1, який відрізняється тим, що розчинником, що змішується з водою, є діоксан, оцтова кислота, тетрагідрофуран або С1-4спирт, що має розгалужений або нерозгалужений ланцюг, переважно метиловий спирт, етиловий спирт або ізопропіловий спирт. 9 UA 100397 C2 5 7. Спосіб за п. 1, який відрізняється тим, що каталізатором фазового перенесення є четвертинна сіль амонію, переважно бензилтриетиламонію хлорид, тетрабутиламонію хлорид, бензилтриетиламонію бромід або тетрабутиламонію бромід. 8. Спосіб за п. 1, який відрізняється тим, що сіллю лужного металу є бромід натрію, хлорид натрію, бромід калію або хлорид калію. 9. Спосіб за п. 1, який відрізняється тим, що в реакції використовують 1-5 мольн. еквівалентів солі лужного металу і 2-10 мольн. еквівалентів водного розчину пероксиду водню. 10. Спосіб одержання сполук формули (І) O S O O N CH3 F , I 10 із сполук формули (III) O X R , III де R є атомом фтору в положенні 2, X є атомом хлору або брому, який характеризується тим, що сполуку циклопропілбензилкетону формули (II) O R , II 15 де R є атомом фтору в положенні 2, галогенують в суміші розчину водного розчину галогеноводню і водного розчину пероксиду водню у присутності розчинника, що змішується з водою, або у присутності каталізатора фазового перенесення; або галогенування виконують в суміші сірчаної кислоти і солі лужного металу з водним розчином галогеноводню, і одержану сполуку формули (III) O X R 20 , III де R є атомом фтору в положенні 2, і X є атомом хлору або брому, перетворюють на сполуку формули (І) 10 UA 100397 C2 O S O O N F , I або її сіль приєднання кислоти відповідно до відомих способів. 11 UA 100397 C2 Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of pharmaceutical intermediates
Автори англійськоюMezei Tibor, Lukacs, Gyula, Molnar, Eniko, Barkoczy, Jozsef, Volk, Balazs, Porcs-Makkay, Marta, Szulagyi, Janos, Vajjon, Maria
Назва патенту російськоюСпособ получения фармацевтических промежуточных соединений
Автори російськоюМезей Тибор, Лукаш Дьюла, Молнар Энико, Баркоци Йожеф, Волк Балаж, Порч-Маккай Марта, Суладий Янош, Вайон Мария
МПК / Мітки
МПК: C07D 495/04, C07C 49/567, C07C 45/63
Мітки: одержання, спосіб, фармацевтичних, проміжних, сполук
Код посилання
<a href="https://ua.patents.su/14-100397-sposib-oderzhannya-farmacevtichnikh-promizhnikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання фармацевтичних проміжних сполук</a>
Попередній патент: Джерело світла
Наступний патент: Аерозольний інгалятор
Випадковий патент: Спосіб комплексного лікування хворих з гнійно-некротичними ускладненнями синдрому діабетичної стопи