Оптично активні карбамати, спосіб їх отримання і їх застосування в якості фармацевтичних проміжних сполук
Номер патенту: 92195
Опубліковано: 11.10.2010
Автори: Мезей Тібор, Молнар Еніко, Понгьо Ласло, Надь Кальман, Евінгер Жужанна, Порч-Маккай Марта, Барта Ференц, Трінка Петер, Сіміг Дюла, Верецкейне Донат Дйордьі, Лукач Дьюла, Катона Золтан
Формула / Реферат
1. Спосіб одержання 1-[(4-хлорфеніл)метилфеніл]піперазину Формули (І)
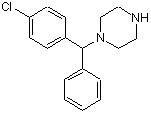 (I)
(I)
або його енантіомерів і солей, при якому 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III)
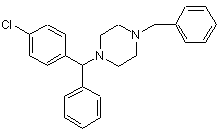 (III)
(III)
або його енантіомер піддають реакції з 2,2,2-трихлоретилхлорформіатом Формули (X)
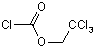 (X)
(X)
і перетворюють одержаний таким чином 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2-трихлоретоксикарбоніл)піперазин Формули (IV)
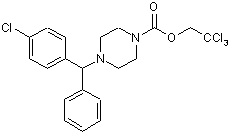 (IV)
(IV)
у 1-[(4-хлорфеніл)метилфеніл]піперазин Формули (І).
2. Спосіб за п. 1, який відрізняється тим, що 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III)
 (III)
(III)
піддають реакції з 1,0-1,2 молярними еквівалентами, переважно 1,05 молярним еквівалентом 2,2,2-трихлоретилформіату Формули (X).
3. Спосіб за п. 1, який відрізняється тим, що вказану реакцію 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) і 2,2,2-трихлоретилхлорформіату Формули (X) здійснюють у присутності неорганічної або органічної основи, що є реагентом, який зв'язує кислоту.
4. Спосіб за будь-яким із пп. 1-3, який відрізняється тим, що реакцію 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) і 2,2,2-трихлоретилхлорформіату здійснюють в розчиннику, вибраному з ароматичного, апротонного або ефірного органічного розчинника.
5. Спосіб за п. 1, який відрізняється тим, що реакцію здійснюють при температурі від -20 до 40 °С, переважно від 15 до 20 °С.
6. Спосіб за п. 1, який відрізняється тим, що сполуку Формули (І) виділяють у вигляді солі фумарату Формули (XI)
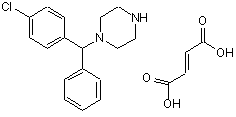 (XI).
(XI).
7. Спосіб за п. 1, який відрізняється тим, що як початкову речовину використовують (R)-(+)-1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III).
8. Спосіб одержання 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2-трихлоретоксикарбоніл)піперазину Формули (IV)
 (IV)
(IV)
або його енантіомерів, або його солей, при якому піддають реакції 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III)
 (III)
(III)
або його енантіомер з 2,2,2-трихлоретилхлорформіатом Формули (X) і довільно перетворюють утворений таким чином 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2-трихлоретоксікарбоніл)піперазин Формули (IV) в його сіль приєднання кислоти.
9. Спосіб за п. 8, який відрізняється тим, що 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III) піддають реакції з 1,0-1,2 молярними еквівалентами, переважно 1,05 молярним еквівалентом 2,2,2-трихлоретилформіату Формули (X).
10. Спосіб за п. 8, який відрізняється тим, що вказану реакцію 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) і 2,2,2-трихлоретилхлорформіату Формули (X) здійснюють у присутності неорганічної або органічної основи, що є реагентом, який зв'язує кислоту.
11. Спосіб за п. 10, який відрізняється тим, що як неорганічну основу використовують гідрокарбонат або карбонат лужного або лужноземельного металу, або як органічну основу використовують триетиламін, трибутиламін або піридин.
12. Спосіб за будь-яким із пп. 8-11, який відрізняється тим, що реакцію 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) і 2,2,2-трихлоретилхлорформіату Формули (X) здійснюють в розчиннику, вибраному з ароматичного, полярного апротонного або ефірного органічного розчинника.
13. Спосіб за п. 12, який відрізняється тим, що як ароматичний розчинник використовують бензол або толуол, як полярний апротонний розчинник - N,N-диметилформамід або диметилсульфоксид, як ефірний розчинник - діізопропіловий ефір, діетиловий ефір, діоксан або тетрагідрофуран.
14. Спосіб за будь-яким із пп. 8-13, який відрізняється тим, що реакцію здійснюють при температурі від -20 до 40 °С, переважно від 15 до 20 °С.
15. Спосіб за будь-яким із пп. 8-14, який відрізняється тим, що сполуку Формули (І) виділяють у вигляді солі фумарату Формули (XI)
 (XI).
(XI).
16. Спосіб за п. 8, який відрізняється тим, що як початкову речовину використовують (R)-(+)-1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III).
17. Спосіб за п. 8, який відрізняється тим, що перетворення 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2-трихлоретоксикарбоніл)піперазину Формули (IV) в 1-[(4-хлорфеніл)метилфеніл]піперазин Формули (І) здійснюють шляхом відновлення.
18. Спосіб за п. 17, який відрізняється тим, що відновлення здійснюють за допомогою цинку в кислому розчині.
19. Спосіб за п. 18, який відрізняється тим, що використовують від 1 до 5, переважно від 1,5 до 2,5, молярних еквівалентів цинку.
20. Спосіб за будь-яким із пп. 8-19, який відрізняється тим, що для перетворення 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2-трихлоретоксікарбоніл)піперазину Формули (IV) в 1-[(4-хлорфеніл)метилфеніл]піперазин Формули (І) використовують розчинник, вибраний з води, водного розчину кислоти, переважно розчину оцтової кислоти або соляної кислоти, довільної домішки ароматичного вуглецю, переважно толуолу.
21. Спосіб за будь-яким із пп. 8-20, який відрізняється тим, що перетворення 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2-трихлоретоксікарбоніл)піперазину Формули (IV) в 1-[(4-хлорфеніл)метилфеніл]піперазин Формули (І) здійснюють при температурі від 0 до 50 °С, переважно від 20 до 25 °С.
22. Спосіб за п. 17, який відрізняється тим, що як початкову речовину використовують (R)-(-)-1-(4-хлорфеніл)метилфеніламін Формули (VI).
23. 1-[(4-Хлорфеніл)фенілметил]-4-(2,2,2-трихлоретоксикарбоніл)-піперазин Формули (IV) або його енантіомери і солі приєднання кислоти.
Текст
1. Спосіб одержання 1-[(4хлорфеніл)метилфеніл]піперазину Формули (І) 2 (I) або його енантіомерів і солей, при якому 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III) (19) (III) піддають реакції з 1,0-1,2 молярними еквівалентами, переважно 1,05 молярним еквівалентом 2,2,2трихлоретилформіату Формули (X). 3. Спосіб за п.1, який відрізняється тим, що вказану реакцію 1-[(4-хлорфеніл)фенілметил]-4бензилпіперазину Формули (III) і 2,2,2трихлоретилхлорформіату Формули (X) здійснюють у присутності неорганічної або органічної основи, що є реагентом, який зв'язує кислоту. UA NH N 3 92195 4. Спосіб за будь-яким із пп.1-3, який відрізняється тим, що реакцію 1-[(4-хлорфеніл)фенілметил]4-бензилпіперазину Формули (III) і 2,2,2трихлоретилхлорформіату здійснюють в розчиннику, вибраному з ароматичного, апротонного або ефірного органічного розчинника. 5. Спосіб за п.1, який відрізняється тим, що реакцію здійснюють при температурі від -20 до 40 °С, переважно від 15 до 20 °С. 6. Спосіб за п.1, який відрізняється тим, що сполуку Формули (І) виділяють у вигляді солі фумарату Формули (XI) Cl NH O N OH O OH (XI). 7. Спосіб за п.1, який відрізняється тим, що як початкову речовину використовують (R)-(+)-1-[(4хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III). 8. Спосіб одержання 1-[(4-хлорфеніл)фенілметил]4-(2,2,2-трихлоретоксикарбоніл)піперазину Формули (IV) O 4 лу, або як органічну основу використовують триетиламін, трибутиламін або піридин. 12. Спосіб за будь-яким із пп.8-11, який відрізняється тим, що реакцію 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) і 2,2,2-трихлоретилхлорформіату Формули (X) здійснюють в розчиннику, вибраному з ароматичного, полярного апротонного або ефірного органічного розчинника. 13. Спосіб за п.12, який відрізняється тим, що як ароматичний розчинник використовують бензол або толуол, як полярний апротонний розчинник N,N-диметилформамід або диметилсульфоксид, як ефірний розчинник - діізопропіловий ефір, діетиловий ефір, діоксан або тетрагідрофуран. 14. Спосіб за будь-яким із пп.8-13, який відрізняється тим, що реакцію здійснюють при температурі від -20 до 40°С, переважно від 15 до 20°С. 15. Спосіб за будь-яким із пп.8-14, який відрізняється тим, що сполуку Формули (І) виділяють у вигляді солі фумарату Формули (XI) Cl NH O N OH O OH Cl N O CCl 3 N (IV) або його енантіомерів, або його солей, при якому піддають реакції 1-[(4-хлорфеніл)фенілметил]-4бензилпіперазин Формули (III) Cl N N (III) або його енантіомер з 2,2,2трихлоретилхлорформіатом Формули (X) і довільно перетворюють утворений таким чином 1-[(4хлорфеніл)фенілметил]-4-(2,2,2трихлоретоксікарбоніл)піперазин Формули (IV) в його сіль приєднання кислоти. 9. Спосіб за п.8, який відрізняється тим, що 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III) піддають реакції з 1,0-1,2 молярними еквівалентами, переважно 1,05 молярним еквівалентом 2,2,2-трихлоретилформіату Формули (X). 10. Спосіб за п.8, який відрізняється тим, що вказану реакцію 1-[(4-хлорфеніл)фенілметил]-4бензилпіперазину Формули (III) і 2,2,2трихлоретилхлорформіату Формули (X) здійснюють у присутності неорганічної або органічної основи, що є реагентом, який зв'язує кислоту. 11. Спосіб за п.10, який відрізняється тим, що як неорганічну основу використовують гідрокарбонат або карбонат лужного або лужноземельного мета (XI). 16. Спосіб за п.8, який відрізняється тим, що як початкову речовину використовують (R)-(+)-1-[(4хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III). 17. Спосіб за п.8, який відрізняється тим, що перетворення 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2трихлоретоксикарбоніл)піперазину Формули (IV) в 1-[(4-хлорфеніл)метилфеніл]піперазин Формули (І) здійснюють шляхом відновлення. 18. Спосіб за п.17, який відрізняється тим, що відновлення здійснюють за допомогою цинку в кислому розчині. 19. Спосіб за п.18, який відрізняється тим, що використовують від 1 до 5, переважно від 1,5 до 2,5, молярних еквівалентів цинку. 20. Спосіб за будь-яким із пп.8-19, який відрізняється тим, що для перетворення 1-[(4хлорфеніл)фенілметил]-4-(2,2,2трихлоретоксікарбоніл)піперазину Формули (IV) в 1-[(4-хлорфеніл)метилфеніл]піперазин Формули (І) використовують розчинник, вибраний з води, водного розчину кислоти, переважно розчину оцтової кислоти або соляної кислоти, довільної домішки ароматичного вуглецю, переважно толуолу. 21. Спосіб за будь-яким із пп.8-20, який відрізняється тим, що перетворення 1-[(4хлорфеніл)фенілметил]-4-(2,2,2трихлоретоксікарбоніл)піперазину Формули (IV) в 1-[(4-хлорфеніл)метилфеніл]піперазин Формули (І) здійснюють при температурі від 0 до 50°С, переважно від 20 до 25°С. 22. Спосіб за п.17, який відрізняється тим, що як початкову речовину використовують (R)-(-)-1-(4хлорфеніл)метилфеніламін Формули (VI). 23. 1-[(4-Хлорфеніл)фенілметил]-4-(2,2,2трихлоретоксикарбоніл)-піперазин Формули (IV) або його енантіомери і солі приєднання кислоти. 5 Даний винахід відноситься до хлорфеніл)фенілметил]-4-(2,2,2трихлоркарбетоксі)піперазину Формули (IV) 92195 1-[(4 (IV) і його оптичних ізомерів, способів їх отримання і застосування 1-[(4-хлорфеніл)фенілметил]-4(2,2,2-трихлоркарбетоксі)піперазину Формули (IV) при отриманні 1-(4хлорфеніл)фенілметилпіперазину Формули (І) (I) і його оптичних ізомерів і солей. 1-(4Хлорфеніл)фенілметилпіперазин Формули (І) і його оптичні ізомери є важливими фармацевтичними проміжними сполуками при отриманні неседативних активних фармацевтичних інгредієнтів антигістамінового типу. 1-(4-Хлорфеніл)фенілметилпіперазин Формули (І) є важливою проміжною сполукою при отриманні активного фармацевтичного інгредієнту, відомого під міжнародною непатентованою назвою цетиризин. Цетиризин, що хімічно є {2-[4-{(4хлорфеніл)фенілметил}-1піперазиніл]етоксі}оцтовою кислотою, є неседативним активним інгредієнтом антигістамінового типу, відповідним для лікування алергії. Дія цетиризину заснована на його виборчій взаємодії з гістаміновими рецепторами Н1, що інгібують вивільнення гістаміну. Цетиризин є рацемічною сполукою, яка сама по собі придатна для терапії. З рівня техніки відомо, що введення лівообертаючого енантіомеру (-)цетиризину є фармакологічно сприятливим, оскільки при введенні (-)-цетиризину виявляють менше побічних дій. (-)-Цетиризин є індивідуальним активним фармацевтичним інгредієнтом, відомим під міжнародною непатентованою назвою левоцетиризин. Існує декілька підходів, відомих у області техніки для синтезу оптично активних сполук. Відповідно до одного з цих підходів одержують рацемічний кінцевий продукт і оптично чистий енантіомер одержують на кінцевій стадії шляхом розщеплювання рацемату. Відповідно до другого підходу оптично активну проміжну сполуку одержують на ранній стадії способу синтезу і потім розробляють шлях синтезу, який забезпечує збереження конфігурації бажаного оптичного центру і запобігає його рацемізації. 6 Зважаючи на економічні причини бажано здійснювати розділення оптичних ізомерів на ранній стадії способу синтезу. Цінність речовин, використовуваних на ранній стадії синтезу, як правило, менша ніж цінність проміжних сполук, використовуваних на пізніших стадіях. Цей підхід звичайно приводить в результаті також до переваг для навколишнього середовища, оскільки побічні продукти ранніх стадій синтезу можуть бути легше утилізовані або перероблені в порівнянні з одержаними на пізніших стадіях. Відповідно до загального прийнятного способу у області синтезу оптично активних хімічних сполук, переважні шляхи синтезу, які дають можливість для застосування раніше розділеної проміжної сполуки, відомої в області техніки, або, альтернативно, процес розділення оптичних ізомерів забезпечує хороший вихід або передбачувану оптично активну проміжну сполуку є у продажу. Відповідно до рівня техніки, відомі три способи отримання оптично активних форм 1-(4хлорфеніл) фенілметилпіперазину Формули (І). Відповідно до способу, розкритого в патенті Великобританії №2225321, рацемічний 1-(4хлорфеніл)фенілметилпіперазин розщеплювали з використанням 2-хмольного еквівалента (R)винної кислоти і сіль тартрат, що володіє незадовільною оптичною чистотою, одержану після трьох перекристалізацій, нейтралізували. Одержану таким чином основу тричі перекристалізовували з гексану. Спосіб дозволяв одержати (R)-(-)-1-(4хлорфеніл)фенілметилпіперазин з виходом 6,3%. Цей спосіб не підходить для застосування у фармацевтичній промисловості, оскільки ні чистота ні одного з продуктів, ні вихід не є задовільними. Аналогічно вищеописаному способу загальний спосіб розділення оптичних ізомерів включає приготування діастереоізомерних солей з використанням оптично активної кислоти, яка є так званою розділяючою кислотою. Фізичні властивості одержаних таким чином діастереоізомерних солей (тобто температура плавлення, розчинність і т.д.), одержаних з двох оптичних ізомерів основної сполуки, відрізняються один від одного. Як правило, відмінність у фізичних властивостях між двома оптичними ізомерами оптично активної основи є значущим, якщо оптичний центр оптично активної основи стерично близько розташований до основного атому азоту, який бере участь в утворенні солі. Розділення оптичних ізомерів 1-(4хлорфеніл)фенілметилпіперазину Формули (І) є складною проблемою, оскільки 1-(4хлорфеніл)фенілметилпіперазин Формули (І) містить два основні атоми азоту. Хоча один із вказаних атомів азоту стерично близько розташований до оптичного центру, цей атом азоту стерично блокований, таким чином утворення солі в цьому атомі азоту утруднено. Атом азоту, що знаходить 7 92195 ся на відстані від оптичного центру, у позиції 4 набагато легше зазнає утворення солі. Крім того, розділення такої сполуки ускладнюється тим, що зважаючи на присутність двох основних атомів азоту, для утворення солі повинні бути використані два молярні еквіваленти розщеплюючої кислоти. Оскільки оптичні ізомери рацемічного 1-(4хлорфеніл) фенілметилпіперазину Формули (І) не можуть бути розділені з хорошим виходом через два основні атоми азоту, розробили ще один спосіб. У Європейській заявці на патент № 1236722 рацемічний 1-(4-хлорфеніл)фенілметилпіперазин Формули (І) ацилували у позиції 4 і третинну бутоксикарбоніловану похідну Формули (V) розділяли. Ацилування у позиції 4 привело в результаті до того, що в молекулі присутній один основний атом азоту, тому кількість розщеплюючої кислоти може бути зменшена до одного молярного еквіваленту. Утворення солі услід за ацилуванням здійснюється в позиції, стерично близької оптичному центру, таким чином, ефективність розділення може бути збільшена. Бутоксикарбонільну похідну Формули (V) розщеплювали з використанням D-(+)-Ο,Οдибензоїлвинної кислоти як розщеплюючої кислоти і первинний продукт одержували з енантіомерною чистотою 78%. Потім захисну групу видаляли шляхом гідролізу і основу кілька разів перекристалізовували. Недолік вищезазначеного способу полягає в тому, що введення і гідролітичне видалення захисної групи є дорогим і вихід складає лише приблизно 30% з розрахунку на основі кількості рацемічного 1-(4-хлорфеніл)фенілметилпіперазину Формули (І). З рівня техніки відомо, що можуть бути використані тільки ті захисні групи на атомі азоту у позиції 4 піперазинового кільця 1-(4хлорфеніл)фенілметилпіперазину Формули (І), які можуть бути видалені в м'яких умовах при низькій температурі в неводному розчині без рацемізації оптичного центру. Відповідно до досвіду авторів винаходу оптично активний 1-(4-хлорфеніл)фенілметилпіперазин Формули (І) поволі перетворюється на відповідну рацемічну сполуку в кислому або основному розчині навіть при кімнатній температурі. Рацемізація здійснюється швидко у водному розчині лугу, тому захисні групи, які віддаляються лужним гідролізом, тобто ацетилова або етоксікарбонільна група, не можуть бути використані без істотної рацемізації. Відповідно до способу, розкритого в Європейському патенті №617028, оптичний центр одержують на ранній фазі синтезу. (R)-(-)-1-(4хлорфеніл)фенілметиламін Формули (VI) (VI) 8 використовують як початкову речовину. Вказана сполука Формули (VI) може бути одержана відповідно до способу Інгольда і Вілсона з використанням камфорсульфонової кислоти (J. Chem. Soc. 1933, 1493) або з використанням способу Клемо і Гаднера у водному розчині з (+)-винною кислотою (J. Chem. Soc. 1939, 1958). Синтез піперазинового кільця 1-(4хлорфеніл)фенілметилпіперазину Формули (І) здійснюють за допомогою реакції циклізації. Для цієї реакції використовують N-заміщені похідні N,N-біс-(2-хлоретил)аміну, такі як N,N-біс-(2хлоретил)-4-метилбензолсульфонамід Формули (VII) (Vll) або N,N-біс-(2-хлоретил)бензиламін Формули (VIII) (Vlll) оскільки використання N,N-біс-(2хлоретил)аміну супроводжується побічними реакціями і утворенням смоли. Під час синтезу одержують оптично активний 1-[(4-хлорфеніл)фенілметил]-4-[паратолуолсульфоніл]піперазин Формули (II) (Il) шляхом реакції оптично активного (4хлорфеніл)фенілметиламіну Формули (VI) і N,Nбіс-(2-хлоретил)-4-метилбензолсульфонаміду Формули (VII), яку здійснюють шляхом кип'ятіння реагентів в Ν,Ν-диізопропілетиламіновому розчиннику при температурі 127°С протягом чотирьох годин. Продукт кристалізують і паратолуолсульфонільну групу видаляють з використанням 30% броміду водню в розчиннику оцтовій кислоті шляхом перемішування протягом 24 годин. У жорстких умовах реакції для запобігання рацемізації використовують чотири молярні еквіваленти 4-гідроксибензойної кислоти. Проте, шляхом додавання 4-гідроксибензойної кислоти спосіб приводить в результаті до продукту з домішками. Продукт одержують з виходом приблизно 85%. Неочищений продукт додатково очищають шляхом перекристалізації. Відповідно до різних авторів (Oplatka, C.J. et al., Synthesis 1995, 766) з використанням вищезазначеного способу оптично чистий 1-(4хлорфеніл)фенілметилпіперазин Формули (І) може бути одержаний з виходом 59%. Недолік вищезазначеного способу полягає в тому, що для гідролізу толуолсульфонільної групи потрібні жорсткі умови реакції. За таких умов відбувається рацемізація, якої можна уникнути з ви 9 92195 користанням тільки додаткових добавок. Використання таких добавок складає додаткові витрати і вказані добавки можуть забруднювати продукт. В області органічної хімії для захисту атомів азоту часто використовують бензильну групу. Бензильна група може бути видалена шляхом каталітичного гідрування з використанням каталізатора паладій на вуглеці при температурі від 25 до 80°С або з використанням платинового каталізатора або ренеєвського нікелю при вищій температурі і при вищому тиску водню. Шляхом реакції N,N-(біс-хлоретил)бензиламіну Формули (VIII) з 1-(4хлорметил)метилфеніламіном Формули (VI) у присутності агенту, зв'язуючому кислоту, одержують 1-[(4-хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III) (Ill) Проте, бензильна група не може бути вибірково видалена з 1-[(4-хлорфеніл)фенілметил]-4бензилпіперазину Формули (III) шляхом каталітичного гідрування з використанням каталізатора паладій на вуглеці, оскільки N-(4-хлорбензгідрильне) угрупування елімінується швидше, ніж бензильна група. Відповідно до опису Патенту США №2709169 видалення N-бензильної групи рацемічного 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) може бути здійснено з виходом 75% з використанням каталізатора ренеєвського нікелю. Реакцію здійснювали при температурі 150°С і тиску 100бар (100*105Па). Проте, коли починають з оптично активної бензилпіперазинової похідної, загальна рацемізація відбувається при цій високій температурі, таким чином вищезазначений спосіб не підходить для отримання 1-[(4хлорфеніл)фенілметил]піперазину Формули (І) в оптично активній формі. У разі, коли сполука біс-(2-хлоретил) амін, захищена 2,2,2-трихлоретоксігрупою у позиції 4, що більш легко видаляється, що відповідає Формулі (IX) (IX) і 1-(4-хлорфеніл) метилфеніламін Формули (VI) безпосередньо вступають в реакцію, вихід бажаного заміщеної піперазинової похідної Формули (IV) є низьким, оскільки в умовах циклізації при температурі 100°С у присутності реагенту, що зв'язує кислоту, майже повністю видаляють 2,2,2трихлоретоксікарбонільну групу. Завдання науково-дослідної роботи авторів даного винаходу полягало в розробці способу для отримання оптично активних форм 1-(4хлорфеніл)метилфенілпіперазину Формули (І) з 10 хорошим виходом і з високою оптичною і хімічною чистотою економічним чином. Вищезгадану задачу вирішують за допомогою способу за даним винаходом. Вельми несподівано виявили, що 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазин Формули (III) може вступати в реакцію в м'яких умовах при кімнатній температурі з 2,2,2трихлоретилхлорформіатом Формули (X) (X) приводячи в результаті до утворення 1-[(4хлорфеніл)фенілметил]-4-(2,2,2трихлоретоксікарбоніл)піперазину Формули (IV) протягом декількох годин. Хоча в області техніки існує декілька прикладів перетворення N-бензильної групи аліфатичних амінів у відповідний карбамат шляхом реакції вказаних амінів із складними ефірами хлоркарбонової кислоти, хімічна література умовчує про перетворення заміщених піперазинових похідних в карбамати. Література також умовчує про заміну бензильної групи на алкоксикарбонільну групу. Вельми несподівано, що в цій реакції відщеплення 4хлорбензгідрильної групи відбувається в набагато меншому ступені і продукт побічної реакції осідає з реакційної суміші і може бути легко видалений. З використанням оптично активного 1-(4хлорфеніл)метилфеніламіну Формули (VI) у якості початкової речовини не відбувається рацемізація під час отримання 1-[(4-хлорфеніл)фенілметил]-4бензилпіперазину Формули (III) або під час отримання 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2трихлоретоксікарбоніл)піперазину Формули (IV). Одержаний таким чином продукт 1-[(4хлорфеніл)фенілметил]-4-(2,2,2трихлоретоксікарбоніл)піперазин Формули (IV) може бути перетворений на 1-[(4хлорфеніл)фенілметил])піперазин Формули (І) без небезпеки для рацемізації шляхом видалення захисної 2,2,2-трихлоретоксікарбонільної групи, що здійснюють шляхом обробки сполуки Формули (IV) цинком і оцтовою кислотою в безводному середовищі в толуольному розчиннику. Після видалення захисту 1-[(4-хлорфеніл)фенілметил])піперазин Формули (І) виділяють у формі солі фумарату Формули (XI). (XI) Фумарат 1-[(4хлорфеніл)фенілметил]піперазину Формули (XI) є новим. Відповідно до першого аспекту даного винаходу запропонований спосіб отримання рацемічної і оптично активних форм 1-(4хлорфеніл)фенілметилпіперазину Формули (І), що включає реакцію рацемічної або відповідної оптично активної форми 1-(4-хлорфеніл) метилфеніламіну Формули (VI) з N,N-(біс-2хлоретил)бензиламіном Формули (VIII) і перетво 11 рення продукту рацемічного або оптично активного 1-(4-хлорфеніл)фенілметил-4-бензилпіперазину Формули (III) в 1-(4-хлорфеніл)фенілметил-4(2,2,2-трихлоретоксікарбоніл)піперазин Формули (IV) шляхом обробки сполуки Формули (III) 2,2,2трихлоретоксіхлорформіатом, видалення захисної групи і виділення продукту 1-(4хлорфеніл)фенілметилпіперазину Формули (І) у формі його солі фумарату. Фумарат 1-(4хлорфеніл) фенілметилпіперазину (1:1) Формули (XI) є новим. У даному описі під виразом "соли приєднання кислоти" розуміють солі тієї сполуки, якою зацікавлені, які утворюються з органічними або неорганічними кислотами. Кислоти, відповідні для утворення солі, включають неорганічні кислоти, такі як соляна кислота, бромід водню, фосфорна кислота, азотна кислота і сірчана кислота; і органічні кислоти, наприклад, мурашина кислота, оцтова кислота, пропіонова кислота, малеїнова кислота, фумарова кислота, янтарна кислота, молочна кислота, яблучна кислота, винна кислота, лимонна кислота, аскорбінова кислота, малонова кислота, щавелева кислота, мигдалева кислота, пікринова кислота, гліколева кислота, фталева кислота, бензолсульфонова кислота, пара-толуолсульфонова кислота, нафталінсульфонова кислота або метансульфонова кислота. Карбонати, гідрокарбонати, сульфіди, гідросульфіти і сульфіти також розглядають як солі приєднання кислоти, утворені з неорганічною кислотою. Відповідно до ще одного аспекту даного винаходу запропоновані оптично активні форми 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) і їхні солі приєднання кислоти. Відповідно до ще одного аспекту даного винаходу запропонований спосіб отримання оптично активних форм 1-[(4-хлорфеніл)фенілметил]-4бензилпіперазину Формули (III) і його солей приєднання кислоти. Енантіомери сполуки Формули (III) одержують шляхом реакції оптично активної форми (4-хлорфеніл)фенілметиламіну Формули (VI) з N,N-біс-(2-хлоретил)бензиламіном Формули (VIII). (4-Хлорфеніл)фенілметиламін Формули (VI) може бути використаний у вигляді вільної основи або у вигляді гідрохлориду. N,N-біс-(2хлоретил)бензиламін Формули (VIII) використовують в 1,0-1,5-кратній, переважно 1,1-кратній молярній кількості, розрахованій на основі кількості сполук Формули (VI). Агенти, що зв'язують кислоту, відповідні для застосування в реакції, включають неорганічні основи, наприклад, карбонати або гідрокарбонати лужного металу або лужноземельного металу, або органічні основи, наприклад, піридин або трибутиламін. Агент, що зв'язує кислоту, використовують в реакції в 3,0-5,0-кратній молярній кількості, розрахованій на основі кількості N,N-біс-(2хлоретил)бензиламіну Формули (VIII). У разі, коли (4-хлорфеніл) фенілметиламін Формули (VI) використовують у формі солі, кількість агента, що зв'язує кислоту, збільшується з кількістю, необхідною для нейтралізації. 92195 12 Реакцію переважно здійснюють у висококиплячому інертному розчиннику, наприклад в метилі або етилцелюлозі, етилгліколі, 1-бутанолі, ізобутанолі, циклогексанолі; або в біполярному апротонному розчиннику, наприклад, в Ν,Νдиметилформаміді, диметилсульфоксиді. Реакція також може бути здійснена у висококиплячому ефірному розчиннику, наприклад, диізобутиловому ефірі, діоксані або в ароматичному розчиннику, наприклад, толуолі. Швидкість реакції може бути збільшена з використанням каталізаторів. Відповідний тип каталізаторів включає галогеніди лужного металу і каталізатори фазового перенесення. Як галогенід лужного металу може бути використаний йодид або бромід натрію або калію, як каталізатор фазового перенесення можуть бути використані галогеніди четвертинного бутиламонію. Реакцію здійснюють при температурі від 80 до 140°С, переважно при температурі від 100 до 110°С. Час реакції залежно від температури реакції приблизно складає від 1 до 8 годин, переважно від 2 до 4 годин. Відповідно до ще одного аспекту даного винаходу запропонований 1-[(4хлорфеніл)фенілметил]]-4-[(2,2,2трихлоретил)оксикарбоніл]піперазин Формули (IV), його рацемічна і оптично активні форми і його солі приєднання кислоти. Ще один аспект даного винаходу відноситься до способу отримання 1-[(4хлорфеніл)фенілметил]]-4-[(2,2,2трихлоретил)оксикарбоніл]піперазину Формули (IV), що включає реакцію 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) з 2,2,2-трихлоретилхлорформіатом Формули (V). Реакція може бути здійснена, починаючи з рацемічної або оптично активної форми, що по суті містить одиничний енантіомер 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III), де одержують рацемічний або оптично активний продукт. У реакції вільна основа 1-[(4хлорфеніл)фенілметил]-4-бензилпіперазину Формули (III) вступає в реакцію переважно з 1,0-1,2 молярними еквівалентами 2,2,2трихлоретилхлорформіату Формули (V). Переважно, на коженмоль сполуки Формули (III) використовують 1,05моль сполуки Формули (V). Не обов'язково під час реакції використовувати агент, що зв'язує кислоту, оскільки продукт Формули (IV) утворює сіль із соляною кислотою, що утворюється в реакції; проте, якщо бажано, може бути використаний агент, що зв'язує кислоту. Сполуки, придатні як агенти, що зв'язують кислоту, можуть бути вибрані з неорганічних основ, наприклад, з карбонату натрію, карбонату калію, або з органічних основ, наприклад піридину, трибутиламіну або триетиламіну. Реакцію здійснюють в інертному розчиннику, переважно ароматичного типу, наприклад, толуолі, бензолі. Також можуть бути використані біполярні апротонні або ефірні розчинники, наприклад, Ν,Ν-диметилформамід, диметилсульфоксид, диі 13 92195 зобутиловий ефір, діетиловий ефір, тетрагідрофуран або діоксан. У реакції 1-[(4-хлорфеніл)фенілметил]-4бензилпіперазину Формули (III) і 2,2,2трихлоретилхлорформіата Формули (V) утворюється побічний продукт 1-бензил-4-(2,2,2трихлоретоксікарбоніл)піперазину Формули (XII) (XII) у реакції ацилування 1-(4-хлорбензгідрильної) групи сполука Формули (IV) в кількості від 5 до 25мас.%. Сіль гідрохлорид сполуки Формули (XII) кристалізується з ароматичного розчинника під час реакції і може бути легко і повністю видалена. Реакцію здійснюють при температурі від -20 до 40°С, переважно при температурі від 15 до 20°С. Час реакції залежно від розчинника і температури звичайно складає від 1 до 4 годин. Відповідно до ще одного аспекту даного винаходу запропонований спосіб отримання 1-[(4хлорфеніл)фенілметил]піперазину Формули (І) і його солі фумарату, що включає видалення трихлоретоксікарбонільної захисної групи у 1-[(4хлорфеніл)фенілметил]]-4-[(2,2,2трихлоретил)оксикарбоніл]піперазину Формули (IV) шляхом відновлення, яке включає обробку вказаної сполуки цинком і кислотою. Цинк в реакції використовують в кількості від 1 до 5 молярних еквівалентів, переважно від 1,5 до 2,5 молярних еквівалентів, розрахованих на основі молярної кількості сполуки Формули (IV). 1-[(4-Хлорфеніл)фенілметил]]-4-[(2,2,2трихлоретил)оксикарбоніл]-піперазин Формули (IV) може бути використаний у вигляді вільної основи або у формі його солі гідрохлориду. Як правило, переважно застосування солі гідрохлориду сполуки Формули (IV). Реакцію здійснюють в розчиннику, вибраному з води, водного розчину соляної кислоти або водного розчину оцтової кислоти, або з органічних розчинників, тобто простих ефірів або ароматичних розчинників, або сумішей вищезгаданих. Температура реакції складає від 0 до 50°С, переважно температура складає від 20 до 25°С. Час реакції складає декілька годин. Під час будь-якого з вищезазначених способів може бути використана рацемічна або оптично активні форми початкової речовини. Отже, як продукт одержують відповідні рацемічну або оптично активні проміжні сполуки. Відповідно до переважного втілення способу оптично активний 1-[(4-хлорфеніл)фенілметил]-4бензилпіперазин Формули (III) перетворюють на оптично активний 1-[(4хлорфеніл)фенілметил]піперазину Формули (І) або його сіль фумарат без виділення проміжної сполуки 1-[(4-хлорфеніл)фенілметил]-4-(2,2,2трихлоретил)піперазину Формули (IV) в такому названому "однореакторному" способі. 14 Додаткові деталі винаходу розкриті в наступних прикладах без обмеження об'єму винаходу вказаними прикладами. Приклад 1 Дигідрохлорид (R)-(+)-1-(4хлорфеніл)фенілметил-4-бензилпіперазину {сполука Формули (III)} До 200мл н-бутанолу при перемішуванні додають 21,8г (0,10моль) (R)-(-)-(4хлорфеніл)фенілметиламіну, 33,6г (0,40моль) гідрокарбонату натрію, 25,6г (0,11моль) гідрохлориду N,N-біс-(2-хлоретил)бензиламіну і 1,0г йодиду натрію. Суміш перемішують при температурі 110°С протягом двох годин, потім охолоджують і перемішують при температурі 0°С протягом ще двох годин і хлорид натрію, що утворюється в реакції, фільтрують. Фільтрат упарюють у вакуумі і залишок розчиняють в триразовому об'ємі ізопропанолу. Цей розчин по краплях додають до суміші 250мл ізопропанолу і 30мл концентрованого водного розчину соляної кислоти. Кристалічний продукт фільтрують при 0°С, промивають і сушать. Вихід: 38,5г (85,5%) не зовсім білих кристалів. Температура плавлення 245-246°С. Елементарний аналіз {розрахований на основі Формули C24H25CIN2.2HCI (449,9)}: Розраховано: С: 64,07 Н: 6,05 СІ: 23,65 N: 6,23 Виміряно: С: 63,85 Н:6,12 СІ: 23,44 N: 6,28 Оптична чистота відповідно до хіральної високоефективної рідинної хроматографії 99,5%. Приклад 2 (R)-(-)-1-(4-Хлорфеніл)фенілметил-4бензилпіперазин {сполука Формули (III)} Слідують способу Приклада 1 з відмінністю, що полягає в тому, що після відфільтровування неорганічних солей, фільтрат концентрують у вакуумі, залишок розчиняють в 250мл етилацетату, етилацетатний розчин промивають водою, сушать і розчинник упарюють. Жовтий маслянистий залишок після упарювання розчиняють в 150мл метанолу, продукт кристалізують при температурі -20°С протягом 24 годин, продукт основу фільтрують, промивають метанолом і сушать. Вихід 38,5г (65,0%) не зовсім білих кристалів. Температура плавлення 76-78°С. Елементарний аналіз {розрахований на основі Формули C24H25CIN2 (376,9)}: Розраховано: С: 76,48 Н: 6,69 СІ: 9,41 N: 7,43 Виміряно: С: 76,12 Н: 6,82 СІ: 9,30 N:7,51 Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,9%. Приклад 3 Дигідрохлорид (S)-(-)-1-(4хлорфеніл)фенілметил-4-бензилпіперазину Слідують способу, описаному в Прикладі 1, з відмінністю, що полягає в тому, що замість R-(-)(4-хлорфеніл)фенілметиламіну, використовують 21,8г (0,1моль) (S)-(+)-(4хлорфеніл)фенілметиламіну, замість розчинника н-бутанолу та ж сама кількість метилцелозольву (2-метоксиетанолу). Вихід: 33,1г (73,7%), не зовсім білі кристали. Температура плавлення: 245-246°С. 15 Елементарний аналіз {розрахований на основі Формули C24H25CIN2.2HCI (449,9)}: Розраховано: С: 64,07 Н: 6,05 СІ: 23,65 N: 6,23 Виміряно: С: 64,04 Н:6,16 СІ: 23,74 N: 6,12 Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,4%. Приклад 4 Дигідрохлорид (R)-(+)-1-(4хлорфеніл)фенілметил-4-бензилпіперазину {сполука Формули (III)} Спосіб Прикладу 1 здійснюють з відмінністю, що полягає в тому, що замість гідрокарбонату натрію використовують 27,4г (0,20моль) карбонату калію і замість н-бутанольного розчинника метилцелюлозу. Вихід 38,5г (85,5%) не зовсім білих кристалів. Температура плавлення: 245-246°С. Елементарний аналіз {розрахований на основі Формули C24H25CIN2.2HCI (449,9)}: Розраховано: С: 64,07 Н: 6,05 СІ: 23,65 N: 6,23 Виміряно: С: 63,72 Н: 6,22 СІ: 23,51 N: 6,32 Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,4%. Приклад 5 Дигідрохлорид (R)-(+)-1-(4хлорфеніл)фенілметил-4-бензилпіперазину {сполука Формули (III)} Спосіб Прикладу 1 здійснюють з відмінністю, що полягає в тому, що замість гідрокарбонату натрію використовують 40,4г (0,40моль) триетиламіну, замість н-бутанолу - рівний об'єм діоксанового розчинника. Вихід: 35,4г (75,6%) не зовсім білих кристалів. Температура плавлення: 245-246°С. Елементарний аналіз {розрахований на основі Формули C24H25CIN2.2HCI (449,9)}: Рассчитано.С: 64,07 Н: 6,05 СІ: 23,65 N: 6,23 Виміряно: С: 63,94 Н:6,19 СІ: 23,85 N: 6,34 Оптична чистота (хіральна високоефективна рідинна хроматографія): 98,9%. Приклад 6 Гідрохлорид 2,2,2-трихлоретилового ефіру (R)-(+)-4-(4-хлорфеніл)фенілметилпіперазин-1карбонової кислоти (1:1) [сполука Формули (IV)] 37,7г (0,1моль) вільної основи (R)-(-)-1-[(4хлорфеніл)фенілметил]-4-бензилпіперазину розчиняють в 300мл толуолу і до цього розчину по краплях додають розчин 23,3г (0,11моль) 2,2,2трихлоретилхлорформіату, одержаного в 50мл толуолу. Каламутну суспензію перемішують при кімнатній температурі протягом двох годин, рН реакційній суміші доводять до рН1,0-1,5 10мас.%ним розчином соляної кислоти, приготованим в етилацетаті, кристалічний побічний продукт (1бензилпіперазин-4-(2,2,2-трихлоретил)карбамат фільтрують, фільтрат промивають водним розчином гідрокарбонату натрію, толуольний шар сушать над карбонатом натрію і після фільтрації фільтрат упарюють. Жовтий маслянистий залишок після упарювання, що має масу приблизно 53,5г, розчиняють в 160мл ізопропилового спирту, і при температурі 40-55°С по краплях протягом 30 хвилин при перемішуванні додають 37мл 15г/100мл розчину соляної кислоти в ізопропанолі (вміст соляної кислоти 92195 16 5,5г, 0,15моль). Після додавання соляної кислоти суспензію охолоджують до температури -5°С протягом однієї години, кристали фільтрують після перемішування протягом двох годин, фільтрують, промивають ізопропанолом і сушать. Вихід 37,1г (74,5%) білих кристалів. Температура плавлення 244-246°С. Елементарний аналіз {розрахований на основі Формули C20H20CI4N2O2.HCI (498,7)} Розраховано: С: 48,17 Н:4,24 СІ: 35,55 N: 5,62 Виміряно:С: 48,05 Н:4,32 СІ: 35,85 N: 5,71 Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,2%. Приклад 7 2,2,2-Трихлоретиловий ефір (R)-(+)-4-(4хлорфеніл)фенілметилпіперазин-1-карбонової кислоти [вільна основа сполуки Формули (IV)] 5,0г (10ммоль) гідрохлориду, одержаного відповідно до Прикладу 6, додають до суміші 50мл води і 50мл етилацетату і рН суміші доводять до рН14 шляхом додавання 10мас.% розчину гідроксиду натрію при перемішуванні. Два шари розділяють, етилацетатний шар сушать над карбонатом калію, фільтрують і розчинник упарюють. Залишок після упарювання розчиняють в 20мл ізопропанолу і продукт кристалізують. Вихід: 3,89г (84,2%) білих кристалів. Температура плавлення: 96-97°С. Елементарний аналіз {розрахований на основі Формули C20H20CI4N2O2 (462,2)}: Розраховано: С: 51,97 Н: 4,36 СІ: 30,68 N: 6,06 Виміряно: С: 51,84 Н:4,52 СІ: 30,85 N: 5,97 Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,8%. Приклад 8 Гідрохлорид 2,2,2-трихлоретилового ефіру (S)(-)-4-(4-хлорфеніл)фенілметилпіперазин-1карбонової кислоти (1:1) [сполука Формули (IV)] Спосіб Прикладу 6 здійснюють з відмінністю, що полягає в тому, що як початкову речовину використовують дигідрохлорид (S)-(-)-1-(4хлорфеніл)фенілметил-4-бензилпіперазину (сполука Прикладу 3). Вихід: 33,1г (66,4%) білих кристалів. Температура плавлення 242-246°С. Елементарний аналіз {розрахований на основі Формули C20H20CI4N2O2HCI (498,7)} Розраховано: С: 48,17 Н:4,24 СІ: 35,55 N: 5,62 Виміряно: С: 48,22 Н: 4,38 СІ: 35,14 N: 5,79 Оптична чистота (хіральна високоефективна рідинна хроматографія): 98,5%. Приклад 9 2,2,2-Трихлоретиловий ефір (R)-(+)-4-(4хлорфеніл)фенілметилпіперазин-1-карбонової кислоти [вільна основа сполуки Формули (IV)] Спосіб відповідно до Прикладу 6 здійснюють з відмінністю, що полягає в тому, що реакцію здійснюють в Ν,Ν-диметилформамідному розчиннику замість толуолу при температурі 15°С, і на початку реакції до реакційної суміші додають 15,1г (0,15моль) триетиламіну. Після реакції реакційну суміш виливають в 300мл суміші лід-вода, продукт екстрагують етилацетатом, органічний шар сушать над сульфатом натрію і розчинник упарюють. 17 Одержаний таким чином маслянистий залишок розчиняють в суміші розчинників 1:1 (об./об.) гексан-діетиловий ефір, продукт кристалізують, фільтрують, сушать. Вихід 28,9г (62,6%) білих кристалів. Температура плавлення 96-97°С. Елементарний аналіз {розрахований на основі Формули C20H20CI4N2O2 (462,2)}: Розраховано: 51,97 Н: 4,36 СІ: 30,68 N: 6,06 Виміряно: С: 51,89 Н:4,42 СІ: 30,85 N: 5,96 Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,0%. Приклад 10 Дигідрохлорид (R)-(-)-1-(4хлорфеніл)фенілметилпіперазину [сполука Формули (І)] У судину завантажують 250мл тетрагідрофурану, 25мл метанолу і 5,0мл (60ммоль) концентрованої соляної кислоти (37мас.%). Суміш охолоджують до температури 15°С і при інтенсивному перемішуванні додають 5,5г (84ммоль) цинку з пульверизатора. Потім при температурі від 5 до 10°С декількома порціями додають 12,5г (25,1ммоль) гідрохлорида 2,2,2-трихлоретилового ефіру (R)-(+)-4-(4хлорфеніл)фенілметилпіперазин-1-карбонової кислоти (сполука Прикладу 6). Суспензію перемішують протягом однієї години при кімнатній температурі. В кінці реакції цинк, що не прореагував, фільтрують, фільтрат змішують з 150мл води і 150мл етилацетату, органічний шар відокремлюють, промивають водним 5мас.%-ним розчином гідрокарбонату натрію, сушать і розчинник упарюють. Залишок розчиняють в 100мл етилацетату і по краплях при перемішуванні додають до 80мл 10 г/100мл розчину соляної кислоти, приготовленого в етилацетаті. Суспензію, що містить кристалічну сіль, яка починає осідати майже відразу після додавання, охолоджують, продукт фільтрують, промивають діетиловим ефіром і сушать. Вихід: 7,7г (85,4%) білих кристалів Температура плавлення 198-202°С. Елементарний аналіз {розрахований на основі Формули C17H19CIN2.2HCI (359,7)}: Розраховано: С: 56,76 Н: 5,88 СІ: 29,57 N: 7,79. Виміряно:С: 56,45 Н: 5,74 СІ: 29,25 N: 7,61. Оптична чистота (хіральна високоефективна рідинна хроматографія): 98,7%. Приклад 11 Фумарат (R)-(-)-1-(4хлорфеніл)фенілметилпіперазину (1:1) [сполука Формули (XI)] 13,0г (0,2моль) цинку з пульверизатора при перемішуванні додають до суміші 300мл толуолу, 30мл (0,52моль) крижаної оцтової кислоти (96мас.%) і 30мл метанолу. Потім трьома рівними порціями протягом 15 хвилин додають 50,0г (0,10моль) гідрохлориду (R)-(+)-4-(4хлорфеніл)фенілметилпіперазин-1-(2,2,2трихлоретилкарбамата) (сполука Прикладу 6). Температура сіруватої суспензії збільшується приблизно до 41-45°С протягом 10 хвилин і відбувається інтенсивне виділення діоксиду вуглецю. 92195 18 Через одну годину суспензію фільтрують, фільтрат змішують з 40мл води і 38,5мл 25мас.% розчину гідроксиду амонію. Шари розділяють, толуоловий шар сушать над карбонатом калію і розчинник упарюють. Одержаний таким чином жовтий маслянистий залишок після упарювання (приблизно 42г), що має вміст 75,5%, розрахований у вигляді вільної основи, розчиняють в 500мл ацетону і додають 12,8г (0,11моль) фумарової кислоти. Продукт, який початково виділяють в маслянистій формі, перемішують протягом трьох годин при температурі 25°С. Кристалічний продукт фільтрують і сушать до постійної маси. Вихід 31,3г (77,8%) не зовсім білих кристалів. Температура плавлення 146-148°С. Елементарний аналіз {розрахований на основі Формули C21H23CIN2O4 (402,9)}: Розраховано: 3: 62,61 Н: 5,75 СІ: 8,80 N: 6,95 Виміряно: С: 62,27 Н: 5,72 СІ: 8,79 N: 6,84 Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,8%. Приклад 12 Фумарат (S)-(+)-1-(4хлорфеніл)фенілметилпіперазину (1:1) [сполука Формули (XI)] Спосіб Прикладу 11 здійснюють з відмінністю, що полягає в тому, що замість використання солі гідрохлорида (R)-(+)-4-(4хлорфеніл)фенілметилпіперазин-1-(2,2,2трихлоретил)карбамата використовують сіль гідрохлорид (S)-(-)-4-(4хлорфеніл)фенілметилпіперазин-1-(2,2,2трихлоретил) карбамата (сполука Прикладу 8). Вихід: 24,2г (60,0%) не зовсім білих кристалів. Температура плавлення 145-148°С. Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,2%. Температура плавлення основи (S)-(+)-1-(4хлорфеніл)фенілметил піперазину 94-96°С (гексан). Приклад 13 Фумарат (R)-(-)-1-(4хлорфеніл)фенілметилпіперазину (1:1) [сполука Формули (XI)] 45,0г (0,10моль) дигідрохлориду (R)-(+)-1-[(4хлорфеніл)фенілметил]-4-бензилпіперазину суспендують в 300мл толуолу, і при інтенсивному перемішуванні додають 50г льоду, 50мл води і 25мл водного розчину гідроксиду амонію. Шари розділяють, верхній толуоловий шар сушать над карбонатом калію при перемішуванні і фільтрації. До фільтрату по краплях додають розчин 23,3г (0,11моль) 2,2,2-трихлоретилхлорформіата, приготовленого в 50мл толуолу. Каламутну суспензію перемішують протягом двох годин при кімнатній температурі, кристалічний побічний продукт фільтрують. Фільтрат змішують з 30мл концентрованої оцтової кислоти (96мас.%), додають 30мл метанолу і при інтенсивному перемішуванні 13,0г (0,2моль) цинку з пульверизатора. Під час реакції відбувається інтенсивне виділення діоксиду вуглецю. Через одну годину суспензію фільтрують, фільтрат змішують з 40мл води і 38,5мл 25мас.% розчину 19 92195 гідроксиду амонію. Два шари розділяють, верхній толуоловий шар сушать над карбонатом калію і розчинник упарюють. Залишкове жовте масло (приблизно 35,2г) розчиняють в 350мл ацетону і при перемішуванні додають 11,6г (0,1моль) фумарової кислоти. Суміш кип'ятять до розчинення. Продукт осідає при охолоджуванні. Суспензію продукту перемішують Комп’ютерна верстка Т. Чепелева 20 протягом трьох годин при кімнатній температурі, кристали фільтрують, промивають діетиловим ефіром і сушать. Вихід 27,9г (65,8%) не зовсім білих кристалів. Температура плавлення 146-148°С. Оптична чистота (хіральна високоефективна рідинна хроматографія): 99,6%. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюOptically active carbamates, process for preparation thereof and use thereof as pharmaceutical intermediates
Автори англійськоюMezei Tibor, Molnar Enikoe, Trinka Peter, Bartha Ferenc, Katona Zoltan, Vereczkeyne Donath Gyoergyi, Nagy Kalman, Pongo Laszlo, Lukacs Gyula, Porcs-Makkay Marta, Evinger Zsuzsanna, Simig Gyula
Назва патенту російськоюОптически активные карбаматы, способ их получения и их применение в качестве фармацевтических промежуточных соединений
Автори російськоюМезей Тибор, Молнар Энико, Тринка Петер, Барта Ференц, Катона Золтан, Верецкейне Донат Дьйорди, Надь Калман, Понго Ласло, Лукач Дьюла, Порч-Маккай Марта, Эвингер Жужанна, Симиг Дьюла
МПК / Мітки
МПК: C07D 295/18, C07D 295/06
Мітки: оптично, застосування, активні, якості, карбамати, фармацевтичних, проміжних, отримання, сполук, спосіб
Код посилання
<a href="https://ua.patents.su/10-92195-optichno-aktivni-karbamati-sposib-kh-otrimannya-i-kh-zastosuvannya-v-yakosti-farmacevtichnikh-promizhnikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Оптично активні карбамати, спосіб їх отримання і їх застосування в якості фармацевтичних проміжних сполук</a>
Попередній патент: Зуборізальний інструмент зі змінними різальними пластинами
Наступний патент: Шпиндель високої піддатливості
Випадковий патент: Сушарка для рук