Спосіб одержання сульфонілпіролів як інгібіторів hdac
Формула / Реферат
1. Спосіб одержання сполуки формули І:
 , Формула І
, Формула І
в якій
R1 означає водень, 1-4С-алкіл, галоген або 1-4С-алкоксигрупу,
R2 означає водень або 1-4С-алкіл,
R3 означає водень або 1-4С-алкіл,
R4 означає водень, 1-4С-алкіл, галоген або 1-4С-алкоксигрупу,
R5 означає водень, 1-4С-алкіл, галоген або 1-4С-алкоксигрупу,
R6 означає -Т1-Q1, де
Т1 означає зв'язок,
Q1 означає Ar1, Aa1, Hh1 або Ah1, де
Аr1 означає феніл, або R61- і/або R62-заміщений феніл, де
R61 означає 1-4С-алкіл або -T2-N(R611)R612, де
або
Т2 означає зв'язок, і
R611 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл або феніл-1-4С-алкіл,
R612 означає 1-4С-алкіл або 1-4С-алкоксі-2-4С-алкіл, або
R611 і R612 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het1, де
Het1 означає морфолін, тіоморфолін, S-оксотіоморфолін, S,S-діоксотіоморфолін, піперидин або піролідин,
або
Т2 означає 1-4С-алкілен або 2-4С-алкілен, перерваний киснем, і
R611 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл або феніл-1-4С-алкіл,
R612 означає 1-4С-алкіл або 1-4С-алкоксі-2-4С-алкіл, або
R611 і R612 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het1, де
Het1 означає морфолін, тіоморфолін, S-оксотіоморфолін, S,S-діоксотіоморфолін, піперидин, піролідин, імідазол, пірол або піразол,
R62 означає 1-4С-алкіл, 1-4С-алкоксигрупу, галоген, ціаногрупу, 1-4С-алкоксі-1-4С-алкіл, 1-4С-алкілкарбоніламіногрупу або 1-4С-алкілсульфоніламіногрупу,
Аа1 означає бісарильний радикал, що складається з двох арильних груп, які незалежно вибрані з групи, що включає феніл і нафтил,
і
які зв'язані разом за допомогою простого зв'язку,
Нh1 означає бісгетероарильний радикал, що складається з двох гетероарильних груп, які незалежно вибрані з групи, що включає моноциклічні 5- або 6-членні гетероарильні радикали, що містять один або два гетероатоми, кожний з яких вибраний з групи, що включає азот, кисень і сірку, і які зв'язані разом за допомогою простого зв'язку,
Ah1 означає гетероарил-арильний радикал або арил-гетероарильний радикал, утворений гетероарильною групою, вибраною з групи, що включає моноциклічні 5- або 6-членні гетероарильні радикали, що містять один або два гетероатоми, кожний з яких вибраний з групи, що включає азот, кисень і сірку, і арильною групою, вибраною з групи, що включає феніл і нафтил, тим самим згадані гетероарильні і арильні групи зв'язані разом за допомогою простого зв'язку,
де Aa1, Hh1 і Ah1 можуть бути необов'язково заміщені R63 і/або R64, де
R63 означає 1-4С-алкіл, феніл-1-4С-алкіл, 1-4С-алкоксигрупу, трифторметил, ціаногрупу, галоген, повністю або предомінантно фторзаміщений, 1-4С-алкоксигрупу, 1-4С-алкоксі-1-4С-алкіл, 1-4С-алкілсульфоніламіногрупу, толілсульфоніламіногрупу, фенілсульфоніламіногрупу, 1-4С-алкілкарбоніламіногрупу, карбамоїл, моно- або ді-1-4С-алкіламінокарбоніл, моно- або ді-1-4С-алкіламіносульфоніл або -T3-N(R631)R632, де
Т3 означає зв'язок, 1-4С-алкілен або 2-4С-алкілен, перерваний киснем, і
R631 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл або феніл-1-4С-алкіл,
R632 означає 1-4С-алкіл або 1-4С-алкоксі-2-4С-алкіл, або
R631 і R632 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het2, де
Het2 означає морфолін, тіоморфолін, S-оксотіоморфолін, S,S-діоксотіоморфолін, піперидин, піролідин, імідазол, пірол або піразол, і
R64 означає 1-4С-алкіл, 1-4С-алкоксигрупу або галоген,
в якому здійснюють стадію взаємодії хлорангідриду акрилової кислоти сполуки формули ІI':
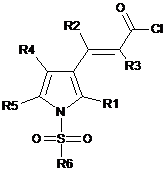 ,Формула ІI'
,Формула ІI'
де R1, R2, R3, R4, R5 і R6 мають значення, як визначено вище, з водним гідроксиламіном
і необов'язково перетворення утвореної сполуки в її сіль приєднання кислоти.
2. Спосіб за п. 1, в якому додатково здійснюють стадії
і) забезпечення сполуки формули II:
 , Формула II
, Формула II
де R1, R2, R3, R4, R5 і R6 мають значення, як визначено в п. 1, і
іі) перетворення сполуки формули II в її хлороангідрид формули ІI'.
3. Спосіб за п. 2, в якому стадію іі) проводять з тіонілхлоридом або оксалілхлоридом.
4. Спосіб за п. 2, в якому стадію і) проводять шляхом синтезу сполуки формули II відповідно до способу, в якому здійснюють наступні стадії:
подовження вуглецевого ланцюга сполуки формули V:
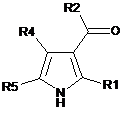 , Формула V
, Формула V
де R1, R2, R4 і R5 мають значення, як визначено в п. 1,
з одержанням сполуки формули IV:
 , Формула IV
, Формула IV
де R1, R2, R3, R4 і R5 мають значення, як визначено в п. 1, і PG1 означає придатну тимчасову захисну групу для карбоксильної групи,
взаємодію сполуки формули IV зі сполукою формули R6-SO2-X, де R6 є таким, як визначено в п. 1, і X означає придатну відхідну групу, що дає відповідну сполуку формули III:
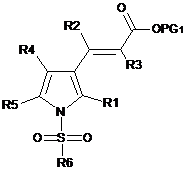 , Формула III
, Формула III
де R1, R2, R3, R4, R5 і R6 мають значення, як визначено в п. 1, і PG1 означає придатну тимчасову захисну групу для карбоксильної групи,
і видалення захисної групи PG1, що дає сполуку формули II.
5. Спосіб за будь-яким з попередніх пунктів, у якому сполуку формули І одержують у вигляді вільної основи.
6. Спосіб за будь-яким з пп. 1-4, у якому сполуку формули І одержують безпосередньо у вигляді її гідрохлориду шляхом реакції сполуки формули II' з водним гідроксиламіном.
7. Спосіб за будь-яким з пп. 1-4 для одержання інших солей сполук формули І, відмінних від гідрохлориду, в якому здійснюють
взаємодію вільної основи сполуки формули І з придатною кислотою або похідною кислоти з утворенням відповідної солі приєднання кислоти, або
перетворення солі приєднання кислоти сполуки формули І в іншу сіль приєднання кислоти.
8. Спосіб за п. 7, де сіллю приєднання кислоти сполук формули І, відмінною від гідрохлориду, є метансульфонат.
9. Спосіб одержання фармацевтичної композиції, що містить сполуку формули І або її фармацевтично прийнятну сіль приєднання кислоти, в якому здійснюють синтез сполуки формули І або її солі приєднання кислоти за будь-яким з попередніх пунктів і формування композиції одержаної сполуки з загальноприйнятими фармацевтичними допоміжними речовинами.
10. Спосіб за п. 9, у якому фармацевтична композиція призначена для лікування, попередження або покращення доброякісної і/або злоякісної неоплазії, такої як, наприклад, рак, гіперпроліферативні захворювання доброякісної або злоякісної поведінки і/або захворювання, чутливі до індукції апоптозу.
Текст
Реферат: Спосіб одержання сполуки формули (І), у якій R1, R2, R3, R4, R5 і R6 мають значення, як визначено в описі винаходу, що включає стадію взаємодії хлорангідриду акрилової кислоти сполуки формули (ІI'), у якій R1, R2, R3, R4, R5 і R6 мають значення, як визначено в описі винаходу, з водним гідроксиламіном і необов'язково перетворення утвореної сполуки в її сіль приєднання кислоти. O R2 O OH R2 NH R4 Cl R4 R3 R5 R1 N O S R6 R3 R5 O O ,Формула І R1 N S R6 O Формула ІІ'. UA 102091 C2 (12) UA 102091 C2 UA 102091 C2 5 10 15 20 25 30 35 40 45 50 Галузь застосування винаходу Винахід належить до нового способу одержання похідних N-сульфонілпіролу і їх солей, які застосовуються в фармацевтичній промисловості для одержання фармацевтичних композицій. Передумови створення винаходу Транскрипційна регуляція в клітинах є комплексним біологічним процесом. Одним головним принципом є регуляція посттрансляційної модифікації гістонових білків, а саме гістонових білків Н2А/В, Н3 і Н4, які формують комплекс октамеру корового гістону. Ці комплексні N-кінцеві модифікації біля лізинових залишків ацетилуванням або метилюванням і біля серинових залишків фосфорилюванням утворюють частину так званого "гістонового коду" (Strahl & Ellis, Nature 403, 41-45, 2000). В простій моделі, ацетилування позитивно заряджених лізинових залишків зменшує аффінність до негативно зарядженої ДНК, яка зараз стала доступною для вводу факторів транскрипції. Ацетилування і дезацетилування гістону каталізується гістонацетилтрансферазами (HAT) і гістоновими дезацетилазами (HDAC). HDAC з'єднані з транскрипційними комплексами репрессора, які переключають хроматин на транскрипційно неактивну, закриту структуру (Marks et al. Nature Cancer Rev 1, 194-202, 2001). Протилежні захвати справедливі для HAT, які з'єднані з транскрипційними комплексами активатора. Уже описано три класи HDAC, а саме І клас (HDAC 1-3, 8) з Mr=42-55 кДа переважно розміщений в ядрі і чутливий до інгібування трихостатином A (TSA), II клас (HDAC 4-7, 9, 10) з Mr=120-130кДа і TSA чутливістю і III клас (Sir2 + гомологи) які досить відрізняються своєю NAD залежністю і TSA нечутливістю. Встановлено, ракова хіміотерапія базується на концепції, що переважно вбиваються ракові клітини з неконтрольованою проліферацією і високим вмістом клітин в мітозі. Звичайні ракові хімікотерапевтичні ліки врешті убивають ракові клітини після індукції програмованої смерті клітини ("апоптоз") націленням основних клітинних процесів і молекул, а саме РНК/ДНК (алкілуючі і карбамілуючі агенти, аналоги платину і інгібітори топоізомерази), метаболізму (ліки цього класу називаються антиметаболітами) так само як і апарату мітотичного веретена (стабілізуючі і дестабілізуючі інгібітори тубуліну). Інгібітори гістонових дезацетилаз (HDIs) утворюють новий клас протиракових ліків з диференціюванням і активністю індукції апоптозу. Націленням гістонових дезацетилаз, HDIs здійснюють ацетилування гістону (білка) і структури хроматину, яка індукує комплексне транскрипційне репрограмування, втілене реактивацією генів-супресорів пухлини і репресією онкогенів. Біля здійснення ацетилування N-кінцевих лізинових залишків в коревих гістонових білках, знаходяться негістонові мішені важливі для біології ракової клітини подібні до білка теплового шоку 90 (Hsp90) або білка-супресора пухлини р53. Медичне використання HDIs не може бути обмежене тільки лікуванням раку, оскільки була показана ефективність в моделях для запальних захворювань, ревматоїдного артриту і нейродеградації. Бензоїл або ацетил заміщені піролілпропенаміди описані в загальнодоступній літературі як HDAC-інгібітори, де з'єднуються ацил-групи в положенні 2 або З пірольного каркасу (Mai et.al, Journal Med.Chem. 2004, Vol. 47, No. 5, 1098-1109; або Ragno et al., Journal Med. Chem. 2004, Vol. 47, No. 5, 1351-1359). Додатково піроліл заміщені похідні гідроксамової кислоти описані в US4960787 як інгібітори ліпоксигенази або в US6432999 як інгібітори циклооксигенази або в ЕР570594 як інгібітори клітинного росту. Звертаючись до потреби, що залишається в даній галузі техніки для нових, з хорошою переносимістю і більш ефективних інгібіторів HDAC, міжнародні заявки WO 2005/087724, WO 2007/039403 і WO 2007/039404 описують N-гідроксіакриламідні похідні як HDAC інгібітори. WO 2005/087724, WO 2007/039403 і WO 2007/039404 також розкривають спосіб одержання згаданих N-гідроксі-акриламідних похідних. Цей спосіб одержання включає на останній стадії синтез N-гідроксі-акриламідних похідних, що починається з відповідних акрилових кислот. Під час згаданого синтезу, відповідна похідна акрилової кислоти зв'язується з О-(тетрагідро-2Н-піран-2-іл)гідроксиламіном шляхом реакції з амідним зшиваючим реагентом (EDCxHCI і HOBtxH2O). Після видалення захисної групи шляхом перемішування з кислотоіонообмінною смолою, одержують відповідну N-гідрокси-акриламідну похідну: 1 UA 102091 C2 5 10 15 20 25 30 35 40 45 50 Застосування О-(тетрагідро-2Н-піран-2-іл)гідроксиламіну і EDCxHCI, тим не менш, є невигідним не тільки через цінові аспекти, але також тому що ці реагенти є недоступними у великих кількостях. Крім того, О-(тетрагідро-2Н-піран-2-іл)гідроксиламін є вибухонебезпечною речовиною і необхідна додаткова стадія очистки видалення побічних продуктів, наприклад колонкова хроматографія. Завданням винаходу, виходячи з цього, є забезпечити комерційно привабливий, менш дорогий, але щонайменше настільки ж ефективний спосіб одержання N-гідроксі-акриламідних похідних сполук N-сульфонілпіролу, які мають HDAC інгібуючу активність, який дозволяє одержати продукт реакції за меншу кількість стадій і з високим виходом і чистотою. Опис винаходу Відповідно до першого об'єкту дійсного винаходу зараз був розроблений новий спосіб одержання N-гідроксі-акриламідних похідних сполук N-сульфонілпіролу, що мають HDAC інгібуючу активність, які описані більш детально нижче, що включає стадію перетворення інтермедіату хлорангідриду акрилової кислоти у відповідну N-гідроксиакриламідну похідну. Неочікувано, ця реакція може бути проведена з водним гідроксиламіном без утворення побічних продуктів акрилової кислоти і полягає в утворенні вільної основи відповідного N-гідроксиакриламід N-сульфонілпіролу або його відповідного гідрохлориду. Згадане відкриття є особливо неочікуваним, оскільки хлориди кислот як вищезазначені інтермедіати є в основному дуже схильними до гідролізу при контакті з водою. В цьому th відношенні, добре відомий підручник Jerry March, Advanced Organic Chemistry [4 edition, 1992, p.377] зазначає наступне: Ацилгалогеніди є настільки реащійноздатними, що легко проходить гідроліз. Фактично, найпростіші ацилгалогеніди мають зберігатися в безводних умовах для запобігання їх реакції з водою повітря. Отже, вода звичайно є достатньо сильним нуклеофілом для реакції, хоча в складних випадках може бути потрібний гідроксидний іон. Ще більш неочікувано, застосування захищеного гідроксиламіну як в способі попереднього рівня техніки призводить до утворення значних кількостей побічних продуктів акрилової кислоти. Таким чином, наново розроблений спосіб одержання N-гідроксі-акриламідних похідних сполук N-сульфонілпіролу, що мають HDAC інгібуючу активність, згідно дійсного винаходу забезпечує переваги, які полягають в тому, що він є набагато більш економічно вигідним ніж спосіб відомий з попереднього рівня техніки і робить можливим безпосереднє утворення Nгідрокси-акриламідів без потреби додаткових стадій зняття захисту і очищення. Дійсний винахід таким чином належить в першому основному об'єкті до нового способу одержання сполуки формули І, яка є N-гідрокси-акриламідною похідною сполуки Nсульфонілпіролу і має HDAC інгібуючу активність: у якій R1 означає водень, 1-4С-алкіл, галоген, або 1-4С-алкоксигрупу, R2 означає водень або 1-4С-алкіл, R3 означає водень або 1-4С-алкіл, R4 означає водень, 1-4С-алкіл, галоген, або 1-4С-алкоксигрупу, R5 означає водень, 1-4С-алкіл, галоген, або 1-4С-алкоксигрупу, R6 означає -Т1-Q1, де Т1 означає зв'язок, Q1 означає Ar1, Aa1, Hh1, або Ah1, де Ar1 означає феніл, або R61- і/або R62-заміщений феніл, де R61 означає 1-4С-алкіл, або -T2-N(R611) R612, де або T2 означає зв'язок, і R611 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл, або феніл-1-4С-алкіл, 2 UA 102091 C2 5 10 15 20 25 30 35 40 45 R612 1-4С-алкіл, або 1-4С-алкоксі-2-4С-алкіл, або R611 і R612 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het1, де Het1 означає морфолін, тіоморфолін, S-оксо-тіоморфолін, S, S-діоксо-тіоморфолін, піперидин, або піролідин, або Т2 означає 1-4С-алкілен, або 2-4С-алкілен перерваний киснем, і R611 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл, або феніл- 1-4С-алкіл, R612 означає 1-4С-алкіл, або 1-4С-алкоксі-2-4С-алкіл, або R611 і R612 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het1, де Het1 означає морфолін, тіоморфолін, S-оксо-тіоморфолін, 8,8-діоксо-тіоморфолін, піперидин, піролідин, імідазол, пірол або піразол, R62 означає 1-4С-алкіл, 1-4С-алкоксигрупу, галоген, ціаногрупу, 1-4С-алкоксі-1-4С-алкіл, 14С-алкілкарбоніламіногрупу, або 1-4С-алкілсульфоніламіногрупу, Аа1 означає бісарильний радикал, що складається з двох арильних груп, які незалежно вибрані з групи, що включає феніл і нафтіл, і які зв'язані разом за допомогою простого зв'язку, Hh1 означає бісгетероарильний радикал, що складається з двох гетероарильних груп, які незалежно вибрані з групи, що включає моноциклічні 5- або 6-членні гетероарильні радикали, що містять один або два гетероатоми, кожний з яких вибраний з групи, що включає азот, кисень і сірку, і які зв'язані разом за допомогою простого зв'язку, Ah1 означає гетероарил-арильний радикал або арил-гетероарильний радикал, утворений гетероарильною групою, вибраною з групи, що включає моноциклічні 5- або 6-членні гетероарильні радикали, що містять один або два гетероатоми, кожний з яких вибраний з групи, що включає азот, кисень і сірку, і арильної групи, вибраної з групи, що включає феніл і нафтіл, тим самим згадані гетероарильні і арильні групи зв'язані разом за допомогою простого зв'язку, де Aa1, Hh1 i Ah1 можуть бути необов'язково заміщені R63 і/або R64, де R63 означає 1-4С-алкіл, феніл-1-4С-алкіл, 1-4С-алкоксигрупу, трифторметил, ціаногрупу, галоген, повністю або предомінантно фтор-заміщену 1-4С-алкоксигрупу, 1-4С-алкоксі-1-4Салкіл, 1-4С-алкілсульфоніламіногрупу, толілсульфоніламіногрупу, фенілсульфоніламіногрупу, 14С-алкілкарбоніламіногрупу, карбамоїл, моно- або ді-1-4С-алкіламінокарбоніл, моно- або ді-14С-алкіламіносульфоніл, або -T3-N(R631)R632, де Т3 означає зв'язок, 1-4С-алкілен, або 2-4С-алкілен перерваний киснем, і R631 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл, або феніл-1-4С-алкіл, R632 1-4С-алкіл, або 1-4С-алкоксі-2-4С-алкіл, або R631 і R632 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het2, де Het2 означає морфолін, тіоморфолін, S-оксо-тіоморфолін, БЗ-діоксо-тіоморфолін, піперидин, піролідин, імідазол, пірол або піразол, ї R64 означає 1-4С-алкіл, 1-4С-алкоксигрупу або галоген, що включає стадію взаємодії хлорангидриду акрилової кислоти сполуки формули Іl’: де R1, R2, R3, R4, R5 і R6 мають значення як визначено вище, з водним гідроксиламіном і необов'язково перетворення утвореної сполуки в її сіль приєднання кислоти. 3 UA 102091 C2 В додатковому об'єкті дійсний винахід належить до нового способу одержання сполуки формули І відповідно до першого основного об'єкту, що додатково включає стадії і) забезпечення сполуки формули II: 5 10 де R1, R2, R3, R4, R5 і R6 і мають значення як визначено вище, і іі) перетворення сполуки формули II в її хлороангідрид формули Іl’. В третьому об'єкті дійсний винахід належить до способу, в якому вищезазначена стадія іі) проводиться з хлористим тіонілом або хлористим оксалілом. В четвертому об'єкті дійсний винахід належить до способу, в якому вищезазначена стадія і) проводиться шляхом синтезу сполуки формули II відповідно до способу що містить наступні стадії: подовження вуглецевого ланцюга сполуки формули V: де R1, R2, R4 і R5 мають значення як визначено вище, з одержанням сполуки формули IV: 15 де R1, R2, R3, R4 і R5 мають значення як визначено вище і PG1 означає підходящу тимчасову захисну групу для карбоксильної групи, взаємодію сполуки формули IV зі сполукою формули R6-SO2-X, де R6 означають як визначено вище і X означає підходящу відходящу групу, що дає відповідну сполуку формули III: 20 4 UA 102091 C2 5 10 15 20 25 30 35 40 45 50 де R1, R2, R3, R4, R5 і R6 мають значення як визначено вище і PG1 означає підходящу тимчасову захисну групу для карбоксильної групи, і видалення захисної групи PG1 що дає сполуку формули II. В п'ятому об'єкті дійсний винахід належить до способу відповідно до будь-якого з попередніх об'єктів, де сполуку формули І одержують у вигляді вільної основи. В шостому об'єкті дійсний винахід належить до способу відповідно до будь-якого з об'єктів 14, де сполука формули І отримується безпоспредньо у вигляді її гідрохлоридної солі шляхом реакції сполуки формули Іl’ з водним гідроксиламіном. В сьомому об'єкті дійсний винахід належить до способу відповідно до будь-якого з об'єктів 15 для одержання інших солей сполук формули І, відмінних від гідрохлориду, що включає взаємодію вільної основи сполуки формули І з підходящою кислотою або похідної кислоти з утворенням відповідної солі приєднання кислоти, або перетворення солі приєднання кислоти сполуки формули І в іншу сіль приєднання кислоти. У восьмому об'єкті дійсний винахід належить до способу відповідно до сьомого об'єкту, де сіль приєднання кислоти сполук формули І відмінна від гідрохлориду являє собою метансульфонат. В дев'ятому об'єкті дійсний винахід належить до способу одержання фармацевтичної композиції, що включає сполуку формули І або її фармацевтично прийнятну сіль приєднання кислоти, що включає синтез сполуки формули І або її солі приєднання кислоти відповідно до будь-якого з попередніх об'єктів і формування композиції утвореної сполуки з загальноприйнятими фармацевтичними допоміжними речовинами. В десятому об'єкті дійсний винахід належить до способу відповідно до дев'ятого об'єкту, де фармацевтична композиція призначена для лікування, попередження або покращення доброякісної і/або злоякісної неоплазії, такої як наприклад рак, гіперпроліферативні захворювання доброякісної або злоякісної поведінки і/або захворювання чутливі до індукції апоптозу. Особливо переважним є одержання метансульфонату сполук формули І відповідно до способу як описано в будь-якому з вищенаведених об'єктів, особливо (Е)-3-[1-(4диметиламінометил-бензолсульфоніл)-1H-пірол-3-іл]-N-гідроксиакрил-аміду, (Е)-N-Гідрокси-3-[1-(5-піридин-2-іл-тіофен-2-сульфоніл)-1Н-пірол-3-іл]-акриламіду і (Е)-N-Гідрокси-3-{1-[4-(1-метил-1Н-піразол-4-іл)-бензолсульфоніл]-1Н-пірол-3-іл}-акриламіду. Переважно, хлоруючий агент в способі відповідно до вищенаведених об'єктів 1-8 використовується у 2- - 3-разовому молярному надлишку відносно сполуки формули II. Температура реакції хлорування переважно становить в інтервалі між 40 і 60 °C. Ще більш переважно, водний гідроксиламін використовується у 10- - 30-разовому молярному надлишку відносно сполуки формули Іl’. Температура стадії утворення аміду переважно становить в інтервалі між 10 і 30 °C, найбільш переважно при кімнатній температурі. В іншому переважному варіанті здійснення, реакційну суміш перемішують протягом 20-90 хв. після завершення додавання сполуки формули Іl’ у водний розчин, що містить гідроксиламін. В найбільш переважному варіанті здійснення винаходу, метансульфонат будь-якої з перерахованих вище трьох переважних сполук готують відповідно до способу, використовуючи переважні умови реакції як описано в попередніх п'яти параграфах. Найкращий варіант здійснення винаходу Сполуки формули І можуть бути одержані відповідно до наступної схеми реакцією гідрохлориду відповідної акрилової кислоти сполуки формули II з хлоруючим агентом і додаванням одержаного хлорангидриду формули Іl’ до розчину водного гідроксиламіну і, переважно, THF; Таким чином, сполуки формули І осаджуються або безпосередньо як вільна основа або як гідрохлорид, обидві з яких можуть бути легко відділені фільтрацією з високою чистотою. За бажанням, вільна основа може бути перетворена у її гідрохлорид взаємодією з хлороводнем. 5 UA 102091 C2 Подібні процедури існують, щоб приготувати інші солі приєднання кислоти і добре відомі спеціалісту в даній галузі техніки. Переважні приклади хлоруючого агента включають, але не обмежуються, SOCl 2 i(COCl)2. Сполуки формули II можуть бути одержані відповідно до наступної схеми реакції: 5 10 15 20 25 30 35 40 45 В схемі реакції, вуглецевий ланцюг сполуки формули V, де R1, R2, R4 і R5 мають значення як визначено вище, подовжений, наприклад, реакцією конденсації (з похідною малонової кислоти) або рацією Віттіга або Жуліа або, особливо у випадку коли R2 є воднем, реакцією Горнера-Водстворта-Еммонса (з діалкіловим ефіром -{алкоксикарбоніл)-фосфонієвої кислоти), з одержанням сполуки формули IV, де R1, R2, R3, R4 і R5 мають значення як визначено вище і PG1 означає підходящу тимчасову захисну групу для карбоксильної групи, наприклад третбутил або одну з відомих в даній галузі техніки захисних груп згаданих в "Protective Groups in rd Organic Synthesis" Т. Greene і P. Wuts (John Wiley & Sons, Inc. 1999, 3 Ed.) або в "Protecting Groups " (Thieme Foundations Organic Chemistry Series N Group" by P. Kocienski (Thieme Medical Publishers, 2000). Сполуки формули V відомі, або можуть бути одержані за відомими в даній галузі способами, або можуть бути одержані з сполук формули VI, для випадку, коли R2 означає водень. Сполуки формули VI відомі або є доступними відомими шляхами. Сполука формули IV може реагувати зі сполукою формули R6-SO2-X, де R6 має значення як визначено вище і X означає підходящу відходящу групу, таку як наприклад хлор, що дає відповідну сполуку формули III, де R1, R2, R3, R4, R5, R6 і PG1 мають значення як визначено вище. Сполуки формули R6-SO2-X відомі або можуть бути одержані відомим шляхом. На наступній стадії реакції, захисна група PG1 сполуки формули III може бути видалена відомим в даній галузі способом з виходом сполуки формули II. Сполука формули Іl’ може бути одержана реакцією сполуки формули II з хлористим тіонілом або хлористим оксалілом. Реакція необов'язково може бути проведена як in-situ спосіб без відділення сполуки формули Іl’. Тобто, сполука формули Іl’ може без відділення реагувати з водним розчином гідроксиламіну, щоб утворити сполуку формули І. Дійсний винахід призначений, щоб включати обидва варіанта, тобто in-situ утворення сполуки формули І зі сполуки формули II шляхом взаємодії невідділеного інтермедіату формули Іl’ з водним розчином гідроксиламіну і взаємодії відділеного інтермедіату формули Іl’ з водним розчином гідроксил аміну для утворення сполуку формули І. In-situ спосіб є переважним. Необов'язково, сполука формули І у вигляді вільної основи може бути перетворена в одну зі своїх солей приєднання кислоти. Крім того, гідрохлорид сполуки формули І або будь-яка її інша сіль приєднання кислоти може бути перетворена в її форму вільної основи. Солі можуть бути одержані розчиненням сполук формули І у вигляді вільної основи в підходящому розчиннику (наприклад кетон, такий як ацетон, метилетилкетон або метилізобутилкетон, ефір, такий як діетиловий ефір, тетрагідрофуран або діоксан, хлорований вуглеводень, такий як дихлорметан або хлороформ, або низькомолекулярний аліфатичний спирт такий як етанол або ізопропанол), який містить необхідну кислоту або основу, або в який додають необхідну кислоту або основу. Потім солі можуть бути одержані фільтруванням, переосадженням, осадженням з осаджувачем для доданої солі (наприклад ізопропанол, ацетон або ацетонітріл) або випаровуванням розчинника. Сполуки формули І у вигляді вільної основи можуть бути одержані з її гідрохлоридної солі підлуговуванням і потім можуть бути додатково перетворені в інші солі як описано вище. 6 UA 102091 C2 5 10 15 20 25 30 35 Таким чином, можуть бути одержані фармакологічно прийнятні солі. Наступні приклади служать, щоб додатково проілюструвати винахід без його обмежень. Приклади Гідрохлорид (Е)-3-[1-(4-диметиламінометил-бензолсульфоніл)-1Н-пірол-3-іл]-N-гідроксиакриламіду В реакційну ємність поміщали гідрохлорид (Е)-3-[1-(4-диметиламінометилбензолсульфоніл)-1Н-пірол-3-іл]-акрилової кислоти (20.0 кг, 53.92 моль), hyflow (10.0 кг) і 1метил-2-піролідон (130.0 L). Суспензію нагрівали до 60-68 °C, перемішували протягом 15-45 хв і фільтрували. Залишок на фільтрі промивали 1-метил-2-піролідоном (10.0 л) і фільтрат переносили в реакційну ємність. Розчин нагрівали до 40-50 °C і додавали тіонілхлорид (19.0 кг, 159.94 моль) протягом періоду 1-1.5 год. Після перемішування протягом 20-45 хв, розчин хлоридної кислоти охолоджували до 18-28 °C. В другу реакційну ємність поміщали водний розчин гідроксиламіну (50 %, 42.8 кг, 647 моль) і THF (40.0 L). Вище одержаний розчин гідрохлориду (Е)-3-[1-(4-диметиламінометилбензолсульфоніл)-1Н-пірол-3-іл] -акрилоїлхлориду додавали при 18-30 °C протягом періоду 2-4 год. Після перемішування протягом 20-40 хв, додавали ацетон (47.6 л, 647 ммоль) при 17-25 °C в межах 45-90 хв. Реакційну суміш перемішували протягом 30 хв і додавали ацетонітрил (570.0 л) протягом періоду 1-2 год. Суспензію перемішували при 17-25 °C протягом принаймні 4 год., охолоджували до 5-13 °C і перемішували протягом 1-2 год. Тверду фазу центрифугували і використовували без додаткової сушки в наступній стадії утворення вільної основи. (Е)-N-Гідрокси-3-[1-(5-піридин-2-іл-тіофен-2-сульфоніл)-1Н-пірол-3-іл]-акриламід Гідрохлорид (Е)-3-[1-(5-піридин-2-іл-тіофен-2-сульфоніл)-1Н-пірол-3-іл] -акрилової кислоти (30.0 г, 75.6 ммоль) було суспедовано в ацетонітрилі (540 мл) і додавали тіонілхлорид (12.1 мл, 166.3 ммоль) за період 10 хв. Суспензію нагрівали до 60 °C і перемішували протягом 2 год. Вище одержаний розчин гідрохлориду (Е)-3-[1-(5-піридин-2-іл-тіофен-2-сульфоніл)-1Н-пірол3-іл]-акрилоїлхлориду додавали до водного розчину гідроксиламіну (50 %, 150 г, 2.27 моль) при 20-25 °C за період 45 хв. Після перемішування протягом 65 хв, додавали воду (300 мл) і охолоджували до 0 °C. Суспензію фільтрували і залишок на фільтрі промивали водою (150 мл). Названу сполуку було отримано як тверду речовину бежевого кольору (17.3 г). (Е)-N-Гідрокси-3-{1-[4-(1-метил-1H-піразол-4-іл)-бензолсульфоніл]-1Н-пірол-3-іл}-акриламід Гідрохлорид (Е)-3-{1-[4-(1-метил-1Н-піразол-4-іл)-бензолсульфоніл]-1Н-пірол-3-іл}-акрилової кислоти (70.0 г, 177.7 ммоль) було суспедовано в ацетонітрилі (525 мл) і додавали оксалілхлорид (31.5 мл, 355.4 ммоль) в межах 5 хв. Суспензію нагрівали до 55 °C і перемішували протягом 1 год. 7 UA 102091 C2 5 10 15 20 25 30 35 40 45 50 55 Вище одержаний розчин гідрохлориду (Е)-3-{1-[4-(1-метил-1H-піразол-4-іл)бензолсульфоніл]-1Н-пірол-3-іл}-акрилоїлхлориду додавали до водного розчину гідроксиламіну (50 %, 105 мл, 1.78 моль) при 10-20 °C за період 20 хв. Після перемішування протягом 90 хв, суспензію фільтрували і сушили. Сирий продукт (48.4 г) було суспедовано в суміші ізопропанолу (480 мл) і води (480 мл) і перемішували з оберненим холодильником протягом 1 год. Після охолодження при кімнатній температурі, суспензію фільтрували і сушили. Названу сполуку було отримано як тверду речовину бежевого кольору (28.1 г). Комерційна цінність Сполуки які приготовані відповідно до цього винаходу мають корисні фармакологічні властивості інгібуванням активності і функцій гістонової дезацетилази. Вони викликають гіперацетилуваня конкретних субстратних білків і як функціональний наслідок наприклад індукцію або репресію генної експресії, індукцію руйнування білка, блокування клітинного циклу, індукцію диференціації і/або індукцію апоптозу. Термін "індукція апоптозу" і аналогічні терміни використовуються, щоб ідентифікувати сполуку, яка здійснює програмовану смерть клітини в клітинах, які контактують з цією сполукою. Апоптоз визначається комплексом біохімічних реакцій з клітиною яка контактує, таких як активація специфічної цистеїнової протеїнази ("каспаза") і фрагментація хроматину. Індукція апоптозу в клітинах які контактують зі сполукою не може обов'язково бути зв'язана з інгібуванням клітинної проліферації або клітинної диференціації. Переважно, інгібування проліферації, індукція диференціації і/або індукція апоптозу є особливими для клітин з абераційним клітинним ростом. "Індукція диференціації" визначається як процес клітинного перепрограмування, який призводить до зворотнього або незворотнього блокування клітинного циклу в GO і реекспресії підмножини генів типових для певного спеціалізованого нормального клітинного типу або тканини (наприклад реекспресія білків молочного жиру і жиру в клітинах карциноми ссавців). Винахід додатково відноситься до процесу приготування фармацевтичної композиції для інгібування, лікування, покращення або попередження клітинної неоплазії. "Неоплазія" характеризується клітинами, які показують аномальну проліферацію клітини і/або виживання і/або блок в диференціації. Термін неоплазія включає "доброякісну неоплазію" яка описується гіперпроліферацією клітин, нездатністю формування агресивної, метастазуючої пухлини in vivo, і, на відміну від цього, "злоякісна неоплазія", яка описується клітинами з множиною клітинних і біохімічних відхилень, здатних до формування системного захворювання, наприклад формування пухлинного метастазу у віддалених органах. Фармацевтичні композиції приготовані відповідно дійсному винаходу переважно використовуються для лікування злоякісної неоплазії, також описаної як рак, яка характеризується пухлинними клітинами, які остаточно метастазують у віддалених органах або тканинах. Приклади злоякісної неоплазії яка лікувалась похідними N-сулфонілпіролу дійсного винаходу включають солідні і гематологічні пухлини. Солідні пухлини представлені пухлинами молочної залози, сечового міхура, кістки, мозку, центральної і периферійної нервової системи, товстої кишки, ендокринних залоз (наприклад щитовидної і наднирників), стравоходу, ендометрію, гамет, голови і шиї, нирки, печінки, легені, гортані і гортаноглотки, мезотеліомою, яєчника, підшлункової залози, простати, прямої кишки, нирковий, малого кишечнику, м'якої тканини, сім'яника, шлунку, шкіри, сечоводу, піхви і вульви. Злоякісна неоплазія включає спадкові ракові захворювання прикладами яких є ретинобластома і пухлина Вільмса. Додатково, злоякісна неоплазія включає первинні пухлини у вищевказаних органах і відповідні вторинні пухлини у віддалених органах ("метастази пухлини"). Гематологічні пухлини служать прикладом агресивних і безболісних форм лейкемії і лімфоми, а саме неходжскінської лімфоми, хронічної і гострої мієлоїдної лейкемії (ХМЛ/ГМЛ), гострого лімфобластного лейкозу (ГЛЛ), хвороби Ходжкіна, множинної мієломи і Т-лімфоцитарної лімфоми. Також включеними є мієлодиспластичний синдром, неоплазія з плазмоцитарною інфільтрацією, паранеопластичні синдроми, ракові захворювання невідомих первинних положень, так само як і пов'язані зі СНІДом злоякісні утворення. Винахід додатково передбачає спосіб для приготування фармацевтичних композицій для лікування ссавця, особливо людини, яка має хворобу відмінну від клітинної неоплазії, чутливу до терапії інгібітором гістонової дезацетилази. Ці незлоякісні хвороби включають (і) артропатії і остеопатичні стани або хвороби такі як ревматоїдний артрит, остеоартрит, подагра, поліартрит, і псориатичний артрит, (іі) автоімунні хвороби подібні до систематичного червоного вовчаку і відторгнення трансплантату, 8 UA 102091 C2 5 10 15 20 25 30 35 40 45 50 55 (ііі) гіперпроліферативні хвороби такі як проліферація клітини гладкої мускулатури, яка включає хвороби з васкулярною проліферацією, атеросклероз і рестеноз, (iv) гострі і хронічні запальні стани або хвороби і дермальні стани такі як і виразковий коліт, хвороба Крона, алергічний риніт, алергічний дерматит, кистозний фіброз, хронічний обструкційний бронхіт і астма, (ν) ендометріоз, маточні фіброїди, ендометріальна гіперплазія і доброякісна гіперплазія простати, (vi) дисфункція серця, (vii) інгібовані імуносупресивні стани подібні до ВІЛ інфекцій, (viii) невропатологічні захворювання подібні до хвороби Паркінсона, хвороби Альцгеймера або поліглутамін-асоційовані хвороби, і (іх) патологічні стани, які піддаються лікуванню потенціюванням ендогенної експресії гену так само як і посиленням експресії трансгену в генотерапії. Процес дійсного винаходу передбачає сполуки в очищеному або значно чистому вигляді, такому як наприклад більше ніж приблизно 50 %, більш переважно приблизно 60 %, більш переважно приблизно 70 %, більш переважно приблизно 80 %, більш переважно приблизно 90 %, більш переважно приблизно 95 %, більш переважно приблизно 97 %, більш переважно приблизно 99 % мас. проби, як визначено способами відомими в галузі техніки. Фармацевтичні композиції приготовані відповідно дійсному винаходу знаходяться в твердому або рідкому вигляді, особливо твердих формах дозування для перорального застосування, таких як таблетки і капсули, так само як і супозиторії і інші фармацевтичні форми дозування. Вони містять одну або декілька сполук формули І і фармацевтично прийнятні допоміжні речовини. Необов'язково, може бути присутній додатковий активний інгредієнт, особливо, додаткові протиракові ліки. Фармацевтичні композиції приготовані відповідно цьому винаходу можуть мати активність інгібування гістонової дезацетилази, активність індукції апоптозу, протипроліфераційну дію і/або активність індукції клітинної диференціації. Фармацевтичні композиції, які містять сполуку формули І приготовану відповідно цьому винаходу формуються процесами які відомі per se і знайомі спеціалісту в даній галузі техніки. Як фармацевтичні композиції, сполуки формули І (= активні сполуки) служать в комбінації з підходящими фармацевтичними допоміжними речовинами і/або допоміжними речовинами, наприклад у вигляді таблеток, таблеток з покриттям, капсул, каплетів, супозиторій, пластирів (наприклад, як TTS), емульсій, суспензій, гелів або розчинів, вміст активної сполуки переважно являється між 0.1 і 95 % і де, відповідним варіантом допоміжних речовин і/або допоміжними речовинів, може бути досягнута фармацевтична форма введення (наприклад форма із відстроченим вивільненням або кишечнорозчинна форма) яка точно відповідає активній сполуці і/або бажаному початку дії. Спеціалісту в даній галузі техніки відомі допоміжними речовини (тобто допоміжні речовини, наповнювачі, розчинники, носії або ад'юванти), які є підходящими для бажаних фармацевтичних формулювань, препаратів або композицій за рахунок його/її експертних знань. Додатково до розчинника можуть бути використані згущувач, мазь на основі інших допоміжних речовин, наприклад антиоксидантів, диспергаторів, емульгаторів, консервантів, солюбілізаторів, барвників, агентів комплексоутворення або проникаючих промоторів. Спеціаліст в даній галузі техніки обізнаний на основі його/її експертних знань про вид, загальну добову дозу(и) і форму(и) введення речовини формули І і будь-який лікувальний препарат(и), який вводиться сумісно. Вищесказана загальна добова доза(и) може варіюватися в межах широкого діапазону. Що стосується підходящих комбінацій для сумісного введення, режимів дозування, лікарських препаратів, комплектувань, комерційних упаковок, способів лікування тощо, сполуками формули І, посилання зроблене на WO 2007/039404, розкриття яких таким чином включене повністю, особливо на сторінках 88-96. Введення сполук приготованих відповідно цьому винаходу, комбінації і фармацевтичні композиції приготовані відповідно винаходу можуть бути виконані в будь-яких загальноприйнятих способах введення запропонованих в галузі техніки. Ілюстративні приклади підходящих способів введення включають внутрішньовенну, пероральну, назальну, парентеральну, місцеву, трансдермальну і ректальну подачу. Пероральна і внутрішньовенна подача є переважними. Для додаткових деталей посилання зроблене на WO 2007/039404, особливо на сторінку 87, передостанній параграф. 60 9 UA 102091 C2 ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання сполуки формули І: O R2 OH NH R4 R3 R5 R1 N O S O R6 5 10 15 20 25 30 35 40 45 50 , Формула І в якій R1 означає водень, 1-4С-алкіл, галоген або 1-4С-алкоксигрупу, R2 означає водень або 1-4С-алкіл, R3 означає водень або 1-4С-алкіл, R4 означає водень, 1-4С-алкіл, галоген або 1-4С-алкоксигрупу, R5 означає водень, 1-4С-алкіл, галоген або 1-4С-алкоксигрупу, R6 означає -Т1-Q1, де Т1 означає зв'язок, Q1 означає Ar1, Aa1, Hh1 або Ah1, де Аr1 означає феніл, або R61- і/або R62-заміщений феніл, де R61 означає 1-4С-алкіл або -T2-N(R611)R612, де або Т2 означає зв'язок, і R611 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл або феніл-1-4С-алкіл, R612 означає 1-4С-алкіл або 1-4С-алкоксі-2-4С-алкіл, або R611 і R612 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het1, де Het1 означає морфолін, тіоморфолін, S-оксотіоморфолін, S,S-діоксотіоморфолін, піперидин або піролідин, або Т2 означає 1-4С-алкілен або 2-4С-алкілен, перерваний киснем, і R611 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл або феніл-1-4С-алкіл, R612 означає 1-4С-алкіл або 1-4С-алкоксі-2-4С-алкіл, або R611 і R612 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het1, де Het1 означає морфолін, тіоморфолін, S-оксотіоморфолін, S,S-діоксотіоморфолін, піперидин, піролідин, імідазол, пірол або піразол, R62 означає 1-4С-алкіл, 1-4С-алкоксигрупу, галоген, ціаногрупу, 1-4С-алкоксі-1-4С-алкіл, 1-4Салкілкарбоніламіногрупу або 1-4С-алкілсульфоніламіногрупу, Аа1 означає бісарильний радикал, що складається з двох арильних груп, які незалежно вибрані з групи, що включає феніл і нафтил, і які зв'язані разом за допомогою простого зв'язку, Нh1 означає бісгетероарильний радикал, що складається з двох гетероарильних груп, які незалежно вибрані з групи, що включає моноциклічні 5- або 6-членні гетероарильні радикали, що містять один або два гетероатоми, кожний з яких вибраний з групи, що включає азот, кисень і сірку, і які зв'язані разом за допомогою простого зв'язку, Ah1 означає гетероарил-арильний радикал або арил-гетероарильний радикал, утворений гетероарильною групою, вибраною з групи, що включає моноциклічні 5- або 6-членні гетероарильні радикали, що містять один або два гетероатоми, кожний з яких вибраний з групи, що включає азот, кисень і сірку, і арильною групою, вибраною з групи, що включає феніл і нафтил, тим самим згадані гетероарильні і арильні групи зв'язані разом за допомогою простого зв'язку, де Aa1, Hh1 і Ah1 можуть бути необов'язково заміщені R63 і/або R64, де R63 означає 1-4С-алкіл, феніл-1-4С-алкіл, 1-4С-алкоксигрупу, трифторметил, ціаногрупу, галоген, повністю або предомінантно фторзаміщений, 1-4С-алкоксигрупу, 1-4С-алкоксі-1-4С 10 UA 102091 C2 5 10 алкіл, 1-4С-алкілсульфоніламіногрупу, толілсульфоніламіногрупу, фенілсульфоніламіногрупу, 14С-алкілкарбоніламіногрупу, карбамоїл, моно- або ді-1-4С-алкіламінокарбоніл, моно- або ді-14С-алкіламіносульфоніл або -T3-N(R631)R632, де Т3 означає зв'язок, 1-4С-алкілен або 2-4С-алкілен, перерваний киснем, і R631 означає 1-4С-алкіл, 1-4С-алкоксі-2-4С-алкіл або феніл-1-4С-алкіл, R632 означає 1-4С-алкіл або 1-4С-алкоксі-2-4С-алкіл, або R631 і R632 разом і з включенням атома азоту, з яким вони зв'язані, утворюють гетероциклічне кільце Het2, де Het2 означає морфолін, тіоморфолін, S-оксотіоморфолін, S,S-діоксотіоморфолін, піперидин, піролідин, імідазол, пірол або піразол, і R64 означає 1-4С-алкіл, 1-4С-алкоксигрупу або галоген, в якому здійснюють стадію взаємодії хлорангідриду акрилової кислоти сполуки формули ІI': O R2 Cl R4 R3 R5 R1 N O S O R6 15 ,Формула ІI' де R1, R2, R3, R4, R5 і R6 мають значення, як визначено вище, з водним гідроксиламіном і необов'язково перетворення утвореної сполуки в її сіль приєднання кислоти. 2. Спосіб за п. 1, в якому додатково здійснюють стадії і) забезпечення сполуки формули II: O R2 OH R4 R3 R5 R1 N O S O R6 20 , Формула II де R1, R2, R3, R4, R5 і R6 мають значення, як визначено в п. 1, і іі) перетворення сполуки формули II в її хлороангідрид формули ІI'. 3. Спосіб за п. 2, в якому стадію іі) проводять з тіонілхлоридом або оксалілхлоридом. 4. Спосіб за п. 2, в якому стадію і) проводять шляхом синтезу сполуки формули II відповідно до способу, в якому здійснюють наступні стадії: подовження вуглецевого ланцюга сполуки формули V: R2 O R4 R5 25 N H R1 , Формула V де R1, R2, R4 і R5 мають значення, як визначено в п. 1, з одержанням сполуки формули IV: 11 UA 102091 C2 O R2 OPG 1 R4 R3 R5 5 R1 N H , Формула IV де R1, R2, R3, R4 і R5 мають значення, як визначено в п. 1, і PG1 означає придатну тимчасову захисну групу для карбоксильної групи, взаємодію сполуки формули IV зі сполукою формули R6-SO2-X, де R6 є таким, як визначено в п. 1, і X означає придатну відхідну групу, що дає відповідну сполуку формули III: O R2 OPG 1 R4 R3 R5 R1 N O S O R6 10 15 20 25 , Формула III де R1, R2, R3, R4, R5 і R6 мають значення, як визначено в п. 1, і PG1 означає придатну тимчасову захисну групу для карбоксильної групи, і видалення захисної групи PG1, що дає сполуку формули II. 5. Спосіб за будь-яким з попередніх пунктів, у якому сполуку формули І одержують у вигляді вільної основи. 6. Спосіб за будь-яким з пп. 1-4, у якому сполуку формули І одержують безпосередньо у вигляді її гідрохлориду шляхом реакції сполуки формули II' з водним гідроксиламіном. 7. Спосіб за будь-яким з пп. 1-4 для одержання інших солей сполук формули І, відмінних від гідрохлориду, в якому здійснюють взаємодію вільної основи сполуки формули І з придатною кислотою або похідною кислоти з утворенням відповідної солі приєднання кислоти, або перетворення солі приєднання кислоти сполуки формули І в іншу сіль приєднання кислоти. 8. Спосіб за п. 7, де сіллю приєднання кислоти сполук формули І, відмінною від гідрохлориду, є метансульфонат. 9. Спосіб одержання фармацевтичної композиції, що містить сполуку формули І або її фармацевтично прийнятну сіль приєднання кислоти, в якому здійснюють синтез сполуки формули І або її солі приєднання кислоти за будь-яким з попередніх пунктів і формування композиції одержаної сполуки з загальноприйнятими фармацевтичними допоміжними речовинами. 10. Спосіб за п. 9, у якому фармацевтична композиція призначена для лікування, попередження або покращення доброякісної і/або злоякісної неоплазії, такої як, наприклад, рак, гіперпроліферативні захворювання доброякісної або злоякісної поведінки і/або захворювання, чутливі до індукції апоптозу. 30 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel method for the production of sulphonylpyrroles as hdac inhibitors
Автори англійськоюMueller, Matthias, Muller, Bernd, Maier Thomas
Назва патенту російськоюСпособ получения сульфонилпиролов как ингибиторов hdac
Автори російськоюМюллер Маттиас, Мюллер Бернд, Майер Томас
МПК / Мітки
МПК: C07D 403/12, A61K 31/40, A61P 35/00, C07D 207/48
Мітки: спосіб, інгібіторів, одержання, сульфонілпіролів
Код посилання
<a href="https://ua.patents.su/14-102091-sposib-oderzhannya-sulfonilpiroliv-yak-ingibitoriv-hdac.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання сульфонілпіролів як інгібіторів hdac</a>
Попередній патент: Пристрій і спосіб, а також застосування реактора для приготування сировинних, горючих і паливних матеріалів з органічних речовин
Наступний патент: Пакувальний багатошаровий матеріал, спосіб одержання пакувального багатошарового матеріалу, і виготовлений з нього пакувальний контейнер
Випадковий патент: Спосіб зниження атерогенного ризику у хворих на цукровий діабет 2 типу за наявності метаболічного синдрому












