Спосіб твердофазного синтезу альдегідів, кетонів, оксимів, амінів і гідроксамової кислоти
Номер патенту: 67733
Опубліковано: 15.07.2004
Автори: Мортон Джордж К., Лябодіньєр Річард Ф., Сальвіно Джозеф М., Мейсон Хелен Дж.
Формула / Реферат
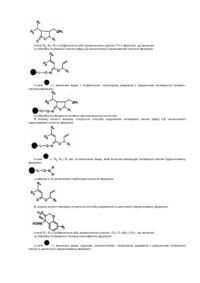
1. Спосіб одержання кетону формули
,
в якій
Rc і Ra незалежно є аліфатичною або ароматичною групою, що включає
а) взаємодію N-алкілованої гідроксамової кислоти на полімерній смолі формули:
,
в якій є твердим носієм, L відсутній або є зв'язувальною групою, a Ra і Rb незалежно є аліфатичною або арильною групою з металоорганічним реагентом формули RcM, в якій Rc є аліфатичним або арильним аніоном і Μ є катіоном металу; і
b) виділення кетону із смоли.
2. Спосіб за пунктом 1, де Μ є літієм або МgХ, де Χ є атомом брому або хлору.
3. Спосіб за пунктом 2, де L є зв'язувальною групою.
4. Спосіб за пунктом 3, де L є зв'язувальною групою формули
,
в якій
А відсутній або є групою формули –Χ1-Ζ-, в якій
X1 є -CHR- або -CHR-Y-CO-(CH2)n-, де R є атомом водню, алкілом, фенілом або фенілом, заміщеним -Н, алкілом, алкокси, атомом галогену, нітрилом або –NO2;
Υ є -О- або -ΝΗ-,
n є цілим числом від 1 до 6, і
Ζ є -О- або -ΝΗ-;
R1, R1a, R2 і R2a незалежно є атомом водню, алкілом, алкокси, атомом галогену, нітрилом або –NO2; і
R3 і R4 незалежно є атомом водню, алкілом, фенілом або фенілом, заміщеним одним або декількома замісниками, вибраними з алкілу, алкокси, атома галогену, нітрилу і –NO2;
або один із R1 і R2, взятий разом з одним із R3 і R4 і атомами вуглецю, з якими вони зв'язані, утворюють зв'язувальну групу формули
,
в якій
R1’ є атомом водню, алкілом, алкокси, атомом галогену, нітрилом або –NO2; і R6, R7 і R8 незалежно вибирають з атома водню, алкілу, алкокси, атома галогену, нітрилу або –NO2.
5. Спосіб за пунктом 4, в якому Rb є алкілом, бензилом або заміщеним бензилом.
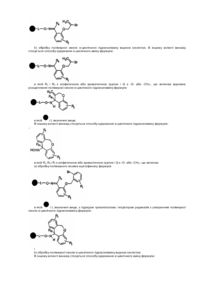
6. Спосіб одержання альдегіду формули RaCHO, в якій Ra є аліфатичною або арильною групою, що включає:
а) взаємодію N-алкілованої гідроксамової кислоти на полімерній смолі формули:
,
в якій є твердим носієм, L відсутній або є зв'язувальною групою, а Ra і Rb незалежно є аліфатичною або арильною групою; з відновлюючим агентом; і
b) відщеплення альдегіду від смоли.
7. Спосіб за пунктом 6, де відновлюючим агентом є гідридний відновлюючий агент.
8. Спосіб за пунктом 7, де L є зв'язувальною групою.
9. Спосіб за пунктом 8, де L є зв'язувальною групою формули
,
в якій
А відсутній або є групою формули –X1-Z-, в якій
X1 є -CHR- або -CHR-Y-CO-(СН2)n-, в якій R є атомом водню, алкілом, фенілом або фенілом, заміщеним -Н, алкілом, алкокси, атомом галогену, нітрилом або –NO2,
Υ є -О- або -ΝΗ-,
n є цілим числом від 1 до 6, і
Ζ є -О- або -ΝΗ-;
R1, R1a, R2 і R2a незалежно є атомом водню, алкілом, алкокси, атомом галогену, нітрилом або –NО2; і
R3 і R4 незалежно є атомом водню, алкілом, фенілом або фенілом, заміщеним одним або декількома замісниками, вибраними з алкілу, алкокси, атома галогену, нітрилу і –NO2;
або один із R1 і R2, узятий разом з одним з R3 і R4 і атомами вуглецю, з якими вони зв'язані, утворюють зв'язувальну групу формули
,
в якій R1’ є атомом водню, алкілом, алкокси, атомом галогену, нітрилом або –NO2; і
R6, R7 і R8 незалежно вибирають з атома водню, алкілу, алкокси, атома галогену, нітрилу або –NO2.
10. Спосіб за пунктом 8, де Rb є алкілом, бензилом або заміщеним бензилом.
11. Спосіб одержання N-алкілованої гідроксамової кислоти на полімерній смолі формули
,
в якій є твердим носієм, L відсутній або є зв'язувальною групою, a Ra і Rb незалежно є аліфатичною або арильною групою, що включає
а) конденсування карбонової кислоти формули RaCOOH із гідроксиламіном на полімерній смолі формули
,
з утворенням гідроксамової кислоти на полімерній смолі формули
,
b) взаємодію гідроксамової кислоти на полімерній смолі з алкілувальним агентом формули RbLG, в якій LG є групою, що відходить.
12. Спосіб за пунктом 11, де L є зв'язувальною групою.
13. Спосіб за пунктом 12, де L є зв'язувальною групою формули
,
в якій
А відсутній або є групою формули –X1-Z, в якій
X1 є -CHR- або -CHR-Y-CO-(CH2)n-, в якій R є атомом водню, алкілом, фенілом або фенілом, заміщеним -Н, алкілом, алкокси, атомом галогену, нітрилом або –NO2,
Υ є -О- або -ΝΗ-,
n є цілим числом від 1 до 6, і
Ζ є -О- або -ΝΗ-;
R1, R1a, R2 і R2a незалежно є атомом водню, алкілом, алкокси, атомом галогену, нітрилом або –NO2; і
R3 і R4 незалежно є атомом водню, алкілом, фенілом або фенілом, заміщеним одним або декількома замісниками, вибраними з алкілу, алкокси, атома галогену, нітрилу і –NO2;
або один із R1 і R2, узятий разом з одним з R3 і R4 і атомами вуглецю, з якими вони зв'язані, утворюють зв'язувальну групу формули
,
в якій
R1’ є атомом водню, алкілом, алкокси, атомом галогену, нітрилом або –NO2; і R6, R7 і R8 незалежно вибирають з атома водню, алкілу, алкокси, атома галогену, нітрилу або –NO2.
14. Спосіб за пунктом 13, де Rb є алкілом, бензилом або заміщеним бензилом.
15. Спосіб за пунктом 11, де гідроксиламіном на полімерній смолі є 4-(O-метилгідроксиламін)феноксиметил-співполімер(стирол-1% дивінілбензол),
4-[4-(O-метилгідроксиламін)-3-метоксифенокси]-(N-4-метилбензгідрил)бутирамід-співполімер(стирол-1% дивінілбензол),
4-(2',4'-диметоксифеніл-O-метилгідроксиламін)феноксиметил-співполімер(стирол-1% дивінілбензол),
4-[4-(1-амінооксіетил)-2-метокси-5-нітрофенокси]-(N-4-метилбензгідрил)бутирамід-співполімер(стирол-1% дивінілбензол),
O-гідроксиламін-2'-хлортритил-співполімер(стирол-1% дивінілбензол),
O-гідроксиламінтритил-співполімер(стирол-1% дивінілбензол),
5-(4-O-метилгідроксиламін-3,5-диметоксифенокси)валеріанова кислота-співполімер(стирол-1% дивінілбензол),
4-(O-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметил-співполімер(стирол-1% дивінілбензол),
4-(2',4'-диметоксифеніл-O-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметил-співполімер(стирол-1% дивінілбензол),
4-O-метилгідроксиламін-3-метоксифенокси-співполімер(стирол-1% дивінілбензол) або
3-гідроксиксантидроламін-співполімер(стирол-1% дивінілбензол).
16. Спосіб за пунктом 11, де гідроксиламіном на полімерній смолі є 4-(O-метилгідроксиламін)феноксиметил-співполімер(стирол-1% дивінілбензол) або 4-(2',4'-диметоксифеніл-O-метилгідроксиламін)феноксиметил-співполімер(стирол-1% дивінілбензол).
17. Спосіб одержання N-алкілованої гідроксамової кислоти на полімерній смолі формули:
,
в якій є твердим носієм, L відсутній або є зв'язувальною групою, a Ra і Rb незалежно є аліфатичною або арильною групою, що включає:
а) взаємодію N-захищеного гідроксиламіну на полімерній смолі формули:
,
в якій Ρ є амінозахисною групою, з алкілувальним агентом формули RbLG, в якій LG є групою, що відходить, з утворенням N-захищеного, N-алкілованого гідроксиламіну на полімерній смолі формули:
,
b) видалення амінозахисної групи з утворенням N-алкілованого гідроксиламіну на полімерній смолі формули:
,
с) сполучення N-алкілованого гідроксиламіну на полімерній смолі з карбоновою кислотою формули RaCOOH.
18. Спосіб за пунктом 17, де L є зв'язувальною групою.
19. Спосіб за пунктом 18, де L є зв'язувальною групою формули
,
в якій
А відсутній або є групою формули –X1-Z-, в якій
X1 є -CHR- або -CHR-Y-CO-(CH2)n-, в якій R є атомом водню, алкілом, фенілом або фенілом, заміщеним -Н, алкілом, алкокси, атомом галогену, нітрилом або –NO2,
Υ є -О- або -ΝΗ-,
n є цілим числом від 1 до 6, і
Ζ є -О- або -ΝΗ-;
R1, R1a, R2 і R2a незалежно є атомом водню, алкілом, алкокси, атомом галогену, нітрилом або –NO2; і
R3 і R4 незалежно є атомом водню, алкілом, фенілом або фенілом, заміщеним одним або декількома замісниками, вибраними з алкілу, алкокси, атома галогену, нітрилу і –NО2;
або один із R1 і R2, узятий разом з одним з R3 і R4 і атомами вуглецю, з якими вони зв'язані, утворюють зв'язувальну групу формули
,
в якій
R1’ є атомом водню, алкілом, алкокси, атомом галогену, нітрилом або –NO2; і R6, R7 і R8 незалежно вибирають з атома водню, алкілу, алкокси, атома галогену, нітрилу або –NO2.
20. Спосіб за пунктом 19, де Rb є алкілом, бензилом або заміщеним бензилом.
21. Спосіб за пунктом 17, де Ρ є алілоксикарбонілом, бензилоксикарбонілом, п-метоксибензилоксикарбонілом, п-нітробензилоксикарбонілом, триметилсилілетоксикарбонілом, 2,4-диметоксибензилоксикарбонілом, о-нітробензилоксикарбонілом, о-нітробензилсульфонілом, п-нітробензилсульфонілом і 2-нітро-4-трифторметилбензолсульфонілом.
22. Спосіб за пунктом 21, де Ρ є алілоксикарбонілом.
23. N-захищений гідроксиламін на полімерній смолі формули:
,
в якій є твердим носієм,
L відсутній або є зв'язувальною групою, і
Ρ є амінозахисною групою, за умови, що Ρ відрізняється від 4-метоксибензилу або 2,4-диметоксибензилу.
24. Тетрафторфенілгідроксиламін на полімерній смолі формули:
,
в якій є твердим носієм,
А відсутній або є групою формули –Χ1-Ζ-, в якій
X1 є -CHR- або -СНR-Y-СО-(СН2)n-, в якій R є атомом водню, алкілом, фенілом або фенілом, заміщеним -Н, алкілом, алкокси, атомом галогену, нітрилом або –NO2,
Υ є -О- або -ΝΗ-,
n є цілим числом від 1 до 6, і
Ζ є -О- або -ΝΗ-;
R3 і R4 незалежно є атомом водню, алкілом, фенілом або фенілом, заміщеним одним або декількома замісниками, вибраними з алкілу, алкокси, атома галогену, нітрилу і -NO2; і
Р1 є атомом водню або амінозахисною групою.
25. Тетрафторфенілгідроксиламін на полімерній смолі за пунктом 24, в якому один із радикалів R3 і R4 є атомом водню, а інший радикал є атомом водню або 2,4-диметоксифенілом.
26. Тетрафторфенілгідроксиламін на полімерній смолі за пунктом 25, в якому Р1 є атомом водню.
27. Тетрафторфенілгідроксиламін на полімерній смолі за пунктом 25, в якому Р1 є алілоксикарбонілом.
28. Тетрафторфенілгідроксиламін на полімерній смолі за пунктом 25, який є 4-(O-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметил-співполімер(стирол-1% дивінілбензол) або 4-(2',4'-диметоксифеніл-O-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметил-співполімер(стирол-1% дивінілбензол).
Текст
Даний винахід стосується способів твердофазного синтезу альдегідів, кетонів, оксимів, амінів і гідроксамової кислоти і полімерної смоли гідроксиламіну, яка використовується в синтезі. Методи твердофазного синтезу, в яких реагент імобілізований на полімерному матеріалі, що є інертним стосовно-використовуваних реагентів і умов реакції, а також нерозчинний у використовуваному середовищі, мають важливе значення як способи одержання амідів, пептидів і гідроксамових кислот. Короткий огляд багатьох методів твердофазного синтезу пептидів можна знайти в публікаціях: J.M. Stewart and, J.D. Young, Solid Phase Peptide Synthesis, 2nd. Ed., Pierce Chemical Co. (Chicago, II., 1984); J. Meienhofer, Hormonal Proteins and Pep-tides, v.2, p.46, Academic Press (New York, 1973); і Ε. Ath-erton and R.C.Sheppard, Solid Phase Peptide Synthesis. A Practical Approach, IRL Press at Oxford University Press (Oxford, 1989). Використання твердофазної методики для одержання непептидних молекул описано в роботі С.С. Leznoff, Асі. Chem. Res., ν.11, p.327333(1978). Ряд полімерних реагентів у перетворенні простих функціональних груп знайшли синтетичне застосування. Дивись роботи A. Akelah and D.C.Sherrington, "Application of Functionalired Polymers in Organic Synthesis", Chem. Rev., v.81, p.557-587 (1981) і W.T. Ford, E.C. Blossey, Polymer Supported Reagents, Polymer supported Catalysts, and Polymer Supported Coupling Reactions in Preparative Chemistry using Supported Reagents, Pierre Laszlo, ed., Academic Press Inc., p.193-212 (1987). Використання полімерних реагентів у реакціях окислення описане в J.M.J. Frechet et al., J. Org. Chem., ν.43, 2618 (1978) і G. Cainelli, J. Am. Chem. Soc, v.98, 6737 (1976). Використання полімерних реагентів у реакціях галоїдування описане в J.M.J. Frechet et al., J. Macromol. Sci. Chem., ν.Α-11, 507 (1977) і D.C. Sherrington et al., Eur. Polym. J., v.13, 73 (1977). Використання полімерних реагентів у реакціях епоксидування описане в J.M.J. Frechet et al., Macromolecules, ν.8, 130 (1975) і C.R. Harrison et al., J. Chem. Soc. Chem. Commun., 1009 (1974). Використання полімерних реагентів у реакціях ацилювання описане в М.В. Shambhu et al., Tet. Lett., 1627 (1973), і М.В. Shambhu et al., J. Chem. Soc. Chem. Commun., 619 (1974). Використання полімерних реагентів в реакціях Віттіга описане в S.V. McKinley et al., J. Chem. Soc. Chem. Commun., 134 (1972). Полімерні реагенти також знайшли широке застосування в комбінаторному синтезі і для укладання комбінаторних бібліотек. Дивись публікації F. Balkenhohl et al., Angew. Chem. Int. Ed. Engl., v.35, 2288-2337 (1996) і L.A. Thompson et al., Chem. Rev., v.96, 555-600(1996). Перевагою полімерних реагентів є легкість їх відділення від реагентів або продуктів із низькою молекулярною масою за допомогою фільтрації або селективного осадження. Також можна використовувати надлишок полімерного реагенту для здійснення швидких і кількісних перетворень, таких як у випадку ацилювання, або великий надлишок реагентів можна використовувати , для того, щоб зрушити рівновагу реакції в напрямку утворення продукту, щоб забезпечити практично кількісне перетворення в продукті, як у випадку твердофазного синтезу пептидів. Додатковою перевагою реагентів і каталізаторів, нанесених на підложки, є те, що їх можна рециркулювати, вони легке можуть бути застосовні для автоматизованих процесів. Крім того, аналоги токсичних і сильно пахучих реагентів нанесені на підложки, більш безпечні для використання. В опублікованій заявці РСТ №W096/26223 описаний синтез сполук гідроксамової кислоти з використанням твердофазного субстрату гідроксиламіну. У Prasad et al. описана сполука О-метилгідроксиламін-полістиролової смоли в J.Steroid Biochem., v.18, 257-261 (1983). Короткий опис винаходу Даний винахід стосується способу одержання кетону формули в якій Rc і Ra незалежно є аліфатичною або ароматичною групою, який включає: a) взаємодію полімерної смоли N-алкілованої гідроксамової кислоти формули: в якій є твердим носієм, L відсутня або є зв'язуючою групою, Ra і Rb с аліфатичною або арильною групою, з металоорганічним реагентом формули КсМ, в якій Rc є аліфатичним або арильним аніоном і Μ катіоном металу; і b) виділення кетону із смоли. В іншому аспекті цей винахід стосується способу одержання альдегіду формули RaCHO, в якій Ra визначений вище, який включає: a) взаємодію полімерної смоли N-алкілованої гідроксамової кислоти формули: в якій , L, Ra і Rb визначені вище; з відновлюючим агентом; і b) виділення альдегіду із смоли. В іншому аспекті цей винахід стосується способу одержання полімерної смоли N-алкілованої гідроксамової кислоти формули: в якій , L, Ra і Rb визначені вище, який включає: a) сполучення карбонової кислоти формули RaCOOH із полімерною смолою гідроксиламіну формули: з утворенням полімерної смоли гідроксамової кислоти формули: b) взаємодію полімерної смоли гідроксамової кислоти з алкілювальним агентом формули RbLG, в якій LG є відхідною групою. В іншому аспекті винахід стосується способу одержання полімерної смоли N--алкілованої гідроксамової кислоти формули: в якій , L, R a і Rb визначені вище, який включає: а)взаємодію полімерної смоли N-захищеної гідроксамової кислоти формули: в якій Ρ є амінозахисною групою, з алкілювальним агентом формули R bLG, в якій LG визначена вище, з утворенням полімерної смоли N-захищеної N-алкілованої гідроксиламіну формули: b) видалення амінозахисної групи з утворенням полімерної смоли N-алкіловансї гідроксиламіну формули: c) сполучення полімерної смоли N-алкілованої гідроксиламіну з карбоновою кислотою формули RaCOOH. В іншому аспекті винахід стосується способу одержання гідроксамової кислоти формули: де А2 є простим зв'язком, або алкиленовою групою, або NR13, в якій R13 є атомом водню або алкілом; R9 є групою формули L1-R14, де L1 є простим зв'язком, або лінійною, або розгалуженою С1-С6-алкіленовою групою, необов'язково заміщеною алкокси, арилом, карбокси, ціано, циклоалкілом, атомом галогену, гетероарилом, гідроксилом або оксо, і R14 є атомом водню, арилом, карбокси, ціано, циклоалкілом, циклоалкенілом, циклокарбамоїлом, циклоімідилом, гетероциклоалкілом, гетероарилом, групою -NH-C(=O)NH2, (N-карбамоїл) циклічним аміном, -C=N-O-C(=O)-NH 2,-C(=O)-NY1Y2 [де Y1 і Y2 незалежно ε атомом водню, алкілом, арилалкілом і арилом, або замісник Υ1 Υ2Ν- утворює 4-6-членний циклічний амін, який необов'язково містить додатковий гетероатом, обраний із кисню, сірки, групи ΝΗ або NR13], -NY1-SО2-арилом, групою -NHR13, -SR13 або -OR13; або гр упою L2-R15 , де L2 є лінійним або розгалудженим вуглецевим ланцюгом, що має від 2 до 6 атомів вуглецю, необов'язково заміщений карбокси- або ціано-групою, що має подвійний або потрійний вуглець-вуглецевий зв'язок, або переривається атомом кисню або сірки, феніленовою групою, іміно(-ΝΗ-) або алкіліміном, або сульфінільною, або сульфонільною групою, і R 15 є атомом водню, арилом, карбокси, ціано, циклоалкілом, циклоалкенілом, гетероциклоалкілом або гетероарилом; або R9 і R10, взяті разом з атомом, з яким вони зв'язані, утворюють цикл; або R9 і R11, взяті разом з атомом, з яким вони зв'язані, утворюють цикл; R10 і R12 незалежно є атомом водню або алкілом; або R10 і R12 разом утворять зв'язок; R11 є групою формули -L3-R16 , де L3 є простим зв'язком, або лінійною або розгалуженою С1-С6-алкіленовою групою, необов'язково заміщену алкокси, арилом, карбокси, ціано, циклоалкілом, атомом галогену, гетероарилом, гідроксилом або оксо; або L3 є лінійним, або розгалуженим вуглецевим ланцюгом, що має від 2 до 6 атомів вуглецю, що має подвійний або потрійний вуглець-вуглецевий зв'язок, або переривається атомом кисню або сірки, феніленовою групою, іміно(-ΝΗ-) або алкіліміном, або сульфінільною, або сульфонільно групою; і R16 є атомом водню, арилом, циклоалкілом, циклоалкенілом, циклокарбамоїлом, циклоімідилом, гетероциклоалкілом, гетероарилом, групою -ΝΗ-C(=O)-NH2, (N-карбамоїл)циклічним аміном, -C=N-O-C(=O)NH2, -C(O-NY1 Y2 [де Υ1 і Υ2 незалежно є атомом водню, алкілом, арилалкілом і арилом, або замісник Υ1Υ2Νутворить 4-6-членний циклічний амін, що необов'язково має додатковий гетероатом, обраний з кисню, сірки, групи ΝΗ або NR13], -NY1SO2-арилом, або R11 і R9, взяті разом з атомом, з яким вони зв'язані, утворюють цикл; або R11 і R12, взяті разом з атомом, з яким вони зв'язані, утворюють цикл; Аr є гр упою, обраною з: де R17 є лінійною або розгалуженою алкільною групою, що має від 1 до 6 атомів вуглецю і необов'язково заміщену одним або декількома атомами галогену, або, коли Ζ3 є простим зв'язком, R17 також може бути атомом водню, алкенільною або алкінільною групою; R18 є необов'язково заміщеним циклоалкілом, циклоалкенілом, гетероциклоалкілом, арилом, частково насиченою біциклоарильною або гетероарильною групою; R19 є R20, -OR20, -SR 20, -SOR 20 , -SO 2R20 , -SO2NR20R21 , -NR20SO 2R21 , -NR20R21, -О(С=О) NR20R21 , -NR20C(=0) R21, -N(OH)C(=O)R 20 або -C(=O)N(OH)R 21, де R20 і R21, які можуть бути однаковими або різними, кожний є атомом водню, або алкілом, алкенілом, циклоалкілом, циклоалкенілом, гетероциклоалкілом, арилом, гетероарилом, арилалкільною або гетероарилалкільною групою, або група NR20R21 є 5-7-членним циклічним аміном, що необов'язково містить один або декілька додаткових гетероатомів, обраних із кисню, азоту або сірки, в якій, коли R18 є заміщеною циклоалкільною групою, циклоалкільна група заміщена одним або декількома (наприклад 1, 2 або 3) замісниками, обраними з OR23, SR24, SOR24, SO2R24, NH2, NR13R24, =NOR 24, =NOH, =NNHR2\ =NOCONHR24, =NCO2R24, NHCOR24, NHSO2R24, SO 2NR13R24, R23 , CONHR24, CONHCH2CO2R13, CONR24R13, або N3 ; де R23 є атомом водню, алкілом, циклоалкілом, арилом, арилалкілом, гетероарилом або гетероарилалкілом; R24 є алкілом, циклоалкілом, циклоалкенілом, гетероциклоалкілом, арилом, арилалкілом, гетероарилом або гетероарилалкілом; або замісник NR 13R24 утворить 4-7-членний циклічний амін, який необов'язково має; додатковий гетероатом, обраний із кисню, сірки, групи NH або NR13, і в якій R18 є заміщеною гетероциклоалкільною групою, що має атом азоту, причому кільце заміщене за одним або декількома (наприклад 1, 2 або 3) атомамами вуглецю, і замісники, вибирають з оксо-, ціано-, CO2R13, CONHCH2CO2R13, арилу, арилалкілу, алкілу або гідроксиалкілу, і/або заміщено за атомом азоту кільця, причому замісник вибирають із R13, (CH2)nCO2H, (CH2)nCO2R24 , (CH2)nCONR13R24 , (CH2)nCOR24, CONH2, CONHR24, COR24 , SO 2R24 або OR24; А3 є простим зв'язком, або лінійною, або розгалуженою Сі-С 5-алкиленовою групою, необов'язково заміщеною атомом галогену, гідроксилом, алкокси, оксо, циклоалкілом, арилом або гетероарилом; або Α3 ε лінійним або розгалуженим вуглецевим ланцюгом, що має від 2 до 6 атомів вуглецю, містить подвійний або потрійний вуглець-вуглецевий зв'язок, або переривається атомом кисню або сірки, феніленовою групою, іміно(-ΝΗ-) або алкіліміном, або сульфінільною або сульфонільною групою; Ζ1 і Ζ 3 кожний є атомом кисню або сірки, простим зв'язком або групою ΝΗ; Z2e атомом кисню, або сірки, або простим зв'язком; В, С, D і Ε незалежно є атомом вуглецю або гетероатомом, обраним з кисню, сірки, азоту, гр упи NOR22 або -^алкілом, гетероарилом або гетероарил-С 1-С4-алкілом, або три з В, С, D і Ε є атомом вуглецю або гетероатомом, обраним із кисню, азоту або групи NR22 або сірки, а інший є простим зв'язком; але крім сполук, в яких два атоми кисню або сірки знаходяться в сусідніх положеннях, причому зв'язки, що з'єднують В, С, D і Ε можуть бути простими або подвійними; Q1, Q2 і Q3, що можуть бути однаковими або різними, кожний є групою СН або СХ1 або атомом азоту; і X1 є атомом галогену; і n дорівнює 0, 1 або 2; або її N-оксиду, пролікарської форми, її кислотної ізостери фармацевтично прийнятної солі або сольвату, що включає обробку полімерної смоли гідроксамової кислоти формули кислотою. В іншому аспекті винахід стосується способу одержання полімерної смоли оксима ефіру формули: де і L такі, як визначено вище, а (Rd і Re незалежно є атомом водню, аліфатичним або ароматичним радикалом, що включає взаємодію полімерної смоли гідро-ксиламіну формули: з карбонільною сполукою формули В іншому аспекті винахід стосується способу одержання α-аміну формули: в якій Rd і Re незалежно є атомом водню, аліфатичною або арильною групою, за умови, що Rd і Re обидва не є атомом водню, який включає відновне розщеплення полімерної смоли оксима ефіру формули: в якій і L такі, як визначено вище. В іншому аспекті винахід стосується способу одержання заміщеного α-аміну формули: в якій Rd і Re незалежно є атомом водню, аліфатичною або ароматичною групою за умови, що Rd і Re обидва не є атомом водню, і Rf є аліфатичною або ароматичною групою, який включає: а) взаємодію полімерного оксима ефіру формули в якій і L такі, як визначено вище, з металоорганічним реагентом формули RfM, в якій Rf є аліфатичним або ароматичним аніоном, а М є катіоном металу, :і утворенням полімерної смоли α-заміщеного гідроксиламіну формули: і b) відновне розщеплення смоли α-заміщеного гідроксиламіну. В іншому аспекті винахід стосується способу одержання лактону формули: в якій Rg , Rh і Ri є аліфатичною або ароматичною групою і Рп є фенілом, що включає a) обробку полімерної смоли ефіру α,β-ненасиченої гідроксамової кислоти формули в якій і L визначені вище, з тіофенолом і ініціатором радикалів з утворенням полімерного оксиміллактону формули: b) обробку полімерного оксиміл-лактону водною кислотою, В іншому аспекті винахід стосується способу одержання полімерної смоли ефіру α,β ненасиченої гідроксамової кислоти формули в якій формули , L, Rg , Rh і Ri такі, як визначено вище, який включає взаємодію полімерної смоли гідроксиламіну з ефіром α, β-ненасиченої карбонової кислоти формули: В іншому аспекті винахід стосується способу одержання α-циклічного гідроксиламіну формули: в якій Ri і Rk є аліфатичною або ароматичною групою і Q є -О- або -СН2-, що включає а) обробку полімерного оксима ацетофенону формули в якій і L визначені вище, гідридом триалкілолова і ініціатором радикалів з утворенням полімерної смоли α-циклічного гідроксиламіну формули: b) обробку полімерної смоли α-циклічного гідроксиламну водною кислотою. В іншому аспекті винахід стосується способу одержання α-циклічного аміну формули: в якій Rj і Rk є аліфатичною або ароматичною групою і Q є -О- або -СН2-, що включає відновне розщеплення полімерної смоли α-циклічного гідроксиламіну формули в якій і L визначені вище. В іншому аспекті винахід стосується способу одержання α-циклічного гідроксиламіну формули: в якій Rj, Rk і Ri є аліфатичною або ароматичною групою і Q є -О- або -СН2-, що включає a) обробку полімерного оксима ацетофенону формули в якій і L визначені вище, з гідридом триалкілолова і ініціатором радикалів з утворенням полімерної смоли α-циклічного гідроксиламіну формули: і b) обробку полімерної смоли α-циклічного гідроксиламіну водною кислотою. В іншому аспекті винахід стосується способу одержання α-циклічного аміну формули: в якій Rj, Rk і Ri є аліфатичною або ароматичною групою і Q є -О- або -СН2-, ще включає відновне розщеплення полімерної смоли α-циклічного гідроксиламіну формули в якій і L визначені вище. В іншому аспекті винахід стосується способу одержання полімерної смоли N-захищеного гідроксиламіну формули: в якій і L визначені вище і Ρ є амінозахисною групою, за умови, що Ρ не є 4-метоксибензилом або 2,4диметоксибензилом. В іншому аспекті винахід стосується полімерної смоли тетрафторфенілгідроксиламіну формули: в якій , A, R3 і R4 визначені вище і Р1 є амінозахисною групою. Визначення використаних термінів Використані вище і у всьому описі винаходу наступні терміни мають вказані нижче значення, якщо не зазначене інше. "Твердий носій" означає субстрат, що є інертним стосовно реагентів і описаних тут умов реакції, а також є практично нерозчинним у використовуваному середовищі. Характерні тверді носії включають неорганічні субстрати, такі як кізельгур, силікагель і скло з регульованим розміром пір; органічні полімери, включаючи полістирол, що включає 1-2% співполімера стиролу з дивінілбензолом (у виді гелю) і 20-40% співполімера стиролу з дивінілбензолом (форма з макропорами), поліпропілен, поліетиленгліколь, поліакриламід, целюлозу і подібні; і композиційні неорганічні/полімерні композиції, такі як поліакриламід, нанесений всередині матриці часток кізельгура. Дивись J.M. Stewart and J.D. Young, Solid Phase Peptide Synthesis, 2nd. Ed., Pierce Chemical Co. (Chicago, IL, 1984). Крім того, "твердий носій" включає описаний вище твердий носій, який закріплений на другому інертному носії, такому як шпильки, що описано в Technical Manual фірми Mul-tipin™ SPOC, Chiron Technologies (1995) і посиланнях, які містяться в ньому, які мають голівку, що відділяється, на основі поліетилену або поліпропилену, графт-полімеризовану з амінофункціоналізованим співполімером метакрилату, і інертний стрижень. Крім того, "твердий носій" включає полімерні носії, такі як поліетиленгліколеві носії, описані Janda et al., Proc. Natl. Acad. Sci. USA, ν.92, 6419-6423 (1995) і S. Brenner, WO 95/16918, які розчинні у багатьох розчинниках, але можуть бути осаджені додаванням осаджуючого розчинника. "Полімерна смола гідроксиламіну" означає твердий носій, визначений вище, який хімічно модифікований, як відомо з рівня техніки, щоб ввести ряд груп гідроксиламіну (-ONH2) або захищених груп гідроксиламіну (ONHP). Групи гідроксиламіну або захищеного гідроксиламіну ковалентно зв'язані безпосередньо з твердим носієм або приєднані до твердого носія ковалентними зв'язками за допомогою зв'язуючих груп. Відповідно до способу винаходу полімерна смола гідроксиламіну позначається тут як або де є твердим носієм, що визначений вище, L відсутня або є зв'язуючою гр упою і Ρ є амінозахисною групою. "Зв'язуюча гр упа" і "лінкер" означає групу, за допомогою якої аміно- або амінометильна функціональна група може бути ковалентно зв'язана з твердим носієм. Звичайно зв'язуюча група є інертною стосовно реагентів і описаним тут умовам реакції. "Амінозахисна група" означає групу, що легко видаляється, яка відома з рівня техніки для захисту аміногрупи від небажаних реакцій в ході процедури синтезу і яка може бути селективно видалена. Використання амінозахисних груп добре відомо з рівня техніки для захисту від небажаних реакцій в ході синтезу, причому багато таких захисних груп відомі, наприклад із Т.Н. Greene and P.G. Wuts, Protective Groups in Organic Synthesis, 2nd edition, John Wiley & Sons, New York (1991), що включена в опис у якості посилання. Типові амінозахисні групи включають формильну, ацетильну, хлорацетильну, трихлорацетильну, онітрофенілацетильну, о-нітрофеноксилацетильну, трифторацетильну, ацетоацетильну, 4-хлорбутирильну, ізобутирильну, о-нітроцінамоїльну, піколіноїльну, ацилізотіоціанатну, амінокапроїльну, бензоїльну, метоксикарбонільну, 9-флуоренілметоксикарбонільну (Fmoc), 2,2,2-трифторетоксикарбонільну, 2триметилсилілетоксикарбонільну (Теос), вінілоксикарбонільну, алілоксикарбонільну, третбутилоксикарбонільну (ВОС), 1,1-диметилпропінілоксикарбонільну, бензилоксикарбонільну (Cbz), пнітробензилоксикарбонльну, 2,4-дихлорбензилоксикарбонільну, алілоксикарбонільну (АІос), 2-(пбіфеніл)ізопропілоксикарбонільну (Врос), адамантилоксикарбонільну (Adoc), 2-(3,5-диметоксифеніл)пропіл-2оксикарбонільну (Ddz), трет-бутильну (t-Bu), п-метоксибен-зилоксикарбонільну (Mo z), пнітробензилоксикарбонільну (4-NO2-Z), 2-(фенілсульфоніл)етоксикарбонільну, 2,4диметоксибензилоксикарбонільну, о-нітробензилоксикарбонільну, 1-(2-оксо-1,2дифенілетил)метилоксикарбонільну, (1,3-дитіон-2-іл)метоксикарбонільну (Dmoc), піридилетильну (Руос), 4нітрофенілалилоксикарбонільну (Noc), 2-нітро-4,5-диметоксибензилоксикарбонільну, диметил-третбутилксильну, о-нітробензилсульфонільну (o-Nbs), п-нітробензилсульфонільну (p-Nbs), 2-нітро-4-трифторметилбензолсульфонільну і т.п. "Природна амінокислота" означає карбонову кислоту, що має аміногрупу в а-положенні стосовно карбоксилатної групи, наприклад сполука формули H2N-CHR-COOH, в якій R є аліфатичним або ароматичним радикалом, визначеним в описі. Кращі амінокислоти мають L-стереохімію при α-атомі вуглецю. Найкращими природними амінокислотами є так звані природні α-амінокислоти, тобто аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, триптофан, метіонін, гліцин, серін, треонін, цистеїн, тірозин, аспарагін, глутамін, аспаргиноваякислота, глутамінова кислота, лізин, аргінін і гістидин. "Пептид" і "полипептид" означають полімер, в якому мономерами є залишки природних і синтетичних амінокислот, з'єднаних разом за допомогою амідних зв'язків. Термін "пептиднй скелет" означає ряд амідних зв'язків, за допомогою яких з'єднуються амінокислотні залишки. Термін "амінокислотні залишки" означає індивідуальні ланки амінокислот, введених у пептиди або поліпептиди. Термін "синтетична амінокислота" означає карбонову кислоту, що має аміногрупу в положенні, яке відрізняється від α-положення стосовно карбоксилатної групи. Представники синтетичних амінокислот включають β-аланін і γ-аміномасляну кислоти. Термін "аліфатичний" означає сполуку або радикал, які не мають ароматичного кільця. Представники аліфатичних гр уп включають алкіл, алкеніл, алкініл, циклоалкіл, циклоалкеніл і подібні. Термін "ароматичний" означає сполуку або радикал, які мають, щонайменше, одне ароматичне кільце. Термін "ароматичне кільце" включає як арильні, так і гетероарильні кільця, що визначені в описі. Представники ароматичних груп включають арил, арилалкеніл, арилалкіл, арилалкініл, бензил, гетероарил, гетероарилалкеніл, гетероарилалкіл, гетероарилалкініл і подібні. Термін "біоізостера кислоти" означає групу, що має хімічну і фізичну подобу, забезпечуючи досить близькі біологічні властивості (див. статті Lipinski, Annual Reports in Medicinal Chemistry, 1986, v.21, p.283 "Bioisosterism In Drug Design"; Yun, Hwahak Sekye, 1993, v.33, p.576-579 "Application Of Bioisosterism To New Drug Design"; Zhao, Huaxue Tongbao, 1995, p.34-38 "Bioisosteric Replacement And Development Of Lead Compounds In Drug Design"; Graham, Theochem, 1995, v.343, p.105-109 "Theoretical Studies Applied To Drug Design: ab initio Electronic Distributions In Bioisosteres"). Приклади відповідних біоізостер кислот включають: -C(=O)-NH-OH, C(=O)-CH 2OH, -C(=O)-CH 2SH, -C(=O)-NH-CN, сульфо, фосфоно, алкілсульфонілкарбамоїл, тетразоліл, арилсульфонілкарбамоїл, гетероарилсульфонілкарбамоїл, N-метоксикарбамоїл, 3-гідрокси-3-циклобутен-1,2діон, 3,5-діоксо-1,2,4-оксадіазолідиніл, або гетероциклічні феноли, такі як 3-гідроксиізоксазоліл, і 3-гідрокси-1метилпіразоліл. "Ацил" означає груп у Η-CO- або алкіл-СО-, в якій алкільна група така, як визначено в описі. Кращі ацили мають нижчу алкільну гр упу. Приклади ацильних груп включають форміл, ацетил, пропаноїл, 2метилпропаноїл, бутаноїл і пальмітоїл. "Ациламіно" означає групу ацил-NH-, в якій ацильна група така, як визначено в описі. "Алкеніл" означає аліфатичну вуглеводневу гр упу, що містить вуглець-вуглецевий подвійний зв'язок, який може бути розгалужений або нерозгалужений і має приблизно від 2 до 15 атомів вуглецю в ланцюзі. Кращі алкенільні групи мають приблизно від 2 до 12 атомів вуглецю в ланцюзі, і найкраще приблизно від 2 до 4 атомів вуглецю в ланцюзі. Розгалужений ланцюг означає, що до лінійного алкенільного ланцюга приєднана одна або декілька нижчих алкільних груп, таких як метил, етил або пропіл. Термін "нижчий алкеніл" означає ланцюг, що містить приблизно від 2 до 4 атомів вуглецю в ланцюзі, який може бути розгалужений або нерозгалужений. Алкенільна група може бути заміщена одним або декількома атомами галогену або циклоалкілом. Приклади алкенільних груп включають етеніл, пропеніл, н-бутеніл, ізобутеніл, 3-метилбут-2еніл, н-пентеніл, гептеніл, октеніл, циклогексил бутеніл і деценіл. Термін "алкокси" означає групу алкіл-О-, в якій алкільна група така, як визначено в описі. Приклади алкокси-групп включають метокси, етокси, н-пропокси, ізопропокси, н-бутокси і гептокси. Термін "алкоксіалкіл" означає групу алкіл-О-алкіл, в якій алкільні групи незалежно є такими, як визначено в описі. Приклади алкоксіалкільних гр уп включають метоксіетил, етоксиметил, н-бутоксиметил і циклопентилметилоксіетил. Термін "алкоксикарбоніл" означає групу алкіл-О-СО-, в якій алкільна група така, як визначено в описі. Приклади алкоксикарбонільних груп включають метоксикарбоніл і етоксикарбоніл. "Алкіл" означає аліфатичну вуглеводневу гр упу, яка може бути розгалуженою або нерозгалуженою і має приблизно від 1 до 15 атомів вуглецю в ланцюзі. Кращі алкільні групи мають приблизно від 1 до 12 атомів вуглецю в ланцюзі. Розгалужений ланцюг означає, що до лінійного алкільного ланцюга приєднана одна або декілька нижчих алкільних груп, таких як метил, етил або пропіл. Термін "нижчий алкіл" означає ланцюг, що містить приблизно від 1 до 4 атомів вуглецю в ланцюзі, який може бути розгалужений або нерозгалужений. Алкільна група може бути заміщена одним або декількома атомами галогену, циклоалкілом або циклоалкенілом. Приклади алкільних груп включають метил, фторметил, дифторметил, трифторметил, циклопропілметил, циклопентилметіл, етил, н-пропіл, ізопропіл, н-бутил, трет-бутил, н-пентил, 3-пентил, гептил, октил, ноніл, децил, і додецил. Кращі алкільні групи для R9 включають метил, фторметил, дифторметил, трифторметил, і етил. "Алкілсульфініл" означає групу алкіл-SО2-, в якій алкільна група така, як визначено в описі. Кращі ті групи, в яких алкільна група є нижчим алкілом. "Алкілсульфоніл" означає груп у алкіл-SО2-, в якій алкільна група така, як визначено вище. Кращі ті гр упи, в яких алкільна група є нижчим алкілом. Термін "алкілтіо" означає групу алкіл-S-, в якій алкільна група така, як визначено вище. Приклади алкілтіогрупп включають метилтіо, етилтіо, ізо-пропілтіо і гептилтіо. "Алкініл" означає аліфатичну вуглеводневу груп у, що містить вуглець-вуглецевий потрійний зв'язок, що може бути розгалуженим або нерозгалуженим і має приблизно від 2 до 15 атомів вуглецю в ланцюзі. Кращі алкінільні групи мають приблизно від 2 до 12 атомів вуглецю в ланцюзі, і найкраще приблизно від 2 до 4 атомів вуглецю в ланцюзі. Розгалужений ланцюг означає, що до лінійного алкінільного ланцюга приєднана одна або декілька нижчих алкільних груп, таких як метил, етил або пропіл. Приклади алкінільних гр уп включають етиніл, пропініл, н-бутиніл, ізобутиніл, 3-метилбут-2-ініл, і н-пентиніл. "Ароїл" означає групу арил-СО-, в якій арильна група така, як визначено вище. Приклади ароїльних груп включають бензоїл, і 1- і 2-нафтоїл. "Ароїламіно" означає групу ароїл-NH-, в якій ароїльна група така, як визначено вище. "Арил" як група або частина групи означає необов'язково заміщену моноциклічну або поліциклічну ароматичну карбоциклічну гр упу, що містить приблизно від 6 до 10 атомів вуглецю. Приклади арильних гр уп включають феніл або нафтил, або феніл, або нафтил, заміщені одним або декількома замісниками арильної групи, що можуть бути однаковими або різними, де "замісник арильної групи" включає ацил, ациламіно, алкокси, алкоксикарбоніл, алкіл, алкілсульфініл, алкілсульфоніл, алкілтіо, ароїл, ароїламіно, арил, арилалкокси, арилалкоксикарбоніл, арилалкіл, арилалкілтіо, арилокси, арилоксикарбоніл, арилсульфініл, арилсульфоніл, арилтіо, карбокси, ціано, галоген, гетероароїл, гетероарил, гетероарилалкіл, гетероариламіно, гетероарилокси, атом водню, гідрокси, гідроксиалкіл, нітро, Y1Y2N-, Y1 Y2NCO- або Y1 Y2NSO2-, де Υ1 і Υ2 незалежно є атомом водню, алкілом, арилалкілом і арилом, або Υ1 і Υ2, взяті разом з атомом азоту, з яким вони зв'язані, утворять 4-7-членний гетероциклічний радикал, що необов'язково містить додатковий гетероатом, обраний із кисню, сірки, ΝΗ або NR 13. Кращі замісники арильної групи включають ацил, ациламіно, алкоксикарбоніл, алкіл, алкілтіо, ароїл, ціано, галоген, атом водню, гідрокси, нітро, Y1 Y2N-, Y1 Y2NCO- або Y1 Y2NSO 2-, де Υ1 і Υ2 незалежно є атомом водню і алкілом. "Арилалкеніл" означає арилалкенільну груп у, в якій арил і алкеніл такі, як визначено вище. Краще арилалкеніли містять нижчу алкенільну груп у. Приклади арилалкенільних груп включають стиріл і фенілаліл. "Арилалкіл" означає арилалкільну груп у, в якій арил і алкіл такі, як визначено вище. Краще арилалкіли містять нижчу алкільну гр упу. Приклади арилалкільних гр уп включають бензил, 2-фенетил і нафталінметил. "Арилалкілокси" означає арилалкіл-О-групу, в якій арилалкільна група така, як визначено вище. Приклади арилалкілокси-груп включають бензилокси і 1- або 2-нафталінметокси. "Арилалкілоксіалкеніл" означає арилалкіл-О-алкенільну групу, в якій арилалкільна і алкенільна групи такі, як визначено вище. Прикладом арилалкілоксіалкенільної групи є 3-бензилоксіаліл. "Арилалкілоксіалкіл" означає арилалкіл-О-алкільну гр упу, в якій арилалкільна і алкільна групи такі, як визначено вище. Прикладом арилалкілоксіалкільної групи є бензилоксіетил. "Арилалкоксикарбоніл" означає арилалкіл-О-СО-групу. Прикладом арилалкілоксикарбонільної групи є бензилоксикарбоніл. Термін "арилалкілтіо" означає групу арилалкіл-S-, в якій арилалкільна група така, як визначено вище. Прикладом арилалкілтіо-групи є бензилтіо. "Арилалкініл" означає арилалкінільну групу, в якій арил і алкініл такі, як визначено вище. Краще арилалкініли містять нижчу алкінільну груп у. Прикладом арилалкінільної групи є фенілацетиленіл. "Арилокси" означає арил-О-групу, в якій арильна група така, як визначено вище. Приклади арилокси-групп включають фенокси і нафтокси. "Арилоксіалкеніл" означає арил-О-алкенільну груп у, в якій арил або алкенільна групи такі, як визначено вище. Прикладом арилоксіалкенільної групи є феноксіаліл. "Арилоксіалкіл" означає арил-О-алкільну гр упу, в якій арильна і алкільна групи такі, як визначено вище. Прикладом арилоксіалкільної групи є феноксипропіл. "Арилоксикарбоніл" означає арил-О-СО- групу, в якій арильна група така, як визначено вище. Приклади арилокси карбонільної групи включають феноксикарбоніл і нафтоксикарбоніл. "Арилсульфініл" означає групу арил-SO-, в якій арильна група така, як визначено вище. "Арилсульфоніл" означає групу арил-SО2-, в якій арильна група така, як визначено вище. Термін "арилтіо" означає групу арил-S-, в якій арилная група така, як визначено вище. Приклади арилтіогруп включають фенілтіо і нафтилтіо. "(М-карбамоїл)циклічний амін" означає 5-7-членну циклоалкільну систему, в якій один з атомів вуглецю в циклі заміщений групою N-C(=O)-NH 2. Прикладом (N-карбамоїл)циклічного аміну є (N-карбамоїл)піперидиніл. "Бензил" означає феніл-СН2- групу, в якій фенільне кільце є незаміщеним або заміщеним одним або декількома замісниками незалежно обраними з алкілу, алкокси, галогену і галогеналкілу. "Циклоалкеніл" означає не ароматичну моноціклічну або поліциклічну систему, що має подвійний вуглецьвуглецевий зв'язок і має приблизно від 3 до 10 атомів вуглецю. Кращі моноциклічні циклоалкеніли включають циклопентеніл, циклогексеніл або циклогептеніл; найкращим є циклопентеніл. Кращим поліциклічним циклоалкенілом є норборненіл. Циклоалкенільна група може бути заміщена одним або декількома атомами галогену, метиленом (Н2С=) або алкілом. "Циклоалкіл" означає неароматичну моноциклічну або поліциклічну систему, що має приблизно від 3 до 10 атомів вуглецю. Приклади моноциклічних циклоалкілів включають циклопропіл, циклопентил, циклогексил і циклогептил. Кращі моно циклічні циклоалкіли для R18 включають циклопентил і циклогексил. Кращий моноциклічний . циклоалкіл для R19 включає циклопропіл. Приклади поліциклічних циклоалкілів включають пергідронафтил, адамант-(1- або 2-)іл і норборніл і спіробіциклічні групи, наприклад спіро[4,4]нон-2-іл. Циклоалкільна група може бути заміщена одним або декількома атомами галогену, метиленом (Н2С) або алкільними групами. "Циклоалкілокси" означає циклолалкіл-О-групу, в якій циклоалкільна група така, як визначено вище. Приклади циклоалкілокси-груп включають циклопентилокси і циклогексилокси. "Циклокарбамоїлалкіл" означає групу формули в якій циклокарбамоїльна група складається з оксооксазагетероциклічної частини, а алкільна група така, як описано вище. Алкільна група може бути приєднана до карбамоїлу або через атом вуглецю, або через атом азоту карбамоїлу. Прикладом циклокарбамоїлалкильної групи є N-оксазолідинілпропіл. "Циклоімідил" означає групу формули в якій імідна група включає оксодіазагетероциклічну частину, а алкільна група така, як описане вище. Алкільна група може бути приєднана до карбамоїлу або через атом вуглецю, або через атом азоту карбамоїлу. Прикладом імідалкільної групи є N-фталімідпропіл. "Гало" і "галоген" означає фтор, хлор, бром або йод. Кращими є атоми фтору, хлору або брому і найкращі фтор або хлор. "Галогеналкіл" означає визначену вище алкільну груп у, заміщену одним або декількома атомами галогену. Представники галогеналкільних груп включають хлорметил, брометил, трифторметил і подібні. "Гетероароїл" означає групу гетероарил-СО-, в якій гетероарильна група така, як визначено вище. Прикладом гетероароїльної групи є піридилкарбоніл. Тетероарил" як група або частина групи означає необов'язково заміщену моноциклічну або поліциклічну ароматичну вуглеводневу систему, що містить приблизно від 5 до 10 атомів вуглецю, в якій один або декілька атомів і/або груп кільця відрізняються від вуглецю, будучи, наприклад, атомом азоту, кисню або сірки. Тетероарил" також може бути заміщений одним або декількома замісниками арильної групи. Приклади відповідних необов'язково заміщених гетероарильних груп включають фурил, ізоксазоліл, ізохінолініл, ізотіазоліл, 1,2,3-оксадіазол, 1,2,4-оксадіазол, 1,2,5-оксадіазол, 1,3,4-оксадіазо.п, піридазиніл, піридил, піримідиніл, хінолініл, 1,3,4-тіадіазоліл, тіазоліл, тієніл і 1,2,3- і 1,2,4-триазолільні групи, необов'язково заміщені одним або декількома замісниками арильної групи, що визначені вище. Коли R18 або R19 містять необов'язково заміщену гетероарильну груп у, вона зокрема може бути необов'язково заміщеною "азагетероарильною групою" (де термін "азагетероарильний" означає гетероарильну групу, що містить приблизно від 5 до 10 атомів, із яких один або декілька атомів кільця є атомом (атомами) азоту). Необов'язкові замісники для гетероарильної групи в межах R18 або R19 включають, наприклад, атоми галогену і алкіл, арил, арилалкіл, гідрокси, оксо, гідроксиалкіл, галогеналкіл (наприклад трифторметил), алкокси, галогеналкокси (наприклад трифторметокси), арилокси і арилалкілокси-групи. Кращі гетероарильні групи в межах R18 включають необов'язково заміщений тієніл, тіазоліл, піридил, 1,2,4оксадіазол або 1,3,4-оксадіазол. Кращі гетероарильні групи в межах R19 включають необов'язково заміщений піридил. "Гетероарилалкеніл" означає гетероарил-алкенільну груп у, в якій гетероарил і алкеніл такі, як визначено вище. Краще гетероарилалкеніли містять нижчу алкенільну груп у. Прикладом гетероарилалкенільної групи є 4-піридилініл. "Гетероарилалкіл" означає гетероарил-алкільну групу, в якій гетероарил і алкіл такі, як визначено вище. Краще гетероарилалкіли містять нижчу алкенільну груп у. Прикладом гетероарилалкільно групи є 4піридилмеїл. "Гетероарилалкілокси" означає гетероарилалкіл-O-rpyny, в якій гетероарилалкільна група така, як визначено вище. Прикладом гетероарилалкілокси-групи є 4-піридилметилокси. Тетероарилалкілоксиалкеніл" означає гетероарилалкіл-О-алкенільну групу, в якій гетероарилалкіл і алкеніл такі, як визначено вище. Прикладом гетероарилалкілоксиалкенільної групи є 4-піридилметилоксіаліл. "Гетероарилалкілоксіалкіл" означає гетероарилалкіл-О-алкільну груп у, в якій гетероарилалкіл і алкіл такі, як визначено вище. Прикладом гетероарилалкілоксіалкільної групи є 4-піридилметилоксіетил. "Гетероарилалкініл" означає гетероарилалкінільну груп у, в якій гетероарил і алкініл такі, як визначено вище. Кра ще гетероарилалкініли містять нижчу алкінільну груп у. Прикладом гетероарилалкінільної групи є 4піридилетиніл. "Гетероциклічний радикал" означає моноциклічну або поліциклічну систему, що має приблизно від 4 до 10 атомів у циклі, в якій один або декілька атомів у циклічній системі відрізняються від вуглецю, причому їх вибирають серед атомів азоту, кисню або сірки. Гетероциклічний радикал необов'язково може бути заміщений одним або декількома замісниками алкільної групи. Приклади гетероциклічних радикалів включають хінуклідин, пентаметиленсульфід, тетрагідропіраніл, тетрагідротіофеніл, піролідиніл, піперідиніл або тетрагідрофураніл. Тетероциклілалкіл" означає гетероцикліл-алкільну гр упу, в якій гетероцикліл і алкіл такі, як визначено вище. Краще гетероциклілалкіл містить нижчу алкільну груп у. Прикладом гетероциклілалкільної групи є тетрагідропіранілметил. "Гетероциклілалкілоксиалкіл" означає гетероциклілалкіл-О-алкільну груп у, в якій гетероциклічний радикал і алкіл незалежно є такими, як визначено вище. Прикладом гетероциклілалкілоксіалкільної групи є тетрагідропіраніл-метилоксиметил. "Гідроксіалкіл" означає НО-алкільну групу, в якій алкіл такий, як визначено вище. Краще гідроксіалкіли містять нижчу алкільну гр упу. Приклад гідроксіалкільної групи включає гідроксиметил і 2-гідроксіетил. Термін "частково насичений біциклоарил" означає групу, в якій арильна і циклоалкільна група конденсовані разом з утворенням біциклічної структури. Приклади арилалкільних груп включають інданіл і тетрагіронафтил, особливо інданіл. Спосіб одержання альдегідів і кетонів за даним винаходом поданий на Схемі 1, із якій R a і Rb незалежно є будь-якою аліфатичною або ароматичною групою, сумісною з розчинниками і реагентами, що застосовуються в описаних тут способах. Групи Ra і Rb можуть бути додатково заміщені і можуть містити функціональні групи, які підходять для подальших хімічних перетворень, перебуваючи зв'язаними з гідроксиламіновою смолою. Зрозуміло, що коли ці функціональні групи мають таку реакційну здатність, що вони потенційно можуть вступати в описані нижче реакції, такі функціональні групи необхідно відповідно захищати. Вичерпна інформація про захист і видалення захисту звичайних функціональних груп наведена в Т.Н. Green, P.G.N. Wuts, Protective Groups in Organic Synthesis, 2nd edition, John Wiley & Sons, New York (1991), яка включена в опис в якості посилання. Rc є будь-якою аліфатичною або ароматичною групою, сумісною з використанням в якості металоорганічного реагенту. Відповідно до наведеної вище Схеми 1 полімерну смолу гідроксиламіну 1 піддають сполученню з похідним карбонової кислоти формули RaCOOH, з одержанням полімерної смоли гідроксамової кислоти 2. Реакцію сполучення здійснюють в присутності активуючого агента, який відомий в області пептидного синтезу. Представники активуючих агентів включають ізопропілхлорформіат, діізопропілкарбодиімід (DIC), 1-(3диметиламіно-пропіл)-3-етилкарбодиімід (EDC), 1-гідроксибензотріазол (НОВТ), біс(2-оксо-3-оксазолідиніл)фосфоний хлорид (BOP-СІ), бензотріазол-1-ілокси-тріс((диметил аміно)фосфоній)гексафторфосфат (ВОР), бензотріазол-1 -ілокси-тріс-піролідинофосфоній гексафторфосфат (PyBROP), бром-тріс-піролідинофосфоній гексафторфосфат (Рувор), 2-(1 н-бензотріазол-1-іл)1,1,3,3-тетраметилуроній тетрафторборат (TBTU), 2-(1 Нбензотріазол-1-іл)-1,1,3,3-тетраметилуроній гексафторборат (HBTU), 2-[2-оксо-1-(2Н)-піридил]-1,1,3,3біспентаметиленуроній тетрафторборат (TOPPipU), Ν,Ν'-дициклогексилкарбодиімід (DCC) і подібні. Відповідні розчинники для цієї реакції сполучення включають дихлорметан, диметилформамід (ДМФ), диметилсульфоксид, тетрагідрофуран (ТГФ) і подібні. Час реакції сполучення змінюється приблизно від 2 до 24 годин, в залежності від сполучуваних смоли і похідного карбонової кислоти, активуючого агента, розчинника і температури. Сполучення проводять при температурі приблизно від -10 до 50сС, краще при кімнатній температурі. Краще реакцію сполучення проводять при кімнатній температурі в диметилформаміді, використовуючи гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодиімід протягом приблизно біля 12 годин. Потім, полімерну смолу гідроксамової кислоти 2 алкілювали алкілювальним агентом формули RbLG, де LG є відхідною групою в присутності такої ненуклеофільної основи, як 1,8-діазабіцикло[5.4.0.]ундец-7-ен (DBU) в середовищі такого інертного органічного розчинника, як толуол, з утворенням полімерної смоли N-алкілованої гідроксамової кислоти 3. Кількість алкилувального агента RbLG, що додається, може змінюватися в інтервалі від еквімолярного до надлишкового, що складає, приблизно, 25 молярних еквівалентів. Кращим є надлишок, приблизно, 15 молярних еквівалентів. Ненуклеофільна основа може добавлятися в кількості від еквімолярної до надлишкової, що складає, приблизно, 10 молярних еквівалентів. Кращою є кількість, біля, 5 молярних еквівалентів. Відхідна група є будь-якою групою, здатною до нуклеофільного заміщення атомом азоту полімерної смоли гідроксамової кислоти 2 в описаних ви ще умовах проведення реакції. Краща відхідна група є галогеном. Для того, щоб засвідчитися в задовільному протіканні реакції, зразок полімерної смоли Nалкілованої гідроксамової кислоти 3 може бути підданий ацидолізу з метою розщеплення заміщеної гідроксамової кислоти. Реакція полімерної смоли N-алкильованої гідроксамової кислоти 3 із металоорганічним реагентом формули RсM, в якій Rc є аліфатичним або ароматичним аніоном, а М є катіоном металу, з наступним кислотним гідролізом, дає кетон 4. Кращими металоорганічними реагентами можуть служити літійорганічні реагенти формули RcLi, a також реагенти Гриньяра формули RcMg X, де X є галогеном. У кращому способі одержання кетонів відповідно до цього аспекту винаходу, полімерну N-алкіловану смолу гідроксамової кислоти 3 обробляють RcMgX в середовищі діетилового ефіру, при температурі навколишнього середовища протягом, приблизно, 18 годин, і потім реакційну суміш гасять додаванням водного розчину НСІ, або водного розчину KHSO4 , для виділення кетону 4. Альдегіди одержують обробкою полімерної смоли N-алкильованої гідроксамової кислоти 3 гідридним відновлюючим агентом з наступним кислотним гідролізом, як показано на приведеній вище схемі 1. Прикладами гідридних відновлюючих агентів можуть служити LіАІН4, (ізо-Вu)2АІН, LіАІН(О-трет.-ВU)3, Li AIH 4EtOH, LiAIH 4-MeOH і подібні. Кращими відновлюючими агентами є LiAIH4 і LiAIH4-MeOH. Кислотний гідроліз, краще, проводять за допомогою водного розчину KHSO4. Як показано на схемі 1 полімерна смола N-алкильованої гідроксамової кислоти 3 є речовиною подібною аміду Weinreb, що використовується для синтезу альдегідів і кетонів (S. Nahm і S. Weinreb, Tet. Lett. 1981, 22, 3815-3818). Така полімерна смола N-алкильованої гідроксамової кислоти має переваги перед відомими раніше прикладами смоли, зв'язаної з амідами типу Weinreb (J.-A. Fehrentz, M. Paris, A. Heitz, J. Veiek, C.-F. Liu, F. Winternitz і J. Martinez. Tet. Lett., 1995, 36, 7871-7874. b) T.Q. Dinh і R.W. Armstrong, Tet. Lett., 1996, 37, 1161-1164), які полягають в тому, що така сполука може бути N-алкильована об'ємними ліпофільними групами, такими як бензил, заміщений бензил, нафтил або алкільна група, необхідними для оптимізації реакції у твердій фазі. Так наприклад, N-бензил-О-метилполістирильна частина дуже підходить для утворення стійкого метал-хелатованого проміжного продукту. Припускають, що ліпофільна бензильна група допомагає захищати хелат і забезпечує його стійкість. Кращий спосіб одержання альдегідів і кетонів поданий на Схемі 2. В Схемі 2, "Р" є амінозахисною групою, що має зазначені вище значення. Як показано на наведеній вище схемі 2, полімерну смолу гідроксиламіну захищають за допомогою амінозахисної групи з утворенням N-захищеної полімерної смоли гідроксиламіну 6. Потім полімерну смолу Nзахищеного гідроксиламіну 6 алкілюють, відповідно до наведеної вище схеми 1 з утворенням полімерної смоли N-алкілованого N-захищеного гідроксиламіну 7. Видаленням амінозахисної групи одержують полімерну смолу N-алкілованого гідроксиламіну 8 Як показане вище, взаємодія 8 із карбоновою кислотою приводить до утворення полімерної смоли N-алкильованої гідроксамової кислоти 3, яку перетворюють в кетон 4 або альдегід 5, як показано на наведеній вище схемі 1. Кращі амінозахисні групи включають алілоксикарбоніл (АІос), бензилоксикарбоніл (Cbz), пметоксибензилоксикарбоніл (Moz), п-нітробензилоксикарбоніл (4-NO2-Z), триметилсилілетоксикарбоніл (Теос), 2,4-диметилоксибензилоксикарбоніл, о-нітробензилоксикарбоніл, о-нітробензилсульфоніл (o-Nbs), пнітробензилсульфоніл (р-Nbs), і 2-нітро-4-трифторметилбензолсульфоніл. Найкраща амінозахисна група є алілоксикарбонілом. Кращі полімерні смоли N-захищеного гідроксиламіну включають: смолу М-алілоксикарбоніл-4-(0-метилгідроксиламін)-феноксиметил-співполімера(стирол-1% дивінілбензол), смолу алілоксикарбоніл-4-[4-(О-метилгідроксиламін)-3-метоксифенокси]-(N-4-метилбензгідрил)-бутирамідспівполімера(стирол-1% дивінілбензол), смолу N-алiлоксикарбонт-4-(2',4'-диметоксифент-O-метил-пдроксиламiн)-феноксиметілспівполімера(стирол-1% дивінілбензол), смолу N-алілоксикарбоніл-4-[4-(1-аміноксиетил)-2-метокси-5-нітрофенокси](N-4-метилбензгідрил)бутирамід-співполімера(стирол-1% дивінілбензол), смолу N-алілоксикарбоніл-О-гідроксиламін-2'-хлоротритіл-співполімера (стирол-1% дивінілбензол, смолу N-алілоксикарбоніл-О-гідроксиламин-тритіл-співполімера (стирол-1% дивінілбензол, смолу N-алілоксикарбоніл-5-(4-O-метилгідроксиламін-3,5-диметоксифенокси)-валеріанова кислотаспівполімерастирол-1% дивінілбензол, смолу N-алілоксикарбоніл-4-O-метилгідроксиламін-3-метоксифенокси-співполімер(стирол-1% дивінілбензол), смолу N-алілоксикарбоніл-4-(О-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметіл-співполімера(стирол1% дивінілбензол), смолу N-алілоксикарбоніл-4-(2',4'-диметоксифеніл-О-метил-гідроксиламін) -2,3,5,6тетрафтор феноксиметіл-співполімера(стирол 1% дивінілбензол) і смолу N-алілоксикарбоніл-3-гідрокси-ксантидроламін-співполімерстирол-1% дивінілбензол. Найкраща полімерна смола N-захищеного гідроксиламіну є смолою N-алілоксикарбоніл-4-(0метилгідроксиламін)феноксиметил-співполімера(стирол-1% дивінілбензол). В тому випадку, коли сполука карбонової кислоти RaCO2H є природною або синтетичною амінокислотою, або пептидом, способи, описані на схемах 1 і 2, забезпечують легкий шлях одержання альдегідів амінокислоти або пептиду, який раніше вважався утрудненим. Спосіб одержання амінів відповідно до даного винаходу поданий на Схемі 3. На схемі 3, Rd і Re, незалежно є Η або будь-якою аліфатичною або ароматичною групою, стійкою до дії розчинників і реагентів, що використовувалися в описаних способах, за умови, що обидва радикали R c і Rd не є Н. Групи Ra, Rb і Rc можуть бути додатково заміщені і можуть містити функціональні групи, які підходять для подальших хімічних трансформацій, будучи приєднаними до гідроксиламінової смоли. Варто мати на увазі, що в тому випадку, коли такі функціональні групи мають реакційну здатність і, потенційно, можуть вступати в описані нижче реакції, такі функціональні групи повинні бути захи щені належним чином. Загальний огляд захисту і зняття захисту для традиційних функціональних груп поданий у Т.Н. Greene і P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd edition, John Wiley & Sons, New York (1991), яка включена тут в якості посилання. Rf є будь-якою аліфатичною або ароматичною групою, яка підходить для застосування в якості частини металоорганічного реагенту. Відповідно до наведеної вище схеми 3, реакція полімерної смоли гідроксиламіну 1 з альдегідом або кетоном 9 приводить до одержання полімерної смоли простого ефіру оксима 10. Краще, утворення оксима відбувається при температурі навколишнього середовища в результаті набрякання полімерної смоли гідроксиламіну 1 в такому відповідному інертному органічному розчиннику, як дихлорметан, із наступним додаванням надлишку альдегіду або кетону. Відровне розщеплення смоли, наприклад, реакцією з NaCNBH3, або ВН3×THF, і наступна реакція з LіАІН4 дає амін 11. Реакція полімерної смоли простого ефіру оксима 10 із металоорганічним реагентом формули RfM, де Rf є аліфатичним або ароматичним аніоном, а М є зазначеним вище катіоном металу, дає полімерну смолу α-заміщеного гідроксиламіну 12. Відщеплення α-аміну13 від смоли здійснюють, наприклад, із використанням BH3THF або LiAIH4 . Див. Y.Ukaji з співр., Chem. Lett., 173, (1991) і R.P. Dieter з співр.. Can. J. Chem. 71, 814 (1993). Кращі катіони металу є Li і МgХ, де X є галогеном. Додавання такого хірального допоміжного агента, як хіральний лінкер бензилгідроксиламін, дають хіральні αзаміщені аміни. На схемі 4 показаний спосіб одержання лактонів радикальною циклізацією. На схемі 4, Rg , Rb і Ri є аліфатичною групою або арилом, що мають зазначені вище значення. О. Як показано на наведеній вище схемі 4, полімерна смола гідроксиламіну і реагує з α,β-ненасиченим складним ефіром карбонової кислоти 14 з утворенням сполуки полімерної смоли оксима 15. Радикальна циклізація 15, наприклад, нагріванням у присутності 2,2'-азобісізобутиронітрилу (АІБН) і тіофенолу, в середовищі такого інертного органічного розчинника, як бензол, приводить до утворення полімерної смоли gлактона 16. В результаті кислотного гідролізу 16, з використанням, наприклад, 10% водного розчину НСІ, одержують лактон 17. Див. О. Mi yata з співр., Tet. Lett., 37, 229-232 (1996). На схемі 5 зображений спосіб одержання карбоциклічних або гетероциклічних сполук шляхом радикальної циклізації. Rj, Rk і R1 на схемі 5 представляють аліфатичні або арильні групи, визначені вище. Методика, описана на схемі 1, може бути застосована для одержанні 5-, 6- або 7-членних кілець. Карбоцикли одержують при заміні фенольного кисневого атома атомом вуглецю. За наведеною вище схемою 5, полімерна смола гідроксиламіна 1 реагує з ацетофеноном 18 і бромалкеном або о-бромбензилом з утворенням полімерного оксима ацетофенона 19 або 23. Радикальна циклізація 19 або 23, наприклад, нагріванням у присутності АІБН і гідриду три-н-бутилолова, в середовищі такого інертного органічного розчинника, як бензол, приводить до утворення полімерної смоли N-цикліл гідроксиламіну 20 або 24. Обробка 20 або 24 кислотою, краще, трифтороцтовою кислотою, приводить до утворення циклічної гідроксамової кислоти 21 або 25. Відновне розщеплення 20 або 24, наприклад, із використанням LiAIH4, як описано для схеми 3 вище, приводить до утворення циклічного аміну 22 або 26. Див. S.E. Booth зспівр., J. Chem. Soc. Conunun., 1248-1249, (1991). Спосіб одержання гідроксамової кислоти формули 29, в якій n і групи Аr, A2 , R9, R10 , R11 і R12 мають зазначені вище значення, показаний на схемі 6. а) 3-(4-метилоксифентсульфоніл)пропіонова кислота (5екв.); гідрохлорид 1-(3-диметиламінопропіл)-3-етил карбодиіміду (EDCI, 5екв.); D MF, 25°С; 12 годин. b) 50% TFA в СН2СІ2(100екв.); 30 хвилин. За наведеною вище схемою 6, карбонову кислоту 27 зв'язують із полімерною смолою гідроксиламіну J,, як показано вище на схемі 1, з утворенням полімерної смоли гідроксамової кислоти 28. Потім, полімерну смолу гідроксамової кислоти 28 обробляють такою кислотою, як трифтороцтова кислота (TFA) у середовищі такого інертного розчинника, як дихлорметан з одержанням гідроксамової кислоти 29. Необхідно використовувати підвищені процентні кількості TFA (трифтороцтової кислоти) і тривалі часи реакції з тим, щоб відщепити гідроксамову кислоту від смоли типу Wang у порівнянні зі смолою типу Rink. В процесі випарювання TFA при обробці, проведеної для виділення гідроксамової кислоти, було встановлено, що нагрівання зразка в процесі концентрування приводить до утворення, в якості побічного продукту, значної кількості N,O-діацильованого димеру батьківської гідроксамової кислоти. З метою мінімізації такої побічної реакції, реакційну суміш концентрують при кімнатній або більш низькій температурі, в присутності толуолу, який використовується для утворення азеотропу. Спосіб твердофазного синтезу карбонової кислоти 27 показаний на схемі 7. На схемі 7, Аr, A2, n, R9, R10, 11 R і R12 мають зазначені вище значення. Наприклад, полімерну гідроксисмолу 30 обробляють діетилфосфонооцтовою кислотою в середовищі такого інертного розчинника, як диметилформамід у присутності хлористого 2,6-дихлорбензоїлу і піридину, при температурі близькій до комнатной з утворенням сполуки полімерної діетилфосфоноацетокси смоли 31. Полімерну смолу діетилфосфоноацетокси 31. обробляли такою основою, як біс(триметилсиліл)амід у середовищі такого інертного розчинника, як толуол, при температурі біля 0°С, із наступною обробкою альдегідом формули R11CHO, де R11 мас зазначене вище значення, при температурі близькій до температури навколишнього середовища, з утворенням полімерної алкеноатної смоли 32. Потім, полімерна смола алкеноату 32 реагувала з тіолом формули Ar-A2-SH; де Аr і А2 мають зазначені вище значення, з утворенням полімерної смоли алканоату 33 Приєднання звичайно проводять у м'яких основних умовах, наприклад, у присутності гідрооксиду літію, при температурі навколишнього середовища. Потім, полімерна смола алканоату 33 може бути гідролізована обробкою такою кислотою, як трифтороцтова кислота, в середовищі такого інертного розчинника, як дихлорметан з одержанням кислоти 35, де n дорівнює 0. Альтернативно, полімерна смола алканоату 33 може бути оброблена таким окисляючим агентом, як мхлор-пербензойна кислота в середовищі такого інертного розчинника, як діоксан, при температурі близькій до температури навколишнього середовища з утворенням сполуки полімерної смоли сульфоксиду (n=1) або сульфону (n=2) 34. В результаті гідролізу сполуки 34, як зазначено вище, одержують карбонову кислоту 35. На схемі 8 показано одержання полімерної смоли гідроксиламіну 1 За наведеною вище схемою 8, полімерну гідроксисмолу 30 перетворюють у полімерну Nгідроксифталімідосмолу 36 взаємодією з N-гідроксифталімідом в умовах Mitsunobu (Mitsunobu, O., Synthesis 1981, 1), перетворенням гідрокси групи в таку відхідну гр упу, як мезилат, із наступним нуклеофільним заміщенням, або реакцією полімерної гідрооксисмоли з N-гідроксифталімідом у присутності такої кислоти, як бензолсульфокислота. В результаті видалення фталімідогрупи одержують полімерну смолу гідроксиламіну. Так наприклад, коли 30 є смолою 4-(гідроксиметил)феноксиметил-співполімера(стирол-1% дивінілбензол) (смола Wang), N-гідроксифталімід зшивається зі смолою в присутності діізопропілазодикарбоксилату і трифенілфосфіну в ДМФ. Фталімідний захист видаляють метиламінолізом у ТГФ при 40°С. Реакция завершується за 2 години. Застосування метиламіну для відщеплення фталімідного захисту дає значну перевагу в порівнянні з традиційно застосовуваним методом гідразинолізу (Wolf з співр., Can. J.Chem., 48, 3572, (1970). При використанні смоли 4-(2',4'-диметоксифеніл-О-метилгідроксиламін)феноксиметілспівполімеру(стирол-1% дивінілбензол) (смола Rink), сполуку 1 краще одержують за реакцією полімерної гідроксисмоли з N-гідроксифталімідом у середовищі ДМФ, в присутності каталітичної кількості бензолсульфокислоти з утворенням полімерної смоли N-гідроксифталіміду 36. Потім, фталімідозахисну гр упу видаляють за реакцією з гідразингідратом у середовищі трет.-бутанолу при 60°С з утворенням відповідної полімерної смоли гідроксиламіну. Альтернативний шлях одержання полімерної смоли N-захищеного гідроксиламіну 6 показаний на схемі 9. За наведеною вище схемою 9 полімерну гідроксисмолу 30 зв'язують із Ν,Ν-дизаміщеним гідроксиламіном 37, в якому Ρ и Р' є амінозахисними групами, як це показано вище на схемі 8, з утворенням смоли Ν,Nзахищеного гідроксиламіну 38. Потім, амінозахисну гр упу Р' селективно видаляють з утворенням полімерної смоли Ν-захищеного гідроксиламіну 6. Відповідно до кращого варіанту синтезу, який описаний на схемі 9, Ρ є бензилом, а Р' є алілоксикарбонілом. Селективне видалення алілоксикарбонільної захисної групи здійснюють обробкою тетракис(трифенілфосфін)паладієм(О). N,N-дизахищений гідроксиламін 37 одержують послідовним введенням захисних груп Ρ і Р' в О-захищений гідроксиламін формули Η 2ΝΟΡ2, де Р2 є гідроксизахисною групою. Краща гідроксизахисна група ε алкілом. Потім вводять амінозахисні групи Ρ і Р', із використанням реагентів і умов проведення реакцій, що добре відомі в області органічного синтезу. Так наприклад, реакція О-трет.-бутилгідроксиламіну з алілоксихлорформіатом приводить до утворення N-алілоксикарбоніл-О-трет.-бутилгідроксиламіну, який потім реагує з бромистим бензилом з утворенням N-бензил-N-алілоксикарбоніл-О-трет.-бутилгідроксиламіну. В результаті обробки N-бензил-N-алілоксикарбоніл-О-трет.-бутилгідроксиламіну трифтороцтовою кислотою одержують N-бензил-N-алілоксикарбонілгідроксиламін. На схемі 10 показане одержання полімерної смоли 4-(0-метилгідроксиламін)-2,3,5,6тетрафтор феноксиметилу. Відповідно до наведеної вище схеми 10, полімерна хлорметильна смола, така як хлорметилполістирол (39, смола Merrifield.) реагує з 4-гідрокси-2,3,5,6-бензойною кислотою в присутності основи з утворенням 4карбокси-2,3,5,6-тетрафторфеноксиметильної смоли 40. Відновленням карбоксильної кислотної групи, наприклад, з використанням LіАІН4, гідриду діізобутилалюмінія, або ВН 3-ТГФ, одержують 4-гідроксиметил2,3,5,6-тетрафторфеноксиметильну смолу 41. В результаті перетворення 41. в сполуку гідроксифталімідо смоли 42, з наступним видаленням фталімідо групи, як показано вище на схемі 8, одержують смолу 4-(Ометилгідроксиламін)-2,3,5,6-тетрафторфеноксиметил-співполімеру(стирол-1% дивінілбензол) 43. Одержання полімерної смоли 4-(2',4'-диметоксифеніл-O-метилгідроксиламін)~ 2,3,5,6тетрафтор феноксиметилу показано на схемі 11. Відповідно до наведеної вище схеми 11, полімерна хлорметильна смола реагує з 4-фенокси-2,3,5,6тетрафтор феніл 2,4-диметоксифеніл кетоном 44 в присутності основи, як показано вище на схемі 10, з утворенням сполуки 4-(2',4'-диметоксифенілкарбоніл)-2,3,5,6-тетрафторфеноксиметильної смоли 45. Відновлення карбонільної групи, із використанням, наприклад, LiBH4, приводить до утворення 4(гідроксиметил-2',4'-диметокси-феніл)-2,3,5,6-тетрафторфеноксиметильної смоли 46. Перетворення 46 в гідроксифталімідо смолу 47, з наступним видаленням фталімідогрупи, як показано вище на схемі 8, приводить до одержання 4-(2',4'-диметоксифеніл-O-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметильної смоли 48. Кращі полімерні смоли гідроксиламіну формули 1, в якій L є зв'язуючою групою. Кращі зв'язуючі гр упи L мають формулу: в якій А відсутня або є групою -X1-Z- де X1 є -CHR- або -CHR-Y-CO-(CH 2)n-; де R є Н, алкілом, фенілом, або феніл, заміщеним -Н, алкілом, алкокси, галогеном, нітрилом або -NO2, Υ є -О- або -ΝΗ-, n є цілим числом від 1 до 6, а Ζ є -О- або -ΝΗ-; R1, R1a , R2 і R 2a, незалежно є -Н, алкілом, алкокси, галогеном, нітрилом або -NO2; a R3 і R4, незалежно один від одного, є -Н, алкілом, фенілом; або феніл, заміщений одним або більше замісниками, обраними з алкілу, алкокси, галогену, нітрилу і -NO2; або один із R1 і R2, разом з одним із R3 і R4 і вуглецевими атомами, до яких вони приєднані, утворять зв'язуючу гр упу формули: в якій R1 є - Н, алкілом, алкокси, галогеном, нітрилом або - NO2; a R6, R7 і R8 , незалежно вибирають із - Н, алкілу, алкокси; галогену, нітрилу або -NO2 . Приклади кращих полімерних смол гідроксиламіну включають 4-(О-метилгідроксиламін)феноксиметилспівполімер(стирол-1 % дивінілбензольну) смолу формули 4-[4-(O-метилгідроксиламін)-3-метоксифенокси]-(N-4-метилбензгідрил)-бутирамід-співполімер(стирол-1% дивінілбензольну) смолу формули 4-(2',4'-диметоксифеніл-О-метилгідроксиламін)-феноксиметіл-співполімер(стирол-1% смолу формули дивінілбензольну) 4-[4-(1-аміноксіетил)-2-метокси-5-нітрофенокси]-(N-4-метилбензгідрил)-бутирамід-співполімер(стирол-1% дивінілбензольну) смолу формули O-гідроксиламін-2'-хлоротритил-співполімерстирол-1%-дивінілбензольну смолу формули О-гідроксиламін-тритил-співполімерстирол-1%-дивінібензольну смолу формули 5-(4-O-метилгідроксиламін-3,5-диметоксифенокси)-валеріанова дивінібензольну смолу формули кислота-співполімерстирол-1% 4-O-метилгідроксиламін-3-метоксифенокси-співполімерстирол-1%-дивінібензольну смолу формули 3-гідрокси-ксантидроксиламін-співполімерстирол-1%-дивініл-бензольну смолу формули 4-(O-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметил-співполімер(стирол-1%-дивінілбензольну) смолу формули 4-(2',4'-диметоксифенiл-O-метилпдроксилам1н)-2,3,5,6-тетрафторфеноксиметил-співполімер(стирол-1% дивінілбензольну) смолу формули Найкращі полімерні смоли гідроксиламіна є: 4-(O-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметил-співполімер(стирол-1% дивінілбензольну) смолу, 4-(2',4'-диметоксифеніл-О-метилгідроксиламін)-2,3,5,6-тетрафторфеноксиметіл-співполімер(стирол-1% дивінілбензольну) смолу, 4-(О-метилгідроксиламін)феноксиметіл-співполімер(стирол-1% дивінілбензольну) смолу, і 4-(2',4'-диметоксифеніл-О-метилгідроксиламін)-феноксиметіл-співполімер(стирол-1% дивінілбензольну) смолу. Спосіб Rink (Η. Rink, Tet. Lett., 28, 3787-3790, 1987) має перевагу, яка полягає в тому, що розщеплення можна проводити в умовах м'якого ацидоліза протягом коротких періодів часу (наприклад, 10% TFA у DCM, протягом 10-15 хвилин). Однак через вартість смоли бажано синтезувати відповідну функціональну смолу на твердому носії Wang ((a) S.S. Wang, J. Am. Chem. Soc, (1973), 95, 1328. b) G. Lu, S. Mojsov, J.P. Tarn, і R.B. Merrifield, J. Org. Chem., (1981), 46, 3433). Особливо придатним є тетрафтор фенілфенільний спосіб, оскільки, сам по собі, він пристосований для кількісного визначення наповнення смоли і моніторингу реакцій, які протікають на смолі, з використанням фтор ЯМР. Описані способи застосовні також для одержання пептидних альдегідів, кетонів і гідроксамових кислот. Як правило, такий спосіб включає взаємодію карбоксильної групи, належним чином N-захищеної першої амінокислоти зі смолою з утворенням полімерної смоли N-захищеної амінокислотної гідроксамової кислоти. Потім амінокислотну N-захисну гр уп у видаляють і смолу незахищеної полімерної амінокислотної гідроксамової кислоти приводять у взаємодію з другою, належним чином N-захищеною, амінокислотою. Такий процес повторюють доти, поки бажані амінокислотні залишки не проникнуть в пептид. Альтернативно, пептиди, що мають велике число амінокислот, одержують взаємодією належним чином Nзахищених пептидних підодиниць, які містять дві або більш амінокислоти з утворенням полімерної смоли Nзахищеної пептидной гідроксамової кислоти. Потім амінокислотну N-захисну груп у видаляють, і смолу незахищеної полімерної пептидної гідроксамової кислоти зв'язують із другою, належним чином N-захищеною, амінокислотою або пептидом. Таким чином, крім описаного вище послідовного приєднання індивідуальних амінокислотних підодиниць, поліпептид може бути отриманий зв'язуванням пептидних підодиниць. Після введення бажаних амінокислот у пептид, полімерна пептидна гідроксамова кислота реагує з металоорганічним реагентом, після чого проводять кислотний гідроліз з утворенням пептидного кетону; який піддається відновному розщепленню з утворенням пептидного альдегіду; або розщеплюється кислотою з утворенням пептидної гідроксамової кислоти. Будь-які захисні групи, що залишилися, можуть бути видалені до або після відщеплення пептиду від смоли. Описані N-захисні групи, що придатні для застосування в пептидному синтезі, повинні мати властивості, які забезпечують стійкість в умовах реакції приєднання до полімерної смоли гідроксиламіну і здатність легко видалятися без деструкції зростаючого пептидного ланцюга або рацемізації будь-якого з хіральних центрів, які є в ньому. Відповідні захисні групи включають 9-фторенілметилоксикарбоніл (Fmoc), трет.-бутилокси-карбоніл (Воc), бензилоксикарбоніл (Cbz), бі фенілізопропілокси-карбоніл, трет.·амілоксикарбоніл, ізоборнілоксикарбоніл, (а,а)диметил-3,5-диметоксибензилоксикарбоніл, о-нітрофенілсульфеніл, 2-ціано-трет.бутилоксикарбоніл і подібні. Крім цього, така смола може застосовуватися для конструювання ранжированих рядів альдегідів, кетонів або амінів комбінаторних бібліотек або ранжированих рядів альдегідів або кетонів, в якості реагентів у синтезі комбінаторних бібліотек, наприклад, реагентів для конденсації Ugi-4-компонента (Ivar Ugi, у Isonitrile Chemistry, 1971, стор.145, Academic Press). Гідроксиламінзв'язана смола може застосовуватися не тільки для трансформацій однієї функціональної групи, але і для багатостадійного твердофазного синтезу з метою створення комбінаторних бібліотек. Функціоналізована смола за винаходом може також застосовуватися для паралельного синтезу ряду різних альдегідних, кетонних або амінних кінцевих продуктів, як це продемонстровано для кетонів на схемах 12а і 12b. На схемах 12а і 12b, Rb і Rc мають зазначені вище значення, η є цілим числом, що визначає загальне число різних альдегідних, кетонних або амінних продуктів, які необхідно одержати. Ral-Ran незалежно є аліфатичною або ароматичною групами, які мають зазначені значення. На схемі 12а зображений паралельний синтез ряду кеонних сполук, з використанням ряду карбонових кислот, RalCO2H-RanCO2H і єдиної металоорганічної сполуки RcMgX. За схемою 12а, смолу N-алкілованого гідроксиламіну 8, одержану за схемою 2, розділяють на η порцій. Потім, кожну порцію смоли з'єднують з карбоновою кислотою з утворенням π частин полімерної смоли N-алкільованої гідроксамової кислоти. Потім, кожна частина полімерної смоли n-алкільованої гідроксамової кислоти реагує з реагентом Гріньяра формули RcX і піддається кислотному гідролізу з одержанням η частин кетону, що є похідним єдиного металоорганічного реагенту. Схема 12b Паралельний синтез η різних кетонних сполук, похідних єдиної карбонової кислоти R aCO2H і η різних металоорганічних сполук від RdMgBr до Rxn MgBr поданий вище на схемі 12Ь. Відповідно до схеми 12b, полімерну смолу N-алкілованого гідроксиламіна з'єднують із карбоновою кислотою формули RaCO2H. Потім, отриману полімерну смолу N-алкілованої гідроксамової кислоти поділяють на η частин, іпотім кожна частина полімерної смоли N-алкілованої гідроксамової кислоти реагує з різними реагентами Гріньяра Rd-RcnMgBr і піддається кислотному гідролізу з одержанням η різних кетонів, похідних єдиної карбонової кислоти. Функціоналізовані смоли за даним винаходом можуть також застосовуватися для конструювання комбінаторної бібліотеки кетонів або амінів, як це проілюстровано на схемі 13 для кетонної бібліотеки, що є похідною 4 карбонових кислот і 4 реагентів Гріньяра. Відповідно до наведеної вище схеми 13 полімерну смолу N-алкілованого гідроксиламіну 8 поділяють на 4 частини, і кожну частину зв'язують із різною карбоновою кислотою для одержання 4 різних полімерних смол Nалкілованої гідроксамової кислоти, Потім, 4 частини полімерної смоли N-алкілованої гідроксамової кислоти змішують одна з одною, з утворенням однієї частини, яку далі поділяють на 4 частини полімерної смоли Nалкілованої гідроксамової кислоти, причому кожна частина має приблизно рівні кількості кожної індивідуальної полімерної смоли N-алкілованої гідроксамової кислоти. Кожна з 4 частин потім реагує з різними реагентами Ґріньяра RclRc4MgBr і піддається кислотному гідролізу з утворенням 4 частин кетону, кожна з яких має 4 сполуки, які є продуктами реакції кожною з 4 різних полімерних смол N-алкілованої гідроксамової кислоти з єдиним реагентом Гріньяра. За допомогою такого методу може бути швидко сконструйована комбінаторна бібліотека, що має ряд кетонів. Аналогічним способом, може бути зібрана комбінаторна бібліотека пептидів, в результаті повторення послідовності поділ-рекомбінація для кожного амінокислотного або пептидного будівельного блока. Поданий вище опис буде зрозуміліше за допомогою наступних прикладів, що наведені для ілюстрації винаходу і не призначені для обмеження об'єму винаходу. Приклад 1 Одержання смоли 4-(2',4'-диметоксифеніл-O-метилгідроксиламін)-феноксиметіл-співполімера(стирол -1% дивінілбензол) Смолі кислоти Rink (1г, 0,63ммоль) дають набухати в 10мл диметилформаміду (ДМФ) протягом 15хв., при кімнатній температурі. До суспензії смоли добавляють 514міг (3,15ммоль) N-гідроксифталіміду і потім 19мг бензолсульфокислоти (0,13ммоль). Суміш перемішують за допомогою механічної мішалки і нагрівають до 50°С протягом 5 годин. Потім суміш охолоджують до кімнатної температури і додатково перемішують протягом 12 годин, після чого смолу відфільтровують і ретельно промивають ДМФ (5 разів по 25мл); сумішшю ДМФ:вода (70:30; 5 разів по 25мл); ТГФ (10 разів по 25мл) і діетиловим ефіром (10 разів по 25мл). Потім смолу сушать протягом ночі в глибокому вакуумі при 40°С. У спектрі ІК виявлене поглинання карбонільної групи при 1773см-1, що відповідає області фталімідного карбонілу. Елементний аналіз: Обчислено 0,28% N. Знайдено 0,26% N. Завантаження складає 18ммоль/г. Смолі дозволяють набухати в 20мл трет-бутанолу протягом 10хв. До суміші добавляють 10мл гідразингідрату, і реакційну суміш нагрівають до 60°С з механічним перемішуванням протягом 12 годин. Після цього реакційну суміш охолоджують до кімнатної температури. Смолу відфільтровують і ретельно промивають ДМФ (10 разів по 2 мл); ТГФ (10 разів по 25мл) і діетиловим ефіром (10 разів по 25мл), потім смолу сушать протягом ночі в глибокому вакуумі при 40°С. В спектрі ІК смоли III відсутнє поглинання в області карбонільної групи при 1733см-1, що мало місце для вихідного матеріалу. Елементный аналіз: % N знайдено 0,43; 0,42% (відповідає рівню завантаження 0,3ммоль/г). Приклад 2 Одержання смоли N-[3-((4-метоксифеніл)сульфоніл)проп-1-ілкарбоніл]-4-(2',4'-диметоксифеніл-Oметилгідроксиламін)феноксиметіл-співполімера(стирол-1% дивінілбензол) Смолі 4-(2',4'-диметоксифеніл-O-метилгідроксиламін)феноксиметіл-співполімера(стирол-1% дивінілбензол) (200мг) дозволяють набуха ти в 3мл ДМФ. До цієї суспензії добавляють 610мг (2,5ммоль) 3-(4метоксифенілсульфоніл)пропіонової кислоти і 477мг (2,5ммоль) гідрохлориду 1-(3-диметиламіно-пропіл)-3етилкарбодиіміду (EDCI) при кімнатній температурі. Реакційну суміш струшують при кімнатній температурі, використовуючи ви хровий струшувач, протягом 12 годин, після чого смолу відфільтровують і ретельно промивають сумішшю ДМФ:вода (80:20; 5 разів по 5мл); ДМФ (5 разів по 5мл); ТГФ (5 разів по 5мл) і діетиловим ефіром (5 разів по 5мл). Потім смолу IV сушать протягом 12 годин у глибокому вакуумі при 40°С. У спектрі ІК виявлене поглинання карбонільної групи при 1675см -1, що відповідає ділянці зв'язаного гідроксамату. Приклад 3 Одержання N-гідрокси-3-(4-метоксифенілсульфоніл)-пропіонаміду Сухій смолі N-[3-((4-метоксифеніл)сульфоніл)проп-1-ілкарбоніл]-4-(2',4'-диметоксифеніл-Ометилгідроксиламін)феноксиметіл-співолімера(стирол-1% дивінілбензол) (200мг), отриманій за методикою приклада 2, дозволяють набухати в 3мл хлористого метилену протягом 10хв. У цю суміш при кімнатній температурі по краплях добавляють 0,3мл трифтороцтової кислоти (ТФО), і суміш, що утворилася, струшують 30хв. При додаванні ТФО смола стає темно-синьою. Потім суміш фільтрують і промивають двома порціями по 5мл хлористого метилену. Фільтрат випарюють на роторному випарнику, одержуючи 20мг сирого продукту. Аналіз сирої реакційної суміші мікрометодом рідинної хромато-масспектрометрії (РХ/МС) показав, що в ній міститься більше 75% (за площею) цільового продукту, а 3-(4-метоксифенілсульфоніл) пропіонова кислота складає 6%(за площею). Спектр 1Н-ЯМР (MeOH-d4) δ 2,45 (τ, 2Н) , 3,45 (τ, 2Η) , 3,90 (із, ЗН), 7,15 (д,2Н), 7,85 (д, 2Н). Приклад 4 Одержання смоли 4-О-метилгідроксиламінфеноксиметіл-співполімера-(стирол-1% дивінілбензол) (100200меш) В реактор з сорочкою (ємність 1л), обладнаний знизу вентилем і зверху мішалкою (№8090 за каталогом фірми Асе), завантажують 18,35г (20мг-екв) смоли Wang і 450мл безводного ТГФ. Цю суміш обережно перемішують приблизно 15хв., потім видаляють максимально можливу кількість розчинника шляхом вакуумного відсосу через трубку :і пористою скляною пластиною. Добавляють нову порцію ТГФ, потім 15,74г трифенілфосфіну (60ммоль) і 16,31г (100ммоль) N-гідроксифталіміду. Отриману суміш перемішують і охолоджують до -5-0°С. Повільно добавляють 11,8мл (60ммоль) діізопропілазодикарбоксилату, таким чином, щоб підтримувати температуру нижче 5°С. По завершенні додавання, при перемішуванні суміші дають повільно нагрітися до кімнатної температури, і її перемішують протягом ночі. За допомогою зазначеної вище заглибної трубки видаляють відсмоктуванням максимально можливу кількість реакційної рідини. Смолу промивають, додаючи N,N-диметилформамід [200мл ДМФ}, суміш перемішують 3-5хв. і потім видаляють відсмоктуванням максимально можливу кількість промивної рідини. Аналогічно, смолу послідовно промивають додатковою кількістю ДМФ і порціями метанолу (2 рази), ТГФ (2 рази) і метанолу (1 раз). Частина смоли може бути оброблена для аналізу: ІК-спектр 1734см-1 (С=0). До смоли, що залишилася в реакторі, добавляють 400мл ТГФ і 200мл 40%-го водного розчину метиламіну (2,31моль). Цю реакційну суміш обережно перемішують при 40°С протягом 2 годин, потім охолоджують до кімнатної температури (суміш можна витримувати при цій температурі протягом ночі). Видаляють відсмоктуванням максимально можливу кількість реакційної рідини, і смолу промивають зазначеним вище набором розчинників. Після остаточного промивання метанолом використовують додаткову кількість метанолу, щоб змити смолу з дна реактора і виділити її фільтрацією. Відфільтровану смолу сушать при 40°С, у вакуумі. Вихід смоли складає 18-18,5г; вміст аміну дорівнює 1,02мг-екв/г (за даними потенціометричного титрування п-толуолсульфокислотою суспензії смоли в ТГФ) ; ІК-спектр (мікроскопія): 3316см -1 (слаб, інтенс. NH2) . Елементний аналіз. Знайдено: С-87,07%; Н-7,77%; N-1,58%, що відповідає 1,13 атомів азоту на 1г смоли. Тест: одержання 4-нітрофенілетангідроксамової кислоти Зразок сухої смоли (200мг, приблизно 0,2ммоль) завантажують у реактор для смоли об'ємом 5 або 10мл (поліпропіленовий шприц, що має поліпропіленову пористу пластину). Смолі дозволяють набухати в сухому ДМФ протягом біля 15хв., і потім добавляють 115мг гідрохлориду 1-(3-диметиламінопропіл)-3етилкарбодиіміду (EDCI, 0,6ммоль). Потім у цю суміш добавляють 115мг (0,6ммоль) 4-нітрофенілоцтової кислоти. Реактор закривають кришкою, і суміш повільно перемішують протягом ночі (використовують пристрій з рамкою, що качається). Реакційну рідину видаляють фільтрацією у вакуумі (реактор із смолою під'єднують за допомогою невеликої гумової муфти до вакуумної колби), і смолу декілька разів промивають порціями (по 23мл) наступних розчинників: ДМФ (4-5 разів), метанол або 50%-й водний ДМФ (3-4 разів), ТГФ (3-4 рази) і метанол (2-3 рази). Смолу ( що знаходиться ще в шприцевому реакторі) сушать при 40°С не менше 4 годин . До висушеної смоли добавляють 2мл дихлорметану і потім 2мл трифтороцтовоТ кислоти (ТФО). Крім того, добавляють 20мл води (вважається, що це дозволить зменшити утворення "ангідриду" із продукту гідроксамової кислоти). Суміші дають прореагувати приблизно протягом 1 години, і реакційну рідину декантують у калібрований збірник. Смолу промивають 1-2 рази порцією 1мл дихлорметану і потім 1-2 рази порцією 1мл толуолу. Об'єднані фільтрати концентрують до об'єму біля 2мл при 30°С, добавляють ще 2мл толуолу, і отриманий розчин концентрують досуха у вакуумі (у роторному випарнику і потім у вакуумній шафі при 30°С, відмічено, що нагрівання в присутності ТФО сприяє утворенню "ангідридної" домішки). Залишок зважують і аналізують, щоб визначити його чистоту (в вагу. %), використовуючи ΒЕΡΧ із внутрішнім стандартом відповіді карбоновою кислотою. Типові результати для 4-нітрофенілетангідроксамової кислоти: 29-30мг твердої речовини чистотою 60-70вага.%, чистотою 90-97 А% (261нм). Спектр 1Н-ЯМР (CD3OD) δ 8,13 (д, 2Н) , 7,25 (д, 2Н), 4,85 (шир. с, ОН, ΝΗ) , 3,55 (с, 2Н) . Спектр 13С-ЯМР δ 169,4; 144,3; 131,3; 124,6; 40,2. Це відповідає хімічному виходу (на зафіксоване завантаження) 50-55% для смоли ємністю 1мг-екв/г. Приклад 5 Одержання смоли N-4-фенілбут-1-оіл-4-О-метилгідроксиламін)феноксиметіл-співполімера(стирол-1% дивінілбензол) Сухій смолі 4-O-метилгідроксиламін)феноксиметіл-співполімера(стирол-1% дивінілбензол) (2г, 1,5ммоль), яку отримано за методикою приклада 4, дають набрякнути в 8мл ДМФ протягом 10хв. і потім обробляють 4фенілмасляною кислотою і EDC (0,86г, 4,5ммоль). Суміш струшують протягом 24 годин і фільтрують. Смолу промивають ДМФ, сумішшю ДМФ/вода, ДМФ, ТГФ і діетиловим ефіром і сушать при 40°С, у вакуумі, одержуючи 2,2г смоли N-4-фенілбут-1-оіл-4-O-метилгідроксиламін)феноксиметіл-співполімера-(стирол-1% дивінілбензол). Спектр ІК: С=0 1670см -1. Елементний аналіз: Обчислене N-1,05%, Знайдено N-1,07%. Приклад 6 Одержання смоли N-(4-бром-3-метилбензоїл)-4-О-метилгідроксил-амін)феноксиметілспівполімера(стирол-1% дивінілбензол) Сухій смолі 4-O-метилгідроксиламін)феноксиметіл-співполімера (стирол-1% дивінілбензол) (4г, 3ммоль), отриманої за методикою приклада 4, дають набухати в 32мл ДМФ протягом 10хв. і потім обробляють 4-бром3-метилбензойною кислотою і EDC (1,725г, 9ммоль). Суміш струшують протягом 24 годин і фільтрують. Смолу промивають ДМФ, сумішшю ДМФ/вода, ДМФ, ТГФ і діетиловим ефіром і сушать при 40°С, у вакуумі, одержуючи 4,5г смоли N-(4-бром-3-метилбензоїл)-4-О-метилгідроксиламін)феноксиметил-співполімера (стирол-1% дивінілбензол). Спектр ІК: С=0 1677,5см-1. Елементний аналіз: Обчислене Вr-5,2%; N-1,05%, Знайдено Br-5,3%; N-0,91%. Приклад 7 Одержання N-гідрокси-4-бром-3-метилбензаміду Смолу N-(4-бром-3-метилбензоїл)-4-O-метилгідроксиламін)феноксиметіл-співполімера (стирол-1% дивінілбензол), отриману за методикою приклада 6, суспендують у суміші 50% ТФО/хлористий метилен протягом 2 годин. Смолу відфільтровують і промивають три рази хлористим метиленом, одержуючи Nгідрокси-4-бром-3-метилбензамід. Аналіз РХ/МС: m/z 230/232 (Вr) [М+Н]+; площа дорівнює 78%. Спектр 1Н ЯМР (300 Мгц, CDCI3) δ 2,42 (с, 3Н) , 7,4 (шир. д, J=7,89, 1Н), 7,58 (шир. д, J=7,89, 1H) 7,62 (шир. с, 1Н). Приклад 8 Одержання смоли N-(4-бромбензил-N-4-фенілбут-1-ілкарбоніл-4-О-метилгідроксиламін)феноксиметілспівполімера(стирол-1% дивінілбензол) Смолу N-4-фенілбут-1-оіл-4-O-метилгідроксиламін)феноксиметіл-співполімера(стирол-1% дивінілбензол) (1,46г, 1,095ммоль), отриману за методикою приклада 5, суспендують в 26мл толуолу протягом 10хв. Добавляють 0,83мл DBU (5,5ммоль), і суміш перемішують протягом 2 годин на шатунному струшуванні. Добавляють 4,1г (16,425ммоль) бромбензилброміду, і реакційну суміш інтенсивно перемішують протягом 4 діб. Смолу фільтрують і промивають ДМФ, сумішшю ДМФ/вода, ДМФ, ТГФ і діетиловим ефіром і суша ть при 40°С, у вакуумі, одержуючи 1,4г смоли N-(4-бром-бензил-N-4-фенілбут-1-ілкарбоніл-4-Oметилгідроксиламін)феноксиметіл-співполімера(стирол-1% дивінілбензол). Спектр ІК: С = О 1668см-1. Елементний аналіз: Обчислене Вr-5,3%; N-0,94%, Знайдено Br-5,4%; N-0,85%. Приклад 9 Одержання 4-фенілбутиральдегіду Смолу N-(4-бромбензил-N-4-фенілбут-1-оіл-4-O-метилгідроксилам!Н)феноксиметіл-співполімера(стирол1% дивінілбензол) (0,2г, 0,6ммоль/г, 0,12ммоль) суспендують у діетиловому ефірі протягом 10хв. і потім охолоджують до 5°С в орбітальному стр ушуванні. Суспензію обробляють 0,22мл 0,46 молярного розчину LiAIH 3OMe (0,1ммоль) у діетиловому ефірі і перемішують протягом 30хв. при цій температурі. Реакційну суміш гасять додаванням 2-молярної водної соляної кислоти і струшують протягом 30хв. Добавляють тартрат натрію-калію, і суміш струшують ще протягом 10хв. Добавляють суль фат натрію, і суміш фільтрують через шар силікагелю, який ретельно промивають дихлорметаном. Фільтрат концентрують, одержуючи 4фенілбутир альдегід. Площа піку дорівнює 91% (ГХ). Спектр 1Н-ЯМР (CDCI3) δ 9,75 (с, 1Н), 7,05-7,30 (м, 5Н), 2,58-2,68 (м, 2Н), 2,41-2,50 (т, 2Н), 1,91-2,02 (м, 2Н). МС (El): m/z=149 [M+H +]. Приклад 10 Одержання 6-фенілгексан-3-ону Смолу N-(4-бромбензил-N-4-фенілбут-1-оіл-4-O-метилгідроксиламін)феноксиметіл-співполімера(стирол1% дивінілбензол) (0,15г, приблизно 0,75ммоль/г, 0,11ммоль) суспендують у діетиловому ефірі (1мл) і обробляють 0,34мл 1-молярного розчину етилмагнійброміду (0,1ммоль) у ТГФ. Реакційну суміш перемішують протягом 18 годин і потім гасять додаванням 2-молярної соляної кислоти (одержують значення рН біля 3). Суміш перемішують протягом 30хв. Добавляють сульфат натрію, і суміш фільтрують через шар силікагелю, який ретельно промивають дихлорметаном. Фільтрат концентрують, одержуючи 6-фенілгексан-3-он. ГХ/МС (El): m/z 176,2 (М)+; площа дорівнює 97,1%. МС (EI-LRP): m/z 176 (М)+; Спектр ЯМР (300 Мгц, CDCI3) δ 1,02 (τ, 3Н), 1,9 (м, 2Н), 2,4 (м, 4Н), 2,6 (м, 2Н), 7,2-7,3 (м, 5Н). Приклад 11 Одержання смоли N-4-хлорбензил-N-(4-бром-3-метилбензоил)-4-O-метилгідроксиламін)феноксиметилспівполімера(стирол-1% дивинил-бензол) Смолу N-(4-бром-1-метилбензоил)-4-O-метилпдроксиламiн)феноксиметил-співполімера (стирол-1% дивінілбензол) (2,8р, 2,1ммоль), отриману за методикою приклада 6, суспендують у 27мл толуолу, і суміш перемішують протягом 10хв. Добавляють 1,6г DBU (10,5ммоль), і суміш перемішують протягом 2 годин на шатунному струшувачі. Добавляють 6,47г (31,5ммоль) хлорбензилброміду, і реакційну суміш інтенсивно перемішують протягом 3 діб. Смолу фільтрують і промивають ДМФ, сумішшю ДМФ/вода, ДМФ/ТГФ і діетиловим ефіром і сушать при 40°С, у вакуумі, одержуючи 3 г смоли N-4-хлорбензил-N-(4-бром-3метилбензот)-4-О-метилгідроксиламін)феноксиметил-співполімера(стирол-1% дивінілбензол). Спектр ІК: С=0 1644 см -1. Елементний аналіз: Обчислено Вr-4,2%; Сl-1,9%; N-0,8%, Знайдено Br-3,8%; Cl-2,0%; N-0,9%. Приклад 12 Одержання N-(4-хлорбензил)-N-гідрокси-3-метил-4-бромбензаміду Смолу N-4-хлорбензил-N-(4-бром-3-метилбензоїл)-4-О-метилгідроксиламін)феноксиметілспівполімера(стирол-1% дивінілбензол), отриману за методикою приклада 11, суспендують в суміші 50% ТФО/ди хлорметан протягом 2 годин. Смолу відфільтровують і промивають три рази дихлорметаном, одержуючи N-(4-хлор-бензил)-N-гідрокси-3-метил-4-бромбензамід. Аналіз РХ/МС (H-ISP) m/z 354/356 (СІ/Вr)[М+Н]+; площа дорівнює 64%. Спектр 1Н-ЯМР (300 Мгц, CDCI2) δ 2,3 (шир. с, 3Н), 4,65 (шир. с, 2Н), 7,27,6 (м, 7Н). Приклад 13 Одержання 4-бром-3-метилбензальдегіду Смолу N-4-хлорбензил-N-(4-бром-3-метилбензот)-4-O-метил-гідроксиламін)феноксиметил-співполімеру (стирол-1% дивінілбензол) (0,2г, 0,5ммоль/г, 0,1ммоль), отриману за методикою приклада 11, суспендують у діетиловому ефірі протягом 10хв. і потім прохолоджують до 5°С в орбітальному струшувачі. Суспензію обробляють 0,2мл 0,46-молярного розчину LiAIH3OMe (0,092ммоль) у діетиловому ефірі і перемішують 30хв. при цій температурі. Реакційну суміш загартовують додаванням 2-·молярної соляної кислоти і струшують 30хв. Добавляють тартрат натрію-калію, і суміш струшують протягом ще 10хв. Добавляють сульфат натрію, і суміш фільтрують через шар силікагелю, який ретельно промивають дихлорметаном. Фільтрат концентрують, одержуючи 4-бром-3-метилбензальдегід. ГХ-МС (El) : m/z=179/199 Вr-[М]+. Площа піку дорівнює 99,5%. Спектр 1 Н-ЯМР (CDCI3) δ 9,94 (с, 1Н), 7,70 (д, 2Н), 7,52 (д, 1Н) , 2,45 (с, 3H).MC(EI):m/z=199[M+H +]. Приклад 14 Одержання 1-(4-бром-3-метилфеніл)пропан-1-ону Смолу N-4-хлорбензил-N-(4-бром-3-метилбензоіл)-4-O-метил-гідроксиламін)феноксиметілспівполімера(стирол-1% дивінілбензол) (0,23г, 0,5ммоль/г, 0,115ммоль), отриману за методикою приклада 11, суспендують у діетиловому ефірі (1мл) і обробляють 0,23мл 1-молярного розчину етилмагнійброміду (0,23ммоль) у ТГФ. Реакційну суміш перемішують протягом 18 годин і потім гасять додаванням 2-молярної водної соляної кислоти (одержують значення рН біля 3). Суміш перемішують протягом 30хв. Добавляють сульфат натрію, і суміш фільтрують через шар силікагелю, який ретельно промивають дихлорметаном. Залишок концентрують, одержуючи 1-(4-бром-3-метилфеніл)-пропан-1-он. ГХ: площа піку дорівнює 78,7%. МС (El) : m/z 226 Вr(М+-Н]; Спектр ЯМР (300 МГц, CDCI3) δ 1,22 (τ, J=7,89, 3Н), 2,96 (квадр., J=7,89, 2H), 7,6 (шир. с, 2Н), 7,8 (с, 1Н). Приклад 15 Одержання смоли N-3-бромбензальдегідоксим-4-(О-метилгідроксиламін)феноксиметілспівполімера(стирол-1% дивінілбензол) Смолі 4-(O-метилгідроксиламін)феноксиметіл-співполімера(стирол-1% дивінілбензол) (105мг; 0,08ммоль) дозволяють набуха ти в дихлорметані (2мл) протягом 10хв. Добавляють до смоли триметилортоформіат (1мл) і 3-бром-бензальдегід (500мг; 2,7ммоль, 34 еквіваленту), і суміш струшують протягом ночі. Потім суспензію фільтрують, промивають дихлорметаном (5мл), 3 рази ДМФ (5мл), водою (5мл x4), ТГФ (5мл х10) і діетиловим ефіром (5 мл x10). Смолу суша ть у вакуумі при 40°С протягом 12 годин. ІК пік оксиму 1602см -1. Елементний аналіз: Розраховано Вr-5,52 %; N-1,04%. Знайдено: Вr-5,76%; N-1,08%. Приклад 16 Одержання смоли N-3-(4-метоксифеніл)пропан-1-оіл-4-(О-метилгідроксиламін)феноксиметіл-співполімера (стирол-1% дивінілбензол) Смолі 4-(O-метилгідроксиламін)феноксиметил-співполімера(стирол-1% дивінілбензол) (1г, 0,73ммоль) дозволяють набуха ти в ДМФ протягом 10хв. і потім обробляють 3-(4-метокси-феніл)пропіоновою кислотою (0,658г, 3,65ммоль) і DIC (0,46г, 3,65ммоль). Суміш струшують протягом 24 годин, потім фільтрують, і залишок промивають ДМФ, сумішшю ДМФ/Н2О, ДМФ, ТГФ і діетиловим ефіром і сушать у вакуумі при 40°С з одержанням смоли N-3-(4-метоксифеніл)пропан-1-оіл-4-(О-метилгідроксиламін)феноксиметилспівполімера(стирол-1% дивінілбензол). ІК: С=0 1698см-1. Елементний аналіз: Розраховане N-1,02%. Знайдено: N-1,21%. Приклад 17 Одержання N-гідрокси-3-(4-метоксифеніл)пропіонаміду N-гідрокси-3-(4-метоксифеніл)пропіонамід одержують взаємодією смоли N-3-(4-метоксифеніл)пропан-1оіл-4-(O-метилгідроксиламін) феноксиметил-співполімера(стирол-1% дивінілбензол) із трифтороцтовою кислотою (ТФУ) за методикою приклада 7. 1Н-ЯМР 300 Мгц (CDCl3/CD3OD): δ 2,25 (τ, 2Н), 2,78 (τ, 2Η), 3,68 (с, 3Н), 6,72 (д, 2Н), 7,04 (д, 2Н). Приклад 18 Одержання смоли N-2-(4-бромфеніл)етан-1-оіл-4-(O-метилгідроксиламін)феноксиметилспівполімера(стирол-1% дивінілбензол) Зазначену в заголовку смолу одержують за методикою приклада 16, замінюючи 3-(4метоксифеніл)пропіонову кислоту на 4-бромфенілоцтову кислоту. ІК: С=0 1713,9 см -1. Елементний аналіз: Розраховано: Вr-5,8 %; N-1,02%. Знайдено: Вr-8,29%, 8,18%; N-0,97%, 0,96%. EDS: Загальний рахунок імпульсів рентгенівського випромінювання К-лінія L-лінія М-ліния О: 969 1024 С: 2662 3003 Вr: 12855 10436 Приклад 19 Одержання смоли N-4-бpoмцiнaмoїл-4-(O-мeтилгiдpoкcилaмiн)фeнoкcимeтил-співполімера(стирол-1% дивінілбензол) Зазначену в заголовку смолу одержують за методикою приклада 16, замінюючи 3-(4метоксифеніл)пропіонову кислоту на 4-бромкоричну кислоту. ІК: С=0 1671,7 см -1 (широка смуга). Елементний аналіз: Розраховане Br-5,8%; N-1,02%. Знайдено: Вr-4,45%, 4,54%. EDS: Загальний рахунок імпульсів рентгенівського випромінювання К-лінія L-лінія М-ліния О: 818 1365 С: 4549 5059 Вr: 6384 5271 Приклад 20 Одержання N-пдрокси-4-бромамщу коричної кислоти N-гідрокси-4-бромамід коричної кислоти одержують обробкою смоли N-4-бромцінамоїл-4-(Oметилгідроксиламін)феноксиметил-співполімера(стирол-1% дивінілбензол) ТФУ за методикою приклада 7. РХМС(Н-іонізація) m/z 241/243 Вr[М+], Площа =84%. +Н-ЯМР (300 Мгц, CDCI3/CD3OD) δ:3,23 (с, 1Н), 6,35 (д, J=15,8), 7,3 (д, J=7,9), 7,4 (д, J=7,9), 7,6 (д, J=15,8). Приклад 21 Одержання смоли N-(4-хлорбензоїл)-4-(O-метилгідроксиламін)феноксиметил-співполімера(стирол-1% дивінілбензол) Зазначену в заголовку смолу одержують за методикою приклада 16, замінюючи 3-(4метоксифеніл)пропіонову кислоту на 4-хлор-бензойну кислоту. ІК: С=0 1678см -1. Елементний аналіз: Розраховане: СІ:2,66%; N-1,05%. Знайдено: СІ-2,39%; N-1,02%. Приклад 22 Одержання N-гідрокси-4-хлорбензаміду N-гідрокси-4-хлорбензамід одержують обробкою смоли N-(4-хлорбензоїл)-4-(Ометилгідроксиламін)феноксиметил-співполімера-(стирол-1% дивінілбензол) ТФУ за методикою приклада 7. РХ-МС (Н-іонізація) : m/z 172, 174 (СІ) [М+Н]+ Площа =96%. 1Н-ЯМР (300 Мгц, ДМСО-d 6) 7,48 (д, J=9,42, 2H) , 7,69 (д, J=9,42, 2H) , 8,9-9,2 (шир. сигнал, 1Н), 11,28 (с, 1Н). Приклад 23 Одержання смоли N-метил-N-(4-хлорбензоїл)-4-(O-метилгідроксиламін) феноксиметилспівполімеру(стирол-1% дивінілбензол) Смолу N-(4-хлорбензоїл)-4-(O-метилгідроксиламін)феноксиметил-співполімеру (стирол-1% дивінілбензол) (0,1г, 0,075ммоль, 0,75ммоль/г) суспендують у толуолі (2мл) і прохолоджують до 5°С. Суміш обробляють метилйодидом (1,5ммоль, 0,21г, 93мкл), потім DBU (0,22мл, 0,228г, 1,5ммоль). Реакційну суміш вміщують у змішувач і витримують при кімнатній температурі. Через кілька хвилин утвориться рясний білий осад, і суміш далі розбавляють толуолом (2мл). Перемішування реакційної суміші продовжується протягом 18 годин. Смолу N-метил-N-(4-хлорбензоїл)-4-(О-метилгідроксиламін)феноксиметил-співполімеру-(стирол-1% дивінілбензол) фільтрують і промивають ДМФ, сумішшю ДМФ/Н2О, ДМФ, ТГФ, діетиловим ефіром і сушать у вакуумі при 40°С. Приклад 24 Одержання 1-(4-хлорфеніл)пропан-1-ону Смолу N-метил-N-(4-хлорбензоїл)-4-(O-метилгідроксиламін)-феноксиметил-співполімеру(стирол-1% дивінілбензол) суспендують у діетиловому ефірі (0,7мл) і обробляють етилмагнійбромідом (1,0Μ в ТГФ, 0,225мл, 0,225ммоль). Реакційну суміш перемішують протягом 18 годин на шатунному струшуванні і потім нейтралізують добавкою 5% НСІ в етанолі. Далі перемішування підтримують протягом 30хв., і потім суміш фільтрують через невеликий шар силікагелю, щоб видалити неорганічну речовину. Фільтрат концентрують, виділяючи 1-(4-хлорфеніл)пропан-1-он. МС (EI-LRP) m/z 168/170 СІ [М+], 169/171 СІ [М+Н]+ 'Н-ЯМР (300 Мгц, CDCI3) δ 1,22 (τ, 3Н), 2,98 (квадр., 2Н), 7,42 (д, 2Н), 7,9 (д, 2Н). Приклад 25 Одержання смоли N-[3-((4-метоксифеніл)сульфоніл)пропан-1-оіл-карбоніл]-4-(Ометилгідроксиламін)феноксиметил-співполімера(стирол-1% дивінілбензол) Смолу N-[3-((4-метоксифеніл)сульфоніл)пропан-1-оіл-карбоніл]-4-(О-метилгідроксиламін)феноксиметилспівполімера(стирол-1% дивінілбензол) одержують за методикою приклада 16, замінюючи 3-(4метоксифеніл)пропіонову кислоту на 3-(4-метоксифенілсульфоніл)пропіонову кислоту. ІК: С=0 1671,7см -1 (широка смуга). Елементний аналіз: Розраховане: N-1,02%; 3-2,34%; Знайдено: N-1,03%; 3-2,5%. Приклад 26 Одержання N-гідрокси-3-N-метоксифенілсульфоніл)пропіонаміду N-гідрокси-3-N-метоксифенілсульфоніл^ропіонамід одержують обробкою смоли N-[3-((4метоксифеніл)сульфоніл)пропан-1-оіл-карбоніл]-4-(O-етилгідроксиламін)феноксиметил-співполімера(стирол1% дивінілбензол) ТФУ за методикою приклада 7. 1Н-ЯМР (300 Мгц, ДМCO-d6) δ 2,25 (τ, 2Н) , 3,42 (τ, 2Η) , 3,85 (с, 3Н), 7,13 (д, 2Н), 7,79 (д, 2Н); РХ-МС (Іон-бомбардування) m/z 259 [М+], Пло ща =44%. Приклад 27 Одержання смоли N-алілоксикарбоніл-4-(О-метилгідроксиламін)феноксиметил-співполімера (стирол-1% дивінілбензол) Смолу 4-(O-метилгідроксиламін)феноксиметил-співполімера(стирол-1% дивінілбензол) (2г, 2ммоль) суспендують у 15мл дихлорметану і стр ушують на шатунному стр ушувані протягом 10хв. і добавляють 284мг (383мкл, 2,2ммоль) діізопропілетиламіну. Суміш струшують протягом 30хв. Добавляють алілхлорформіат (265мг, 233мкл, 2,2ммоль), і струшують суміш протягом ночі. Смолу N-алілоксикарбоніл-4-(Ометилгідроксиламін) феноксиметил-співполімера(стирол-1% дивінілбензол) промивають 3мл 0,5н НСІ. Добавляють Pd(Ph3P)4 (347мг, 15% мас.) і суміш струшують 5хв. Добавляють морфолін (4,3мл) і струшують суміш протягом ночі. Реагенти відфільтровують і смолу N-4-бромбензил-4-(Oметилгідроксиламін)феноксиметил-співполімера(стирол- 1% дивінілбензол) промивають ДМФ (2 рази), 2 рази ТГФ, 2 рази дихлорметаном, 3 рази 0,5%-ним розчином діізопропілетиламіну в ди хлорметані, 0,5%-ним діетилдитіокарбаматом натрію в ДМФ (3 рази), ДМФ (3 рази), ТГФ (3 рази) і дихлорметаном (3 рази) і сушать у вакуумі протягом ночі. Приклад 30 Одержання смоли N-(індол-2-ілкарбоніл)-N-4-бромбензил-4-(О-метилгідроксиламін) феноксиметилспівполімера(стирол-1% дивінілбензол) Смолу N-4-бромбензил-4-(О-метилгідроксиламіно)феноксиметил-співполімера(стирол-1% дивінілбензол) (1,17г, 1ммоль), отриману за методикою приклада 29, суспендують у 15мл ДМФ. Добавляють індол-2карбоксильну кислоту (483мг, 3ммоль) і 575,1мг (3ммоль) 1-(3-диметиламінопропіл)-3-діетилкарбодиімід гідрохлориду, і суміш стр ушують протягом 16 годин. Смолу N-(iндол-2-iлкарбоніл)-N-4-бромбензил-4-(Oметилгідроксиламін)-феноксиметил-співполімера(стирол-1% дивінілбензол) фільтрують і промивають 15мл ДМФ (3 рази), ТГФ/20% Н2О (3 рази), ТГФ (3 рази) і діхлорметаном (3 рази) і суша ть у вакуумі. Приклад 31 Одержання індол-2-карбоксальдегіду Сухій смолі N-(індол-2-ілкарбоніл)-N-4-бромбензил-4-(О-метилгідроксиламін)феноксиметилспівполімера(стирол-1% дивінілбензол) дозволяють набуха ти в 12мл ТГФ, суміш стр ушують і прохолоджують при 0°С протягом 30хв. Добавляють LіАІН4 (0,62мл, 3 еквіваленти), і струшують суміш при 0°С протягом 30хв. Добавляють насичений розчин KHSO4 (0,5мл) і 0,3мл розчину виннокислого калію, натрію, і суміш струшують протягом 30хв. доти, поки вона не нагріється до кімнатної температури. Надлишок води видаляють добавкою сухого Na2SO4 і стр ушуванням протягом більш 15хв. С уміш фільтрують під невеликим тиском азоту і промивають більше 3 разів 8мл дихлорметану з наступною фільтрацією. Фільтрат суша ть Na2SO4 і пропускають двічі через тонкий шар (2,54см) силікагеля 60 (для хроматографії в колонці, розмір часток 0,0400,063мм), і розчинник видаляють у вакуумі, одержуючи індол-2-карбоксальдегід. 1Н-ЯМР (CDCI3) δ 9,84 (1Н, с), 9,22 (1Н, шир. с), 7,75 (1Н, д), 7,14-7,48 (4Н, м); МС (El): m/z=146 [M+H +]. Приклад 32 Одержання альдегіду N-(трет-бутоксикарбоніл)фенілаланіну Зазначену в заголовку речовину одержують за методикою прикладів 30 і 31, замінюючи індол-2карбоксальдегід на N-(трет-бутоксикарбоніл )фенілаланін. Приклад 33 Одержання смоли N-(3,4-диметоксицинаміл)-4-(О-метилгідроксил-амін)феноксиметилспівполімера(стирол-1% дивінілбензол) Смолу 4-(О-метил гідроксилам ін)феноксиметил-співполімер(стирол-1% дивінілбензол) (1г, 1ммоль) промивають ДМФ (15мл), потім суспендують у 15мл ДМФ і 624,6мг (3ммоль, триразовий надлишок) 3,4диметоксикоричної кислоти і добавляють 575,1мг (3ммоль, триразовий надлишок) 1-(3-диметиламінопропіл)-3етилкарбодиімід гідрохлориду, і суміш стр ушують протягом 16 годин. Смолу відфільтровують і промивають 15мл ДМФ (1 раз), ТГФ/20% Н2О (3 рази), ТГФ (3 рази), дихлорметаном (3 рази) і сушать у вакуумі протягом ночі. Приклад 34 Одержання смоли N-4-бромбензил-N-(3,4-диметоксицинамоїл)-4-(O-метилгідроксиламін)феноксиметилспівполімера(стирол-1% дивінілбензол) Суху смолу N-(3,4-диметоксицинамоїл)-4-(O-метилгідроксиламін )феноксиметил-співполімера(стирол-1% дивінілбензол) струшують у 15мл толуолу протягом 10хв., потім добавляють 0,9мл (6ммоль, шестиразовий надлишок) DBU, і суміш струшують протягом 2 годин. Добавляють п-бромбензилбромід (1,5г, 6ммоль, шестиразовий надлишок), і суміш стр ушують протягом 3 діб. Смолу сушать у вакуумі протягом ночі. Приклад 35 Одержання альдегіду 3,4-диметоксикоричної кислоти Сухій смолі N-4-бромбензил-N-(3,4-диметоксицинамот)-4-(О-метилгідроксиламін)феноксиметилспівполімера(стирол-1% дивінілбензол) дозволяють набухати в 12мл сухого ТГФ, її стр ушують і прохолоджують до 0°С протягом 30хв. Добавляють LіАІН4 у ТГФ (0,5мл, 2 еквіваленти) і струшують суміш при 0°С протягом 30хв. Добавляють насичений розчин KHSO4 (0,5мл) і 0,3мл розчину виннокислого калію, натрію, і суміш стр ушують протягом 30хв., доти, поки вона не нагріється до кімнатної температури. Надлишок Н2О видаляють додаванням сухого Na2SO4 і струшуванням протягом більш 15хв. Суміш фільтр ують під невеликим тиском азоту і промивають 3 рази 8мл дихлорметану і фільтрують. Фільтрат суша ть Na2SO4 і пропускають через тонкий шар (2,54см) силікагеля 60 для хроматографії на колонці (розмір часток 0,040-0,063мм), і розчинник видаляють у вакуумі, одержуючи 3,4-диметоксицинамальдегіду. +Н-ЯМР (CDCI3) δ 9,65 (1Н, д), 7,40 (1Н, д), 7,12 (1Н, д), 7,06 (1Н, с), 6,87 (1Н, д) , 6,60 (1Н, дд), 3,90 (6Н, с); МС (El): m/z= 193 [М+Н+]. Приклади 36-43 Сполуки прикладів 36-43 одержують із вихідних речовин для цільових карбоксильних кислот, використовуючи методики прикладів 33-35. Приклад 36. Одержання антранілового альдегіду 1 Н-ЯМР (CDCI3) δ 9,88 (1Н, с), 7,52-7,58 (1Н, д) , 7,11-7,38 (7Н, м) , 6,81 (1Н, т); МС (EI):m/z=198[M+H +]. Приклад 37 Одержання 2-дибензилальдегіду 1 Н-ЯМР (СОСІ3) δ 10,18 (1Н, с), 7,83 (1Н, д) , 7,14-7,52 (8Н, м), 3,30 (2Н, т), 2,87 (2Н, т); МС(ЕІ): m/z= 211 [М+Н*] . Приклад 38 Одержання 4-метокси-2-хінолінового альдегіду 1 Н-ЯМР (CDCI3) δ 10,17 (1Н, с), 8,27 (1Н, д), 8,18 (1Н, д), 7,78 (1Н, т), 7,62 (1Н, т), 7,38 (1Н, с), 4,12 (ЗН, с); МС (El): m/z=188 [M+H +]. Приклад 39 Одержання 3-ацетамідобензальдегіду 1 Н-ЯМР (CDCI3) δ 9,98 (1Н, с), 7,97 (1Н, с), 7,86 (1Н, д) , 7,62 (1Н, д), 7,48 (1Н, т), 2,21 (3Н, с). МС (ТВ): m/z= 164 [М+Н+]. Приклад 40 Одержання 4-(4-N-пропілфеніл)бензальдегіду 1 Н-ЯМР (CDCI3) δ 10,02 (1Н, с), 7,92 (2Н, д), 7,72 (2Н, д) , 7,53 (2Н, д), 7,26 (2Н, д), 2,65 (2Н, т), 1,68 (2Н, дт), 0,95 (ЗН, т); МС (EI): m/z=225 [M+H +]. Приклад 41 Одержання 3-хінолінового альдегіду 1 Н-ЯМР (CDCI3) δ 10,26 (1Н, с), 9,38 (1Н, с), 8,64 (1Н, с), 8,20 (1Н, д), 7,98 (1Н, т), 7,89 (1Н, т), 7,65 (1Н, т); МС (El): m/z=158 [M+H +]. Приклад 42 Одержання 3-(3,4-метилендіокси)пропіонового альдегіду 1 Н-ЯМР (CDCI3) δ 9,80 (1Н, с), 7,60-7,74 (ЗН, м) , 5,92 (2Н, с), 2,88 (2Н, т), 2,74 (2Н, т); МС (El): m/z= 179[M+H+]. Приклад 43 Одержання 2-феніл-4-хінолінового альдегіду 1 Н-ЯМР (CDCI3) δ 10,58 (1Н, с), 9,00 (1Н, д) , 8,19-8,30 (4Н, м), 7,82 (1Н, т), 7,70 (1Н, т), 7,47-7,59 (ЗН, м); МС (El): m/z=234[M+H +]. Приклад 44 Одержання смоли 4-карбокси-2,3,5,6-тетрафторфеноксиметил-співполімера(стирол-1% дивінілбензол) Вихідну смолу (2ммоль/г, 600мг, 1,2ммоль) залишають набухати в безводному ДМФ (20мл). Добавляють гідрат 2,3,5,6-тетрафтор-4-гідроксибензойної кислоти (2,28г, 10ммоль) і карбонат цезію (3,26г, 10ммоль) і нагрівають реакційну суміш при 85°С протягом 12 годин легким перемішуванням. Реакційну суміш фільтрують і промивають смолу 4-карбокси-2,3,5,6-тетрафторфеноксиметил-співполімера(стирол-1% дивінілбензол) ДМФ (5 разів), 20% водним розчином ДМФ (5 разів), ТГФ (5 разів) і ди хлорметаном і сушать у вакуумі протягом ночі. ІК (мікроскоп, см-1): 1640 (С=0); 18F-ЯМР (нанопроба) -144,4(ч/млн), -160,2(ч/млн). EDS (дифракція електронів з скануванням) Виміри розсіювання енергії рентгенівського випромінювання проводять на скануючому електронному мікроскопі Electroscan, що має PGT цифровий детектор. Шарм наносять на алюмінієві підложки і випробують без провідного покриття. Загальний підрахунок імпульсів рентгенівського випромінювання наведений після корекції на підложку. Ніяких поправок для атомних номерів, флуоресценції і абсорбції не робиться.
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for the solid-phase synthesis of aldehydes, ketones, oximes, amines and hydroxamic acid
Назва патенту російськоюСпособ твердофазного синтеза альдегидов, кетонов, оксимов, аминов и гидроксамовой кислоты
МПК / Мітки
МПК: C07D 311/80, C07C 47/20, C07C 49/327, C07C 45/51, C07D 313/00, C07C 209/42, C08F 8/00, C07C 45/00, C07C 271/00, C07C 45/45, C07D 307/33, C07C 239/00, C07D 311/86, C07C 45/61, C07D 209/42, C08F 12/00, C07C 47/52, C07C 317/44, C07C 269/00, C07C 49/213, C07C 315/00, C07B 61/00, C07D 311/68, C07C 209/00, C07C 259/00, C07D 311/82
Мітки: оксимів, гідроксамової, синтезу, твердофазного, кислоти, спосіб, амінів, альдегідів, кетонів
Код посилання
<a href="https://ua.patents.su/30-67733-sposib-tverdofaznogo-sintezu-aldegidiv-ketoniv-oksimiv-aminiv-i-gidroksamovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб твердофазного синтезу альдегідів, кетонів, оксимів, амінів і гідроксамової кислоти</a>
Попередній патент: Спосіб атомно-емісійного аналізу та пристрій для його здійснення
Наступний патент: Похідні нікотинаміду
Випадковий патент: Кольчуга