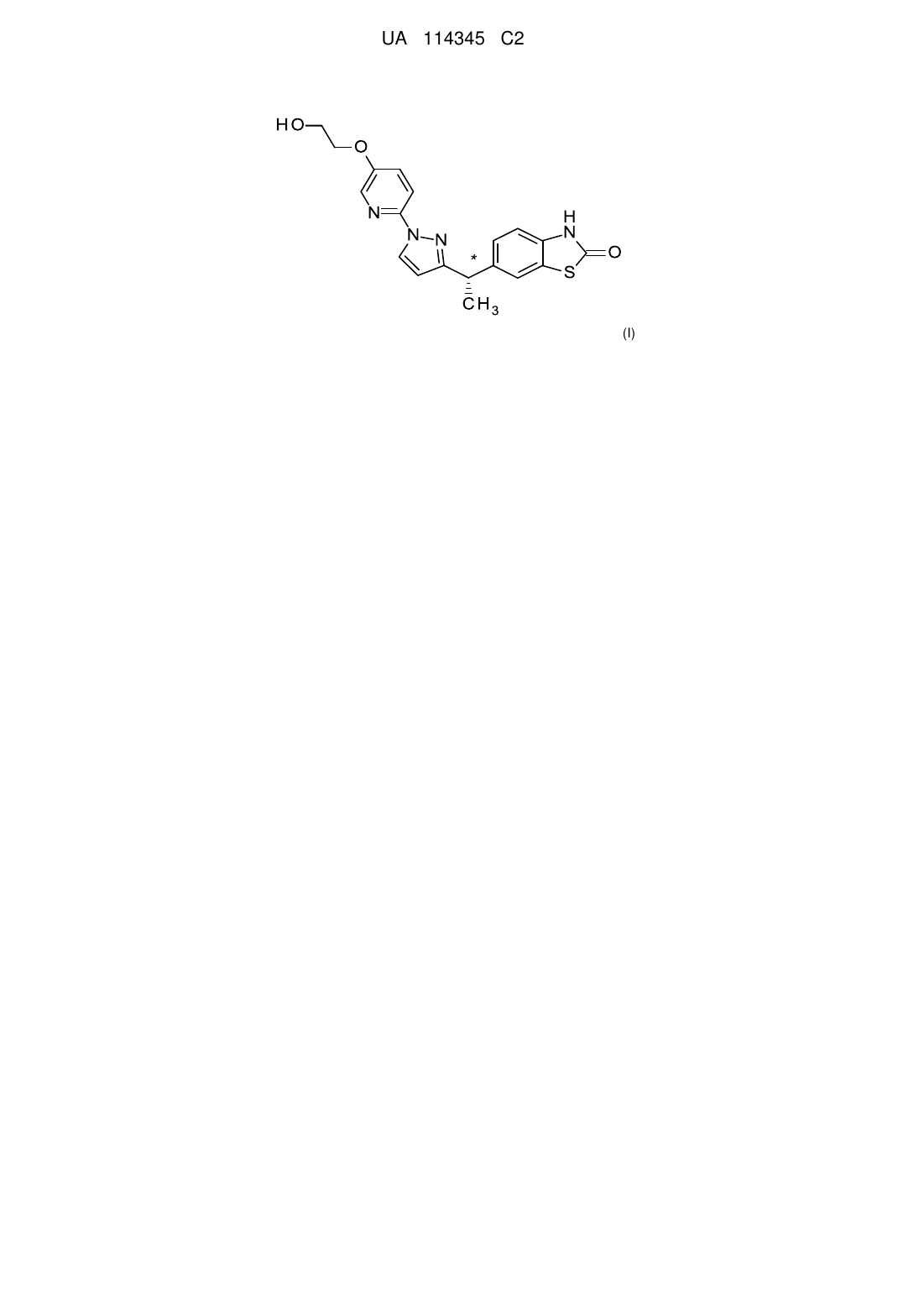
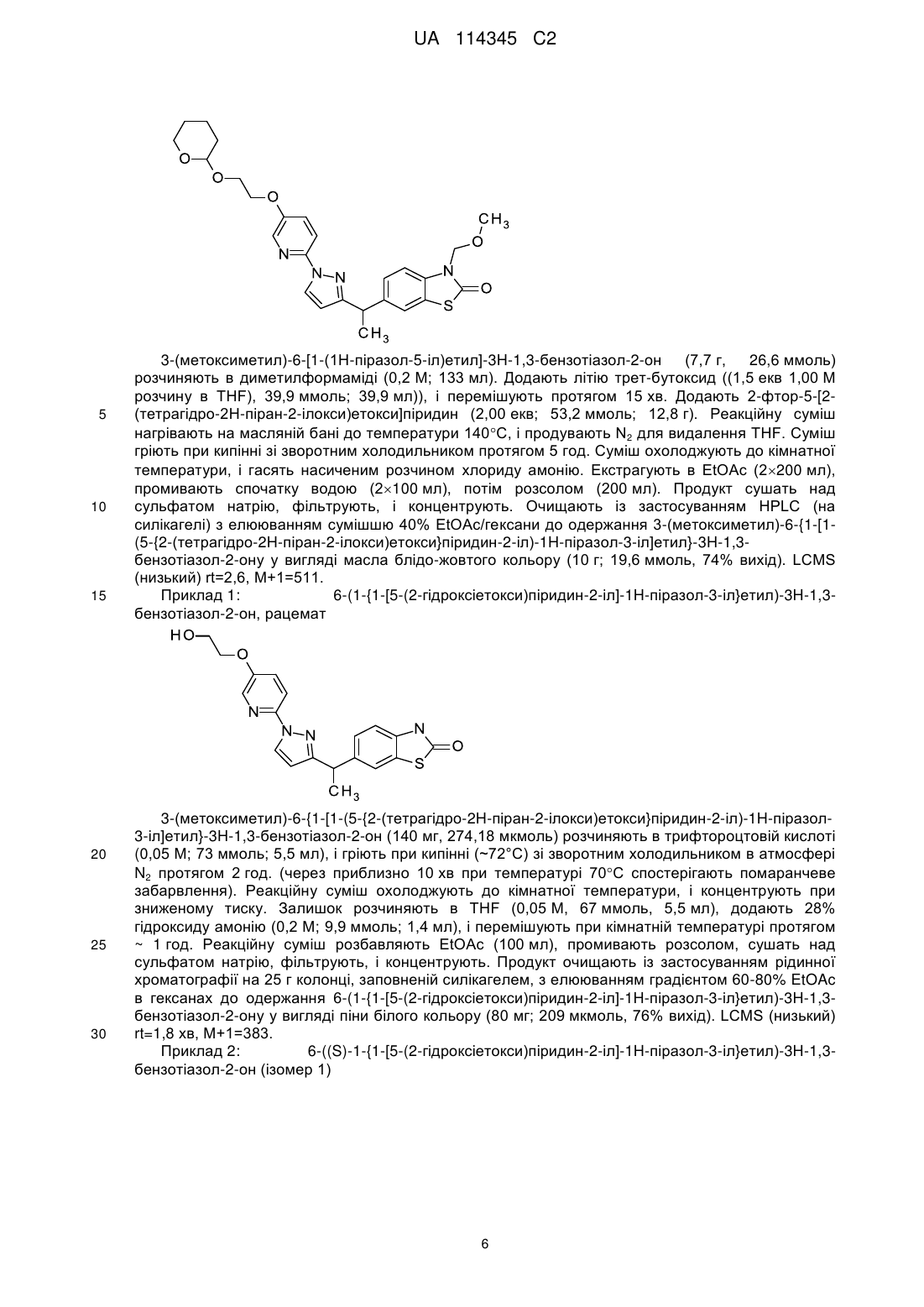
6-((s)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1н-піразол-3-іл}етил)-3н-1,3-бензотіазол-2-он як антагоніст tarp-гамма 8-залежного рецептора ampa
Номер патенту: 114345
Опубліковано: 25.05.2017
Автори: Уіткін Джеффрі Майкл, Ріл Джон Кевін, Портер Уоррен Джей
Формула / Реферат
1. Сполука формули
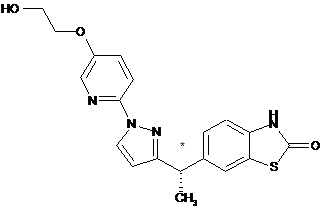
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка являє собою 6-((S)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3-бензотіазол-2-он.
3. Фармацевтична композиція, яка містить 6-((S)-l-{l-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3-бензотіазол-2-он або його фармацевтично прийнятну сіль, і один або декілька фармацевтично прийнятний(-их) носій(-їв), розріджувач(-ів) або наповнювач(-ів).
4. Сполука або сіль за будь-яким з пп. 1 або 2 для застосування у терапії.
5. Сполука або сіль за будь-яким з пп. 1 або 2 для застосування у лікуванні нападів у ссавця, який страждає на епілепсію.
6. Сполука або сіль за п. 5, де згадані напади являють собою прості або складні часткові епілептичні напади.
7. Сполука або сіль за п. 5, де згадані напади являють собою первинно-генералізовані та/або вторинно-генералізовані епілептичні напади.
8. Сполука або сіль за будь-яким з пп. 5-7, де ссавець являє собою людину.
9. Сполука або сіль за будь-яким з пп. 5-8, де застосування являє собою одночасне, роздільне або послідовне комбінування з іншим антиепілептичним лікарським засобом.
10. Сполука або сіль за п. 9, де іншим антиепілептичним лікарським засобом є леветірацетам, габапентин, топірамат або карбамазепін.
11. Сполука або сіль за будь-яким з пп. 1 або 2 для застосування у лікуванні болю у ссавця.
12. Сполука або сіль за п. 11, де ссавцем є людина.
Текст
Реферат: Описаний антагоніст TARP γ8-залежних рецепторів АМРА формули (I) або фармацевтично прийнятна соль, застосування і способи його одержання. HO O N N H N N O * S CH3 (І) UA 114345 C2 (12) UA 114345 C2 * (I) UA 114345 C2 5 10 15 20 25 30 35 40 45 50 55 60 На епілепсію у всьому світі страждає понад 50 мільйонів людей, причому 30-40% пацієнтів, яких піддавали лікуванню, є стійкими до традиційного медикаментозного лікування, і лише приблизно 8% пацієнтів, яких піддавали лікуванню, позбавляються епілептичних нападів. Епілепсію часто розпізнають тоді, коли людина має два або декілька неспровокованих епілептичних напади(-ів). Міжнародна ліга боротьби проти епілепсії (ILAE) визначає епілептичний напад як "тимчасову появу ознак та/або симптомів, викликаних аномально надмірною або синхронною активністю нейронів у мозку." Вважають, що епілептичні напади мають низку важливих взаємозв'язаних причин, які ускладнюють лікування епілепсії. Епілептичні напади розділені відповідно до їх клінічних проявів, в тому числі генералізовані епілептичні напади (малий епілептичний напад, атонічний епілептичний напад, тоніко-клонічний (великий) епілептичний напад і міоклонічний епілептичний напад), простий і складний часткові епілептичні напади, епілептичні напади з істеричним сміхом, епілептичні напади з плачем і епілептичний статус. Сучасні методи терапії націлені на ряд механізмів, в тому числі агонізм рецептора GABA (ГАМК, -аміномасляна кислота), блокатори кальцієвих каналів Т-типу, модулятори натрієвих каналів, модуляцію синаптичних пухирців білка SV2A та пригнічування ГАМК-трансамінази. Нещодавно, також з метою лікування епілептичних нападів, були досліджені антагоністи рецепторів АМРА. Рецептори АМРА (-аміно-3-гідроксил-5-метил-4-ізоксазолпропіонова кислота) являють собою глутаматчутливі іонні канали на постсинаптичних мембранах збуджувальних синапсів у центральній нервовій системі і є значною мірою відповідальними за опосередкування швидкої нейротрансмісії на синаптичних щілинах. Антагоністи рецепторів АМРА є відомими як антиконвульсивні засоби, і їх здатність до негативної модуляції збуджувальної нейротрансмісії відіграє ключову роль в їх анти-епілептичному терапевтичному потенціалі. Однак, оскільки активність рецепторів АМРА є убіквитарною в ЦНС, загальний антагонізм зачіпає більшість ділянок ЦНС, що призводить до небажаних наслідків, таких як атаксія, седативний ефект та/або запаморочення, які є спільними для всіх відомих загальних антагоністів рецепторів АМРА. Зазвичай ці загальні антагоністи мають дуже вузький інтервал терапевтичного дозування, що означає, що зазвичай дози, необхідні для забезпечення антиконвульсивної активності, є близькими до доз, при яких спостерігаються небажані наслідки, або частково співпадають з ними. (Michael A. Rogawski. "Revisiting AMPA Receptors as an Antiepileptic Drug Target" Epilepsy Currents 11.2 (2011)). Трансмембранні регуляторні білки рецепторів АМРА (TARP) є порівняно нещодавно виявленою родиною білків, які, як було встановлено, асоціюються з рецепторами АМРА і модулюють їх активність. Декілька TARP є досить регіоспецифічними в головному мозку, що призводить до фізіологічної диференціації активності рецепторів АМРА. Наприклад, TARP 2 (старгазин)-залежні рецептори АМРА локалізуються насамперед в мозочку і корі головного мозку, у той час як TARP 8-залежні рецептори АМРА локалізуються насамперед в гіпокампі, ділянка якого має особливе значення для виникнення та/або розповсюдження епілептичних нападів. Було висунуто припущення, що цілеспрямований вплив на окремі TARP може надати можливість селективного модулювання конкретних контурів головного мозку без справляння глобального впливу на синаптичну передачу (Gill, Martin B. and Bredt, David S., Neuropsychopharmacology 36(1): 362-363 (2011). Леветірацетам ((S)-2-(2-оксопіролідин-1-іл)бутанамід), габапентин (2-[1(амінометил)циклогексил]оцтова кислота), топірамат (2,3:4,5-біс-О-(1-метилетиліден)-бета-Dфруктопіранози сульфамат) і карбамазепін (5Н-дибензо[b,f]азепін-5-карбоксамід) є на даний час провідними терапевтичними лікарськими засобами від епілептичних нападів. Як видається, жоден із апробованих на цей час препаратів не діє виключно через модуляцію рецепторів АМРА. Талампанел ((8R)-7-ацетил-5-(4-амінофеніл)-8,9-дигідро-8-метил-7Н-1,3-діоксоло[4,5h][2,3]бензодіазепін), селурампанел (BGG492) (N-[7-ізопропіл-6-(2-метил-2H-піразол-3-іл)-2,4діоксо-1,4-дигідро-2H-хіназолін-3-іл]метансульфонамід) і парампанел (5'-(2-ціанофеніл)-1'феніл-2,3'-біпіридиніл-6'(1'H)-он) є загальними (не-TARP-залежними/неселективними) антагоністами рецепторів АМРА, що випробовували як антиепілептичні препарати. У цьому описі зроблено припущення про те, що селективний неконкурентний антагоніст TARP 8-залежних рецепторів АМРА може бути ефективним антинападовим/антиепілептичним терапевтичним засобом без побічних ефектів (наприклад, седативного ефекту, атаксії та/або запаморочення) загальних (не-TARP-залежних/неселективних) антагоністів AMPA або антагоністів TARP 2-залежних рецепторів АМРА, які є більш пов'язаними з антагонізмом рецепторів АМРА в мозочку. У цьому винаході запропонована сполука, яка демонструє сильну і селективну 1 UA 114345 C2 5 антагоністичну активність проти TARP 8-залежних рецепторів АМРА in vitro, а також ефективність на тваринних моделях епілептичного нападу і болю. Тому у цьому винаході запропонована сполука, яка, як вважають, може бути придатною для лікування нападів у хворих на епілепсію, як, наприклад, простого та/або складного часткових початкових епілептичних нападів та/або первинно-генералізованого та/або вторинно-генералізованого епілептичних нападів. Сполука за цим винаходом може також бути придатною для лікування болю. Більше конкретно, у цьому винаході запропонована сполука Формули I * 10 15 20 25 30 35 40 45 50 I (тобто 6-((S)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3-бензотіазол2-он) або її фармацевтично прийнятна сіль. У одному з аспектів цього винаходу запропонована фармацевтична композиція, що містить сполуку Формули I або її фармацевтично прийнятну сіль, та один або більше фармацевтично прийнятний(-их) носій(-їв), розріджувач(-ів) або наповнювач(-ів). На додаток до цього у цьому аспекті винаходу запропонована фармацевтична композиція для лікування епілептичних нападів, наприклад, простого і/або складного часткових початкових епілептичних нападів та/або первинно-генералізованого та/або вторинно-генералізованого епілептичних нападів, у пацієнтів, що страждають на епілепсію, що містить сполуку Формули I або її фармацевтично прийнятну сіль, та один або більше фармацевтично прийнятного(-их) наповнювач(-ів), носій(-їв) або розріджувач(-ів). Далі, за цим аспектом винаходу запропонована фармацевтична композиція, що містить сполуку Формули I або її фармацевтично прийнятну сіль, другий терапевтичний засіб, який являє собою антиепілептичний лікарський засіб, наприклад, леветірацетам, габапентин, топірамат або карбамазепін, та один або більше фармацевтично прийнятного(-их) носій(-їв), розріджувач(-ів) або наповнювач(-ів). У цьому винаході також запропонований спосіб лікування епілептичних нападів, наприклад, простого та/або складного часткових епілептичних нападів та/або первинно-генералізованого та/або вторинно-генералізованого епілептичних нападів, у ссавця, який страждає на епілепсію, що включає введення ссавцю, який потребує такого лікування, ефективної кількості сполуки Формули I або її фармацевтично прийнятної солі. У одному із варіантів здійснення цього аспекту винаходу згаданий спосіб включає одночасне, роздільне або послідовне введення в комбінації з іншим терапевтичним засобом, що являє собою антиепілептичний лікарський засіб, наприклад, леветірацетам, габапентин, топірамат або карбамазепін. У одному з конкретних варіантів здійснення цих способів лікування ссавцем є людина. За цим винаходом також запропонована сполука Формули I або її фармацевтично прийнятна сіль для застосування у терапії. У межах цього аспекта за цим винаходом запропонована сполука Формули I або її фармацевтично прийнятна сіль для застосування у лікуванні епілептичних нападів, наприклад, простого та/або складного часткових епілептичних нападів та/або первинно-генералізованого та/або вторинно-генералізованого епілептичних нападів, у ссавця, зокрема, людини, який(-а) страждає на епілепсію. За цим аспектом винаходу запропонована сполука Формули I або її фармацевтично прийнятна сіль для застосування з одночасним, роздільним або послідовним комбінуванням з антиепілептичним лікарським засобом, наприклад, леветірацетамом, габапентином, топіраматом або карбамазепіном, у лікуванні епілептичних нападів у ссавця, зокрема, людини, який(-а) страждає на епілепсію. За іншим аспектом цього винаходу запропоноване застосування сполуки Формули I або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування нападів, наприклад, простого та/або складного часткових епілептичних нападів та/або первинногенералізованого та/або вторинно-генералізованого епілептичних нападів, у ссавця, зокрема, людини, який(-а) страждає на епілепсію. За цим винаходом запропоноване застосування сполуки Формули I або її фармацевтично прийнятної солі у виготовленні лікарського засобу для лікування нападів, наприклад, простого та/або складного часткових епілептичних нападів та/або первинно-генералізованого та/або вторинно-генералізованого епілептичних нападів, у ссавця, зокрема людини, який(-а) страждає на епілепсію, причому згаданий лікарський засіб має 2 UA 114345 C2 5 10 15 20 25 30 35 40 45 50 55 60 вводитись з одночасним, роздільним або послідовним комбінуванням з іншим терапевтичним засобом, який є антиепілептичним лікарським засобом, таким як, наприклад, леветірацетам, габапентин, топірамат або карбамазепін. За ще одним аспектом цього винаходу запропонована фармацевтична композиція для лікування болю, що включає сполуку Формули I або її фармацевтично прийнятну сіль, і один або більше фармацевтично прийнятного(-их) наповнювача(-ів), носія(-їв) або розріджувача(-ів). За іншим аспектом цього винаходу запропонований спосіб лікування болю у ссавця, що включає введення ссавцю, який потребує такого лікування, ефективної кількості сполуки Формули I або її фармацевтично прийнятної солі. У одному з конкретних варіантів здійснення цього способу лікування згаданим ссавцем є людина. За іншим аспектом цього винаходу запропонована сполука Формули I або її фармацевтично прийнятна сіль для застосування у лікуванні болю, зокрема, у людини. За іншим аспектом цього винаходу запропоноване застосування сполуки Формули I або її фармацевтично прийнятної солі у виготовленні лікарського засобу для лікування болю. Сполуки за цим винаходом мають основні і кислотні складові, і відповідно реагують з рядом органічних та неорганічних кислот і основ з утворенням фармацевтично прийнятних солей. Фармацевтично прийнятні солі сполуки за цим винаходом охоплюються обсягом цієї заявки на патент. Термін “фармацевтично прийнятна сіль” у значенні, вживаному у цьому описі, означає будь-яку сіль сполуки за цим винаходом, яка є по суті нетоксичною для живих організмів. Такі фармацевтично прийнятні солі та загальні методики їх одержання є добре відомими в цій галузі. Дивись, наприклад, P. Stahl, et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE, (VCHA/Wiley-VCH, 2008); та S.M. Berge, et al., “Pharmaceutical Salts”, Journal of Pharmaceutical Sciences, Vol 66, No. 1, January 1977. Скорочення, вжиті в цьому описі, визначені так: "AMPA" означає -аміно-3-гідроксил-5-метил-4-ізоксазол-пропіонову кислоту. "Розсол" означає насичений розчин NaCl. "CHO" означає яєчник китайського хом'ячка. "CTZ" означає циклотіазид. "DCM' означає дихлорметан. "DMEM" означає модифіковане за способом Дульбекко середовище Ігла. "DMSO" означає диметилсульфоксид (пердейтерований [d6], якщо для ЯМР). "ED50" означає дозу, що спричинює 50% максимального ефекту, який спостерігається. "Eq" означає мольний еквівалент. "EtOAc" означає етилацетат. "EtOH" означає етанол. "FLIPR" означає флуоресцентний планшет-рідер. "HBSS" означає збалансований сольовий розчин Хенкса. "HEPES" означає 4-(2-гідроксіетил)-1-піперазинетансульфонову кислоту. "HPLC" означає рідинну хроматографію високої ефективності. "hr." or "h" означає годину або години. "IC50" означає концентрацію, яка забезпечує 50% максимального пригнічення. "LCMS" означає рідинна хроматографія з мас-спектроскопічним детектуванням. "MeOH" означає метанол. "min." or "m" означає хвилини. "MS" означає мас-спектроскопію або мас-спектр. "p.o." означає per os, через рот. "PTZ" означає пентилентетразол. "RT" означає час утримування. "S.C." означає підшкірний. "SEM" означає середню квадратичну помилку середнього. "TARP" означає трансмембранний регуляторний білок рецептора AMPA. "THF" означає тетрагідрофуран. "VCD" означає вібраційний кільцевий дихроїзм. "XRPD" означає дифракцію рентгенівських променів (рентгенографію). Загальна хімія Сполуку за цим винаходом можна одержати із застосуванням звичайних способів, добре відомих та застосовуваних у цій галузі. Прийнятні реакційні умови для стадій цих схем є добре відомими у цій галузі, і придатні заміни розчинників та кореагентів можуть бути визначені фахівцем у цій галузі. Більше того, фахівцям у цій галузі буде зрозуміло, що у разі потреби або необхідності проміжні продукти синтезу можуть бути виділені та/або очищені різними добре 3 UA 114345 C2 5 10 15 20 25 30 35 40 відомими способами, і що часто буде можливе застосування різних проміжних продуктів безпосередньо на подальших стадіях синтезу з незначним очищенням або зовсім без очищення. На додаток до цього, фахівцю буде зрозуміло, що за деяких обставин порядок, за яким вводяться складові, не є критичним. У наведених нижче пояснювальних препаративних методиках і прикладах розчинники зазвичай видаляють при зниженому тиску (випаровують). У деяких методиках зазначені виходи являють собою репрезентативні виходи неочищених продуктів, які виділяють шляхом випаровування або фільтрації і використовують безпосередньо без додаткового очищення. Препаративна методика 1: 6-ацетил-3-(метоксиметил)-3H-1,3-бензотіазол-2-он До розчину 6-ацетил-3H-1,3-бензотіазол-2-ону (40,0 г, 207 ммоль) в диметилформаміді (690 мл) додають карбонат цезію (1,5 екв; 310,5 ммоль; 101,1 г). Краплями додають хлорметилметиловий простий ефір (1,3 екв, 269 ммоль, 20,4 мл), і перемішують при кімнатній температурі протягом 18 год. Продукт переносять в ділильну лійку, додають EtOAc (1 л), промивають водою (2200 мл), потім розсолом (200 мл), та піддають зворотному екстрагуванню із застосуванням DCM (300 мл). Об'єднані органічні шари сушать над Na 2SO4, фільтрують, і концентрують. Концентрат суспендують в 200 мл суміші гексани/EtOAc (75:25), і фільтрують до одержання 6-ацетил-3-(метоксиметил)-3H-1,3-бензотіазол-2-ону у вигляді твердої речовини білого кольору (37,0 г, 156 ммоль, 75% вихід). LCMS (низький) rt=1,68 хв, M+1=238. Препаративна методика 2: 6-[1-гідрокси-1-(1-тетрагідропіран-2-іл-1H-піразол-5-іл)етил]-3(метоксиметил)-3H-1,3-бензотіазол-2-он (Рацемічна суміш діастереомерів) У висушену в полум’ї пальника 2 л тригорлу круглодонну колбу вміщують 1-тетрагідропіран2-ілпіразол (1,5 екв, 202 ммоль, 30,8 г) (компанія Aldrich) та THF (900 мл), і охолоджують до температури -78C (баня: сухий лід/ацетон). Краплями додають трет-бутиллітій (2,5 М розчин в THF) (1,5 екв, 202 ммоль; 81,0 мл) при температурі, яку підтримують на рівні щонайменше 68С, і перемішують протягом 60 хв при температурі -78С. Краплями протягом 45 хв додають розчин 6-ацетил-3-(метоксиметил)-3H-1,3-бензотіазол-2-ону (32,0 г, 134 ммоль) в THF (450 мл), і перемішують при температурі -78C протягом 30 хв. Баню з сухим льодом видаляють, дозволяють суміші нагрітися до температури -50С, і перемішують протягом 1 год. (температура не має підійматись вище -45C). Реакційну суміш гасять MeOH (80 мл), переносять в ділильну лійку, додають EtOAc (2000 мл), і промивають спочатку водою (500 мл), а потім розсолом (500 мл). Органічний шар сушать над Na2SO4, фільтрують, і концентрують до одержання неочищеного масла жовтого кольору. Вказаний матеріал очищають із застосуванням HPLC з елююванням сумішшю гексани/етилацетат (6:4) для одержання 6-[1-гідрокси-1-(1тетрагідропіран-2-іл-1H-піразол-5-іл)етил]-3-(метоксиметил)-3H-1,3-бензотіазол-2-ону у вигляді піни білого кольору (44 г, 113 ммоль, 84% вихід) (рацемічна суміш діастереомерів). LCMS (низький) rt=1,76 хв, M+1=288, та rt=1,86 хв, M+1=288. Препаративна методика 3: 3-(метоксиметил)-6-[1-(1Н-піразол-5-іл)етеніл]-3H-1,3бензотіазол-2-он 4 UA 114345 C2 5 10 15 20 25 30 35 До розчину 6-[1-гідрокси-1-(1-тетрагідропіран-2-іл-1H-піразол-5-іл)етил]-3-(метоксиметил)3H-1,3-бензотіазол-2-ону (44 г, 113 ммоль) в DCM (0,2 М, 8,81 моль, 565 мл) додають трифтороцтову кислоту (20 екв (мольних), 2,26 моль, 170 мл), і перемішують при кімнатній температурі протягом ночі (~ 16 год.). Одержану реакційну суміш темно-фіолетового кольору концентрують, розчиняють в EtOAc (2 л), і цей розчин нейтралізують шляхом повільного додавання насиченого водного розчину бікарбонату натрію, переносять на ділильну лійку, і екстрагують в EtOAc, промивають спочатку водою (300 мл), а потім розсолом (300 мл). Сушать над Na2SO4, фільтрують, і концентрують. Одержаний матеріал очищають із застосуванням HPLC з елююванням сумішшю EtOAc/гексани (1:1) до одержання 3-(метоксиметил)-6-[1-(1Нпіразол-5-іл)етеніл]-3H-1,3-бензотіазол-2-ону (30 г, 104 ммоль, 92% вихід) у вигляді густого масла жовтого кольору. Бажаний LCMS (низький) пік продукту при rt=1,82 хв, M+1=288. Препаративна методика 4: 3-(метоксиметил)-6-[1-(1Н-піразол-5-іл)етил]-3H-1,3-бензотіазол2-он У продуту N2 колбу додають 5% паладій на деревному вугіллі (15 г; 7,0 ммоль) і EtOAc (250 мл). 3-(метоксиметил)-6-[1-(1Н-піразол-5-іл)етеніл]-3H-1,3-бензотіазол-2-он (29 г, 101 ммоль) додають у вигляді розчину в EtOAc (250 мл). Колбу знегажують під вакуумом, і заповнюють воднем за допомогою еластичної камери. Суміш перемішують протягом ночі, надлишок водню видаляють під тиском, і продувають N 2. Фільтрують через діатомову землю, і концентрують до одержання 3-(метоксиметил)-6-[1-(1Н-піразол-5-іл)етил]-3H-1,3-бензотіазол-2ону у вигляді густого масла жовтого кольору (27 г, 93 ммоль, 92% вихід). Матеріал може бути перенесений на наступну стадію без додаткового очищення. LCMS (низький) rt=1,73 хв, M+1=290. Препаративна методика 5: 2-фтор-5-[2-(тетрагідро-2Н-піран-2-ілокси)етокси]піридин До розчину 2-фтор-5-гідроксипіридину (2,0 г, 1,00 екв, 17,68 ммоль) в диметилформаміді (0,3 М; 762,37 ммоль; 59,0 мл) додають спочатку карбонат цезію (3 екв, 53,05 ммоль; 17,2 г), потім 2-(2-брометокси)тетрагідро-2H-піран (17,7 ммоль, 3,7 г), і перемішують при кімнатній температурі протягом ночі. Суміш переносять на ділильну лійку, і додають EtOAc (500 мл). Органічний шар промивають спочатку водою (300 мл), потім розсолом (200 мл), сушать над Na2SO4, фільтрують, і концентрують. Неочищену суміш очищають із застосуванням HPLC з елююванням сумішшю гексани/EtOAc (7/3) до одержання 2-фтор-5-[2-(тетрагідро-2Н-піран-2ілокси)етокси]піридину у вигляді масла блідо-жовтого кольору (3,9 г, 16,2 ммоль; 91% вихід). LCMS (низький) rt=1,8 хв, M+1=242. Препаративна методика 6: 3-(метоксиметил)-6-{1-[1-(5-{2-(тетрагідро-2H-піран-2ілокси)етокси}піридин-2-іл)-1H-піразол-3-іл]етил}-3H-1,3-бензотіазол-2-он (Рацемічна суміш діастереомерів) 5 UA 114345 C2 5 10 15 20 25 30 3-(метоксиметил)-6-[1-(1Н-піразол-5-іл)етил]-3H-1,3-бензотіазол-2-он (7,7 г, 26,6 ммоль) розчиняють в диметилформаміді (0,2 М; 133 мл). Додають літію трет-бутоксид ((1,5 екв 1,00 М розчину в THF), 39,9 ммоль; 39,9 мл)), і перемішують протягом 15 хв. Додають 2-фтор-5-[2(тетрагідро-2Н-піран-2-ілокси)етокси]піридин (2,00 екв; 53,2 ммоль; 12,8 г). Реакційну суміш нагрівають на масляній бані до температури 140С, і продувають N2 для видалення THF. Суміш гріють при кипінні зі зворотним холодильником протягом 5 год. Суміш охолоджують до кімнатної температури, і гасять насиченим розчином хлориду амонію. Екстрагують в EtOAc (2200 мл), промивають спочатку водою (2100 мл), потім розсолом (200 мл). Продукт сушать над сульфатом натрію, фільтрують, і концентрують. Очищають із застосуванням HPLC (на силікагелі) з елююванням сумішшю 40% EtOAc/гексани до одержання 3-(метоксиметил)-6-{1-[1(5-{2-(тетрагідро-2H-піран-2-ілокси)етокси}піридин-2-іл)-1H-піразол-3-іл]етил}-3H-1,3бензотіазол-2-ону у вигляді масла блідо-жовтого кольору (10 г; 19,6 ммоль, 74% вихід). LCMS (низький) rt=2,6, М+1=511. Приклад 1: 6-(1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3бензотіазол-2-он, рацемат 3-(метоксиметил)-6-{1-[1-(5-{2-(тетрагідро-2H-піран-2-ілокси)етокси}піридин-2-іл)-1H-піразол3-іл]етил}-3H-1,3-бензотіазол-2-он (140 мг, 274,18 мкмоль) розчиняють в трифтороцтовій кислоті (0,05 М; 73 ммоль; 5,5 мл), і гріють при кипінні (~72°C) зі зворотним холодильником в атмосфері N2 протягом 2 год. (через приблизно 10 хв при температурі 70С спостерігають помаранчеве забарвлення). Реакційну суміш охолоджують до кімнатної температури, і концентрують при зниженому тиску. Залишок розчиняють в THF (0,05 М, 67 ммоль, 5,5 мл), додають 28% гідроксиду амонію (0,2 М; 9,9 ммоль; 1,4 мл), і перемішують при кімнатній температурі протягом ~ 1 год. Реакційну суміш розбавляють EtOAc (100 мл), промивають розсолом, сушать над сульфатом натрію, фільтрують, і концентрують. Продукт очищають із застосуванням рідинної хроматографії на 25 г колонці, заповненій силікагелем, з елююванням градієнтом 60-80% EtOAc в гексанах до одержання 6-(1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3бензотіазол-2-ону у вигляді піни білого кольору (80 мг; 209 мкмоль, 76% вихід). LCMS (низький) rt=1,8 хв, М+1=383. Приклад 2: 6-((S)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3бензотіазол-2-он (ізомер 1) 6 UA 114345 C2 * 5 10 15 20 25 30 35 40 45 50 6-(1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3-бензотіазол-2-он (330 мг) розчиняють в МеОН (3,0 мл) і DCM (2,5 мл), і розділяють на енантіомери із застосуванням хіральної хроматографії з використанням Chiralcel OJ-H (колонка 2,115 см, 5 мкм, компанія Chiral Technologies Europe), з елююванням сумішшю 40% MeOH/рідкий CO 2, 70 мл/хв, детектування при 225 нм, впорскування 300 мкл аліквот на кожний цикл. Фракції, які містять розділені енантіомери, об'єднують, концентрують у вакуумі, та одержують Ізомер 1 (150 мг) і Ізомер 2 (169 мг) у вигляді аморфних твердих речовин білого кольору. Аналітична хіральна хроматографія із застосуванням Chiracel OJ-H (колонка 4,6150 мм, 5 мкм, компанія Chiral Technologies Europe), з елююванням сумішшю 40% MeOH/рідкий CO 2, 5 мл/хв, детектуванням при 225 нм, визначила для Ізомера 1 rt=2,03 хв і для Ізомера 2 rt=2,66 хв LCMS (низький): Ізомер 1, rt=1,8 хв, М+1=383; Ізомер 2, rt=1,8 хв, M+1=383. Кристалізація: Форма I: 6-((S)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3-бензотіазол-2-он (Ізомер 1) (56,9 мг) розчиняють в суміші EtOH:гептан (1:1) (3,0 мл), та перемішують протягом 20 хв при температурі 70С. Розчин фільтрують у гарячому стані, і розділяють на дві рівні частини; одну з яких переносять у пробірку при температурі навколишнього середовища, закривають, та перемішують протягом ночі при температурі 5С. Тверді речовини видаляють фільтруванням, та сушать в атмосфері азоту до одержання кристалічної Форми I (23,9 мг, 84% вихід). Абсолютна стереохімія Ізомеру I із застосуванням монокристалічної рентгенівської кристалографії підтверджується як 6-((S)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3іл}етил)-3H-1,3-бензотіазол-2-он. Порошкова рентгенографія Порошкові рентгенограми кристалічних твердих речовин одержують із застосуванням порошкового рентгенівського дифрактометру Bruker D4 Endeavor, спорядженого джерелом CuKa (=1,54060 Å) і детектором Vantec, що працює при 35 кВ і 50 мА. Зразок сканують у межах 4-40 2 з величиною кроку, що дорівнює 0,0087° 2, при швидкості сканування 0,5 с/крок, з 0,6 мм розходженням, фіксованим рівнем антирозсіювання 5,28 мм та 9,5 мм діафрагмами детектору. Сухим порошком наповнюють кварцовий тримач зразку; гладку поверхню одержують із застосуванням предметного скла. З кристалографії добре відомо, що для будь-якої певної кристалічної форми відносна інтенсивність дифракційних піків може змінюватись унаслідок переважної орієнтації, яка є наслідком таких, наприклад, факторів, як морфологія і форма кристалу. Якщо наявні впливи переважної орієнтації, інтенсивність піків змінюється, однак характеристичні позиції піків поліморфних модифікацій залишаються незмінними. Дивись, наприклад, The U.S. Pharmacopeia 33 - National Formulary 28 Chapter Characterization of Crystalline Solids by X-ray Powder Diffraction (XRPD) Official October 1, 2010-February 1, 2011. З кристалографії також добре відомо, що, для будь-якої даної кристалічної форми, кутові положення піків можуть дещо змінюватись. Наприклад, положення піків можуть зсуватись унаслідок змін температури або вологості, при яких аналізують зразок, зміщення зразку або присутності чи відсутності внутрішнього стандарту. У цьому випадку змінність положення піків ± 0,2 2 буде враховувати ці потенційні зміни без перешкоджання однозначній ідентифікації вказаної кристалічної форми. Підтвердження кристалічної форми може бути здійсненим на основі будь-якої унікальної комбінації характерних піків (в градусах 2), зазвичай більш виступних піків. Порошкові рентгенограми кристалічної форми, зібрані при температурі й відносній вологості навколишнього середовища, підганяють на основі стандартних піків NIST 675 при 8,85 і 26,77 градуса 2-тета. 6-((S)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3-іл}етил)-3H-1,3-бензотіазол-2-он (Ізомер 1) охарактеризований порошковою рентгенограмою із застосуванням випромінювання CuKa як такий, що має дифракційні піки (значення 2-тета), описані у наведений нижче 7 UA 114345 C2 5 Таблиці 1. Зокрема, ця рентгенограма містить пік при 15,81 у комбінації з одним або декількома піками, вибраними з групи, до складу якої входять 16,62, 14,39, 14,05, 11,54 та 10,99 з допуском на кути дифракції 0,2 градуси. Таблиця 1: Порошкові рентгенографічні піки 6-((S)-1-{1-[5-(2-гідроксіетокси) піридин-2-іл]-1Hпіразол-3-іл}етил)-3H-1,3-бензотіазол-2-ону (Ізомер 1) Форма 1. Пік Інтенсивність (%) Кут ( 2-тета) 1 5,44 8 2 7,85 21 3 10,99 44 4 11,54 34 5 14,05 75 6 14,39 26 7 15,81 100 8 16,62 27 9 14 25,05 15 26,24 9 28,40 8 16 35 23,41 15 30 8 14 25 22,69 13 20 16 12 15 8 21,61 11 10 20,22 10 35,08 11 Дані, одержані in vitro і в експериментах на тваринах, підтверджують роль антагоністів TARP 8-залежних рецепторів АМРА і сполук за цим винаходом, зокрема, у лікуванні епілептичних нападів. Зокрема було виявлено, що сполука за цим винаходом селективно антагонізує TARP 8-залежні рецептори АМРА з високою активністю, і захищає від епілептичних нападів на пацючій моделі нападів, індукованих пентилентетразолом (PTZ). Згадана сполука за цим винаходом також демонструє анальгетичну активність на мишачій моделі болю, індукованого формаліном. Для подальшої демонстрації властивостей сполук за цим винаходом, ці сполуки можуть бути піддані наведеним нижче випробуванням in vitro та in vivo: Функціональне дослідження антагоністів з використанням FLIPR Селективність сполук-антагоністів рецептора АМРА відносно підтипу TARP доводять шляхом порівняння активності сполук на флоп-ізоформі субодиниць GluA1 рецептора АМРА, що коекспресуються в клітинах СНО-S, збагачених TARP (TARP -8) з гіпокампу або TARP (TARP -2) з мозочка. TARP-залежність сполук-антагоністів рецептора АМРА доводять шляхом порівняння вищезгаданої активності з активністю на фліп-ізоформі субодиниць GluA1 рецептора АМРА, що експресуються в клітинах СНО-S за відсутності коекспресованого TARP. Стисло, клітини CHO-S (компанія Invitrogen) вирощують у вигляді суспензії у виготовленому 7 на замовлення живильному середовищі 50/50 з густиною 110 клітин/мл. (Виготовлене на замовлення живильне середовище 50/50 являє собою живильне середовище з низьким вмістом кальцію, яке одержують у вигляді суміші (1:1 за об’ємом) середовища CD CHO (компанія Gibco, № за каталогом 10743) і виготовленого на замовлення живильного середовища повного складу. Це виготовлене на замовлення живильне середовище повного складу виготовляють додаванням 0,40 мг/л трополону, 5,00 мг/л інсуліну, 20 мМ HEPES і 0,075% Pluronic F68 до виготовленого на замовлення основного живильного середовища, яке має такий склад: (значення в мг/л, якщо не вказано інше) 11,01 безводного хлориду кальцію, 0,050 нітрату заліза(III) - 9H2O, 0,420 сульфату заліза(II) - 7H2O, 28,64 безводного хлориду магнію, 48,84 безводного сульфату магнію, 312,14 KCl, 5505,96 NaCl, 62,57 дигідрофосфату натрію, 71,28 безводного гідрофосфату натрію, 0,432 сульфату цинку - 7H2O, 10,0 етаноламіну HCl, 6000 Dглюкози (декстрози), 0,210 DL ліпоєвої (тіоктової) кислоти, 0,081 путресцину 2 HCl, 4,78 гіпоксантину натрію, 220,24 пірувату натрію, 0,730 тимідину, 8,90 L-аланіну, 211,23 L-аргініну HCl, 15,02 L-аспарагіну Н2О, 13,31 L-аспарагінової кислоти, 62,67 цистину 2 HCl, 7,360 L 8 UA 114345 C2 5 10 15 20 25 30 35 40 45 50 55 глутамінової кислоти, 146,16 L-глутаміну, 30,0 гліцину, 42,04 L-гістидину HCl 2 H2O, 105,11 Lізолейцину, 105,11 L-лейцину, 146,16 L-лізину HCl, 30,03 L-метіоніну, 66,07 L-фенілаланіну, 17,27 L-проліну, 42,04 L-серину, 95,1 L-треоніну, 16,02 L-триптофану, 104,11 L-тирозину динатрієвої солі, 94,1 L-валіну, 8,99 хлориду холіну, 4,00 фолієвої кислоти, 12,61 вітаміну I (інозиту), 4,00 ніацинаміду, 4,00 піридоксалю HCl, 0,031 піридоксину HCl, 0,400 рибофлавіну, 4,00 пантотенату натрію, 4,00 тіаміну HCl, 0,680 вітаміну B12 і 2200 бікарбонату натрію). Клітини центрифугують при 1000g протягом 15 хв, і ресуспендують у свіжому виготовленому на 6 замовлення живильному середовищі 50/50 з густиною 210 клітин/мл. Для періодичної трансфекції, на кожен літр клітин використовують 2 мг тотальної ДНК. Для трансфекції GluA1-8 клітин CHO-S людську GluA1Qflop-Cacng8-pBudCE4.1 ДНК (компанія Qiagen) і людську EAAT3 pAN104 ДНК (компанія Qiagen, транспортер глутаміну) змішують у співвідношенні 2:3. Для трансфекції GluA1-2 клітин CHO-S використовують людську GluA1Qflop-Cacng2-pBudCE4.1 (компанія Qiagen). Для трансфекції GluA1flip клітин CHO-S використовують людську GluA1flip pcDNA3.1 ДНК (компанія Qiagen). Для одержання комплексу ДНК до виготовленого на замовлення основного живильного середовища (дивись вище) ДНК і реактив FreeStyle MAX (компанія Invitrogen, № за каталогом 16447-500) додають у співвідношенні 10 мкг тотальної ДНК:10 мкл реактиву FreeStyle MAX:1 мл середовища. Через 15 хв до підготовленої культури клітин додають відповідний об’єм (20% об’ємн.) комплексу ДНК. Тимчасово трансфековані клітини СНО-S збирають через 48 год., і заморожують в аліквотах для подальшого використання. Функціонування та фармакологію рецепторів АМРА в трансфекованих клітинах перевіряють як на свіжоодержаних, так і на відтаяних аліквотах клітин. Заморожені трансфековані клітини СНО-S, які експресують рецептори АМРА, відтаюють, і висівають на модифіковане за способом Дульбекко середовище Ігла (DMEM) (компанія Gibco, № за каталогом 11960), яке містить 5% діалізованої ембріональної бичачої сироватки (компанія Gibco, № за каталогом 26400-036) і 20 мМ HEPES, з розрахунку 50000 клітин на лунку в 384лункових планшетах, сенсибілізованих полі-D-лізином (компанія Becton Dickinson, № за каталогом 354663), і культивують протягом ночі при температурі 37С. У день експерименту приготовляють два буфери з флуоресцентним барвником. Буфер з барвником Fluo-4 AM містить 5 мкМ барвника Fluo-4 AM (компанія Molecular Probes, № за каталогом F-14202) в збалансованому сольовому розчині Хенкса (HBSS), який містить 20 мМ HEPES (рН 7,4), 2,5 мМ пробенециду (компанія Sigma, № за каталогом P8761, уповільнює відкачування барвника клітинними транспортерами) і 5 нМ Pluronic F-127 (компанія Molecular Probes, № за каталогом P3000MP). Буфер з барвником Fluo-4 NW приготовляють шляхом вміщування 100 мл HBSS, який містить 20 мМ HEPES (рН 7,4) і 2,5 мМ пробенециду, у флакон з барвником Fluo-4 NW (компанія Molecular Probes, високопродуктивний пакет, № за каталогом F36205). На культивовані клітини GluA1-8 і GluA1-2 СНО-S наносять буфер з барвником Fluo-4 AM, і інкубують при температурі 22С протягом 2 год. На клітини GluA1flip СНО-S наносять барвник Fluo-4 NW, і інкубують при температурі 37С протягом 30 хв, після чого піддають додатковому інкубуванню протягом 90 хв при температурі 22С. Перед піддаванням клітин дії сполуки буфер с флуоресцентним барвником з планшетів для культивування клітин видаляють, і додають свіжий аналітичний буфер. Аналітичний буфер складається з HBSS з 20 мМ HEPES (рН 7,4), 2,5 мМ пробенециду і 4 мМ CaCl2. Дослідження починають додаванням сполук з подальшим стимулюванням клітин глутаматом (кінцева концентрація =45 мкм) і циклотіазидом (CTZ, кінцева ++ концентрація =20 мкМ) в аналітичному буфері. Зміни вмісту внутрішньоклітинного [Ca ] кінетично реєструють за допомогою флуоресцентного планшет-рідера (FLIPR). Уповільнення дії глутамату досліджуваними сполуками виражають як відсоток реакцій, стимульованих глутаматом плюс CTZ у присутності досліджуваних сполук, від дії, що спостерігається за відсутності досліджуваних сполук. Відносні IC50 обчислюють із застосуванням 4-параметричного нелінійного логістичного рівняння. Щоб підтвердити TARP-залежнуі TARP-селективну активність, сполуки так само оцінюють із застосуванням клітин СНО-S, які експресують лише GluA1flip або GluA1flop-2. Сполуку Прикладу 2 досліджують по суті так, як описано вище, та встановлюють, що вона уповільнює активацію глутаматом плюс CTZ TARP 8-залежних GluA1 флоп-рецепторів на рівні приблизно 85,60,7% (середнє SEM, n=9), при IC50 74,517,8 нМ (середнє SEM, n=9), і не пригнічує ні фліп-ізоформу, позбавлену TARP, ні TARP 2-залежні GluA1 флоп-рецептори (IC50>аналітична межа, яка становить 9260 нм). Отже очікується, що фізіологічно релевантні дози сполук за цим винаходом забезпечать істотне пригнічування TARP 8 рецепторів АМРА in vivo, без суттєвої взаємодії з іншими фізіологічно важливими рецепторами, як, наприклад, TARP-незалежними рецепторами або 9 UA 114345 C2 5 10 15 20 25 30 35 40 45 50 55 60 TARP 2-залежними рецепторами, і тому можуть бути корисними у лікуванні епілептичного нападу з одночасним уникненням при цьому небажаних ефектів, пов'язаних з не-TAPRзалежними антагоністами рецепторів АМРА. Пацюча модель епілептичних нападів, індукованих пентилентетразолом (PTZ): Пацюків-самців лінії Sprague Dawley (від компанії Harlan Sprague Dawley, Indianapolis, штат Індіана) масою 90-110 г під час випробування розміщають по 5 голів на клітку з їжею і водою ad libitum у приміщенні, розрахованому на велику колонію, зі стандартним циклом чергування світла і темряви (світло вмикають о 6 ранку, вимикають о 6 вечора). Тварин утримують у цьому приміщенні протягом щонайменше 3 діб до випробування. Тварин переводять до тихого приміщення за 1 год. до початку випробування. Тварин використовують тільки один раз. Тварин виймають, вводять досліджувану сполуку або носій (5% DMSO, 10% аравійської камеді і 0,05% протиспінювача Dow Corning 1510-US), p.o., 10 мл/кг, і повертають в клітку. Через двадцять п'ять хвилин після введення тварин поміщають на сітку, яку перевертають на 180 градусів для перевірки рухової недостатності. Тварин оцінюють через 60 с після перевертання так: 0, якщо тварина перелізає через сітку; 1, якщо тварина звисає під сіткою; 2, якщо тварина впала з сітки. Після завершення випробування на сітці, тваринам підшкірним шляхом вводять 35 мг/кг PTZ у фізіологічному розчині в об’ємі 1 мл/кг. Потім тварин поміщають в клітку для спостереження, і спостерігають протягом 30 хв після введення PTZ. Клонус визначають як клонічний напад передніх та/або задніх кінцівок, протягом якого пацюк демонструє втрату здатності до випрямлення. Тонічний напад визначають як втрату здатності до випрямлення з тонічним витяганням задніх кінцівок. Протягом періоду спостереження реєструється також летальність. Тварин оцінюють за наявністю нападів певного типу в будьякий час протягом періоду спостереження. Дані представляють у вигляді числа тварин, що мають напад даного типу (наприклад, клонічні напади 4/5 означають, що 4 з 5 тварин мали щонайменше один клонічний напад будь-якої тривалості в будь-який час протягом періоду спостереження). Сполуку Прикладу 2 випробували, по суті так, як описано вище, в діапазоні доз 1-10 мг/кг, і виявили, що пацюки є захищеними проти PTZ-індукованих нападів з оцінюваною ED50 1,74 мг/кг і 100% захистом при дозі 10 мг/кг, без жодної спостереженої рухової недостатності за результатами випробування з перевертанням сітки. Ці дані показують, що сполука Прикладу 2 є ефективною на пацючій моделі епілептичного нападу, і отже, що сполуки за цим винаходом можуть бути корисними у лікуванні епілептичного нападу з одночасним уникненням при цьому небажаних впливів, пов'язаних з не-TAPR-залежними антагоністами рецепторів АМРА. Здійснювана вручну модель болю, індукованого формаліном: Ручна модель болю, індукованого формаліном, є добре відомою для скринінгу сполук за знеболювальними властивостями (Mogil J.S. et al., Heritability of nociception I: Responses of 11 inbred mouse strains on 12 measures of nociception. Pain 80 (1999) 67-82). Дослідження проводять в боксах Plexiglas розмірами приблизно 101010 см. Дзеркало, розміщене в задній частині клітки, надає можливість безперешкодного спостереження за лапкою, у яку був впорскнутий формалін. Мишей-самців (Harlan (HSD) CD1-ICR), які не мали обмеження у їжі, розміщають окремо в боксах щонайменше за 60 хв до проведення експерименту. Всі випробування проводять в період з 08:00 год. до 16:00 год., і температуру в приміщенні для проведення випробувань підтримують на рівні 21-23С. В різні моменти часу перед введенням формаліну тваринам периферичними шляхами (p.o.) вводять численні дози досліджуваної сполуки (3 мг/кг, 10 мг/кг і 30 мг/кг), носія (5% DMSO в 10% аравійської камеді, 0,05% протиспінювача) та позитивного контролю (трамадол 80 мг/кг в 1% HEC, 0,25% Tween 80, 0,05% протиспінювача). Формалін (20 мкл 5%розчину в 0,9% фізіологічному розчині) вводять підшкірно в плантарну поверхню лівої задньої лапки за допомогою голки № 27. Спостереження починається відразу після ін'єкції формаліну. Індукований формаліном біль піддають кількісному визначенню шляхом реєстрації тривалості у секундах кожного явища лизання протягом 5 хв. Оцінку болю в балах здійснюють протягом 60 хв після ін'єкції формаліну. Як було описано раніше, спостерігають дві фази больової поведінки (Wheeler-Aceto, H., Porreca, F. and Cowan, A., The rat paw formalin test: comparison of noxious agents, Pain 40 (1990) 229-238). Ранню фазу, яка починається відразу після ін'єкції формаліну і триває приблизно 5 хв, та подальшу пізню фазу, яка починається між 10 хв та 15 хв з максимальною реакцією, що зазвичай спостерігається приблизно через 25-40 хв після ін'єкції формаліну. Через 60 хв періоду спостереження тварин умертвлюють із застосуванням CO2 з подальшим зміщенням шийних хребців. З-посеред різних параметрів оцінювання, описаних для формалінового випробування, найбільш важливим вважається загальний час, витрачений на лизання і покусування лапки, у яку виконана ін'єкція. (Abbott et al., The formalin test: scoring properties of the first and second phases of the pain response 10 UA 114345 C2 5 10 in rats, Pain 60 (1995) 91-102; Coderre et al., The formalin test: a validation of the weighted-scores method of the behavioral pain rating, Pain 54 (1993) 43-50). Оцінкою ранньої фази є сума часу, витраченого на лизання (секунди) від часу 0 до 5 хв. Оцінку пізньої фази визначають шляхом додавання загальної кількості секунд, витрачених на лизання з 15 хв до 55 хв періоду спостереження. Дані представлені у вигляді середніх з середніми квадратичними помилками середнього ( SEM). Дані оцінюють за однофакторним дисперсійним аналізом (ANOVA), і відповідні контрасти аналізують за "t"-критерієм Даннета для двостороннього порівняння. Різниці вважаються значущими, якщо значення P є меншим ніж 0,05 (Abbott, supra.; Coderre, supra.; and Wheeler-Aceto, supra.). Сполуку Прикладу 2 випробували по суті так, як описано вище, та виявили, що вона значною мірою скорочує больову поведінку з ED50 2,61 мг/кг, встановлену за наведеними нижче даними залежності "доза-ефект": Доза (мг/кг p.o.) 30 10 1 15 20 25 30 35 40 45 % зменшення загального часу лизання 90,0 80,4 53,9 S.E.M. 3,4% 8,6% 7,2% Отже сполуки за цим винаходом можуть бути корисними у лікуванні болю. Незважаючи на те, що введення сполук, використовуваних у методах за цим винаходом, безпосередньо, без будь-якої композиції, є можливим, ці сполуки зазвичай вводять у вигляді фармацевтичних композицій, що містять сполуку Формули I або її фармацевтично прийнятну сіль як активний інгредієнт, і щонайменше один фармацевтично прийнятний носій, розріджувач та/або наповнювач. Ці композиції можна вводити різними шляхами, в тому числі пероральним, сублінгвальним, назальним, підшкірним, внутрішньовенним і внутрішньом'язовим. Такі фармацевтичні композиції і способи їх одержання добре відомі в цій галузі. Дивись, наприклад, Remington: The Science and Practice of Pharmacy (University of the Sciences in Philadelphia, ed., st 21 ed., Lippincott Williams & Wilkins Co., 2005). Композиції за варіантом, якому віддають перевагу, виготовляють у вигляді дозованої лікарської форми, причому кожна доза містить від приблизно 25 мг до приблизно 1000 мг, частіше від приблизно 50 мг до приблизно 500 мг, наприклад, приблизно 100 мг активного інгредієнта. Термін "дозована лікарська форма" означає фізично окремі одиниці, придатні як разові дози для людей та інших ссавців, причому кожна одиниця містить заздалегідь визначену кількість активного матеріалу, розраховану на одержання бажаного терапевтичного ефекту, у поєднанні з щонайменше одним придатним фармацевтично прийнятним носієм, розріджувачем та/або наповнювачем. Сполуки Формули I у більшості випадків ефективні в широкому діапазоні доз. Наприклад, добові дози зазвичай знаходяться в діапазоні від приблизно 0,3 мг/кг до приблизно 15 мг/кг, частіше - від приблизно 0,7 мг/кг до приблизно 7,5 мг/кг, наприклад, приблизно 1,5 мг/кг маси тіла. У деяких випадках рівні доз нижче нижньої межі вищевказаного діапазону можуть бути більш ніж достатніми, тоді як в інших випадках ще більш високі дози можуть бути застосовані без спричинення будь-якого шкідливого побічного ефекту, і тому згаданий вище діапазон доз не є призначеним для обмеження обсягу винаходу будь-яким чином. Корисним також може виявитись введення добової дози частинами протягом кожного дня (наприклад, 1/2 дози двічі на день або 1/3 дози тричі на день). Слід розуміти, що фактично введена кількість сполуки буде визначатися лікарем, який лікує, у залежності від релевантних обставин, у тому числі від стану, який підлягає лікуванню, вибраного шляху введення, фактичної сполуки або сполук, які вводяться, віку, маси і реакції конкретного пацієнта, а також від тяжкості симптомів пацієнта. Припускають, що сполука за цим винаходом або її фармацевтично прийнятна сіль, наприклад, у фармацевтичній композиції за цим винаходом, буде використовуватися для лікування епілептичних нападів шляхом постійного введення для запобігання таких епілептичних нападів та/або невідкладного введення для регуляції або припинення епілептичних нападів, що відбуваються. 50 55 11 UA 114345 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука формули HO O N N H N N O * S CH3 5 10 15 20 або її фармацевтично прийнятна сіль. 2. Сполука за п. 1, яка являє собою 6-((S)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1H-піразол-3іл}етил)-3H-1,3-бензотіазол-2-он. 3. Фармацевтична композиція, яка містить 6-((S)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1Hпіразол-3-іл}етил)-3H-1,3-бензотіазол-2-он або його фармацевтично прийнятну сіль, і один або декілька фармацевтично прийнятний(их) носій(їв), розріджувач(ів) або наповнювач(ів). 4. Сполука або сіль за будь-яким з пп. 1 або 2 для застосування у терапії. 5. Сполука або сіль за будь-яким з пп. 1 або 2 для застосування у лікуванні нападів у ссавця, який страждає на епілепсію. 6. Сполука або сіль за п. 5, де згадані напади являють собою прості або складні часткові епілептичні напади. 7. Сполука або сіль за п. 5, де згадані напади являють собою первинно-генералізовані та/або вторинно-генералізовані епілептичні напади. 8. Сполука або сіль за будь-яким з пп. 5-7, де ссавець являє собою людину. 9. Сполука або сіль за будь-яким з пп. 5-8, де застосування являє собою одночасне, роздільне або послідовне комбінування з іншим антиепілептичним лікарським засобом. 10. Сполука або сіль за п. 9, де іншим антиепілептичним лікарським засобом є леветірацетам, габапентин, топірамат або карбамазепін. 11. Сполука або сіль за будь-яким з пп. 1 або 2 для застосування у лікуванні болю у ссавця. 12. Сполука або сіль за п. 11, де ссавцем є людина. 25 Комп’ютерна верстка О. Гергіль Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійською6-((s)-1-{1-[5-(2-hydroxy-ethoxy)-pyridin-2-yl]-1h-pyrazol-3-yl}-ethyl)-3h-1,3-benzothiazol-2-one as a tarp-gamma 8 dependent ampa receptor antagonist
Автори англійськоюReel, Jon Kevin, Porter, Warren Jaye, Witkin, Jeffrey Michael
Автори російськоюРил Джон Кэвин, Портэр Уоррэн Джэй, Уиткин Джэффри Майкл
МПК / Мітки
МПК: A61K 31/4439, C07D 417/14
Мітки: 6-((s)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1н-піразол-3-іл}етил)-3н-1,3-бензотіазол-2-он, рецептора, 8-залежного, tarp-гамма, антагоніст
Код посилання
<a href="https://ua.patents.su/14-114345-6-s-1-1-5-2-gidroksietoksipiridin-2-il-1n-pirazol-3-iletil-3n-13-benzotiazol-2-on-yak-antagonist-tarp-gamma-8-zalezhnogo-receptora-ampa.html" target="_blank" rel="follow" title="База патентів України">6-((s)-1-{1-[5-(2-гідроксіетокси)піридин-2-іл]-1н-піразол-3-іл}етил)-3н-1,3-бензотіазол-2-он як антагоніст tarp-гамма 8-залежного рецептора ampa</a>
Попередній патент: Спосіб визначення концентрації іонів у водних розчинах електролітів та прилад для його реалізації
Наступний патент: Спосіб герметизації зазорів у струмознімальному кільці та ущільнювальний пристрій
Випадковий патент: Спосіб лікування психопатичних реакцій у хворих з дисоціальним розладом особистості з агресивною поведінкою