Генно-інженерна конструкція днк, що кодує 3-фосфогліцерат дегідрогеназу, вектор експресії, клітина та спосіб одержання цільового продукту, який є серином або похідним серину.
Формула / Реферат
1. Генно-инженерная конструкция ДНК, кодирующая 3- фосфоглицерат дегидрогеназу (РGD), обладающую пониженной чувствительностью к ингибированию серином по сравнению с нативным типом PGD, характеризующаяся тем, что она кодирует PGD, которая имеет изменения на С-концевом участке от VAL 363 до TYR 410 по сравнению с PGD, выделенной из E.coli.
2. Генно-инженерная конструкция по п.1, отличающаяся тем, что указанная PGD содержит С-концевую делецию по сравнению с PGD, выделенной из E.coli.
3. Генно-инженерная конструкция по п. 1, отличающаяся тем, что С-концевые изменения представляют собой инсерцию в последовательность PGD, выделенной из E.coli.
4. Генно-инженерная конструкция по п. 3, отличающаяся тем, что инсерция находится между VAL 363 и ASN 364 или между ALA 392 и GLN 394 последовательности, выделенной из E.coli.
5. Генно-инженерная конструкция по п. 1, отличающаяся тем, что упомянутая ДНК кодирует PGD, имеющую одну из следующих аминокислотных последовательностей.
AEQG V--- -NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL --QA MKAI PASL D;
AEQG VLV;
AEQG VL;
AEQG VCSR ANIA AQYL QTSA QMGY VVID IEAD EDVAEKAL --QA MKAI PGT- -IRA RLLY;
AEQG V--- -NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL SRQA MKAI PGT- -IRA RLLY;
AEQG V--- -NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL L;
AEQG V--- -NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL --QA MKAI PGT- AIRA RLLY;
AEQG V--- -NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL --QA MKAI PVL;
AEQG V--- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -CSR AIRA RLLY;
AEQG V--- -NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL - - - - - - - - --SR AIRA RLLY;
6. Вектор экспрессии, содержащий генно-инженерную конструкцию по любому из пунктов 1 – 5 и регуляторную последовательность ДНК, помещенную и сориентированную для экспрессии генно-инженерной конструкции ДНК в системе экспрессии хозяина.
7. Клетка, содержащая генно-инженерную конструкцию ДНК по любому из пунктов 1 - 5 и регуляторную последовательность ДНК, помещенную и сориентированную для экспрессии упомянутой генно-инженерной конструкции ДНК в упомянутых клетках.
8. Клетка по п. 7, отличающаяся тем, что она делетирована по ser A. нативного типа.
9. Способ получения целевого продукта, являющегося серином или серинпроизводным, отличающийся тем, что он включает культивирование клетки по любому из пунктов 7 - 8 и восстановление целевого продукта.
10. Способ по п. 9, отличающийся тем, что упомянутым целевым продуктом является серин.
Текст
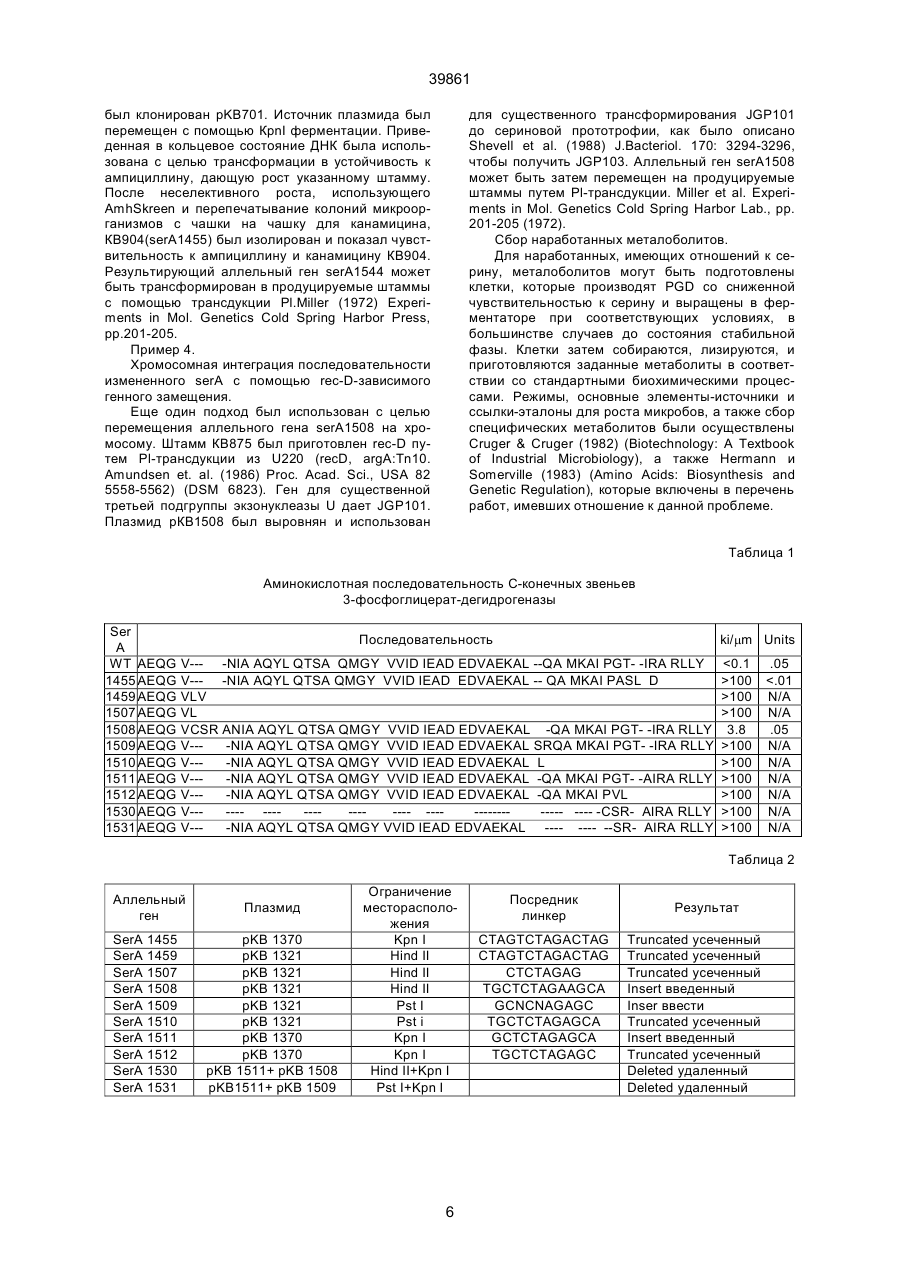
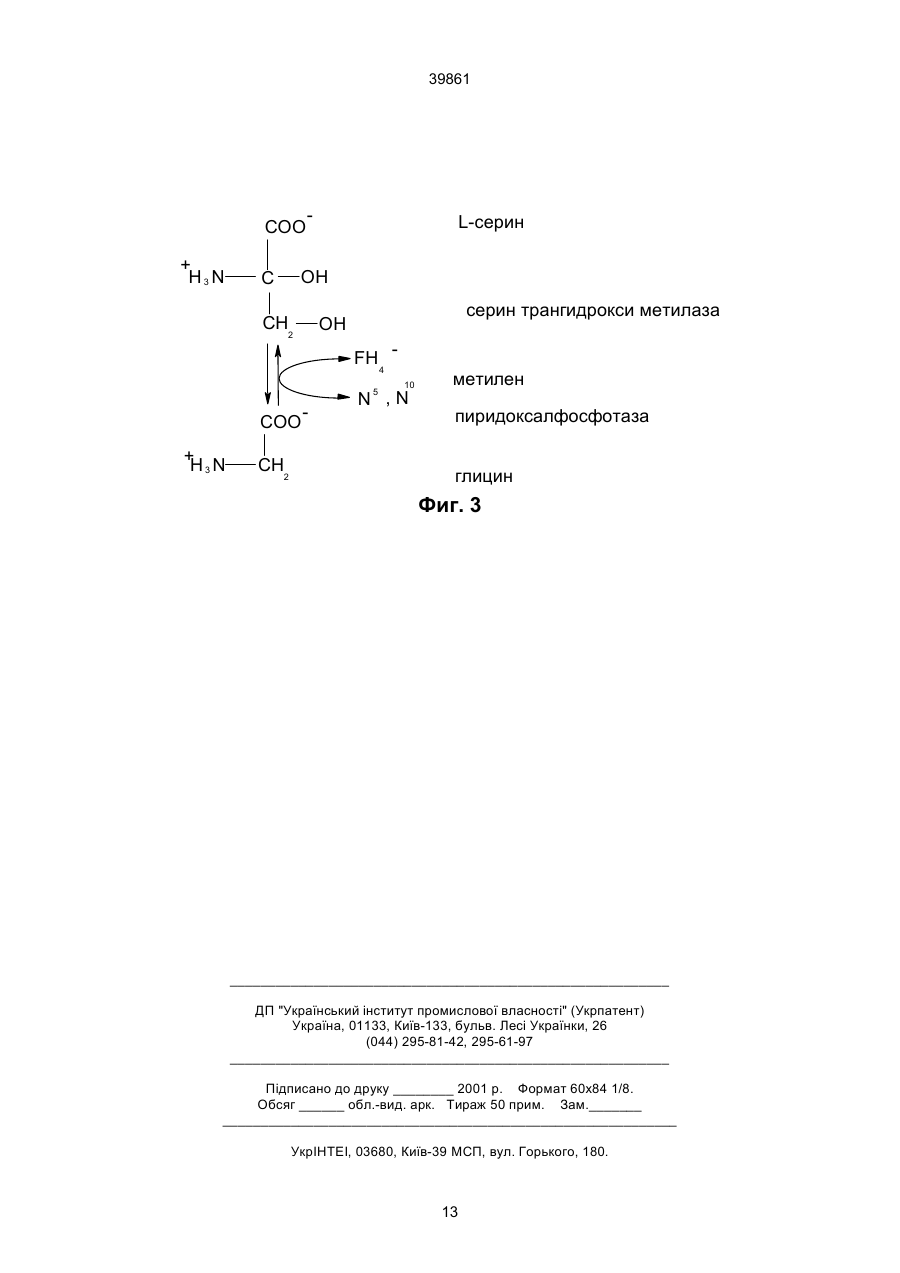
1. Генно-инженерная конструкция ДНК, кодирующая 3-фосфоглицерат дегидрогеназу (РGD), обладающую пониженной чувствительностью к ингибированию серином по сравнению с нативным C2 (54) ГЕННО-ІНЖЕНЕРНА КОНСТРУКЦІЯ ДНК, ЩО КОДУЄ 3-ФОСФОГЛІЦЕРАТ ДЕГІДРОГЕНАЗУ, ВЕКТОР ЕКСПРЕСІЇ, КЛІТИНА ТА СПОСІБ ОДЕРЖАННЯ ЦІЛЬОВОГО ПРОДУКТУ, ЯКИЙ Є СЕРИНОМ АБО ПОХІДНИМ СЕРИНУ 39861 Настоящее изобретение относится к общей проблеме биосинтеза серина и его производных, в частности, триптофана, а также к способам, используемым при такого рода биосинтезе. Серин - это основная промежуточная структура в биосинтезе значительного количества клеточных метаболитов, включая такие экономически важные, как холин, глицин, цистеин и триптофан. Кроме того, серин действует как единственный поставщик углерода и ответственен за 60-75% общей клеточной потребности в С-компонентах через получение 5,10-метилентетрагидрофолата из тетрагидрофолата. Эти С-компоненты используются в большом количестве путей биосинтеза, включая синтез метионина, инозина монофосфата, других пуринов и некоторых пиримидинов (например, тимидина и гидроксиметилцитидина). Путь биосинтеза серина, показанный на фиг.1, возможен, в основном, для большого количества разновидностей тканей и микроорганизмов. Первым принципиальным шагом на этом пути является превращение 3-фосфо-D-глицериновой кислоты (РGA) в 3-фосфогидроксипировиноградную кислоту (РНА) посредством 3-фосфоглицерат-дегидрогеназы (PGD) под действием фермента. Было проведено клонирование и секвенирование генного кода PGD и получена аминокислотная последовательность субъединицы PGD (Tobey and Grant, J. Biol. Chem. 261:12179-12183 (1980)). У прокариота (особенно, у бактерий) и микроорганизмов, таких как, например, дрожжи, но не у высших эукариот, активность нативной PGD тормозится уровнями клеточного серина. Данный процесс торможения исследовался кинетически и косвенно развивается в аллостерическом веществе (Тоbеу и Grant, J. Biol Сhеm. 261:12179-12183 (1986); Dubrow и Ріzег, J. Biol Сhem. 252:1527-1551 (1977); McKitrick и Pizer, J. Bacteriol. 141:235-245 (1980)). Tosa и Pizer (J. Bacteriol. 106:972-962 (1971)) изучили воздействие нормально токсичного аналога серина, гидроксамата L-серина, на штамм Е-соlі штамм. Селекция на питательной среде, содержащей такой аналог, дала в результате мутанты, устойчивые против серина. Было продемонстрировано, что некоторые мутанты имели модификацию энзима, не имеющую отношения к PGD, серил-tRNА-синтетазы. Неочищенный экстракт одного из мутантов проявил PGD-активность со сниженной сериновой чувствительностью (см. Bacteriol. 106:972-982 (1971); фиг. 5, таблица 6, стр. 977, нижняя левая колонка). Один из отличительных признаков изобретения характеризуется ДНК, которая кодирует 3-фосфоглицерат-дегидрогеназу (PGD) со сниженной чувствительностью к торможению посредством серина в сравнении с нативной PGD, т.e. ДНК кодирует PGD, которая имеет, по меньшей мере, некоторый уровень энзиматической активности, пригодной для биосинтеза, и которая сохраняет эту активность при более высоких уровнях серина, чем нативная (немодифицированная) PGD. В предпочтительных вариантах изобретения нативная PGD является микробной или дрожжевой PGD. Предпочтительным также является то, что созданная ДНК кодирует PGD, которая включает изменение в 25% С-конечных звеньев нативной PGD, предпочтительно, в С-конечных звеньях 50 аминокислот. Например, разработанная ДНК может кодировать PGD, включающую делецию в части или во всех концах С-векторов. Предпочтительным является также то, что разработанная ДНК кодирует PGD, имеющую инсерцию в концы С-векторов (например, между VAL 363 и ASN 364 или между ALA 392 и GLN 394) в дополнение к указанной выше делеции или в качестве отдельного изменения. Изобретение также характеризуется: a) PGD, имеющей аминокислотную последовательность мономерных звеньев, указанной выше созданной ДНК; b) векторами экспрессии гена, включающими разработанную ДНК и регуляторную ДНК, расположенную и ориентированную на экспрессию разработанной ДНК в системе экспрессии организмахозяина; c) клетками, включающими такие векторы экспрессии; d) способами получения серина или продукта, являющегося производным серина, путем культивирования таких клеток. Что касается п. с), клетка, предпочтительно, исключается для нативного Ser A. Еще один пример осуществления характеризуется клеткой (например, если она включает рекомбинированную генетическую конструкцию), которая разработана для получения мРНК транскрипта, кодирующего PGD с измененным 3'-концом, при этом данный транскрипт переводится данной клеткой с целью получения PGD со сниженной чувствительностью к торможению серином в сравнении с нестабильной PGD. Изобретение предлагает снятие контроля с важного контрольного значения биосинтеза, в результате чего повышается интенсивность возникновения многочисленных соединений книзу от этого контрольного значения, включая, в частности, серин и производные серина, например, триптофан. Другие клеточные метаболиты, являющиеся производными серина (т.е. серин является первичным промежуточным веществом в процессе их биосинтеза), включают холин, глицин, цистеин и зависящие от С-поставщиков соединения, такие как метионин, монофосфат инозина, пурины, а также некоторые из пиримидинов (например, тимидин и гидрокеиметил-цитозин). А.: Иллюстративный материал: На фиг. 1 представлены этапы биосинтеза Lсерина и глюкозы. На фиг. 2 представлена последовательность гена E.coli ser A, описанная Tobey и Grant, упомянутыми выше, и аминокислотная последовательность аминокислоты, имеющей происхождение от этого гена. На фиг. 3 представлена биоконверсия L-серина и тетрагидрофолата в глицин и N5, N10-метилен тетрагидрофолат. В. Обеспечение PGD с пониженной чувствительностью к серину. 1. Генетически созданные соединения. 2 39861 Настоящие предпочтительные варианты изобретения предлагают способ биосинтеза серина и имеющих отношение к серину соединений - -, например, соединений, описанных выше, полученных путем биосинтеза из серина. Первым этапом биосинтеза этих соединений, в соответствии с настоящим изобретением, является обеспечение получения PGD, нечувствительной к серину, что будет изложено ниже. Было определено, что в PGD имеется промежуточная специфическая область обратной связи, при этом данная промежуточная область может быть изменена с целью снижения сериновой чувствительности при поддержании благоприятных уровней PGD-активности. На фиг. 2 дана отдельная PGD-генетическая и аминокислотная последовательность, которая может быть использована при обсуждении данного вопроса. Последовательность на фиг. 2 включает 420 аминокислот (включая первоначальный Мет, который выделяется методом расщепления из выдержанного протеина). Область PGD, которая может снизить чувствительность к серину без нарушения активности PGD, находится в пределах 25% Сконечных звеньев данной молекулы, наиболее предпочтительный вариант - 50 остатков С-конечных звеньев. Примерами модификаций PGD, которые подпадают под изобретение, являются делеции отдельных или всех С-конечных звеньев 42 аминокислот, а такие инсерции или замещения внутри той области, которая снижает чувствительность к серину при поддержании эффективности функции PGD. Например, инсерция кислотных остатков аминокислоты между Val 363 и Asn 364 увеличивает Кi предлагаемого PGD по сравнению с нативным типом при поддержании активности PGD. Более резкие увеличения значений Ki получают путем исключения отдельных или всех Сконечных звеньев кислотных остатков аминокислоты. Например, деления С-конечных звеньев остатков GTlRARLLY и замещение с помощью ASLD увеличивает Ki на несколько порядков абсолютного значения при сохранении оптимального уровня активности PGD. Другими инсерциями, в соответствии с набором признаков изобретения, являются инсерции между Ala 392 и Gln 394. Другие приемлемые модификации включают делеции из С-конца вектора в дополнение к инсерциям и усовершенствованиям, изложенным выше. Описанные выше гены, кодирующие PGD с пониженной чувствительностью к серину, могут быть сконструированы методами генной инженерии, которые включают изменение 3'-конечного звена кодируемой области, которая кодируется для получения аминокислот с С-конеными звеньями, а затем трансформирование штамма организма-хозяина с помощью посредника, с целью получения экспрессии измененного PGD энзима. Кандидатные измененные энзимы отбираются, как будет описано ниже, для обеспечения сродства к серину и для достижения оптимальной PGD активности приемами, описанными ниже. При отборе описанных выше генетических конструкций, полученных вышеупомянутыми ме тодами, используют следующие методы анализа PGD активности и чувствительности к серину. Не будучи решающим для изобретения, исследование PGD активности необходимо, в основном, для установления степени чувствительности к серину измененного энзима. Как известно из уровня техники, степень активности энзима является функцией общего числа молекул энзимов и каталитической активности каждой молекулы. Таким образом, при сравнении каталитической активности вариантов обратной связи PGD должны быть предприняты шаги для обеспечения адекватного контроля относительного числа молекулPGD для образцов, на которых должно быть проведено сравнение относительной каталитической активности. Существуют способы, с помощью которых это может быть осуществлено. Однако ввиду того, что трудно установить адекватный уровень экспрессии гена в клетках, трансформированных с помощью усеченных ser A генов (благодаря снижению жизнеспособности, наиболее приемлемым способом сравнения активности PGD, полученной из различных конструкций, и нативного типа, является метод хромосомного интегрирования измененного ser A гена, содержащего стандартные регуляторные элементы в единственном экземпляре (копии), с последующим сбором трансформаций и определением относительной каталитической активности по сравнению с PGD из клеток нативного типа. Может быть использован любой метод, пригодный для измерения PGD-активности. PGDактивность может быть измерена посредством детектирования (обнаружения), прямой или обратной реакции методом McKitrick, John С. и Levis I. Pizer. (1980) J. BacterioI. 141: 235-245. Описанное выше исследование энзимов предназначено для определения чувствительности к серину для любого из PGD энэимов, включая такие, которые имеют химически измененные Сконцы вектора. Исследования проводятся при различных уровнях серина. Каталитическая активность в присутствии серина сравнивается с каталитической активностью в условиях отсутствия серина и подсчитывается Ki. В большинстве случаев предпочтительно снизить чувствительность к серину без значительного изменения каталитической активности PGD. B других вариантах появляется целесообразность снижения чувствительности обратных связей и каталитической активности. Могут быть использованы конструкции, имеющие последовательность Сконечного звена аминокислоты 3-фосфоглицерат дегидрогеназы, показанную в таблице 1 (описано ниже). Другие конструкции с усовершенствованными 3'-конечными звеньями также подпадают под перечень существенных признаков настоящего изобретения, поскольку не составляет трудности приготовить образцы для испытаний, трансформировать клетки в соответствии с настоящим изобретением и провести испытания на сериновое торможение активности PGD. Любой вектор, который ведет к экспрессии сниженной чувствительности PGD протеина к торможению с помощью серина, подпадает под объем защиты настоящего изобретения. Однако, в основном, при отсутствии выпадания серина сле 3 39861 дует избегать высоких уровней экспрессии свободной PGD обратной связи, так как результирующие высокие цитоплазматические уровни серина или метаболитов с производными серина могут оказаться токсичными для клетки. Таким образом, в основном, для любой конструкции, кодируемой для заторможенной PGD обратной связи с нормальной каталитической активностью и уровнями экспрессии, идентичными тем, которые имеют отношение к родственному гену, трансформация, вероятно, приведет к высоким уровням экспрессии PGD и к сниженной клеточной жизнеспособности. Токсичность, вызванная высокими уровнями серина, в действительности, может быть выбрана для мутантов со сниженной PGD-экспрессией. Таким образом, если трансформация, использующая плазмиды со множественностью копий, может быть полезна при первоначальном отборе конструкций, имеющих по несколько вариантов, предпочтительно осуществить хромосомное интегрирование единственных копий ser A конструкций в геном. Кроме того, хромосомное интегрирование, как будет описано ниже, облегчает измерение активности PGD с аннулированной обратной связью. Таким образом, в большинстве вариантов, где была задана или ожидалась сильная каталитическая активность, предпочтительно использование векторов, пригодных для хромосомного интегрирования единственной копии. Многие такие векторы и приемы их использования известны из уровня техники, см. например, Bаckmаn. USSN 07/091.837, подано 1 сентября 1987 г., включено в перечень использованных материалов. Пригодные к использованию векторы и конструкции могут быть осуществлены с целью создания условий, позволяющих успешно выполнить трансформацию и экспрессию энзима в соответствующем организме-хозяине для получения заданного продукта. Средства для получения этих конечных звеньев хорошо известны тем, кто ориентируется в уровне техники, и не составляют предмета изобретения. Кроме того, в дополнение к ДНК, кодирующей измененную PGD, вектор экспрессии будет содержать различные другие элементы, описанные ниже. Во-первых, кодирующая последовательность, присутствующая на векторе, будет сопровождаться соответствующими регуляторными элементами, необходимыми для поддержания соответствующего уровня экспрессии, кодируемой последовательности, включая промоторы, места привязки рибосомы и последовательности конечных звеньев. В большинстве случаев регуляторные последовательности родственного serА будут представлять собой предпочтительный источник каталитически активной части молекулы, хотя было выяснено, что могут быть использованы многие другие регуляторные последовательности, известные из уровня техники, или такие, которые еще только могут быть разработаны. Во-вторых, предпочтительно, чтобы на данном векторе, попутно с соответствующими регуляторными элементами, присутствовали также последовательности, кодирующие избирательные гены-маркеры и/или гены-регистраторы. Экспрессия таких избирательных генов-маркеров используется при идентификации трансформантов. Со ответствующие избирательные гены-маркеры включают такие, которые кодируют для получения ампициллина, тетрациклина, хлорамфеникола. В третьих, желательность возникновения репликации на векторе плазмида в большой степени зависит от желательности хромосомного или экстрахромосомного поддержания генов. Те, кто знаком с уровнем техники, отдает себе отчет в том, что существуют различные способы, с помощью которых недостаток источника репликации может быть использован для инициирования интегрирования в хромосому. См. например, Backman и др. US Патент 4743546, который включен в перечень использованной литературы. После конструирования вектора экспрессии подходящая клетка организма-хозяина может быть трансформирована вектором, содержащим единицу транскрипции, кодирующую получение PGD протеина с пониженной чувствительностью к серину. В большинстве случаев полезно использовать клетки, эндогенный PGD протеин для которых известен в качестве такого, который замедляется серином, и в которой эндогенный ser A ген стирается и замещается измененным в соответствии с изобретением геном. Такие системы на клеточном уровне используются для производства метаболитов, имеющих отношение к серину. Клетками, известными в качестве таких, которые содержат чувствительные к серину протеины, являются прокариоты и дрожжи. Приведенные ниже примеры иллюстрируют, не ограничивая, данное изобретение. Пример 1. Конструкция serА аллельных генов, кодирующая дегидрогеназу 3 - фосфоглицерата с устойчивой обратной связью. Ген Е coli K12 serА был изолирован на 6,4 kb ДНК фрагмент от Sаu3A частичного гидролизата, клонированного в BCL 1 месторасположение рТR264. См. Backmann и др. патент USSN 07/285.128, подано 16 декабря 1988 г. и Robert и др., Gene 12:123 (1980). Этот плазмид получил название рКВ1302. 3 Kb Sall в SphI фрагмент рКВ1302 ДНК, содержащий serА ген, был клонирован в pUC19 с целью генерирования рКВ1321. рКВ1370 был генерирован методом клонирования KB HindIII в Sall фрагмент, содержащий serA ген в pBR322. Aллельные гены serA, кодирующие дегидрогеназу 3-фосфоглицерата с устойчивой обратной связью, были генерированы путем инсерции Xbal соединительных элементов в места расположения ограничений в 3'зоне serA гена. Частичный гидролизат плазмида рКВ1321 с помощью HincII позволил расположить тупые концы в позиции 1793, где инсерция соединительных элементов дала: а) рКВ1459, кодирующий усеченную 3-фосфоглицерат-дегидрогеназу; b) рКВ1507, кодирующий усеченную 3-фосфоглицерат-дегидрогеназу; с) рКВ1508, который кодирует усеченную 3фосфоглицерат-дегидрогеназу с инсерцией четырех аминокислотных остатков. PstI ферментация рКВ1321 дает 3'выступание в позиции 1888. Тупые конечные звенья были генерированы путем действия фрагмента Klenow ДНК полимеразы I. Связующие элементы были 4 39861 введены во фрагменты с тупыми конечными звеньями, а производными плазмидами оказались рКВ1509, которые кодируют дегидрогеназу 3'фосфоглицерата с 2-аминокислотной инсерцией, и рКВ1510, который кодирует дегидрогеназу усеченного 3-фосфоглицерата. КрnI гидролизат рКВ1370 был выполнен притупленным с конечным звеном из фрагмента Klenow ДНК полимеразы I, а введенные промежуточные элементы дали сбор плазмидов, кодирующих дегидрогеназу усеченного 3-фосфоглицерата, рКВ1455 и рКВ1512 или дегидрогеназу 3-фосфоглицерата с инсерцией двух аминокислотных остатков, рКВ1511. Делеционные плазмиды рКВ1530 и рКВ1531 были генерированы путем инсерции 0,8 Kb BamHI в ХbаI фрагмент из рКВ1508 или 0,9 Kb ВаmНІ в ХbаI фрагмент из pKВ1509, соотвественно, в 5,8 KbBamHI в XbaI фрагмент pKB1511. Таблица 2 подводит итог различным полученным конструкциям. Для всех конструкций определяются стартовый вектор, используемые места ограничения и последовательность включенного связующего элемента. Значения Кі серина даны в таблице 1, точно так же как и относительная каталитическая активность для трех таких конструкций с последующей хромосомной интеграцией (описано ниже). N/А указывает на то, что определенная структура не была подвергнута хромосомному интегрированию, а уровень активности поэтому не был стандартизирован. Те, кто владеет информацией из предшествуюшего уровня техники, понимают, что делеции или модификации С-концов векторов нестабильной PGD могут быть осуществлены энзиматически или химически, например, с помощью различных карбоксипептидаз, включая карбоксипептидаэу Y, или посредством лактопероксидазы через кодирование. В качестве альтернативы возможно снижение чувствительности к серину in vivo через генерацию PGD-кодирующих транскриптов, усеченных в 3' конечных звеньях путем получения антисенсорных m-рибонуклеиновых кислот, которые включают нуклеотидную последовательность дополнительно к порциям 3'кодирующей зоны нативной (природной) или трансформированной PGD-кодирующей последовательности. Как показано на фиг.3, серин является промежуточным веществом в технологическом процессе получения глицина. Он также является промежуточным продуктом в производстве N5,N10–метилентетрагидрофолата, который является основным С I донором, существенным для синтеза метионина, пуринов (включая инозин) и некоторых пиримидимов. Таким образом, расширение производства серина из фосфоглицерата может быть широко использовано в системах микробиологического производства, включая системы производства холина, глицина, цистеина, метионина, триптофана и всех пуринов, включая монофосфат инозина. Настоящее изобретение дополнительно иллюстрируется следующими специфическими примерами осуществления. Пример 2. Последовательности, внутренние по отношению к врожденному serA гену плазмида, были замещены геном, устойчивым к канамицину. Этот плазмид затем был использован для дезактивации serA гена штамма организма-хозяина путем замены аллельного гена, а именно: SerA - зона YMC9 (AТСС33920) была клонирована из хромосомной ДНК, частично ферментированной Sau 3А1 путем комплементации РС1523 (arg161, argF58, serА27, рurA54, thr-25, tonA49, relA1, spoT1), полученный в Coli GeneticStock Center, Yale University, New Haven, CT. A3kb фермент, несущий serA ген, был субклонирован в pUC19, дающем рост плазмиду, названному рКВ1321. Из этого плазмида 3kb Sall до HindIII фрагмента был реклонирован в pBR322, дающий рост плазмиду рКВ1370. Место КрnІ на 3'конечном участке serA гена было преобразовано в ВаmНI с промежуточным звеном и ВаmНI фрагмент, расположенный с внутренней стороны результирующего serA, был замещен ВаmHI фрагментом из pUC-4-KSАC(Pharmacia), содержащего ген, устойчивый против канамицина Тn903. Этот новый плазмид получил обозначение рКВ1429. Было генерировано производное - элемент pBR322, получивший название рКВ701(АТСС39772), см. USSN 06/757,019, включенный в перечень ссылок, в котором Мbоl и TThIII, примыкающие к источнику репликации были преобразованы в места KpnI. SaIl до EcoRI фрагмент, содержащий seraА: : KanR из рКВ1429 был клонирован в рКВ701, дающий рост до рКВ1438. рКВ1438 был ферментирован с помощью KpnI, с целью перемещения зоны оri. Обширный фрагмент, содержащий кодируемую сферу, устойчивую против ампициллина, точно так же как и serA: :KanR, был циркулизирован и использован в трансформациях СаСl, относящихся к YMC9. После трансформации клетки организмахозяина YMС9 были размещены под селекцией на ампициллин. При таких обстоятельствах клоны, устойчивые к ампициллину, усовершенствуются путем ввода кольцевой ДНК через гомологическую рекомбинацию в зоны, примыкающие к гену serA. Рост изолята, устойчивого к ампициллину при отсутствии ампициллиновой селекции, приводит к потере гена, устойчивого к ампициллину, из-за гомологической рекомбинации повторяющейся последовательности зон, примыкающих к serA гену. Такие штаммы были идентифицированы с помощью остатков производства b-лактамазы, использующей AmpScreen(BRL) в соответствии с политикой производителя. Штриховая разводка дупликата одиночных колоний среды в присутствии и при отсутствии серина, обнаружила клоны, чувствительные к ампициллину, нуждающиеся в серине для роста на минимуме среды и которые обладали бы также устойчивостью к канамицину. Один из таких изолятов получил обозначение КВ875. Пример 3. Хромосомная интеграция измененной serA последовательности с помощью замены аллельного гена. Аллельный ген serA1455 был введен в хромосому с помощью способа, аналогичного тому, который используется для ввода serA: : KanR, как показано в примере 2. Одним словом, фрагмент (Sall до HindIII), несущий аллельный ген serA1455, 5 39861 был клонирован pKB701. Источник плазмида был перемещен с помощью КрnІ ферментации. Приведенная в кольцевое состояние ДНК была использована с целью трансформации в устойчивость к ампициллину, дающую рост указанному штамму. После неселективного роста, использующего AmhSkreen и перепечатывание колоний микроорганизмов с чашки на чашку для канамицина, КВ904(serA1455) был изолирован и показал чувствительность к ампициллину и канамицину КВ904. Результирующий аллельный ген serA1544 может быть трансформирован в продуцируемые штаммы с помощью трансдукции Рl.Міller (1972) Experiments in Моl. Genetics Cold Spring Harbor Press, pp.201-205. Пример 4. Хромосомная интеграция последовательности измененного serA с помощью rec-D-зависимого генного замещения. Еще один подход был использован с целью перемещения аллельного гена serA1508 на хромосому. Штамм КВ875 был приготовлен rec-D путем Рl-трансдукции из U220 (recD, argA:Tn10. Amundsen et. al. (1986) Proc. Acad. Sсі., USA 82 5558-5562) (DSM 6823). Ген для существенной третьей подгруппы экзонуклеазы U дает JGP101. Плазмид рКВ1508 был выровнян и использован для существенного трансформирования JGP101 до сериновой прототрофии, как было описано Shevell et al. (1988) J.Bacteriol. 170: 3294-3296, чтобы получить JGP103. Аллельный ген serA1508 может быть затем перемещен на продуцируемые штаммы путем Pl-трансдукции. Міllеr et al. Experiments in Моl. Genetics Cold Spring Harbor Lab., pp. 201-205 (1972). Сбор наработанных металоболитов. Для наработанных, имеющих отношений к серину, металоболитов могут быть подготовлены клетки, которые производят PGD со сниженной чувствительностью к серину и выращены в ферментаторе при соответствующих условиях, в большинстве случаев до состояния стабильной фазы. Клетки затем собираются, лизируются, и приготовляются заданные метаболиты в соответствии со стандартными биохимическими процессами. Режимы, основные элементы-источники и ссылки-эталоны для роста микробов, а также сбор специфических метаболитов были осуществлены Cruger & Cruger (1982) (Biotechnology: A Textbook of Industrial Microbiology), a также Hermann и Somerville (1983) (Amіnо Acids: Biosynthesis аnd Genetic Regulation), которые включены в перечень работ, имевших отношение к данной проблеме. Таблица 1 Аминокислотная последовательность С-конечных звеньев 3-фосфоглицерат-дегидрогеназы Ser Последовательность A WT AEQG V--- -NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL --QA MKAI PGT- -IRA RLLY 1455 AEQG V--- -NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL -- QA MKAI PASL D 1459 AEQG VLV 1507 AEQG VL 1508 AEQG VCSR ANIA AQYL QTSA QMGY VVID IEAD EDVAEKAL -QA MKAI PGT- -IRA RLLY 1509 AEQG V---NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL SRQA MKAI PGT- -IRA RLLY 1510 AEQG V---NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL L 1511 AEQG V---NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL -QA MKAI PGT- -AIRA RLLY 1512 AEQG V---NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL -QA MKAI PVL 1530 AEQG V------ ------------- --------------- ---- -CSR- AIRA RLLY 1531 AEQG V---NIA AQYL QTSA QMGY VVID IEAD EDVAEKAL ---- ---- --SR- AIRA RLLY ki/mm Units 100 100 N/A >100 N/A 3.8 .05 >100 N/A >100 N/A >100 N/A >100 N/A >100 N/A >100 N/A Таблица 2 Аллельный ген SerA 1455 SerA 1459 SerA 1507 SerA 1508 SerA 1509 SerA 1510 SerA 1511 SerA 1512 SerA 1530 SerA 1531 Плазмид pKB 1370 pKB 1321 pKB 1321 pKB 1321 pKB 1321 pKB 1321 pKB 1370 pKB 1370 pKB 1511+ pKB 1508 pKB1511+ pKB 1509 Ограничение месторасположения Kpn I Hind II Hind II Hind II Pst I Pst i Kpn I Kpn I Hind II+Kpn I Pst I+Kpn I 6 Посредник линкер CTAGTCTAGACTAG CTAGTCTAGACTAG CTCTAGAG TGCTCTAGAAGCA GCNCNAGAGC TGCTCTAGAGCA GCTCTAGAGCA TGCTCTAGAGC Результат Truncated усеченный Truncated усеченный Truncated усеченный Insert введенный Inser ввести Truncated усеченный Insert введенный Truncated усеченный Deleted удаленный Deleted удаленный 39861 Glucose COO H 3 фосфодеглицериновая кислота OH C CH PO3 H NAD O 2 COO NADH 3-фосфогидроксипируват C=O CH2 COO -H N 3 O трансаминаза 3-фосфо-L-серин CH CH COO PO H O 2 -H N 3 PO3 H 3 фосфотаза P1 L-серин CH CH2 OH Фиг. 1 7 Фиг. 2-1 39861 8 Фиг. 2-2 39861 9 Фиг. 2-3 39861 10 Фиг. 2-4 39861 11 Фиг. 2-5 39861 12 39861 COO + H3N L-серин OH C CH серин трангидрокси метилаза OH 2 FH 5 COO + N H3 CH 2 4 10 N ,N метилен пиридоксалфосфотаза глицин Фиг. 3 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. 13 39861 (044) 268-25-22 ___________________________________________________________ 14
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 15/09, C12P 13/06, C12N 1/19, C12N 15/53, C12N 9/04, C12N 1/21
Мітки: дегідрогеназу, клітина, цільового, вектор, серину, одержання, експресії, генно-інженерна, 3-фосфогліцерат, днк, похідним, спосіб, продукту, кодує, конструкція, серином
Код посилання
<a href="https://ua.patents.su/14-39861-genno-inzhenerna-konstrukciya-dnk-shho-kodueh-3-fosfoglicerat-degidrogenazu-vektor-ekspresi-klitina-ta-sposib-oderzhannya-cilovogo-produktu-yakijj-eh-serinom-abo-pokhidnim-serinu.html" target="_blank" rel="follow" title="База патентів України">Генно-інженерна конструкція днк, що кодує 3-фосфогліцерат дегідрогеназу, вектор експресії, клітина та спосіб одержання цільового продукту, який є серином або похідним серину.</a>
Попередній патент: 10-дезацетокситаксол та його похідні
Наступний патент: Спосіб отримання ізомеру або рацемічної модифікації, що містить ізомер та його енантіомер
Випадковий патент: Спосіб лапароскопічної герніопластики