10-дезацетокситаксол та його похідні
Номер патенту: 39860
Опубліковано: 16.07.2001
Автори: Чен Шу-Х'юі, Холтон Роберт А., Фаріна Вітторіо
Формула / Реферат
1. 10-Дезацетокситаксол и его производные формулы (I):
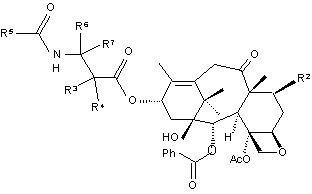 , (I)
, (I)
где R2 - атом водорода, гидроксильная группа или защищенная гидроксильная
группа,
R3 и R4 - независимо друг от друга атом водорода, гидроксильная группа или
загущенная гидроксильная группа,
R5 является радикалом R10 или -OR10,
R6 и R7 - каждый независимо от другого атом водорода, алкил или арил,
R10 - алкил, алкенил, алкинил или арил при условии, что когда R 2- атом
водорода,
R3 и R4 - атомы водорода.
2. Производные 10-дезацетокситаксола по п. 1, где R3 - атом водорода, а R4 - гидроксильная группа или защищенная гидроксильная группа, R5 - фенил или трет-бутоксигруппа, R6 - атом водорода, а R7 - фенил.
3. Производные по п. 2, где R5 - фенил.
4. Производные по п. 2, где R5 - трет-бутоксигруппа.
5. Производные по п. 1, где R2 - гидроксильная группа.
6. Производные по п. 5, где R3 - атом водорода и R4 - гидроксильная группа или защищенная гидроксильная группа, R5 - фенил или трет-бутоксигруппа, R6 - атом водорода, а R7 - фенил.
7. Соединение по п. 1, представляющее собой 10-дезацетокситаксол.
8. Соединение по п. 1, представляющее собой 10-дезокситаксотер.
Текст
1. 10-Дезацетокситаксол и его производные формулы (I): O 6 5 R 7 R R O N O 2 H R 3 R 4 O R C2 (54) 10-ДЕЗАЦЕТОКСИТАКСОЛ ТА ЙОГО ПОХІДНІ 39860 Сущность изобретения. Предметом изобретения является создание нового таксана, 10-дезацетокситаксола и его производных, которые проявляют противоопухолевую активность. Согласно изобретению, получено соединение, имеющее следующую структурную формулу (I): циклогексил; и фенил или бензилкарбонаты, возможно, замещенные в кольце одной или более C1-6-алкокси- или нитрогруппой. Данным изобретением создаются новые производные 10-дезацетокситаксола формулы (I) O O O O R5 R6 R7 O N H R2 O R3 R4 R5 R6 N H HO Ph O H O AcO R7 O R2 O R3 R4 HO Ph O H O AcO O O где: R2 - атом водорода, гидрокси- или замещенная гидроксигруппа; R3 и R4 - независимо друг от друга, атом водорода; R5-R10 или –OR10; R6 и R7 независимо друг от друга, а том водорода, алкил или арил; R10 - алкоксигруппа, алкил, алкенил, алкинил или арил. В качестве примера приведены соединения общей формулы 2-9, приведенные в конце описания. Предпочтительно, один из радикалов R3 и R4 атом водорода или метил, в то время как другой обозначает гидрокси- или защищенную гидроксигруппу. Предпочтительно, R5 - фенил, р-замещенный фенил или низший алкокси и, наиболее предпочтительно, фенил, метокси-, этокси- или третбутоксигруппа. Предпочтительно, один из радикалов R6 и R7 обозначает атом водорода или низший алкил, а другой - фенил или нафтил. B одном из предпочтительных вариантов соединений формулы (I) R2 - гидрокси- или защищенная гидроксигруппа; R3 - атом водорода; R4 гидрокси- или защищенная гидроксигруппа; R5 фенил; R6 - атом водорода, а R7 - фенил. В др угом предпочтительном варианте R5 - трет.-бутоксигруппа, где либо R3, либо R4 обозначает защищенную гидроксигруппу, предпочтительно, типа карбоната, наиболее предпочтительно, выбранную из гр уппы, состоящей из 2,2,2-трихлорэтоксикарбонила, аллилоксикарбонила и бензилоксикарбонила; или группу типа триалкилсилила, наиболее предпочтительно, триэтилсилила. Наиболее предпочтительны следующие варианты получаемых соединений формулы (I): 1) 10-дезацетокситаксол и 2) 10-деокситаксотер. Способ получения соединений формулы (I) обеспечивается при соблюдении последовательности реакции, приведенной в схеме I, приведенной в конце описания. Как показано, исходные материалы, используемые для получения соединений формулы (I) с использованием схемы I, включают 10-деацетилтаксол, который может быть получен из таксола путем обработки последнего с помощью бромистого цинка в хлороформе/метаноле, как описано в работе [1], включенной в виде ссылки. В схеме I P1 обозначает гидрокси-защитную группу. Таким образом, на первом этапе реакции , (I) где: R2 - атом водорода, гидроксильная или защищенная гидроксильная группа; R3 и R4 - независимо друг от друга, атом водорода, гидроксильная группа или защищенная гидроксильная группа; R5-R10 или –OR10; R6 и R7 - независимо друг от друга, а том водорода, алкил или арил; R10 - алкил, алкенил, алкинил или арил, при условии, что, если R2 - атом водорода, то R3 и R4 атом водорода. Также были получены соединения 10-дезацетокситаксол и 10-деокситаксотер. Другие предметы и характеристики данного изобретения будут частично видны и частично показаны в нижеследующем. Согласно использованию в данном описании, Аг обозначает арил; Ph - фенил; Ас - ацетил; R алкил; 11-ен - двойная связь между атомами углерода 11 и 12 соединения формулы (I); и 10, 12диен - двойные связи между атомами углерода 11 и 11, и 12 и 18 соединения формулы (I). "Гидроксильная защищенная группа" включает, не будучи ограниченной ими, простые эфиры, такие как метил, третбутил, бензил, р-метоксибензил, рнитробензил, аллил, тритил, метоксиметил, метоксиэтоксиметил, этоксиэтил, тетрагидропиранил, тетрагидротиапиранил и простые триалкилсилиловые эфиры, такие как простой триметилсилиловый эфир, простой триэтилсилиловый эфир, простой диметиларилсилиловый эфир, простой триизопропилсилиловый эфир и третбутилдиметилсилиловый эфир; сложные эфиры, как бензоил, ацетил, фенилацетил, формил, моно-, ди- и тригалоидацетил, как хлорацетил, дихлорацетил, трихлорацетил, трифторацетил; и карбонаты, включающие, но не ограниченные ими, алкилкарбонаты, имеющие от одного до шести атомов углерода, такие как метил, этил, n-пропил, изопропил, n-бутил, третбутил; изобутил и n-пентил; алкилкарбонаты, имеющие от одного до шести атомов углерода и замещенные одним или более атомами галогена, такие как 2,2,2-трихлорэтоксиметил и 2,2,2-трихлорэтил; алкенилкарбонаты, имеющие от двух до шести атомов углерода, такие как винил и аллил; циклоалкилкарбонаты, имеющие от трех до шести атомов углерода, такие как циклопропил, циклобутил, циклопентил и 2 39860 2'-гидроксигруппа 10-деацетилтаксола защищена; защитная группа может быть такой, какую можно ввести и удалить без недопустимого воздействия на остальную часть молекулы, более предпочтительно, она может быть такой, какая, предпочтительно, блокирует 2'-гидроксигруппу над обеими вторичными гидроксигруппами на кольце, а именно: 7- и 10-гидроксигруппами. Защита гидроксигруппы может быть осуществлена с помощью хорошо известных методов в данной области; например, путем введения в реакцию с карбоновой кислотой или с ее ацилирующим эквивалентом для образования сложного эфира, путем введения в реакцию с алкилгалогенидом в присутствии основания для получения простого эфира или путем введения в реакцию с хлорформиатом для получения карбоната. Предпочтительной защитной группой 2'-гидрокси в данной реакции является карбонат, который может быть образован путем обработки 10деацетилтаксола соответствующим хлорформиатом, например, аллилом или бензилхлорформиатом, для образования соответствующего карбоната. Реакция проводится в инертном органическом растворителе, таком как дихлорметан, тетрагидрофуран, ацетонитрил, диметилформамид, бензол, пиридин, р-диоксан и, предпочтительно, в присутствии поглотителя кислоты, такого как аминооснование, например, пиридина, диизопропилэтиламина, 4-аминопиридина, триэтиламина и подобных или неорганического основания, такого как карбонат калия или гидроокись тетрабутиламмония при подходящей температуре, которая может составлять от -78°С до, примерно, 50°С, в зависимости от конкретных выбранных реагентов. Обычно могут быть использованы от, примерно, одного до десяти эквивалентов реагента защитной группы по отношению к соединению таксола; целесообразно контролировать реакцию, например, с помощью тонкослойной хроматографии для обеспечения требуемой степени защиты. Полученный таким образом 2'-гидрокси-защищенный 10-деацетилтаксол затем обрабатывают 1,1,2-трифтор-2-хлортриэтиламином (ниже ТФХТ) для получения 2'-гидроксизащищенного 7-О-хлорфторацетил-10-дезацетокси-11,12- дигидротаксол10,12(18)-диена. ТФХТ может быть получен из диэтиламина и трифторхлорэтилена согласно способу, изложенному в работе [2], включенной в описание в виде ссылки. Реакцию 2'-гидрокси-защищенного 10-деацетилтаксола и ТФХТ проводят в инертном органическом растворителе, таком как галогенированные углеводороды, например, дихлорметан, хлороформ и тетрахлорид углерода, при температуре от, примерно, 0°С до температуры нагревания с обратным холодильником реакционного раствора, предпочтительно, реакцию проводят при температуре окружающей среды. ТФТХ используют в количестве, равном, по крайней мере, 1 эквиваленту по отношению к реагенту таксола, но, предпочтительно, его используют в избытке; обычно от одного до, примерно, десяти эквивалентов ТФХТ могут быть использованы по отношению к реагенту таксола. 2'-гидрокси-защитная группа может быть удалена с использованием известных в данной области методов, которые пригодны для конкретной используемой защитной группы; например, посредством гидролиза с кислотным или основным катализатором, восстановлением, гидрогенолизом и тому подобное. Таким образом, аллилкарбонат может быть удален гидридом трибутилолова и третракис-(трифенилфосфин)-палладием; бензилкарбонат может быть удален каталитическим гидрогенолизом. 7 - О - хлорфторацетил- 10-дезацетокси-11,12дигидрокситаксол-10,12(18)-диен может быть преобразован в 10-дезацетокси-7-О-хлорфторацетилтаксол путем каталитического гидрирования, при котором катализатор может представлять собой, например, палладий, платину, родий и тому подобное. В случаях, когда 2'-окси-защитная группа, используемая на предшествующи х стадиях проведения реакции, представляет собой бензилоксикарбонил, каталитическое гидрирование преобразует этот 10,12-диен в 11-ен, и удаляет 2'-защитн ую гр уппу за один этап. Понимается, что порядок снятия защиты с 2'-гидроксигруппы и гидрирования не является критическим, и любое из них может быть осуществлено ранее другого. Дополнительный способ получения соединений согласно изобретению приводит к получению соединений формулы (I), в которых R2 - атом водорода, гидрокси- или защищенную гидроксигруппу; а R5 - фенил. Соединения этого типа могут быть получены из 10-деацетилтаксола или 10-деацетил-7-эпитаксола, как показано на схеме II, приведенной в конце описания. На схеме II Rа - гидроксигруппа; Rb - атом водорода, R2' – ОР2, а Р3' - атом водорода; или же Ra - атом водорода, Rb - гидроксильная группа, R2' - атом водорода, R3' - гидроксигруппа; Р2 - гидрокси-защитная группа. Когда 10-деацетилтаксол (то есть Ra обозначает гидрокси-, а Рb обозначает атом водорода) является исходным материалом, желательно защитить как 2'-, так и 7-гидроксильные группы, и чтобы 10-гидроксильная группа оставалась свободной; предпочтительно, защитная группа представляет собой 2,2,2-трихлорэтоксикарбонил, который может быть введен путем реакции реагента таксола с 2,2,2-трихлорэтилхлорформиатом в присутствии основания, такого как пиридин, диизопропиламин, триэтиламин, диметиламинопиридин и тому подобное. Для контроля степени защиты и для сведения к минимуму блокировки 10-оксигруппы основание обычно применяют в количестве от одного до двух эквивалентов по отношению к таксолу, а хлорформиат в количестве от, примерно, 0,6 до, примерно, 1,5 эквивалента по отношению к таксолу. Когда исходным материалом является 10-деацетил-7-эпитаксол (то есть Ra - атом водорода, а Rb - гидроксигруппа), то защищается только 2'-гидроксигруппа, так как 7-гидроксигруппа значительно более инертна, чем 2'-гидроксигруппа, и она относительно невосприимчива к ацилированию либо хлорформиатом, либо от ТФХТ на последующем этапе. 2',7-бисгидрокси-защищенный 10-деацетилтаксол или полученный таким образом 2'-гидроксизамещенный 10-деацетил-7'-эпитаксол затем обрабатывают с помощью ТФХТ для получения 2',7дигидрокси-защищенного 10-дезацетокси-11,12дигидротаксол-10,12(18)-диена или 2'-защищенного 10-дезацетокси-11,12-дигидро-7-эпитаксол 3 39860 10,12(18)-диена, соответственно. Реакцию с ТФХТ проводят в инертном органическом растворителе, таком как галогенсодержащие углеводороды, такие как дихлорметан, хлороформ и тетрахлорид углерода, при температуре от, примерно, 0°С до, примерно, температуры нагревания с обратным холодильником реакционного раствора, предпочтительно, реакцию проводят при температуре окружающей среды. ТФХТ используют в количестве, по крайней мере, 1 эквивалента по отношению к реагенту таксола, но предпочтительно, его используют в избытке; обычно ТФХТ применяют в количестве от, примерно, одного до, примерно, десяти эквивалентов. 2'- и, если присутствует, 7окси-защитная группа затем удаляется при помощи метода, подходящего для конкретной защитной группы с целью получения 10-дезацетокси11,12-дигидротаксол-10,12(18)-диена или 10-дезацетокси-11,12-дигидро-7- эпитаксол-10,12(18)-диена; например, трихлорэтоксикарбонильную группу удаляют цинковым реагентом, бензилоксикарбонил удаляют гидрогенолизом и аллилкарбонат удаляют гидридом трибутилолова и тетракис(трифенилфосфин)палладием. Затем 10-деацетокси11,12-дигидро-7-эпитаксол-10,12(18)-диен могут быть подвергнуты каталитическому гидрированию, как описано ранее, для получения 10-дезацетокситаксола и 10-дезацетокси-7-эпитаксола, соответственно. 2',7-дигидрокси-защищенный 10-дезацетокси11,12-дигидротаксол-10,12(18)-диен или 2'-гидpoкcи-зaщищeнный 10-дезацетокси-11,12-дигидро-7эпитаксол-10,12(18)-диен также могут быть подвергнуты каталитическому гидрированию для получения 2',7-дигидрокси-7-эпитаксола, соответственно. Гидрокси-защитные группы могут быть удалены, как это описано выше, для получения 10дезацетокситаксола или 10-дезацетокси-7-эпитаксола. Дополнительный способ получения соединений согласно изобретению обеспечивает получение соединений формулы (I), в которой R2 - гидроксигруппа или защищенная гидроксигруппа, R3 атом водорода; R4 - атом водорода, гидрокси- или гидрокси-защитную группу; R5 - трет.бутоксигруппа; R6 - атом водорода, а R7 - фенил. Соединения этого типа могут быть получены из 7-защищенного 10-дезацетоксибаккатина III или 10-дезацетокси-7-эпи-баккатина III с использованием процесса, изображенного на схеме III, приведенной в конце описания. На схеме III Ra - гидроксигруппа, Rb - атом водорода, R2' – ОР3 и R3' - атом водорода; или Ra атом водорода, Rb - гидроксигруппа, R2' - атом водорода и R3' - гидроксигруппа; P3 - гидрокси-защитная группа; предпочтительно, триалкилсилильная группа, наиболее предпочтительно, триэтилсилил. 7-гидрокси-защищенный 10-дезатокси-баккатин III или 10-дезацетокси-7-эпи-баккатин III обрабатывают сильным основанием, таким как n-бутти- литий, для получения соответствующего 13-алкоксида. Этот алкоксид вводят в реакцию с (3R, 4S)1-третбутоксикарбонил-4-фенил - 3 - защищенным окси-2-азетидиноном в инертном органическом растворителе, таком как тетрагидрофуран, для получения соответствующего 2',7-дигидрокси-защищенного 10-деокситаксотера. Реакцию прово дят при низкой температуре в диапазоне от, примерно, -20°С до, примерно, 25°С, предпочтительно, при, примерно, 0°С. Затем гидрокси-защитные группы удаляют для получения 10-деокситаксотера с применением обычных методов, например, группа триэтилсилила может быть удалена при помощи кислотного гидролиза соляной кислотой. Последовательность реакции, изображенная на схеме III, показывает получение 10-диокситаксотера или 10-деокси-7-эпитапксотера, однако она также пригодна для получения 10-дезацетокситаксола или 10-дезатокси-7-эпитаксола. Таким образом, 10-дезатокситаксол и 10-дезатокси-7-эпитаксол могут быть получены аналогичным образом путем замены бета-лактама, показанного на схеме III, (3R, 4S)-1-бензоил-4-фенил-3-окси-защищенным 2-азетидином. Другие производные 10-дезатокситаксола в рамках формулы (I) могут быть легко получены путем отбора соответствующи х заместителей для b- -лактама, который образует b-амидоэфирную боковую цепь в положении С-13 структуры таксола. 10-дезацетоксибаккатин III и 10-дезатокси-7эпибаккатин III могут быть получены из 10-дезацетилбаккатина III и 10-деацетил-7-эпибаккатина III с помощью процесса, показанного на схеме IV. На схеме IV R2' - атом водорода, а R3' - гидроксигруппа или R2' - защищенная гидроксигруппа и R3' - атом водорода. Предпочтительно, гидроксизащитная группа представляет собой группу типа простого триалкилсилилового эфира, например, триэтилсилила. Таким образом, 10-деацетилбаккатин III вначале обрабатывают сильным основанием, таким, как n-бутиллитий, а полученный in siti алкоксид вводят в реакцию с пентафторфенилхлортионоформиатом для получения соответствующего 10-(пентафторфенил)тиокарбоната. Реакцию проводят в инертном органическом растворителе, таком как тетрагидрофуран, при температуре в диапазоне от, примерно, -78°С до, примерно, комнатной температуры. Полученный таким образом тиокарбонат обрабатывают подходящим реагентом, таким как гидрид трибутилолова, гидрид трифенилолова, триметилсилан и хлористое трибутилолово и натрийцианоборгидрид, в присутствии радикального инициатора, такого как азобисизобутинитрил (АИБН). Реакцию проводят в органическом растворителе, таком как третбутанол, N-метилпирролидон, диметилсульфоксид, диметилформамид, толуол и бензол при температуре от, примерно, 80°С до, примерно, 115°С, для получения 7-защищенного гидрокси-10-дезацетоксибаккатина III или 7-эпибаккатина III. Альтернативой может служить проведение фотохимической реакции (гидрид триорганоолова, hv, бензол, 0°С комнатная температура). Гидрокси-защитная группа может быть удалена при использовании известных в данной области методов; например, триэтилсилил может быть удален кислотным гидролизом с использованием соляной кислоты. Производные 10-дезацетокситаксола изобретения являются полезными веществами для ингибирования роста опухоли у животных и человека. Соединения были оценены in vito на цитотоксическую активность против клеток рака толстой кишки человека НСТ-116 и HCT-116/VM46. Клетки 4 39860 HCT116/VM являются клетками, которые были выбраны благодаря тенипозидной стойкости, и выражают фенотип стойкости к многим лекарственным препаратам, включая устойчивость к таксолу. Цитотоксичность была оценена в клетках НСТ-116 рака толстой кишки человека с помощью анализа ХТТ (2,3-бис(2-метокси-4-нитро-5-сульфофенил)-5-[(фениламино)-карбонил] 2Н-гидроокись тетразолия), как описано в работе [3]. Клетки высевали в количестве 4000 клеток/лунку в микротитрационных планшетах с 96 лунками и спустя 24 ч добавляли лекарственные средства и серийно разводили. Клетки инкубировали при 37°С в течение 72 ч, в это время добавляли краситель тетразолия, ХТТ. Фермент дегидрогеназы в живых клетках снижает ХТТ до такой формы, которая поглощает све т при 450 нм, что может быть подсчитано с помощью спектрофотометрии. Чем выше поглощающая способность, тем больше число живых клеток. Результаты выражены в виде IC50, что представляет собой концентрацию лекарственного средства, требуемого для ингибирования роста клеток (т.е. поглощение при 450 нм) до 50% от количества необработанных контрольных клеток. Значения IC50 для 10-дезацетокситаксола и таксола приведены в табл. 1. Соединения формулы (I), согласно изобретению, пригодны для ингибирования роста опухолей у животных, включая человека, и, предпочтительно, вводятся в форме фармацевтической композиции, содержащей эффективное количество противоопухолевого соединения, согласно изобретению, в сочетании с фармацевтически приемлемым носителем или разбавителем. Противоопухолевые композиции в данном случае могут быть приготовлены в любой подходящей форме, соответствующей требуемому виду применения, например, орально, парентерально или при помощи местного введения. Примерами парентерального введения являются внутримышечное, внутривенное, внутрибрюшинное, ректальное и подкожное введение. Ингредиенты разбавителя или носителя не должны снижать терапевтические эффекты противоопухолевы х соединений. Подходящие дозировочные формы для орального применения включают таблетки, диспергируемые порошки, гранулы, капсулы, суспензии, сиропы и эликсиры. Инертные разбавители и носители для таблеток включают, например, карбонат кальция, карбонат натрия, лактозу и тальк. Таблетки также могут содержать гранулирующие и дезинтегрирующие ве щества, такие как крахмал и альгиновая кислота, связывающие вещества, такие как крахмал, желатин и камедь, и замасливатели, такие как стеарат магния, стеариновая кислота и тальк. Таблетки могут не иметь покрытия или иметь покрытие, нанесенное с помощью неизвестной технологии, например, для задержки разрушения и поглощения. Инертные разбавители и носители, которые могут быть использованы в капсулах, включают, например, карбонат кальция, фосфа т кальция и каолин. Суспензии, сиропы и эликсиры могут содержать обычные наполнители, например, метилцеллюлозу, трагакант, альгинат натрия; увлажнители, такие как лецитин и полиок сиэтиленстеарат; и консерванты, например, этилр-оксибензоат. Дозировочные формы, пригодные для парентерального введения, включают растворы, суспензии, дисперсии, эмульсии и тому подобное. Они также могут бы ть изготовлены в форме стерильных твердых композиций, которые могут быть растворены или суспендированы в стерильной инъецируемой среде непосредственно перед применением. Они могут содержать суспендирующие или диспергирующие вещества, известные в данной области. Один из аспектов изобретения направлен на терапевтическое ингибирование роста опухоли у животного, имеющего опухоль, чувстви тельную к соединениям, согласно изобретению, включающее введение указанному организму-носителю эффективной дозы указанного противоопухолевого соединения. Целесообразно, чтобы реальное предпочтительное количество соединения, согласно изобретению, менялось индивидуально в зависимости от соединения, составленной рецептуры, способа введения и конкретного места, организма-носителя и заболевания, которые подвергаются лечению. Многие факторы, которые изменяют это действие, будут учитываться специалистами в данной области, например, возраст, вес тела, пол, диета, время введения, метод введения, скорость экскреции, состояние организманосителя, сочетания лекарственных средств, чувствительность к реакции и серьезность заболевания. Введение может быть непрерывным или периодическим в рамках максимально допустимой дозы. Оптимальные скорости введения для заданного набора условий могут быть определены специалистами в данной области при помощи обычных тестов на вводимые дозы с учетом вышеуказанных рекомендаций. Пример 1. 2',7-биc'О-(2,2,2-трихлорэтоксикарбонил)-10-деацетилтаксол (12). HO PhCON H O Rh O OCO 2CH 2CCl 3 O O O O HO OCOPh AcO CCl3CH 2O 10-деацетилтаксол (140 мг, 0,173 ммоль) в сухом дихлорметане (3,5 мл) обрабатывали при 0°С пиридином (0,028 мл, 0,346 ммоль) и трихлорэтилхлор формиатом (0,0724 мл, 0,260 ммоль). После 1 ч выдержки при этой температуре холодную ванну удаляли, и смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали и остаток хроматографировали на силикагеле (30-50% этилацетата в гексане) для 12 получения в виде пены (92,3 мг, 46%). Дополнительное элюирование приводило к получению не прореагировавшего исходного материала (35 мг, 25%). Карбонат 12 имел ЯМР (300 МГц, CDCI3) d 8,14 (d, J=8,5 Гц, 2H), 7,75 (d, J=8,5 Гц, 5 39860 2Н), 7,65-7,35 (m, 11H), 6,94 (exch.d., J=9,3 Гц, 1H), 6,27 (шир. t, 1H), 6,04 (dd, J=9,3 Гц, J'=2,6 Гц, 1H), 5,71 (d, J=6,9 Гц, 1Н), 5,54 (d, J=2,6 Гц, 1H), 5,435,37 (m, 2H), 4,96 (d, J=7,9 Гц, 1H), 4,85-4,67 (m, 4Н), 4,29 (АВ q, 2H), 4,04-4,01 (m, 2H), 2,69-1,80 (m, 14H вкл. s при 2,58, 1,96, 1,89, ЗН каждый), 1,20 (s, ЗН), 1,09 (s, ЗН). Масс-спектр высокого разрешения: Для C51H51NO 17Cl6K(MK+) Рассчитано, %: 1198, 0925 Найдено, %: 1198, 0949. Пример 2. 2',7-бис' О -(2,2,2-трихлорэтоксикарбонил)-10-дезацетокси-11,12-дигидротаксол10,12(18)-диен (13) вали. Хроматографирование остатка (40-60% 14 этилацетата в гексане) давало в виде пены (18 мг, 14%), вместе с его 7-эпи-изомером (97 мг, 14 77,7%). Соединение имело ЯМР (300 МГц, CDCI3) d 8,19 (d, J=8,5 Гц, 2H), 7,69 (d, J=8,5 Гц, 2H), 7,59-7,25 (m, 11H), 7,00 (exch.d., J=10,4 Гц, 1H), 6,20 (br. t, 1H), 5,96 (s, 1H), 5,83-5,77 (m, 2H), 5,18 (d, J=2,2 Гц, 1H), 4,94 (dd, J=7,2 Гц, J'=2,1 Гц, 1H), 4,79 (d, J=2,2 Гц, 1H), 4,72 (dd, J=4,3 Гц, J'=2,2 Гц, 1H), 4,30 (АВ q, 2H), 4,00 (m, 1H), 3,65 (d, J= =7,8 Гц, 1Н), 3,51 (exch.d, J=4,3 Гц, 1H), 2,60 (m, 1H), 2,40 (s, 3Н), 2,30-1,80 (m, 5H), 1,70 (s, 3Н), 1,16 (s, 3Н), 1,06 (s, 3Н). Масс-спектр высокого разрешения: Для C45H48NO 12(MH+) Рассчитано, %: 794,3177 Найдено, %: 794,3152. В качестве альтернативы диенон 13 (39 мг, 0,034 ммоль) растворяли в метаноле (0,5 мл) и уксусной кислоте (0,5 мл) и обрабатывали промытым в кислоте порошком цинка (66,4 мг, 1,020 ммоль). Эту массу нагревали при 40°С в течение 1 ч, фильтровали и фильтрат выпаривали. Хроматография остатка с 60% этилацетата/гекса . O OCO 2CH2CCl 3 PhCONH O Rh O O HO O O AcO OCOPh CCl3CH 2O 14 на дала в виде пены (22 мг, 81%). Спектральные данные те же самые, что и предыдущие. 12 Бис-карбонат (92,3 мг, 0,079 ммоль) в сухом дихлорметане (2 мл) обрабатывали при комнатной температуре ТФХТ (0,0384 мл, 0,238 ммоля). Раствор перемешивали в течение ночи. Растворитель выпаривали и остаток очищали с помощью хроматографии на колонне (25% этилацетата в гексане) 13 для получения в виде белого порошка (42,8 мг, 47,3%). ЯМР (300 МГц, CDCI3) d 8,18 (d, J=8,5 Гц, 2H), 7,69 (d, J=8,5 Гц, 2Н), 7,58-7,28 (m, 11H), 6,90 (exch.d., J=9,7 Гц, 1H), 6,31 (s, 1H), 6,25 (br t, 1H), 6,04 (dd, J=9,7 Гц, J'=2,2 Гц, 1H), 5,80 (d, J=7,8 Гц, 1H), 5,51 (d, J=2,2 Гц, 1H), 5,38 (d, J=2,3 Гц, 1H), 5,31 (dd, J=11,0 Гц, J'=7,3 Гц, 1Н), 4,99 (d, J=2,3 Гц, 1H), 4,97 (br d, 1H), 4,80-4,65 (m, 4Н), 4,30 (АВ q, 2H), 3,75 (d, J=7,8 Гц, 1H), 2,60 (m, 1H), 2,55 (s, 3Н), 2,16-2,09 (m, 3Н), 1,83 (s, 3Н), 1,77 (s, 1H), 1,13 (s, 3Н), 1,07 (s, 3Н). Масс-спектр высокого разрешения: Для C51H49NO 16Cl6K(MK+) Рассчитано, %: 1180, 0820. Найдено, %: 1180, 0777. Пример 3. 10-дезацетокси-11,12-дигидротаксол-10,12(18)-диен Пример 4. 10-дезацетокситаксол O Ph OH O AcO OCOPh 15 чали 10-деокситаксол (15,0 мг, 68%) в виде белой пены. ЯМР (300 МГц, CDCI3) d 8,12 (d, J= =8,5 Гц, 2Н), 7,61 (d, J=8,4 Гц, 2Н), 7,60-7,27 (m, 11H), 7,06 (exch.d., J=8,9 Гц, 1H), 6,09 (шир. t, 1H), 5,78 (dd, J=8,9 Гц, J'=2,6 Гц, 1H), 5,66 (d, J=6,8 Гц, 1H), 4,91 (d, J=7,6 Гц, 1Н), 4,76 (dd, J=5,1 Гц, J'= =2,6 Гц, 1H), 4,29-4,20 (m, ЗН), 4,01 (d, J=6,8 Гц, 1H), 3,75 (d, J=15,8 Гц, 1H), 3,60 (exch.d, J=5,1 Гц, 1H), 3,39 (шир. d, 1H), 2,60 (m, 1H), 2,34 (s, 3Н), 2,34-2,22 (m, 2Н), 1,90-1,71 (m, 2Н), 1,62 (s, 3Н), 1,61 (s, 3Н), 1,52 (exch. d, J=7,8 Гц, 1H), 1,14 (s, 3Н), 1,12 (s, 3H). Масс-спектр высокого разрешения: Для C45H50NO 12(MH+) Рассчитано, %: 796,3333 Найдено, %: 796,3319. OH O OH OH Диенон 14 (22 мг, 0,028 ммоль) в этилацетате (0,7 мл) гидрировали при атмосферном давлении в присутствии палладия на древесном угле (10%, 14,7 мг, 0,014 ммоль Pd). После выдерживания в течение 5,5 ч при комнатной температуре, фильтрования (промывки этилацетатом), выпаривания и хроматографии (60% этилацетат в гексане) полу . O OH O OH PhCONH O Ph . PhCONH O 14 O (15) AcO OCOPh 13 Диенон (180 мг, 0,157 ммоля) растворяли в метаноле (3 мл) и обрабатывали промытым в кислоте порошком цинка (300 мг, 4,72 ммоль). Эту массу кипятили с обратным холодильником в течение 20 мин, фильтровали и фильтрат выпари 6 39860 Пример 5. 10-дезацетокси-7- О -триэтилсилил(16) баккатин III . O Масс-спектр: 642 (МН+). (17). Пример 6. 10-деокситаксотер OSiEt 3 O OH tBuOCON H O HO OH Ph O O OH AcO OCOPh OH O AcO OCOPh Соединение 16 (100 мг, 0,156 ммоль) помещали в колбу в атмосфере аргона и растворяли в сухом ТГФ (1,5 мл). После охлаждения до -40°С по каплям добавляли n-бутиллитий (1,45 М в гексанах, 0,119 мл, 0,170 ммоль), за ним следовал (3R,4S)-1-трет.бутоксикарбонил- 4 -фенил- 3 -триэтилсилилокси-2-азетидинон 94,2 мг, 0,25 ммоль) в ТГФ (0,5 мл) в течение периода в 2 мин. Смесь сразу же нагревали до 0°С и перемешивали в течение 45 мин перед резким охлаждением насыщенным хлористым аммонием (3 мл). Смесь экстрагировали этилацетатом, высушивали и выпаривали. Хроматография на силикагеле (30% этилацетат в гексане) давала 2',7-бис-О-(триэтилсилил)-10-деокситаксотер в виде пены (125 мг, 76%). Это соединение (100 мг, 0,098 ммоль) немедленно растворяли в ацетонитриле (2 мл) при -5°С и обрабатывали соляной кислотой (0,037 мл, 36%, 12М). Смесь перемешивали в течение 2 ч при -5°С, затем ее резко охлаждали водным бикарбонатом, экстрагировали этилацетатом и высушивали. За выпариванием следовала хроматография на кремнеземе (75% этилацетат в гексане) для получения указанного в заголовке соединения в виде пены (80,5 мг, 80%). ЯМР (CDCI3) d 8,10 (d, J=8,2 Гц, 2Н), 7,64-7,29 (m, 8H), 6,11 (шир. t, 1H), 5,68 (d, J=6,9 Гц, 1H), 5,43 (шир. d, 1H), 5,25 (шир. d, 1H), 4,93 (d, J=7,7 Гц, 1H), 4,60 (шир. s, 1H), 4,30-4,18 (m, ЗН), 4,02 (d, J=7,7 Гц, 1H), 3,80 (d, J=15,8 Гц, 1Н), 3,46-3,40 (m, 2Н), 2,62 (m, 1Н), 2,35 (s, ЗН), 2,35-2,25 (m,2H) 1,89-1,65 (m, 5Н), 1,63 (s, 3Н), 1,35 (s, 9H), 1,19 (s, 3Н), 1,16 (s, 3Н). Пример 7. Получение (3R,4S)-трет.бутоксикарбонил-4-фенил-3-триэтилсилилокси- 2-азетидиона (см. схему V, приведенную в конце описания). (L)-треонин-метилэфир-гидрохлорид (1,26 г, 7,44 ммоль) в безводном дихлорметане (15 мл) перемешивали с имидазолом (1,01 г, 14,89 ммоль) и трет.бутоксидифе-нилсилилхлоридом (2,274 г, 7,816 ммоль) в течение 16 ч при комнатной температуре. Реакционную смесь разделяли между водой и дихлорметаном. Органическую фазу промывали 5%-ным водным бикарбонатом натрия и водой, высуши вали и концентрировали для получения 2,88 г неочищенного масла, которое использовали непосредственно на следующем этапе; 1H ЯМР (CDCl3) d: 7,70-7,25 (m, 10Н), 4,44 (m, 1H), 3,62 (s, 3Н), 3,31 (d, J=3 Гц, 1Н) 2,12 (bs, 2Н), 1,3-1,15 (m, 12Н). Это масло (548 мг, 1,414 ммоль) в безводном дихлорметане (10 мл) обрабатывали бензальдегидом (0,158 мл, 1,55 ммоль) при комнатной температуре в течение ночи в присутствии молекулярных сит 4 Å для получения соединения формулы XVIIa in situ. После охлаждения раствора, со А. 10-дезацетил - 7 -О -триэтилсилил-баккатин III (Соединение А). 10-дезацетил-баккатин III (из Taxus baccata, 628,0 мг, 1,150 ммоль) растворяли в сухом ДМФ (6 мл), охлаждали до 0°С и обрабатывали имидазолом (312,8 мг, 4,595 ммоль) и хлортриэтилсиланом (0,772 мл, 4,60 ммоль). Смесь перемешивали при 0°С в течение 4 ч, затем разбавляли этилацетатом (150 мл) и тщательно промывали водой и соляным раствором. Органический слой высушивали и концентрировали. Остаток хроматографировали (кремнезем, 50% этилацетат в гексане) для получения соединения А в виде пены (586 мг, 77%). Это соединение описано в [4]. В. 10-дезацетил-7-О-триэтилсилил-10-O-(пентафторфенилокси)тиокарбонил-баккатин III (Соединение В). Соединение А (319 мг, 0,485 ммоль) растворяли в сухом ТГФ (5 мл), охлаждали до -40°С и обрабатывали n-бутиллитием (1,58 М в гексанах, 0,384 мл, 0,606 ммоль). Спустя 40 мин выдержки при этой температуре, пентафторфенилхлортионоформиат (0,086 мл, 0,536 ммоль) в чистом виде добавляли с помощью шприца. Реакционную смесь перемешивали при -20°С в течение 90 мин, затем резко охлаждали насыщенным раствором хлористого аммония и экстрагировали этилацетатом. Слой этилацетата высушивали, выпаривали и остаток хроматографировали (кремнезем, 40% этилацетат в гексане) для получения соединения В в виде пены (320 мг, 74%). ЯМР (CDCl3) d 8,09 (d, 2Н), 7,56 (t, 1H), 7,44 (m, 2Н), 6,78 (s, 1H), 5,64 (d, J=6,9 Гц, 1H), 4,96-4,89 (m, 2H), 4,49 (dd, J=10,2 Гц, J'=6,6 Гц, 1H), 4,12 (АВ q, 2Н), 3,80 (d, J=6,9 Гц, 1H), 2,55-0,44 (m, 43H). Масс-спектр: 884 (МН+). С. 10-дезацетокси-7-О-триэтилсилил-баккатин III. Тионокарбонат (соединение В, 119 мг, 0,135 ммоль) растворяли в сухом толуоле (3 мл) и обрабатывали 2,2'-азобисизобутированитрилом (АИБН, 2 мг). Раствор дегазировали при помощи сухого азота, затем добавляли гидрид трибутилолова (0,055 мл, 0,202 ммоль) и раствор нагревали в течение 1 ч (90°С). После выпаривания растворителя и хроматографии (кремнезем, 40% этилацетат в гексане) получали указанный в заголовке продукт (87 мг, 99%) в виде бесцветной пены. ЯМР (CDCl3) d 8,07 (d, J=8,2 Гц, 2Н), 7,56 (br, t, 1H), 7,44 (m, 2Н), 5,57 (d, J=6,7 Гц, 1H), 4,92 (d, J=9,3 Гц, 1H), 4,78 (br s, 1H), 4,48 (dd, J=10,4 Гц, J'=6,6 Гц, 1H), 4,09 (АВ q, 2Н), 4,06 (d, J=6,7 Гц, 1H), 3,74 (d, J=14,8 Гц, 1H), 3,35 (br d, 1H), 2,44 (m, 1H), 2,25 (s, 3Н), 2,22-0,45 (m, 42Н). 7 39860 держащего соединение XVIIa до -40°С, добавляли триэтиламин (0,20 мл, 1,698 ммоль), за ним следовал ацетоксиацетилхлорид (XVIa) (0,182 мл, 1,698 ммоль) в течение 10 мин. Смеси давали достигнуть комнатной температуры в течение 4 ч продукт разделяли между дихлорметаном и водой. Затем органическую фазу промывали водой и соляным раствором, высушивали и концентрировали. Хроматография на силикагеле (при элюировании с помощью 1;4 EtAOc/гексаном) давала 411 мг соединения XVIIIa в виде примерно 10;1 смеси 3R, 4R:3S, 4R диастереомеров. Эту смесь диастереомеров (245,1 мг, 0,414 ммоль) в сухом ТГФ (2 мл) обрабатывали уксусной кислотой (0,15 мл) и тетрабутиламмонийфторидом (ТБАФ, 1 М в ТГФ, 1,20 мл). Раствор перемешивали в течение 14 ч при комнатной температуре, затем разделяли между этилацетатом и 5%-ным водным бикарбонатом натрия. Органическую фазу высушивали и концентрировали. После быстрой хроматографии на силикагеле с использованием 1:1 этилацетата:гексана в качестве элюента получили 66 мг (выход: 50%) соединения XIXa в виде пены в одном диастереомере; 1Н-ЯМР (CDCI3 d : 7,42-7,25 (m, 5Н), 5,90 (d, J= =4,8 Гц, 1H), 5,09 (d, J=4,8 Гц, 1 Н), 4,28 (m, 1H), 4,01 (d, J=4,8 Гц, 1H), 3,70 (s, 3Н), 1,73 (s, 3Н), 1,19 (d, J=6,6 Гц, 3Н). Соединение формулы XIXa (9,8 г, 0,0305 моль) в сухом дихлорметане (100 мл) обрабатывали при -78°С триэтиламином (9,40 мл, 0,0671 моль) и метансульфонилхлоридом (MsCI, 3,50 мл, 0,0457 моль). Этому раствору давали достичь комнатной температуры в течение ночи. Реакционную смесь разделяли между водой и дихлорметаном. Органический слой промывали 5%-ным водным бикарбонатом натрия, разбавленной водной НСl, водой и соляным раствором и концентрировали до получения соединения ХХа в виде неочищенного маслянистого остатка. Сырой остаток (10,0 г) растворяли в дихлорметане (250 мл) и озонировали при -78°С до тех пор, пока раствор не отстаивался до синего цвета. Добавление сернистого метила (11 мл) и концентрирование реакционной смеси давали соединение формулы XXIа (сырое). Соединение формулы XXIa растворяли в ТГФ (150 мл) и обрабатывали при -78°С гидратом гидразина (10 мл). Спустя 2 ч смесь выливали в разбавленную водную НСl и этилацетат, и обе фазы разделяли. Органическую фазу промывали дополнительным количеством кислоты, воды и соляного раствора и концентрировали до получения сырого продукта, который очищали с помощью хроматографии на силикагеле с использованием 1-5%-ного метанола в хлористом метилене для получения 4,40 г (выход: 71%) соединения формулы ХХIIа; 1Н-ЯМР (CDCI3) d: 7,38-7,24 (m, 5Н), 6,31 (bs, 1Н), 5,87 (bm, 1Н), 5,04 (d, J=4,8 Гц, 1Н), 1,67 (s, 3H). К охлажденной (-5°С) смеси 1 М водного КОН (140 мл) и ацетонитрила (100 мл) по каплям добавляли раствор соединения ХХIIа (2,39 г, 11,22 ммоль) в ацетонитриле (130 мл). Смесь перемешивали при 0°С в течение 1 ч и разбавляли этилацетатом (300 мл), водой (50 мл) и насыщенным водным бикарбонатом (50 мл). Органическую фазу отделяли, и затем водный слой экстрагировали этилацетатом (3×200 мл). Органические фазы соединяли, сушили, фильтровали и концентрировали до получения соединения формулы XXIIIa (сырое вещество), которое перекристаллизовывали из гексана/ацетона (т.пл. 184-6°С); выход 1,53 г (выход: 82%). К азетидинону XXIIIa (580 мг, 3,55 ммоль) в сухом ТГФ (5,0 мл) добавляли имидазол (265 мг, 3,90 ммоль), за ним следовал триэтилсилилхлорид (0,654 мл, 3,90 ммоль). Смесь перемешивали в течение 1 ч. Добавляли этилацетат и органический слой промывали соляным раствором, 10%ной водной НСl и сушили. Хроматография на силикагеле (при элюировании 25% этилацетатом в гексане) давала 670 (выход: 68%) соединения XXXIVa в виде пены. К перемешиваемому раствору соединения XXIVa (2,20 г, 7,92 ммоль) в сухом ТГФ (25 мл) добавляли этилдиизопроламин (1,65 мл, 9,51 ммоль) при 0°С в атмосфере аргона. Раствор перемешивали в течение 5 мин, затем добавляли ди-трет.бутилкарбонат (2,08 г, 9,51 ммоль) и 4-диметиламинопиридин (193,6 мг, 1,58 ммоль). Реакционную смесь перемешивали при 0°С в течение 60 мин. Реакционную смесь разбавляли этилацетатом (25 мл) и смесь промывали соляным раствором, 10%-ным водным бикарбонатом натрия, 10%-ной водной НСl, сушили над сульфатом магния и концентрировали до получения масла. Быстрая хроматография на силикагеле (при элюировании 15% этилацетатом в гексане) давала 2,40 г (Выход: 83%) соединения XVa в виде белого твердого вещества; 1Н-ЯМР (CDCI3) d 7,28 (m, 5Н), 5,03 (m, 2Н), 1,38 (s, 9H), 0,76 (t, J=7,56, 9H), 0,43 (m, 6H). Пример А. O O tBuO O N H O OH HO Ph H O AcO O O (72-1) Получение 3'-дефенил-3'-(изобутенил)-N-дебензоил-N-(третбутоксикарбонил) - 7 - дегидрокси10-деацетокситаксола. В раствор 28,7 мг (0,051 ммоль) 7-дегидрокси10-деацетоксибаккатина (III) в 0,7 мл ТГФ при -45°С по каплям добавляли 0,06 мл 0,98 М раствора LiN(SiMe3)2 в гексане. По истечении 0,5 ч при -45°С в эту смесь по каплям добавляли раствор 47,3 мг (0,15 мол.) цис-1-трет.-бутоксикарбонил-3-(2-метоксиизопропилокси)-4-(изобутенил)азетидин-2-она в 0,7 мл ТГФ. Раствор нагревали до 0°С и выдерживали при этой температуре 1 ч с последующим добавлением 1 мл 10%-ного раствора уксусной кислоты в ТГФ. Смесь делили между насыщенным водным раствором NaHCO3 и смесью этилацетата с гексаном 60/40. Выпаривание органического слоя давало остаток, который 8 39860 очищали фильтрованием через силикагель с получением 40,3 г смеси, содержащей (2'R,3'S)-2'-O(2- метоксиизопропил)-3'-дефенил-3'-(изобутенил)N-дебензоил-N-(трет.-бутиксикарбонил) - 7 -дегидрокси-10-деацетокситаксола и небольшое количество (2S',3'R)изомера. В раствор 40,3 мг (0,046 ммоль) смеси, полученный предыдущим взаимодействием, в 3,2 мл ацетонитрила и 0,15 мл пиридина при 0°С добавляли 0,47 мл 48%-ного водного раствора HF. Смесь перемешивали при 0°С в течение 3 ч, затем при 25°С в течение 13 ч и делили между насыщенным водным раствором бикарбоната натрия и этилацетатом. В результате выпаривания этилацетатного раствора получали 35,2 мг материала, который очищали высокоскоростной хроматографией, получая 24,0 мг (70%) 3'-дефенил3'-(изобутенил)-N-дебензоил-N-(трет. - бутоксикарбонил)-7-дегидрокси-10-деацетокситаксола, который перекристаллизовывали из смеси метанола с водой. Т. пл. 122-125°С; a ? - 64,3° (с=0,0025, СНСl3). 1 Н-ЯМР-спектрограмма (CDCl3, 300 МГц, d : 8,12 (d, J=7,1 Гц, 2Н, ортобензоат), 7,60 (m, 1H, пара-бензоат), 7,48 (m, 2Н, мета-бензоат), 6,11 (td, J=8,1, 1,8 Гц, 1Н, Н13), 5,68 (d, J=6,9 Гц, 1H, Н2), 5,23 (d, J=9,9 Гц, 1H, NH), 5,12 (d, J=9,9 Гц, 1H, H3'), 4,96 (dd, J=9,1, 2,7 Гц, 1Н, Н5), 4,80 (d, J=8,7 Гц, 1H, Ме2С=СН-), 4,58 (dd, J=5,7, 2,1 Гц, 1H, Н2'), 4,30 (d, J=8,1 Гц, 1H, Н20a) ), 4,19 (d, J=8,1 Гц, 1H, H20b) ), 3,97 (d, J=6,9 Гц, H3), 3,83 (d, J=16,5 Гц, 1Н, H10a) ), 3,33 (m, 1H, Н10b), 3,30 (m, 1H, 2'ОН), 2,39 (m, 1H, Н14a) ), 2,35 (s, 3H, 4A), 2,26 (m, 1H, Н14b) ), 2,19 (m, 1H, Н6a) ), 2,10 (m, 1H, H7b) ), 1,95 (m, 1H, H6C), 1,73 (s, 3H, Ме18), 1,69 (s, 6H, 2Ме изобутенила), 1,63 (s, 3H, Ме19), 1,44 (m, 1H, Н7b) ), 1,39 (br.s, 1H, 1 ОН), 1,35 (s, 9H, 3 трет.бутокси-Ме), 1,25 (s, 3H, Ме16), 1,15 (s, 3H, Me17). Пример Б. щенным водным раствором NaHCO3 и смесью этилацетата с гексаном 60/40. Выпаривание органического слоя давало остаток, который очищали фильтрованием через силикагель с получением 38,4 г смеси, содержащей (2'R,3'S)-2'-О-триэтилсилил-N-дебензоил-N-(трет. - бутоксикарбонил)-7дегидрокси-10-деацетокситаксола и небольшое количество (2'S,3'R)изомера. В раствор 38,4 мг (0,041 ммоль) смеси, полученной предыдущим взаимодействием, в 3,2 мл ацетонитрила и 0,15 мл пиридина при 0°С добавляли 0,46 мл 48%-ного водного раствора HF. Смесь перемешивали при 0°С в течение 3 ч, затем при 25°С в течение 13 ч и делили между насыщенным водным раствором бикарбоната натрия и этилацетатом. В результате выпаривания этилацетатного раствора получали 33,8мг материала, который очищали высокоскоростной хроматографией, получая 27,4 мг (71%) N-дебензоилN-(трет.-бутоксикарбонил)-7-дегидрокси-10-деацетокситаксола, который перекристаллизовывали из смеси метанола с водой. Т. пл. 135-138°C; [a]? - 65,2° (с=0,0025, СНСl3). 1 Н-ЯМР-спектрограмма (CDCI3, 300 МГц, d : 8,12 (d, J=7,1 Гц, 2Н, ортобензоат), 7,60 (m, 1H, пара-бензоат), 7,51 (m, 2H, мета-бензоат), 7,427,29 (m, 5Н, фенил), 6,12 (td, J=8,1, 1,8 Гц, 1H, Н13), 5,66 (d, J=6,9 Гц, 1H, Н2), 5,21 (d, J=9,9 Гц, 1H, NH), 5,16 (d, J=9,9 Гц, 1H, H3'), 4,92 (dd, J=9,1, 2,7 Гц, 1H, Н5), 4,58 (dd, J=5,7, 2,1 Гц, 1H, Н2'), 4,30 (d, J=8,1 Гц, 1H, Н20a) ), 4,21 (d, J=8,1 Гц, 1H, H20b) , 3,97 (d, J=6,9 Гц, H3), 3,82 (d, J=16,5 Гц, 1H, H10a) ), 3,41 (m, 1H, H10b) ), 3,36 (m, 1H, 2'ОН), 2,40 (m, 1H, Н14a) ), 2,38 (s, 3H, 4Ac), 2,26 (m, 1H, Н14b) ), 2,20 (m, 1H, Н6a) ), 2,13 (m, 1H, Н7b) ), 1,93 (m, 1H, Н6b) ), 1,73 (s, 3H, Ме18), 1,70 (s, 3H, Ме19), 1,43 (m, 1H, H7b) ), 1,38 (br.s, 1H, 1 ОН), 1,32 (s, 9H, 3 трет.-бутокси-Ме), 1,25 (s, 3H, Ме16), 1,15 (s, 3H, Me17). Пример В. O O Ph O O O tBuO N H O OH HO Ph H O AcO tBuOCON O H OH O OH HO Ph O (72-4) H O AcO O O (68-4) Получение N-дебензоил-N-(трет.-бутоксикарбонил)-7-дегидрокси-10-деацетокситаксола. В раствор 28,0 мг (0,049 ммоль) 7-дегидрокси10-деацетоксибаккатина (III) в 0,7 мл ТГФ при -45°С по каплям добавляли 0,06 мл 0,98 М раствора LiN(SiMe3)2 в гексане. По истечении 0,5 ч при -45°С в эту смесь по каплям добавляли раствор 56,0 мг (0,15 мол.) цис-1-трет.-бутоксикарбонил-3-триэтилсилилокси)-4-(фенил)-азетидин-2она в 0,7 мл ТГФ. Раствор нагревали до 0°С и выдерживали при этой температуре 1 ч с последующим добавлением 1 мл 10%-ного раствора уксусной кислоты в ТГФ. Смесь делили между насы Получение 3'-дефенил-3'-(изобутенил)-N-дебензоил-N-(трет.-бутоксикарбонил)-10-деацетокситаксола. В раствор 50,0 мг (0,077 ммоль) 7-O-триэтилсилил-10-диацетоксибаккатина (III) в 0,8 мл ТГФ при -45°С по каплям добавляли 0,09 мл 0,98 М раствора LiN(SiMe3)2 в гексане. По истечении 0,5 ч при -45°С в эту смесь по каплям добавляли раствор 58,0 мг (0,193 моль) цис-1-трет.бутокси- карбонил-3-(2-метоксиизопропилокси)-4-(изобутенил)азетидин-2-она в 0,7 мл ТГФ. Раствор нагревали до 0°С и выдерживали при этой температуре 1 ч с 9 39860 последующим добавлением 1 мл 10%-ного раствора уксусной кислоты в ТГФ. Смесь делили между насыщенным водным раствором NaHCO3 и смесью этилацетата с гексаном 60/40. Выпаривание органического слоя давало остаток, который очищали фильтрованием через силикагель с получением 62,7 г смеси, содержащей (2'R,3'S)-2'-O(метоксиизопропил)-7 - O - триэтилсилил-3'-дефинил-3'-(изобутенил)-N-дебензоил-N-(трет.-бутоксикарбонил)-10-деацетокситаксола и небольшое количество (2'S,3'R) изомера. В раствор 62,7 мг (0,059 ммоль) смеси, полученной предыдущим взаимодействием, в 3,5 мл ацетонитрила и 0,16 мл пиридина при 0°С добавляли 0,55 мл 48%-ного водного раствора HF. Смесь перемешивали при 0°С в течение 3 ч, затем при 25°С в течение 13 ч и делили между насыщенным водным раствором бикарбоната натрия и этилацетатом. В результате выпаривания этилацетатного раствора получали 51,5 мг материала, который очищали высокоскоростной хроматографией, получая 43,0 мг (95%) 3'-дефенил3'-(изобутенил)-N-дебензоил-N-(трет. -бутоксикарбонил)-10-деацетокситаксола, который перекристаллизовывали из смеси метанола с водой. Т.пл. 153-155°С; [a] ? -56,3° (с=0,003, СНСl3). 1 Н-ЯМР-спектрограмма (CDCl3, 300 МГц, d) : 8,10 (d, O=7,3 Гц, 2Н, ортобензоат), 7,60 (m, 1H, пара-бензоат), 7,47 (m, 2Н, мета-бензоат), 6,15 (td, J=8,5, 1,8 Гц, 1H, Н13), 5,69 (d, J=6,9 Гц, 1H, 2Н), 5,32 (d, J=9,2 Гц, 1Н, NH), 4,93 (dd, J=9,6, 1,8 Гц, 1H, H5), 4,82 (d, J=8,7 Гц, 1H, Ме2С=СН-), 4,76 (td, J=8,7, 2,7 Гц, 1H, Н3'), 4,37 (d, J=8,7 Гц, 1H, Н20a) ), 4,22 (d, J=8,7 Гц, 1H, H20b) ), 4,18 (d, J= =2,7 Гц, 1H Н2'), 4,03 (d, J=7,3 Гц, 1H, H7), 3,82 (d, J=15,2 Гц, 1H, H10a) ), 3,47 (m, 1H, 2'OH), 3,41 (d, J=6,6 Гц, 1H, 3Н), 2,60 (m, 1H, Н6b) ), 2,39 (m, 1H, H10a) ), 2,37 (s, 3Н, 4Ас), 2,18 (s, 1H, 7OН), 2,08 (m, 1H, Н14b) , 1,78 (m, 1H, Н14b) ), 1,76 (s, 3Н, Ме18), 1,74 (s, 6H, 2Ме изобутенила), 1,63 (m, 1H, Н6b) ), 1,36 (s, 9H, 3 трет.-бутокси-Ме), 1,26 (s, 3Н, Ме17), 1,18 (s, 3Н, Ме19), 1,15 (s, 3Н, Ме16). Пример Г. 1 мл 10%-ного раствора уксусной кислоты в ТГФ. Смесь делят между насыщенным водным раствором NаНСО3 и смесью этилацетата с гексаном 60/40. Выпаривание органического слоя дает остаток, который очищают фильтрованием через силикагель с получением смеси, содержащей (2'R,3'S)-2-О-триэтилсилил-N-дебензоил-N-(аллилоксикарбонил)- 7 -дегидрокси-10-деацетокситаксола и небольшое количество (2'S,3'R)изомера. В раствор смеси, полученной предыдущим взаимодействием, в ацетонитриле и пиридине при 0°С добавляют 48%-ного водного раствора HF. Смесь перемешивают при 0°С в течение 3 ч, затем при 25°С в течение 13 ч и делят между насыщенным водным раствором бикарбоната натрия и этилацетатом. В результате выпаривания этилацетатного раствора получают материал, который очищают высокоскоростной хроматографией, получая N-дебензоил-N-(аллилоксикарбонил)-7-дегидрокси-10-деацетокситаксола, который перекристаллизовывают из смеси метанола с водой. Пример Д. O O Ph O Ph H O OH HO Ph H O AcO O OH HO Ph H O AcO O O Получение 3'-дефенил-3'-(изопропил)-7-дегидрокси-10-деацетокситаксола. В раствор 7-дегидрокси-10-деацетоксибаккатина (III) в ТГФ при -45'С по каплям добавляют 0,98 М раствора LiN(Si-Me3)2 в гексане. По истечении 0,5 ч при -45°С в эту смесь по каплям добавляют раствор цис-1-бензоил-3-триэтилсилокси-4изопропилазетидин-2-она в ТГФ. Раствор нагревают до 0°С и выдерживают при этой температуре 1 ч с последующим добавлением 1 мл 10%-ного раствора уксусной кислоты в ТГФ. Смесь делят между насыщенным водным раствором NaHCO3 и смесью этилацетата с гексаном 60/40. Выпаривание органического слоя дает остаток, который очищают фильтрованием через силикагель с получением смеси, содержащей (2'R,3'S)-2'-O-триэтилсилил-3' - дефенил- 3'-(изопропил)-7-дегидрокси-10-деацетокситаксола и небольшое количество (2'S,3'R) изомера. В раствор смеси, полученной предыдущим взаимодействием, в ацетонитриле и пиридине при 0°С добавляют 48%-ного водного раствора HF. Смесь перемешивают при 0°С в течение 3 ч, затем при 25°С в течение 13 ч и делят между насыщенным водным раствором бикарбоната натрия и этилацетатом. В результате выпаривания этилацетатного раствора получают материал, который очищают высокоскоростной хроматографией, получая 3'-дефенил-3'-(изопропил)-7-дегидрокси-10деацетокситаксола, который перекристаллизовывают из смеси метанола с водой. O N N H O O O O O Получение N-дебензоил-N-(аллилоксикарбонил)-7-дегидрокси-10-деацетокситаксола. В раствор 7-дегидрокси-10-деацетоксибаккатина (III) в ТГФ при -45°С по каплям добавляют 0,98 М раствора LiN(Si-Me3)2 в гексане. По истечении 0,5 ч при -45°С в эту смесь по каплям добавляют раствор цис-1-(аллилоксикарбонил)-3-триэтилсилилокси-4-фенилазетидин-2-она в ТГФ. Раствор нагревают до 0°С и выдерживают при этой температуре 1 ч с последующим добавлением 10 39860 Пример Е. триэтилсилилокси-4-фенилазетидин-2-она в ТГФ. Раствор нагревают до 0°С и выдерживают при этой температуре 1 ч с последующим добавлением 1 мл 10%-ного раствора уксусной кислоты в ТГФ. Смесь делят между насыщенным водным раствором NаНСО3 и смесью этилацетата с гексаном 60/40. Выпаривание органического слоя дает остаток, который очищают фильтрованием через силикагель с получением смеси, содержащей (2'R,3'S)-2' - O - триэтилсилил-N-дебензоил-N-(кротилоксикарбонил)-7-дегидрокси-10-деацетокситаксола и небольшое количество (2'S,3'R) изомера. В раствор смеси, полученной предыдущим взаимодействием, в ацетонитриле и пиридине при 0°С добавляют 48%-ного водного раствора HF. Смесь перемешивают при 0°С в течение 3 ч, затем при 25°С в течение 13 ч и делят между насыщенным водным раствором бикарбоната натрия и этилацетатом. В результате выпаривания этилацетатного раствора получают материал, который очищают высокоскоростной хроматографией, получая N-дебензоил-N-(кротилоксикарбонил)-7-дегидрокси-10-деацетокситаксола, который перекристаллизовывают из смеси метанола с водой. Пример З. O O Ph O N O H HO OH H O AcO Ph O O Получение 3'-дефенил-3'-(циклопропил)-7-дегидрокси-10-деацетокситаксола. В раствор 7-дегидрокси-10-деацетоксибаккатина (III) в ТГФ при -45°С по каплям добавляют 0,98 М раствора LiN(Si Mg3)2 в гексане. По истечении 0,5 ч при -45°С в эту смесь по каплям добавляют раствор цис-1-бензоил-3-триэтилсилилокси4-циклопропилазетидин-2-она в ТГФ. Раствор нагревают до 0°С и выдерживают при этой температуре 1 ч с последующим добавлением 1 мл 10%ного раствора уксусной кислоты в ТГФ. Смесь делят между насыщенным водным раствором NaHCO3 и смесью этилацетата с гексаном 60/40. Выпаривание органического слоя дает остаток, который очищают фильтрованием через силикагель с получением смеси, содержащей (2'R, 3'S)2'- O-триэтилсилил-3'-дефенил-3'-(циклопропил)-7дегидрокси-10-деацетокситаксола и небольшое количество (2'S,3'R)изомера. В раствор смеси, полученной предыдущим взаимодействием, в ацетонитриле и пиридине при 0°С добавляют 48%-ного водного раствора HF. Смесь перемешивают при 0°С в течение 3 ч, затем при 25°С в течение 13 ч и делят между насыщенным водным раствором бикарбоната натрия и этилацетатом. В результате выпаривания этилацетатного раствора получают материал, который очищают высокоскоростной хроматографией, получая 3'-дефенил-3'-(циклопропил)-7-дегидрокси10-деацетокситаксола, который перекристаллизовывают из смеси метанола с водой. Пример Ж. O O O O Ph H O OH HO Ph H O AcO O OH HO Ph H O AcO O O Получение N-дебензоил-N-(3-бутинилоксикарбонил)-7-дегидрокси-10-деацетокситаксола. В раствор 7-дегидрокси-10-деацетоксибаккатина (III) в ТГФ при -45°С по каплям добавляют 0,98 М раствора LiN(SiºMe3)2 в гексане. По истечении 0,5 ч при -45°С в эту смесь по каплям добавляют раствор цис-1-(3-бутинилоксикарбонил)3-триэтилсилилокси-4-фенилазетидин-2-она в ТГФ. Раствор нагревают до 0°С и выдерживают при этой температуре 1 ч с последующим добавлением 1 мл 10%-ного раствора уксусной кислоты в ТГФ. Смесь делят между насыщенным водным раствором NaHCO3 и смесью этилацетата с гексаном 60/40. Выпаривание органического слоя дает остаток, который очищают фильтрованием через силикагель с получением смеси, содержащей (2'R, 3'S)-2'-O-триэтилсилил-N-дебензоил-N-(3-бутинилоксикарбонил)- 7 -дегидрокси-10-деацетокситаксола и небольшое количество (2'S, 3'R)изомера. В раствор смеси, полученной предыдущим взаимодействием, в ацетонитриле и пиридине при 0°С добавляют 48%-ного водного раствора HF. Смесь перемешивают при 0°С в течение 3 ч, затем при 25° С в течение 13 ч и делят между насыщенным водным раствором бикарбоната натрия и этилацетатом. В результате выпаривания этилацетатного раствора получают материал, который очищают высокоскоростной хроматографией, получая N-дебензоил-N-(3-бутинилоксикарбо O N O N H O O Ph O O Получение N-дебензоил-N-(кротилоксикарбонил)-7-дегидрокси-10-деацетокситаксола. В раствор 7-дегидрокси-10-деацетоксибаккатина (III) в ТГФ при -45°С по каплям добавляют 0,98 М раствора LiN(SiºMe3)2 в гексане. По истечении 0,5 ч при -45°С в эту смесь по каплям добавляют раствор цис-1-(кротилоксикарбонил)-3 11 39860 нил)-7-дегидрокси-10-деацетокситаксола, который перекристаллизовывают из смеси метанола с водой. Данные примеров приведены в таблице 2. С уче том вышеизложенного можно видеть, что достигаются несколько целей изобретения. Так как различные изменения могут быть внесены в вышеуказанные соединения и процессы в рамках данного изобретения, подразумевается, что весь материал, содержащийся в вышеприведенном описании, считается иллюстративным и не ограничивает смысл. Таблица 1 Цитотоксичность in vitro для аналогов таксола против клеток рака толстой кишки человека IC50 (мкМ) НСТ-116 0,008 0,004 Соединение 10-дезацетокситаксол Таксол НСТ-116/VМ46 1,22 (153)* 0,440 (124)* * Величина в скобках обозначает устойчивость относительно клеток НСТ-116. Таблица 2 O O R5 R6 R7 O N H R2 O R3 R4 HO Ph Группа Пример 4 R2 OH R3 H R4 OH R5 R6 R7 R10 R10 H фенил фенил Пример6 Защищенная OH; OH H Защищенная OH; OH -OR10 H фенил трет.-бутил H O AcO O Пример А Защищенная OH; H H Защищенная OH; OH -OR10 H изобутенил трет.-бутил 12 O Пример Б Защищенная OH; H H Защищенная OH; OH -OR10 H фенил трет.-бутил Пример В ЗащищеннаяOH; H H Защищенная OH; OH -OR10 H изобутенил трет.-бутил 39860 Схема І 13 39860 Схема ІІ 14 39860 Схема ІІІ 15 39860 Схема IV 16 39860 Схема V 17 39860 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 18
ДивитисяДодаткова інформація
Автори англійськоюHOLTON Robert A.
Автори російськоюХолтон Роберт А.
МПК / Мітки
МПК: C07D 407/12, A61K 31/335, A61K 31/337, A61P 35/00, C07F 7/18, C07F 7/00, C07D 409/12, C07D 305/00
Мітки: 10-дезацетокситаксол, похідні
Код посилання
<a href="https://ua.patents.su/18-39860-10-dezacetoksitaksol-ta-jjogo-pokhidni.html" target="_blank" rel="follow" title="База патентів України">10-дезацетокситаксол та його похідні</a>
Випадковий патент: Склад для пилогазоподавлення при масових вибухах у кар'єрах












