Біспецифічна молекула, що використовується для лізису пухлинних клітин, спосіб її одержання, моноклональне антитіло (варіанти), фармацевтичний препарат, фармацевтичний набір (варіанти), спосіб видалення пухлинн
Номер патенту: 40577
Опубліковано: 15.08.2001
Автори: Вілд Мартін, Штріттматтер Вольфганг, Буркхардт Шравен, Мейєр Стефан, Яггл Карлота-Сільвія
Формула / Реферат
1. Биспецифическая молекула применяемая для лизиса опухолевых клеток, содержащая детерминанты X и Z, где Х является специфичной для эпитопа на опухолевом антигене, и Z является специфичной для эпитопа антигена CD2, отличающаяся тем, что Z выбирается из моноклонального антитела, обозначенного AICD2.Ml, получаемого из гибридомной клеточной линии 1 Н 10 (DSM АСС2118) и другого могоклонального антитела, обозначенного AICD2.М2, получаемого из гибридомной клеточной линии 7 D 3 (DSMACC2119).
2. Биспецифическая молекула по п.1, отличающаяся тем, что детерминанту антитела X получают из моноклональных антител МАb 425 (АТСС НВ 9629) или МАb 361 (АТСС НВ 9325).
3. Биспецифическая молекула по п.1 или 2, отличающаяся тем, что указанная биспецифическая молекула является молекулой F(ab')2.
4. Биспецифическая молекула F(ab')2 по любому из пп.1-3, отличающаяся тем, что комбинация детерминат Х и Z является одной из следующих:
Х получена из Mab 425, и Z получена из Mab AICD2.M1;
Х получена из Mab 425, и Z получена из Mab AICD2. М2;
Х получена из Mab 361, и Z получена из Mab AICD2.M1;
Х получена из Mab 361, и Z получена из Mab AICD2.M2.
5. Способ получения биспецифической молекулы, указанной в п.З или п.4, путем ферментативного превращения двух различных моноклональных антител, каждое из которых содержит две идентичные L (легкая цепь) - Н (тяжелая цепь) полумолекулы, соединенные одной или несколькими дисульфидными связями, в две молекулы F(ab')2, расщепления каждой из F(ab')2 молекул при восстанавливающих условиях на Fab'-тиолы, дериватизации одной из этих Fab' молекул каждого антитела активирующим тиол агентом и комбинирования активированной Fab' - молекулы, несущей опухолевую специфичность, с неактивированной Fab' молекулой, несущей специфичность к лейкоцитам, или vice versa, для получения целевого биспецифического F(ab')2 фрагмента антитела, отличающийся тем, что в качестве антител, узнающих антиген лейкоцитов, применяют моноклональное антитело AICD2.M1 или AICD2.M2.
6. Способ получения биспецифической молекулы по п.5, отличающийся тем, что антитело МАb 425 или МАb 361 применяют в качестве антитела, узнающего антиген опухолевой клетки.
7. Моноклональное антитело AICD2.M1, узнающее антиген CD2, полученное выделением из клеточной линии 1 Н 10, депонированной под №DSМАСС2118.
8. Моноклональное антитело AICD2,M2, узнающее антиген CD2, полученное выделением из клеточной линии 7 D 3, депонированной под №DSMACC2119.
9. Фармацевтический препарат, содержащий по меньшей мере одну биспецифическую молекулу по любому из п.п. 1-4 вместе с фармацевтически приемлемым носителем, наполнителем или разбавителем.
10. Фармацевтический набор, содержащий
(і) первый фармацевтический препарат (I) по п.9, включающий биспецифическую молекулу по п.1, где Z получена из AICD2.M2, и
второй отдельный фармацевтический препарат (II), содержащий MAb AICD2.M1 или его Fv или F(ab')2 фрагмент или биспецифическую молекулу по п.1, где Z получена из MAb AICD2.M1.
11. Фармацевтический набор, включающий
(і) первый фармацевтический препарат (I) по п. 9, содержащий биспецифическую молекулу по п.1, где Z получена из AICD2.M1, и
(ii) второй отдельный фармацевтический препарат (II), содержащий MAb AICD2.M2 или его Fv, или F(ab')2 фрагмент или биспецифическую молекулу по п.1, где Z получена из Mab AICD2.M2.
12. Фармацевтический набор по п.11, отличающийся тем, что препарат (I) включает биспецифическую молекулу F(ab')2, в которой Х получена из MAb 425 и Z получена из MAb AICD2.M1, или в которой Х получена из MAb 361 и Z получена из MAb AICD2.M1, и препарат (II) включает F(ab')2 фрагмент MAb AICD2.M2.
13. Способ удаления опухолевых клеток ex vivo аутогенной трансплантации костного мозга при помощи фармацевтического набора частей по п.10 или п.12, иногда в. присутствии добавленных Т-лимфоцитов, отличающийся тем, что клетки сначала обрабатывают препаратом (I), а затем препаратом (II), иногда с последующей обычной стадией очистки.
Текст
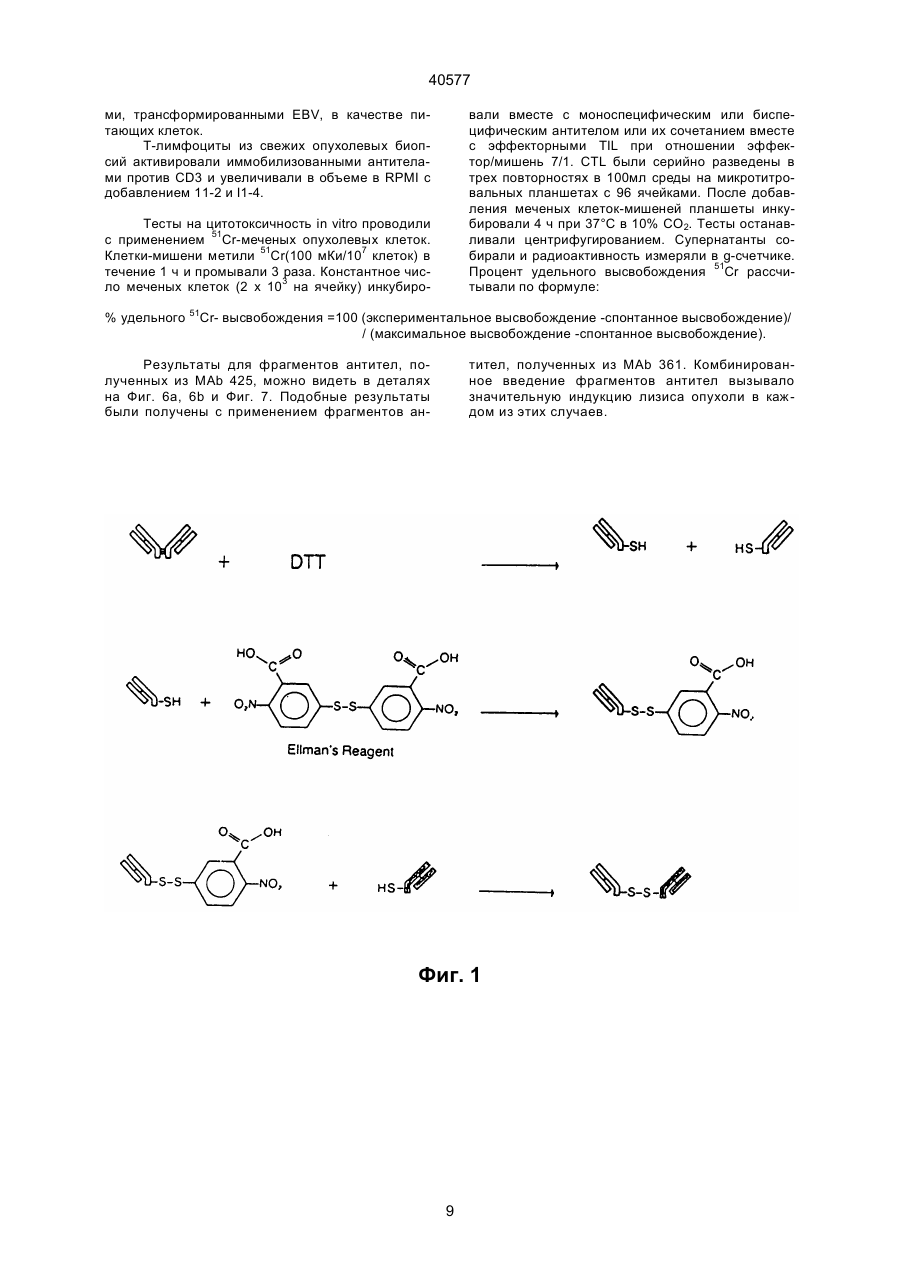
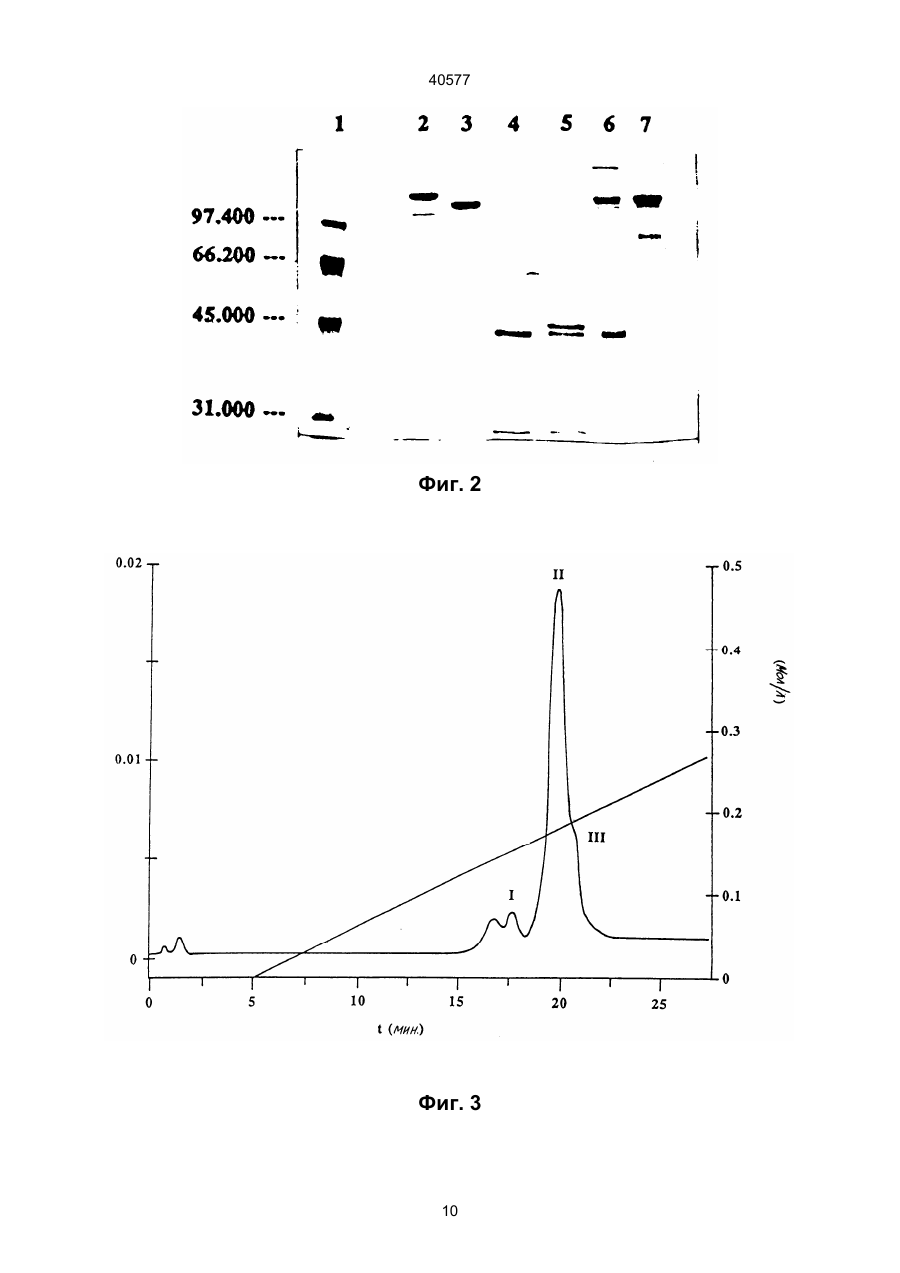
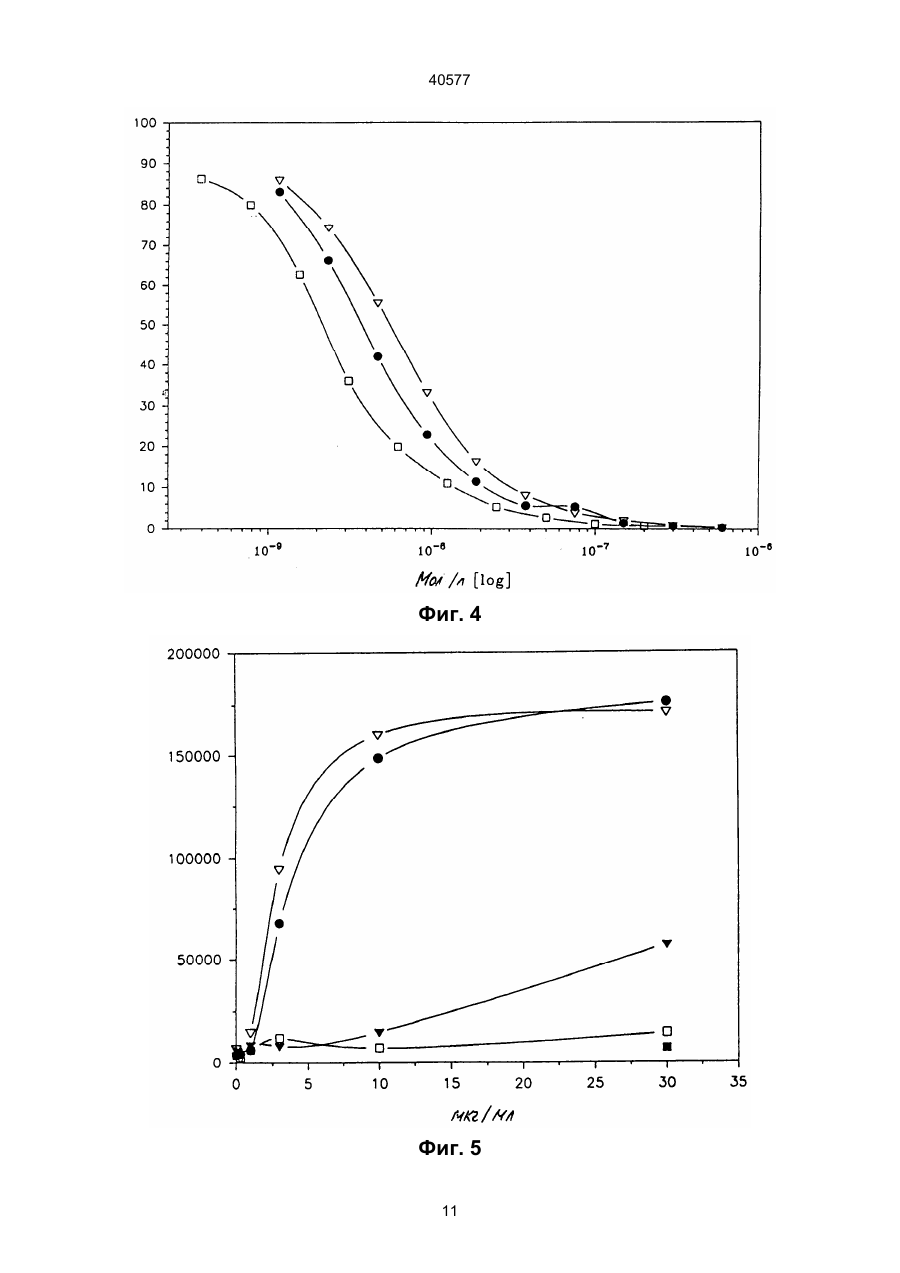
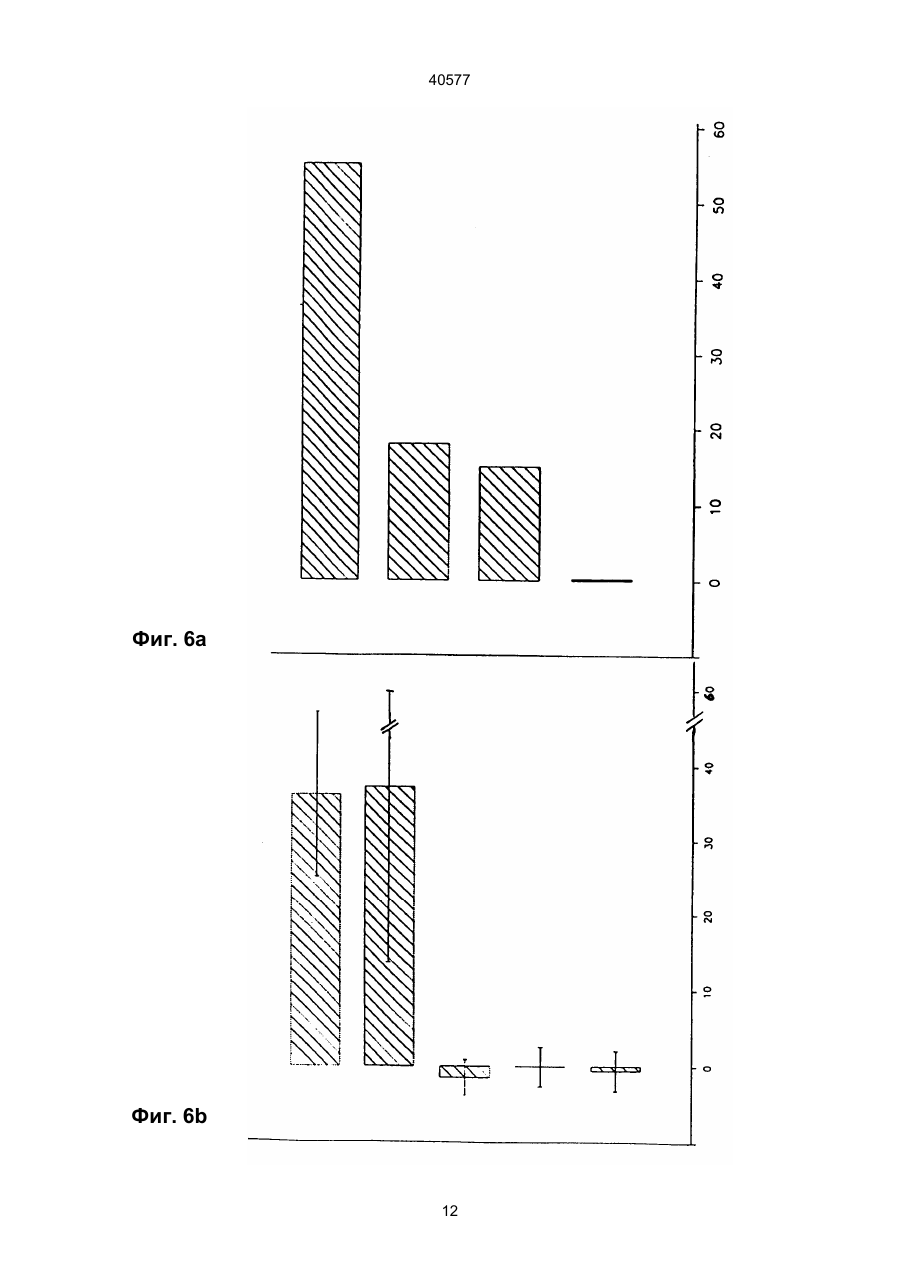
1. Биспецифическая молекула, применяемая для лизиса опухолевых клеток, содержащая детерминанты антитела X и Z, где Х является специфичной для эпитопа на опухолевом антигене, и Z является специфичной для эпитопа антигена CD2, отличающаяся тем, что Z выбирается из моноклонального антитела, обозначенного AICD2.M1, получаемого из гибридомной клеточной линии 1 Н 10 (DSM АСС2118) и другого моноклонального антитела, обозначенного AICD2.М2, получаемого из гибридомной клеточной линии 7 D 3 (DSMACC2119). 2. Биспецифическая молекула по п.1, отличающаяся тем, что детерминанту антитела X получают из моноклональных антител МАb 425 (АТСС НВ 9629) или МАb 361 (АТСС НВ 9325). 3. Биспецифическая молекула по п.1 или 2, отличающаяся тем, что указанная биспецифическая молекула является молекулой F(ab')2. 4. Биспецифическая молекула F(ab')2 по любому из пп.1-3, отличающаяся тем, что комбинация детерминат Х и Z является одной из следующих: Х получена из Mab 425, и Z получена из Mab AICD2.M1; Х получена из Mab 425, и Z получена из Mab AICD2. М2; Х получена из Mab 361, и Z получена из Mab AICD2.M1; Х получена из Mab 361, и Z получена из Mab AICD2.M2. 5. Способ получения биспецифической молекулы, указанной в п.3 или п.4, путем ферментативного C2 (54) БІСПЕЦИФІЧНА МОЛЕКУЛА, ЩО ВИКОРИСТОВУЄТЬСЯ ДЛЯ ЛІЗИСУ ПУХЛИННИХ КЛІТИН, СПОСІБ ЇЇ ОДЕРЖАННЯ, МОНОКЛОНАЛЬНЕ АНТИТІЛО (ВАРІАНТИ), ФАРМАЦЕВТИЧНИЙ ПРЕПАРАТ, ФАРМАЦЕВТИЧНИЙ НАБІР (ВАРІАНТИ), СПОСІБ ВИДАЛЕННЯ ПУХЛИННИХ КЛІТИН 40577 (ii) второй отдельный фармацевтический препарат (II), содержащий MAb AICD2.M2 или его Fv, или F(ab')2 фрагмент или биспецифическую молекулу по п.1, где Z получена из Mab AICD2.M2. 12. Фармацевтический набор по п.11, отличающийся тем, что препарат (I) включает биспецифическую молекулу F(ab')2, в которой Х получена из MAb 425 и Z получена из MAb AICD2.M1, или в которой Х получена из MAb 361 и Z получена из MAb AICD2.M1, и препарат (II) включает F(ab')2 фрагмент MAb AICD2.M2. 13. Способ удаления опухолевых клеток ex vivo аутогенной трансплантации костного мозга при помощи фармацевтического набора частей по п.10 или п.12, иногда в присутствии добавленных Т-лимфоцитов, отличающийся тем, что клетки сначала обрабатывают препаратом (I), а затем препаратом (II), иногда с последующей обычной стадией очистки. ____________________ Данное изобретение касается новых биспецифических фрагментов антител, которые узнают антиген CD2 лимфоцитов и любой вариабельный опухолевый антиген. В качестве опухолевого антигена предпочтительно применяют антигенную детерминанту рецептора эпидермального фактора роста (EGF-R). Кроме того, изобретение касается двух новых моноклональных антител, обозначенных AICD2.M1 и AICD2.M2, и комбинированного положительного действия на лизис опухолей, причем по меньшей мере одно из них представляет собой биспецифический фрагмент антител. Эти антитела и фрагменты антител могут успешно применяться в терапии и диагностике опухолей. Т-лимфоциты, по-видимому, являются наиболее эффективными компонентами иммунной системы при элиминировании опухолевых клеток. Однако большинство раковых больных не имеет большого количества цитотоксических Т-лимфоцитов (CTL), специфически реактивных по отношению к ИХ опухолевым клеткам (например, Knuth et al. 1984, Proc. Nаtl. Acad. Sci. (USA) 81, 3511). Для активации полного литического потенциала CTL все эти клетки должны быть направлены к опухолевым клеткам, к которым они нe имеют природной специфичности. Связывание моноклональных антител с определенными мембранными антигенами на поверхности Т-клеток может активировать пролиферацию Т-клеток, секрецию цитокинов и цитолитическую активность. Было показано, что биспецифические антитела, узнающие ассоциированные с опухолями антигены при помощи одного связывающего плеча и маркеры Т-клеток при помощи другого, соединяют моноспецифические CTL и злокачественные клетки (например, Staerz et al. 1985, Nature 314, 628). Активация Т-клеток этими синтетическими антителами может происходить через комплекс рецептор Т-клеток (TCR)/CD3, в которой TCR ответственен за узнавание антигена, а эпитоп CD3 за трансдукцию сигналов, генерируемых взаимодействием TCR с антигеном (например, см. обзорную статью Н. Nelson, Cancer Cells, May 1991, 163 и цитированные в ней ссылки). Активация эффекторных клеток может происходить также через антиген CD2, гликопротеин, присутствующий на Т-лимфоцитах и природных клетках-убийцах (NK) (например, Hunig et al., 1987, Nature, 326, 298). CD2 способствует взаимодействию эффекторной клетки с природным лигандом LFA3 (CD58) на целевой клетке. На CD2 были идентифицированы три функционально важных эпитопа (Т11.1, Т 11.2 и Т11.3). В противополож ность антигену CD3, который подвергается модуляции при связывании антител, пока не было сообщений о модуляции CD2 после взаимодействия CD2 с антителом. В более ранней работе с применением антител против CD2 для активации было показано, что реалистичной является двухступенчатая активация через антиген CD2. Антитела, такие как анти-Т11.2 плюс анти-Т11.1 или анти-Т11.2 плюс анти-Т11.3, обладали синергически действующими специфичностями против CD2 при использовании их для активации. Сообщалось, что Т11.3 является скрытым эпитопом, который становится доступным после активации при помощи анти-Т11.2. Большинство применяемых до сих пор антител конкурирует за связывание с природным лигандом CD2 LFA-334.1 (например, Bolhius et al., 1991, Cancer Іmmunоl. Immunther. 34,1 и цитированные ссылки). В Европейской патентной заявке 294703 (Schlossman et al.) описаны бифункциональные антитела против CD2 (Т112 и Т113), чтобы обратиться к альтернативному пути активации Т-клеток. Согласно Schlossman et al.эпитопы Т11 не были выражены на оставшихся, неактивированных Т-клетках. Таким образом, описанные биспецифические антитела могут быть полезны лишь для доставки активированных клеток-убийц (NK, Тклетки). Эта концепция биспецифических антител основывалась на идее, что будет возможно направлять и связывать биспецифическое антитело сперва с целевой опухолью, а затем активизировать Т-клетки, расположенные на целевой стороне, для получения связывания клетки, направленной на опухоль, и уничтожения альтернативным путем. Биспецифические антитела Schlossman перекрестно сшивают клетки-мишени и эффекторные клетки, хотя не активируют эффекторные механизмы. Активация достигается цитокинами. Glennie et al. (J.Immunol. 1991,147:60-9) и другие продемонстрировали, что одновременное применение перекрестно сшитых антител, направленных на комплекс рецептор Т-клеток, и несколько других Т-клеточных молекул, таких как CD2, CD4, CD5, и CD8, может быть использовано для активации оставшихся Т-клеток. Для создания более четкой конструкции они разработали способ синтезации триспецифических производных F(ab')3. Эти производные, несущие два связывающих плеча к Т-лимфоцитам и одно единичное плечо Fab' для нацеливания на опухолевые клетки, были также описаны в WO 91/03493 тем же автором. На два разных эпитопа CD2, описанные в 2 40577 заявке, были нацелены ОКТ11 и дополнительное антитело, называемое GT2. Авторы считали, что эти антитела эквивалентны антителам Т111 и Т113, которые были опубликованы Schlossman et al. и, как было показано, активировали лимфоцит альтернативным путем активации Т-клеток, как описано и использовано выше. Использование триспецифического производного F(ab')3 (антиТ11(1) х анти-Т11(3) х анти-СD37) в терапевтической установке значило бы, что антитело связывается со всеми CD2 позитивными NK и Т-клетками, а также индуцировало бы распространенную активацию лимфоцита, таким образом, вызывая тяжелые побочные эффекты. Таким образом, целью данного изобретения было получение новых биспецифических антител, происходящих из противоопухолевых антител и пары синергически действующих антител против CD2, которые способны передавать цитотоксичность после двухступенчатой активации, не влияя на нормальную пресс-реактивность клеток через CD2/LFA3. Было обнаружено, что новые биспецифические антитела согласно данному изобретению имеют следующие положительные свойства: обладают сильной авидностью к опухолевой клетке, сильной авидностью к Т-клетках и NK-клеткам, не конкурируют с LFA3, не обнаруживают синергизма с LFA3, не модулируют рецептор, обладают высокой специфичностью в отношении NK- и Т-клеток, эффективны только после двухступенчатой активации, что означает, что одно биспецифическое антитело как таковое не влияет или влияет минимально на активацию Т-клеток и на лизис опухолевых клеток соответственно. Таким образом, объектом настоящего изобретения является биспецифическая молекула, применимая для лизиса опухолевых клеток, содержащая детерминанты Х и Z антитела, где Х является специфичной для эпитопа на опухолевом антигене, и Z является специфичной для эпитопа антигена CD2, отличающаяся тем, что Z выбирается из моноклонального антитела, обозначенного как AICD2.M1, получаемого из гибридомной клеточной линии 1 Н 10 (DSM ACC2118), и другого моноклонального антитела, обозначенного как AICD2.M2, получаемого из гибридомной клеточной линии 7 D3 (DSM ACC2119). AICD2.M1 и AICD2.M2 - новые моноклональные антитела, которые были получены иммунизацией мышей генно-инженерным антителом CD2 и выделением и очисткой антител из подходящих мышиных гибридомных клеток (детали см. в примерах) и которые обладают высокой специфичностью в отношении CD2 антигена Т- и NK-клеток. Таким образом, объектом данного изобретения является моноклональное антитело, обозначаемое AICD2.M1, узнающее CD2 антиген, полученное путем выделения из клеточной линии 1 Н 10, депонированной под № DSM ACC2118. Объектом данного изобретения является также моноклональное антитело, обозначаемое AІCD2.M2, узнающее CD2 антиген, полученное из клеточной линии 7 D 3, депонированной под № DSM ACC2119. Эти новые клеточные линии, продуцирующие названные антитела, были депонированы в "Deutsche Sammlung für Mikroorganismen" (DSM, Braunschweig, FRG) согласно Budapest Treaty, 23 февраля 1993 года. Изобретение также касается моноклональных антител, которые являются природными или синтетическими вариантами или мутантами AICD2.MI и AІCD2.M2, в том числе генетически модифицированными или сконструированными, предпочтительно "очеловеченными" и химерными вариантами. Биспецифическая молекула согласно изобретению содержит плечо связывания AICD2.M1 или AІCD2.M2 и другое плечо связывания антитела, которое узнает любой опухолевой антиген. Выбор противоопухолевого антигена не оказывает значительного влияния на эффективность биспецифического антитела в отношении активации Тклеток и лизиса опухолевых клеток. В предпочтительном варианте изобретения второе плечо связывания представлено плечом связывания моноклонального противоопухолевого антитела МАb 425 или МАb 361, в том числе, согласно изобретению, модифицированных, предпочтительно "очеловеченных" или химерных вариантов, и генетически сконструированных минимальных фрагментов. Таким образом, объектом данного изобретения является обеспечение биспецифического фрагмента антитела, описанного выше и в формуле изобретения, где Х - детерминанта антитела, происходящая из моноклональных антител МАb 425 или МАb 361. MAb 425 представляет собой мышиное моноклональное антитело, образующееся против хорошо известной линии клеток человеческой А431 карциномы (АТСС CRL 1555), связывается с полипептидным эпитопом наружного домена человеческого рецептора эпидермального фактора роста (EGF-R) и ингибирует связывание EGF. Было обнаружено, что МАb 425 (АТСС HВ 9629) медиирует опухолевую цитотоксичность in vitro и подавляет рост опухолевых клеток клеточных линий, полученных из эпидермоида и колоректальной карциномы, in vitro (Rodeck et al. 1987, Cancer Res. 47, 3692). "Очеловеченные" и химерные варианты МАb 425 были описаны в WO 92/15683. Mab 361 представляет собой IgG 2a мышиное моноклональное антитело (АТСС HВ 9325) и связывается специфически с GD2 антигеном и GD3 антигеном ганглиозида. Такими ганглиозидами сильно обогащены меланомные опухоли (ЕР 0280 209, US SN 016302). MAb 361 обнаруживает высокий уровень цитотоксичности in vitro в отношении опухолевых клеток, экспрессирующих GD2 антиген (Thurin et al. 1987, Cancer Res. 47, 1229). Биспецифические антитела данного изобретения являются фрагментами целых антител, например F(ab')2 молекулами или миниантителами (Fv молекулами), предпочтительно F(ab')2 молекулами. В противоположность целым антителам такие фрагменты, как F(ab')2 и миниантитела, могут более легко проникать в массу твердых опухолей и проявлять свою цитотоксичность и силу внутри опухоли. Кроме того, F(ab')2 молекулы и миниантитела, происходящие из мышей, обычно обна 3 40577 руживают пониженную ответную реакцию человека на антитела против мышей (НАМА). Таким образом, предпочтительным объектом данного изобретения является обеспечение биспецифической молекулы F(ab')2, как указано выше и в формуле изобретения, где комбинация детерминат Х и Z является одной из следующих: Х получена из Mab 425, и Z получена из Mab AICD2.M1; Х получена из Mab 425, и Z получена из Mab AICD2.M2; Х получена из Mab 361, и Z получена из Mab AICD2.M1; Х получена из Mab 361, и Z получена из Mab AICD2.M2. Были описаны различные способы получения биспецифических антител, основанные на полных антителах или фрагментах (например, см. обзорную статью Brissinck et al. 1922, Drugs of the Future 17(11), 1003). Одним из путей конструирования биспецифических фрагментов антител является превращение целых антител в (моноспецифические) F(ab')2 молекулы путем протеолиза, расщепляющего эти фрагменты на Fab' молекулы, и рекомбинация Fab' молекул с разной специфичностью в биспецифические F(ab')2 молекулы (см., например, ЕР 0179872 В1). Таким образом, объектом данного изобретения является обеспечение способа получения биспецифического F(ab')2 фрагмента антитела, применимого для лизиса опухолевых клеток, имеющего первый сайт связывания с эпитопом опухолевой клетки и второй сайт связывания с эпитопом антигена CD2, при помощи ферментативного превращения двух различных моноклональных антител, каждое из которых содержит две идентичные L (легкая цепь) - Н (тяжелая цепь) полумолекулы, соединенные одной или несколькими дисульфидными связями, в две F(ab')2 молекулы, расщепления каждой F(ab')2 молекулы при восстанавливающих условиях на Fab' тиолы, дериватизации одной из этих Fab' молекул каждого антитела активирующим тиол агентом и комбинирования активированной Fab' молекулы, несущей опухолевую специфичность, с неактивированной Fab' молекулой, несущей специфичность к лейкоцитам, или, наоборот, для получения целевого биспецифического F(ab')2 фрагмента антитела. Способ отличается тем, что в качестве антител, узнающих антиген лейкоцитов, применяют моноклональные антитела AICD2.M1 и AICD2.M2. et al. 1982, Cancer Res. 42, 457). В способе данного изобретения предпочтительно применяют DTNB. Обработку активирующим тиол агентом проводят только с одним из двух Fab' фрагментов. В принципе безразлично, какая из двух Fab' молекул превращается в активированный Fab' фрагмент (например, Fab' - TNB). Однако, как правило, тиолактивирующим агентом модифицируется более лабильный Fab' фрагмент. В данном случае фрагменты, несущие противоопухолевую специфичность, немного более лабильны и, следовательно, предпочтительно применяются в данном способе. Конъюгирование активированного Fab' производного со свободными SН-группами второй Fab' молекулы для образования бивалентного F(ab')2 антитела происходит спонтанно при температурах между 0 и 30°С. Выход очищенного F(ab')2 антитела составляет 20-40% (от целых антител). Как упомянуто выше, изобретение касается также биспецифических миниантител. Миниантитела представляют собой фрагменты антител, содержащие два одноцепочечных Fv фрагмента (scFv фрагменты обычно генетически соединены либо в виде VН-линкер-VL, либо в виде VL-линкерVH), которые соединяются путем аутоагрегации или путем слияния каждого из них на С-конце с шарнирным участком (иногда) для обеспечения гибкости и(или) с амфипатической спиралью для достижения димеризации. Спираль может быть взята из конструкции четырехспирального пучка или на лейциновой "молнии" (например. Pack и Plückthun 1992, Biochem. 31, 1579). Получение миниантител, описанных выше, представлено, например, в WO 93/00082. Биспецифические фрагменты антител были тестированы in vitro/ ex vivo в отношении следующих свойств: способности связываться со специфическими опухолевыми и Т-клетками, иммуномодуляции (пролиферации Т-клеток) и цитотоксичности (лизиса опухолевых клеток). Эти тесты описаны per se в стандартной литературе. Детали и результаты даны в примерах. Биспецифические фрагменты антитела данного изобретения могут вводиться больным для терапии. Таким образом, объектом изобретения является обеспечение фармацевтического препарата, содержащего в качестве активного ингредиента по меньшей мере один биспецифический фрагмент антитела, как описано выше и в формуле изобретения, соединенный с одним или несколькими фармацевтически приемлемыми носителями, наполнителями или разбавителями. Как правило, фрагменты антител данного изобретения должны вводиться внутривенно или парентерально. Обычно диапазоны доз для введения биспецифических фрагментов антител достаточно велики для получения желаемого подавления опухоли и лизирующего действия, доза зависит от возраста, состояния, пола и степени заболевания больного и может варьировать от 0,1 мг/кг до 200 мг/кг, предпочтительно от 0,1 мг/кг до 100 мг/кг на дозу, вводимую один раз или в несколько приемов в день в течение одного или нескольких дней. Препараты для парентерального введения могут быть в виде стерильных водных или невод В качестве ферментов, пригодных для превращения антитела в его F(ab')2 молекулы, можно применять пепсин и папаин. В некоторых случаях пригодны трипсин или бромелин. Однако в способе данного изобретения предпочтительно применять пепсин. Превращение дисульфидных связей в свободные SH-группы (Fab' молекулы) можно проводить при помощи восстанавливающих соединений, таких как дитиотреитол (ДТТ), меркаптоэтанол и меркаптоэтиламин. Активирующими тиол агентами, которые предотвращают рекомбинацию тиоловых полумолекул, являются 5,5'-дитио-бис-/2-нитробензойная кислота (DTNB), 2,2'дипиридиндисульфид, 4,4'-дипиридиндисульфид или тетратионат/сульфит натрия (см. также Raso 4 40577 ных растворов, суспензий и эмульсий. Примерами неводных растворителей являются пропилен гликоль, полиэтиленгликоль, растительные масла, например оливковые масла, и пригодные для инъекций органические эфиры, например этилолеат, и другие растворители, известные в данной области, которые пригодны для этих целей. Биспецифические антитела данного изобретения могут применяться в композиции, содержащей физиологически приемлемый носитель. Примерами таких носителейявляются физиологический раствор, физиологический раствор с фосфатным буфером (PBS), раствор Рингера или содержащий лактак раствор Рингера. В фармацевтических препаратах могут также присутствовать консерванты и другие добавки, такие как антибиотики, антиоксиданты и хелатирующие агенты. Биспецифические фрагменты антител могут быть также конъюгированы при помощи известных способов с цитокинами, такими как интерлейкин-2, для поддержания их цитотоксичности. Способы химического связывания фрагментов антитела (одноцепочечных Fv и Fab фрагментов) с помощью перекрестно сшивающих агентов представляют собой, например, таковые, описанные Segal and Snider 1989, Chem Immunol. 47, 179; Glennie et al. 1987, J. Immunol, 139, 2367; Brennan et al. 1985, Science, 229, 81 и PCT/US91/07283 (Romet-Lemonne and Fanger). Фармацевтические препараты данного изобретения пригодны для лечения всех типов опухолей, в том числе меланом, глиом и карцином, а также опухолей кровеносной системы и твердых опухолей. Предпочтительные препараты содержат биспецифический фрагмент антител, в котором одно плечо связывания несет сайты связывания моноклонального антитела МАb 425 или МАb 361. Данное изобретение описывает очень эффективную двухступенчатую активацию лейкоцитов путем введения двух различных антител или биспецифических фрагментов антител соответственно. Двухступенчатая активация согласно данному изобретению обозначает, что если (a) первый препарат, содержащий биспецифический фрагмент антитела, имеющий заданную специфичность опухолевой клетки и CD2 сайт связывания, не применяется с (b) вторым препаратом, содержащим дополнительный, другой биспецифический фрагмент антитела, имеющий другой CD2 сайт связывания, но ту же самую специфичность опухолевой клетки, или моноклональное антитело, имеющее другой CD2 сайт связывания и никакой опухолевой специфичности, или фрагмент указанного антитела, первый биспецифический фрагмент антитела является либо неэффективным, либо только минимально (20-40% в сравнении с двухступенчатым препаратом) эффективным в качестве единичного агента. Следовательно, объектом изобретения является обеспечение фармацевтического набора (кита) частей (А), включающего (і) первый фармацевтический препарат (I), содержащий биспецифическую молекулу, как описано выше и в п.1, вместе с фармацевтически приемлемым носителем, наполнителем или растворителем, где Z по лучена из AICD2.M2, и (іі) второй отдельный фармацевтический препарат (II), содержащий MAb AICD2.M1 или его Fv или F(ab')2 фрагмент или биспецифическую молекулу, как описано выше и в п.1, где Z получена из MAb AICD2.M1. В этом фармацевтическом наборе частей препарат (I) основан на MAb AICD2.M2 и препарат (II) - на MAb AICD2.M1. Альтернативно, изобретение касается другого набора частей, где препарат (I) основан на MAb AICD2.M1, тогда как препарат (II) основан MAb AICD2.M2. Таким образом, следующим объектом данного изобретения является обеспечение фармацевтического набора (кита) частей (В), включающего (і) первый фармацевтический препарат (I), содержащий биспецифическую молекулу, как описано выше и в п.1, вместе с фармацевтически приемлемым носителем, наполнителем или разбавителем, где Z получена из AICD2.M1, и (ii) второй отдельный фармацевтический препарат (II), содержащий МАb AICD2.M2 или его Fv или F(ab')2 фрагмент или биспецифическую молекулу, как описано выше и в п.1, где Z получена из МАb AICD2.M2. Различия между композициями (А) и (В) обычно не очень значительны. В случае МАb 425 можно видеть, что композиция (В), в которой препарат (I) основан на МАb AICD2.M1, работает лучше. Различия в опухолевых сайтах связывания внутри композиции (А) или (В) также не очень значительны. Эффективность фармацевтических наборов относительно связывающей способности, иммуномодуляции (пролиферации лейкоцитов) и цитотоксичности зависят, однако, от воздействия сайтов связывания биспецифических фрагментов антител, которые происходят из антител AICD.M1, и AICD2.M2. Таким образом, предпочтительные варианты этого изобретения обнаруживают сходные свойства. Различия в терапевтическом действии относительно препарата (II) (альтернативно, целое антитело, фрагмент моноспецифических антител или биспецифическое антитело) также не очень значительны. Однако предпочтительны препараты (II), содержащие подходящий фрагмент моноспецифичегких антител. Фармацевтический набор частей применяют следующим образом. Лечение начинают инъекцией препарата (I) одного из фармацевтических наборов больному. Биспецифическое антитело не только связывается согласно его специфичности с поверхностью опухоли, но, вследствие его малых размеров, может также проникать в массу твердой опухоли. Введение фрагмента биспецифического антитела согласно данному изобретению дает обогащение инъецированным иммуноглобулином в локальной зоне опухоли, но еще не приводит к значительному иммунному ответу. После индивидуального периода времени (зависящего от степени заболевания, типа опухоли, состояния, пола и возраста больного) от нескольких часов до нескольких дней вводят препарат (II), что вызывает немедленные иммунные ответы. Препараты (I) и (II) вводят предпочтительно в эквимолярных количествах. Эксперименты ex vivo показывают, что 5 40577 вертикальная ось: % включения 3Н-тимидина, горизонтальная ось: концентрация фрагментов антител (мкг/мл): × биспецифическая F(ab')2 молекула MAb 425 и MAb AICD2.M1 + F(ab')2 MAb AICD2.M2 Ñбиспецифическая F(ab')2 молекула MAb 425 и Mab AICD2.M2 + F(ab')2 MAb AICD2.M1 t F(ab')2 MAb AICD2.M2 q F(ab')2 MAb AICD2.M1 n F(ab')2 Mab 425 Фиг.6а: Индуцированный биспецифическими антителами лизис опухоли: аллогенные TIL в качестве эффекторных клеток; вертикальная ось: % цитотоксичности, горизонтальная ось: I = биспецифическая F(ab')2 молекула MAb 425 и МАb AICD2.M1 + F(ab')2 MAb AICD2.M2 2 = F(ab')2 MAb AICD2.M1 3 = F(ab')2 MAb AICD2.M2 4 = F(ab')2 MAb 425 Фиг.6b: Индуцированный биспецифическими антителами лизис опухоли: аутогенные TIL в качестве эффекторных клеток: вертикальная ось: % цитотоксичности, горизонтальная ось: I = биспецифическая F(ab')2 молекула MAb 425 и MAb AICD2.M1 + F(ab')2 MAb AICD2.M2 2 = биспецифическая F(ab')2 молекула MAb 425 и MAb AICD2.M2 + F(ab')2 MAb AICD2.M1 3 = F(ab')2 MAb AICD2.M1 4 = F(ab')2 MAb AICD2.M2 5 = F(ab')2 MAb 425 вертикальные линии на верхней части столбцов: среднее отклонение. Фиг. 7: Попадание Т-клеток в мишень и лизис опухолевых клеток, медиированные биспецифическими антителами. Фиг. 7А и В показывают совместную культуру инфильтрующих опухоль лимфоцитов (TIL) и аутогенных злокачественных клеток при отношении эффектор/мишень 40/1. Совместную культуру инкубировали 4 ч без (Фиг. 7А, контроль) и в присутствии биспецифической F(ab')2 молекулы МАb 425 и MAb AICD2.M1 + F(ab')2 MAb AICD2.M2 (20 мкг/мл каждого) (Фиг. 7В). В присутствии CD2 биспецифического антитела многочисленные Тлимфоциты слипаются с аутогенными опухолевыми клетками, впоследствии убивая клетки меланомы. Стрелка на фиг. 7В указывает конъюгат TIL с разрушенной клеткой меланомы. Совместное культивирование TIL и клеток меланомы проводили на 24 планшетах с ячейками в культуральной среде, содержащей 10% FCS. Микроснимки были получены при помощи модифицированного фазово-контрастного микроскопа, увеличение оригинала 100. Следующие примеры описывают изобретение в деталях. Пример 1: Получение MAb AICD2.M1 и AICD2.M2: Мышей Balb/C иммунизировали 4 раза в течение двух недель генетически сконструированным CD2. Последовательность ДНК человеческого CD2 и его клонирование было описано Sayre et al. 1987, Proc. Natl. Acad. USA 84, 2941. Экспрессию гена CD2 проводили в системе бакуловируса по способам, известным в литературе (Fraser аутогенные и аллогенные инфильтрующие опухоль лимфоциты (TIL), которые обычно не способны индуцировать значительную цитотоксичность против опухоли (лизис клеток), могут сильно активировать в результате такого способа (Фиг. 6а, в, 7). При помощи фармацевтического набора данного изобретения можно также очистить ех vivo до опухолевых клеток препарата костного мозга. Для усиления цитотоксического действия можно добавить экзогенные Т-лимфоциты. Следовательно, объектом данного изобретения является, наконец, обеспечение способа удаления опухолевых клеток ех vivo при аутогенной трансплантации костного мозга при помощи фармацевтического набора, описанного выше и в формуле изобретения, иногда в присутствии добавленных Т-лимфоцитов. Способ предусматривает обработку клеток препаратом (I) с последующей обработкой препаратом (II), иногда с последующей обычной стадией очистки. Способы очистки ex vivo костного мозга хорошо известны per se. Краткое описание фигур: Фиг. 1: Синтез биспецифического антитела (схема). Фиг. 2: ПААГ-ДС-Na фрагментов антитела и биспецифических антител: Дорожка 1: маркер мол. массы. Дорожка 2: F(ab')2 MAb AICD2.M1 перед восстановлением ДТТ. Дорожка 3: F(ab')2 MAb 425 перед восстановлением ДТТ. Дорожка 4: после восстановления ДТТ и дериватизации DTN3. Дорожка 5: F(ab')2 MAb 425 после восстановления ДТТ и дериватизации DTN3. Дорожка 6: биспецифические антитела перед и Дорожка 7: биспецифические антитела после очистки. Фиг.3: Хроматографический профиль биспецифической F(ab')2 молекулы MAb 425 и Mab AICD2.M1 на гидроксиапатите: левая вертикальная ось: оптическая плотность OD при 280 нм, правая вертикальная ось: концентрация фосфатного буфера (рН = 7,0), горизонтальная ось: время элюции (мин). Биспецифический фрагмент антител представлен пиком II. Пики I и III - минорные примеси. Фиг. 4: Конкурентноесвязывание биспецифических антител и Mabs с EGF-R: вертикальная ось: % поглощения при 490 нм, горизонтальная ось: концентрация фрагментов антител в моль/л/логарифмическая шкала/, меченые биотином МАb 425 применяли для конкуренции с немечеными F(ab')2 MAb 425 или биспецифического антитела за связывание с EGF-R; × биспецифическая F(ab')2 молекула Mab 425 и Mab AICD2.M1 Ñбиспецифическая F(ab')2 молекула Mab 425 и Mab AICD2.M2 F(ab')2 молекула Mab 425. Фиг. 5: Пролиферация лейкоцитов периферической крови человека (PBL): 6 40577 Пример 4: Синтез биспецифической F(ab')2 молекулы MAb 425 и MAb AICD2.M2: Биспецифическое антитело получали согласно примеру 2, исходя из MAb AICD2.M2 и MAb 425. Выход биспецифического антитела был приблизительно 30%. Пример 5: Синтез биспецифической (scFv)2 молекулы MAb 425 и MAb AICD2.M1: Два одноцепочечных белка, состоящих из VL и VH доменов AICD2.M1 и MAb 425, получали молекулярной инженерией (Winter et al. 1991, Nature 349, 293-299). Экспрессирующие плазмиды были получены из pHEN1 (Hoogenboom et al. Nucleic Acid Res. 19, 4133-4137), которая содержит структурные гены для VL и VH доменов, происходящие либо из мышиной гибридомы против EGF-R (MAb 425), либо из мышиной гибридомы против CD2 (AICD2.M1). Лидерную последовательность реlВ применяли для медиирования периплазматической секреции в E.coli. scFV очищали при помощи аффинной хроматографии и применяли для конструирования биспецифического scFv. Химическое перекрестное сшивание EGF-R и CD2cпeцифичecкиx scFv проводили при помощи реагента 2-Иминотиолана и гетеробифункционального кросс-линкера SPDP. Исходя из 10 мг scFv молекулы MAb 425 мы достигли статистического включения одной молекулы 2-пиридилдисульфида на молекулу scFv через SPDP. Очистку этого производного проводили при помощи гель-фильтрационной хроматографии. Реактивную -SH- группу вводили в scFv молекулу MAb AICD2.M1 при помощи дериватизации 10 мг scFv 2-Иминотиоланом. Очистку этого производного проводили при помощи гель-фильтрационной хроматографии. Эквимолярные количества активированной 2-пиридилсульфидом scFv молекулы MAb 425 и модифицированной 2-Иминотиоланом scFv молекулы MAb AICD2.M1 связывали вместе при нейтральном рН. Реакция связывания сопровождалась выделением пиридин-2-тиона. Конечный биспецифический продукт извлекали гель-фильтрационной хроматографией с выходом приблизительно 5%. Пример 6: Характеристика биспецифических антител: Отдельные стадии синтеза биспецифических антител прослеживались при помощи ПААГДС-Na согласно обычным известным способам. Полупродукты химического синтеза и конечные биспецифические продукты представлены на фиг. 2. Кроме анализа в ПААГ-ДС-Na, чистота и гомогенность биспецифического антитела оценивались при помощи хроматографии на колонке гидроксиапатита. Элюцию биспецифического антитела проводили градиентом фосфатного буфера (рН = 7.0, 0 - 0,3 ммоль/л). Фиг. 3 показывает хроматографический профиль биспецифической F(ab')2 молекулы MAb 425 и MAb AICD2.M1. Биспецифическое антитело представлено основным пиком II, меньшие пики I и III являются минорными примесями. Пример 7: Связывающие свойства биспецифической F(ab')2 молекулы MAb 425 и MAb AICD2.M1 в отношении EGF-R: 1992, Current Topics in Microbiol. Immunol. 158, 131 и цитированные ссылки). Клетки селезенки иммунизированных мышей выделяли и сливали с линией клеток миеломы (Ag8.653, ATCC CRL 1580). Гибридомы подвергали скринингу на образование специфических моноклональных антител путем испытания супернатантов, растущих гибридом на человеческих Т-лимфоцитах (CD2 положительных) при помощи клеточного сортера с активацией флуоресценции (FACS). Положительные гибридомы извлекали клонированием способом серийных разведении. Супернатанты отобранных гибридом исследовали при помощи иммунопреципитации и Вестерн-блот анализа. Выделение отобранных моноклональных антител было достигнуто очисткой культур супернатантов по Еу et al. 1978, Immunochemistry 15,249. Функциональный анализ антигена, направленного к антителам, проводили при помощи теста пролиферации (включения 3Н-тимидина). Два антитела, отобранные из ряда моноклональных антител, реагирующих с CD2 антигеном, сильно индуцировали пролиферацию Т-клеток. Эти моноклональные антитела были обозначены как AICD2.M1 и AICD2.M2 и депонированы в Deutsche Sammlung für Microorganismen. Были использованы стандартные способы. Многие из них описаны, например, в "Antibodies, a Laboratory Manual", Harlow and Lane, 1988, Cold Spring Harbor и цитированных здесь ссылках. Пример 2: Синтез биспецифической F(ab')2 молекулы MAb 425 и MAb AICD2.M1: Синтез начинали с 10 мг антитела AICD2.M1 и 10 мг антитела MAb 425. Антитела обрабатывали для предактивации папаином (10 мг/мл) в цитратнoм буфере, 3 мМ ЭДТА, рН 5,5. После протеолиза F(ab')2 извлекали из элюата колонки Protein-A-SepharoseÒ. Выход F(ab')2 был, как правило, близок к 100%. Оба фрагмента F(ab')2 отдельно превращали в Fab' фрагмент обработкой 0,5 мМ ДТТ в течение 40 мин при 30°С. После восстановительной стадии избыток ДТТ удаляли и Fab' извлекали при помощи гель-фильтрации (SuperdexÒ 200). В данном способе производное F/ab'TNB получали обработкой MAb 425 фрагмента 0,5 мМ реагента Эллмана (5,5'-дитио-бис-(2-нитробензойная кислота) (DTNB)) при 4°С в течение 60 мин. Избыток DTNB удаляли гель-фильтрацией. 6 мг каждого из партнеров конъюгации (Fab' AICD2.M1 и Fab'-TNB MAb 425) применяли для конечной стадии конъюгации, проводимой при перемешивании смеси при 4°С в течение 18 ч. Биспецифические антитела извлекали из реакционной смеси гель-фильтрацией (SuperdexÒ 200). Выход синтетического препарата F(ab')2 был в диапазоне 3-4мг (»30%). Последовательности операций синтеза биспецифического антитела суммированы в Фиг. 1. Пример 3: Синтез биспецифической F(ab')2 молекулы MAb 361 и MAb AICD2.M1: Биспецифическое антитело получали соответственно примеру 2, исходя из MAb AICD2.M1 и MAb 361. Выход биспецифического антитела был приблизительно 34%. 7 40577 Связывающие свойства этого биспецифического антитела сравнивали при помощи конкурентного твердофазного иммуноферментного анализа (ELISA). Вкратце: Меченые биотином MAb 425 применяли для конкуренции с немеченым антителом или биспецифическими антителами за связывание с EGF-R. EGF-R выделяли из А 431 клеток (АТСС CRL 1555) известными способами (например, Harlow, Lane: "Antibodies, A Laboratory Manual", Cold Spring Harbor, 1988). A 431 клетки СD2-отрицательны. Детектирование проводили после инкубирования с POD-конъюгированным стептавидином и субстратом. На основании этих данных строили кривые ингибирования (Фиг.4). Кривые ингибирования для обоих биспецифических антител были сдвинуты вправо, что свидетельствует о потере аффинности, вызываемой изменением двухвалентного связывания на моновалентное. Пример 8: Связывающие свойства биспецифической F(ab')2 молекулы MAb 425 и MAb AICD2.M2 в отношении EGF-R: Связывающие свойства этого биспецифического антитела исследовали согласно примеру 8 (Фиг.4). Оба биспецифических антитела имели сравнимую авидность в отношении их антигенамишени. Пример 9: Связывающие свойства биспецифических и моноспецифических фрагментов антител в отношении CD2 антигена: Jurkat клетки (острый Т-клеточный лейкоз человека, CD2-, CD3-положительные, EGF-R-отрицательные; АТСС TIB 152) инкубировали (1 x х 106 клеток на пробу) с логарифмическими разведениями биспецифического/ моноспецифического фрагмента антител в течение 15 мин при 4°С. Затем клетки промывали и инкубировали с козьими анти-мышиными-каппа-FITC в качестве антисыворотки второй стадии. Клетки снова промывали и анализировали иммунофлуоресценцию при помощи клеточного сортера с возбуждением флуоресценции FACStar plusÒ. FACStar plusÒ с одиночным лазерным возбуждением и реестровым способом сбора информации был применен для анализа окрашивания антител живых клеток. Были определены удельные интенсивности флуоресценции всей клеточной популяции и процент реагирующих с антителами клеток. Распределение флуоресценции клеток, окрашенных антисывороткой второй стадии, служили в качестве отрицательных контролей. В следующей таблице указаны полунасыщающие концентрации (конц.1/2нас.) как мера связывающей силы различных биспецифических/ моноспецифических фрагментов антител на клетках Jurkat. Величины для конц.1/2 нас. были взяты с кривых титрования (интенсивность флуоресценции/ линейное воспроизведение) по отношению к концентрации антител), и следовательно, представляют собой лишь грубые оценки. Фрагмент антитела Конц. 1/2 нас. F(ab')2 MAb AICD2.M биспецифическая F(ab')2 молекула MAb 425 и MAb AICD2.M1 биспецифическая F(ab')2 молекула MAb 361 и MAb AICD2.M1 F(ab')2 MAb AICD2.M2 биспецифическая F(ab')2 молекула MAb 425 и MAb AICD2.M2 F(ab')2 MAb 425 1 3 х 108 > 1х10 (насыщения нет) 1 х 107 (насыщения нет) 2 х 108 7 >1 х 10 (насыщения нет) отриц. 7 введение фрагментов антител вызывает значительную индукцию пролиферации в каждом из этих случаев. Пример 11: Индуцированный биспецифическим антителом лизис опухолей Клеточная линия С8161, высокоинвазивная и спонтанно метастатическая, EGF-R-положительная линия меланомных клеток человека (Welch et al. 1991, Int. J. Cancer 47, 227 и цитированные ссылки) была применена в качестве мишени для EGF-R-зависимой доставки к ней аллогенных и аутогенных инфильтрующих опухоль Т-лимфоцитов (TIL). Можно применять также и другие EGF-R-положительные линии меланомных клеток человека. Исходная культура TIL была исходно получена из образца меланомы. Условия культивирования опухолевых клеток и TIL были описаны ранее (например, Shimizu et al. 1991, Cancer Res. 51,6153). Пример 10: Пролиферация лейкоцитов Мононуклеарные лейкоциты периферической крови культивировали вместе с освещенной (30Gy) аутогенной опухолевой клеткой в среде (RPMI 1640) с добавлением I1-2 (интерлейкина-2) (20 Е/мл) и I1-4 (1000 Е/мл). Клетки-респондеры слабо рестимулировались аутогенными опухолевыми клетками. Свежеприготовленные лейкоциты периферической крови человека (huPBL) из здоровых доноров крови или больных с меланомой культивировали на микротитровальных планшетах с плоским дном и с 96 ячейками в конечном объеме 200 мкл при плотности 1 х 105 клеток на ячейку. Клетки инкубировали с моноспецифическими или моноспецифическими + биспецифическими фрагментами антител в указанных концентрациях. Через 72 часа клеткам давали 0,5 мкКи 3H-тимидина, инкубировали в течение ночи и собирали. Включение 3Н-тимидина измеряли путем сцинтиляционного b-plate счета, и результаты выражали в виде средних величин имп/мин. Результаты для фрагментов антител, полученных из МАb 425, можно видеть в деталях на Фиг. 5. Подобные результаты были получены с использованием фрагментов антител, полученных из МАb 361. Комбинированное Получение стабильных CTL клонов проводили с применением MLTC клеток-респондеров при условиях способа серийных разведений. MTLC Тклетки-респондеры высевались (одна клетка на ячейку) на планшеты с 96 ячейками в среду с добавлением I1-2 и I1-4 вместе с аутогенными стимуляторными клетками и аутогенными В-клетка 8 40577 ми, трансформированными EBV, в качестве питающих клеток. Т-лимфоциты из свежих опухолевых биопсий активировали иммобилизованными антителами против CD3 и увеличивали в объеме в RPMI с добавлением 11-2 и I1-4. вали вместе с моноспецифическим или биспецифическим антителом или их сочетанием вместе с эффекторными TIL при отношении эффектор/мишень 7/1. CTL были серийно разведены в трех повторностях в 100мл среды на микротитровальных планшетах с 96 ячейками. После добавления меченых клеток-мишеней планшеты инкубировали 4 ч при 37°С в 10% СO2. Тесты останавливали центрифугированием. Супернатанты собирали и радиоактивность измеряли в g-счетчике. Процент удельного высвобождения 51Сr рассчитывали по формуле: Тесты на цитотоксичность in vitro проводили с применением 51Сr-меченых опухолевых клеток. Клетки-мишени метили 51Cr(100 мКи/107 клеток) в течение 1 ч и промывали 3 раза. Константное число меченых клеток (2 х 103 на ячейку) инкубиро % удельного 51Cr- высвобождения =100 (экспериментальное высвобождение -спонтанное высвобождение)/ / (максимальное высвобождение -спонтанное высвобождение). Результаты для фрагментов антител, полученных из МАb 425, можно видеть в деталях на Фиг. 6а, 6b и Фиг. 7. Подобные результаты были получены с применением фрагментов ан тител, полученных из МАb 361. Комбинированное введение фрагментов антител вызывало значительную индукцию лизиса опухоли в каждом из этих случаев. Фиг. 1 9 40577 Фиг. 2 Фиг. 3 10 40577 Фиг. 4 Фиг. 5 11 40577 Фиг. 6a Фиг. 6b 12 40577 Фиг. 7а Фиг. 7b Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 13 40577 14
ДивитисяДодаткова інформація
Назва патенту англійськоюBispecific antigen molecule for lysis of tumor cells, method for preparing of bispecific antigen molecule, monoclonal antibody (variants), pharmaceutical preparation, pharmaceutical kit for lysis of tumor cells (variants), method of lysis of tumor cells
Автори англійськоюSchtrittmatter Wolfgang, Yahl Karlota-Silviia, Meiier Stefan, Burkkhard Shraven, Vild Martin
Назва патенту російськоюБиспецифическая молекула, которая используется для лизиса опухолевых клеток, способ ее получения, моноклональное антитело (варианты), фармацевтический препарат, фармацевтический набор (варианты), способ удаления опухолевых клеток
Автори російськоюШтриттматтер Вольфганг, Яггл Карлота-Сильвия, Мейер Стефан, Буркхардт Шравен, Вилд Мартин
МПК / Мітки
МПК: A61K 38/00, C07K 14/485, C12R 1/91, C07K 14/705, C12P 21/08, C12N 15/02, C07K 16/00, C07K 19/00, C07K 1/113, C07K 16/46, C07K 16/30, G01N 33/53, G01N 33/531, A61K 39/395, C07K 16/28, C07K 16/18, G01N 33/574, C07K 14/52, C12N 15/09, A61P 35/00
Мітки: біспецифічна, пухлинн, препарат, одержання, варіанти, спосіб, антитіло, клітин, набір, використовується, лізису, моноклональне, фармацевтичний, пухлинних, молекула, видалення
Код посилання
<a href="https://ua.patents.su/14-40577-bispecifichna-molekula-shho-vikoristovuehtsya-dlya-lizisu-pukhlinnikh-klitin-sposib-oderzhannya-monoklonalne-antitilo-varianti-farmacevtichnijj-preparat-farmacevtichnijj-nabir-vari.html" target="_blank" rel="follow" title="База патентів України">Біспецифічна молекула, що використовується для лізису пухлинних клітин, спосіб її одержання, моноклональне антитіло (варіанти), фармацевтичний препарат, фармацевтичний набір (варіанти), спосіб видалення пухлинн</a>
Попередній патент: Гербіцидна композиція та спосіб обробки для захисту культур від бур’янів та/або для покращення врожайності
Наступний патент: Сульфоніламінопіримідини і фармацевтичний препарат на їх основі
Випадковий патент: Коронуючий елемент