Спосіб одержання е-ізомерів похідних акрілової кислоти
Номер патенту: 6304
Опубліковано: 29.12.1994
Автори: Майкл Гордон Хічінгс, Патрік Джелф Кроулі, Вів'єнн Маргарет Ентоні, Пол Дефрейн, Крістофер Річард Ейлз Годфрі, Ян Фергусон, Джон Мартін Клаф
Формула / Реферат
Способ получения Е-изомеров производных акриловой кислоты общей формулы
где W - пиридинил- или пиримидинилгруп-па, замещенная галогеном, С1-С4-алкилом, который, в свою очередь, может быть замещен галогеном, фенилом. С1-С4-алкоксилом, феноксигруппой, которая может быть замещена 1-метоксикарбонил-2-метоксиэтиленом, галогеном, циано- или нитрогруппой; амино-, формамидо-, нитро-, циано-или N-оксидной группой, или W-хинолинил-или хиназолинилгруппа, возможно замещенная галогеном и связанная с А одним из атомов углерода кольца; А - кислород или группа S(O)n, где n=0, или 1, или 2 при условии, что когда W-5-трифторметилпи-ридинил-2-, то А не является кислородом, отличающийся тем, что в ацетале формулы II
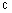
где W и А имеют указанные значения, элиминируют метанол в кислотных или щелочных условиях.
Приоритеты по признаку: 17.04.86 при W - все значения, А- кислород; 23.12.86 при А - другие значения.
Текст
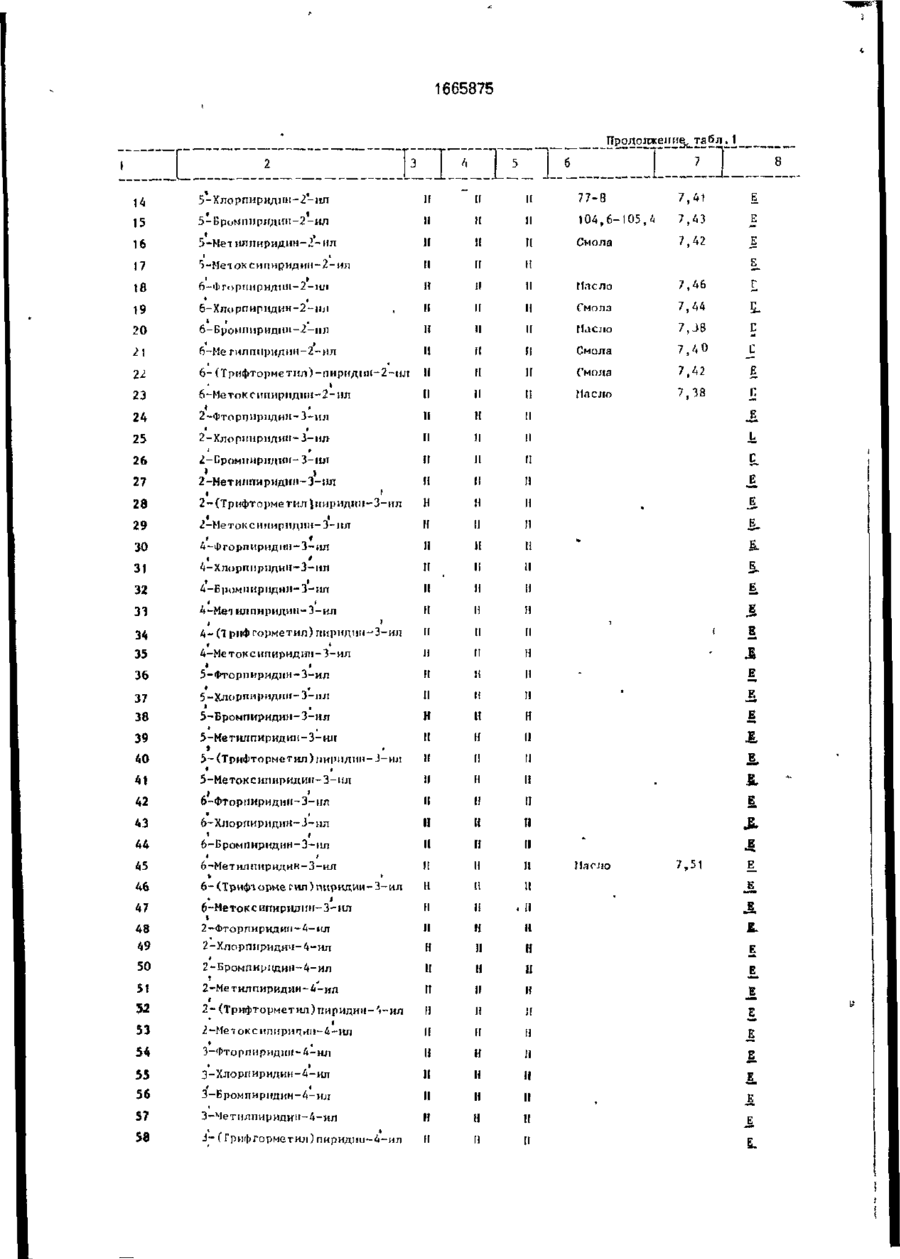
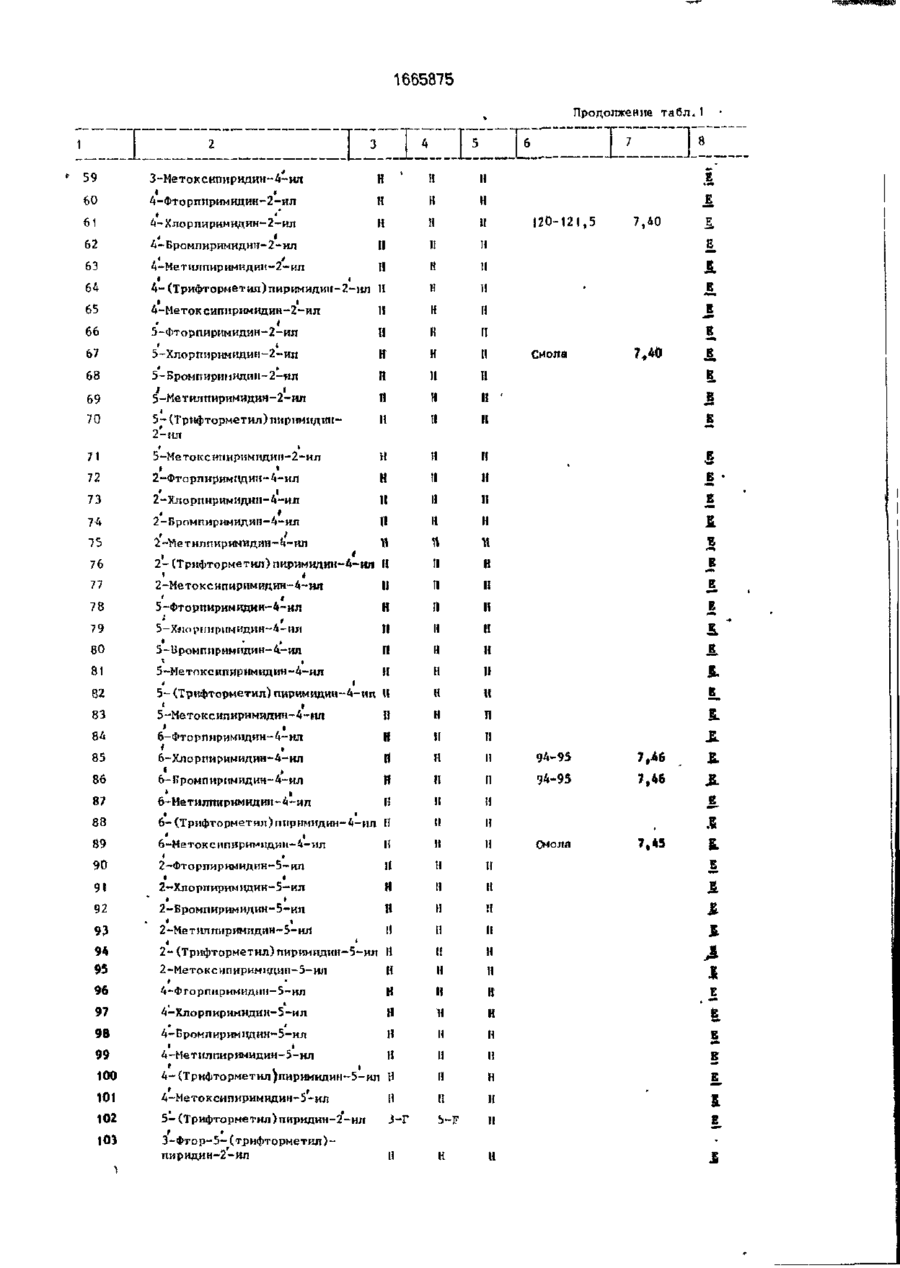
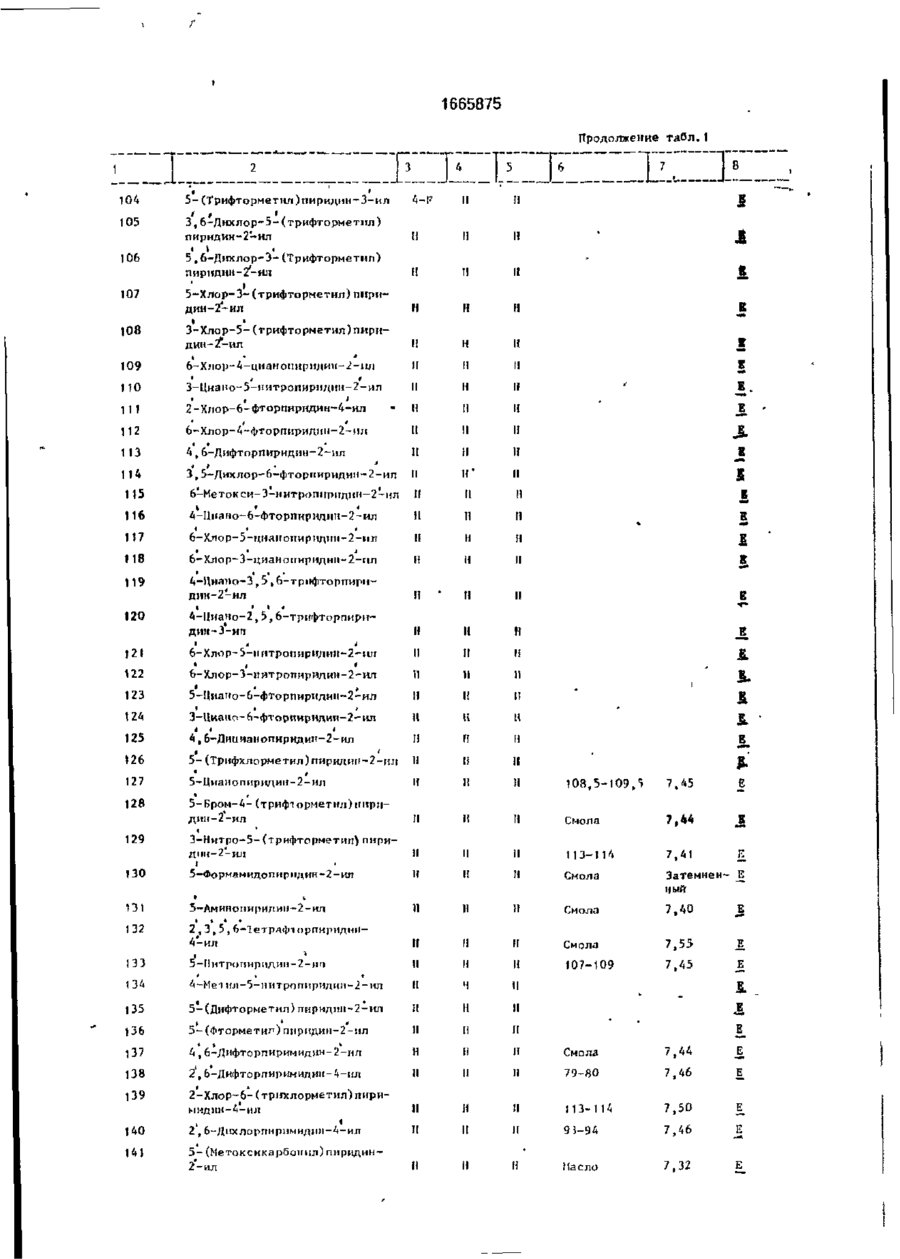
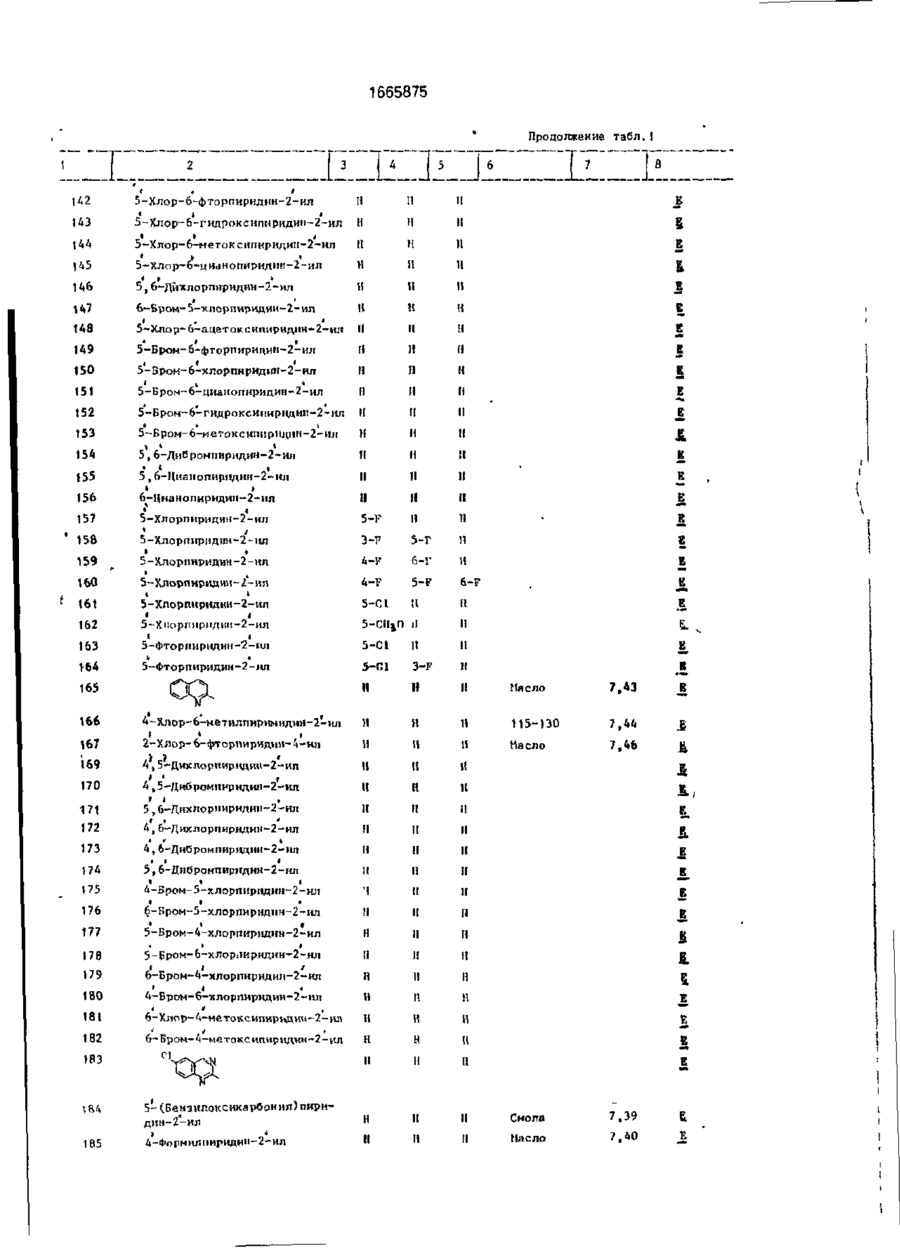
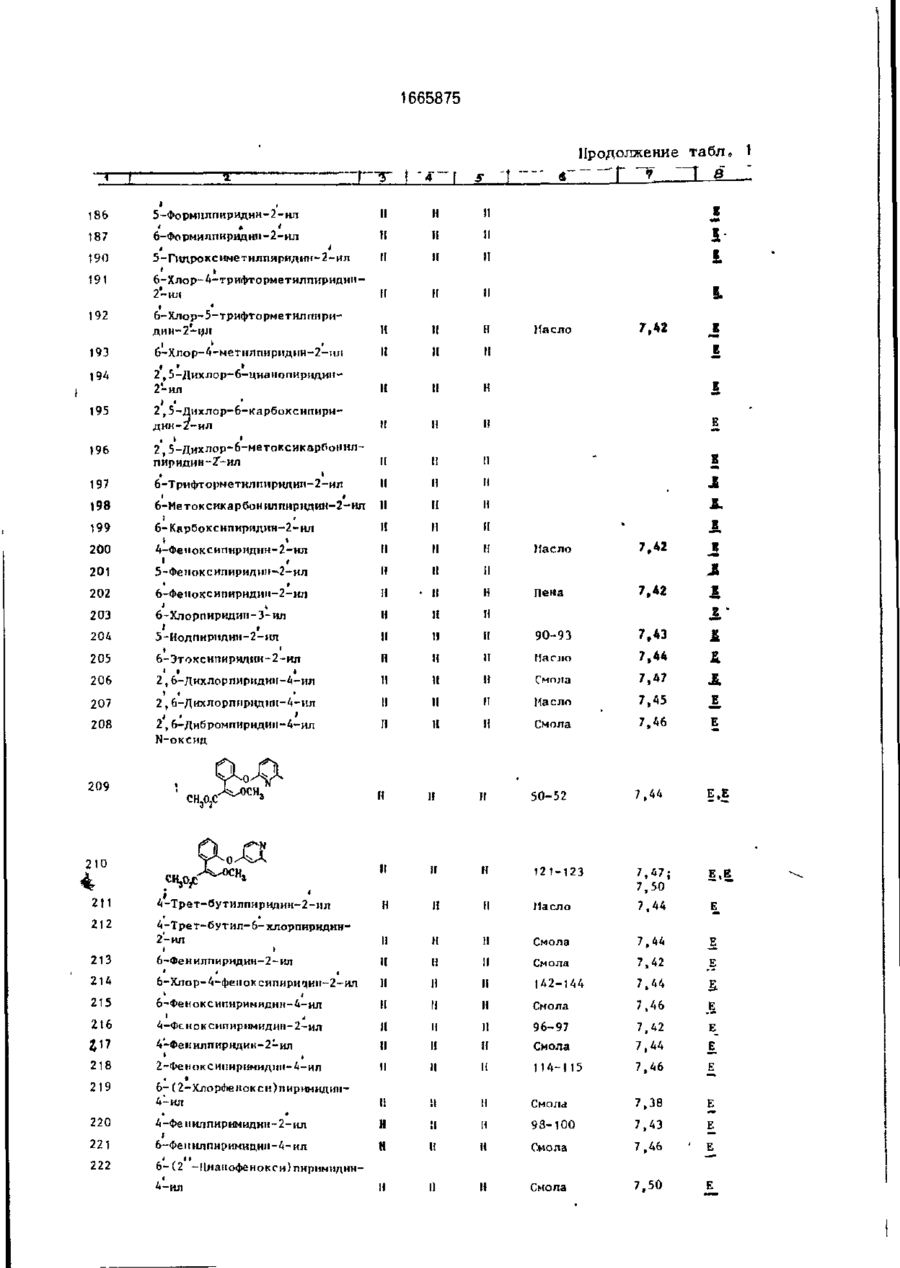
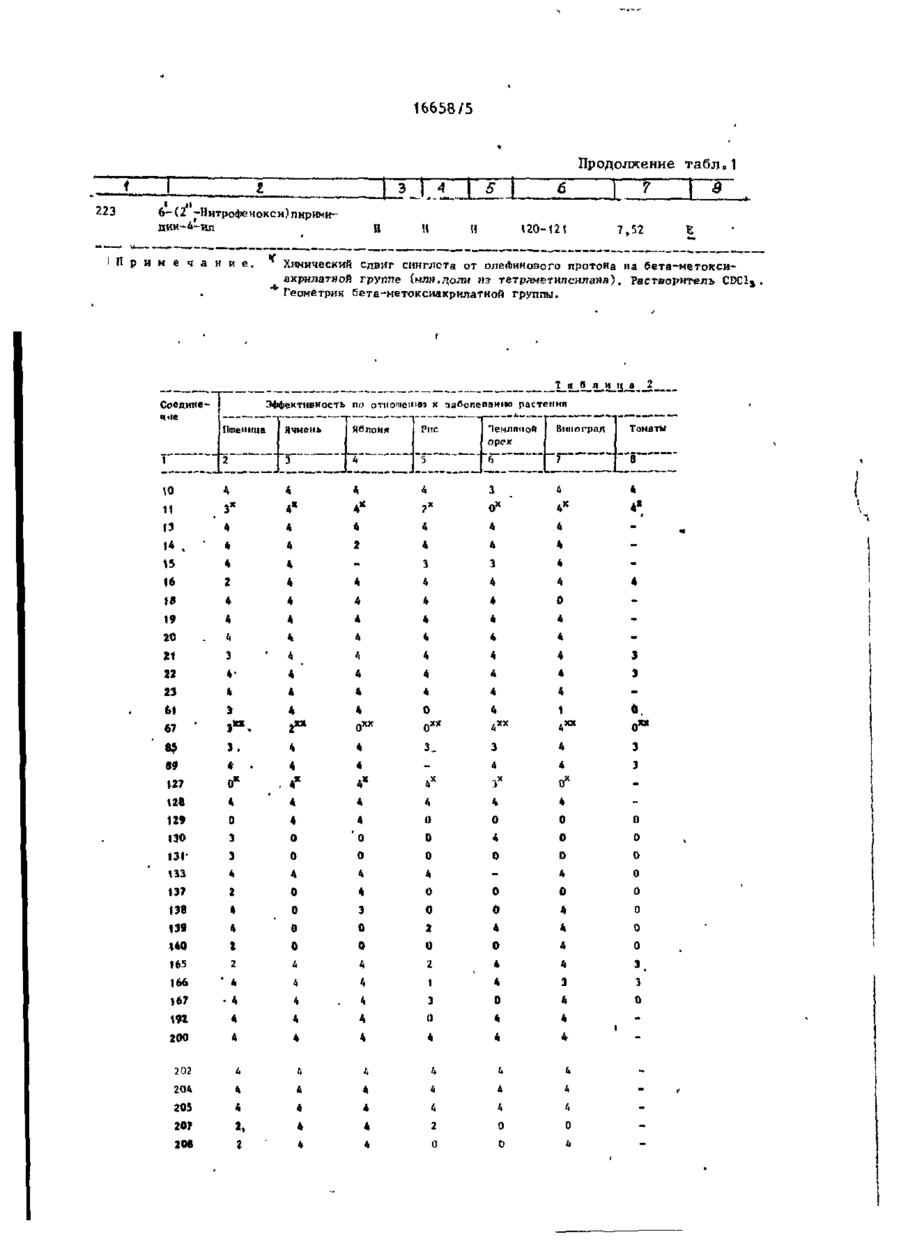
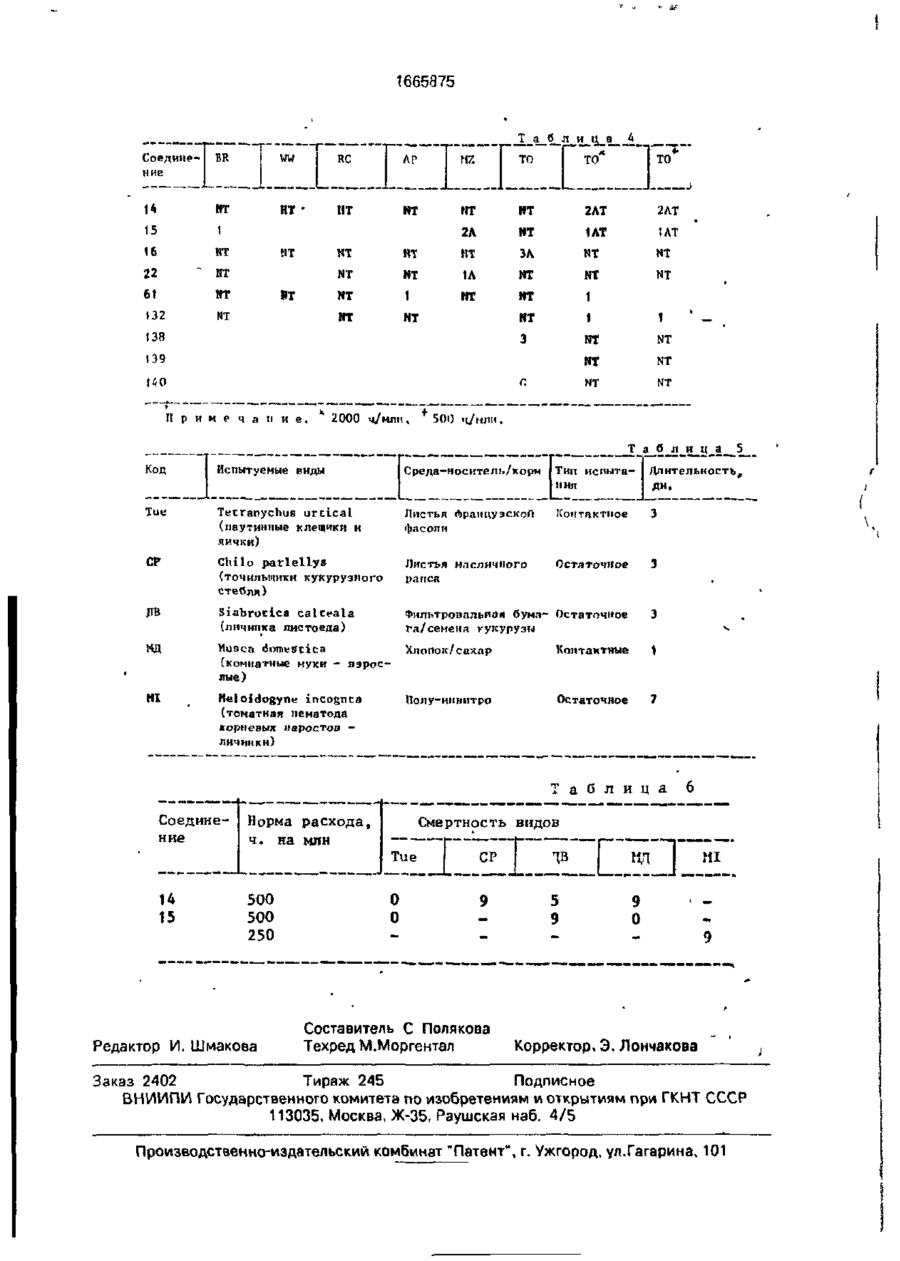
Изобретение относится к гетероциклическим соединениям и, в частности, к получению Е-изомеров производных акриловой кислоты формулы . соосн, -С. осн, где W - пиридинил- или пиримидинилгруппа, замещенная галогеном, Сі-Сгалкилом, который, & свою очередь, может быть замещен галогеном, фенилом, Сі~С4-алкоксилом, феноксигруппой, которая может быть замещена 1-метоксикарбонил-2-мегоксиэтенилом, галогеном, циано- или нитрогрулпой, аминоформэмидо-, нитро-, циано- или N-оксидной группой; или W-хинолинил- или хиназо/іинилгруппа, возможно замещенная галогеном и связанная с А одним из атомов углерода кольца; А - О или группа $(О)п, где п » 0 или 1, или 2. при условии, что когда W 5-трифторметилпиридинил-2-, то А не является кислородом. Цель изобретения - получение соединений, обладающих более высокой гербицидной активностью Получение ведут путем элиминирования в соответствующем ацетале метанола в кислотных или щелочных условиях. 6 табл. ON СЛ Изобретение относится к способу получения новых производных акриловой кислоты, обладающих ценными гербицидными свойствами, которые могут найти применение в сельском хозяйстве. Цель изобретения - способ получения новых производных акриловой кислоты, обладающих более высокой гербицидной активностью. П р и м е р а (Е)-Метил-2-[2' -{5" -цианолат (соединение 127. табл. 1). Орто-гидро кс ифен ил уксусную кислоту (3,08 г, 0,02 моль) добавляют к перемешиваемому раствору гидроокиси калия (2,26 г, 0,04 моль) в метаноле (40 мл), Через 15 мин раствор упаривают досуха при пониженном давлении, твердый остаток суспендируют в диметилформзмиде (ДМФ)(50 мл). Добавляют 6-хлороникотинонитрил (3.08 г, 0,002 моль) и медную бронзу (0 1 г) и смесь перемешивают при 8О-9О°С 1 ч, затем охлаждают и выливают в воду (200 мл) Смесь фильтруют, фильтрат доводит до рН 2~3 добавлением 1665875 соляной кислоты. Смесь экстрагируют диэтиловым эфиром (х 3). Объединенные эфирные экстракты экстрагируют насыщенным раствором бикарбоната натрия. Водную фазу подкисляют соляной кислотой (рН 2-3). получают столообразное еещестао. Растирание с небольшим количеством метанола дает белое твердое вещество (1,27 г. выход 25%). Перекристаллизация в воде дает 2-[2' -(5" -цизнопиридпн-2" -илокси)фенил ]уксус~ ную кислоту в виде белого твердого вещества, т.пл, 120°С. И К: 1672 см" 1 . *Н ЯМР (d6DMCO, 60 МГц) (5, м.д.: 3.45 (2Н,с); 7,05-7,45 (5М,м); 8.25-3.35 (м,1Н); 8.6 (1Н,д);6.3(ширх..1Н), Эту кислоту (3,0 г. 0,0118 моль) перемешивают при кипячении с обратным холодильником в метаноле (50 мл), содержащем концентрированную серную кислоту (0,1 мл), в течение 3 ч. Смесь охлаждают, добавляют воду (200 мл) и экстрагируют диэтиловым эфиром (3 х 50 мл). Объединенные эфирные экстракты промывают насыщенным раствором бикарбоната натрия (30 мл), водой (3 х 30 мл) м насыщенным солевым раствором (1 х 30 мл). После сушки и фильтрования эфирный раствор упаривают, получают метйл-2~[2' -(5" -цианопиридин-2" -шюкси)фенил]зцетэт в виде янтарного мае Добавляет насыщенный раствор карбоната натрия (50 мл) и смесь фильтруют. Фильтрат экстрагируют диэтиловым эфиром (3 х 20 мл). Объединенные органические экстракты промывают водой (3 х 15 мл), насыщенным солевым раствором (15 мл), после сушки и фильтрования эфирный раствор упаривают досуха при пониженном давлении. Хроматография остатка(гексан/простой эфир) 10 дает целевое соединение в виде стеклообразного продукта, которое после растирания с метанолом образует белые кристаллы (40 мш. выход 3%), т.пл. 108,5-109.5°С. 1 Н ЯМР д. м.д.: 3.58 (ЗН. с); 3,75 (ЗН. с); 15 6,9 (Ж. д); 7.1 ( Ш , д); 7.28-7.4 (2Н. м); 7,45 (1Н. с); 7.85 (1Н, кв); 8.45 (1Н, с). П р и м е р 2. (Е)-Метил-2-{2' -(5" -метокСикарбонилпиридин-2" -илокси)фенил]-3метоксиакрилэт (соединения 141. табл.1). 20 Метил-2-[2* -(5" -цианопиридин-2" илокси)фенил]ацетат (2.03 г; 0.008 моль), полученный по примеру 1, кипятят с обратным холодильником в растворе гидроокиси калий (1.0 г; 0,017 моль) в воде (30 мл) в 25 течение 16 ч. Раствор охлаждают до комнатной температуры, доводят рН до 2-2 добавлением соляной кислоты. Образующийся осадок отфильтровывают, промывают небольшим количеством охлажденной льдом 30 воды и сушат при 95°С (1,83 г). Перекристаллизация из водного метанола дает 2-[2' -(5" ла (2.77 г. выход 87,5%}' 1 -карбоксипиридин-2" -илокси)фенил]уксусИК:2200, 1700 см" . 1 ную кислоту (1,83 г) в виде белых кристалН ЯМР (СОСІз) д% м.д.: 3.5 (5Н, с); 6.8лов, т.пл. 187-188°С. 7,3 (5Н. м); 7,8(1Н. кв); 8,3 (1Н. д); п.д. Триметилсилилтрифторметилсульфон- 35 ИК: 3400, 2556, 1710. 1686 см" 1 . 1 ат(1,42 г, 0,0064 моль) добавляют по каплям Н ЯМР (deDACO) (5. м.д.: 3,42 (2Н, с); к раствору триэтиламина (0,65 г, 0,0064 6.32 (1Н. шир.с); 6,95-7,44 (5Н. м): 8.1 (1Н, моль) в диэтиловом эфире (10 мл) при комшир.с); 8,27 (1Н, кв); 6,62 (1Н. д). натной температуре. Смесь оставляют стоСмесь 2^2' -(5" -карбоксипиридин-2" ять в течение 20 мин, затем дсбавляют по 40 илокси)фенил]уксусной кислоты (1,46 г, каплям на протяжении 15 мин к перемеши0.0053 моль), метилиодида (1.52 г; 0.00107 ваемому раствору метил-2-[2* -(5" -цианопимоль), карбоната КЙЛИЯ (2,95 г, 0,021 моль) и ридилокси)фенил]ацетатэ (1.15 г; 0,0043 ДМФ перемешивают при комнатной темпемоль) в эфЕлре (10 ил) при 0-5°С. Смесь осратуре 3 ч. Смесь выливают в воду (100 мл) тавляютсогреваться до комнатной темпера- 45 и экстрагируют диэтиловым эфиром (2 х 40 мл). туры м перемешивают в течение 1 ч, давая Объединенные органические экстракты двухфазную смесь. Верхний слой (распромывают водой (3 х 20 мл) и насыщенным твор А) оставляют. солевым раствором (20 мл). После сушки, фильтрования и упаривания эфирного расЧетыреххлористый титан (',22 г, 0,0064 моль") добавляют по каплям к перемешивав- 50 твора получают метил-2-{2' -(5" -метоксикарбонилпиіридин-2' -илокси)фенил] ацетат в мому раствору тримегилорт©формиата(0,71 г. виде масла (0,73 г). 0,0064 моль) в диклорметане (10 мл) при У 70°С. По- учающийся в результате желтый Н ЯМР д, м .д.: 3,45 (ЗН, с); 3.47 (2Н, с); ос? док перемегіивают в течение 15 мин и по 3,79 (ЗН, с); 6.73-7.3 (5Н, м); 8,2 (1Н, кв); 8.7 . каплям ка протяжении 20 мин добавляют 55 раствор А при -7(Г'С. Смесь перемешивают Триметилсилилтрифторметансульфон при -70 с С в течение 1 ч, ззтем ей дают ат(0.81 г; 0,0036 моль) добавляют по каплям возможность согреться до комнатной темк раствору триэтиламине! (0.37 г; 0.0036 моль) перемешивают еще в течение 1 ч. в диэтиловом эфире (10 мл) при комнатной 1665875 температуре. После отстаивания втечени20 мин образующийся раствор добавляют по каплям к раствору метил-2-[21 ~(5" -метокси' в диэтиловом эфире (10 мл) при 0-5°С на 5 протяжении 20 мин. Смесь перемешивают и подогревают до комнатной температуры на протяжении 3 ч. Верхний светлый слой от данной смеси оставляют (раствор А). В другой колбе раствор четыреххлори- 10 стого титана (0,69 г, 0,0036 моль) в дихлорметане (5 мл) добавляют к раствору триметипортоформиата(0,4 г, 0,0036 моль) в дихлормстзне (10 мл) при-70°С. Образующийся желтый осадок перемешивают 15 при -70°С в течение 15 мин. Раствор А добавляют к смеси по каплям на протяжении 10 мин при -70°С. Смесь перемешивают 1 ч, оставляют стоять в течение 16 ч. Добавляют насыщенный раствор карбоната натрия 20 (50 мл) и смесь фильтруют. Фильтрат экстрагируют диэтиловым эфиром (3 х 20 мл), объединенные органические экстракты промывают водой (3 х 15 мл) и насыщенным солевым раствором (15 мл). После сушки 25 фильтрования эфирный раствор упаривают, получают смолообразный остаток. Целевое " соединение получают в виде масла путем хроматографирования (с использованием гексанэ в качестве элюента) (20 мг). 30 1 Н ЯМР д , м.д.: 3,47 (ЗН, с); 3,62 (ЗН, с); 3,92 (ЗН, с); 6,75-7,3 (5Н, м); 7,32 (1Н, с); 8,15 (1Н.кв);8,72(1Н,д). П р и м е р З . (Е)-Метил-2-[2' -(5" -бензилоксикэрбонилпиридин-2" -илокси)фенил}- 35 3-метоксиакрилата (соединение 184). 2-[2' -(5" -Кэрбоксипиридин-21 -илокси)фенил]уксусную кислоту (1,5 г; 0,005 моль), полученную по примеру 1, кипятят в смеси метанола (50 мл) и серной кислоты 40 (0,1 мл) с обратным холодильником 8 ч. Смесь упаривают до половины объема, охлаждают, выливают в воду (100 мл), а затем экстрагируют диэтмловым эфиром (2 х 30 мл). Объединенные органические экстракты 45 экстрагируют насыщенным раствором бикарбоната натрия. Щелочной экстракт подкисляют соляной кислотой до рН 2-3, охлаждают в смеси льда и воды, и полученный белый осадок отфильтровывают, про- 50 мывают водой и сушат при 95°С, получают метил-2-{2' -(5" -карбоксипиридин-2" -илокси)фенил]ацетат (0,63 г), т.пл. 118°С. 1 Н ЯМР?, м.д : 3,52 {ЗН, с); 3,57 (2Н. с); 6,88-7,4 (5Н. м); 8,3 (1Н, кв): 8,88 (1Н, д). 55 Смесь метил-2-[2' -(5" -карбоксипиридин-2" -илокси)фенил]ацетата (0,63 г; 0,0022 моль), бензилбромида (0,37 г; 0,0021 моль), карбоната калия (0,6 г; 0,0043 моль) и ДМФ (30 мл) перемешивают при комнатной тем 6 пературе 1 ч. Смесь выливают в воду (100 мл) и экстрагируют диэтиловым эфиром (2 х 30 мл). Объединенный органический экстракт промывают водой (3 х 15 мл) и насыщенным солевым раствором (15 мл). После сушки и фильтрования эфирный раствор упаривают, получают метил 2-[2' -{$" -бензилоксикарбонилпиридин-2" -илокси)фенил]ацетат в виде бесцветной смолы, которую очищают с помощью хроматографии (элюент - гексан), целевое соединение - бесцветное твердое вещество (0,69 г), т.пл. 56°С. ИК: 1735, 1722 см" 1 , 'Н ЯМР д , м.д.: 3,44 (ЗН, с); 3,5 (2Н. с); 5,24 (2Н. с); 6,75-7,4 (5Н, м); 8,2 (1Н, кв); 8,76 Триметилсилилтрифторметилсульфонат (0,61 г; 0,0027 моль) добавляют по каплям при комнатной температуре к раствору тризтиламина (0,277 г; 0,0027 моль) в диэтиловом эфире (5 мл). Смесь отстаивают 20 мин, полученный раствор добавляют к перемешиваемой смеси метил-2-[2' -(5" -бензилоксикарбонилпиридин-2" -илокси)фенил]ацетата и диэтилового эфира (5 мл) при 0-5°С в течение 15 мин.Полученную смесь оставляют перемешиваться и согреваться до комнатной температуры на протяжении 3 ч, затем разбавляют дихлорметаном (5 мл) и оставляют (раствор А). Раствор четыреххлористого титана (0,52 г; 0,0027 моль) а дихлорметане (2 мл) добавляют по каплям к раствору триметилортоформиата (0,301 г; 0,0077 моль) при -70°С. Полученный желтый осадок перемешивают при -70°С 15 мин, по каплям на протяжении 30 мин добавляют раствор А при -70°С. Смесь перемешивают, оставляют подогреться до комнатной температуры на протяжении 1 ч, затем оставляют на 15 ч. Добавляют насыщенный раствор карбоната натрия (30 мл), смесь перемешивают, затем фильтруют. Фильтрат экстрагируют эфиром (3 х 15 мл). Объединенные эфирные экстракты промывают водой (3 х 10 мл) и насыщенным солевым раствором (10 мл). После сушки и фильтрования эфирный раствор упаривают, получают смолу. Целевое соединение выделяют с помощью хроматографии (элюент- гексан). 1 Н ЯМР д , м.д.: 3,55 (ЗН, с); 3,60 (ЗН, с); 5.35 (2Н, с); 6,82 (1Н, д); 7,18-7,48 (м, включая один протонный синглет при 7,39), 8,25 {1Н. кв), 8,25 (1Н,д). П р и м е р 4, Аналогично описанному в примере 1 получают следующие соединения: (Е)-метил-2-[2' -(5" -хлорпиридин-2" илокси)фенил]-3-метоксиакрилат (соедине 1665875 8 П р и м е р 8 . Дустовый порошок готовят ниь 14),т.пл. 77-78°С:ИК: 1700. 1725, 1260, 1 1200 см" . путем измельчения и смешения активного 3 *Н Я М Р д , м.д.: (CDCI ): 3,57 (ЗН, с); 3.74 ингредиента с тальком, %: (ЗН, с); 6,75 (1Н, д); 7.41 (1Н, с); 8,10 (1Н, Соединение 61 5 шир.с); 7,1-7,6 (м), 5 Тальк 95 (Е)-метил-2-[2' -(5" -нитропиридин-2" илокси}фенил]-3-метоксиакрилат (240 мг) в виде желтой смолы, которая кристаллизуется при стоянии, т.пл. 107-109°С; (Е)-метил-2-[2* -{4" -хлорпиридин-2" - 10 млокси)фенил]-2-метоксиакрилат (соединение 61. табл. 1),т.пл. 120-121, 5°С; 1Н ЯМР д, м.д.: 3,60 (36, с); 3,80 (ЗН,с); 6,60 (1Н, д. г = 4 Гц), 7,40 (1Н, с), 8,40 (1Н. д, г = 4 Гц); (Е)-метмл-2-{2' -{5" -хлорпиридин-2" -илок- 15 си)фенил}-3-метоксиакрилат (соединение 14'), в виде густой смолы, ИК: 1700, 1630 см" 1 , (Е)-метил-2-{2' -(5" -бромпиридин-2" илсульфинил)фенил]-3-метоксиакрилат в ви20 де смолы; (Е)-метил-2-[21 -{5" -бромпиридин-2" илсульфонил)фенил]-3-метоксиакрилат в виде аморфного твердого вещества; (Е)-метил-2-{2' -{6" -метилпиридин-3" илокси)феиил]-3-метоксиакрилат в виде 25 бледно-желтого масла (соединение 45, табл. 1), ИК 1705, 1642, 1488 см~\ 1 Н ЯМР 5-І!цтрипиріідин-2-ии 4-Меі нл-5-нитрппіфіЩ[ін-2-ііл 135 5-(Дифторметнл)пирндіш-2-ил 133 13 6 ]37 13 8 13 9 1 40 141 І * > 5-(Фторметн^)пиридин-2-нл U,6-Дифторпиримидин-2-ил 2,6-Дифторпиримидин-4-ил 2-Хлор-6-(трихлормєтил)пиримидин-4-нл 2 , 6-Дихлорггиримидци-А-ил 113-114 7,50 95-94 7,46 5-(Meтокснкарбонил)пиридин2-ил Масло 7,32 1665875 I Продолжение табл.1 7 і < • 142 ПІП І і і ' t t 5-Хлор-6-фторпиридин-2-нл І! 144 145 * 5-Хлор-6-метоксипиридин-2-іш < 5-Хлор-6-цианопиридин-2-ил і » ' 5,б-Днхлорпиридин-2-ил II II 1 1 1 1 1 1 II н и 11 Н II і 5-Хлор-6-гидроксипнридии-2~ил II II и її 11 148 5-5Слор-6-ацетоксиішриднн-2~ил И II н н 149 5-Бром-6-фторпиригіин-2-нл м м (1 150 5-Бром~6-хлорпириднн-2-ил II н и 1 1 154 155 156 157 ' 158 159 160 ' 161 * • t і б-Цианопиридип-2-ил • Ї * 4,5-Дкклорпирнди»-2-ї^ ' и П 4-Хл op-6-м є тиллприм идин-2-ил і II II 165 166 1 1 1 1 5-R1 • К 1 1 5-С1 5, б-Цианопиридин-2-ил [І 5-CHjO її , & II 5-ГЛ 5, б-Дибромішрндин-2-щі Ё І! 4-К і II II 1 1 t і II 3-F і II 4-F • п 5-F 5-Бром-6-метоксипиридн»-2-ил Е II 5-Бром-6-гидроксиг[ирндии-2-ип 153 II II 152 п II 151 II II II 1 1 II •І II II 174 5, б-Дихлорчирндиіі-2-ил > > ' 4,б~Дихлорпирнди»-2-ил 4,6-Дибромпириднн-2-чл 5, б-Днбромпиридші-2-щі 175 4-Бром-5-хлорпирндин-2-нл 176 ф-Бром-5-хлорпиридин-2-нл 1 1 II II 177 з 172 173 * • • і і і 5-Бром-4-хлорпирнднн-2-ил н II II 178 5 II II 1 1 179 6-Бром-4-хлорпиридип-2-ил U II H tBO 4-Бром-6-хлорпнридич-2-іш н 11 11 1 1 \\ 11 н н It II 1 II II Е Б р р р д 481 182 183 6-Бром— 4-метоксигшріідин-2-ил 01 5~(Бензилоксикарбонил)пирн~ дші-2-ил 185 і * 4-Форміш пиридин-2-ил Смола 7,39 Масло 7,40 Е 1665875 Продолжение табл. 1 rx " " ' ' Г ~т "~Т а І 186 5-Формилпиридин-2-ил 187 б-Формилпиридиіі-2-ил 190 5-Гнлроксиметилпиридіш-2-ил і I" І t 191 6-Хлор-4-трифторметилпиридии2-Ш1 192 6-Хлор-5-трнфторметнлпнридин-2-нл 193 Масло 7,42 J Е 6-Хлор-4-метилпиридин-2-ил і • * 194 2,5-Дихлор-6-цнанопиркдин2-ил Е 195 2,5-Дихлор-6-карбоксипирндни-2-ил I 196 2 5-Дихлор-6-метокснкарОоннлпирндин-2'-нл Б «А 197 6-Трнфторметилпиридин-2-ил X 198 6-Метоксикарбонилпнрндин-2-ил Е. 199 200 і J , і б-Карбоксипириднн-2-ил • і 7,42 4-Фепоксипнрндіш-2-ил • > 5-Феноксипнрилин-^2-ил Масло 201 202 6-Фепоксипириднн-2-ил Пена 7,42 203 6-Хлорпиридин-З-ил Ж & 204 5 - Иод n и pit л ии - 2 - ил 90-93 7,43 і Масло 7,44 Сміла 7,47 Масло 7,45 Смола 7,46 205 206 207 208 I Л I • ' б-Этоксипнридпн-2-ил ' і і 2, б-Дихлорпиридиіі-4-ил t t • 2, б-Дихлоршіридші-^-ил ' 4 ' 2, б-Дибромпиридиіі-4-itn N-оксид 209 7,44 Е.Е 7,47; 7,50 Е,Е Масло 7,44 Е _ 50-52 210 4 211 Б І 1 212 4-Трет-бутил-б-хлорпнрндин2- ил -Трет-бутилпиридин-2-ил Н Л II ІІ м 1 1 Смола 7,44 J 5 213 6-Фениллиридин-2-ил И И II Смола 7,42 Е II И II 142-144 7,44 £ ІІ И И Смола 7,46 . Е Е _ , Е • і 214 6-Х л о р - 4 - ф е н о к с и п и р и ч и н - 2 - и л 215 6-Фенокснпнримидии-4-нл і 216 4-Фсноксипирнмидин-2-ил II II II 96-97 417 4-Фенилпирндин-2-ил II I! И Смола 7,42 7,44 218 2-Феноксиііиримидин-4-ил II 1! 1 1 114-115 7,46 219 £ II !1 || Смола 7,38 220 6-(2-ХлорЛенокси)пиримиднн4-и л 4 98-100 7,43 Е Е 221 6 Смола 7,46 222 6-(2 -Цнанофеноксиїпирнмидин4 Смола 7,50 і Феі[илпнримиди»-2-ііп Феннлпирнмидин-4-ил Н If II Н I! И ' Е 16658/5 Продолжение табло 1 і J_?J..±J_£_1 223 дии-4-ип UO-121 и 7,52 л Примечание. Химический сдвиг сннглста от олеАинового протона на бета-метоксиакрипатной группе (млн.доли из тетраметилсилана). Растворитель CDClj * Геометрия бета-метоксиакрилатной группы. Т а б л и Ч а 2 Эффективность ПО ОТПОЛЮ! It» К заболевание растения Соединечиє Пшеница Ячмень Яблоня Рис 'ІЄМЛПІЮЙ Виноград Томаты орех И г 1 э 4 в 5 3 4 10 11 0х 4* 4 4 4 2 4 4 3 4 * 4 4 4 3 13 1* , • я 15 4 16 2 4 4 4 1в 4 4 4 О 19 4 4 4 20 4 ь 4 4 4 21 3 4 4 4 22 4 4 4 4 23 * 4 4 4 61 г 4 4 67 ' е I хх 1 4« 2к и 0х* 4 3 4 в ? і. 4 4 89 4 4 4 4 4 127 0K 4* 4х 4Л 3Х 0Х Ї2в 4 4 4 4 4 4 129 0 4 4 II О О 130 3 0 "о О 4 О О О О 131* 3 О О из 4 4 4 4 137 2 О 4 О О О 138 4 О 3 О О 4 139 4 О 2 4 к **о 1 о о О U О 4 165 2 4 4 1 4 4 166 ' 4 4 4 1 4 3 167 • 4 4 4 3 О 4 о 4 4 4 4 4 \п 4 4 4 200 4 4 4 4 2 02 4 4 4 4 4 204 4 4 4 4 4 205 4 4 6 4 4 207 2V 4 2 О О 206 г 4 О О k хж 16658/5 ~F 1 > 1 1 4 Продолжение тавл.2 I s I 3 0 4 0 0 4 4 4 4 4 4 4 4 4 * 4 4 2 TO 4 4 211 k 3 212 4 213 209 I' 1' 4 4 4 видов Tue 0 СР 9 0 Составитель С Полякова Техред М.Моргентал Г В 5 9 — Г мд 9 0 6 т Ml 9 Корректор, Э. Лончакова Заказ 2402 Тираж 245 Подписное ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР 113035, Москва, Ж-35, Раушская наб. 4/5 Производственно-издательский комбинат "Патент", г. Ужгород, ул.Гагарина, 101
ДивитисяДодаткова інформація
МПК / Мітки
Мітки: похідних, кислоти, одержання, е-ізомерів, акрилової, спосіб
Код посилання
<a href="https://ua.patents.su/14-6304-sposib-oderzhannya-e-izomeriv-pokhidnikh-akrilovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання е-ізомерів похідних акрілової кислоти</a>
Попередній патент: Спосіб одержання 2-(2-імідазолін-2-іл)пірідінів або хінолінів
Наступний патент: Фільтр
Випадковий патент: Спосіб готування шихти оксидного матеріалу, що містить телур