Нуклеотидна послідовність, здатна інгібувати активність il-6, її використання для терапії, плазмідний вектор та фармацевтична композиція (варіанти), що містять цю нуклеотидну послідовність
Формула / Реферат
1. Нуклеотидна послідовність, здатна інгібувати активність IL-6, що містить:
і) восьмиразовий повтор нуклеотидної послідовності, яка являє собою послідовність елемента реакції гострої фази (APRE-елемент) загальної формули ZXMYKGKAA, де
Ζ - Τ або G, або може бути відсутнім;
Χ - Τ або може бути відсутнім;
Μ - С або Α;
Υ - С або Т; і
К - Т або G,
у сполученні з
іі) принаймні однією нуклеотидною послідовністю, що становить сайт зв'язування фактора транскрипції, відмінний від APRE-елемента, причому вказаний сайт знаходиться у промоторній області.
2. Нуклеотидна послідовність за п.1, де (і) є нуклеотидною послідовністю ТТCTGGGAA.
3. Нуклеотидна послідовність за будь-яким з попередніх пунктів, де (іі) вибирають з групи, що складається з блоку ТАТА і сайтів зв’язування для таких факторів транскрипції: АР-1, АР-2, HNF-1, SP-1, NF-kB, Oct-1, E-2 i SRF.
4. Нуклеотидна послідовність за будь-яким з попередніх пунктів, де послідовність (і) містить, принаймні, два різних АPRE-елемента.
5. Нуклеотидна послідовність за будь-яким з попередніх пунктів, де послідовність (іі) містить, принаймні, дві різні олігонуклеотидні послідовності, що становлять сайт зв’язування фактора транскрипції.
6. Нуклеотидна послідовність за п. 5, де послідовність (іі) є раннім промотором SV40.
7. Нуклеотидна послідовність за п. 1, що має вигляд SEQ ID NO:1.
8. Нуклеотидна послідовність за будь-яким з пп. 1-7 для інгібування дії IL-6 при терапії.
9. Плазмідний вектор для трансфекції у клітини ссавців, що містить нуклеотидну послідовність за п.1, що функціонально зв’язана з регуляторними ділянками.
10. Фармацевтична композиція для інгібування дії IL-6, що містить ефективну кількість нуклеотидної послідовності за будь-яким з пп. 1-7 разом з одним або декількома фармацевтично прийнятними носіями та/або наповнювачами.
11. Фармацевтична композиція для інгібування дії IL-6, що містить ефективну кількість плазмідного вектора за п. 9 разом з одним або декількома фармацевтично прийнятними носіями та/або наповнювачами.
Текст
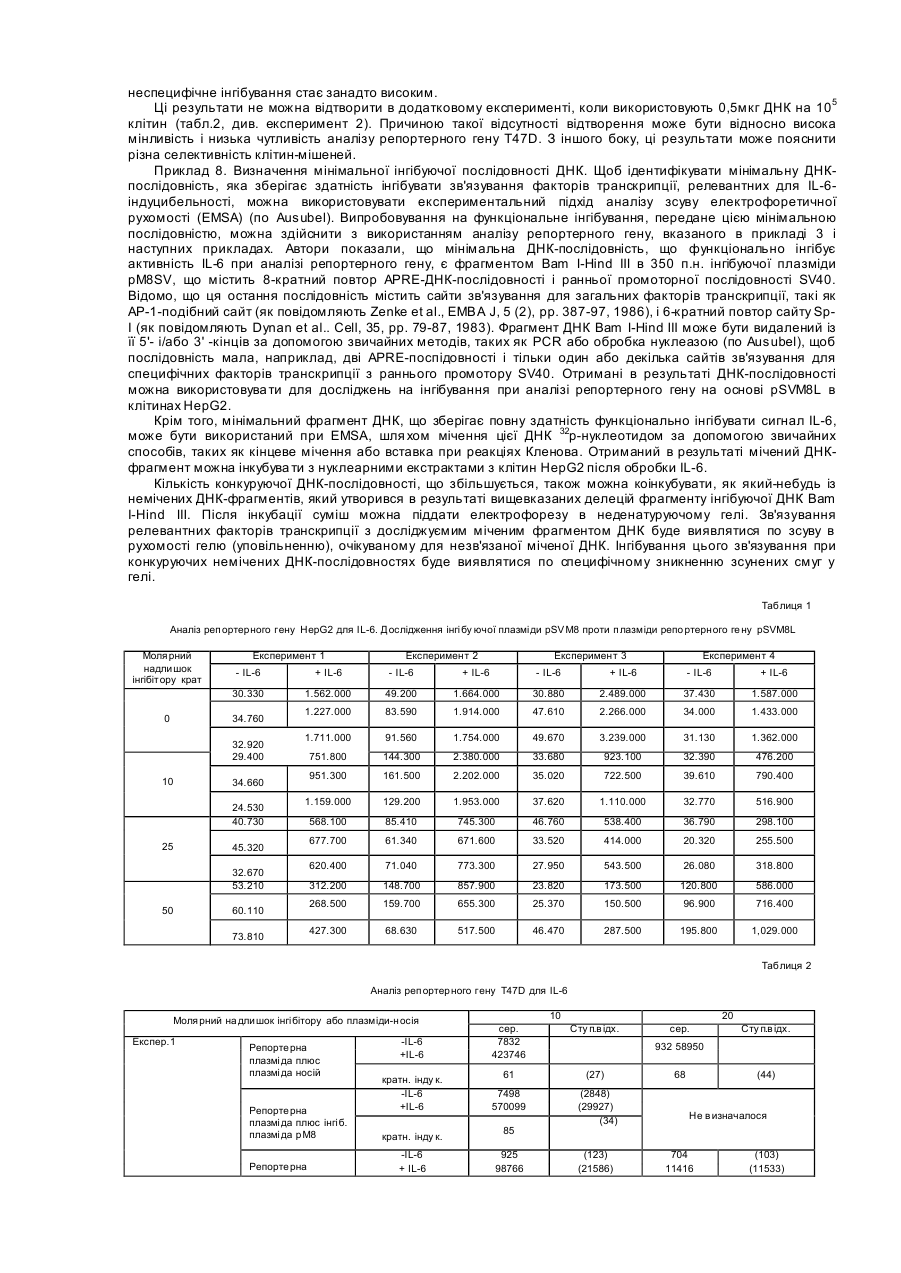
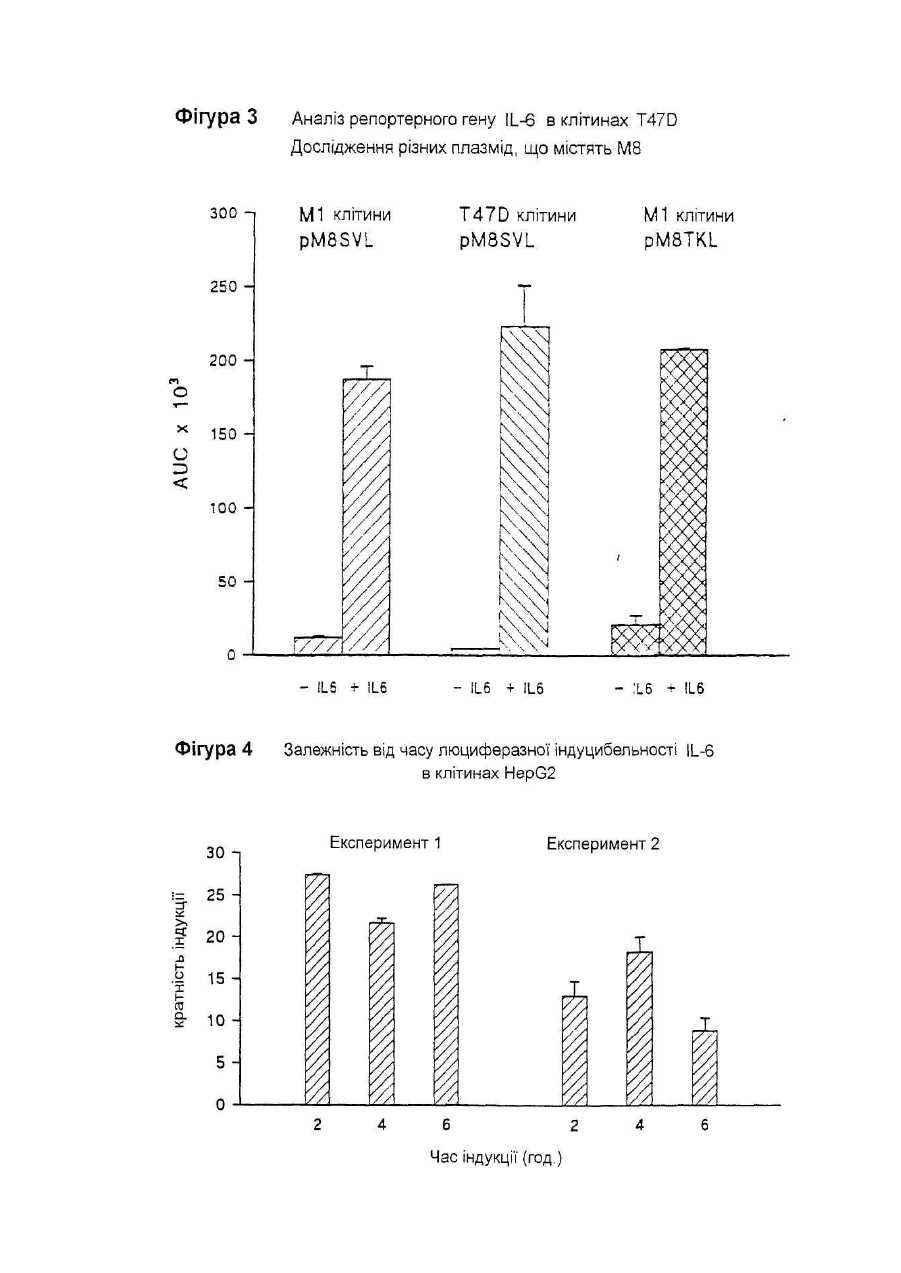
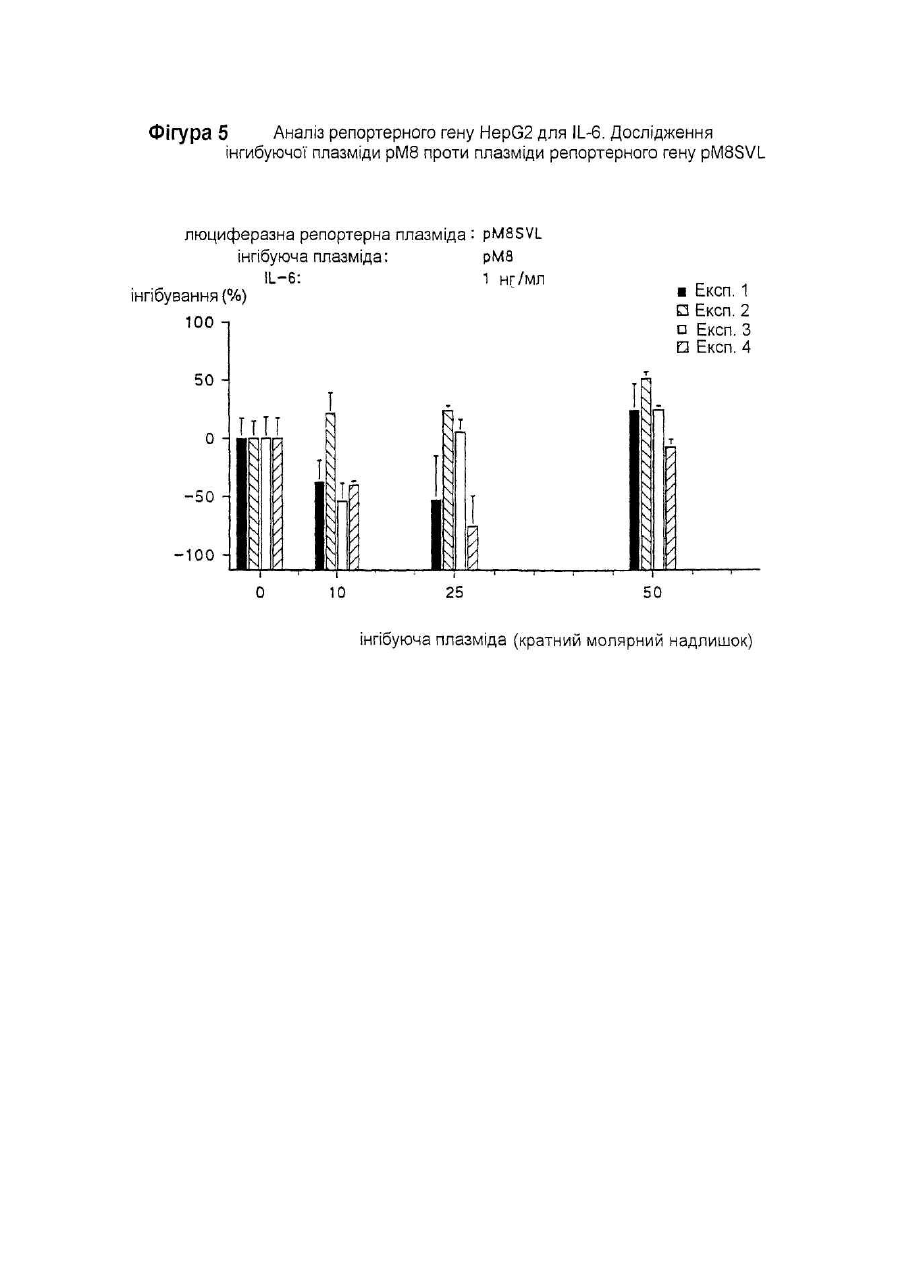
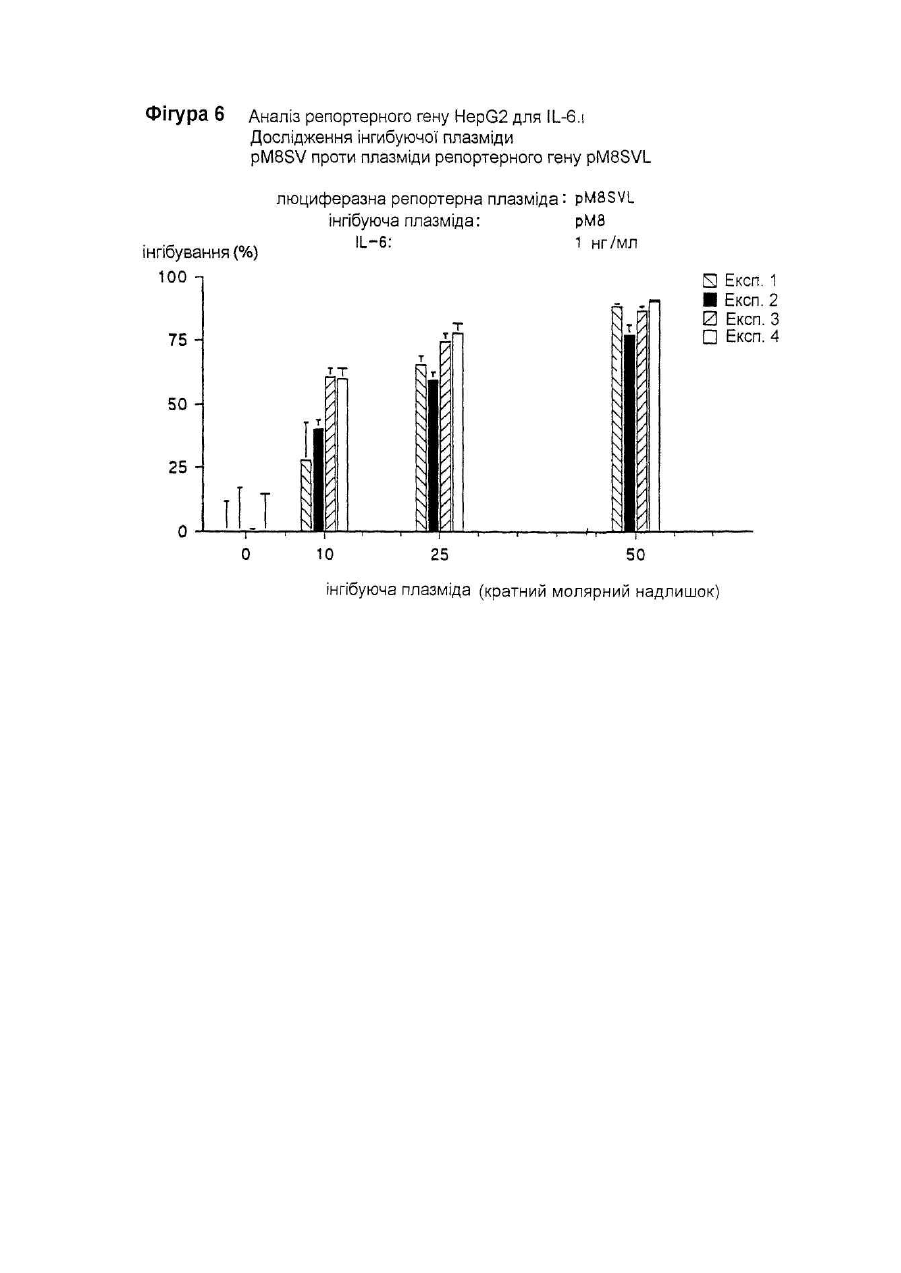
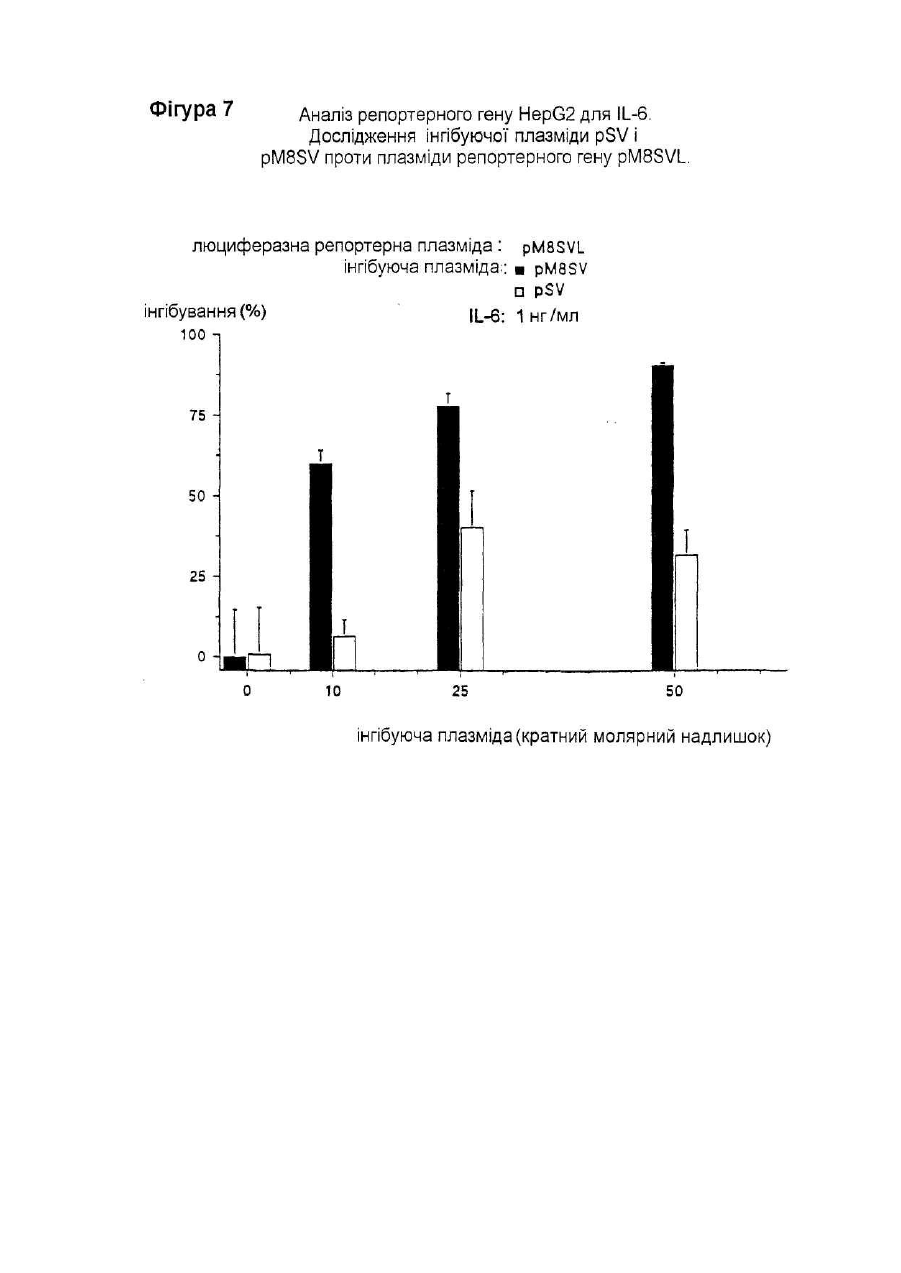
Даний винахід відноситься до нуклеотидної послідовності, яка здатна інгібувати активність ІL-6, її застосуванню в терапії, а також до фармацевтичних композицій, які її містять. IL-6 є білком, що належать до групи цитокінів, які призначені виконувати основну роль в імунній реакції організму і стимуляції гематопоезу. Дійсно, виявлено багато біологічних функцій IL-6 у гематологічній і лімфатичній системах, у печінці та інших мішених органах і тканинах. Деякі з цих функцій є сприятливими, у той час як інші відносять до патологічних станів. До числа останніх відносять, як виявлено, те, що IL-6 є фактором росту для клітин множинної мієломи; показано, що антитіла проти ІL-6 тимчасово блокують проліферацію мієломних клітин у пацієнта з лейкемією (див., наприклад, Klein et al.. Blood, 78, (5), pp. 1198-1204, 1991, і Lu et al., 5ur. J. Immunol., 22, pp. 2819-24, 1992). Знайдено взаємозв'язок оцінених рівнів IL-6 з аутоімунними і запальними захворюваннями, такими як ревматоїдний артрит, гломерулонефрит, псоріаз і хвороба Кастлемена (див., наприклад, Graeve et al., Clin. Investig., 71, pp. 664-71, 1993). Також показано, що IL-6 відіграє значну роль в остеопорозі і гіперкальціємії (див., наприклад, Роlі et al., Embo J., 13, (5), pp. 1189-96, і Yoneda et al.. Cancer Res., 53, pp. 737-40, Feb. 1993). Тому розробка інгібіторів активності IL-6 була предметом активних досліджень. Для цих цілей були обрані різноманітні підходи, в тому числі, застосування антитіл проти IL-6 gp130 або gp80 (як повідомляють Klein et al., див. ви ще); застосування розчинного gp130; або застосування мутеінів для IL-6, або рецептору IL-6. Так як такі підходи можуть асоціюватися зі специфічними небажаними ефектами при клінічному застосуванні (як повідомляють Lu et al., див. ви ще), може бути корисним висунення інших стратегій інгібування активності IL-6. Тому Заявник здійснив дослідження при іншому підході до інгібування активності IL-6, як-то, шляхом блокування внутрішньоклітинних білків, що опосередкують сигнал IL-6. Трансдукція сигналу IL-6 у відповідаючих клітинах старанно досліджена. Fowlkes et al. (PNAS USA, 81, pp. 2313-6, 1984) першими припустили, що існують відповідаючі елементи ДНК, специфічні для IL-6, що фланкують фібріногенні гени пацюка. Пізніше Kunz et al. (Nuc Ac Res., 17, (3), 1121-37, 1989) показали відповідаючий елемент із коровою послідовністю, яка ідентична послідовності генів фібриногену пацюка (CTGGGA), що відповідає на IL-6 у гені пацюкового-2-макроглобуліну. Відповідаючі елементи ДНК із послідовностями, спорідненими вищезгаданим послідовностям, також визначені в генах, що кодують людський С-реактивний білок (CRP) (див. Toniatti et al., Mol. Biol. Med., 7, pp. 199-212, 1990), людський гаптоглобін (див. Oliviero et al., Embo J. 6, (7), pp. 1905-12, 1987), і в інших генах, що кодують додаткові білки гострої фази, індуковані IL-6 (див. Heinrich et al., Biochem. J., 265, pp. 621-36, 1990), що призводить до визначенню корової консенсусної послідовності CTGGGAW або CTGGRAA, де W представляє А або Т, і R представляє А або G. Hocke et al. (Mol. Cell. Biol., 12, (5), pp. 2282-94, 1992) показали, що багато які споріднені корові послідовності, подібні коровій послідовності, що згадана вище, можуть бути присутніми в регуляторних областях генів дикого типу, що відповідають IL-6, і що ця множинність веде до ампліфікації відповіді, що аналізується функціонально за допомогою аналізу репортерного гену. Wenenka et al. (Mol. Cell. Biol., 13, (1), pp. 276-88, 1993) нещодавно запропонували розширену версію корової консенсусної послідовності як елементу реакції гострої фази (APRE), активного в клітинах гепатоми, яку можна уявити формулою KTMYKGKAA, де М представляє С або А, К представляє Т або G, Y представляє С або Т. Показано (Yuan et al., Mol. Cell. Biol., 14, (3), pp. 1657-68, 1994), що такі APRE-подібні послідовності зв'язують білковий фактор транскрипції з молекулярною масою порядку 90 кД, названий APRE, що нещодавно клонований (див. Akira et al.. Cell, 77, pp. 63-71, 1994). На практиці, зв'язування активованого APRF з APREпослідовностями призводило б до активації IL-6-індуцибельних генів (що мають такі APRE-послідовності) у відповідаючих на IL-6 клітинах. Внаслідок цього, APRE-елемент можна використовувати в якості енхансера гена-мішені у відповідаючих на IL-6 клітинах у такий спосіб: у відповідаючих на IL-6 клітинах обробка IL-6 індукує синтез APRF-білків, що зв'язуються з APRE-елементом, і таке зв'язування активує експресію гену-мішені. Serlupi Crescenzi et al. (повідомлення на 12-ій Європейській конференції по імунології, Барселона, 14-17 червня 1994) показали, що 8-кратний повтор ДНК-послідовності APRE (М8) відповідає за 50-100-кратну індукцію за допомогою IL-6 репортерного гену в клітинах гепатоми людини HepG2. У випадку таких окремих транскрипційних факторів дійсно виявлені двуланцюгові олігонуклеотиди. Основним предметом даного винаходу є н уклеотидна послідовність, здатна інгібувати активність IL-6, що включає: 1) принаймні одну нуклеотидну послідовність, що є APRE-елементом загальної формули ZXMYKGKAA, де Z представляє Т або G, або може також бути відсутнім, X представляє Т або також може бути відсутнім, М представляє С або А, Y С або Т, і К представляє Т або G, в поєднанні з II) принаймні однією нуклеотидною послідовністю, що складає сайт зв'язування транскрипційного фактору інший, ніж APRE-елемент, такий, як сайти, що присутні у промоторних областях. Прикладами нуклеотидних послідовностей останнього типу є блок ТАТА і сайти зв'язування факторів транскрипції, таких як АР-1 (див. Riabowol et al., PNAS USA, 89, pp. 157-61, 1992), AP-2, HNF-I (див. Clusel et al Nuc. Ac. Res., 21 (15), pp. 3405-11), SP-I (див. Wu et al.. Gene, 89, pp. 203-9, 1990), NF-kB (див. Bielinska et al.. Science, 250, pp. 997-1000, 1990), Oct-I, E-2 і факторів транскрипції SRF. У кращому варіанті здійснення даного винаходу як APRE-елемент (1), так і/або нуклеотидна послідовність (II) приведеної вище загальної формули повторюються принаймні 2 рази, краще - від 3 до 10 разів, ще краще 8 разів. У іншому кращому варіанті здійснення цього винаходу елемент (1) містить принаймні два різних APRE елементи, і/або нуклеотидна послідовність (II) містить принаймні дві різні олігонуклеотидні послідовності, що складають сайт зв'язування фактору транскрипції інший, ніж APRE-елемент. Нуклеотидна послідовність (II) є, переважно, раннім промотором SV40. APRE-елемент (1) містить, наприклад, нуклеотидну послідовність TTCTGGGAA. На фіг. 2 подана нуклеотидна послідовність, яка входить в об'єм винаходу, відповідно до кращих варіантів його здійснення. Така послідовність також позначається як послід. № 1, і становить предмет даного винаходу. Іншим предметом даного винаходу є плазмідний вектор, що містить нуклеотидну послідовність даного винаходу. Додатковим аспектом даного винаходу є застосування нуклеотидної послідовності даного винаходу в якості терапевтичного засобу для інгібування дії IL-6 в умовах, коли IL-6 відіграє патологічну роль. Даний винахід також відноситься до фармацевтичних композицій, що містять нуклеотидну послідовність або плазмідний вектор згідно з даним винаходом. Такі композиції можуть бути складені для перорального, ректального, внутрішньовенного або місцевого застосування. Суміші даного винаходу можуть включати використання будь-якого поєднання переносу вірусоопосередкованого гену, ліпосомні композиції, опосередкованої рецептором доставки ДНК і/або гантельних стр уктур активної н уклеотидної інгібуючої послідовності згідно з даним винаходом. Інгібуючу дію нуклеотидної послідовності даного винаходу визначають за допомогою аналізу репортерного гену. Аналіз репортерного гену даного винаходу заснований на здатності APRE-елементу функціонувати в якості енхансера будь-якого гену у відповідаючих на IL-6 клітинах (як повідомлялося вище). У цьому випадку APRE-елемент використовують як енхансер репортерного гену-мішені (яким є, наприклад, ген люциферази) у відповідаючих на IL-6 клітинах (якими є, наприклад, гепатоцити, такі як HepG2). Потім клітини обробляють IL-6: якщо достатня кількість продукованих APRF-білків захоплюється надлишком нуклеотидної послідовності даного винаходу, ген-мішень не буде активуватися. Відповідно до цього аналізу, будують інгибуючі плазміди, що містять нуклеотидну послідовність даного винаходу. Приклад такої плазміди подається на фіг. 1 разом із стратегією її побудови. Також мається на увазі, що ця й інші плазміди, що містять нуклеотидну послідовність даного винаходу, становлять інший варіант здійснення даного винаходу . Надалі даний винахід буде описуватися за допомогою прикладів, які не варто розглядати як такі, що обмежують даний винахід у будь-якій мірі. В прикладах будуть подаватися посилання на креслення, описані тут далі. Фіг. 1. Побудова плазміди pM8SV. PM8SVL переварюють з Sal 1 Hind III, і липкі кінці трансформують у тупі кінці за допомогою реакції Кленова. Фрагмент ДНК, що утворюється в результаті, в 3,2 т.п.н, очищають за допомогою електрофорезу в агарозному гелі, і потім його аутолігують. Потім генерують плазміду pM8SV, що містить послідовність М8 (170 п.н.) і послідовність від раннього промотору вірусу SV40 (190 п.н.), але таку, що не має гену люциферази. Фіг. 2. Послідовність фрагменту BamH I-Hind III інгібуючої ДНК плазміди pM8SV. Неперервна лінія над верхньою частиною приведеної нуклеотидної послідовності представляє послідовність М8. Чітка неперервна лінія над нижньою частиною нуклеотидної послідовності представляє промоторну послідовність SV40. Також вказані сайти рестрикції BamH 1 і Hind III. Фіг. 3. Аналіз репортерного гену в клітинах T47D і М1.Дослідження різних плазмід, що містять М8. Приведені величини світлового випромінювання є середніми значеннями дворазового визначення чос (cps) за період 30 секунд (AUC = площа під кривою, ППК) з трансфектованих клітин. Кожний прямокутник є середнє трьох трансфекцій ± ст. відх. Фіг. 4. Залежність від часу люциферазної індуцибільності трансфектованих клітин Hep G2 після обробки IL-6. Плазміду pM8SVL використовують у якості позитивної плазміди репортерного гену. Кожний прямокутник є середнє з двох трансфекцій ± ст.відх.. На кресленні показані результати двох експериментів. Фіг. 5. Аналіз репортерного гену HepG2 для ІL-6. Дослідження рМ8 як інгібуючої плазміди проти pM8SVL як плазміди репортерного гену. Кожний прямокутник є середнє з трьох трансфекцій ± ст.відх.. На кресленні показані результати чотирьох експериментів. Фіг. 6. Аналіз репортерного гену HepG2 для IL-6. Дослідження pN8SV як інгібуючої плазміди проти pN8SVL як плазміди репортерного гену. Кожний прямокутник є середнє з трьох трансфекцій ± ст.відх.. Результати подаються у вигляді % інгібування по відношенню до клітин HepG2, трансфектованим плазмідою-носієм рС без інгібуючої плазміди. Фіг. 7. Аналіз репортерного гену HepG2 для IL-6. Дослідження pSV і pM8SV як інгібуючих плазмід проти pN8SVL як плазміди репортерного гену. Кожний прямокутник є середнє з трьох трансфекцій ± ст.відх.. Результати подаються у вигляді % інгібування по відношенню до клітин HepG2, трансфектованим плазмідоюносієм рС без інгібуючої плазміди. Фіг. 8. Дослідження інгібування активності IL-6 інгібуючими плазмідами рМ8 і pM8SV при аналізі репортерного гену HepG2 на основі люциферазного гену під контролем індуцибельних регуляторних послідовностей IL-6 із промотора гену людського гемоглобіну. Кожний прямокутник є середнє з трьох трансфекцій ± ст.відх.. Результати подаються у вигляді % інгібування по відношенню до клітин HepG2, трансфектованим плазмідою-носієм рС без інгібуючої плазміди. Трансфекцію здійснюють 0,1мкг репортерної плазмідної ДНК і вказаним молярним надлишком інгібуючої плазміди. Загальну кількість трансфектованої ДНК підтримують постійною за допомогою плазміди-носія. Трансфектовані клітини обробляють протягом 18 годин 1нг/мл IL-6. Приклад 1. Побудова плазмід. Плазміду репортерного гену люциферази, що відповідає на IL-6 конструюють, одержуючи, спочатку, шля хом хімічного синтезу двухланцюговий олігонуклеотид з 38 п.н. з невирізаним сайтом BamH І на його 5' тупому кінці, і формуючи виступ нижнього ланцюжка з 4 нуклеотидів, сумісних із сайтами Bg1 II і BamH І на 3' -кінці. Цей синтетичний олігонуклеотид називають М2, і він містить дві ідентичні APRE-послідовності з промоторної області гену пацюкового a2-макроглобуліну. Послідовність олігонуклеотиду (верхній ланцюжок, 5'-3') має вигляд GGATCCTTCTGGGAATTCTGATCC-TTCTGGGAATTCTG (послід. № 2). Цей олігонуклеотид клонують в сайта х Sma І - Bgl II плазміди pGL2-pv (від Promega Corporation), де експресія люциферазного репортерного гену провадиться раннім промотором вірусу SV40, формуючи, таким чином, після аутолігування, плазміду pM2SVL. Синтетичний олігонуклеотид також лігують, через його 5' тупий кінець, з сайтом Sma І тієї ж плазміди pGL2-pv, і лінійний продукт лігування, що утворюється в результаті, потім розрізають Hind III. Отриманий в результаті лінійний вектор використовують у якості реціпієнта для клонування слідуючих фрагментів ДНК: 1) фрагменту ВаmН І -Hind III із 238 п.н. з плазміди pM2SVL, з утворенням, таким чином, після аутолігування, плазміди pM4SLV; 2) фрагменту BamH I-Hind III з 280 п.н із pM4SLV, з утворенням, таким чином, після аутолігування, плазміди pM6SLV; і 3) фрагменту BamH I-Hind III з 322 п.н. із pM6SLV, з утворенням, таким чином, після аутолігування, плазміди pM8SLV. Плазміду pM8L конструюють шляхом перетравлення pM8SLV з Sfan 1 і шляхом конвертування липких кінців у тупі кінці за допомогою реакції вставки з ферментом Кленова. Після перетравлення BamH І отриманий в результаті фрагмент ДНК М8 в 163 п.н. лігують з синтетичним адаптером BamH I-Kpnl з 16 п.н. і клонують у фрагменті ДНК в 5,6 т. п.н., що утворюється при перетравленні Sma І + Крn І вектору pGL2-b (від Promega Corporation). Плазміда pGL-2b ідентична вищезгаданій плазміді pGL2-pv, за винятком відсутності промоторної послідовності SV40 в pDL2-b. Адаптер з 16 п.н. містить сайт множинного клонування, і його одержують шляхом хімічного синтезу з наступною послідовністю: верхній ланцюжок: 5'CGCGGCCGCCTCGAGG3' (послід. № 3); нижній ланцюжок: 5'GATCCCTCGAGGCGGCCGCGGTAC3' (послід. №4). Плазміда, що утворюється з вищевказаної конструкції, являє собою pM8L, і вона має послідовність ДНК М8 без промотору, яка вставлена в сайт множинного клонування, в зворотному напрямку люциферазного гену. Плазміду люциферазного репортерного гену pM8TKL одержують шля хом розрізування плазміди pGEMTK-CAT (описаної в Cohen et al., ЕМВО J, 7(5), рр 1411-9, 1988) Хbа І і Bgl II. Одержаний в результаті фрагмент в 181 п.н., що містить ТК-промоторну послідовність гену тимідинкінази вірусу HSV, лігують з фрагментом Nhe I-Bgl II з 5,8 т.п.н. вектору p M8L між послідовностями М8 і ДНК люциферази. Плазміду люциферазного репортерного гену pHPSVL конструюють спочатку шля хом PCR-ампліфікації 841 п.н. з промоторної області гену гаптоглобіну з людської геномної ДНК. Кінець 3' ампліфікованого PCR фрагменту відповідає позиції 36 від початку транскрипції гену людського гаптоглобіну (як повідомляється в Maeda et al., J. Biol. Chem., 260(ІІ), pp. 6698-709, 1985). Цей PCR-продукт одержують із верхньою і нижньою приманками, що містять, відповідно, сайти рестрикції Мlu І і Bgl II. ДНК-приманки, синтезовані для геномної ампліфікації промоторної області гаптоглобіну, мають слідуючу послідовність: верхня приманка: 5'CTACGCGTGC AGTATTGACCCTTCCTCCT3' (послід. № 5 ); нижня приманка: 5'CGCAGATCTAGCTCACTTCTCCCCCTTC3' (послід. № 6). Отриманий у такий спосіб PCR-фрагмент вставляють в сайти Мlu І і Вg1 II вказаної вище плазміди люциферазного репортерного гену pGL2-pv, в зворотному напрямку раннього промотору SV40. Утворена в результаті плазміда являє собою pHPSVL. Щоб сконструювати інгібуючу плазміду рМ8, ви щевказану плазміду рМ8L перетравлюють з Sal І і Вg1 II, і отримані в такий спосіб липкі кінці виправляють у тупі кінці за допомогою реакції Кленова. Отриманий в результаті фрагмент в 3,1 т.п.н., що не має послідовності гену люциферази, очищають за допомогою електрофорезу в агарозному гелі, потім його аутолігують, і генерують інгібуючу плазміду рМ8. Інгібуючу плазміду pM8SV одержують так, як показано на фіг. 1. Перетравлюють pM8SVL з Sal І і Hind III, і липкі кінці трансформують у тупі кінці за допомогою реакції Кленова. Отриманий в результаті фрагмент ДНК в 3,2 т.п.н, очи щають за допомогою електрофорезу в агарозному гелі, потім його аутолігують. Генерують, таким чином, плазміду pM8SV, що містить послідовність М8 (170 п.н.) і послідовність із раннього промотору вірусу SV40 (190 п.н.), але таку, що не має люциферазного гену. Інгібуючу плазміду pSV конструюють за допомогою вирізання фрагменту Sal I-Hind III, що містить люциферазний ген, із вказаної вище плазміди pGL2-pv. Отриманий в результаті фрагмент в 3,1 т.п.н. піддають реакції вставки з ферментом Кленова, очищають за допомогою електрофорезу в агарозному гелі, і потім його аутолігують, одержуючи, таким чином, плазміду pSV, що містить промотор SV40, але не має люциферазного гену. Плазміду-носій рС одержують шляхом розрізування вказаної вище плазміди pGL2-b ферментами рестрикції Sal І і Hind III. Отриманий в результаті фрагмент в 2,9 т.п.н. піддають реакції вставки з ферментом Кленова, очищають за допомогою електрофорезу в агарозному гелі, і потім його аутолігують, одержуючи, таким чином, плазміду рС. Всі описані вище плазмідні конструкції використовують для трансформації штаму Е. Coli XLI-Blue звичайними способами (Ausubel R. et al.. Current Protocols in Molecular Biology. Greene Publishing Associates and Wiley Interscience, New York). Плазмідну ДНК екстрагують із трансформованих клонів за допомогою мініпрепаративного методу лужного лізісу (по Ausubel, цит. ви ще). Плазмідну ДНК перевіряють за допомогою рестрикційного аналізу і електрофорезу в агарозному гелі. Відбирають клони з передбаченою картиною. Щоб одержати очищені плазмідні препарати для застосування при трансфекції клітин ссавців, одержують 300мл культур відібраних трансформантів Е. Coli XLI-Blue. Потім плазміди очищують за допомогою іонообмінних мініколонок 500 з наконечником QIAGEN відповідно до інструкцій виробника. Приклад 2. Клітинні лінії і умови культивування Клітини гепатоми людини HepG2 (АТСС) культивують в мінімальному підтримуючому середовищі (MEM) із додаванням 10% FCS, 5мМ L-глутаміну, 20мМ HEPES, 100Е/мл пеніциліну/стрептоміцину. Клітини раку молочної залози людини T47D (АТСС) культивують в модифікованому згідно із способом Дульбекко середовищі Ігла (DMEM) із додаванням 10% FCS, 5мМ L-глутаміну, 20мМ HEPES, 100Е/мл пеніциліну/стрептоміцину. Клітини мієлоїдного лейкозу миші М1 (АТСС) культивують в RPMI із додаванням 10% FCS, 5мМ L-глутаміну, 20мМ HEPES, 100Е/мл пеніциліну/стрептоміцину. Культивування вищевказаних клітинних ліній здійснюють при або у відсутності відповідної дози IL-6 (похідний СНО h IL-6 від Interpharm Laboratories), як описано нижче. Приклад 3. Проміжна трансфекція і аналізи люциферази і b-галактозидази. Проміжну трансфекцію клітин гепатоми людини HepG2 і клітин раку молочної залози людини T47D здійснюють із використанням преципітації ДНК фосфатом кальцію в буфері HEPES, згідно зі стандартними процедурами (Ausubel R. et а І.. Current Protocols in Molecular Biology. Greene Publishing Associates and Wiley Interscience, New York). Проміжну трансфекцію клітин мієлоїдного лейкозу миші М1 здійснюють із використанням DEAE-декстрану звичайними процедурами (згідно Ausubel, цит.вище). Щоб виявити активність люциферази і b-галактозидази, клітини екстрагують in situ шляхом інкубації протягом 15 хвилин при кімнатній температурі з 1мл/106 клітин буфері для екстракції (25мМ тріс-фосфату, pH 7,8, 2мМ DTT, 2мМ ЕДТК, 10% гліцерину, 1% тритону Х-100). У випадку люциферазної активності безпосередньо аналізують 20мкл клітинного екстракту з 100мкл буферу для аналізу люциферази (20мМ трицину, 1,07мМ (МgСО3)4 Мg (ОН)2×5 Н2О, 2,67мМ MgSO4 , 0,1мМ ЭДТК, 33,3мМ DTT, 0,27мМ коферменту А, 0,47мМ люциферину, 0,53мМ АТФ). У випадку активності b-галактозидази 10мкл клітинного екстракту інкубують протягом 1 години при 37°С з 100мкл субстрату Lumigal (від Lumigen). Зчитування даних із Lumigal і люциферази здійснюють за допомогою люменметру Berthold Autolumat LB953, причому випромінююча потужність є числом відліків за секунди (чос), взяте за період 30 секунд у випадку люциферази і за період 15 секунд у випадку b-галактозидази. Показано, що репортерна плазміда pM8SVL надає IL-6-відповідаємість після проміжної трансфекції клітин HepG2, підвищуючи експресію люциферазної активності в 50-100 разів (Serlupi Crescenzi et al., повідомлення на 12-ій європейській конференції по імунологи, Барселона, 14-17 червня 1994). Цю плазміду також досліджують у клітинах раку молочної залози людини T47D і в клітинах мієлоїдного лейкозу миші М1 Клітини М1 трансфектують 0,5мкг ДНК на 106 клітин із використанням DEAE-декстрану, у той час як для кальційфосфатної трансфекції клітин T47D використовують 2,5мкг ДНК на 10 5 клітин. Тільки дуже обмежені ознаки розділяються цими двома клітинними лініями, крім їхньої звичайної реакції на людський IL-6. Результати (фіг.3) показують, що молекула ДНК М8 в плазміді pM8SVL істотно активна в обох клітинних лініях після обробки IL-6. Як показує фіг.3, значна реакція на IL-6 також спостерігається в клітинах М1 з плазмідою репортерного гену pM8TKL, де молекула М8 фланкована тимидинкіназним промотором, що відрізняється від промотору SV40, що присутній в pM8SVL. Залежність від часу люци феразної індуцибельності трансфектованих клітин HepG2 перевіряють після обробки IL-6 (1нг/мл). Плазміду pM8SVL використовують у якості позитивної плазміди репортерного гену (при 0,2мкг/105 клітин). Клітини трансфектують протягом ночі, розщеплюють і потім піддають обробці IL-6. Результати приводяться на фіг.4, і вони показують, що майже повної відповіді на IL-6 можна досягти тільки через дві години після обробки IL-6. Приклад 4. Випробовування інгібуючої плазміди рМ8. Інгібування активності IL-6 молекулами ДНК М8 вимірюють після котрансфекції в клітини HepG2 1) плазміди репортерного гену pM8SVL, що відповідає на IL-6, і II) молекули М8, вставленої в інгібуючу плазміду М8. Ця остання плазміда виступає в ролі хазяїна послідовності М8, але вона не здатна надавати відповідь на IL-6. Клітини HepG2 трансфектують 2,5мкг/105 клітин відповідаючої на IL-6 репортерної плазміди pM8SVL (що містить М8 і ген люциферази) і 10- або 50кратним молярним надлишком рМ8, при різноманітних дозах IL-6. Загальну кількість ДНК на трансфекцію підтримують постійною, використовуючи плазміду-носій рС, що ідентична рМ8, за винятком відсутності в першій плазміді специфічного фрагменту ДНК М8 довжиною в 165 п.н. Як видно з фіг.5, інгібуюча плазміда не показує суттєвого і відтворюємого специфічного інгібування активності IL-6 у чотирьох експериментах, навіть при 50-кратному молярному надлишку інгібуючої плазміди рМ8. В цих експериментах відповідаючу на IL-6 плазміду репортерного гену використовують при дозі 0,1мкг/105 клітин, у той час як постійна кількість загальної ДНК, використованої при трансфекції , становить 5мкг/105 клітин. Субоптимальна доза IL-6, використана в цих експериментах, становить 1нг/мл. Як показує фіг.5, мінливість при цих умовах експерименту прийнятна, виходячи з факту, що різноманітні трансфекції самі по собі є неминучим джерелом мінливості. Приклад 5. Випробовування інгібуючої плазміди pM85V. Результати, наведені на фіг.5, є трохи несподіваними, оскільки активна інгібуюча ДНК-послідовність М8 інгібуючої плазміди рМ8 ідентична активній послідовності плазміди репортерного гену pM8SVL. Тому після котрансфекції варто було б очікувати конкуренції між двома ідентичними М8 послідовностями, які присутні в різних плазмідах, що призводить до інгібування активності IL-6 при аналізі репортерного гену. Крім того, описані вище результати не можна пояснити за допомогою присутності надлишку активованого IL-6-специфічного фактору (факторів) транскрипції, що недостатньо нейтралізовані молекулами інгибуючої ДНК М8, тому що дані одержують при обмеженій кількості IL-6. Крім того, опубліковані дані про подібні експерименти з сайтами зв'язування ДНК для відомих факторів транскрипції (26-30) не сумісні з результатами, приведеними на фіг.5. Іншим поясненням результатів, показаних на фіг.5, може бути те, що відмінні від М8 послідовності в плазміді репортерного гену можуть робити внесок в IL-6-специфічну сигнальну трансдукцію. Ці послідовності повинні бути відсутні в інгібуючій послідовності рМ8, але вони повинні бути присутніми в позитивній плазміді репортерного гену pM8SVL (наприклад, послідовності раннього генного промотору SV40, що можуть зв'язувати загальні фактори транскрипції). Інгібуюча плазміда рМ8 тому може бути неефективною при конкуренції з плазмідою репортерного гену pM8SVL. Щоб перевірити цю гіпотезу, конструюють інгібуючу плазміду (pM8SV), що містить у якості інгібуючих IL-6 ДНК-послідовностей як послідовність М8, так і промоторну послідовність SV40 (див. фіг.1). Цю інгібуючу плазміду перевіряють при аналізі репортерного гену IL-6 з клітинами HepG2. Здійснюють чотири незалежних експерименти, при дворазовому повторенні трансфекції на експеримент. Трансфекцію здійснюють 0,1мкг репортерної плазмідної ДНК і молярним надлишком інгібуючої плазміди як показано на фіг.6. Загальну кількість трансфектованої ДНК підтримують постійною за допомогою плазміди-носія. Трансфектовані клітини обробляють протягом 18 годин 1нг/мл IL-6. Результати, приведені на фіг.6, показують чітке залежне від дози інгібування активності IL-6 інгібуючою плазмідою pM8SV. Неопрацьовані дані для фіг.6 приводяться в табл.1. При кожному експерименті здійснюють три повторних трансфекції на дозу інгібуючої плазміди. Для кожного експерименту величини у випадку індукування і без індукування, приведені в окремій колонці, призводять до однієї і тієї ж трансфекції. Дані значення світлового випромінювання представляють чос за період у 30 секунд. Як можна бачити з табл.1, спостерігається деяка мінливість у ци х експериментах, особливо, при більш низьких дозах інгібуючої плазміди, але звичайно коеф. варіації повторних трансфекцій твердо становить ниж. 20%. Щоб виключити припущення, що інгібування активності IL-6, забезпечене інгібуючою плазмідою pM8SV, відбувається винятково завдяки ДНК-послідовності промотора SV40, а не сполученню послідовностей М8 і SV40, конструюють додаткову інгібуючу плазміду, і досліджують її при аналізі репортерного гену. Ця плазміда містить у якості інгібітора активності ІL-6 тільки ДНК-послідовність SV40, без послідовності М8, а також люциферазного гену. Трансфекцию здійснюють 0,1мкг репортерної плазмідної ДНК і молярним надлишком інгібуючої плазміди, як показано на фіг.7. Загальну кількість трансфектованої ДНК підтримують постійною за допомогою плазмідиносія. Трансфектовані клітини обробляуть протягом 18 годин 1нг/мл IL-6. Результати, приведені на фіг.7, показують, що ця інгібуюча плазміда, (pSV) демонструє тільки часткове інгібування активності IL-6, що ніколи не перевищує 40% і не залежить від дози. Це дозволяє зробити висновок, що однієї ДНК-послідовності SV40 недостатньо для ефективного інгібування активності IL-6. З іншого боку, репортерна плазміда pGL2-pv, що містить люциферазу, містить промоторну послідовність SV40, але не містить послідовність М8, даючи, таким чином, в результаті, основний рівень експресії люциферази, більше не індукований IL-6. В цій плазміді основний рівень експресії люциферази не інгібується інгібуючою плазмідою pM8SV, показуючи, таким чином, що фактори транскрипції, які специфічно зв'язуються тільки промоторною областю SV40 pGL2-pv, не видаляються ефективно інгібуючою плазмідою pM8SV. В дійсності, при наявності останньої інгібуючої плазміди активність люцеферази з репортерної плазміди pGL2-pv навіть вище, ніж у відсутність вказаної інгібуючої плазміди (не показано). Приклад 6. Інгібування pM8SV активності IL-6, наданої плазмідою репортерного гену pHPSVL. Автори потім побажали перевірити інгібуючу плазміду pM8SV при додатковому аналізі репортерного гену для IL-6, коли послідовність ДНК-мішені, що опосередкує сигнал IL-6 в плазміді репортерного гену, не цілком відповідає інгібуючій послідовності М8. Тому клітини HepG2 трансфектують плазмідою pHPSVL, що містить 841 пару основ з промоторної послідовності гену людського гаптоглобіну, фланковану промотором SV40 і люциферазним геном. В цій плазміді є присутнім один сайт APRE із гаптоглобінової промоторної послідовності (відповідно до Maeda at al., J. Biol. Chem., 260 (II), pp. 6698-709, June 10, 1985). Автори попередньо показали, що ця плазміда відповідає на IL-6 6-8-кратним збільшенням експресії люциферази (Surlupi Crescenzi et al., повідомлення на 12-ій Європейській конференції по імунології, Барселона, 14-17 червня 1994). Результати одного з експериментів при триразовому повторі трансфекції приводяться на фіг.8. Після котрансфекції плазміди репортерного гену pHPSVL з 50-кратним молярним надлишком плазміди-носія індуцибельність за рахунок IL-6 дає, в результаті, експресію люциферази в 4 рази вище основного рівня. Навпаки, котрансфекція з 50-кратним молярним надлишком інгібуючої плазміди pM8SV цілком руйнує індуцибельність за рахунок IL-6. Отже, інгібуюча плазміда pM8SV здатна інгібувати активність IL-6 також тоді, коли досліджують відповідаючу на IL-6 плазміду репортерного гену, що відрізняється від pM8SVL (наприклад, репортерну плазміду pHPSVL). Приклад 7. Дослідження інгібуючої плазміди pM8SV у клітинах T47D. Інгібуючу плазміду pM8SV також досліджують при аналізі репортерного гену pM8SVL, використовуючи клітини раку молочної залози людини T47D, де трансдукція сигналу IL-6 може бути іншою, ніж в клітинах гепатоми. Як згадувалося раніше, аналіз репортерного гену IL-6 з плазмідою репортерного гену pM8SVL працює в цій клітинній лінії, хоча він не оптимізований. Тому що чутливість аналізу з клітинами T47D іноді нижче, трансфекцію здійснюють із 1мкг позитивної плазміди репортерного гену на 105 клітин, що є відносно високим рівнем плазмідної ДНК. Тому в цьому експерименті спостерігають неспецифічне інгібування при надлишку плазміди-носія або інгібуючої плазміди, що призводить, в результаті, до більш високої мінливості IL-6-специфічного інгібування. Результати наводяться в табл.2. Показано середні (ср) і стандартні відхилення (ст. відх.) триразово повтореної трансфекції в двох експериментах. Середні величини кратної індукції обчисляють із неопрацьованих значень кожної трансфекції. В експериментах 1 і 2 використовують 1 і 0,5мкг плазміди репортерного гену, відповідно, на 10 5 трансфектованих клітин. У цих експериментах здійснюють окрему трансфекцію плазміди-носія і інгібуючої плазміди, причому обидві плазміди використовують при вказаному молярному надлишку по відношенню до репортерної плазміди. Після трансфекції клітини індукують на протязі 18 годин 1нг/мл IL-6. Приведені величини світлового випромінювання є чос за період у 30 секунд. Специфічне інгібування IL-6 у цих експериментах оцінюють шляхом порівняння індукції, отриманої при надлишку інгібуючої плазміди і індукції, отриманої при відповідній дозі плазміди-носія. Крім того, через неспецифічне інгібування основний рівень експресії люциферази наближається до кількісної межі аналізу. Результати, наведені в табл.2 (див. експеримент 1), показують, що, після трансфекції, повтореної тричі, релевантне специфічне інгібування активності IL-6 одержують при 20-кратному молярному надлишку інгібуючої плазміди pM8SV, а не при 10-кратному молярному надлишку. В цьому експерименті не можна здійснити дослідження при 50-кратному молярному надлишку інгібуючої плазміди, оскільки неспецифічне інгібування стає занадто високим. Ці результати не можна відтворити в додатковому експерименті, коли використовують 0,5мкг ДНК на 105 клітин (табл.2, див. експеримент 2). Причиною такої відсутності відтворення може бути відносно висока мінливість і низька чутливість аналізу репортерного гену T47D. З іншого боку, ці результати може пояснити різна селективність клітин-мішеней. Приклад 8. Визначення мінімальної інгібуючої послідовності ДНК. Щоб ідентифікувати мінімальну ДНКпослідовність, яка зберігає здатність інгібувати зв'язування факторів транскрипції, релевантних для IL-6індуцибельності, можна використовувати експериментальний підхід аналізу зсуву електрофоретичної рухомості (EMSA) (по Ausubel). Випробовування на функціональне інгібування, передане цією мінімальною послідовністю, можна здійснити з використанням аналізу репортерного гену, вказаного в прикладі 3 і наступних прикладах. Автори показали, що мінімальна ДНК-послідовність, що функціонально інгібує активність IL-6 при аналізі репортерного гену, є фрагментом Ваm І-Hind III в 350 п.н. інгібуючої плазміди pM8SV, що містить 8-кратний повтор APRE-ДНК-послідовності і ранньої промоторної послідовності SV40. Відомо, що ця остання послідовність містить сайти зв'язування для загальних факторів транскрипції, такі як АР-1-подібний сайт (як повідомляють Zenke et al., ЕМВА J, 5 (2), pp. 387-97, 1986), і 6-кратний повтор сайту SpI (як повідомляють Dynan et al.. Cell, 35, pp. 79-87, 1983). Фрагмент ДНК Bam I-Hind III може бути видалений із її 5'- і/або 3' -кінців за допомогою звичайних методів, таких як PCR або обробка нуклеазою (по Ausubel), щоб послідовність мала, наприклад, дві APRE-поспідовності і тільки один або декілька сайтів зв'язування для специфічних факторів транскрипції з раннього промотору SV40. Отримані в результаті ДНК-послідовності можна використовува ти для досліджень на інгібування при аналізі репортерного гену на основі pSVM8L в клітинах HepG2. Крім того, мінімальний фрагмент ДНК, що зберігає повну здатність функціонально інгібувати сигнал IL-6, може бути використаний при EMSA, шля хом мічення цієї ДНК 32р-нуклеотидом за допомогою звичайних способів, таких як кінцеве мічення або вставка при реакціях Кленова. Отриманий в результаті мічений ДНКфрагмент можна інкубува ти з нуклеарними екстрактами з клітин HepG2 після обробки IL-6. Кількість конкуруючої ДНК-послідовності, що збільшується, також можна коінкубувати, як який-небудь із немічених ДНК-фрагментів, який утворився в результаті вищевказаних делецій фрагменту інгібуючої ДНК Bam I-Hind III. Після інкубації суміш можна піддати електрофорезу в неденатуруючому гелі. Зв'язування релевантних факторів транскрипції з досліджуємим міченим фрагментом ДНК буде виявлятися по зсуву в рухомості гелю (уповільненню), очікуваному для незв'язаної міченої ДНК. Інгібування цього зв'язування при конкуруючих немічених ДНК-послідовностях буде виявлятися по специфічному зникненню зсунених смуг у гелі. Таблиця 1 Аналіз реп ортерного гену HepG2 для IL-6. Дослідження інгі бу ючої плазмі ди pSV M8 проти п лазміди репо ртерного ге ну pSVM8L Моля рний надли шок інгібітору крат Експеримен т 1 Експеримен т 2 Експеримен т 3 Експеримен т 4 + IL-6 - IL-6 + IL-6 - IL-6 + IL-6 - IL-6 + IL-6 30.330 0 - IL-6 1.562.000 49.200 1.664.000 30.880 2.489.000 37.430 1.587.000 1.227.000 83.590 1.914.000 47.610 2.266.000 34.000 1.433.000 1.711.000 91.560 1.754.000 49.670 3.239.000 31.130 1.362.000 751.800 144.300 2.380.000 33.680 923.100 32.390 476.200 951.300 161.500 2.202.000 35.020 722.500 39.610 790.400 1.159.000 129.200 1.953.000 37.620 1.110.000 32.770 516.900 568.100 85.410 745.300 46.760 538.400 36.790 298.100 677.700 61.340 671.600 33.520 414.000 20.320 255.500 620.400 71.040 773.300 27.950 543.500 26.080 318.800 312.200 148.700 857.900 23.820 173.500 120.800 586.000 268.500 159.700 655.300 25.370 150.500 96.900 716.400 427.300 68.630 517.500 46.470 287.500 195.800 1,029.000 34.760 32.920 29.400 10 34.660 24.530 40.730 25 45.320 32.670 53.210 50 60.110 73.810 Таблиця 2 Аналіз реп ортерного гену T47D для IL-6 Моля рний на дли шок інгі бітору або плазміди-н осія Експер.1 Репорте рна плазмі да плюс плазмі да носій Репорте рна плазмі да плюс інгі б. плазмі да р М8 Репорте рна 10 20 -IL-6 +IL-6 сер. 7832 423746 кратн. інду к. -IL-6 +IL-6 61 (27) 7498 570099 (2848) (29927) (34) кратн. інду к. -IL-6 + IL-6 85 925 98766 Сту п.в ідх. сер. Сту п.в ідх. 932 58950 (123) (21586) 68 (44) Не в изначалося 704 11416 (103) (11533) плазмі да плюс інгі б. плазм. p M8SV Репорте рна плазмі да плюс плазмі да-н осій Експер.2 Репорте рна плазмі да плюс Інгіб. плазмі да р М8 Репорте рна плазмі да плюс Інгіб. плазм. PM8SV кратн. інду к. -IL-6 +IL-6 110 (39) 15 (13) 35320 390400 (20227) (145230) 2325 77617 (1019) (30495) кратн. інду к. -IL-6 + IL-6 15 (11) 35 (8) 7498 570099 (2256) (40806) (14) кратн. інду к. 85 Не в изначалося -IL-6 925 (495) 704 (103) + IL-6 98766 (64852) 11416 (11533) кратн. інду к 110 (8) 15 (13) Перелік послідовностей (І) Загальна інформація (1) ЗАЯВНИК: (A) ІМ'Я: APPLIED RESEARCH SYSTEMS ARS HOLDING N. V. (Б) ВУЛИЦЯ: 6 JOHN GORSIRAWEG (B) МІСТО: CURACAO (Д) КРАЇНА: NETHERLANDS ANTILLES (E) ПОШТОВИЙ ІНДЕКС (ZIP): НЕМАЄ (II) Н АЗВА ВИН АХОДУ: ІНГІБІТОР АКТИВНОСТІ IL-6 (III) ЧИСЛО ПОСЛІДОВНОСТЕЙ: 6 (IV) ФОРМА КОМП'ЮТЕРНОГО ЗЧИТУВАННЯ: (A) ТИП СЕРЕДОВИЩА: дискета (Б) КОМП'ЮТЕР: сумісний із системою IBM PC (B) ОПЕРАЦІЙНА СИСТЕМА: PC-DOS/MS-DOS (Г) ПРОГРАМНЕ ЗАБЕЗПЕЧЕННЯ: Patentin Release 1.0, версія 1.30 (ЕРО) (2) ІНФОРМАЦІЯ ПРО ПОСЛІД. № 1 (І) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 356 пар основ (Б) ТИП: нуклеїнова кислота (B) Одноланцюгова (Г) ТОПОЛОГІЯ: лінійна (II) ТИП МОЛЕКУЛИ: кДНК (III) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (IV) АНТИЗМІСТОВА: НЕМАЄ (XI) ОПИС ПОСЛІДОВНОСТІ: ПОСЛІД. № 1 (2) ІНФОРМАЦІЯ ПРО ПОСЛІД. № 2 (1) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 38 пар основ (Б) ТИП: нуклеїнова кислота (B) Одноланцюгова (Г) ТОПОЛОГІЯ: лінійна (11) ТИП МОЛЕКУЛИ: кДНК (III) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (IV) АНТИЗМІСТОВА: НЕМАЄ (2) ІНФОРМАЦІЯ ПРО ПОСЛІД. № 3 (I) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 16 пар основ (Б) ТИП: нуклеїнова кислота (B) Одноланцюгова (Г) ТОПОЛОГІЯ: лінійна (II) ТИП МОЛЕКУЛИ: кДНК (III) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (IV) АНТИЗМІСТІОВА: НЕМАЄ (XI) ОПИС ПОСЛІДОВНОСТІ: ПОСЛІД. №3 (2) ІНФОРМАЦІЯ ПРО ПОСЛІД. № 4 (I) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 24 пари основ (Б) ТИП: нуклеїнова кислота (B) Одноланцюгова (Г) ТОПОЛОГІЯ: лінійна (II) ТИП МОЛЕКУЛИ: кДНК (III) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (IV) АНТИЗМІСТОВА: НЕМАЄ (XI) ОПИС ПОСЛІДОВНОСТІ: ПОСЛІД. № 4 (2) ІНФОРМАЦІЯ ПРО ПОСЛІД. № 5 (I) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 29 пар основ (Б) ТИП: нуклеїнова кислота (B) Одноланцюгова (Г) ТОПОЛОГІЯ: лінійна (II) ТИП МОЛЕКУЛИ: кДНК (III) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (IV) АНТИЗМІСТОВА: НЕМАЄ (XI) ОПИС ПОСЛІДОВНОСТІ: ПОСЛІД. № 5 (2) ІНФОРМАЦІЯ ПРО ПОСЛІД. № 6 (I) ХАРАКТЕРИСТИКИ ПОСЛІДОВНОСТІ: (A) ДОВЖИНА: 28 пар основ (Б) ТИП: нуклеїнова кислота (B) Одноланцюгова (Г) ТОПОЛОГІЯ: лінійна (II) ТИП МОЛЕКУЛИ: кДНК (III) ГІПОТЕТИЧНІСТЬ: НЕМАЄ (IV) АНТИЗМІСТОВА: НЕМАЄ (XI) ОПИС ПОСЛІДОВНОСТІ: ПОСЛІД. № 6
ДивитисяДодаткова інформація
Назва патенту англійськоюNucleotide sequence, able to inhibit activity of il-6, use thereof for therapy, plasmide vector and pharmaceutical composition (alternatives) containing this nucleotide sequence
Назва патенту російськоюНуклеотидная последовательность, способная ингибировать активность il-6, ее применение для терапии, плазмидный вектор и фармацевтическая композиция (варинты), содержащая эту нуклеотидную последовательность
МПК / Мітки
МПК: C07K 14/47
Мітки: варіанти, вектор, фармацевтична, містять, здатна, композиція, інгібувати, послідовність, il-6, плазмідний, терапії, нуклеотидну, використання, нуклеотидна, активність
Код посилання
<a href="https://ua.patents.su/14-63888-nukleotidna-poslidovnist-zdatna-ingibuvati-aktivnist-il-6-vikoristannya-dlya-terapi-plazmidnijj-vektor-ta-farmacevtichna-kompoziciya-varianti-shho-mistyat-cyu-nukleotidnu-poslidovn.html" target="_blank" rel="follow" title="База патентів України">Нуклеотидна послідовність, здатна інгібувати активність il-6, її використання для терапії, плазмідний вектор та фармацевтична композиція (варіанти), що містять цю нуклеотидну послідовність</a>
Попередній патент: Вибірково діючі інгібітори тромбіну та фармацевтична композиція на іх основі
Наступний патент: Спосіб автоматизованого здійснення державних закупівель товарів, робіт та послуг
Випадковий патент: Жалюзі з вертикальними ламелями