Спосіб лікування серцево-судинних захворювань лікарською формою ранолазину пролонгованої дії
Формула / Реферат
1.Спосіб лікування пацієнта-людини, що страждає на серцево-судинне захворювання, вибране з групи, яка включає аритмії, різновиди стенокардії, стенокардію напруження та інфаркт міокарда, шляхом введення згаданому пацієнту-людині фармацевтичної дозованої лікарської форми пролонгованої дії, що містить щонайменше 50% (мас.) ранолазину, у дозі, яка включає щонайбільше дві таблетки, для підтримання рівнів ранолазину у плазмі згаданого пацієнта-людини у межах від приблизно 550 нг основи/мл до приблизно 7500 нг основи/мл протягом щонайменше 24 год, причому згадану дозу вводять із частотою один, два або три рази на 24 год, причому згадана дозована лікарська форма пролонгованої дії містить щонайменше одну рН-залежну в’яжучу речовину, що уповільнює вивільнення ранолазину із згаданої дозованої лікарської форми пролонгованої дії у разі, коли ця дозована лікарська форма пролонгованої дії зазнає впливу водного середовища, що має рН шлунка, та сприяє вивільненню терапевтичної кількості ранолазину у водному розчині, рівень рН якого перевищує приблизно 4,5.
2. Спосіб за п. 1, який відрізняється тим, що згадана рН-залежна в'яжуча речовина є частково нейтралізованою.
3. Спосіб за п. 1, який відрізняється тим, що згадану фармацевтичну дозовану лікарську форму вводять пацієнту-людині з частотою один або два рази на 24 год.
4. Спосіб за п. 1, який відрізняється тим, що згадану фармацевтичну дозовану лікарську форму вводять пацієнту-людині у двох дозах впродовж 24 год, причому кожна доза складається із двох таблеток.
5. Спосіб за п. 1, який відрізняється тим, що згадана фармацевтична дозована лікарська форма містить від приблизно 50% (мас.) до приблизно 95% (мас.) ранолазину.
6. Спосіб за п. 1, який відрізняється тим, що згадана фармацевтична дозована лікарська форма містить від приблизно 70% (мас.) до приблизно 80% (мас.) ранолазину.
7. Спосіб за п. 1, який відрізняється тим, що згадана рН-залежна в'яжуча речовина вибрана із групи, яка включає співполімери метакрилової кислоти, фталат гідроксипропілцелюлози, фталат гідроксипропілметилцелюлози, ацетофталат целюлози, фталат полівінілацетату, фталат полівінілпіролідину та їх суміші.
8. Спосіб за п. 1, який відрізняється тим, що згаданою рН-залежною в'яжучою речовиною є співполімер метакрилової кислоти.
9. Спосіб за п. 8, який відрізняється тим, що згаданим співполімером метакрилової кислоти є співполімер метакрилової кислоти Типу С, фармакопея США.
10. Спосіб за п. 1, який відрізняється тим, що згаданою рН-залежною в'яжучою речовиною є від приблизно 5% (мас.) до приблизно 12% (мас.) співполімеру метакрилової кислоти Типу С, фармакопея США.
11. Спосіб за п.1, який відрізняється тим, що згаданою рН-залежною в'яжучою речовиною є приблизно 10% (мас.) співполімеру метакрилової кислоти Типу С, фармакопея США.
12. Спосіб за п. 1, який відрізняється тим, що згадана фармацевтична дозована лікарська форма містить рН-незалежну в'яжучу речовину.
13. Спосіб за п. 12, який відрізняється тим, що згадана рН-незалежна в'яжуча речовина вибрана із групи, яка включає гідроксипропілметилцелюлозу, гідроксипропілцелюлозу, полі(мет)акрилатні ефіри, полівінілпіролідон та їх суміші.
14. Спосіб за п. 12, який відрізняється тим, що згаданою рН-незалежною в'яжучою речовиною є гідроксипропілметилцелюлоза.
15. Спосіб за п. 14, який відрізняється тим, що згадана фармацевтична дозована лікарська форма містить від приблизно 1% (мас.) до приблизно 3% (мас.) гідроксипропілметилцелюлози.
16. Спосіб за п. 14, який відрізняється тим, що згадана фармацевтична дозована лікарська форма містить приблизно 2% (мас.) гідроксипропілметилцелюлози.
17. Спосіб за будь-яким з пп. 1 та 5-16, який відрізняється тим, що рівень ранолазину у плазмі пацієнта-людини підтримують у межах від 1000 нг основи/мл до 5000 нг основи/мл.
18. Спосіб за будь-яким з пп. 1 та 5-16, який відрізняється тим, що рівень ранолазину у плазмі пацієнта-людини підтримують у межах від 1000 нг основи/мл до 3800 нг основи/мл.
19. Спосіб за будь-яким з пп. 1 та 5-16, який відрізняється тим, що рівень ранолазину у плазмі пацієнта-людини підтримують у межах від 550 нг основи/мл до 5000 нг основи/мл.
20. Спосіб за будь-яким з пп. 1 та 5-16, який відрізняється тим, що рівень ранолазину у плазмі пацієнта-людини підтримують у межах від 550 нг основи/мл до 3800 нг основи/мл.
21. Спосіб за будь-яким з пп. 1 та 5-16, який відрізняється тим, що рівень ранолазину у плазмі пацієнта-людини підтримують у межах від 1000 нг основи/мл до 2800 нг основи/мл.
22. Спосіб за будь-яким з пп. 1 та 5-16, який відрізняється тим, що рівень ранолазину у плазмі пацієнта-людини підтримують у межах від 1700 нг основи/мл до 3900 нг основи/мл.
23. Спосіб за будь-яким з пп. 1 та 5-16, який відрізняється тим, що рівень ранолазину у плазмі пацієнта-людини підтримують у межах від 550 нг основи/мл до 2000 нг основи/мл.
24. Спосіб за п. 22, який відрізняється тим, що згадана дозована форма містить від 650 мг до 850 мг ранолазину.
25. Спосіб за п. 23, який відрізняється тим, що згадана дозована форма містить від 900 мг до 1100 мг ранолазину.
26. Спосіб за п. 24, який відрізняється тим, що згадана дозована форма містить від 400 мг до 600 мг ранолазину.
27. Спосіб за будь-яким з пп. 21-26, який відрізняється тим, що співвідношення пікових та залишкових рівнів ранолазину у плазмі пацієнта-людини становить менше за 4:1 впродовж 24-годинного інтервалу часу.
28. Спосіб за будь-яким з пп. 22-26, який відрізняється тим, що співвідношення пікових та залишкових рівнів ранолазину у плазмі пацієнта-людини становить менше за 3:1 впродовж 24-годинного інтервалу часу.
29. Спосіб за п. 23 або 27, який відрізняється тим, що співвідношення пікових та залишкових рівнів ранолазину у плазмі пацієнта-людини становить менше за 2:1 впродовж 24-годинного інтервалу часу.
Текст
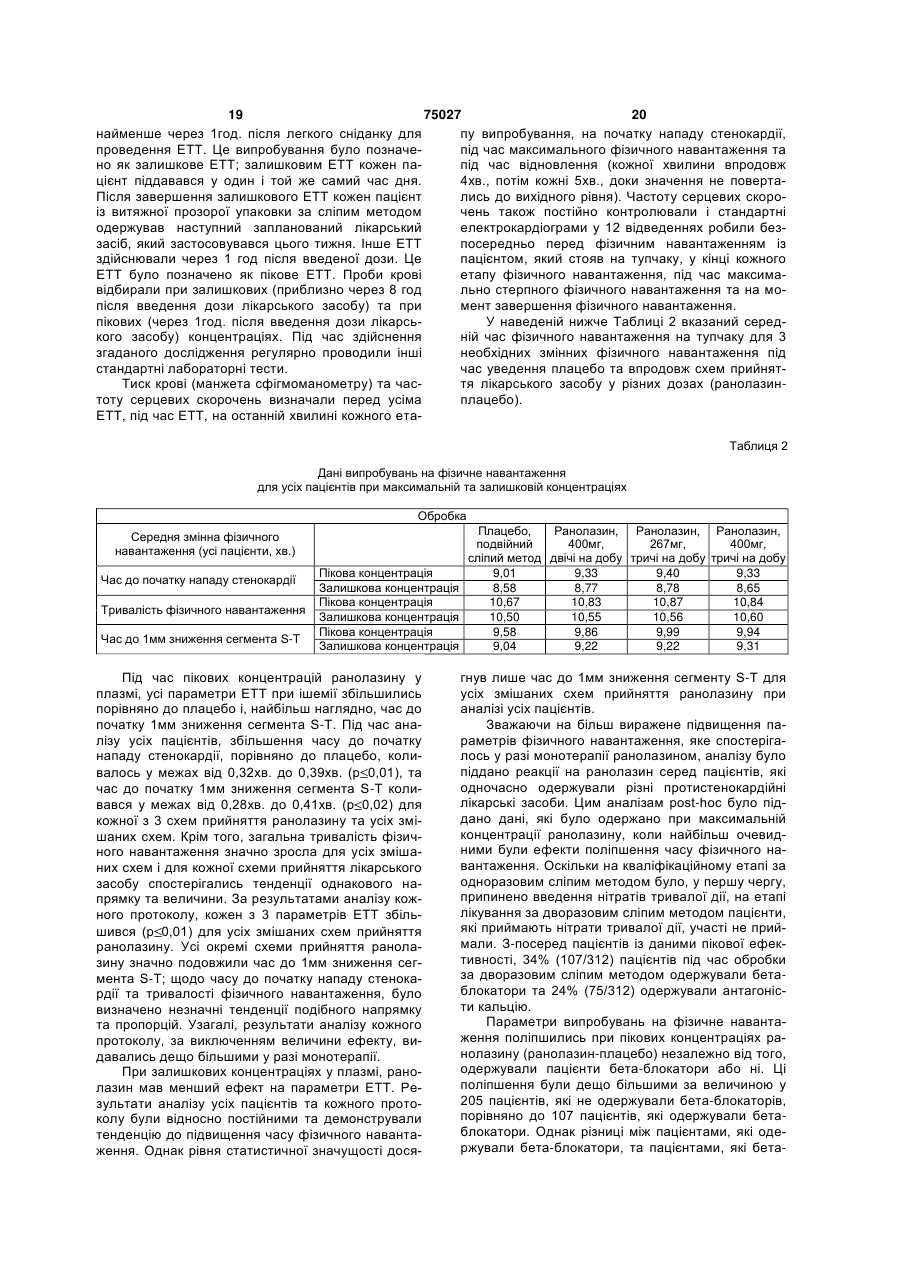
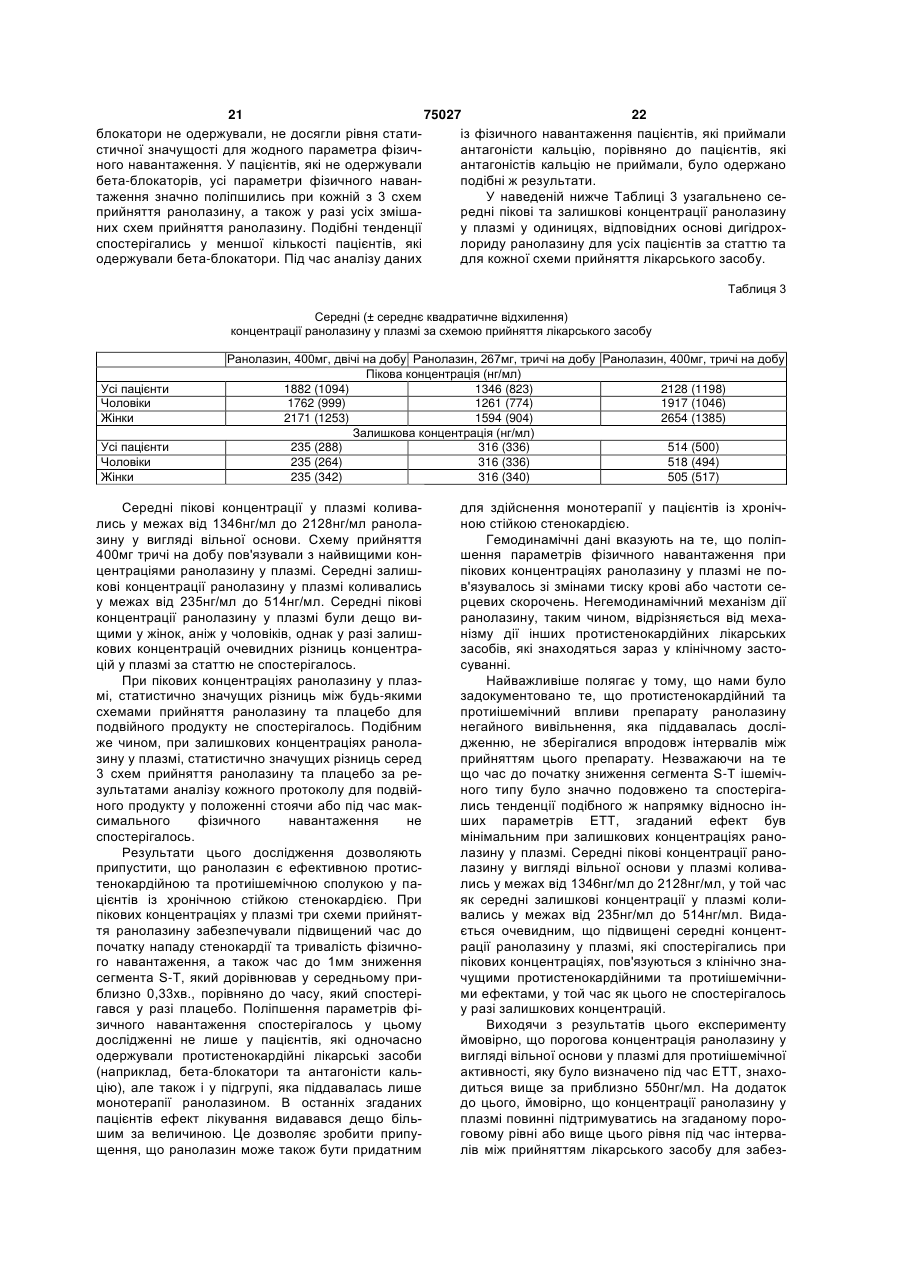
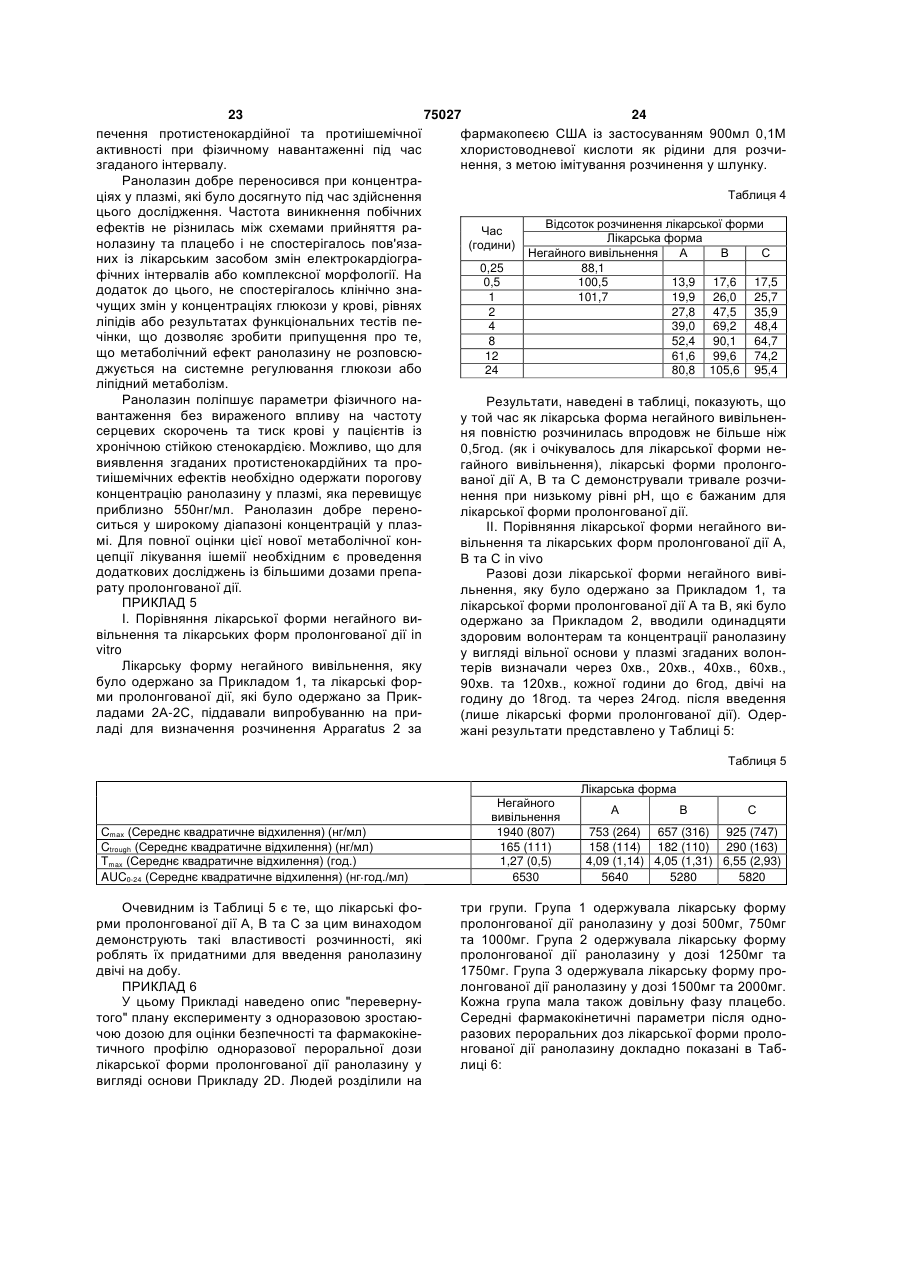
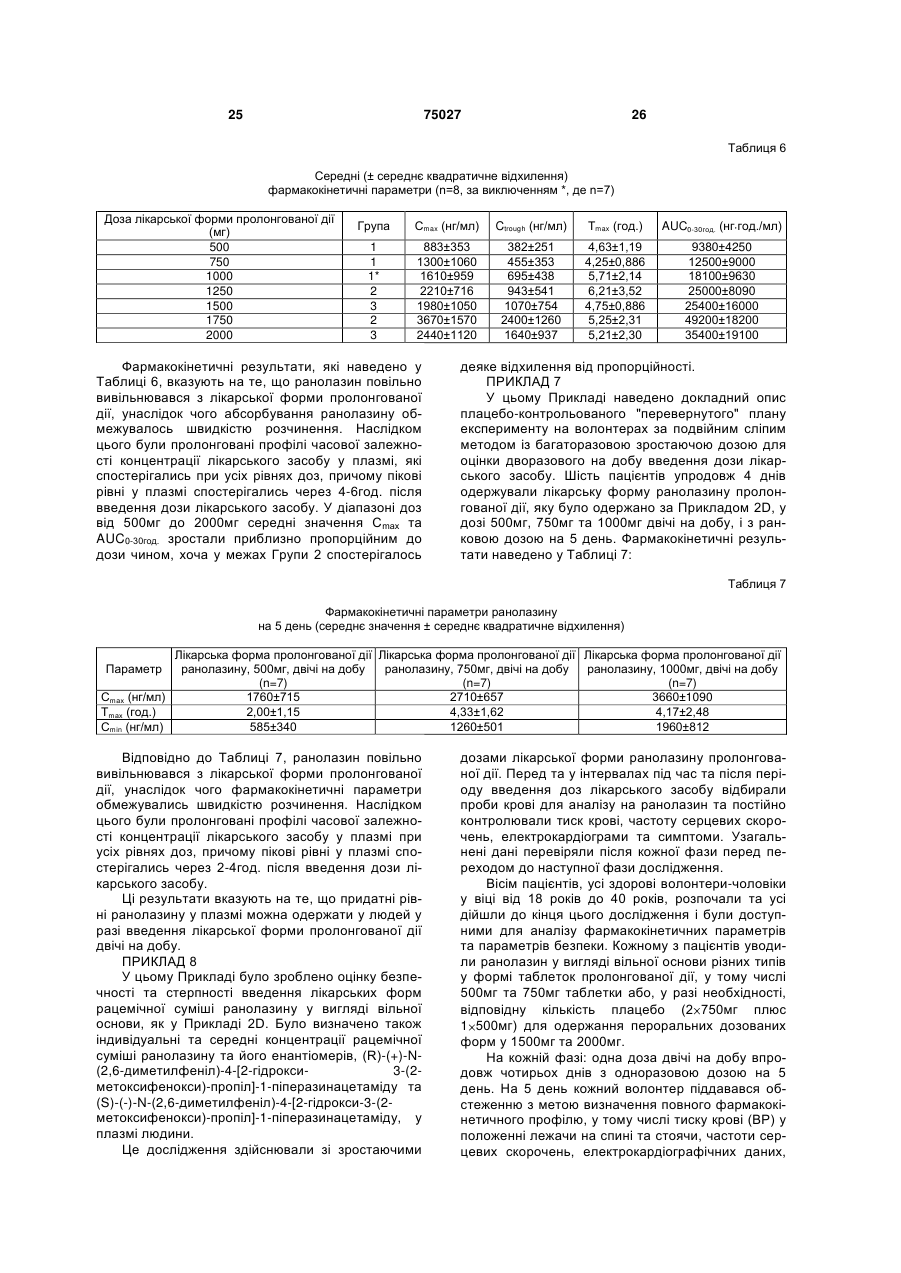
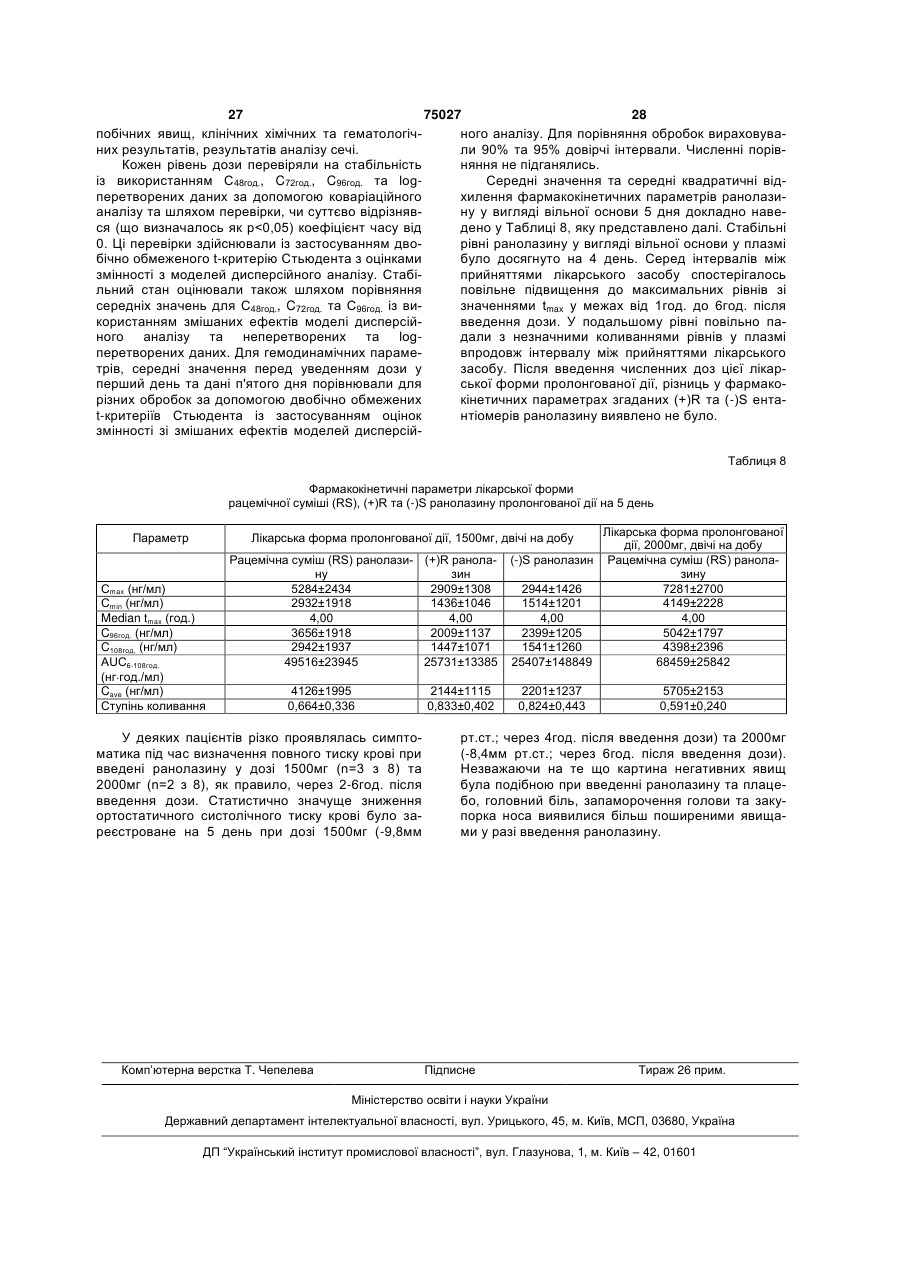
1.Спосіб лікування пацієнта-людини, що страждає на серцево-судинне захворювання, вибране з групи, яка включає аритмії, різновиди стенокардії, стенокардію напруження та інфаркт міокарда, шляхом введення згаданому пацієнту-людині фармацевтичної дозованої лікарської форми пролонгованої дії, що містить щонайменше 50% (мас.) ранолазину, у дозі, яка включає щонайбільше дві таблетки, для підтримання рівнів ранолазину у плазмі згаданого пацієнта-людини у межах від 2 (19) 1 3 75027 4 20. Спосіб за будь-яким з пп.1 та 5-16, який відріполімер метакрилової кислоти Типу С, фармакозняється тим, що рівень ранолазину у плазмі папея США. 10. Спосіб за п.1, який відрізняється тим, що згацієнта-людини підтримують у межах від 550 нг даною рН-залежною в'яжучою речовиною є від основи/мл до 3800 нг основи/мл. 21. Спосіб за будь-яким з пп.1 та 5-16, який відріприблизно 5% (мас.) до приблизно 12% (мас.) зняється тим, що рівень ранолазину у плазмі паспівполімеру метакрилової кислоти Типу С, фармакопея США. цієнта-людини підтримують у межах від 1000 нг 11. Спосіб за п.1, який відрізняється тим, що згаоснови/мл до 2800 нг основи/мл. 22. Спосіб за будь-яким з пп.1 та 5-16, який відріданою рН-залежною в'яжучою речовиною є прибзняється тим, що рівень ранолазину у плазмі пализно 10% (мас.) співполімеру метакрилової кислоти Типу С, фармакопея США. цієнта-людини підтримують у межах від 1700 нг 12. Спосіб за п.1, який відрізняється тим, що згаоснови/мл до 3900 нг основи/мл. 23. Спосіб за будь-яким з пп.1 та 5-16, який відрідана фармацевтична дозована лікарська форма зняється тим, що рівень ранолазину у плазмі памістить рН-незалежну в'яжучу речовину. 13. Спосіб за п.12, який відрізняється тим, що цієнта-людини підтримують у межах від 550 нг згадана рН-незалежна в'яжуча речовина вибрана основи/мл до 2000 нг основи/мл. 24. Спосіб за п.22, який відрізняється тим, що із групи, яка включає гідроксипропілметилцелюлозу, гідроксипропілцелюлозу, полі(мет)акрилатні згадана дозована форма містить від 650 мг до 850 ефіри, полівінілпіролідон та їх суміші. мг ранолазину. 14. Спосіб за п.12, який відрізняється тим, що 25. Спосіб за п.23, який відрізняється тим, що згаданою рН-незалежною в'яжучою речовиною є згадана дозована форма містить від 900 мг до гідроксипропілметилцелюлоза. 1100 мг ранолазину. 15. Спосіб за п.14, який відрізняється тим, що 26. Спосіб за п.24, який відрізняється тим, що згадана фармацевтична дозована лікарська форзгадана дозована форма містить від 400 мг до 600 ма містить від приблизно 1% (мас.) до приблизно мг ранолазину. 27. Спосіб за будь-яким з пп.21-26, який відрізня3% (мас.) гідроксипропілметилцелюлози. 16. Спосіб за п.14, який відрізняється тим, що ється тим, що співвідношення пікових та залишкозгадана фармацевтична дозована лікарська форвих рівнів ранолазину у плазмі пацієнта-людини ма містить приблизно 2% (мас.) гідроксипропілместановить менше за 4:1 впродовж 24-годинного тилцелюлози. інтервалу часу. 17. Спосіб за будь-яким з пп.1 та 5-16, який відрі28. Спосіб за будь-яким з пп.22-26, який відрізнязняється тим, що рівень ранолазину у плазмі пається тим, що співвідношення пікових та залишкоцієнта-людини підтримують у межах від 1000 нг вих рівнів ранолазину у плазмі пацієнта-людини основи/мл до 5000 нг основи/мл. становить менше за 3:1 впродовж 24-годинного 18. Спосіб за будь-яким з пп.1 та 5-16, який відріінтервалу часу. зняється тим, що рівень ранолазину у плазмі па29. Спосіб за п.23 або 27, який відрізняється тим, цієнта-людини підтримують у межах від 1000 нг що співвідношення пікових та залишкових рівнів основи/мл до 3800 нг основи/мл. ранолазину у плазмі пацієнта-людини становить 19. Спосіб за будь-яким з пп.1 та 5-16, який відріменше за 2:1 впродовж 24-годинного інтервалу зняється тим, що рівень ранолазину у плазмі пачасу. цієнта-людини підтримують у межах від 550 нг основи/мл до 5000 нг основи/мл. Цей винахід претендує на пріоритет тимчасової [заявки США реєстраційний №60/099,804, яку було подано 10 вересня 1998 року]. Цей винахід стосується способу застосування лікарських форм ранолазину пролонгованої дії, які вводяться пероральним шляхом, для підтримання рівнів ранолазину у плазмі людини на терапевтичних рівнях. [Патент США №4,567,264], опис якого включено до цього опису шляхом посилання, розкриває ранолазин, (±)-N-(2,6-диметилфеніл)-4-[2-гідрокси3-(2-метоксифенокси)-пропіл]-1піперазинацетамід, та його фармацевтично прийнятні солі, та їх застосування для лікування серцево-судинних хвороб, у тому числі аритмій, різновидів стенокардії, стенокардії напруження та інфаркту міокарда. [Патент США №5,506,229], опис якого включено до цього опису шляхом посилання, розкриває застосування ранолазину та його фармацевтично прийнятних солей та ефірів для лікування тканин, які піддаються фізичному або хімічному пошкодженню, у тому числі кардіоплегії, гіпоксичного або реперфузійного пошкодження серцевих або скелетних м'язів або тканин головного мозку, та для застосування у трансплантатах. Розкривають традиційні пероральні та парентеральні лікарські форми, у тому числі лікарські форми з контрольованим вивільненням. Зокрема, у Прикладі 7D [патенту США №5,506,229] наведено опис лікарської форми з контрольованим вивільненням в інкапсульованій формі, до складу якої входять мікрокульки ранолазину та мікрокристалічна целюлоза, вкрита полімерною оболонкою для контролювання 5 75027 6 вивільнення. людини шляхом уведення дозованої лікарської Переважним на цей час шляхом уведення раформи ранолазину лише один раз або двічі на нолазину та його фармацевтично прийнятних содобу. лей та ефірів є пероральний. Типовою пероральЦей винахід включає способи лікування пацієною дозованою лікарською формою є пресована нта-людини, який страждає на серцево-судинну таблетка, тверда желатинова капсула, яку наповхворобу, у тому числі аритмію, різновид стенокарнено порошкоподібною сумішшю або гранулятом, дії, стенокардію напруження та інфаркт міокарда. або м'яка желатинова капсула, яку наповнено розЦей спосіб включає введення дозованої лікарської чином або суспензією. [Патент США №5,472,707], форми пролонгованої дії, що містить щонайменше опис якого включено до цього опису шляхом поси50% (мас.) ранолазину, у кількості не більше ніж лання, розкриває великодозову пероральну лікардвох таблеток на дозу, пацієнту-людині для підтську форму, що містить переохолоджений рідкий римки рівнів ранолазину у плазмі зазначеного паранолазин як розчин-наповнювач твердої або м'яцієнта-людини від приблизно 550 (нг основи)/мл до кої желатинової капсули. приблизно 7500 (нг основи)/мл упродовж щонайЯк наведено у Прикладі 3 цієї заявки, початкоменше 24год., де зазначену дозу вводять із частові випробування ранолазину на людях, які стражтою один, два або три рази на 24год. дають на стенокардію, були повністю незадовільЦей винахід додатково включає способи лікуними. Під час проведення зазначених випробувань вання пацієнта-людини, що страждає на серцевобуло використано лікарську форму ранолазину судинну хворобу, у тому числі аритмію, різновид негайного вивільнення (доза - 120мг), яку вводили стенокардії, стенокардію напруження та інфаркт тричі на добу. Результати зазначених початкових міокарда. Цей спосіб включає введення дозованої експериментів не дали однозначної відповіді на лікарської форми пролонгованої дії, що містить від питання, чи можна вводити ранолазин людям у приблизно 70% (мас.) до приблизно 80% (мас.) кількості та шляхом, які б забезпечували ефективранолазину, у кількості не більше ніж двох таблену дію проти стенокардії. ток на дозу, пацієнту-людині для підтримування Одна з проблем, пов'язана з традиційними перівнів ранолазину у плазмі зазначеного пацієнтароральними лікарськими формами, полягає у толюдини від приблизно 1000 до приблизно 3900 (нг му, що вони не є ідеально придатними для ранооснови)/мл упродовж щонайменше 24год., де залазину та його фармацевтично прийнятних солей, значену дозу вводять із частотою один або два оскільки розчинність ранолазину є відносно висорази на 24год. кою при низьких рівнях рН, які спостерігаються у Цей винахід охоплює також дозовані лікарські шлунку. На додаток до цього, ранолазин має таформи, які містять щонайменше приблизно 50% кож порівняно короткий період напіввиведення з (мас.) ранолазину та щонайменше одну рНплазми. Наслідком того, що ранолазин характеризалежну в'яжучу речовину, що уповільнює вивільзується високою розчинністю у кислотах, є швидке нення ранолазину з цієї дозованої лікарської форабсорбування та виведення зазначеного лікарсьми пролонгованої дії у разі, коли ця дозована лікого засобу, що спричинює значні та небажані кокарська форма пролонгованої дії зазнає впливу ливання концентрації ранолазину у плазмі та ководного середовища, яке має рН шлунка, та яка ротку тривалість дії, що обумовлює необхідність сприяє вивільненню терапевтичної кількості раночастого перорального введення для забезпечення лазину у водному розчині, рН якого перевищує адекватного лікування. приблизно 4,5. Таким чином, існує необхідність у способі вве"Ранолазин" це сполука (±)-N-(2,6дення ранолазину у пероральній дозованій лікардиметилфеніл)-4-[2-гідрокси-3-(2ській формі один раз або двічі на добу, що забезметоксифенокси)-пропіл]-1-піперазинацетамід або печував би терапевтично ефективні рівні її енантіомери (R)-(+)-N-(2,6-диметилфеніл)-4-[2концентрації ранолазину у плазмі для лікування гідрокси-3-(2-метоксифенокси)-пропіл]-1стенокардії у людей. піперазинацетамід та (S)-(-)-N-(2,6-димeтилфeнiл)За першим аспектом цей винахід є лікарською 4-[2-гiдpoкcи-3-(2-мeтoкcифeнoкcи)-пpoпiл]-1формою ранолазину пролонгованої дії, що містить піперазинацетамід і їхні фармацевтично прийнятні здебільшого активний ранолазин. солі, а також їх суміші. Якщо не вказано іншого, За іншим аспектом цей винахід є способом ліконцентрації ранолазину у плазмі, які згадуються у кування пацієнта-людини, що страждає на стеноцьому описі та прикладах, означають концентракардію або інші коронарні хвороби, шляхом увецію ранолазину у вигляді вільної основи. дення лікарської форми ранолазину пролонгованої Термін "факультативний" або "факультативно" дії один раз або двічі на добу. означає, що подія або обставини, опис яких навеЗа ще іншим аспектом цей винахід є способом дено далі, можуть відбутись або можуть не відбулікування ссавця, який знаходиться у стані хворотись, і що цей опис винаходу охоплює як випадки, би, для якої є показаним уведення ранолазину, коли зазначена подія або обставини відбуваються, який включає введення один раз або двічі на добу так і випадки, коли вони не відбуваються. Наприлікарської форми ранолазину пролонгованої дії за клад, вираз "факультативні фармацевтичні наповцим винаходом таким чином, що забезпечується нювачі" означає, що лікарська форма, що описупідтримання концентрації ранолазину у плазмі на ється з використанням цього виразу, може містити мінімальних ефективних рівнях без пікових колиабо може не містити фармацевтичні наповнювачі, вань. за винятком тих, щодо яких прямо вказано на їх Ще іншим аспектом цього винаходу є спосіб наявність, і що бувають випадки, коли лікарська підтримання придатних рівнів ранолазину у плазмі форма, що описується з використанням цього ви 7 75027 8 разу, містить відповідні факультативні наповнюватервал часу. чі, та випадки, коли вона їх не містить. Відсотки, що наводяться, є масовими відсотТермін "лікування" означає будь-яке лікування ками, якщо не зазначено протилежне. Цей винахід хвороби у ссавця, зокрема, людини, та охоплює: охоплює дозовані форми ранолазину пролонгова(і) запобігання виникнення відповідної хвороби ної дії, а також способи введення дозованих форм у суб'єкта, який може бути схильним до такої хворанолазину пролонгованої дії за цим винаходом роби, однак його ще не було діагностовано як тадля забезпечення терапевтичних рівнів ранолазикого, що має цю хворобу; ну у плазмі. (іі) пригнічення зазначеної хвороби, тобто приЛікарські форми ранолазину пролонгованої дії зупинення її розвитку; або за цим винаходом мають за переважним варіан(ііі) полегшення зазначеної хвороби, тобто том вигляд пресованої таблетки, що містить ретеспричинення зворотного розвитку зазначеної хвольно перемішану суміш ранолазину та частково роби. нейтралізованої рН-залежної в'яжучої речовини, Термін "негайне вивільнення" ("IR") стосується яка контролює швидкість розчинення ранолазину у композиції або дозованих форм, які швидко розчиводних середовищах у діапазоні рН, характерному няються in vitro та призначені для повного розчидля шлунка (як правило - приблизно 2) та кишечнення та абсорбування у шлунку або верхньому нику (як правило - приблизно 5,5). відділі шлунково-кишкового тракту. Такі композиції Для забезпечення пролонгованої дії ранолаабо лікарські форми, як правило, вивільнюють зину вибирають одну або декілька рН-залежних щонайменше 90% активного інгредієнта протягом в'яжучих речовин для контролювання профілю 30хв. після введення. розчинення зазначеної лікарської форми ранолаТермін "пролонгована дія" ("SR") стосується зину так, що ця лікарська форма повільно та безкомпозицій або дозованих форм за цим винахоперервно вивільнює ранолазин під час її проходом, які повільно й безперервно розчиняються та дження через шлунок та шлунково-кишковий абсорбуються у шлунку і шлунково-кишковому тракт. Властивості рН-залежної в'яжучої речовини тракті протягом періоду часу, який складає 6год. (речовин) щодо контролювання розчинення є осоабо більше. Переважними композиціями або лібливо важливими у разі лікарської форми ранолакарськими формами пролонгованої дії є такі, що зину пролонгованої дії, оскільки лікарська форма демонструють концентрації ранолазину у плазмі, пролонгованої дії, яка містить ранолазин у кількосщо відповідають введенню щонайбільше двічі на ті, достатній для введення двічі на добу, може видобу у дозі не більше двох таблеток, як описано кликати небажані побічні ефекти у разі занадто нижче. швидкого вивільнення ранолазину ("демпінгКонцентрація ранолазину у плазмі - середня синдром"). концентрація, яка визначається шляхом аналізуВідповідно, зазначеними рН-залежними в'яжування концентрації ранолазину у щонайменше чими речовинами, придатними для використання у п'яти та щонайбільше десяти людей, до яких зацьому винаході, є речовини, які пригнічують швидстосовується однакова схема застосування лікарке вивільнення лікарської речовини з таблетки під ського засобу. Важливим є те, що зазначена кончас її знаходження у шлунку (де рівень рН є нижцентрація ранолазину визначається як середня чим за приблизно 4,5) та сприяють вивільненню величина, з огляду на коливання рівнів концентратерапевтичної кількості ранолазину із зазначеної ції ранолазину у окремих осіб, які можуть обумовдозованої лікарської форми у нижньому відділі люватись відмінностями у масі, обміні речовин або шлунково-кишкового тракту (де рівень рН, як прахворобливих станах, унаслідок чого одна особа вило, перевищує приблизно 4,5). Багато матеріаможе засвоювати ранолазин швидше або повільлів, відомих у фармацевтичній галузі як "ентераніше за "середню" особу. Рівні ранолазину у плазльні" та кишковорозчинні в'яжучі речовини та мі визначаються шляхом відбирання проб крові до оболонки, мають необхідні властивості розчинення пробірок із гепарином. за відповідних рівнів рН. До них належать похідні Інші терміни, які використано у цій заявці, вифталевої кислоти, наприклад, такі похідні фталезначаються таким чином: вої кислоти, як полімери та співполімери вінілу, АNОVА=дисперсійний аналіз гідроксіалкілцелюлози, алкілцелюлози, ацетати АТР=аденозин-5'-трифосфат целюлози, ацетати гідроксіалкілцелюлози, ефіри ЕСG=електрокардіографічний целюлози, ацетати алкілцелюлози та її часткові ЕТТ=випробування на фізичне навантаження ефіри, а також полімери та співполімери нижчих на тупчаку алкілакрилових кислот та нижчих алкілакрилатів, РDН=піруватдегідрогеназа та їхні часткові ефіри. Сmах=максимальна концентрація рН-залежними в'яжучими речовинами, що їм Ctrough=залишкова концентрація через 8год. півіддається перевага, які можуть використовувасля введення (для лікарських форм негайного витись у комбінації з ранолазином для одержання вільнення) або через 12год. після введення (для лікарської форми пролонгованої дії, є співполімери лікарських форм пролонгованої дії А-С Приметакрилової кислоти. Співполімерами метакрикладу 2). лової кислоти є співполімери метакрилової кислоtid=тричі на добу ти з нейтральними акрилатними або метакрилатbig=двічі на добу ними ефірами, наприклад, етилакрилатом або Сх=концентрація у момент часу x метилметакрилатом. Співполімером, якому віддаТmах=час до максимальної концентрації ється найбільша перевага, є співполімер метакриАUСх=площа під кривою через x годин або інлової кислоти Типу С, фармакопея США (який є 9 75027 10 співполімером метакрилової кислоти та етилакринення у разі рН, який перевищує 4,5, де розчинлату, який має від 46,0% до 50,6% одиниць метакність ранолазину є нижчою. Належний вибір рНрилової кислоти). Такий співполімер постачається залежної в'яжучої речовини уможливлює більшу компанією Rohm Pharma як Eudragit® L100-55 (у швидкість вивільнення ранолазину з лікарської вигляді порошку) або L30D-55 (у вигляді 30% дисформи при рівнях рН, які перевищують 4,5, водноперсії у воді). До інших рН-залежних в'яжучих речас істотно впливаючи на швидкість вивільнення човин, які можуть використовуватись самостійно при низькому рН. Часткова нейтралізація згаданої або у комбінації у дозованій лікарській формі рав'яжучої речовини сприяє її перетворенню на ланолазину пролонгованої дії, належать гідроксиптексоподібну плівку, яка утворюється навколо ропілцелюлози фталат, гідроксипропілметилцеокремих гранул ранолазину. Відповідно, тип та люлози фталат, целюлози ацетофталат, кількість згаданої рН-залежної в'яжучої речовини полівінілацетату фталат, полівінілпіролідону фтата кількість частково нейтралізованої композиції лат тощо. Одна або декілька рН-залежних в'яжупідбираються таким чином, щоб точно регулювати чих речовин містяться у дозованих лікарських фошвидкість вивільнення ранолазину з лікарської рмах ранолазину за цим винаходом у кількості від форми. приблизно 1% (мас.) до приблизно 20% (мас), за Дозовані лікарські форми за цим винаходом більш переважним варіантом від приблизно 5% мають містить рН-залежні в'яжучі речовини у кіль(мас.) до приблизно 12% (мас), та за найпереважкості, достатній для одержання лікарських форм нішим варіантом приблизно 10% (мас). пролонгованої дії, швидкість вивільнення ранолаПероральні дозовані лікарські форми ранолазину з яких контролюється таким чином, що у разі зину пролонгованої дії можуть містити одну або низьких рН (нижче за приблизно 4,5) ця швидкість декілька рН-незалежних в'яжучих речовин. Слід значно уповільнюється. У разі співполімеру метаквідзначити, що рН-залежні в'яжучі речовини та рилової кислоти Типу С, фармакопея США компоненти, що підвищують в'язкість, такі як гідро(Eudragit® L100-55), прийнятна кількість рНксипропілметилцелюлоза, гидроксипропілцелюлозалежної в'яжучої речовини становить від 5% до за, метилцелюлоза, полівінілпіролідон, нейтральні 15%. Згадана рН-залежна в'яжуча речовина як полі(мет)акрилатні ефіри тощо самі по собі не заправило буде мати від приблизно 1% до приблизбезпечують необхідного контролювання розчиненно 20% нейтралізованих карбоксильних груп метаня, яке забезпечується згаданими рН-залежними крилової кислоти, яка входить до складу згаданої в'яжучими речовинами. Зазначені рН-незалежні в'яжучої речовини. Однак перевага надається вав'яжучі речовини містяться у лікарській формі за ріанту, за яким рівень нейтралізації становить від цим винаходом у кількості, яка складає від прибприблизно 3% до 6%. лизно 1% (мас) до приблизно 10% (мас), за переЛікарські форми пролонгованої дії можуть місважним варіантом від приблизно 1% (мас) до притить також фармацевтичні наповнювачі, ретельно близно 3% (мас), та за найпереважнішим змішані з ранолазином та рН-залежною в'яжучою варіантом приблизно 2,0% (мас). речовиною. Фармацевтично прийнятні наповнюваЯк показано у Таблиці 1, ранолазин є відносно чі можуть включати, наприклад, рН-незалежні в'янерозчинним у водних розчинниках, рН яких пережучі або плівкотвірні речовини, наприклад, гідроквищує приблизно 6,5, у той час як розчинність посипропілметилцелюлозу, гідроксипропілцелюлозу, чинає різко зростати при рівнях рН, нижчих за метилцелюлозу, полівінілпіролідон, нейтральні приблизно 6. полі(мет)акрилатні ефіри (наприклад, співполімери метилметакрилату/етилакрилату, які продаються Таблиця 1 під товарним знаком Eudragit® NE компанією Rohm Pharma), крохмаль, желатину, цукри, карбоксимеРозчинтилцелюлозу тощо. Іншими придатними фармацеКлас розчинності за рН розчину ність втичними наповнювачами є розріджувачі, наприфармакопеєю США (мг/мл) клад, лактоза, маніт, сухий крохмаль, 4,81 161 Добре розчинний мікрокристалічна целюлоза тощо; поверхнево4,89 73,8 Розчинний активні речовини, наприклад, ефіри поліоксіетиле4,90 76,4 Розчинний нсорбітану, ефіри сорбітану тощо; а також барвни5,04 49,4 Розчинний ки та коригенти. Факультативно присутніми є також 5,35 16,7 Помірно розчинний змащувальні речовини (наприклад, тальк та маг5,82 5,48 Слабкорозчинний нію стеарат) та інші компоненти, які сприяють таб6,46 1,63 Слабкорозчинний летуванню. 6,73 0,83 Дуже слабкорозчинний 7,08 0,39 Дуже слабкорозчинний Уміст ранолазину у лікарських формах рано7,59 Незабуферена вода 0,24 Дуже слабкорозчинний лазину пролонгованої дії за цим винаходом стано7,73 0,17 Дуже слабкорозчинний вить від приблизно 50% (мас.) до приблизно 95% 12,66 0,18 Дуже слабкорозчинний (мас.) або більше, за більш переважним варіантом від приблизно 70% (мас.) до приблизно 90% (мас), Підвищення вмісту рН-залежної в'яжучої речота за найпереважнішим варіантом від приблизно вини у лікарській формі зменшує швидкість виві70% (мас.) до приблизно 80% (мас); уміст рНльнення ранолазину із зазначеної лікарської форзалежної в'яжучої речовини становить від 5% до ми при рівні рН, нижчому за 4,5, який є типовим 40%, за більш переважним варіантом від 5% до рівнем рН шлунка. Кишковорозчинна оболонка, 25%, та за найпереважнішим варіантом від 5% до яка утворюється цією в'яжучою речовиною, є менш 15%; у той час як рештою дозованої лікарської розчинною та збільшує відносну швидкість вивільформи є рН-незалежні в'яжучі речовини, заповню 11 75027 12 вачі та інші факультативні наповнювачі. за цим винаходом, яким віддається особлива пеЛікарські форми ранолазину пролонгованої дії ревага, мають такий склад: Інгредієнт Ранолазин Мікрокристалічна целюлоза (заповнювач) Співполімер метакрилової кислоти Натрію гідроксид Гідроксипропілметилцелюлоза Магнію стеарат Масовий діапазон, Переважний діа% пазон, % 50-95 70-90 1-35 5-15 1-35 5-12,5 0,1-1,0 0,2-0,6 0,5-5,0 1-3 0,5-5,0 1-3 Лікарські форми ранолазину пролонгованої дії за цим винаходом одержують таким чином: ранолазин та рН-залежну в'яжучу речовину та будь-які факультативні наповнювачі ретельно перемішують (піддають сухій гомогенізації). Після цього суміш, яку було одержано шляхом сухої гомогенізації, гранулюють у присутності водного розчину сильної основи, який розбризкують на гомогенізований порошок. Одержаний гранулят сушать, просівають, змішують із факультативними змащувальними речовинами (наприклад, тальком або магнію стеаратом) та пресують з одержанням таблеток. Переважними водними розчинами сильних основ є розчини гідроксидів лужних металів, наприклад, гідроксиду натрію або калію, за переважним варіантом гідроксиду натрію, у воді (до складу яких факультативно входить до 25% розчинників, які змішуються з водою, наприклад, нижчих спиртів). Одержані таблетки, до складу яких входить ранолазин, можуть вкриватися факультативною плівкотвірною речовиною, для ідентифікації, з метою маскування смаку та для полегшення ковтання. Кількість цієї плівкотвірної речовини як правило становитиме від приблизно 2% до 4% від маси згаданої таблетки. Придатні плівкотвірні речовини є добре відомими у цій галузі і до них належать гідроксипропілметилцелюлоза, катіонні співполімери метакрилату (співполімери диметиламіноетилметакрилату/метилбутил-метакрилатуEudragit®-компанія Rohm Pharma) тощо. Плівкотвірні речовини можуть факультативно містити барвники, пластифікатори та інші додаткові складові. Твердість одержаних пресованих таблеток за переважним варіантом є достатньою для того, щоб витримувати стиснення у 8КПа. Розмір таблетки буде залежати, головним чином, від кількості ранолазину у таблетці. Таблеток будуть містити від 300мг до 1100мг ранолазину у вигляді вільної основи. За переважним варіантом таблетки будуть містити ранолазин у кількості від 400мг до 600мг, від 650мг до 850мг та від 900мг до 1100мг (у вигляді вільної основи). Для впливання на швидкість розчинення регулюють час, впродовж якого здійснюється змішування вологим способом порошку, до складу якого входить ранолазин. За переважним варіантом загальний час змішування порошку, тобто час, впродовж якого згаданий порошок піддають впливу розчину гідроксиду натрію, буде становити 1-10хв., за переважним варіантом - 2-5хв. Після завершення гранулювання одержані частинки видаляють з гранулятора та вміщують до сушарки з псевдозрідженим шаром для сушіння при температурі приб Найпереважніший діапазон, % 75 10,6 10,0 0,4 2,0 2,0 лизно 60°С. Несподівано виявилося, що за допомогою згаданих способів одержують лікарські форми ранолазину пролонгованої дії, які забезпечують більш низькі пікові рівні ранолазину у плазмі, та, при цьому, такі рівні концентрації ранолазину у плазмі, які залишаються ефективними впродовж 12год. і більше після введення, у разі використання ранолазину у вигляді вільної основи, а не більш фармацевтично традиційної дигідрохлоридної солі ранолазину або іншої солі або ефіру. Використання ранолазину у вигляді вільної основи забезпечує принаймні одну перевагу: уміст ранолазину у згаданій таблетці може бути підвищений, оскільки молекулярна маса ранолазину у вигляді вільної основи становить лише 85% від молекулярної маси ранолазину дигідрохлориду. Таким чином, забезпечується доставка ефективної кількості ранолазину з одночасним зменшенням фізичного розміру дозованої лікарської форми. Інша перевага лікарських форм ранолазину пролонгованої дії за цим винаходом полягає у тому, що їх одержують за допомогою процесу, який використовує як розчинник по суті лише воду, та для свого здійснення потребує лише стандартних фармацевтичних способів обробки та обладнання. Лікарські форми ранолазину пролонгованої дії за цим винаходом можна застосовувати для лікування серцево-судинних хвороб, у тому числі аритмій, різновидів стенокардії, стенокардії напруження та інфаркту міокарда; лікування тканин, які зазнали фізичного або хімічного пошкодження, у тому числі кардіоплегії, гіпоксичного або реперфузійного пошкодження серцевих або скелетних м'язів або тканин головного мозку та ішемії; та хвороб периферичних артерій, наприклад, переміжного кульгання. За найпереважнішим варіантом згадана дозована лікарська форма пролонгованої дії застосовується як протистенокардійний засіб для ссавців, за найпереважнішим варіантом - як протистенокардійний засіб для людей. Пероральні дозовані лікарські форми ранолазину пролонгованої дії за цим винаходом уводяться один раз, двічі або тричі впродовж 24-годинного періоду з метою підтримання рівня ранолазину у плазмі (який перевищує пороговий терапевтичний рівень та є нижчим за максимальні стерпні рівні), який становить від приблизно 550 (нг основи)/мл до 7500 (нг основи)/мл у пацієнта. Це відповідає кількості дигідрохлориду ранолазину у межах від приблизно 644нг/мл до приблизно 8782нг/мл. На додаток до цього, графік (у часі) перорального введення дозованих пероральних лікарських форм ранолазину повинен контролюватись таким чином, 13 75027 14 щоб рівень ранолазину у плазмі не перевищував на увазі: приблизно 7500 (нг основи)/мл та, за переважним (1) Пероральні дози лікарської форми негайноваріантом, щоб рівень ранолазину у плазмі не пего вивільнення (IR) вводилися у вигляді капсул або ревищував приблизно 5000 (нг основи)/мл та, за таблеток дигідрохлоридної солі та виражені у винайпереважнішим варіантом, щоб він не перевигляді дигідрохлоридної солі. щував 3800 (нг основи)/мл. У деяких випадках (2) Пероральні дози лікарської форми пролонефективним може виявитись обмеження пікового гованої дії (SR) вводилися у вигляді таблеток осрівня ранолазину у плазмі на рівні, який не перенови ранолазину та виражені у вигляді основи. вищує приблизно 2800 (нг основи)/мл. У той же (3) У разі порівняння лікарських форм негайної час, залишкові рівні ранолазину у плазмі не пота пролонгованої дії впродовж одного дослідженвинні за переважним варіантом бути нижчими за ня, дози виражають як у вигляді основи, так і у 1000 (нг основи)/мл, та, у деяких випадках, не повигляді дигідрохлоридної солі. Коефіцієнт переховинні падати нижче 1700 (нг основи)/мл. ду від дигідрохлоридної солі до основи становить З метою забезпечення переважного рівня ра0,854 (наприклад, 400мг дигідрохлоридної солі нолазину у плазмі у межах від приблизно 1000 (нг 0,854=еквівалент 342мг вільної основи). основи)/мл до приблизно 3800 (нг основи)/мл пе(4) Усі рівні у плазмі та фармакокінетичні паревага надається одно- або дворазовому введенраметри виражають як рівні вільної основи. ню впродовж дня згаданих дозованих пероральних ПРИКЛАД 1 лікарських форм ранолазину. У разі, коли згадані У цьому Прикладі наведено опис способу одедозовані лікарські форми вводяться двічі на добу, ржання лікарських форм ранолазину негайного перевага віддається тому, щоб згадані дозовані вивільнення (IR). Ранолазину дигідрохлорид пероральні лікарські форми ранолазину вводились (4000г), мікрокристалічну целюлозу (650г), полівіз приблизно дванадцятигодинними інтервалами. нілпіролідон (100г) та кроскармелозу натрію (100г) На додаток до одержання та введення дозоу вигляді порошків ретельно змішували за допомованих пероральних лікарських форм пролонговагою мішалки-гранулятору Fielder PMA 65, після ної дії за цим винаходом таким чином, що забезчого додавали достатню кількість води з переміпечується контролювання рівнів ранолазину у шуванням з одержанням грануляту. Одержаний плазмі, важливо також звести до мінімуму різницю гранулят сушили на сушарці з псевдозрідженим між піковими та залишковими рівнями ранолазину шаром Aeromatic Strea-5, просіювали та змішували у плазмі. Пікові рівні ранолазину у плазмі досягазі стеаратом магнію (100г). Одержану суміш уміються, як правило, через приблизно 30хв.-8год. щували у тверді желатинові капсули. Маса вмісту або більше після початкового уведення дозованої становила, наприклад, 500мг на капсулу для оделікарської форми, у той час як залишкові рівні раржання дози 400мг ранолазину дигідрохлориду нолазину у плазмі досягаються приблизно під час (еквівалент 342мг ранолазину у вигляді вільної уведення наступної запланованої за графіком увеоснови) на капсулу. Маса вмісту, однак, може піддення дозованої лікарської форми. Перевага набиратись для одержання від 30мг до 400мг ранодається тому, щоб дозовані лікарські форми пролазину дигідрохлориду. лонгованої дії за цим винаходом вводились у ПРИКЛАД 2 такий спосіб, який забезпечував би одержання У цьому Прикладі наведено опис способу одепікового рівня ранолазину, який перевищував би ржання лікарських форм ранолазину пролонговазалишковий рівень ранолазину не більше, ніж у 8 ної дії (SR). разів, за переважним варіантом - не більше, ніж у Лікарську форму пролонгованої дії (SR), яку 4 рази, та за найпереважнішим варіантом - не бібуло позначено як лікарську форму пролонгованої льше, ніж у 2 рази. дії А і яка містила рН-залежні та рН-незалежні в'яЛікарські форми ранолазину пролонгованої дії жучі речовини, було одержано шляхом ретельного за цим винаходом забезпечують терапевтичну перемішування ранолазину (2500г), співполімеру перевагу, яка полягає у зведенні до мінімуму кометакрилової кислоти Типу С (Eudragit® L100-55ливань концентрації ранолазину у плазмі та робRohm Pharma) (1000г), мікрокристалічної целюлолять можливим уведення щонайбільше двічі на зи (Avicel®) (100г) та полівінілпіролідону (710г) у добу. Згадана лікарська форма може вводитись вигляді порошків за допомогою мішалкисамостійно або (щонайменше спочатку) у поєдгранулятора Fielder PMA 65. Одержану суміш грананні з лікарською формою негайного вивільнення, нулювали з розчином гідроксиду натрію (40г) у у разі необхідності швидкого досягнення терапевводі; до вологої маси додавали 30% водну диспетично ефективної концентрації ранолазину у пларсію співполімеру метилметакрилазмі, або у вигляді розчинних лікарських форм для ту/етилакрилату (Eudragit® NE 30 D-Rohm Pharma) інтравенозного введення та дозованих перораль(1667г). Одержаний гранулят сушили на сушарці з них лікарських форм. псевдозрідженим шаром Aeromatic Strea-5, просіНаведені далі Приклади є характерними для ювали та змішували з кроскармелозою натрію цього винаходу, але не повинні розглядатись як (100г) та стеаратом магнію (50г). Одержану суміш такі, що обмежують обсяг формули винаходу. пресували за допомогою таблетувального преса ПРИКЛАДИ Manesty В з одержання таблеток масою 684мг. У цих прикладах наведено докладний опис Кожна таблетка містила ранолазин у вигляді вільспособів одержання дозованих форм ранолазину, ної основи у дозі 342мг. Цю лікарську форму було а також експериментів, які було здійснено для випозначено як лікарську форму пролонгованої дії А. значення ефективності. Лікарську форму пролонгованої дії В було Під час розглядання цих Прикладів слід мати одержано таким само чином, як і лікарську форму 15 75027 16 пролонгованої дії А, за виключенням того, що кільміру до типового рівня від 2% (мас.) до 4% (мас). кість Eudragit® L100-55 було зменшено до 500г, a k) Відполірувати за допомогою карнаубського Eudragit® NE 30 D було замінено на 40% водну воску із застосуванням типового рівня від 0,002% дисперсію співполімеру метилметакрилату/етил(мас.) до 0,003% (мас). акрилату (Eudragit® NE 40 D-Rohm Pharma) ПРИКЛАД 3 (2500г). Одержана лікарська форма пролонгованої У цьому Прикладі узагальнено результати додії містила 342мг ранолазину у вигляді вільної осслідження, які було опубліковано у Circulation нови на таблетку. 90:726-734 (1994), які демонструють неефективПід час одержання лікарської форми пролонність застосування ранолазину як протистенокаргованої дії С ранолазин у формі вільної основи дійного та протиішемічного засобу у разі введення (342мг) змішували з мікрокристалічною целюлоу вигляді лікарської форми негайного вивільнення зою та полівінілпіролідиноном K25, гранулювали з Прикладу 1. водою, сушили та змішували з кроскармелозою У згаданому дослідженні приймали участь панатрію та стеаратом магнію. Одержану гомогеніцієнти зі стійкою стенокардією. Після медичного зовану суміш пресували з одержанням таблеток та обстеження пацієнтами було припинено застосувкривали кишковорозчинною оболонкою. вання будь-яких попередньо призначених протисЛікарську форму пролонгованої дії D, що містенокардійних лікарських засобів. 319 пацієнтів тить лише рН-залежну в'яжучу речовину, було одержували плацебо за одноразовим сліпим меодержано поєднанням ранолазину (7500г), тодом упродовж 18 днів, та 318 пацієнтів було поEudragit® L100-55 (1000г), гідроксипропілметилцезбавлено навантаження унаслідок появи симптолюлози (джерело-Methocel® E5) (200г) та мікрокмів стенокардії помірної тяжкості та ішемії ристалічної целюлози (Avicel®) (1060г) шляхом серцевого м'яза ( 1мм зниження сегмента S-T). ретельного перемішування. Згадані змішані пороПацієнтів довільно розбили на чотири експеримешки гранулювали з розчином гідроксиду натрію нтальні групи і їм уводили: дигідрохлорид ранола(40г) у воді (від 1900г до 2500г). Одержаний гранузину, 30мг, тричі на добу (n=81); дигідрохлорид лят сушили та просіювали, змішували зі стеаратом ранолазину, 60мг, тричі на добу (n=81); дигідрохмагнію (200г) та пресували з одержанням, наприлорид ранолазину, 120мг, тричі на добу (n=78); та клад, таблеток масою 667мг для одержання дози плацебо тричі на добу (n=79). Після введення 500мг ранолазину у вигляді вільної основи на таб30мг, 60мг та 120мг доз тричі на добу, середні пілетку. На згадані таблетки за допомогою машини кові концентрації ранолазину у вигляді вільної осдля вкривання оболонкою Accelacota® (із цилінднови у плазмі через 1год. після введення дози ричним 24 дюймовим (609,59мм) піддоном) наностановили 94нг/мл, 219нг/мл та 510нг/мл, відповісили оболонку шляхом розпилювання плівкоутводно, та середні залишкові концентрації у плазмі рювального розчину OPADRY із 2-4% збільшенням через 8год. після введення дози становили ваги. Згадані плівкоутворювальні покривні розчини 18нг/мл, 37нг/мл та 90нг/мл, відповідно. OPADRY різноманітних кольорів постачаються Після 4-тижневої фази за дворазовим сліпим компанією Colorcon, West Point, штат Пенсільванія. методом випробування на фізичне навантаження з Поетапна процедура одержання лікарської обмеженням унаслідок появи симптомів було поформи пролонгованої дії D має такий вигляд: вторено через 1год. (визначення пікового рівня) та a) За допомогою відповідної мішалки змішати 8год. (визначення залишкового рівня) після вверанолазин, мікрокристалічну целюлозу, співполідення експериментального лікарського засобу. мер метакрилату (Тип С) та гідроксипропілметилЗагальна тривалість фізичного навантаження при целюлозу. базовому рівні (± середня квадратична помилка b) В очищеній воді розчинити гідроксид натрію. середнього) становила 5,9хв.±0,2хв. для групи, яка c) До згаданої суміші з постійним перемішуодержувала плацебо, та 6,4хв.±0,3хв., ванням повільно додати розчин гідроксиду натрію 5,9хв.±0,3хв. та 6,6хв.±0,2хв. для груп, які одержуіз застосуванням відповідного грануляційного обвали ранолазин у дозі 30мг, 60мг та 120мг, відполаднання. відно (Р= кількість симптомів, які проявляються). d) Продовжувати перемішування для одерПісля 4 тижнів лікування за дворазовим сліпим жання ретельно перемішаної суміші. У разі необметодом, порівняно до вихідних значень, через хідності додати додаткову аліквоту води. 1год. після введення експериментального лікарсьe) Здійснити гранулювання сухим способом на кого засобу (піковий ефект), загальна тривалість сушарці з псевдозрідженим шаром. фізичного навантаження (± середня квадратична f) Просіяти сухі гранули через відповідний помилка середнього) зросла на 0,45хв.±0,2хв. у млин. групі, яка одержувала плацебо, та на 0,3хв.±0,2хв., g) До просіяних гранул додати стеарат магнію 0,6хв.±0,2хв. та 0,5хв.±0,2хв. у групах, які одержута перемішати. вали ранолазин у дозі 30мг, 60мг та 120мг, відпоh) У разі необхідності пропустити одержаний відно (плацебо порівняно до ранолазину, Р= кільгранульований матеріал через ультразвуковий кість симптомів, які проявляються). Періоди часу дезінтегратор з охолодженням. до 1мм зниження сегмента S-T при вихідному рівні і) За допомогою обладнання відповідного розбули подібними у чотирьох групах та, після 4 тижміру шляхом пресування одержати з гранул табнів лікування у кожній групі, значно підвищились летки. на однаковий рівень через 1год. після введення j) Диспергувати порошок OPADRY у воді та згаданих лікарських засобів. Подібні ж зміни спонанести плівкову оболонкою за допомогою обладстерігались відносно моменту появи симптомів нання для вкривання оболонкою відповідного розстенокардії. Через 8год. після введення (залишко 17 75027 18 вий ефект) між групами, які одержували плацебо серця. Іншими критеріями виключення була нета ранолазин, не спостерігалось різниць ні за застійка стенокардія або інфаркт міокарда під час 3 гальним часом фізичних навантажень, ні за будьпопередніх місяців, серцева недостатність, віднеякими іншими змінними фізичних навантажень. сена до Класу III або IV за визначенням ньюПорівняно до вихідних значень, кількість нападів йоркської асоціації кардіологів, суттєвий порок стенокардії впродовж тижня та кількість і триваклапана серця або вроджений порок серця, які не лість ішемічних епізодів впродовж 48-годинного піддавались коригуванню, потреба у дигоксиновій спостереження за Холтером (Holter) значно зменабо тривалій нітратній терапії, лабільний цукровий шились на однакові величини у групах, які одердіабет або інші серйозні захворювання, які могли б жували плацебо та ранолазин. негативно вплинути на подальшу оцінку. Ці результати вказують на те, що лікування Згадані лікарські форми дигідрохлориду ранодигідрохлоридом ранолазину у дозі 30мг, 60мг та лазину негайного вивільнення (267мг тричі на до120мг тричі на добу не забезпечувало ніяких перебу, 400мг двічі на добу, 400мг тричі на добу) та ваг порівняно до плацебо. Результати згаданого плацебо вводили впродовж фази лікування. Пацідослідження також не показали позитивного вплиєнти приймали одну капсулу, яка вміщувала 267мг ву подібних доз ранолазину ні на ішемію серцевоабо 400мг дигідрохлориду ранолазину або плацего м'яза, ні на ефективність фізичних навантажень, бо о 8:00 ранку, 4:00 після обіду, 8:00 після обіду ні на напади стенокардії впродовж одноденного та 12:00 ранку. Усі капсули за зовнішнім виглядом періоду життя пацієнтів зі стенокардією. були ідентичними. Пацієнтів довільно розподіляли ПРИКЛАД 4 до 1 з 4 послідовностей лікування; на кожну посліУ цьому Прикладі оцінювали безпечність та довність припадало по 25% пацієнтів. Кожну обропротиішемічні ефекти високих рівнів ранолазину у бку здійснювали впродовж 1 тижня; одну обробку плазмі на великій групі пацієнтів зі стенокардією та повторювали впродовж п'ятого 1-тижневого періотривалість будь-яких ефектів при стабільному ду. введенні доз за схемою двократного та трикратноДля визначення придатності пацієнтів, які одего введення лікарського засобу. У цьому Прикладі ржували свої звичайні протистенокардійні лікарські пацієнтів із хронічною стійкою стенокардією, які засоби, піддавали відбірковому випробуванню на реагували на традиційні протистенокардійні лікарфізичне навантаження на тупчаку (ЕТТ-1) за моські засоби, лікували за трьома схемами прийнятдифікованим за способом Брюса (Bruce) протокотя дигідрохлориду ранолазину: 267мг тричі на долом Шеффідда (Sheffield). У разі, коли час до побу, 400мг двічі на добу та 400мг тричі на добу чатку нападу стенокардії був 3хв., але 13хв., лікарської форми негайного вивільнення Прикладу прийняття протистенокардійного лікарського засо1. Параметри випробування на фізичне навантабу припиняли та розпочинали введення плацебо ження та концентрації ранолазину у вигляді вільза одноразовим сліпим методом. Через 1-2 тижні ної основи визначали при пікових та залишкових пацієнтів знову піддавали ще одному випробуванрівнях у плазмі. ню на фізичне навантаження на тупчаку (ЕТТ-2). У Методи разі, якщо час до початку нападу стенокардії змеЦе дослідження представляло собою плаценшувався на 1хв. порівняно до ЕТТ-1, вважали, що бо-контрольовану фазу лікування з довільним розгаданий пацієнт пройшов перше кваліфікаційне зподіленням за дворазовим сліпим методом із випробування на фізичне навантаження на тупчачотирма різновидами лікування (плацебо, дигідроку (ЕТТ). У разі, якщо скорочення часу до початку хлорид ранолазину, 400мг двічі на добу, дигідрохнападу стенокардії було не більше 1хв., могли лорид ранолазину, 267мг тричі на добу та дигідроприпинити введення другого протистенокардійного хлорид ранолазину, 400мг тричі на добу), чотирма лікарського засобу та повторити вищезгадану поспослідовностями лікування та п'ятьма періодами лідовність. У разі необхідності за цією процедурою лікування за подвійним сліпим методом упродовж для визначення придатності пацієнта могли притривалого періоду часу за схемою введення за пинити введення третього протистенокардійного латинським квадратом пацієнтів із попередньо лікарського засобу. Нітрати тривалої дії завжди встановленим діагнозом, які реагували на відомі відміняли першими; пацієнтам, які не одержували протистенокардійні методи лікування та мали станітратів тривалої дії, відміняли введення бетабільний час фізичного навантаження. блокаторів та антагоністів кальцію у будь-якій посКандидатами вважались пацієнти-люди з хролідовності. Пацієнтів, які пройшли перше кваліфінічною стійкою стенокардією тривалістю щонайкаційне ЕТТ (ЕТТ-2), піддавали другому кваліфікаменше 3 місяці, які реагували на традиційні протиційному ЕТТ (ЕТТ-3), під час якого згаданий час до стенокардійні методи лікування. На додаток до початку нападу стенокардії повинен був знаходицього, пацієнти повинні були мати електрокардіогтись у межах ±15% від часу, який спостерігався під рафічне (ECG) підтвердження індукованої наванчас ЕТТ-2. На додаток до цього, під час кожного зі таженням ішемії, виходячи з горизонтального або згаданих кваліфікаційних ЕТТ повинні були реєстспрямованого донизу зниження сегмента S-T 1мм, руватися електрокардіографічні симптоми ішемії яке зберігалось впродовж 3 послідовних скорочень (горизонтальне або спрямоване донизу зниження серця під час випробування на стресове навантасегменту S-T 1мм упродовж 3 послідовних скороження, та електрокардіограму, яка не перешкочень серця). У дослідженні приймали участь паціджала тлумаченню змін сегмента S-T. Останній єнти, які задовольняли згаданим критеріям. критерій конкретно виключав пацієнтів із гіпертроПісля кожного 1-тижневого періоду пацієнти фією лівого шлуночка, передзбудженням, порувранці повертались до лабораторії, де здійснювашенням провідності або ритмом синусового вузла лось випробування на фізичне навантаження, що 19 75027 20 найменше через 1год. після легкого сніданку для пу випробування, на початку нападу стенокардії, проведення ЕТТ. Це випробування було позначепід час максимального фізичного навантаження та но як залишкове ЕТТ; залишковим ЕТТ кожен папід час відновлення (кожної хвилини впродовж цієнт піддавався у один і тойже самий час дня. 4хв., потім кожні 5хв., доки значення не повертаПісля завершення залишкового ЕТТ кожен пацієнт лись до вихідного рівня). Частоту серцевих скороіз витяжної прозорої упаковки за сліпим методом чень також постійно контролювали і стандартні одержував наступний запланований лікарський електрокардіограми у 12 відведеннях робили беззасіб, який застосовувався цього тижня. Інше ЕТТ посередньо перед фізичним навантаженням із здійснювали через 1 год після введеної дози. Це пацієнтом, який стояв на тупчаку, у кінці кожного ЕТТ було позначено як пікове ЕТТ. Проби крові етапу фізичного навантаження, під час максимавідбирали при залишкових (приблизно через 8 год льно стерпного фізичного навантаження та на мопісля введення дози лікарського засобу) та при мент завершення фізичного навантаження. пікових (через 1год. після введення дози лікарсьУ наведеній нижче Таблиці 2 вказаний середкого засобу) концентраціях. Під час здійснення ній час фізичного навантаження на тупчаку для 3 згаданого дослідження регулярно проводили інші необхідних змінних фізичного навантаження під стандартні лабораторні тести. час уведення плацебо та впродовж схем прийнятТиск крові (манжета сфігмоманометру) та частя лікарського засобу у різних дозах (ранолазинтоту серцевих скорочень визначали перед усіма плацебо). ЕТТ, під час ЕТТ, на останній хвилині кожного етаТаблиця 2 Дані випробувань на фізичне навантаження для усіх пацієнтів при максимальній та залишковій концентраціях Обробка Середня змінна фізичного навантаження (усі пацієнти, хв.) Час до початку нападу стенокардії Тривалість фізичного навантаження Час до 1мм зниження сегмента S-T Плацебо, Ранолазин, Ранолазин, Ранолазин, подвійний 400мг, 267мг, 400мг, сліпий метод двічі на добу тричі на добу тричі на добу Пікова концентрація 9,01 9,33 9,40 9,33 Залишкова концентрація 8,58 8,77 8,78 8,65 Пікова концентрація 10,67 10,83 10,87 10,84 Залишкова концентрація 10,50 10,55 10,56 10,60 Пікова концентрація 9,58 9,86 9,99 9,94 Залишкова концентрація 9,04 9,22 9,22 9,31 Під час пікових концентрацій ранолазину у плазмі, усі параметри ЕТТ при ішемії збільшились порівняно до плацебо і, найбільш наглядно, час до початку 1мм зниження сегмента S-T. Під час аналізу усіх пацієнтів, збільшення часу до початку нападу стенокардії, порівняно до плацебо, коливалось у межах від 0,32хв. до 0,39хв. (р 0,01), та час до початку 1мм зниження сегмента S-T коливався у межах від 0,28хв. до 0,41хв. (р 0,02) для кожної з 3 схем прийняття ранолазину та усіх змішаних схем. Крім того, загальна тривалість фізичного навантаження значно зросла для усіх змішаних схем і для кожної схеми прийняття лікарського засобу спостерігались тенденції однакового напрямку та величини. За результатами аналізу кожного протоколу, кожен з 3 параметрів ЕТТ збільшився (р 0,01) для усіх змішаних схем прийняття ранолазину. Усі окремі схеми прийняття ранолазину значно подовжили час до 1мм зниження сегмента S-T; щодо часу до початку нападу стенокардії та тривалості фізичного навантаження, було визначено незначні тенденції подібного напрямку та пропорцій. Узагалі, результати аналізу кожного протоколу, за виключенням величини ефекту, видавались дещо більшими у разі монотерапії. При залишкових концентраціях у плазмі, ранолазин мав менший ефект на параметри ЕТТ. Результати аналізу усіх пацієнтів та кожного протоколу були відносно постійними та демонстрували тенденцію до підвищення часу фізичного навантаження. Однак рівня статистичної значущості дося гнув лише час до 1мм зниження сегменту S-T для усіх змішаних схем прийняття ранолазину при аналізі усіх пацієнтів. Зважаючи на більш виражене підвищення параметрів фізичного навантаження, яке спостерігалось у разі монотерапії ранолазином, аналізу було піддано реакції на ранолазин серед пацієнтів, які одночасно одержували різні протистенокардійні лікарські засоби. Цим аналізам post-hoc було піддано дані, які було одержано при максимальній концентрації ранолазину, коли найбільш очевидними були ефекти поліпшення часу фізичного навантаження. Оскільки на кваліфікаційному етапі за одноразовим сліпим методом було, у першу чергу, припинено введення нітратів тривалої дії, на етапі лікування за дворазовим сліпим методом пацієнти, які приймають нітрати тривалої дії, участі не приймали. З-посеред пацієнтів із даними пікової ефективності, 34% (107/312) пацієнтів під час обробки за дворазовим сліпим методом одержували бетаблокатори та 24% (75/312) одержували антагоністи кальцію. Параметри випробувань на фізичне навантаження поліпшились при пікових концентраціях ранолазину (ранолазин-плацебо) незалежно від того, одержували пацієнти бета-блокатори або ні. Ці поліпшення були дещо більшими за величиною у 205 пацієнтів, які не одержували бета-блокаторів, порівняно до 107 пацієнтів, які одержували бетаблокатори. Однак різниці між пацієнтами, які одержували бета-блокатори, та пацієнтами, які бета 21 75027 22 блокатори не одержували, не досягли рівня статиіз фізичного навантаження пацієнтів, які приймали стичної значущості для жодного параметра фізичантагоністи кальцію, порівняно до пацієнтів, які ного навантаження. У пацієнтів, які не одержували антагоністів кальцію не приймали, було одержано бета-блокаторів, усі параметри фізичного наванподібні ж результати. таження значно поліпшились при кожній з 3 схем У наведеній нижче Таблиці 3 узагальнено сеприйняття ранолазину, а також у разі усіх змішаредні пікові та залишкові концентрації ранолазину них схем прийняття ранолазину. Подібні тенденції у плазмі у одиницях, відповідних основі дигідрохспостерігались у меншої кількості пацієнтів, які лориду ранолазину для усіх пацієнтів за статтю та одержували бета-блокатори. Під час аналізу даних для кожної схеми прийняття лікарського засобу. Таблиця 3 Середні (± середнє квадратичне відхилення) концентрації ранолазину у плазмі за схемою прийняття лікарського засобу Усі пацієнти Чоловіки Жінки Усі пацієнти Чоловіки Жінки Ранолазин, 400мг, двічі на добу Ранолазин, 267мг, тричі на добу Ранолазин, 400мг, тричі на добу Пікова концентрація (нг/мл) 1882 (1094) 1346 (823) 2128 (1198) 1762 (999) 1261 (774) 1917 (1046) 2171 (1253) 1594 (904) 2654 (1385) Залишкова концентрація (нг/мл) 235 (288) 316 (336) 514 (500) 235 (264) 316 (336) 518 (494) 235 (342) 316 (340) 505 (517) Середні пікові концентрації у плазмі коливались у межах від 1346нг/мл до 2128нг/мл ранолазину у вигляді вільної основи. Схему прийняття 400мг тричі на добу пов'язували з найвищими концентраціями ранолазину у плазмі. Середні залишкові концентрації ранолазину у плазмі коливались у межах від 235нг/мл до 514нг/мл. Середні пікові концентрації ранолазину у плазмі були дещо вищими у жінок, аніж у чоловіків, однак у разі залишкових концентрацій очевидних різниць концентрацій у плазмі за статтю не спостерігалось. При пікових концентраціях ранолазину у плазмі, статистично значущих різниць між будь-якими схемами прийняття ранолазину та плацебо для подвійного продукту не спостерігалось. Подібним же чином, при залишкових концентраціях ранолазину у плазмі, статистично значущих різниць серед 3 схем прийняття ранолазину та плацебо за результатами аналізу кожного протоколу для подвійного продукту у положенні стоячи або під час максимального фізичного навантаження не спостерігалось. Результати цього дослідження дозволяють припустити, що ранолазин є ефективною протистенокардійною та протиішемічною сполукою у пацієнтів із хронічною стійкою стенокардією. При пікових концентраціях у плазмі три схеми прийняття ранолазину забезпечували підвищений час до початку нападу стенокардії та тривалість фізичного навантаження, а також час до 1мм зниження сегмента S-T, який дорівнював у середньому приблизно 0,33хв., порівняно до часу, який спостерігався у разі плацебо. Поліпшення параметрів фізичного навантаження спостерігалось у цьому дослідженні не лише у пацієнтів, які одночасно одержували протистенокардійні лікарські засоби (наприклад, бета-блокатори та антагоністи кальцію), але також і у підгрупі, яка піддавалась лише монотерапії ранолазином. В останніх згаданих пацієнтів ефект лікування видавався дещо більшим за величиною. Це дозволяє зробити припущення, що ранолазин може також бути придатним для здійснення монотерапії у пацієнтів із хронічною стійкою стенокардією. Гемодинамічні дані вказують на те, що поліпшення параметрів фізичного навантаження при пікових концентраціях ранолазину у плазмі не пов'язувалось зі змінами тиску крові або частоти серцевих скорочень. Негемодинамічний механізм дії ранолазину, таким чином, відрізняється від механізму дії інших протистенокардійних лікарських засобів, які знаходяться зараз у клінічному застосуванні. Найважливіше полягає у тому, що нами було задокументовано те, що протистенокардійний та протиішемічний впливи препарату ранолазину негайного вивільнення, яка піддавалась дослідженню, не зберігалися впродовж інтервалів між прийняттям цього препарату. Незважаючи на те що час до початку зниження сегмента S-T ішемічного типу було значно подовжено та спостерігались тенденції подібного ж напрямку відносно інших параметрів ЕТТ, згаданий ефект був мінімальним при залишкових концентраціях ранолазину у плазмі. Середні пікові концентрації ранолазину у вигляді вільної основи у плазмі коливались у межах від 1346нг/мл до 2128нг/мл, у той час як середні залишкові концентрації у плазмі коливались у межах від 235нг/мл до 514нг/мл. Видається очевидним, що підвищені середні концентрації ранолазину у плазмі, які спостерігались при пікових концентраціях, пов'язуються з клінічно значущими протистенокардійними та протиішемічними ефектами, у той час як цього не спостерігалось у разі залишкових концентрацій. Виходячи з результатів цього експерименту ймовірно, що порогова концентрація ранолазину у вигляді вільної основи у плазмі для протиішемічної активності, яку було визначено під час ЕТТ, знаходиться вище за приблизно 550нг/мл. На додаток до цього, ймовірно, що концентрації ранолазину у плазмі повинні підтримуватись на згаданому пороговому рівні або вище цього рівня під час інтервалів між прийняттям лікарського засобу для забез 23 75027 24 печення протистенокардійної та протиішемічної фармакопеєю США із застосуванням 900мл 0,1М активності при фізичному навантаженні під час хлористоводневої кислоти як рідини для розчизгаданого інтервалу. нення, з метою імітування розчинення у шлунку. Ранолазин добре переносився при концентраТаблиця 4 ціях у плазмі, які було досягнуто під час здійснення цього дослідження. Частота виникнення побічних Відсоток розчинення лікарської форми ефектів не різнилась між схемами прийняття раЧас Лікарська форма нолазину та плацебо і не спостерігалось пов'яза(години) Негайного вивільнення А В С них із лікарським засобом змін електрокардіогра0,25 88,1 фічних інтервалів або комплексної морфології. На 0,5 100,5 13,9 17,6 17,5 додаток до цього, не спостерігалось клінічно зна1 101,7 19,9 26,0 25,7 чущих змін у концентраціях глюкози у крові, рівнях 2 27,8 47,5 35,9 ліпідів або результатах функціональних тестів пе4 39,0 69,2 48,4 чінки, що дозволяє зробити припущення про те, 8 52,4 90,1 64,7 що метаболічний ефект ранолазину не розповсю12 61,6 99,6 74,2 джується на системне регулювання глюкози або 24 80,8 105,6 95,4 ліпідний метаболізм. Ранолазин поліпшує параметри фізичного наРезультати, наведені в таблиці, показують, що вантаження без вираженого впливу на частоту у той час як лікарська форма негайного вивільненсерцевих скорочень та тиск крові у пацієнтів із ня повністю розчинилась впродовж не більше ніж хронічною стійкою стенокардією. Можливо, що для 0,5год. (як і очікувалось для лікарської форми невиявлення згаданих протистенокардійних та прогайного вивільнення), лікарські форми пролонготиішемічних ефектів необхідно одержати порогову ваної дії А, В та С демонстрували тривале розчиконцентрацію ранолазину у плазмі, яка перевищує нення при низькому рівні рН, що є бажаним для приблизно 550нг/мл. Ранолазин добре перенолікарської форми пролонгованої дії. ситься у широкому діапазоні концентрацій у плазII. Порівняння лікарської форми негайного вимі. Для повної оцінки цієї нової метаболічної конвільнення та лікарських форм пролонгованої дії А, цепції лікування ішемії необхідним є проведення В та С in vivo додаткових досліджень із більшими дозами препаРазові дози лікарської форми негайного вивірату пролонгованої дії. льнення, яку було одержано за Прикладом 1, та ПРИКЛАД 5 лікарської форми пролонгованої дії А та В, які було І. Порівняння лікарської форми негайного виодержано за Прикладом 2, вводили одинадцяти вільнення та лікарських форм пролонгованої дії in здоровим волонтерам та концентрації ранолазину vitro у вигляді вільної основи у плазмі згаданих волонЛікарську форму негайного вивільнення, яку терів визначали через 0хв., 20хв., 40хв., 60хв., було одержано за Прикладом 1, та лікарські фор90хв. та 120хв., кожної години до 6год, двічі на ми пролонгованої дії, які було одержано за Прикгодину до 18год. та через 24год. після введення ладами 2А-2С, піддавали випробуванню на при(лише лікарські форми пролонгованої дії). Одерладі для визначення розчинення Apparatus 2 за жані результати представлено у Таблиці 5: Таблиця 5 Лікарська форма Сmах (Середнє квадратичне відхилення) (нг/мл) Ctrough (Середнє квадратичне відхилення) (нг/мл) Тmax (Середнє квадратичне відхилення) (год.) AUC0-24 (Середнє квадратичне відхилення) (нг год./мл) Очевидним із Таблиці 5 є те, що лікарські форми пролонгованої дії А, В та С за цим винаходом демонструють такі властивості розчинності, які роблять їх придатними для введення ранолазину двічі на добу. ПРИКЛАД 6 У цьому Прикладі наведено опис "перевернутого" плану експерименту з одноразовою зростаючою дозою для оцінки безпечності та фармакокінетичного профілю одноразової пероральної дози лікарської форми пролонгованої дії ранолазину у вигляді основи Прикладу 2D. Людей розділили на Негайного вивільнення 1940 (807) 165 (111) 1,27 (0,5) 6530 А В С 753 (264) 657 (316) 925 (747) 158 (114) 182 (110) 290 (163) 4,09 (1,14) 4,05 (1,31) 6,55 (2,93) 5640 5280 5820 три групи. Група 1 одержувала лікарську форму пролонгованої дії ранолазину у дозі 500мг, 750мг та 1000мг. Група 2 одержувала лікарську форму пролонгованої дії ранолазину у дозі 1250мг та 1750мг. Група 3 одержувала лікарську форму пролонгованої дії ранолазину у дозі 1500мг та 2000мг. Кожна група мала також довільну фазу плацебо. Середні фармакокінетичні параметри після одноразових пероральних доз лікарської форми пролонгованої дії ранолазину докладно показані в Таблиці 6: 25 75027 26 Таблиця 6 Середні (± середнє квадратичне відхилення) фармакокінетичні параметри (n=8, за виключенням *, де n=7) Доза лікарської форми пролонгованої дії (мг) 500 750 1000 1250 1500 1750 2000 Група Сmax (нг/мл) Ctrough (нг/мл) Тmax (год.) AUC0-30год. (нг год./мл) 1 1 1* 2 3 2 3 883±353 1300±1060 1610±959 2210±716 1980±1050 3670±1570 2440±1120 382±251 455±353 695±438 943±541 1070±754 2400±1260 1640±937 4,63±1,19 4,25±0,886 5,71±2,14 6,21±3,52 4,75±0,886 5,25±2,31 5,21±2,30 9380±4250 12500±9000 18100±9630 25000±8090 25400±16000 49200±18200 35400±19100 Фармакокінетичні результати, які наведено у Таблиці 6, вказують на те, що ранолазин повільно вивільнювався з лікарської форми пролонгованої дії, унаслідок чого абсорбування ранолазину обмежувалось швидкістю розчинення. Наслідком цього були пролонговані профілі часової залежності концентрації лікарського засобу у плазмі, які спостерігались при усіх рівнях доз, причому пікові рівні у плазмі спостерігались через 4-6год. після введення дози лікарського засобу. У діапазоні доз від 500мг до 2000мг середні значення Сmах та AUC0-30год. зростали приблизно пропорційним до дози чином, хоча у межах Групи 2 спостерігалось деяке відхилення від пропорційності. ПРИКЛАД 7 У цьому Прикладі наведено докладний опис плацебо-контрольованого "перевернутого" плану експерименту на волонтерах за подвійним сліпим методом із багаторазовою зростаючою дозою для оцінки дворазового на добу введення дози лікарського засобу. Шість пацієнтів упродовж 4 днів одержували лікарську форму ранолазину пролонгованої дії, яку було одержано за Прикладом 2D, у дозі 500мг, 750мг та 1000мг двічі на добу, і з ранковою дозою на 5 день. Фармакокінетичні результати наведено у Таблиці 7: Таблиця 7 Фармакокінетичні параметри ранолазину на 5 день (середнє значення ± середнє квадратичне відхилення) Лікарська форма пролонгованої дії Лікарська форма пролонгованої дії Лікарська форма пролонгованої дії ранолазину, 500мг, двічі на добу ранолазину, 750мг, двічі на добу ранолазину, 1000мг, двічі на добу (n=7) (n=7) (n=7) Сmах (нг/мл) 1760±715 2710±657 3660±1090 Тmaх (год.) 2,00±1,15 4,33±1,62 4,17±2,48 Сmin (нг/мл) 585±340 1260±501 1960±812 Параметр Відповідно до Таблиці 7, ранолазин повільно вивільнювався з лікарської форми пролонгованої дії, унаслідок чого фармакокінетичні параметри обмежувались швидкістю розчинення. Наслідком цього були пролонговані профілі часової залежності концентрації лікарського засобу у плазмі при усіх рівнях доз, причому пікові рівні у плазмі спостерігались через 2-4год. після введення дози лікарського засобу. Ці результати вказують на те, що придатні рівні ранолазину у плазмі можна одержати у людей у разі введення лікарської форми пролонгованої дії двічі на добу. ПРИКЛАД 8 У цьому Прикладі було зроблено оцінку безпечності та стерпності введення лікарських форм рацемічної суміші ранолазину у вигляді вільної основи, як у Прикладі 2D. Було визначено також індивідуальні та середні концентрації рацемічної суміші ранолазину та його енантіомерів, (R)-(+)-N(2,6-диметилфеніл)-4-[2-гідрокси3-(2метоксифенокси)-пропіл]-1-піперазинацетаміду та (S)-(-)-N-(2,6-диметилфеніл)-4-[2-гідрокси-3-(2метоксифенокси)-пропіл]-1-піперазинацетаміду, у плазмі людини. Це дослідження здійснювали зі зростаючими дозами лікарської форми ранолазину пролонгованої дії. Перед та у інтервалах під час та після періоду введення доз лікарського засобу відбирали проби крові для аналізу на ранолазин та постійно контролювали тиск крові, частоту серцевих скорочень, електрокардіограми та симптоми. Узагальнені дані перевіряли після кожної фази перед переходом до наступної фази дослідження. Вісім пацієнтів, усі здорові волонтери-чоловіки у віці від 18 років до 40 років, розпочали та усі дійшли до кінця цього дослідження і були доступними для аналізу фармакокінетичних параметрів та параметрів безпеки. Кожному з пацієнтів уводили ранолазин у вигляді вільної основи різних типів у формі таблеток пролонгованої дії, у тому числі 500мг та 750мг таблетки або, у разі необхідності, відповідну кількість плацебо (2 750мг плюс 1 500мг) для одержання пероральних дозованих форм у 1500мг та 2000мг. На кожній фазі: одна доза двічі на добу впродовж чотирьох днів з одноразовою дозою на 5 день. На 5 день кожний волонтер піддавався обстеженню з метою визначення повного фармакокінетичного профілю, у тому числі тиску крові (ВР) у положенні лежачи на спині та стоячи, частоти серцевих скорочень, електрокардіографічних даних, 27 75027 28 побічних явищ, клінічних хімічних та гематологічного аналізу. Для порівняння обробок вираховуваних результатів, результатів аналізу сечі. ли 90% та 95% довірчі інтервали. Численні порівКожен рівень дози перевіряли на стабільність няння не підганялись. із використанням С48год., C72год., C96год. та logСередні значення та середні квадратичні відперетворених даних за допомогою коваріаційного хилення фармакокінетичних параметрів ранолазианалізу та шляхом перевірки, чи суттєво відрізнявну у вигляді вільної основи 5 дня докладно навеся (що визначалось як р
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for treating cardiovascular diseases using sustained release ranolazine formulation
Назва патенту російськоюСпособ лечения сердечно-сосудистых заболеваний с помощью лекарственной формы ранолазина пролонгированного действия
МПК / Мітки
МПК: A61K 9/20, A61K 31/495
Мітки: формою, лікування, спосіб, дії, серцево-судинних, пролонгованої, ранолазину, захворювань, лікарською
Код посилання
<a href="https://ua.patents.su/14-75027-sposib-likuvannya-sercevo-sudinnikh-zakhvoryuvan-likarskoyu-formoyu-ranolazinu-prolongovano-di.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування серцево-судинних захворювань лікарською формою ранолазину пролонгованої дії</a>
Попередній патент: Трипептидні інгібітори вірусу гепатиту с, спосіб їх одержання та фармацевтична композиція
Випадковий патент: Пристрій для обліку теплової енергії