Фармацевтична композиція, що містить фактор viia та фактор xiii, комплект для внутрішньовенного введення, спосіб посилення утворення фібринового згустка та спосіб лікування епізодичної кровотечі, застосування ф
Номер патенту: 76106
Опубліковано: 17.07.2006
Автори: Рьойк'єр Расмус, Петерсен Ларс Крістіан, Хеднер Улла
Формула / Реферат
1. Фармацевтична композиція для внутрішньовенного введення, яка містить фактор VIIa і фактор XІІІ.
2. Композиція за п. 1, яка відрізняється тим, що фактор VIIa являє собою варіант фактора VІІ.
3. Композиція за п. 1, яка відрізняється тим, що фактор VIIa являє собою фактор VIIa людини.
4. Композиція за п. 1 або п. 3, яка відрізняється тим, що фактор VIIa та фактор XIII являють собою рекомбінантний фактор VIIa людини та рекомбінантний фактор XIII людини.
5. Композиція за будь-яким з пп. 1-4, яка відрізняється тим, що фактор XIII являє собою a2-димер фактора XІІІ.
6. Композиція за будь-яким з пп. 1-5, яка відрізняється тим, що фактор XIII являє собою активований фактор XIII.
7. Композиція за будь-яким з пп. 1-6, яка відрізняється тим, що додатково містить інгібітор TFPI.
8. Композиція за будь-яким з пп. 1-7, яка відрізняється тим, що додатково містить фактор VІІI.
9. Комплект для внутрішньовенного введення, який містить лікарський засіб для лікування епізодичної кровотечі, що містить
а) ефективну кількість фактора VIIa і фармацевтично прийнятний носій у першій одиничній лікарській формі;
b) ефективну кількість фактора XІІІ і фармацевтично прийнятний носій у другій одиничній лікарській формі, і
c) контейнер для розміщення в ньому зазначених першої та другої лікарських форм.
10. Комплект за п. 9, який відрізняється тим, що додатково містить ефективну кількість інгібітору TFPI та фармацевтично прийнятний носій, у третій одиничній лікарській формі.
11. Комплект за п. 9, який відрізняється тим, що перша одинична лікарська форма або друга одинична лікарська форма додатково містить інгібітор TFPI.
12. Комплект за будь-яким з пп. 9-11, який відрізняється тим, що додатково містить фактор VIII або виготовлений у формі окремої одиничної лікарської форми, або у складі одиничної лікарської форми, яка також містить одну або більше сполук, вибраних з групи, яка складається з фактора VІІa, фактора XIII або інгібітору TFРI.
13. Застосування фактора VІІa у комбінації з фактором XІІІ для виготовлення лікарського засобу для лікування епізодичної кровотечі у суб'єкта, причому лікарський засіб призначений для внутрішньовенного введення.
14. Застосування за п. 13 для виготовлення лікарського засоба для скорочення часу утворення згустку у суб'єкта.
15. Застосування за п. 13 для виготовлення лікарського засоба для подовження часу лізису згустку у нормальній плазмі ссавця.
16. Застосування за п. 13 для виготовлення лікарського засоба для збільшення міцності згустку у нормальній плазмі ссавця.
17. Застосування за п. 13 для виготовлення лікарського засоба для посилення утворення фібринового згустку у нормальній плазмі людини.
18. Спосіб посилення утворення фібринового згустка у суб'єкта, який включає введення суб'єкту ефективної кількості фактора VІІa у комбінації з ефективною кількістю фактора XІІІ.
19. Спосіб лікування епізодичної кровотечі у суб'єкта, який включає введення суб'єкту ефективної кількості фактора VІІa у комбінації з ефективною кількістю фактора XIII.
20. Спосіб за п. 18 або п. 19, який відрізняється тим, що фактор VIIa та фактор XІІІ вводять у вигляді однократної лікарської форми.
21. Спосіб за п. 18 або п. 19, який відрізняється тим, що фактор VIIa та фактор XIII вводять послідовно.
Текст
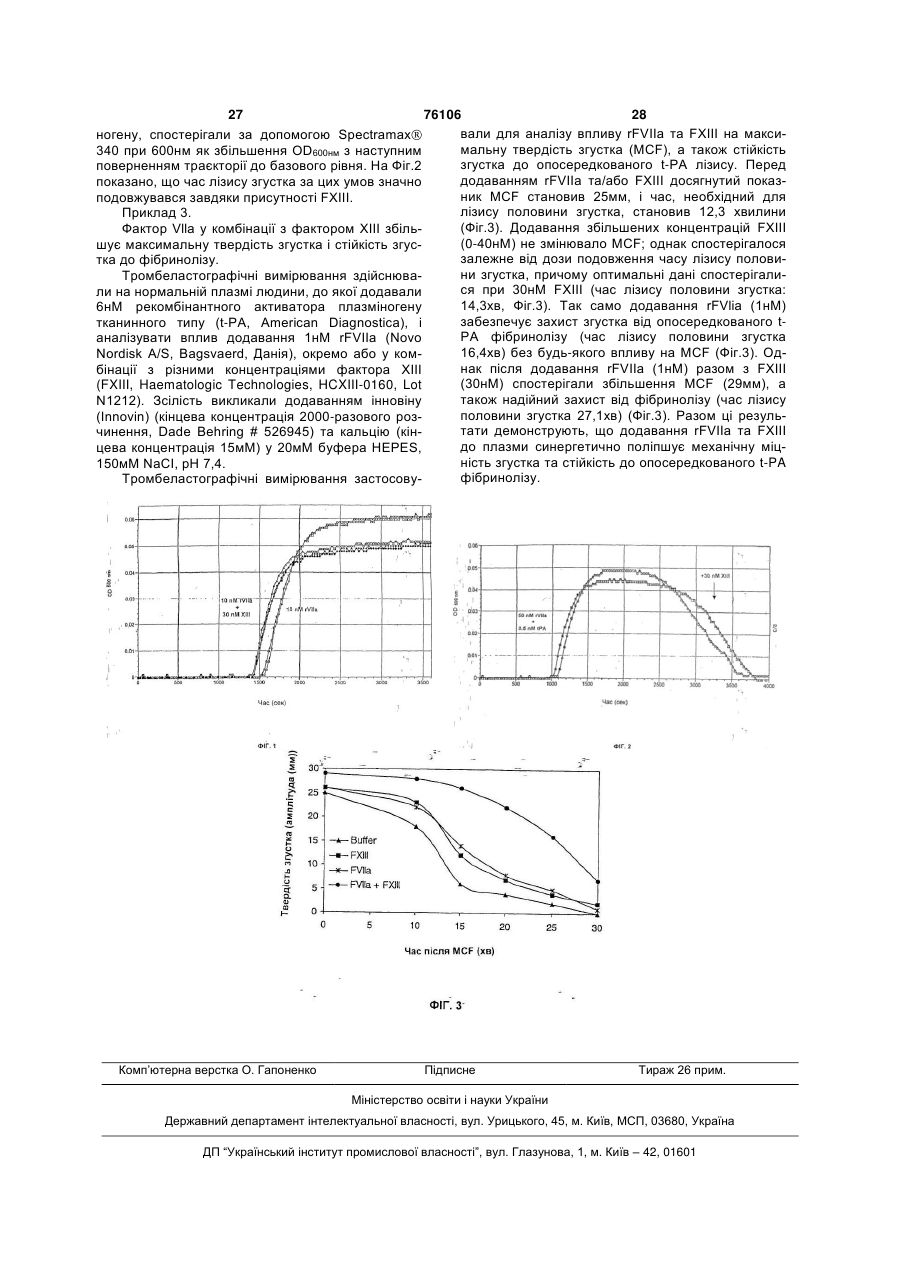
1. Фармацевтична композиція для внутрішньовенного введення, яка містить фактор VIIa і фактор XІІІ. 2. Композиція за п. 1, яка відрізняється тим, що фактор VIIa являє собою варіант фактора VІІ. 3. Композиція за п. 1, яка відрізняється тим, що фактор VIIa являє собою фактор VIIa людини. 4. Композиція за п. 1 або п. 3, яка відрізняється тим, що фактор VIIa та фактор XIII являють собою рекомбінантний фактор VIIa людини та рекомбінантний фактор XIII людини. 5. Композиція за будь-яким з пп. 1-4, яка відрізняється тим, що фактор XIII являє собою a2-димер фактора XІІІ. 6. Композиція за будь-яким з пп. 1-5, яка відрізняється тим, що фактор XIII являє собою активований фактор XIII. 7. Композиція за будь-яким з пп. 1-6, яка відрізняється тим, що додатково містить інгібітор TFPI. 8. Композиція за будь-яким з пп. 1-7, яка відрізняється тим, що додатково містить фактор VІІI. 2 (19) 1 3 76106 4 20. Спосіб за п. 18 або п. 19, який відрізняється ефективної кількості фактора VІІa у комбінації з ефективною кількістю фактора XІІІ. тим, що фактор VIIa та фактор XІІІ вводять у ви19. Спосіб лікування епізодичної кровотечі у сугляді однократної лікарської форми. 21. Спосіб за п. 18 або п. 19, який відрізняється б'єкта, який включає введення суб'єкту ефективної кількості фактора VІІa у комбінації з ефективною тим, що фактор VIIa та фактор XIII вводять послікількістю фактора XIII. довно. Даний винахід стосується фармацевтичної композиції, що містить фактор Vlla та фактор XIII. Винахід також стосується застосування комбінації фактора Vlla з фактором XIII для одержання медикаменту для лікування суб'єктів, які страждають від нападів кровотечі, або профілактики таких нападів. Винахід також стосується способу лікування нападів кровотечі у суб'єктів та підвищення зсілості крові у суб'єкта. Даний винахід також стосується комплектів, які включають ці сполуки. Гемостаз викликається утворенням комплексу між тканинним фактором (TF), підданим дії циркулюючої крові внаслідок пошкодження стінки судини, та FVIIa, присутнім у кровообігу в кількості, яка відповідає приблизно 1% загальної маси білка FVII. Цей комплекс закріплюється на клітині, що містить TF, і активує FX до FXa і FIX до FIXa на поверхні клітин. FXa активує протромбін до тромбіну, який активує FVIII, FV, FXI та FXIII. Крім того, обмежена кількість тромбіну, утвореного на цьому першому етапі гемостазу, також активує тромбоцити. Після дії тромбіну на тромбоцити вони змінюють форму і відкривають заряджені фосфоліпіди на своїй поверхні. Ця поверхня активованих тромбоцитів утворює зразок для подальшої активації FX та повного вироблення тромбіну. Подальша активація FX на поверхні активованих тромбоцитів відбувається через комплекс FIXa-FVIIIa, утворений на поверхні активованого тромбоциту, і FXa після цього перетворює протромбін на тромбін, усе ще перебуваючи на поверхні. Тромбін після цього перетворює фібриноген на фібрин, який є нерозчинним і який стабілізує первісну тромбоцитну пробку. Цей процес є компартменталізованим, тобто обмежується місцем експресії або дії TF, таким чином, зводячи до мінімуму ризик системної активації системи коагуляції. Нерозчинний фібрин, який утворює пробку, крім того, стабілізується каталізованим FXIII шляхом зшивання волокон фібрину. FVIIa існує у плазмі здебільшого як одноланцюговий зимоген, який розщеплюється FXa на його дволанцюгову активовану форму, FVIIa. Рекомбінантний активований фактор Vlla (rFVIIa) виявляє себе як прогемостатичний агент. Введення rFVIIa забезпечує швидку і високоефективну прогемостатичну реакцію у суб'єктів з гемофілією, що страждають від кровотечі, при якій не допомагають продукти, що містять фактор коагуляції, через утворення антитіл. FVIIa також успішно може бути застосований для суб'єктів, що страждають від кровотечі, з дефіцитом фактора VII, або суб'єктів, які мають нормальну систему коагуляції, але зазнали надмірної кровотечі. У цих дослідженнях не спостерігалося несприятливих побічних ефектів rFVIIa (зокрема, випадків тромбоемболії). Додаткове екзогенне введення FVIIa збільшує вироблення тромбіну на поверхні активованих тромбоцитів. Це відбувається у суб'єктів з гемофілією, що мають дефіцит FIX або FVIII, а отже, позбавлені найефективнішого шляху повного вироблення тромбіну. Також за наявності зменшеної кількості тромбоцитів або тромбоцитів з недостатньою функцією додатковий FVIIa збільшує вироблення тромбіну. FXIII, фібриностабілізуючий фактор, є трансглутаміназою, яка зшиває фібринові мономери, таким чином забезпечуючи структуру фібрину, стійкішу до розчинення плазміном та іншими протеолітичними ферментами. Фактор XIII також є відомим як "фібринолігаза" та "фібриностабілізуючий фактор". Активований FXIIIa може утворювати міжмолекулярні гамма-глутаміл-епсилон-лізинові поперечні зв'язки між боковими ланцюгами молекул фібрину та між іншими субстратами. FXIII виявляють у плазмі та у тромбоцитах. Цей фермент існує у плазмі як тетрамерний зимоген, який складається з двох альфа-субодиниць та двох бетасубодиниць (позначається a2b2), і у тромбоцитах як зимоген, який складається з двох альфасубодиниць (позначається а2-димер). Обидва зимогени активуються тромбіном та Са2+. Кальцій вивільнюється з тромбоцитів і накопичується у місці пошкодження. Тромбін відщеплюється від 1-37 N-кінцевих амінокислотних залишків (а2-димеру). У разі а2b2-зимогену бетасубодиниці відокремлюються від активованих альфа-субодиниць. Кальцій однаково добре зв'язується з зимогеном та зміненою тромбіном молекулою. Після тромбінової та кальцієвої активації цистеїн активного центру на альфа-ланцюгу відкривається і утворюється повністю активований фермент. Було виявлено, що суб'єкти з важкою тромбоцитопенією мають низький рівень FXllI у плазмі. Загальновідомим є те, що суб'єкти, які зазнали надмірної кровотечі у зв'язку з хірургічним втручанням або значною травмою і потребують переливання крові, створюють більше ускладнень, ніж ті, які взагалі не зазнають кровотечі. Однак навіть помірна кровотеча, яка вимагає введення людської крові або продуктів крові (тромбоцитів, лейкоцитів, похідних від плазми концентратів для лікування від порушень коагуляції тощо) може призводити до ускладнень, пов'язаних з ризиком передачі людських вірусів (гепатиту, ВІЛ, парвовірусу та інших, донині невідомих вірусів). Широка кровотеча, яка вимагає переливання крові у великих обсягах, може призводити до розвитку поліорганної недостатності, включаючи порушення фун 5 76106 6 кцій легенів та нирок. З розвитком цих серйозних кровотечі та порушень коагуляції. ускладнень у суб'єкта починається низка явищ, Другою метою даного винаходу є забезпеченпов'язаних із багатьма цитокінами та запальними ня композицій в одній дозованій формі, які ефекреакціями, що робить будь-яке лікування надзвитивно можуть бути застосовані для лікування чи чайно важким і часто, на жаль, марним. Отже, гопрофілактики нападів кровотечі або як прокоагуловною метою як хірургічного втручання, так і лікулянти. вання у разі значного пошкодження тканин є Іншою метою даного винаходу є забезпечення уникнення кровотечі або зведення її до мінімуму. композицій, способів лікування або комплектів, які Для уникнення або зведення до мінімуму такої виявляють синергетичний ефект. кровотечі важливо забезпечити утворення стійких і Ще однією метою даного винаходу є забезпетвердих кровоспиняючих пробок, які не можуть чення композицій, способів лікування або комплебути легко розчинені фібринолітичними ферменктів, які не виявляють значних побічних ефектів, тами. Крім того, важливо забезпечити швидке й таких як високий рівень системної активації систеефективне утворення таких пробок та згустків. ми коагуляції. Японська патентна заявка №2-167234 А стоІнші цілі даного винаходу стануть зрозумілими сується адгезиву для біологічної тканини, який по ознайомленні з представленим описом. характеризується тим, що містить фібриноген, Автори даного винаходу показали, що комбіпротромбін, фактор коагуляції крові VII, фактор нація фактора Vlla та фактора XIII може знизити коагуляції крові IX, фактор коагуляції крові X, факчас згортання нормальної плазми людини ефектитор коагуляції крові XIII, антитромбін, інгібітор провніше, ніж будь-який з факторів Vlla або XIII, взятеїнази та іон кальцію. тий окремо. Було також продемонстровано, що Японська патентна заявка №59-116213А стокомбінація фактора Vlla та фактора XIII може збісується аерозольної композиції для застосування льшити стійкість згустка ефективніше, ніж будьяк тканинного клею, який містить коагулянт для який з факторів Vlla або XIII, взятий окремо. Поєдкрові як активний компонент. Коагулянт для крові нання фактора Vlla у концентрації, за якої не сповибирають з-поміж факторів коагуляції крові І, II, lll, стерігається подальшого збільшення стійкості згуIV, V, VII, VIII, IX, X, XI, XII та XIII, прекалікреїн, стка, з фактором XIII, також у концентрації, за якої високомолекулярний полімер кініноген та тромбін. не спостерігається подальшого збільшення стійкоПеревагу віддають комбінації F XIII та тромбіну. сті згустка несподівано виявило, що в цьому разі WO 93/12813 (ZymoGenetics) стосується викодосягається подальше збільшення стійкості згустристання F XIII для зменшення періопераційної ка. Було також продемонстровано, що комбінація втрати крові суб'єктом, підданим хірургічній операфактора Vlla та фактора XIII може подовжити час ції. Композиція також може містити апротинін. FXIII лізису згустка in vitro у нормальній плазмі людини вводять суб'єктові у формі болюсного вливання, як ефективніше, ніж будь-який з інгібіторів факторів правило, за день до операції. Vlla або XIII, взятих окремо. Таким чином, шляхом Європейський патент №225.160 (Novo Nordisk) збільшення коагуляції можна ефективніше лікувастосується композицій FVIIa та способів лікування ти кровотечі у суб'єктів. Крім того, пацієнти можуть пов'язаних із кровотечею порушень, викликаних не бути піддані лікуванню за нижчих концентрацій пошкодженням коагулюючого фактора і не інгібітофактора Vlla, що знижує потребу у відносно висорами коагулюючого фактора. ких витратах, пов'язаних із традиційним лікуванЄвропейський патент №82.182 (Baxter ням самим фактором Vlla. Travenol Lab.) стосується композиції фактора Vlla У першому аспекті винахід стосується фармадля використання з метою протидії дефіцитові цевтичної композиції, що містить фактор Vlla та коагулюючих факторів або впливові інгібіторів коафактор XIII, і, необов'язково, фармацевтично пригулюючих факторів на організм суб'єкта. йнятний носій. Міжнародна патентна публікація № WO В іншому аспекті винахід стосується фармаце93/06855 (Novo Nordisk) стосується місцевого навтичної композиції, що містить фактор Vlla та факнесення FVIIa. тор XIII як єдині активні агенти і, необов'язково, Робота Kjalke et al., Thrombosis and фармацевтично прийнятний носій. Haemostasis, 1999 (Suppl), 095 1, стосується ввеВ іншому аспекті винахід стосується фармацедення додаткового екзогенного FVIIa та впливу на втичної композиції, рецептованої для внутрішньовироблення тромбіну на поверхні активованих венного введення, яка включає фактор Vlla та фатромбоцитів на динамічних моделях з імітацією ктор XIII і, необов'язково, фармацевтично станів гемофілії А або В. прийнятний носій. І досі у даній галузі зберігається потреба у В іншому аспекті винахід стосується фармацевдосконаленому, надійному і широко застосовувавтичної композиції, рецептованої для внутрішньоному способі підвищення коагуляції, швидкого венного введення, яка включає фактор Vlla та фаутворення стійких кровоспиняючих пробок та досяктор XIII як єдині активні агенти і, необов'язково, гнення повного гемостазу у суб'єктів, зокрема, у фармацевтично прийнятний носій. суб'єктів з порушенням вироблення тромбіну. ТаВ одному варіанті втілення фактор Vlla є рекож необхідним є спосіб, який би потребував менкомбінантним фактором Vlla, а фактор XIII є рекошої кількості FVIIa для досягнення повного гемосмбінантним фактором XIII. тазу. В одному варіанті втілення винаходу фактор Однією з цілей даного винаходу є забезпеченVlla є рекомбінантним фактором Vlla. В іншому ня композицій, які ефективно можуть бути застоваріанті втілення фактор Vlla є рекомбінантним совані для лікування або профілактики нападів людським фактором Vlla. В іншому варіанті вті 7 76106 8 лення фактор Vlla є різновидом фактора Vlla. тій формі дозованої одиниці; і В одному варіанті втілення різновиди фактора г) тару для вміщення вищезгаданих першої, Vlla є різновиди амінокислотних послідовностей, другої та третьої дозованих форм. які мають не більше 20 заміщених, видалених або В іншому аспекті винахід стосується комплекту вставлених амінокислот порівняно з природним для лікування нападів кровотечі, який включає фактором Vlla (тобто, поліпептидом, який має аміа) ефективну кількість фактора Vlla та інгібітонокислотну послідовність, описану у патенті США ра TFPI і, необов'язково, фармацевтично прийнят№4,784,950). В іншому варіанті втілення різновиди ний носій у першій формі дозованої одиниці; фактора Vlla мають не більше 15 заміщених, виб) ефективну кількість фактора XIII і, необов'ядалених або вставлених амінокислот; в іншому зково, фармацевтично прийнятний носій у другій варіанті втілення різновиди фактора Vlla мають не формі дозованої одиниці; і більше 10 заміщених, видалених або вставлених в) тару для вміщення вищезгаданих першої та амінокислот; в іншому варіанті втілення різновиди другої форм дозованої одиниці. фактора Vlla мають не більше 8 заміщених, видаВ іншому аспекті винахід стосується комплекту лених або вставлених амінокислот; в іншому варідля лікування нападів кровотечі, який включає анті втілення різновиди фактора Vlla мають не а) ефективну кількість фактора Vlla і, необобільше 6 заміщених, видалених або вставлених в'язково, фармацевтично прийнятний носій у перамінокислот; в іншому варіанті втілення різновиди шій формі дозованої одиниці; фактора Vlla мають не більше 5 заміщених, видаб) ефективну кількість фактора XIII та інгібітолених або вставлених амінокислот; в іншому варіра TFPI і, необов'язково, фармацевтично прийнятанті втілення різновиди фактора Vlla мають не ний носій у другій формі дозованої одиниці; і більше 3 заміщених, видалених або вставлених в) тару для вміщення вищезгаданих першої та амінокислот порівняно з природним фактор Vlla. В другої форм дозованої одиниці. В іншому аспекті одному варіанті втілення різновиди фактора Vlla є винахід стосується комплекту для лікування напавибраними з-поміж [L305V]-FVIIa, дів кровотечі, який включає [L305V/M306D/D309S]-FVIIa, [L305l]-FVIIa, [L305T]а) ефективну кількість фактора Vlla та фактора FVIIa, [F374P]-FVIIa, [V158T/M298Q]-FVIIa, XIII і, необов'язково, фармацевтично прийнятний [V158D/E296V/M298Q]-Fvlla та [K337A]-FVIIa. носій у першій формі дозованої одиниці; В одному варіанті втілення фактором XIII є б) ефективну кількість інгібітора TFPI і, необоFXIII а2b2. В іншому варіанті втілення фактором в'язково, фармацевтично прийнятний носій у друXIII є FXIII а2. В іншому варіанті втілення фактогій формі дозованої одиниці; і ром XIII є активований фактор XIII (FXIIIa). В одв) тару для вміщення вищезгаданих першої та ному варіанті втілення фактором XIII є різновид другої форм дозованої одиниці. фактора XIII. В одному варіанті втілення фактором В іншому аспекті винахід стосується комплекту XIII є фактор XIII людини. В одному варіанті втідля лікування нападів кровотечі, який включає лення фактором XIII є рекомбінантний фактор XIII. а) ефективну кількість фактора Vlla і, необоВ одному варіанті втілення фактором XIII є рекомв'язково, фармацевтично прийнятний носій у пербінантний фактор XIII людини. В одному варіанті шій формі дозованої одиниці; втілення фактором XIII є а2-димер людини. б) ефективну кількість фактора XIII і, необов'яВ одному аспекті композиція також містить інзково, фармацевтично прийнятний носій у другій гібітор TFPI. В іншому аспекті композиція також формі дозованої одиниці; і містить фактор VIII. В іще одному аспекті композив) ефективну кількість фактора VIII і, необов'яція також містить фактор VIII та інгібітор TFPI. зково, фармацевтично прийнятний носій у третій В одному варіанті втілення композиція також дозованій формі; і включає інгібітор фібринолітичної системи, наприг) ефективну кількість інгібітора TFPI і, необов'язково, фармацевтично прийнятний носій у четклад, апротинін, -амінокапронову кислоту або вертій дозованій формі; і транексамову кислоту. e) тару для вміщення вищезгаданих першої, В іншому аспекті винахід стосується комплекту другої, третьої та четвертої дозованих форм. для лікування нападів кровотечі, який включає В іншому аспекті комплект включає а) ефективну кількість фактора Vlla і, необоа) ефективну кількість фактора Vlla та фактора в'язково, фармацевтично прийнятний носій у перXIII і, необов'язково, фармацевтично прийнятний шій формі дозованої одиниці; носій у першій формі дозованої одиниці; б) ефективну кількість фактора XIII і, необов'яб) ефективну кількість фактора VIII і, необов'язково, фармацевтично прийнятний носій у другій зково, фармацевтично прийнятний носій у другій формі дозованої одиниці; і формі дозованої одиниці; в) тару для вміщення вищезгаданих першої та в) ефективну кількість інгібітора TFPI і, неободругої форм дозованої одиниці. В одному аспекті в'язково, фармацевтично прийнятний носій у трекомплект включає тій формі дозованої одиниці; і а) ефективну кількість фактора Vlla і, необог) тару для вміщення вищезгаданих першої, в'язково, фармацевтично прийнятний носій у пердругої та третьої дозованих форм. шій формі дозованої одиниці; В іншому аспекті винахід стосується комплекту б) ефективну кількість фактора XIII і, необов'ядля лікування нападів кровотечі, який включає зково, фармацевтично прийнятний носій у другій а) ефективну кількість фактора Vlla та інгібітоформі дозованої одиниці; ра TFPI і, необов'язково, фармацевтично прийнятв) ефективну кількість інгібітора TFPI і, необоний носій у першій формі дозованої одиниці; в'язково, фармацевтично прийнятний носій у тре 9 76106 10 б) ефективну кількість фактора XIII і, необов'язково, фармацевтично прийнятний носій у другій зково, фармацевтично прийнятний носій у другій формі дозованої одиниці; і формі дозованої одиниці; і г) тару для вміщення вищезгаданих першої, в) ефективну кількість фактора VIII і, необов'ядругої та третьої дозованих форм. зково, фармацевтично прийнятний носій у третій В іншому аспекті винахід стосується комплекту формі дозованої одиниці; і для лікування нападів кровотечі, який включає г) тару для вміщення вищезгаданих першої, а) ефективну кількість інгібітора TFPI та факдругої та третьої дозованих форм. тора XIII і, необов'язково, фармацевтично прийняВ іншому аспекті винахід стосується комплекту тний носій у першій формі дозованої одиниці; для лікування нападів кровотечі, який включає б) ефективну кількість фактора VIII та фактора а) ефективну кількість фактора Vlla та фактора Vlla і, необов'язково, а фармацевтично прийнятний VIII і, необов'язково, фармацевтично прийнятний носій у другій формі дозованої одиниці; і носій у першій формі дозованої одиниці; в) тару для вміщення вищезгаданих першої та б) ефективну кількість фактора XIII і, необов'ядругої форм дозованої одиниці. зково, фармацевтично прийнятний носій у другій В іншому аспекті винахід стосується комплекту формі дозованої одиниці; і для лікування нападів кровотечі, який включає в) ефективну кількість інгібітора TFPI і, необоа) ефективну кількість фактора Vlla та інгібітов'язково, фармацевтично прийнятний носій у друра TFPI і, необов'язково, фармацевтично прийнятгій формі дозованої одиниці; і ний носій у першій формі дозованої одиниці; г) тару для вміщення вищезгаданих першої, б) ефективну кількість фактора VIII та фактора другої та третьої дозованих форм. XIII і, необов'язково, фармацевтично прийнятний В іншому аспекті винахід стосується комплекту носій у другій формі дозованої одиниці; і для лікування нападів кровотечі, який включає в) тару для вміщення вищезгаданих першої та а) ефективну кількість фактора Vlla та фактора другої форм дозованої одиниці. XIII і, необов'язково, фармацевтично прийнятний В іншому аспекті винахід стосується викорисносій у першій формі дозованої одиниці; тання фактора у комбінації з фактором XIII для б) ефективну кількість фактора VIII та інгібітоодержання медикаменту для лікування нападів ра TFPI і, необов'язково, фармацевтично прийняткровотечі. ний носій у другій формі дозованої одиниці; і В іншому аспекті винахід стосується викорисв) тару для вміщення вищезгаданих першої та тання фактора у комбінації з фактором XIII для другої форм дозованої одиниці. одержання медикаменту для скорочення часу згоВ іншому аспекті винахід стосується комплекту ртання у суб'єкта. для лікування нападів кровотечі, який включає В іншому аспекті винахід стосується викориса) ефективну кількість фактора VIII та фактора тання фактора у комбінації з фактором XIII для XIII і, необов'язково, фармацевтично прийнятний одержання медикаменту для подовження часу носій у першій формі дозованої одиниці; лізису згустка у плазмі ссавців. б) ефективну кількість інгібітора TFPI і, необоВ іншому аспекті винахід стосується викорисв'язково, фармацевтично прийнятний носій у друтання фактора у комбінації з фактором XIII для гій формі дозованої одиниці; і одержання медикаменту для збільшення міцності в) ефективну кількість фактора Vlla і, необов'язгустка у плазмі ссавців. зково, фармацевтично прийнятний носій у другій В іншому аспекті винахід стосується викорисформі дозованої одиниці; і тання фактора у комбінації з фактором XIII для г) тару для вміщення вищезгаданих першої, одержання медикаменту для посилення згортання другої та третьої дозованих форм. фібрину у плазмі ссавців В іншому аспекті винахід стосується комплекту В одному варіанті втілення плазма ссавця є для лікування нападів кровотечі, який включає плазмою людини. В іншому варіанті втілення плаа) ефективну кількість фактора XIII та інгібітозма ссавця є нормальною плазмою; в іншому варіра TFPI і, необов'язково, фармацевтично прийнятанті втілення плазма є нормальною плазмою люний носій у першій формі дозованої одиниці; дини; в одному варіанті втілення плазма є б) ефективну кількість фактора VIII і, необов'яплазмою суб'єкта з порушенням вироблення трозково, фармацевтично прийнятний носій у другій мбіну. В одному варіанті втілення плазма є плазформі дозованої одиниці; і мою суб'єкта зі зниженою концентрацією фібринов) ефективну кількість фактора Vlla і, необов'ягену. зково, фармацевтично прийнятний носій у другій В одному варіанті втілення фактор Vlla та факформі дозованої одиниці; і тор XIII подовжують час лізису згустка in vitro у г) тару для вміщення вищезгаданих першої, нормальній плазмі людини. другої та третьої дозованих форм. В іншому аспекті винахід стосується способу В іншому аспекті винахід стосується комплекту посилення згортання фібрину у суб'єкта, включаюдля лікування нападів кровотечі, який включає чи введення суб'єктові ефективної кількості фака) ефективну кількість інгібітора TFPI та фактора у комбінації з ефективною кількістю фактотора VIII і, необов'язково, фармацевтично прийняра XIII. тний носій у першій формі дозованої одиниці; В іншому аспекті винахід стосується способу б) ефективну кількість фактора Vlla і, необолікування нападів кровотечі у суб'єкта, включаючи в'язково, фармацевтично прийнятний носій у друвведення суб'єктові ефективної кількості фактора гій формі дозованої одиниці; і у комбінації з ефективною кількістю фактора XIII. в) ефективну кількість фактора XIII і, необов'яВ іншому аспекті винахід стосується способу 11 76106 12 скорочення часу згортання плазми ссавця, вклюлізатора та/або детергента та/або нейтральної чаючи контакт плазми з ефективною кількістю фасолі та/або антиоксиданта та/або консерванта ктора Vlla у комбінації з ефективною кількістю фата/або інгібітора протеази, та другої форми дозоктора XIII. В одному варіанті втілення ефективну ваної одиниці, яка складається, головним чином, з кількість фактора у комбінації з ефективною кількіфактора XIII, і, необов'язково, принаймні одного стю фактора XIII вводять суб'єктові, який потребує фармацевтично прийнятного наповнювача чи нотакого лікування. В іншому аспекті винахід стосусія та/або стабілізатора та/або детергента та/або ється способу посилення утворення фібрину у нейтральної солі та/або антиоксиданта та/або консуб'єкта, включаючи введення суб'єктові ефективсерванта та/або інгібітора протеази. ної кількості фактора у комбінації з ефективною В іншому варіанті втілення фармацевтична кількістю фактора XIII. композиція (якщо має форму комплекту) складаВ одному варіанті втілення способів винаходу ється з першої форми дозованої одиниці, яка фактор Vlla та фактор XIII є єдиними активними складається, головним чином, з фактора Vlla і, агентами, які вводять суб'єктові. В іншому варіанті необов'язково, принаймні одного фармацевтично втілення винаходу фармацевтична композиція прийнятного наповнювача або носія та/або стабівключає фактор Vlla та фактор XIII як єдині активні лізатора та/або детергента та/або нейтральної агенти. солі та/або антиоксиданта та/або консерванта В одному варіанті втілення винаходу фактор та/або інгібітора протеази та/або інгібітора TFPI, та Vlla та фактор XIII вводять одночасно і у формі другої форми дозованої одиниці, яка складається, одиничної дози. В іншому варіанті втілення фактор головним чином, з фактора XIII, і, необов'язково, Vlla та фактор XIII вводять послідовно. В іншому принаймні одного фармацевтично прийнятного варіанті втілення фактор Vlla та фактор XIII ввонаповнювача або носія та/або стабілізатора та/або дять з інтервалом у межах приблизно 1-2 годин детергента та/або нейтральної солі та/або антиокміж ними, наприклад, у межах 30 хвилин між ними, сиданта та/або консерванта та/або інгібітора пронаприклад, у межах 10 хвилин між ними, напритеази та/або інгібітора TFPI та/або фактора VIII. клад, у формі комплекту, який включає фактор Vlla В іншому варіанті втілення суб'єкт є людиною; у першій формі дозованої одиниці та фактор XIII у в іншому варіанті втілення суб'єкт має порушення другій формі дозованої одиниці. вироблення тромбіну; в одному варіанті втілення В одному варіанті втілення ефективна кільсуб'єкт має знижену концентрацію фібриногену у кість фактора Vlla становить від 0,05мг/день до плазмі (наприклад, суб'єкт, підданий неодноразо500мг/день (при масі суб'єкта 70кг). В одному варівому переливанню). анті втілення ефективна кількість фактора XIII стаВ іншому аспекті композиція також містить фановить від 0,05мг/день до 500мг/день (при масі ктор VIII. В одному варіанті втілення фактор VIII є суб'єкта 70кг). активованим фактором VIII (фактором Vllla). В інВ одному варіанті втілення даного винаходу шому варіанті втілення фактор VIII є рекомбінантфармацевтична композиція (у формі єдиного преним фактором Vllla. В іншому варіанті втілення парату) складається, головним чином, з фактора фактор VIII є рекомбінантним фактором Vllla люVlla та фактора XIII, і, необов'язково, принаймні дини. одного фармацевтично прийнятного наповнювача В іншому аспекті композиція також включає інабо носія та/або стабілізатора та/або детергента гібітор фібринолітичної системи, наприклад, апрота/або нейтральної солі та/або антиоксиданта тинін, -амінокапронову кислоту або транексамову та/або консерванта та/або інгібітора протеази. кислоту. В іншому варіанті втілення даного винаходу На Фігурі 1 показано, що спонтанне утворення фармацевтична композиція (у формі єдиного презгустка у нормальній плазмі людини (NHP), розвепарату) складається, головним чином, з фактора деній у співвідношенні 1/10 у буфері, що містив Vlla та фактора XIII, і, необов'язково, принаймні 20нМ Hepes, 150мМ NaCI та 5мМ СаСІ2, рН 7,4 у одного фармацевтично прийнятного наповнювача мікротитрувальній лунці (загальний об'єм 250мкл) або носія та/або стабілізатора та/або детергента досягалося за приблизно 2500-3000сек. Згортання та/або нейтральної солі та/або антиоксиданта фібрину простежувалося за збільшенням оптичної та/або консерванта та/або інгібітора протеази густини при 600нм у Specramax 340. Molecular та/або інгібітора TFPI. Devices, Sunny-vale CA. На Фіг.1 показано, що В іншому варіанті втілення даного винаходу 10нМ рекомбінантного фактора Vlla (rFVIIa) від фармацевтична композиція (у формі єдиного преNovo Nordisk A/S Bagsvaerd, Denmark скорочували парату) складається, головним чином, з фактора час утворення згустка до 1600сек (n=2). Подальше Vlla та фактора XIII, і, необов'язково, принаймні скорочення часу утворення згустка досягалося при одного фармацевтично прийнятного наповнювача додаванні 30нМ фактора XIII (FXIII) від American або носія та/або стабілізатора та/або детергента Diagnostica inc, Greenwich, CT разом із 10нМ rFVIIa та/або нейтральної солі та/або антиоксиданта (n=3). Згусток, утворений у присутності FXIII, був та/або консерванта та/або інгібітора протеази прозорішим (мав нижчу максимальну оптичну густа/або інгібітора TFPI та/або фактора VIII. тину), ніж за його відсутності, вказуючи на те, що В іншому варіанті втілення фармацевтична додавання FXIII внаслідок забезпечує дрібнішу композиція (якщо має форму комплекту) складагелеву структуру фібрину з тоншими волокнами. ється з першої форми дозованої одиниці, яка На Фігурі 2 показано, що додатковий FXIII складається, головним чином, з фактора Vlla і, (30нМ) подовжує час лізису фібрину згустків, утвонеобов'язково, принаймні одного фармацевтично рених у присутності rFVIIa та активатора тканинноприйнятного наповнювача або носія та/або стабіго плазміногену (tPA). Утворення згустка виклика 13 76106 14 ли у присутності або за відсутності 30нМ XIII шлявироблення тромбіну утворюється пориста фібрихом додавання від 25мкл NHP до 225мкл 20нМ нова пробка, яка має велику проникність. ФібриноHepes, 150мМ NaCI, 5мМ СаСІ2, рН 7,4 що містив літичні ферменти, які зазвичай є присутніми на 50нМ rFVIIa та 0,5нМ рекомбінантного tPA від поверхні фібрину, легко розчиняють таку фібриноNovo Nordisk A/S Bagsvasrd, Denmark. Утворення ву пробку. Утворення стійкої фібринової пробки згустка та наступний лізис згустка, викликаний також залежить від наявності фактора ХІІІа, який опосередкованою tPA активацією плазміногену, активується тромбіном, а отже, також залежить від повного вироблення тромбіну. Крім того, описаний спостерігали за допомогою Spectramax 340 при вище активований тромбіном фібринолітичний 600нм як збільшення OD6000нм з наступним поверінгібітор, TAFI, вимагає досить великої кількості ненням траєкторії до базового рівня. На Фіг.2 потромбіну для його активації. Отже, за недостатньоказано, що час лізису згустка за цих умов значно го вироблення тромбіну TAFI не може бути актиподовжувався завдяки присутності FXIII. вований, внаслідок чого утворюється кровоспиняНа Фігурі 3 показано вплив rFVIIa та FXIII на юча пробка, яка легше за нормальну розчиняється максимальну твердість згустка (MCF), а також у разі звичайної фібринолітичної активності. стійкість згустка до опосередкованого t-PA лізису. Через збільшення вироблення тромбіну факПеред додаванням rFVIIa та/або FXIII досягнутий тор Vlla забезпечує основу для повної активації показник MCF становив 25мм, і час, необхідний фактора XIII, що є найважливішим для утворення для лізису половини згустка, становив 12,3 хвилиповністю стабілізованої кровоспиняючої пробки, а ни (Фіг.3). Додавання збільшених концентрацій отже, для підтримання гемостазу. У випадках зниFXIII (0-40нМ) не змінювало MCF; однак спостеріженої кількості тромбоцитів, тромбоцитопенії, пригали залежне від дози подовження часу лізису скорення вироблення тромбіну викликають ввеполовини згустка, причому оптимальне спостеріденням екзогенного додаткового фактора Vlla. галося при 30нМ FXIII (час лізису половини згустОднак загальне вироблення тромбіну не нормаліка: 14,3хв, Фіг.3). Так само, додавання rFVIIa (1нМ) зується фактором Vlla навіть у високих концентвнаслідок забезпечує захист згустка від опосередраціях. кованого t-PA фібринолізу (час лізису половини Поєднуючи фактор Vlla та фактор XIII, зокрезгустка; 16,4хв) без будь-якого впливу на MCF ма, альфа-ланцюг фактора XIII (а2-димер), забез(Фіг.3). Однак після додавання rFVIIa (1нМ) разом печують повну активацію фактора XIII, що збільз FXHI (30нМ) спостерігали збільшення MCF шує кровоспиняючий вплив фактора Vlla. (29мм), а також надійний захист від фібринолізу Крім того, у суб'єктів зі зниженою концентраці(час лізису половини згустка; 27,1хв) (Фіг.3). Взяті єю фібриногену у плазмі (суб'єктів, підданих неодразом, ці результати демонструють, що додавання норазовому переливанню внаслідок множинних rFVIIa та FXIII до плазми синергетично поліпшує травм або широкого хірургічного втручання) повна механічну міцність згустка та стійкість до опосереактивація фактора XIII не трапляється. Ефективдкованого t-PA фібринолізу. нішого гемостазу досягають шляхом введення Даний винахід забезпечує композицію, яка комбінації фактора Vlla та фактора XIII. включає комбінацію фактора Vlla та фактора XIII. Іншим способом збільшення стійкості фібриВинахід також забезпечує композицію, яка вклюнових кровоспиняючих пробок є забезпечення почає комбінацію фактора VIla та фактора XIII як вної присутності фактора ХІІІа (активованого факокремих активних інгредієнтів. Композиція може тора XIII). існувати у формі окремої композиції або у формі Суб'єкти з тромбоцитопенією мають порушенбагатокомпонентного комплекту. Дані композиції ня вироблення тромбіну, а також порушення стакорисні як терапевтичні і профілактичні прокоагубілізації фібринових пробок, внаслідок чого кроволянти та агенти стабілізації фібринового згустка і спиняючі пробки стають схильними до утворюють швидкі фібринові згустки у ссавців, передчасного розчинення. Крім того, у суб'єктів, які включаючи приматів, таких як людина. зазнали значної травми або пошкодження органів і При згадуванні першої, другої або третьої і т. через це піддавалися частому переливанню крові, д. дозованої одиниці в цьому описі вказується не нерідко знижується кількість тромбоцитів, а також на оптимальний порядок введення; це робиться знижується кількість фібриногену, фактора VIII та лише для зручності. інших коагуляційних білків. У цих суб'єктів порушуДаний винахід також забезпечує спосіб лікується (або знижується) вироблення тромбіну. Крім вання (включаючи профілактичне лікування або того, знижений рівень фібриногену негативно запобігання) нападів кровотечі у суб'єктів, вклювпливає на активацію фактора XIII. Отже, ці суб'єкчаючи людину, викликаних, наприклад, травмою ти мають недостатній або менш ефективний гемоабо хірургічним втручанням, або у суб'єктів, у яких стаз, внаслідок чого утворені фібринові пробки фактори коагуляції крові FIX або FVIII чи тромболегко і передчасно розчиняються протеолітичними цити відсутні або пошкоджені. ферментами; крім того, ці ферменти широко вивіБуло виявлено, що комбінація фактора Vlla та льнюються у випадках значних травм та пошкофактора ХІІІа є корисним продуктом, який забездження органів. печує утворення твердих і стійких кровоспиняючих Для сприяння утворенню повністю стабілізопробок, що швидко утворюються. ваних пробок з повною здатністю до підтримання Повне вироблення тромбіну є необхідним для гемостазу суб'єкту вводять композицію згідно з утворення твердої стійкої кровоспиняючої пробки. винаходом. Ця композиція є особливо корисною Структура фібрину такої пробки залежить як від для суб'єктів зі зниженою кількістю тромбоцитів та кількості утвореного тромбіну, так і від швидкості для суб'єктів зі зниженим рівнем фібриногену початкового вироблення тромбіну. При порушенні 15 76106 16 та/або інших коагуляційних білків у плазмі. У присутності фактора XIII нижчої концентрації Таблиця фактора Vlla може бути достатньо для забезпечення потрібного гемостазу. Скорочення для амінокислот Як зазначалося вище, фактор XIII існує у плазмі як тетрамерний зимоген, який складається з Амінокислота Трилітерний код Однолітерний код двох альфа-субодиниць та двох бета-субодиниць Гліцин Gly G (позначається а2 b2), але міститься в іншій тканині Пролін Pro Ρ (наприклад, тромбоцитах) як а2-димер. У межах Аланін Ala A даного винаходу може застосовуватися будь-яка з Валін Val V цих форм зимогену або активований фактор XIII Лейцин Leu L (фактор ХІІІа), а також генетично змінені різновиди Ізолейцин He I фактора XIII, які зберігають характерну для них Метіонін Met Μ здатність до зшивання. В одному варіанті втілення Цистеїн Cys С фактором XIII є фактор XIII людини; в іншому варіФенілаланін Phe F анті втілення фактором XIII є а2-димером людини; Тирозин Tyr Υ у ще одному варіанті втілення фактором XIII є акТриптофан Тrр W тивований фактор ХІІІа людини. Гістидин His Η Фактор XIII та фактор Vlla, застосовувані у даЛізин Lys К ному винаході, можуть бути виділені з крові або Аргінін Arg R одержані рекомбінантним способом. Очевидно, що Глютамін Gin Q практичне втілення описаних нами способів є неАспарагін Asn N залежним від походження очищеного фактора XIII Глутамінова та фактора Vlla, а отже, даний винахід розглядаGlu Ε кислота ється як такий, що охоплює застосування будьАспарагінова якої композиції фактора XIII та фактора Vlla, приAsp D кислота датної для застосування за даним винаходом. Перевагу віддають факторові Vlla та факторові XIII Термін "фактор Vlla" або "FVIIa" може вживалюдини. У даному винаході також можуть бути тися переміжно. Термін "фактор Vlla" включає зизастосовані генетично змінені різновиди фактора могенний фактор VII (одноланцюговий фактор VII). Vlla та фактора XIII, які зберігають характерну для Термін "фактор XIII або "FXIM" може вживатися них активність, пов'язану з гемостазом. Фрагменти переміжно. Термін "фактор VIII або "FVIM" може різновидів фактора Vlla або фактора XIII, або факвживатися переміжно. тора Vlla-, або фактора XIII-, які зберігають харакСпеціалістові у даній галузі стане зрозуміло, терну для них пов'язану з гемостазом активність, що заміщення можуть відбуватися за межами дітакож можуть бути застосовані у даному винаході. лянок, які відповідають за функцію молекули факПов'язану з гемостазом активність фактора Vlla тора Vlla або фактора XIII і все одно внаслідок вимірюють, наприклад, застосовуючи аналіз актизабезпечують активний поліпептид. Амінокислотні вності фактора Vlla, представлений у даному опизалишки, суттєві для активності поліпептиду факсі. Пов'язану з гемостазом активність фактора XIII тора Vlla або фактора XIII, а отже, можуть не підвимірюють, наприклад, застосовуючи аналіз актилягати заміщенню, розпізнають згідно з відомим вності фактора XIII, представлений у даному описі. спеціалістам процедурами, такими, як сайтПрикладами різновидів фактора VII, які мають специфічний мутагенез або аланіноскануючий практично таку саму або кращу біологічну активмутагенез [див., наприклад, Cunningham and Wells, ність порівняно з природним фактором Vlla, є, крім 1989, Science 244:1081-1085]. Згідно з останнім інших, описані у Датських патентних заявках №№ способом, мутації здійснюють у кожному позитивРА 2000 00734, РА 2000 01360, РА 2000 01361 та но зарядженому залишку молекули, і отримані РА 2001 00477. Прикладами, крім інших, є [L305V]внаслідок мутантні молекули випробують на коаFVIIa, [L305V/M306D/D309S]-FVHa, [L305l]-FVIIa, гуляцію, і, відповідно, здатність до зшивання для [L305T]-FVIIa, [F374P]-FVIIa, [V158T/M298Q]-FVIIa, розпізнання амінокислотних залишків, які відпові[V158D/E296V/M298Q]-FVIIa та [K337A]-FVIIa. дають за активність молекули. Місця взаємодії У даному контексті трилітерні або однолітерні субстрату з ферментом також визначають шляхом позначення амінокислот застосовуються в їх трааналізу тривимірної структури, визначеним згідно з диційному значенні, як вказано у Таблиці. Якщо цим способом як аналіз на основі ядерного магнітпрямо не вказано іншого, згадані авторами аміноного резонансу, кристалографія або ковалентна кислотни є L-амінокислотами. Слід розуміти, що фіксація мічених субстратів [див., наприклад, de перша літера, наприклад, у К337, представляє Vos et ai, 1992, Science 255: 306-312; Smith et al, амінокислоту, яка в природі присутня у вказаній 1992, Journal of Molecular Biology 224: 899-904; позиції природного фактора VII, і що, наприклад, Wlodaver et al, 1992, FEBS Letters 309: 59-64]. [K337A]-FVIIa означає різновид FVII, у якому предВнесення мутації у нуклеїново-кислотну посліставлена однолітерним кодом К амінокислота, яка довність для заміни одного нуклеотиду на інший в природі присутня у вказаній позиції, заміщується може здійснюватися шляхом сайт-специфічного амінокислотною, представленою однолітерним мутагенезу з застосуванням будь-яких відомих кодом А. спеціалістам способів. Особливо доцільною є процедура з застосуванням надспірального, дволан 17 76106 18 цюгового вектора ДНК з потрібною вставкою та Термін "повний гемостаз" означає утворення у двома синтетичними праймерами, що містять потмісці пошкодження стійкого і твердого фібринового рібну мутацію. Олігонуклеотидні праймери, кожен згустка або пробки, який ефективно спиняє кровоз яких є комплементарним протилежному ланцютечу і який не може бути легко розчинений фібригові вектора, розкручуються під час термоциклунолітичною системою. вання за допомогою Pfu ДНК-полімерази. Після Термін "активність фактора Vlla" означає здатвключення праймерів утворюється мутована планість до вироблення тромбіну; термін також вклюзміда, яка містить розташовані в шаховому порядчає здатність до вироблення тромбіну на поверхні ку ніки (розриви одного ланцюга у дволанцюговій активованих тромбоцитів за відсутності тканинного молекулі нуклеїнової кислоти). Після термоциклуфактора. вання продукт обробляють Орлі, який є специфічТермін "посилення нормальної кровоспиняюним до метильованої та геміметильованої ДНК, чої системи" означає посилення здатності до видля дигерування зразка батьківської ДНК та відбороблення тромбіну. ру синтезованої ДНК, що містить мутацію. Також Вжитий авторами термін "пов'язане з кровотеможуть бути застосовані інші відомі спеціалістам чею порушення" означає будь-яке порушення, способи створення, розпізнання та виділення різуроджене, набуте або викликане, яке має клітинне новидів, наприклад, переміщення генів або виявабо молекулярне походження і виявляє себе у лення фагів. кровотечах. Прикладами є дефіцит коагулюючих Термін "фактор VIII" або "FVIII" включає актифакторів (наприклад, гемофілія А та В або дефівований фактор VIII (позначається фактор Vllla), цит факторів коагуляції XI чи VII), інгібітори коагурізновиди та зрізані форми фактора VIII, які зберілюючих факторів, порушення функції тромбоцитів, гають характерну для них коагулянтну активність. тромбоцитопенія або хвороба фон Віллебранда В одному варіанті втілення фактор VIII є фактором (псевдогемофіл ія). VIII людини. Термін "напади кровотечі" включає неконтроТермін "інгібітор TFPI" означає сполуки, які інльовану і надмірну кровотечу, яка є головною прогібують протикоагулянтну активність TFPI (інгібітоблемою, що виникає у зв'язку як з хірургічним ра шляху тканинного фактора). Цей термін вклювтручанням, так і з іншими формами пошкодження чає сполуки на зразок тих, які описано у тканин. Неконтрольована та надмірна кровотеча Європейському патенті № 558529, WO 96/28153 та може траплятися у суб'єктів, які мають в цілому US 5,622,988. "TFPI" та "ЕРІ" (інгібітор зовнішнього нормальну систему коагуляції (однак у цих суб'єкшляху) може вживатися переміжно. тів розвивається коагулопатія внаслідок кровотечі Згідно з даним винаходом, "ефективна кіль- розчинення коагуляційних білків, збільшення фікість фактора Vlla та "ефективна кількість" фактобринолізу та зменшення тромбоцитів через розра XIII визначається як кількість фактора Vlla та чинний вплив кровотечі), та суб'єкти, які мають фактора XIII, достатня для запобігання чи зниженпорушення коагуляції або пов'язані з кровотечею ня кровотечі або втрати крові, з метою лікування, порушення. Дефіцит коагулюючих факторів (гепослаблення або часткового припинення хвороби мофілія А та В, дефіцит факторів коагуляції XI або та її ускладнень. VII) або інгібітори коагулюючих факторів можуть Кількість фактора Vlla та кількість фактора XIII, спричинити пов'язані з кровотечею порушення. які вводять згідно з даним винаходом, може бути Надмірна кровотеча також трапляється у суб'єктів різною, від приблизно 1:100 до приблизно 100:1 з нормально функціонуючим каскадом згортання (мкг фактора Vlla:/мкг фактора XIII). крові (без дефіциту коагулюючого фактора або У цьому контексті "суб'єкти з порушенням виінгібіторів проти будь-якого з факторів коагуляції) і роблення тромбіну" означає суб'єктів, які не моможе бути викликана порушенням функції тромбожуть виробляти повного тромбіну на поверхні акцитів, тромбоцитопенією або псевдо гемофілією тивованих тромбоцитів, і включає суб'єктів, у яких фон Віллебранда. У таких випадках кровотеча тромбін виробляється у меншій кількості, ніж у може бути порівняна з кровотечею, спричиненою суб'єктів, які мають повністю функціонуючу, норгемофілією, оскільки кровоспиняюча система, як і мальну кровоспиняючу систему, включаючи норпри гемофілії, відчуває брак або відхилення у мальну кількість та функцію факторів коагуляції, "сполуках", які відповідають за зсілість (таких як тромбоцитів та фібриногену, а також включає сутромбоцити або білок фактора фон Віллебранда), б'єктів, у яких відсутні FIX та/або FVIII (гемофілія А що спричинює значні кровотечі. У суб'єктів, які та В) або суб'єктів з дефіцитом FIX та/або FVIII або зазнали значного пошкодження тканин у зв'язку з з інгібіторами проти FIX та/або FVIII; суб'єктів, у хірургічним втручанням або значною травмою, яких відсутній FXI; суб'єктів зі зниженою кількістю нормальний кровоспиняючий механізм може бути тромбоцитів або тромбоцитами з недостатньою послаблений через необхідність негайного гемосфункцією (наприклад, тромбоцитопенією чи тромтазу, і у них може посилюватися кровотеча, небастенією Гланцманна або суб'єктів з надмірною зважаючи на в цілому нормальний (до травми) кровотечею); а також суб'єктів, які мають знижений кровоспиняючий механізм. Досягнення задовільнорівень протромбіну, FX або FVII. го гемостазу також є проблемою, коли кровотеча Суб'єкти зі зниженою концентрацією фібринотрапляється в таких органах, як мозок, зона внутгену у плазмі (наприклад, піддані багаторазовому рішнього вуха та очі, де обмежується можливість переливанню крові суб'єкти внаслідок множинних хірургічного гемостазу. Така сама проблема може травм або широкого хірургічного втручання) також виникнути у процесі біопсії з різних органів (печінстраждають від утворення м'яких і нестійких фібки, легенів, пухлинних тканин, шлунково-кишкового ринових пробок, які легко розчиняються. тракту), а також при лапароскопічних операціях. 19 76106 20 Спільними для всіх цих ситуацій є труднощі, пов'ята фактора XIII, таким чином, охоплюється термізані з забезпеченням гемостазу хірургічними споном "лікування". собами (накладання швів, скоб тощо), що трапляВжитий авторами термін "суб'єкт" означає ється також при розсіяній кровотечі (геморагічний будь-яку тварину, зокрема, ссавця, такого як люгастрит та профузна маткова кровотеча). Гострі та дина, і може у певному випадку вживатися перепрофузні кровотечі також можуть траплятися у міжно з терміном "пацієнт". суб'єктів при антикоагулянтній терапії, у яких поСкорочення рушення гемостазу були викликані наданою тераTF тканинний фактор пією. Такі суб'єкти можуть потребувати хірургічноFVII фактор VII в його одноланцюговій го втручання у разі, коли вимагається швидка неактивованій формі протидія антикоагулянтному впливові. Для суб'єкFVIIa фактор VII в його активованій фотів з локалізованим раком передміхурової залози рмі зазвичай застосовують радикальну ретролобкову rFVIIa рекомбінантний фактор VII в його простатектомію. Операція часто ускладнюється активованій формі значною, часом дуже великою втратою крові. ЗнаFXIII фактор XIII в його зимогенній неачна втрата крові під час простатектомії найчастіше ктивованій формі буває пов'язана з ускладненим анатомічним розFXIIIa фактор XIII в його активованій ташуванням, з різними густо васкуляризованими формі ділянками, які є важкодоступними для хірургічного rFXIII рекомбінантний FXIII гемостазу і можуть призвести до розсіяної кровоrFXIIIa рекомбінантний FXIIIa течі з великої площі. Іншою ситуацією, яка може a2 альфа- або а-ланцюг FXIII або викликати проблеми у разі незадовільного гемосrFXIII тазу, є ситуація, коли суб'єкти з нормальним кроb2 бета- або b-ланцюг FXIII або rFXIII воспиняючим механізмом піддаються антикоагуFXIIIa2 димерна форма FXIII, яка містить лянтній терапії для запобігання тромбоемболії. два а-ланцюги Така терапія може включати застосування гепариFXIIIa2b2 тетрамерна форма FXIII, яка місну, інших форм протеогліканів, варфарину або тить два а- та два b-ланцюги інших форм антагоністів вітаміну K, а також аспіFVIII фактор VIII в його зимогенній неарину та інших інгібіторів агрегації тромбоцитів. ктивованій формі В одному варіанті втілення винаходу кровотеrFVIII рекомбінантний FVIII ча пов'язана з гемофілією. В іншому варіанті втіFVIIIa фактор VIII в його активованій лення кровотеча пов'язана з гемофілією через формі набуті інгібітори. В іншому варіанті втілення кровоrFVIIIa рекомбінантний FVIIIa теча пов'язана з тромбоцитопенією. В іншому ваTFPI інгібітор шляху тканинного факторіанті втілення кровотеча пов'язана з псевдогемора філією. В іншому варіанті втілення кровотеча Одержання сполук пов'язана з важким пошкодженням тканин. В інОчищений фактор Vlla людини, придатний для шому варіанті втілення кровотеча пов'язана з важзастосування у даному винаході, в оптимальному кою травмою. В іншому варіанті втілення кровотеваріанті одержують способом рекомбінантних ча пов'язана з хірургічним втручанням. В іншому ДНК, наприклад, як описано в роботі Hagen et al., варіанті втілення кровотеча пов'язана з лапаросProc.Natl.Acad.Sci. USA 83:2412-2416,1986 або як копічним хірургічним втручанням. В іншому варіанописано в європейському патенті №200,421 ті втілення кровотеча пов'язана з геморагічним (ZymoGenetics, Inc.). Фактор Vlla, одержаний рекогастритом. В іншому варіанті втілення кровотеча є мбінантним способом, може бути автентичним профузною матковою кровотечею. В іншому варіафактором Vlla або більше чи менше модифікованті втілення кровотеча трапляється в органах з ним фактором Vlla, за умови, що такий фактор Vlla обмеженою можливістю механічного гемостазу. В має практично таку саму біологічну активність для іншому варіанті втілення кровотеча трапляється у коагуляції крові, що й автентичний фактор Vlla мозку, зоні внутрішнього вуха або очах. В іншому (природний фактор Vlla). Такий модифікований варіанті втілення кровотеча пов'язана з процесом фактор Vlla одержують шляхом модифікації нуклебіопсії. В іншому варіанті втілення кровотеча поїново-кислотної послідовності, що кодує природв'язана з антикоагулянтною терапією. ний фактор VII, або шляхом зміни амінокислотних Композиція згідно з винаходом також може кодонів, або шляхом видалення деяких із амінокивключати інгібітор TFPI. Така композиція в оптислотних кодонів у нуклеїновій кислоті, що кодує мальному варіанті має вводитись суб'єктам з геприродний фактор VII відомими способами, напримофілією А або В. клад, шляхом сайт-специфічного мутагенезу. Композиція згідно з винаходом також може Фактор VII також одержують способами, опивключати фактор VIII. Таку композицію в оптимасаними в роботах Braze and Majerus, J.Biol.Chem. льному варіанті вводять суб'єктам, які не мають 255 (4): 1242-1247,1980, та Hedner and Kisiel, інгібіторів фактора VIII. J.CIin.invest. 71:1836-1841,1983. Ці способи забезУ цьому контексті термін "лікування" включає печують фактор VII без помітної кількості інших як запобігання можливій кровотечі, наприклад, при факторів коагуляції крові. Ще більше очищений хірургічному втручанні, так і регулювання кровотефактор VII одержують шляхом включення додатчі, яка вже відбувається, наприклад, при гемофілії кової гель-фільтрації як кінцевого етапу очищення. або травмі, з метою стримування або мінімізації Фактор VII у цьому разі перетворюється на актикровотечі. Профілактичне введення фактора Vlla вований фактор Vlla відомими способами, напри 21 76106 22 клад, кількома різними білками плазми, такими як приблизно 1мг до приблизно 200мг/день, або, нафактор ХІІа, ІХа або Ха. В альтернативному варіаприклад, від приблизно 10мг до приблизно нті, як описано в роботі Bjoern et al. (Research 175мг/день для суб'єкта масою 70кг як ударні та Disclosure, 269 September 1986, pp. 564-565), факпідтримуючі дози, залежно від маси суб'єкта, стану тор VII активують шляхом пропущення його через та його тяжкості. іонообмінну хроматографічну колонку, таку як Доза фактора XIII становить від приблизно 0,05мг до приблизно 500мг/день, наприклад, від Mono Q (Pharmacia fine Chemicals) або іншу подіприблизно 1мг до приблизно 200мг/день, або, набну колонку. приклад, від приблизно 10мг до приблизно Фактор XIII для застосування згідно з даним 175мг/день для суб'єкта масою 70кг як ударні та винаходом одержують із плазми згідно з відомими підтримуючі дози, залежно від маси суб'єкта, стану способами, такими як описані в роботах Cooke and та його тяжкості. Holbrook (Biochem. J. 141:79-84,1974) та Curds and Композиції та комплекти даного винаходу коLorand (Methods Enzymol. 45:177-191,1976), на які рисні для медицини та ветеринарії, наприклад, автори посилаються. Димерну форму а2 фактора для лікування або профілактики, розрахованих на XIII одержують із плаценти, як описано у патентах суб'єктів, які страждають нападів кровотечі або США №№ 3,904,751; 3,931,399; 4,597,899 та порушень коагуляції. Для застосування згідно з 4,285,933, на які автори посилаються. Однак переданим винаходом фактор Vlla та фактор XIII рецевагу віддають застосуванню рекомбінантного факптують необов'язково з фармацевтично прийняттора XIII для уникнення застосування продуктів ним носієм. В оптимальному варіанті фармацевкров'яного або тканинного походження, пов'язанотичні композиції вводять парентерально, тобто го з ризиком перенесення хвороб. Способи одервнутрішньовенно, підшкірно або внутрішньом'язожання рекомбінантного фактора XIII є відомими во, або шляхом безперервного або пульсуючого спеціалістам. Див., наприклад, Davie et al., ЕР вливання. 268,772; Grundmann et al., AU-A-69896/87; Bishop Композиції також можуть включати один або et al., Biochemistry 1990,29:1861-1869; Board et al., кілька розріджувачів, емульгаторів, консервантів, Thromb. Haemost. 1990, 63:235-240; буферів, наповнювачів тощо і можуть існувати в Jagadeeswaran et al., Gene 1990, 86:279-283; та таких формах, як рідини, порошки, емульсії, форBroker etal., FEBS Lett. 1989,248:105-110, на які ма контрольованого вивільнення і т. ін. Спеціаліст автори посилаються в їх повному обсязі. В одному у даній галузі може рецептувати композиції винаваріанті втілення а2-димер фактора XIII одержуходу відповідним чином і згідно з загальноприйняють цитоплазматично у дріжджах Saccharomyces тою практикою, наприклад, як описано у cerevisiae, як описано у патентній заявці США Remington's Pharmaceutical Sciences, Gennaro, ed., №07/741,263, яка також перебуває у стадії розгляMack Publishing Co., Easton, PA, 1990. Композиції ду і на яку автори посилаються в її повному обсядля парентерального введення включають фактор зі). Клітини збирають і піддають лізисові, одержуVII та фактор XIII у комбінації, в оптимальному ючи прозорий лізат. Цей лізат фракціонують варіанті - розчинені у фармацевтично прийнятношляхом аніонообмінної хроматографії при рН від му носії, в оптимальному варіанті - водному носії. нейтрального до слабко лужного, застосовуючи Використовують різні водні носії, такі як вода, буколонку дериватизованої агарози, такої як швидферована вода, 0,4% сольовий розчин, 0,3% глікоплинна сефароза DEAE Fast-Flow цин тощо. Різновиди фактора VII згідно з винахоSepharose.TM. (Pharmacia) або ін. Фактор XIII після дом також можуть бути рецептовані у ліпосомні цього осаджують з елюату колонки шляхом його композиції для введення або спрямування на місконцентрування та доведення рН до 5,2-5,5, наця пошкоджень. Загальний опис ліпосомних комприклад, шляхом діафільтрації на сукцинатнопозицій міститься, наприклад, у U.S. 4,837,028, амонієвому буфері. Осад далі розчиняють і очиU.S. 4,501,728 та U.S. 4,975,282. щають, застосовуючи традиційні способи хроматоТипова фармацевтична композиція для внутграфії, такі як гель-фільтрація та хроматографія з рішньовенного вливання містить 250мл стерильгідрофобною взаємодією. ного розчину Рингера та 10мг фактора Vlla та/або Як стане зрозуміло спеціалістам, перевагу фактора XIII. Фактичні способи приготування комвіддають застосуванню білків фактора XIII та факпозицій для парентерального введення відомі або тора Vlla, сингенним із суб'єктом, для зниження зрозумілі спеціалістам і описані детальніше, наризику викликання імунної реакції. Одержання та приклад, у Remington's Pharmaceutical Sciences, характеристики фактора XIII не людського похо18th ed., Mack Publishing Company, Easton, PA дження описано в роботі Nakamura et al. (J. (1990). Biochem. 78:1247-1266,1975). Даний винахід також Коротко, фармацевтичні композиції, придатні охоплює застосування таких білків фактора XIII та для застосування згідно з даним винаходом, одефактора Vlla у ветеринарних процедурах. ржують шляхом змішування фактора Vlla або факВведення та фармацевтичні композиції тора XIII або фактора Vlla у комбінації з фактором Для лікування у зв'язку з запланованим хірурXIII, в оптимальному варіанті - в очищеній формі, з гічним втручанням фактор VII та фактор XIII, як підходящими ад'ювантами та підходящим носієм правило, вводять у межах приблизно 24 годин до або розріджувачем. До підходящих фізіологічно здійснення втручання і протягом 7 днів або більше прийнятних носіїв або розріджувачів належать після нього. Введення як коагулянта здійснюють стерильна вода та розсіл. Композиції можуть місрізними шляхами, як описано уданому винаході. тити фармацевтично прийнятні допоміжні речовиДоза фактора VII становить від приблизно ни, необхідні для наближення до фізіологічних 0,05мг до приблизно 500мг/день, наприклад, від 23 76106 24 умов, такі як агенти регулювання рН та буферні ція фактора Vlla та фактора XIII виявляє синергеагенти, агенти регулювання тонусу та ін., напритичний ефект в утворенні стійких фібринових згусклад, ацетат натрію, лактат натрію, хлорид натрію, тків, збільшуючи час лізису половини згустка, збіхлорид калію, хлорид кальцію та ін. До підходящих льшуючи міцність згустка та стійкість до ад'ювантів також належать кальцій, білки (наприфібринолізу. клад, альбуміни) або інші інертні пептиди (наприКомпозиції, які містять фактор VII та фактор клад, гліцилгліцин) чи амінокислоти (наприклад, XIII, вводять для профілактичного та/або терапевгліцин або гістидин) для стабілізації очищеного тичного лікування. При терапевтичному застосуфактора Vlla та/або фактора XIII. Іншими фізіолованні композиції вводять суб'єктові, який уже гічно прийнятними ад'ювантами є невідновні цукстраждає від хвороби, як описано вище, у кількосри, поліспирти (наприклад, сорбіт, маніт або гліцеті, достатній для виліковування, послаблення або рин), полісахариди, такі як декстрини з низькою часткового призупинення хвороби та її ускладнень. молекулярною масою, детергенти (наприклад, Достатню для цього кількість визначають як "ефеполісорбат) та антиоксиданти (наприклад, бісульктивну кількість" або "терапевтично ефективну фіт та аскорбат). Ад'юванти, як правило, присутні у кількість". Як стане зрозуміло спеціалістові, ефекконцентрації від 0,001 до 4% (маса/об'єм). Фармативна кількість залежить від тяжкості хвороби або цевтична композиція також може містити інгібітори пошкодження, а також маси та загального стану протеази, наприклад, апротинін або транексамову суб'єкта. Слід зважати, що матеріали даного винакислоту, та консерванти. Крім того, композиція ходу зазвичай застосовують у разі серйозної хвотакож може містити інгібітор TFPI та/або факроби або пошкодження, тобто коли існує або може тор VIII. існувати загроза для життя. У цих випадках для Композиції стерилізують традиційними загальзменшення побічних ефектів і за умов загального новідомими способами стерилізації. Одержані браку імуногенності фактора Vlla та фактора XIII у внаслідок стерилізації водні розчини розфасовулюдини, лікар може вважати можливим і бажаним ють для застосування або фільтрують в асептичвведення значної надлишкової кількості цих комних умовах і ліофілізують, ліофілізовану композипозицій. цію перед введенням комбінують зі стерильним При профілактичному застосуванні композиції, водним розчином. які містять фактор Vlla та фактор XIII, вводять суКонцентрація фактора Vlla, фактора XIII або б'єктові, сприйнятливому або іншим чином піддафактора у комбінації з фактором XIII у цих компоному ризикові хвороби або пошкодження, для підзиціях може бути різною в широких межах, тобто, вищення його здатності до коагуляції. Така від меншої за приблизно 0,5% за масою, зазвичай кількість визначається як "профілактично ефектиабо принаймні приблизно 1% за масою, до 15 або вна доза." 20% за масою, і визначається, насамперед, об'єОдно - або багаторазове введення композицій мом, в'язкістю рідини тощо згідно з конкретним здійснюють у дозах i за схемою, які визначаються вибраним способом введення. лікарем Композиції можуть вводитись один або Перевагу віддають введенню шляхом ін'єкції кілька разів на день або тиждень Ефективною кіабо вливання, краще - ін'єкції. Таким чином, факлькістю такої фармацевтичної композиції є кільтор Vlla та фактор XIII одержують у формі, підхокість, яка забезпечує клінічно значущий ефект дящій для внутрішньовенного введення, такій як проти нападів кровотечі. Така кількість частково композиція, яка є або розчиненим ліофілізованим залежить від конкретного стану, який піддають порошком, або рідкою композицією, яка містить як лікуванню, віку, маси та загального стану здоров'я фактор Vlla, так і фактор XIII в одній дозованій суб'єкта, а також інших чинників, які є очевидними формі, або розчиненим ліофілізованим порошком, для спеціалістів. або рідкою композицією, яка містить фактор Vlla та Композицію, як правило, вводять однією окрерозчинений ліофілізований порошок в одній дозомою дозою до передбачуваної кровотечі або на ваній формі, або рідкою композицією, яка містить початку кровотечі. Однак вона також може вводифактор XIII в іншій дозованій формі. тись ι кількома дозами, в оптимальному варіанті - з Місцеве введення фактора Vlla та фактора інтервалами 2-4-6-12 годин, залежно від дози та XIII, наприклад, місцеве нанесення, здійснюють, стану суб'єкта. наприклад, шляхом розпилювання, перфузії, поКомпозиція може існувати у формі окремого двійних балонних катетерів, розширювача, введепрепарату, який містить як фактор Vlla, так ι факного у судинні трансплантати, гідрогелів, які застотор XIII у підходящих концентраціях. Композиція совують для вкривання балонних катетерів, або також може існувати у формі комплекту, який інших традиційно застосовуваних способів. Для складається з першої форми дозованої одиниці, амбулаторних пацієнтів, які вимагають щоденного яка включає фактор Vlla, та другої форми дозовапідтримуючого введення, фактор Vlla та фактор ної одиниці, яка включає фактор XIII і, необов'язXIII може застосовуватися шляхом безперервного ково, одну або кілька інших форм дозованих одивливання за допомогою, наприклад, портативної ниць, які включають фактор VIII та/або інгібітор насосної системи. В усякому разі, фармацевтична TFPI. У цьому разі фактор Vlla та фактор XIII ввокомпозиція має передбачати кількість фактора Vlla дять послідовно, в оптимальному варіанті - з інтета фактора XIII, достатню для ефективного лікурвалом приблизно 1-2 години між ними, напривання суб'єкта. клад, у межах 30 хвилин між ними, краще - у Комбінація фактора Vlla та фактора XIII виявмежах 10 хвилин, ще краще - у межах 5 хвилин ляє синергетичний ефект в in vitro аналізі твердосміж ними. Будь-яка з цих двох форм дозованих ті згустка та часу фібринолізу. Крім того, комбінаодиниць може бути введена першою. 25 76106 26 Оскільки даний винахід стосується профілакні фактори коагуляції, інгібітори у фізіологічних тики або лікування нападів кровотечі або забезпеконцентраціях (мінус фактор VIII при імітації умов чення коагуляції шляхом лікування комбінацією гемофілії А) та активовані тромбоцити (як описано активних інгредієнтів, які можуть вводитися окрена стор. 543 роботи Monroe et al. (1997) Brit. J. мо, винахід також стосується поєднання окремих Haematol. 99, 542-547, на яку автори посилафармацевтичних композицій у формі комплекту. ються). Комплект включає принаймні дві окремі фармацеВипробування на активність фактора XIII: втичні композиції. Він також включає тару для Підходящий аналіз з випробуванням на активокремих композицій, таку як флакон з перегородність трансглутамінази фактора XIII, а отже, вибір кою або пакет із фольги з перегородкою. Як прапідходящих різновидів фактора XIII, здійснюють як вило, комплект включає інструкцію з введення просте in vitro випробування, як описано, наприокремих компонентів. Форма комплекту є особликлад, у роботі [Methods of Enzymology, т.45 (1976), во вигідною у разі, коли перевагу віддають ввеProteolytic Enzymes, ч.В, стор.177-191 (Ed. денню окремих компонентів у різних дозованих Lorand, L)]. формах, з різними інтервалами між дозами, або Даний винахід далі пояснюється за допомогою коли лікар вважає бажаним титрування окремих наведених прикладів, які, однак, не повинні тлумакомпонентів комбінації. читись як такі, що обмежують обсяг захисту. ОсоАналізи бливості, описані вище, та нижчеподані приклади Випробування на активність фактора Vlla: можуть, як окремо, такі і у будь-якій комбінації, Підходящий аналіз для випробування на актибути суттєвими для розуміння винаходу в його вність фактора Vlla, а отже, й відбір підходящих різних формах. різновидів фактора Vlla, здійснюють як просте поПриклади переднє in vitro випробування: Приклад 1. In vitro гідролітичний аналіз Фактор XIII посилює викликану фактором Vlla Природний (дикого типу) фактор Vlla та різнозсілість фібрину . вид фактора Vlla (далі обидва вказуються як "факНормальну плазму людини (NHP) розводили тор Vlla") можуть бути піддані аналізові на специ1/10 у буфері, що містив 20нМ HEPES, 150мМ фічну активність. Вони також можуть бути NaCI, 5мМ СаСІ2, рН 7,4, у мікротитрувальній лунці паралельно піддані аналізові для прямого порів(загальний об'єм 250мкл) і зсілість фібрину проняння їхньої специфічної активності. Аналіз здійсстежувалася за збільшенням оптичної густини при нюють у мікротитрувальному планшеті (MaxiSorp, 600нм у Specramax 340 (Molecular Devices, Nunc, Данія). Хромогенний субстрат D-lle-Pro-ArgSunnyvale CA). p-нітроанілід (S-2288, Chromogenix, Швеція), кінСпонтанне утворення згустка досягалося за цева концентрація 1мМ, додають до фактора Vlla приблизно 2500-3000сек. На Фіг.1 показано, що (кінцева концентрація 100нМ) у 50мМ Hepes, pH 10нМ рекомбінантного фактор Vlla (rFVIIa) (Novo 7,4, що містить 0,1Μ NaCI, 5мМ СаСІ2 та 1мг/мл Nordisk A/S Bagsvaerd, Данія) скорочували час альбуміну сироватки великої рогатої худоби. У утворення згустка до 1600сек (n=2). Подальше пристрої для зчитування планшетів SpectraMax скорочення часу утворення згустка досягалося, 340 (Molecular Devices, США) безперервно виміколи додавали 30нМ фактора XIII (FXIII) (American рюють оптичну густину при 405нм. Від значення Diagnostica inc, Greenwich, CT) разом з 10нМ оптичної густини, виявленого під час 20-хвилинної rFVIIa (n=3). Згусток, утворений у присутності FXIII, інкубації, віднімають значення оптичної густини у був прозорішим (мав нижчу максимальну оптичну чистій лунці, що не містить ферменту, і різницю густину), ніж за його відсутності, вказуючи на те, застосовують для розрахунку співвідношення пощо додавання FXIII забезпечує дрібнішу гелеву казників активності різновиду та природного факструктуру фібрину з тоншими волокнами. тора Vlla: Приклад 2. Співвідношення = (А405нм різновиду фактора Присутність додаткового фактора XIII під час Vlla)/( А405нм фактора Vlla дикого типу). викликаного фактором Vlla утворення згустка заНа основі даного рівняння можуть бути іденбезпечує збільшення стійкості до фібринолітичнотифіковані різновиди фактора Vlla з активністю, го розпаду. приблизно рівною або вищою від природного факФібриновий згусток, який складається з тонких тора Vlla, наприклад, різновиди, у яких співвідноволокон, є механічно міцнішим і важче піддається шення між активністю різновиду та активністю розпадові, ніж згусток, який містить таку саму кільприродного фактора VII, як показано на Фіг.1, стакість фібрину, але складається з товстих волокон новить приблизно 1,0, але не більше. або меншої кількості поперечно зшитих волокон. Активність фактора Vlla або різновидів фактоРезультати експерименту, наведені на Фіг.2, свідра Vlla також вимірюють, застосовуючи фізіологіччать про те, що додатковий FXIII (30нМ) подовжує ний субстрат, такий як фактор X, в оптимальному час лізису фібрину згустків, утворених у присутноваріанті - у концентрації 100-1000нМ, причому висті rFVIIa та активатора тканинного плазміногену роблений фактор Ха вимірюють після додавання (t-PA, American Diagnostica). Утворення згустка підходящого хромогенного субстрату (наприклад, ініціювали у присутності або за відсутності 30нМ S-2765). Крім того, аналіз активності може здійсFXIII шляхом додавання 25мкл NHP до 225мкл нюватися при фізіологічній температурі. 20нМ HEPES, 150мМ NaCI, 5мМ СаСІ2, рН 7,4, що Здатність фактора Vlla або різновидів фактора містив 50нМ rFVIIa та 0,5нМ рекомбінантного t-PA. Vlla до вироблення тромбіну також може бути виУтворення згустка та наступний лізис згустка, виміряна шляхом аналізу, який включає всі відповідкликані опосередкованою t-PA активацією плазмі 27 76106 28 вали для аналізу впливу rFVIIa та FXIII на максиногену, спостерігали за допомогою Spectramax мальну твердість згустка (MCF), а також стійкість 340 при 600нм як збільшення OD600нм з наступним згустка до опосередкованого t-PA лізису. Перед поверненням траєкторії до базового рівня. На Фіг.2 додаванням rFVIIa та/або FXIII досягнутий показпоказано, що час лізису згустка за цих умов значно ник MCF становив 25мм, і час, необхідний для подовжувався завдяки присутності FXIII. лізису половини згустка, становив 12,3 хвилини Приклад 3. (Фіг.3). Додавання збільшених концентрацій FXIII Фактор Vlla у комбінації з фактором XIII збіль(0-40нМ) не змінювало MCF; однак спостерігалося шує максимальну твердість згустка і стійкість згусзалежне від дози подовження часу лізису половитка до фібринолізу. ни згустка, причому оптимальні дані спостерігалиТромбеластографічні вимірювання здійснювася при 30нМ FXIII (час лізису половини згустка: ли на нормальній плазмі людини, до якої додавали 14,3хв, Фіг.3). Так само додавання rFVlia (1нМ) 6нМ рекомбінантного активатора плазміногену забезпечує захист згустка від опосередкованого tтканинного типу (t-PA, American Diagnostica), і РА фібринолізу (час лізису половини згустка аналізувати вплив додавання 1нМ rFVIIa (Novo 16,4хв) без будь-якого впливу на MCF (Фіг.3). ОдNordisk A/S, Bagsvaerd, Данія), окремо або у комнак після додавання rFVIIa (1нМ) разом з FXIII бінації з різними концентраціями фактора XIII (30нМ) спостерігали збільшення MCF (29мм), а (FXIII, Haematologic Technologies, HCXIII-0160, Lot також надійний захист від фібринолізу (час лізису N1212). Зсілість викликали додаванням інновіну половини згустка 27,1хв) (Фіг.3). Разом ці резуль(Innovin) (кінцева концентрація 2000-разового розтати демонструють, що додавання rFVIIa та FXIII чинення, Dade Behring # 526945) та кальцію (кіндо плазми синергетично поліпшує механічну міццева концентрація 15мМ) у 20мМ буфера HEPES, ність згустка та стійкість до опосередкованого t-PA 150мМ NaCI, pH 7,4. фібринолізу. Тромбеластографічні вимірювання застосову Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFormulation containing factor vііa and factor хiii, set for intravenous administration, method for increasing generation of fibrin clots, method for treatment or prophylaxis of bleeding episodes, use of factor vііa or factor хiii for manufacturing drug for treatment or prophylaxis of bleeding episodes
Автори англійськоюHedner Ulla
Назва патенту російськоюФармацевтическая композиция, содержащая фактор viia и фактор xiii, комплект для внутривенного введения, способ усиления фибринообразования и способ лечения эпизодов кровотечения, применение фактора viia и фактора xiii для лечения изготовления лекарственного средства или профилактики эпизодов кровотечения
Автори російськоюХеднер Улла
МПК / Мітки
МПК: A61K 38/36
Мітки: лікування, фармацевтична, фактор, введення, фібринового, спосіб, утворення, епізодичної, комплект, внутрішньовенного, згустка, композиція, містить, посилення, застосування, xiii, кровотечі
Код посилання
<a href="https://ua.patents.su/14-76106-farmacevtichna-kompoziciya-shho-mistit-faktor-viia-ta-faktor-xiii-komplekt-dlya-vnutrishnovennogo-vvedennya-sposib-posilennya-utvorennya-fibrinovogo-zgustka-ta-sposib-likuvannya-ep.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить фактор viia та фактор xiii, комплект для внутрішньовенного введення, спосіб посилення утворення фібринового згустка та спосіб лікування епізодичної кровотечі, застосування ф</a>
Попередній патент: Спосіб інтенсивної комплексної терапії наркозалежних
Наступний патент: Портативний стенд для вогневих випробувань ракетних двигунів у польових умовах
Випадковий патент: Установка для проточного нанесення гальванічних покриттів