Тверда фармацевтична композиція пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину і спосіб її одержання
Формула / Реферат
1. Тверда фармацевтична композиція пролонгованого вивільнення, яка містить активний інгредієнт 1-(2,3,4-триметоксибензил)піперазин або фармацевтично прийнятну сіль 1-(2,3,4-триметоксибензил)піперазину, в поєднанні з щонайменше одним поліетиленоксидом і щонайменше одним змащувальним агентом, необов'язково в комбінації з одним або більше фармацевтично прийнятними наповнювачами.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що поліетиленоксид(и) має(ють) молекулярну вагу в діапазоні від 100000 до 10000000 дальтонів.
3. Композиція за п. 1 або 2, яка відрізняється тим, що містить від 5 до 80 процентів за вагою поліетиленоксиду(ів), відносно загальної ваги композиції.
4. Композиція за п. 1 або 2, яка відрізняється тим, що містить від 20 до 50 процентів за вагою поліетиленоксиду(ів), відносно загальної ваги композиції.
5. Композиція за одним з пп. 1-4, яка відрізняється тим, що змащувальні агенти вибирають зі стеарату магнію, стеарату кальцію, стеарату цинку, тальку, фумарату стеарину натрію, силікату магнію, силікату кальцію, триосновного кальційфосфату, стеаринової кислоти, бензоату натрію, гідрогенізованих рослинних олій, гліцерилбегенату, легких мінеральних олій і поліетиленгліколю.
6. Композиція за одним з пп. 1-5, яка відрізняється тим, що додатково містить одну або більше домішок, які підвищують текучість.
7. Композиція за п. 6, яка відрізняється тим, що домішки, які підвищують текучість, вибирають з колоїдного кремнезему, тальку, діоксиду кремнію, силікату магнію і силікату кальцію.
8. Композиція за одним з пп. 1-7, яка відрізняється тим, що додатково містить один або більше зв'язувальних агентів.
9. Композиція за п. 8, яка відрізняється тим, що зв'язувальні агенти вибирають з полівінілпіролідону, співполімеру полівінілпіролідонвінілацетату, гуміарабіку, гідроколоїду, мікрокристалічної целюлози, декстринів, желатину, глюкози, гуарової смоли, крохмалю, прежелатинованого крохмалю, мальтози, мальтодекстрину, а також їх сумішей.
10. Композиція за одним з пп. 1-9, яка відрізняється тим, що додатково містить один або більше розріджувачів.
11. Композиція за п. 10, яка відрізняється тим, що розріджувачі вибирають з лактози, включаючи моногідрат лактози, мікрокристалічної целюлози, порошкоподібної целюлози, дикальційфосфату, сахарози, крохмалю або похідних крохмалю, карбонатів, включаючи карбонат кальцію або натрію, або магнію, бікарбонатів, включаючи бікарбонат кальцію або натрію, маніту, сахарози, ксиліту, сорбіту, мальтози, глюкози, двоосновного кальційфосфату, триосновного кальційфосфату, сульфату кальцію, декстрату, декстрину, фруктози, каоліну, лактитолу, декстрози, гліцерилпальмітостеарату, гідрогенізованих рослинних олій типу І, а також їх сумішей.
12. Композиція за будь-яким з пп. 1-11, яка відрізняється тим, що містить:
a) від 10 до 20 процентів за вагою 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину;
b) від 5 до 80 процентів за вагою поліетиленоксиду(ів);
c) від 0,5 до 5 процентів за вагою одного або більше змащувальних агентів; і
d) від 0 до 85 процентів за вагою додаткового(их) наповнювача(ів),
при цьому проценти за вагою підрахованівідносно загальної ваги композиції.
13. Композиція за будь-яким з пп. 1-12, яка відрізняється тим, що містить:
a) від 15 до 20 процентів за вагою 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину;
b) від 20 до 50 процентів за вагою поліетиленоксиду(ів);
c) від 0,5 до 5 процентів за вагою одного або більше змащувальних агентів; і
d) від 30 до 65 процентів за вагою додаткового(их) наповнювача(ів),
при цьому проценти за вагою підраховані відносно загальної ваги композиції.
14. Композиція за будь-яким з пп. 1-13, яка відрізняється тим, що містить:
a) 17,5 процентів за вагою 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину;
b) 37 процентів за вагою поліетиленоксиду(ів);
c) 1 процент за вагою одного або більше змащувальних агентів; і
d) 44,5 процента за вагою додаткового(их) наповнювача(ів),
при цьому проценти за вагою підраховані відносно загальної ваги композиції.
15. Композиція за будь-яким з пп. 1-14, яка відрізняється тим, що містить:
a) 17,5 процента за вагою 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину;
b) 37 процентів за вагою поліетиленоксиду(ів);
c) 0,2 процента за вагою безводного колоїдного кремнезему;
d) 40,63 процента за вагою моногідрату лактози;
е) 1,47 процента за вагою полівінілпіролідону;
f) 1 процент за вагою стеарату магнію;
g) 2 проценти за вагою тальку; і
h) 0,2 процента за вагою барвника,
при цьому проценти за вагою підраховані відносно загальної ваги композиції.
16. Композиція за будь-яким з пп. 1-15, яка відрізняється тим, що представлена у формі таблеток.
17. Композиція за п. 16, яка відрізняється тим, що кожна таблетка містить від 31,5 мг до 38,5 мг 1-(2,3,4-триметоксибензил)піперазин дигідрохлориду, більш переважно від 34 до 36 мг.
18. Композиція за п. 17, яка відрізняється тим, що кожна таблетка має вагу в діапазоні від 180 мг до 220 мг, більш переважно від 195 мг до 205 мг.
19. Композиція за будь-яким з пп. 16-18, яка відрізняється тим, що час розкладання таблетки складає більше ніж 60 хвилин.
20. Композиція за будь-яким з пп. 16-19, яка відрізняється тим, що міцність таблетки до руйнування складає від 30 до 120 ньютонів, більш переважно від 60 до 90 ньютонів.
21. Композиція за будь-яким з пп. 16-20, яка відрізняється тим, що таблетки мають наступний параметр in vitro розчинення 1-(2,3,4-триметоксибензил)піперазину в рН 1,2 буферному розчині:
- вивільнення від 35 до 65 процентів загального 1-(2,3,4-триметоксибензил)піперазину за час у 120 хвилин після початку дослідження; і
- вивільнення від 65 до 85 процентів загального 1-(2,3,4-триметоксибензил)піперазину за час у 240 хвилин після початку дослідження;
- вивільнення більше ніж або яке дорівнює 85 процентам загального 1-(2,3,4-триметоксибензил)піперазину за час у 600 хвилин після початку дослідження.
22. Композиція за будь-яким з пп. 16-21, яка відрізняється тим, що таблетки мають in vivo фармакокінетичний параметр, визначений щонайменше одним з наступних параметрів або комбінацією цих параметрів:
- площа під кривою концентрації в плазмі від 0 до нескінченності ![]() від 600 до 1170 нг·год./мл;
від 600 до 1170 нг·год./мл;
- максимальне значення концентрації в плазмі ![]() від 40 до 110 нг/мл;
від 40 до 110 нг/мл;
- значення ![]() від 2 до 6 годин; і
від 2 до 6 годин; і
- період напівжиття в плазмі ![]() від 4,5 до 10 годин.
від 4,5 до 10 годин.
23. Спосіб одержання таблеток для пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину, який включає стадію змішування 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину з щонайменше одним поліетиленоксидом, щонайменше одним змащувальним агентом і, необов'язково, одним або більше іншими фармацевтично прийнятними наповнювачами, і потім стадію одержання таблеток центральним стисненням суміші, одержаної на попередній стадії.
24. Спосіб за п. 23, який відрізняється тим, що включає наступні стадії:
a) одержання суміші з наступних складових:
- щонайменше частина кінцевої кількості 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину; і
- безводний колоїдний кремнезем;
b) додавання до суміші, одержаної на стадії а):
- необов'язково, кількості 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину, що вимагається для одержання бажаної кінцевої кількості активного інгредієнта;
- щонайменше одного поліетиленоксиду;
- полівінілпіролідону;
- моногідрату лактози;
- необов'язково, щонайменше одного барвника;
з одержанням суміші цих різних складових;
c) додавання до суміші, одержаної на стадії b):
- тальку;
- стеарату магнію;
d) одержання таблеток центральним стисненням суміші, одержаної на стадії с).
25. Спосіб за п. 24, який відрізняється тим, що на стадії а) включають третину кінцевої кількості 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину, і потім на стадії b) включають залишкові дві третини кінцевої кількості 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину.
26. Спосіб за одним з пп. 23-25, який відрізняється тим, що фармацевтично прийнятна сіль 1-(2,3,4-триметоксибензил)піперазину складається з 1-(2,3,4-триметоксибензил)піперазин дигідрохлориду.
27. Таблетка для пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину, одержана відповідно до способу за одним з пп. 23-26, яка відрізняється тим, що має наступні характеристики:
- містить від 31,5 мг до 38,5 мг 1-(2,3,4-триметоксибензил)піперазин дигідрохлориду, більш переважно від 34 до 36 мг;
- вага знаходиться в діапазоні від 180 мг до 220 мг, більш переважно від 195 мг до 205 мг;
- час розкладання складає більше ніж 60 хвилин;
- міцність до руйнування знаходиться в діапазоні від 30 до 120 ньютонів, більш переважно від 60 до 90 ньютонів.
28. Таблетка для пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину, одержана відповідно до способу за одним з пп. 23-26, яка відрізняється тим, що має наступний параметр in vitro розчинення 1-(2,3,4-триметоксибензил)піперазину в рН 1,2 буферному розчині:
- вивільнення від 35 до 65 процентів загального 1-(2,3,4-триметоксибензил)піперазину за час у 120 хвилин після початку дослідження; і
- вивільнення від 65 до 85 процентів загального 1-(2,3,4-триметоксибензил)піперазину за час у 240 хвилин після початку дослідження;
- вивільнення більше ніж або яке дорівнює 85 процентам загального 1-(2,3,4-триметоксибензил)піперазину за час у 600 хвилин після початку дослідження.
29. Таблетка для пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину, одержана відповідно до способу за одним з пп. 23-26, яка відрізняється тим, що має in vivo фармакокінетичний параметр, визначений щонайменше одним з наступних параметрів або комбінацією цих параметрів:
- площа під кривою концентрації в плазмі від 0 до нескінченності ![]() від 600 до 1170 нг·год./мл,
від 600 до 1170 нг·год./мл,
- максимальне значення концентрації в плазмі ![]() від 40 до 110 нг/мл,
від 40 до 110 нг/мл,
- значення ![]() від 2 до 6 годин;
від 2 до 6 годин;
- період напівжиття в плазмі ![]() від 4,5 до 10 годин.
від 4,5 до 10 годин.
Текст
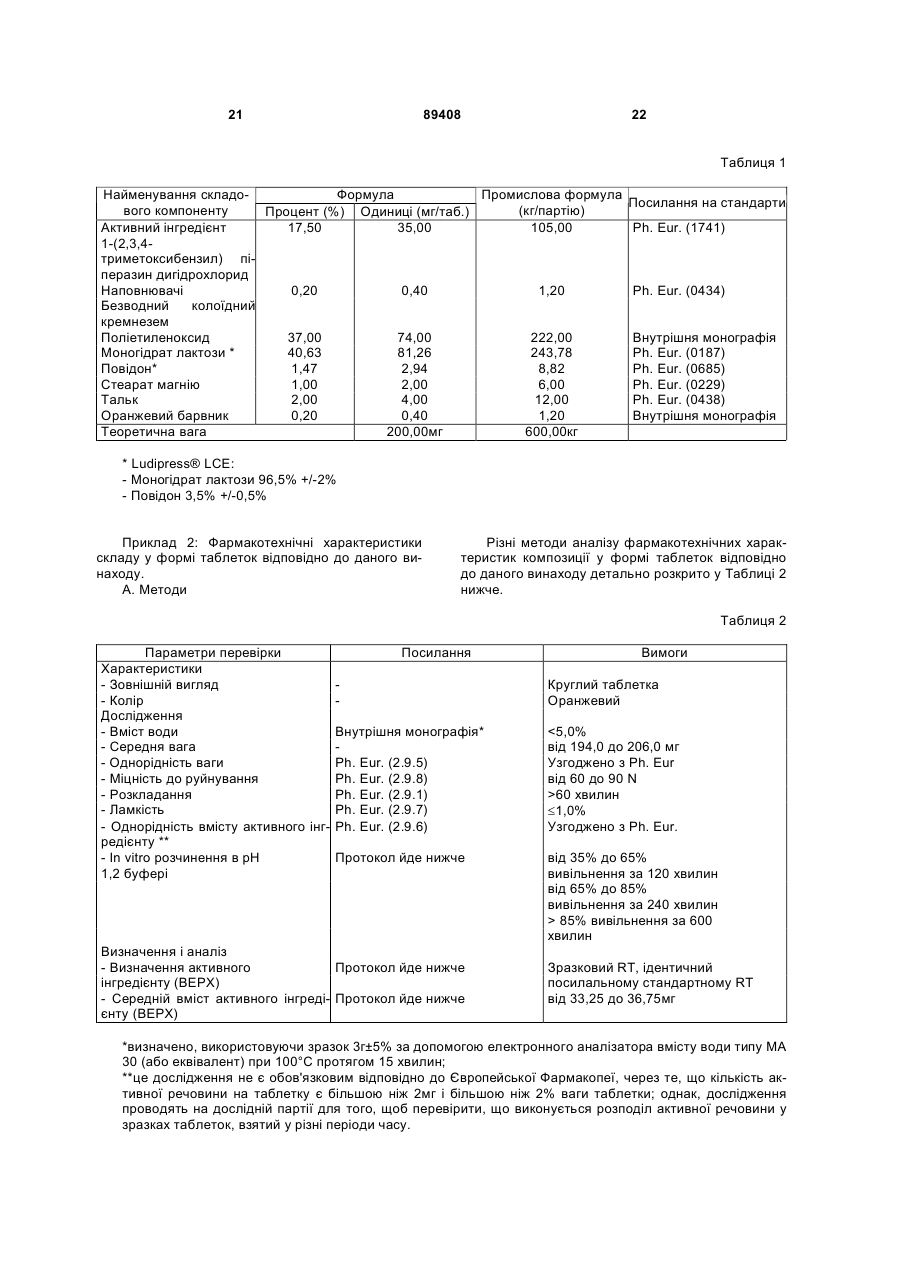
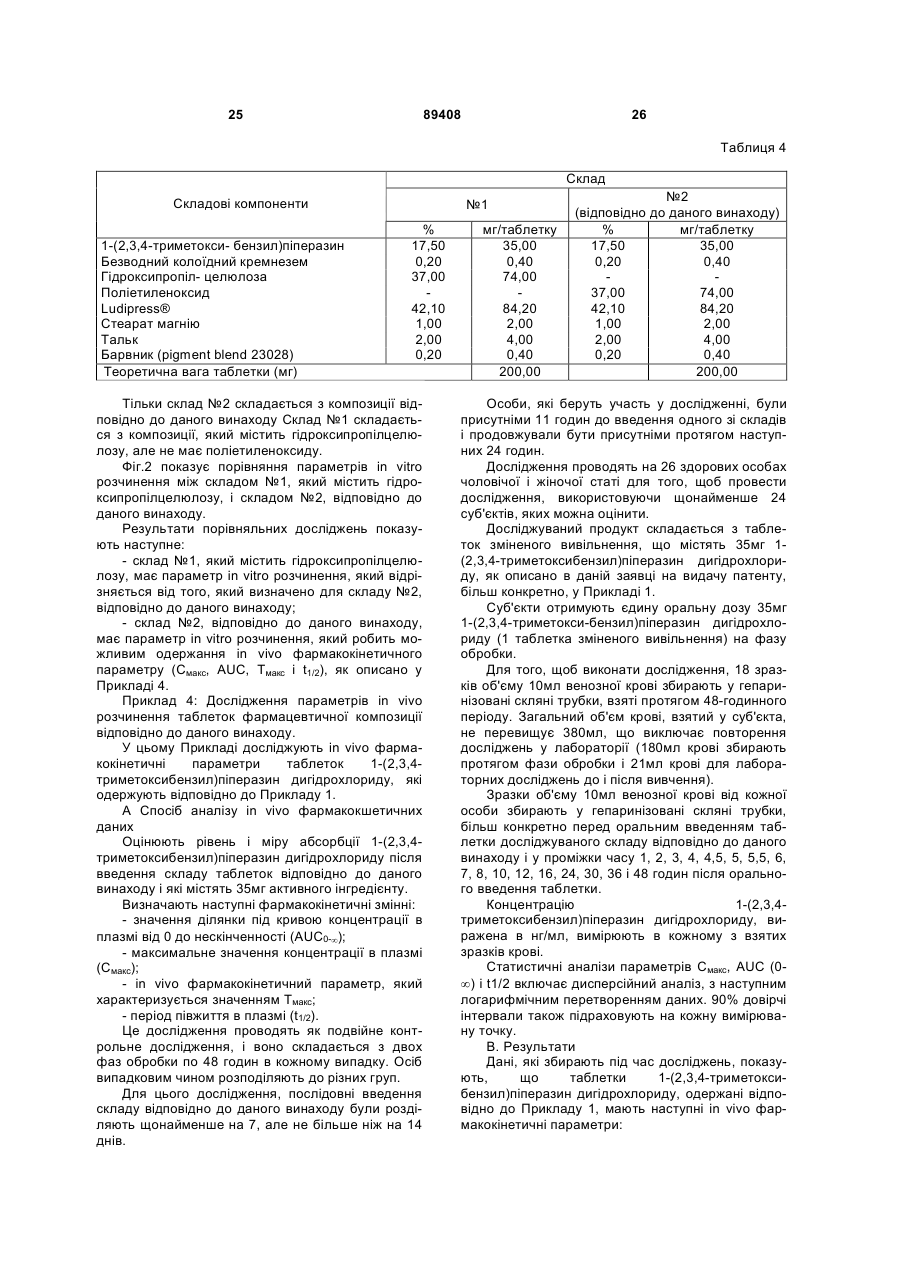
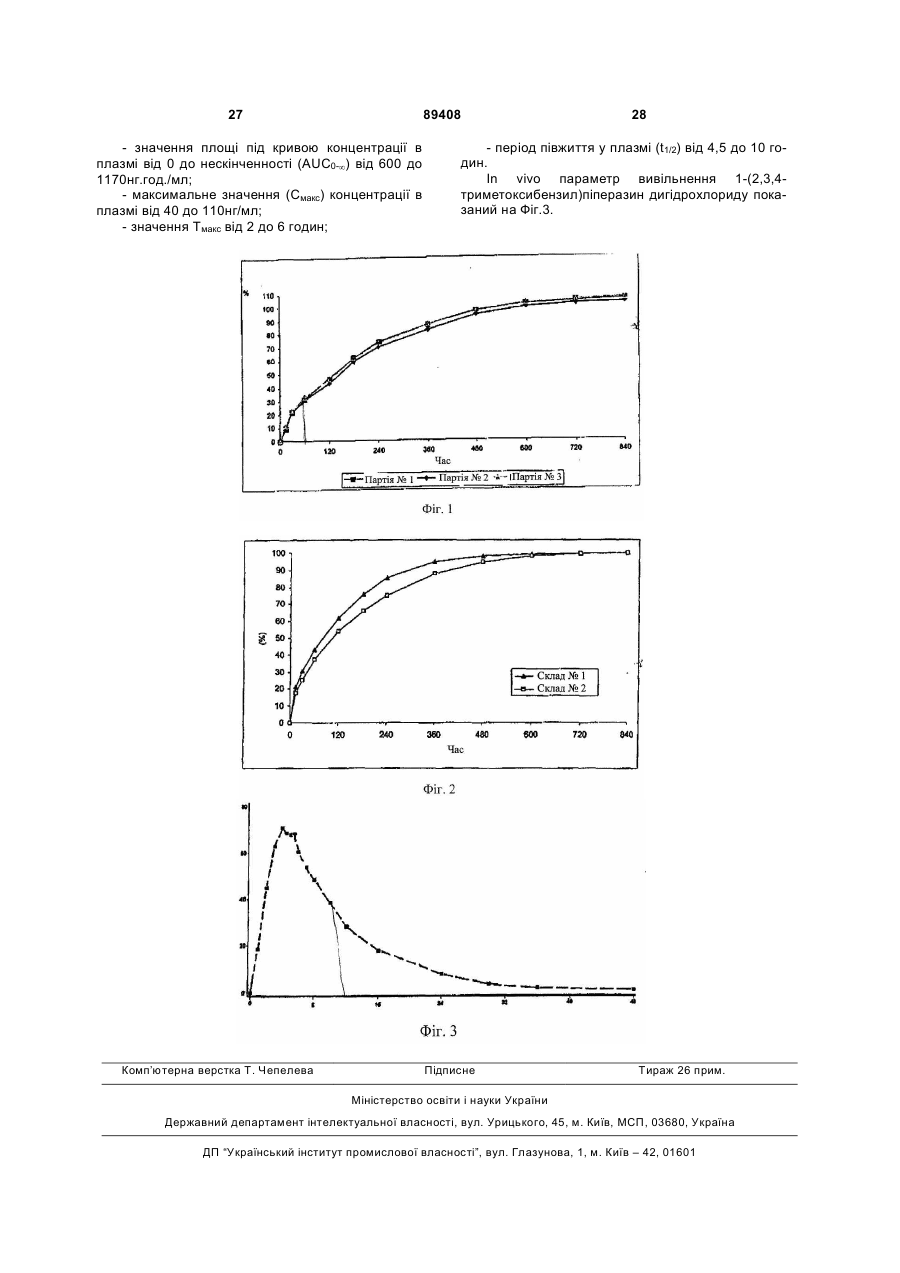
1. Тверда фармацевтична композиція пролонгованого вивільнення, яка містить активний інгредієнт 1-(2,3,4-триметоксибензил)піперазин або фармацевтично прийнятну сіль 1-(2,3,4триметоксибензил)піперазину, в поєднанні з щонайменше одним поліетиленоксидом і щонайменше одним змащувальним агентом, необов'язково в комбінації з одним або більше фармацевтично прийнятними наповнювачами. 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що поліетиленоксид(и) має(ють) молекулярну вагу в діапазоні від 100000 до 10000000 дальтонів. 3. Композиція за п. 1 або 2, яка відрізняється тим, що містить від 5 до 80 процентів за вагою поліетиленоксиду(ів), відносно загальної ваги композиції. 4. Композиція за п. 1 або 2, яка відрізняється тим, що містить від 20 до 50 процентів за вагою поліетиленоксиду(ів), відносно загальної ваги композиції. 5. Композиція за одним з пп. 1-4, яка відрізняється тим, що змащувальні агенти вибирають зі стеарату магнію, стеарату кальцію, стеарату цинку, тальку, фумарату стеарину натрію, силікату магнію, силікату кальцію, триосновного кальційфос 1-(2,3,4 UA 1 ВИВІЛЬНЕННЯ (19) ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 c) від 0,5 до 5 процентів за вагою одного або більше змащувальних агентів; і d) від 0 до 85 процентів за вагою додаткового(их) наповнювача(ів), при цьому проценти за вагою підраховані відносно загальної ваги композиції. 13. Композиція за будь-яким з пп. 1-12, яка відрізняється тим, що містить: a) від 15 до 20 процентів за вагою 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; b) від 20 до 50 процентів за вагою поліетиленоксиду(ів); c) від 0,5 до 5 процентів за вагою одного або більше змащувальних агентів; і d) від 30 до 65 процентів за вагою додаткового(их) наповнювача(ів), при цьому проценти за вагою підраховані відносно загальної ваги композиції. 14. Композиція за будь-яким з пп. 1-13, яка відрізняється тим, що містить: a) 17,5 процентів за вагою 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; b) 37 процентів за вагою поліетиленоксиду(ів); c) 1 процент за вагою одного або більше змащувальних агентів; і d) 44,5 процента за вагою додаткового(их) наповнювача(ів), при цьому проценти за вагою підраховані відносно загальної ваги композиції. 15. Композиція за будь-яким з пп. 1-14, яка відрізняється тим, що містить: a) 17,5 процента за вагою 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; b) 37 процентів за вагою поліетиленоксиду(ів); c) 0,2 процента за вагою безводного колоїдного кремнезему; d) 40,63 процента за вагою моногідрату лактози; е) 1,47 процента за вагою полівінілпіролідону; f) 1 процент за вагою стеарату магнію; g) 2 проценти за вагою тальку; і h) 0,2 процента за вагою барвника, при цьому проценти за вагою підраховані відносно загальної ваги композиції. 16. Композиція за будь-яким з пп. 1-15, яка відрізняється тим, що представлена у формі таблеток. 17. Композиція за п. 16, яка відрізняється тим, що кожна таблетка містить від 31,5 мг до 38,5 мг 1(2,3,4-триметоксибензил)піперазин дигідрохлориду, більш переважно від 34 до 36 мг. 18. Композиція за п. 17, яка відрізняється тим, що кожна таблетка має вагу в діапазоні від 180 мг до 220 мг, більш переважно від 195 мг до 205 мг. 19. Композиція за будь-яким з пп. 16-18, яка відрізняється тим, що час розкладання таблетки складає більше ніж 60 хвилин. 20. Композиція за будь-яким з пп. 16-19, яка відрізняється тим, що міцність таблетки до руйнування складає від 30 до 120 ньютонів, більш переважно від 60 до 90 ньютонів. 89408 4 21. Композиція за будь-яким з пп. 16-20, яка відрізняється тим, що таблетки мають наступний параметр in vitro розчинення 1-(2,3,4триметоксибензил)піперазину в рН 1,2 буферному розчині: - вивільнення від 35 до 65 процентів загального 1(2,3,4-триметоксибензил)піперазину за час у 120 хвилин після початку дослідження; і - вивільнення від 65 до 85 процентів загального 1(2,3,4-триметоксибензил)піперазину за час у 240 хвилин після початку дослідження; - вивільнення більше ніж або яке дорівнює 85 процентам загального 1-(2,3,4триметоксибензил)піперазину за час у 600 хвилин після початку дослідження. 22. Композиція за будь-яким з пп. 16-21, яка відрізняється тим, що таблетки мають in vivo фармакокінетичний параметр, визначений щонайменше одним з наступних параметрів або комбінацією цих параметрів: - площа під кривою концентрації в плазмі від 0 до нескінченності (AUC0 - ¥ ) від 600 до 1170 нг·год./мл; - максимальне значення концентрації в плазмі (Cмакс ) від 40 до 110 нг/мл; - значення Тмакс від 2 до 6 годин; і - період напівжиття в плазмі (t1 / 2 ) від 4,5 до 10 годин. 23. Спосіб одержання таблеток для пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину, який включає стадію змішування 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину з щонайменше одним поліетиленоксидом, щонайменше одним змащувальним агентом і, необов'язково, одним або більше іншими фармацевтично прийнятними наповнювачами, і потім стадію одержання таблеток центральним стисненням суміші, одержаної на попередній стадії. 24. Спосіб за п. 23, який відрізняється тим, що включає наступні стадії: a) одержання суміші з наступних складових: - щонайменше частина кінцевої кількості 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; і - безводний колоїдний кремнезем; b) додавання до суміші, одержаної на стадії а): необов'язково, кількості 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину, що вимагається для одержання бажаної кінцевої кількості активного інгредієнта; - щонайменше одного поліетиленоксиду; - полівінілпіролідону; - моногідрату лактози; - необов'язково, щонайменше одного барвника; з одержанням суміші цих різних складових; c) додавання до суміші, одержаної на стадії b): - тальку; 5 89408 6 - стеарату магнію; d) одержання таблеток центральним стисненням суміші, одержаної на стадії с). 25. Спосіб за п. 24, який відрізняється тим, що на стадії а) включають третину кінцевої кількості 1(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину, і потім на стадії b) включають залишкові дві третини кінцевої кількості 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину. 26. Спосіб за одним з пп. 23-25, який відрізняється тим, що фармацевтично прийнятна сіль 1(2,3,4-триметоксибензил)піперазину складається з 1-(2,3,4-триметоксибензил)піперазин дигідрохлориду. 27. Таблетка для пролонгованого вивільнення 1(2,3,4-триметоксибензил)піперазину, одержана відповідно до способу за одним з пп. 23-26, яка відрізняється тим, що має наступні характеристики: містить від 31,5 мг до 38,5 мг 1-(2,3,4триметоксибензил)піперазин дигідрохлориду, більш переважно від 34 до 36 мг; - вага знаходиться в діапазоні від 180 мг до 220 мг, більш переважно від 195 мг до 205 мг; - час розкладання складає більше ніж 60 хвилин; - міцність до руйнування знаходиться в діапазоні від 30 до 120 ньютонів, більш переважно від 60 до 90 ньютонів. 28. Таблетка для пролонгованого вивільнення 1(2,3,4-триметоксибензил)піперазину, одержана відповідно до способу за одним з пп. 23-26, яка відрізняється тим, що має наступний параметр in vitro розчинення 1-(2,3,4триметоксибензил)піперазину в рН 1,2 буферному розчині: - вивільнення від 35 до 65 процентів загального 1(2,3,4-триметоксибензил)піперазину за час у 120 хвилин після початку дослідження; і - вивільнення від 65 до 85 процентів загального 1(2,3,4-триметоксибензил)піперазину за час у 240 хвилин після початку дослідження; - вивільнення більше ніж або яке дорівнює 85 процентам загального 1-(2,3,4триметоксибензил)піперазину за час у 600 хвилин після початку дослідження. 29. Таблетка для пролонгованого вивільнення 1(2,3,4-триметоксибензил)піперазину, одержана відповідно до способу за одним з пп. 23-26, яка відрізняється тим, що має in vivo фармакокінетичний параметр, визначений щонайменше одним з наступних параметрів або комбінацією цих параметрів: - площа під кривою концентрації в плазмі від 0 до нескінченності (AUC0 - ¥ ) від 600 до 1170 нг·год./мл, - максимальне значення концентрації в плазмі (Cмакс ) від 40 до 110 нг/мл, Даний винахід стосується галузі удосконалення твердих фармацевтичних композицій пролонгованого вивільнення активного інгредієнта 1-(2,3,4триметоксибензил)піперазину. Активний інгредієнт 1-(2,3,4триметоксибензил)піперазин належить до хімічного класу сполук піперазину; він має наступну формулу: його дії на енергетичний обмін. Цей вплив може бути добре пов'язаний з інгібуванням ліпідного окислення і збільшенням окислення глюкози. В даний момент, 1-(2,3,4триметоксибензил)піперазин переважно використовують у фармацевтичних композиціях, які мають протистенокардійний вплив, які призначені для пацієнтів зі стенокардією, включаючи стенокардію напруження, запаморочення, вестибулярний синдром, а також для лікування циклоспориніндукованої нефропатії. Взагалі, 1-(2,3,4-триметоксибензил)піперазин використовують у формі фармацевтично прийнятної солі активного інгредієнта, більш конкретно 1(2,3,4-триметоксибензил)піперазин дигідрохлориду. 1-(2,3,4-Триметоксибензил)піперазин дигідрохлорид швидко абсорбується і виводиться з організму, період півжиття його в плазмі є меншим, ніж 6 годин. З цієї причини різні склади 1-(2,3,4триметоксибензил)піперазину, які мають уповільнений ефект, були запропоновані в попередньому рівні техніки. Європейська заявка на видачу патенту №ЕР 673 649, відповідно, описує уповільнену дію композиції 1-(2,3,4-триметоксибензил)піперазину, в якій пролонговане вивільнення 1-(2,3,4 1-(2,3,4-Триметоксибензил)піперазин являє собою сполуку, яка, за допомогою підтримання енергетичного обміну клітин, підданих гіпоксії або ішемії, запобігає руйнуванню внутрішньоклітинного рівня аденозин трифосфату (АТР). 1-(2,3,4Триметоксибензил)піперазин, відповідно, гарантує функціонування іонних насосів і трансмембранних потоків калію-натрію і підтримує клітинний гомеостаз. Відповідно, 1-(2,3,4триметоксибензил)піперазин має міокардіальний і мозковий антибезкисневий вплив за допомогою - значення Тмакс від 2 до 6 годин; - період напівжиття в плазмі (t1 / 2 ) від 4,5 до 10 годин. 7 триметоксибензил)піперазину стає можливим за допомогою комбінації полімеру, який є нерозчинним у воді, такого як етилцелюлоза або поліметакрилат, з пластифікуючою речовиною. Пластифікуючі речовини, які мають хорошу водопроникність, являють собою ті агенти, з якими одержують найкращі результати постійного вивільнення 1-(2,3,4-триметоксибензил)піперазину. Відповідно до Європейської заявки на видачу патенту №ЕР 673 649, комбінація полімеру, який є нерозчинним у воді, з пластифікуючою речовиною робить можливим одержання відносно проникної плівки, що дозволяє одержати постійне вивільнення активного інгредієнта. Приклади показують, з метою ілюстрації, таблетки, які включають комбінацію нерозчинного полімеру - етилцелюлози і пластифікуючої речовини - цитрат ацетил трибутилу. Таблетки, які описують в Європейській заявці на видачу патенту №ЕР 673 649, одержують шляхом способу мокрої грануляції. Після фази мокрої грануляції слідує етап стиснення активного інгредієнта і суміші наповнювачів в таблетки, які змащують, перед тим як наносять покриття, використовуючи розчин або суспензію, що містить комбінацію вибраного водонерозчинного полімеру і пластифікуючої речовини так, щоб досягнути хорошого покриття таблетки полімерною плівкою, забезпечуючи контрольоване вивільнення 1-(2,3,4-триметоксибензил)піперазину. Французька заявка на видачу патенту, опублікована під №FR 2.818.549, розкриває композиції для контрольованого вивільнення 1-(2,3,4триметоксибензил)піперазину, в якому контроль вивільнення активного інгредієнта одержують за допомогою того факту, що використовують полімери поліметакрилатної групи, які володіють властивостями пластичності, без додавання пластифікуючої речовини. Поліметакрилати, які описують у цій Французькій заявці на видачу патенту, являють собою поліметакрилати Eudragit®. Фармацевтичні композицій, які описують у Французькій заявці на видачу патенту №FR 2.818.549, одержують за допомогою вироблення термоутворюваної суміші активного інгредієнта і поліметакрилату(ів), з наступною стадією співекструзії або співінжекції під тиском. Європейська заявка на видачу патенту №ЕР 1.108.424 розкриває фармацевтичні композиції пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину, де активний інгредієнт включають в гідрофільну матрицю, яка складається з полімеру похідного від целюлози, більш конкретно, ефір целюлози, такої як гідроксипропілцелюлоза, гідроксіетилцелюлоза, гідроксиметилцелюлоза, метилцелюлоза і гідроксипропіл метилцелюлоза. Фармацевтичні композиції, описані в Європейській заявці на видачу патенту № ЕР 1.108.424, одержують за допомогою способу, який включає стадію гранулювання 1-(2,3,4триметоксибензил)піперазину і зв'язувальної речовини за допомогою мокрої грануляції, з наступним змішуванням одержаного грануляту з гідро 89408 8 ксипропіл метилцелюлозою, перед стадіями змащування і стиснення. Деякі фармацевтичні композиції контрольованого вивільнення 1-(2,3,4триметоксибензил)піперазину, що описуються у попередньому рівні техніки, дозволяють одержати вивільнення такого активного інгредієнта постійно протягом часу і, відповідно, мають задовільні фармакотехнічні характеристики, особливо по відношенню до параметру in vitro розчинення. Однак, беручи до уваги високе терапевтичне значення 1-(2,3,4-триметоксибензил)піперазину, у попередньому рівні техніки існує потреба у нових фармацевтичних композиціях пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину, які мають хороші фармакотехнічні характеристики, особливо по відношенню до параметру in vitro розчинення, які є щонайменше такими ж задовільними, як і ті, які вже були запропоновані. Крім того, у попередньому рівні техніки існує потреба у фармацевтичних композиціях контрольованого вивільнення 1-(2,3,4триметоксибензил)піперазину, які можуть бути одержані за допомогою способів, які є більш простими і менш обтяжливими, ніж способи, які використовують для одержання відомих композицій. Даний винахід забезпечує нові тверді фармацевтичні композиції пролонгованого вивільнення 1(2,3,4-триметоксибензил)піперазину, які мають фармакотехнічні характеристики, які є щонайменше такими ж задовільними, як і деякі з вже відомих фармацевтичних композицій контрольованого вивільнення 1-(2,3,4-триметоксибензил)піперазину, і можуть бути одержані відповідно до простого і недорогого способу. Даний винахід стосується твердої фармацевтичної композиції пролонгованого вивільнення, яка містить активний інгредієнт 1-(2,3,4триметоксибензил)піперазин, або фармацевтично прийнятну сіль 1-(2,3,4триметоксибензил)піперазину, в поєднанні з щонайменше одним поліетиленоксидом і щонайменше одним змащувальним агентом, необов'язково в комбінації з одним або більше фармацевтично прийнятним наповнювачем. Відповідно до даного винаходу, було показано, несподівано, що тверда фармацевтична композиція пролонгованого вивільнення 1-(2,3,4триметоксибензил)-піперазину могла б бути одержана, коли 1-(2,3,4-триметоксибензил)піперазин був об'єднаний з щонайменше одним поліетиленоксидом і щонайменше одним змащувальним агентом. Більш конкретно, було показано, відповідно до даного винаходу, що комбінація 1-(2,3,4триметоксибензил)піперазину, або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину, з щонайменше одним поліетиленоксидом і щонайменше одним змащувальним агентом робить можливим одержання твердої фармацевтичної композиції, фармакотехнічні характеристики якої, включаючи in vitro параметр вивільнення активного інгредієнта і in vivo фармакокінетичний параметр, були подібними, або навіть ідентичними, характеристикам 9 деяких фармацевтичних композицій пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину, які вже є на ринку. Крім того, як буде описано детально нижче в описі, нові тверді фармацевтичні композиції, відповідно до даного винаходу, пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину можуть бути одержані простим способом центрального стиснення суміші активного інгредієнта і наповнювачів, не вимагаючи стадії грануляції, чи то сухої або мокрої грануляції, і стадії екструзії або, альтернативно, інжекції під тиском. Поліетиленоксид являє собою сполуку, яка має наступну формулу: в якій n являє собою ціле число, яке може значно змінюватись, наприклад від 102до106. Було показано, що, для виготовлення твердих фармацевтичних композицій відповідно до даного винаходу, які мають хороші характеристики щодо пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину, найкращі результати були одержані, використовуючи поліетиленоксид високої молекулярної ваги, переважно поліетиленоксид, в якому значення n змінюється від 104 до 5´105. Переважно, використовують поліетиленоксид, який має молекулярну вагу в діапазоні від 100000 до 10000000, більш переважно від 1 000 000 до 10 000 000 і навіть більш переважно від 4 000 000 до 10 000 000. З метою прикладу, може бути використаний поліетиленоксид, який має молекулярне вагу в діапазоні від 6 000 000 до 8 000 000, наприклад близько 7 000 000. Особливо може бути використаний поліетиленоксид, розчин якого, маючи концентрацію 1% за вагою, має в'язкість при 25°С від 7500мПа/с до 10,000мПа/с включно (умовна одиниця:мПа/с). Переважно, тверда фармацевтична композиція пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину відповідно до даного винаходу містить від 5% до 80% за вагою поліетиленоксиду, відносно загальної ваги згаданої композиції. Переважно, тверда фармацевтична композиція відповідно до даного винаходу містить від 20% до 50% за вагою поліетиленоксиду, відносно загальної ваги композиції. Коли вміст поліетиленоксиду є меншим ніж 5% за вагою, відносно загальної ваги композиції, активний інгредієнт 1-(2,3,4триметоксибензил)піперазин вивільняється швидко, що призводить до деяких несприятливих умов, беручи до уваги короткий період півжиття його в організмі. Коли вміст поліетиленоксиду перевищує 80% за вагою, вивільнення активного інгредієнту 1-(2,3,4-триметоксибензил)піперазину по суті уповільнюється, що призводить до інших несприятливих умов, які виникають з того факту, що концентрація 1-(2,3,4-триметоксибензил)піперазину в плазмі, або фармацевтично прийнятної солі акти 89408 10 вного інгредієнта, є недостатньою, щоб досягти оптимальної терапевтичної ефективності. Відповідно до переважного втілення твердої фармацевтичної композиції відповідно до даного винаходу, ця композиція містить від 33% за вагою до 41% за вагою поліетиленоксиду, відносно загальної ваги згаданої композиції. З метою прикладу, тверда фармацевтична композиція пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину, відповідно до даного винаходу, містить 37% за вагою поліетиленоксиду, відносно загальної ваги згаданої композиції. У деяких втіленнях композиції відповідно до даного винаходу може використовуватись комбінація декількох поліетиленоксидів, наприклад, 2, 3, 4 або 5 поліетиленоксидів, які мають різну молекулярну вагу в межах діапазону молекулярної ваги поліетиленоксидів, визначеної вище в даному описі. Було показано, що для виробництва фармацевтичної композиції відповідно до даного винаходу використання поліетиленоксиду було значно кращим за використання інших розчинних у воді полімерів, особливо полімерів похідних целюлози, такої як гідроксипропілцелюлоза. Крім того, було показано, що використання одного або більше поліетиленоксидів не вимагало додавання пластифікуючої речовини. Як вже було згадано, тверда фармацевтична композиція відповідно до даного винаходу може також містити, в доповнення до активного інгредієнта, який поєднують з щонайменше одним поліетиленоксидом і щонайменше одним змащувальним агентом, однин або більше фармацевтично прийнятний наповнювач. Переважно, змащувальні агенти вибирають зі стеарату магнію, стеарату кальцію, стеарату цинку, тальку, фумарату стеарину натрію, силікату магнію, силікату кальцію, трьохосновного кальцій фосфату, стеаринової кислоти, бензоату натрію, гідрогенізованих рослинних олій, гліцерил бегенату, легких мінеральних олій і поліетилен гліколю. Переважно, композиція містить одну або більше домішок, що підвищують текучість Серед домішок, що підвищують текучість, можуть бути згадані колоїдний кремнезем, діоксид кремнію, силікат магнію, силікат кальцію і тальк; переважно вибирають колоїдний кремнезем і тальк. Домішку(и), що підвищує(ють) текучість, головним чином використовують в комбінації з 1-(2,3,4триметоксибензил)піперазином, або фармацевтично прийнятною сіллю 1-(2,3,4триметоксибензил)піперазину, в одержанні твердого основного матеріалу у формі порошку, в якому 1-(2,3,4-триметоксибензил)піперазин рівномірно розподіляється і який має хороші характеристики текучості. Переважно, композиція відповідно до даного винаходу включає один або більше зв'язувальних агентів. Переважно, зв'язувальні агенти вибирають з полівінілпіролідону, співполімеру полівінілпіролідон-вініл ацетат, акації, гуміарабіку, гідроколоїдів, мікрокристалічної целюлози, декстринів, желатину, глюкози, гуарової смоли, крохмалю, прежелатино 11 ваного крохмалю, мальтози, мальтодекстрину, а також їх сумішей. Гідроколоїди можуть бути вибрані з альгінової кислоти, солі альгінової кислоти, такої як альгінат натрію, похідного альгінової кислоти, карагеніну, а також похідного карагеніну. Зв'язувальний(і) агент(и) головним чином дає(ють) можливість одержати кінцеву фармацевтичну композицію, особливо у формі таблеток, що має хороші механічні характеристики, особливо хороші характеристики розкладання. Переважно, композиція відповідно до даного винаходу додатково включає один або більше розріджувачів. Розріджувачі переважно вибирають з лактози, включаючи моногідрат лактози, мікрокристалічної целюлози, порошкоподібної целюлози, дикальцій фосфату, сахарози, крохмалю або похідних крохмалю, карбонату, включаючи карбонат кальцію або натрію або магнію, бікарбонатів, включаючи, бікарбонат кальцію або натрію, маніту, сахарози, ксиліту, сорбіту, мальтози, глюкози, двохосновного кальцій фосфату, трьохосновного кальцій фосфату, сульфату кальцію, декстрату, декстрину, фруктози, каоліну, лактитолу, декстрози, гліцерил пальмітостеарату, гідрогенізованих рослинних олій типу І, а також їх сумішей. Розріджувач(і) головним чином дає(ють) можливість одержати кінцеву фармацевтичну композицію контрольованого об'єму або розміру, в якій різні активні інгредієнти та інші ексципієнти однорідно розподілені. Винахід стосується також твердої фармацевтичної композиції пролонгованого вивільнення 1(2,3,4-триметоксибензил)піперазину, яка відрізняється тим, що включає: a) від 10 до 20 процентів за вагою 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; b) від 5 до 80 процентів за вагою поліетиленоксиду(ів); c) від 0,5 до 5 процентів за вагою одного або більше змащувальних агентів; і d) від 0 до 85 процентів за вагою додаткового(их) наповнювача(ів), при цьому проценти за вагою підраховані відносно загальної ваги композиції. Винахід стосується також твердої фармацевтичної композиції пролонгованого вивільнення 1(2,3,4-триметоксибензил)піперазину, яка відрізняється тим, що включає: a) від 15 до 20 процентів за вагою 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; b) від 20 до 50 процентів за вагою поліетиленоксиду(ів); c) від 0,5 до 5 процентів за вагою одного або більше змащувальних агентів; і d) від 30 до 65 процентів за вагою додаткового(их) наповнювача(ів), при цьому проценти за вагою підраховані відносно загальної ваги композиції. 89408 12 Винахід стосується крім того до твердої фармацевтичної композиції пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину, яка відрізняється тим, що включає: a) 17,5 процентів за вагою 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; b) 37 процентів за вагою поліетиленоксиду(ів); c) 1 процент за вагою одного або більше змащувальних агентів; і d) 44,5 процентів за вагою додаткового(их) наповнювача(ів), при цьому проценти за вагою підраховані відносно загальної ваги композиції. Як вже було згадано тут вище, наявність поліетиленоксиду в комбінації з 1-(2,3,4триметоксибензил)піперазином або фармацевтично прийнятною сіллю 1-(2,3,4триметоксибензил)піперазину, не вимагає наявності пластифікуючої речовини для того, щоб одержати бажані фармакотехнічні характеристики. Крім того, як проілюстровано у Прикладах, використання полімеру, похідного від целюлози, особливо гідроксипропілцелюлози, не дозволяє одержувати тверду фармацевтичну композицію пролонгованого вивільнення 1-(2,3,4триметоксибензил)- піперазину, яка має фармакотехнічні характеристики, особливо in vitro параметр вивільнення 1-(2,3,4триметоксибензил)піперазину, відповідно до вимог. З гідроксипропілцелюлозою вивільнення 1(2,3,4-триметоксибензил)піперазину є занадто швидким. До того ж, переважно, фармацевтична композиція відповідно до даного винаходу не містить полімер, похідний від целюлози. Взагалі, тверда фармацевтична композиція відповідно до даного винаходу включає (і) активний інгредієнт 1-(2,3,4триметоксибензил)піперазин або фармацевтично прийнятна сіль 1-(2,3,4триметоксибензил)піперазину, (іі) щонайменше один поліетиленоксид, (ііі) щонайменше одну домішку, яка підвищує текучість, (iv) щонайменше один зв'язувальний агент, (ν) щонайменше один розріджувач і (vi) щонайменше один змащувальний агент. Відповідно до переважного втілення, тверда фармацевтична композиція відповідно до даного винаходу включає, як наповнювачі, інші ніж поліетиленоксид, більш конкретно, від 2 до 10% за вагою однієї або більше домішок, які підвищують текучість, від 50 до 97% за вагою одного або більше розріджувачів, від 0,5 до 5% за вагою одного або більше зв'язувальних агентів і від 0,5 до 5% за вагою одного або більше змащувальних агентів, проценти за вагою виражають відносно загальної ваги наповнювачів, інших ніж поліетиленоксид. Тверда фармацевтична композиція відповідно до даного винаходу може також містити один або більше барвників, рівень яких, взагалі, не перевищує 1% за вагою відносно загальної ваги згаданої композиції і рівень яких є часто меншим ніж 0,5% за вагою відносно загальної ваги згаданої композиції. 13 Перевага надається використанню колоїдного кремнезему і/або тальку як домішки, що підвищує текучість. Перевага надається використанню моногідрату лактози як розріджувача. Перевага надається використанню полівінілпіролідону, також надалі повідону, як зв'язувального агенту. Перевага надається використанню стеарату магнію як змащувального агенту. У конкретному втіленні твердої фармацевтичної композиції відповідно до даного винаходу використовують склад, який об'єднує розріджувач і зв'язувальний агент, такий як склад, який продається на ринку під найменуванням LUDIPRESS® компанією BASF PHARMA, що включає 96,5% за вагою моногідрату лактози і 3,5% за вагою повідону відносно загальної ваги згаданого складу, який об'єднує розріджувач і зв'язувальний агент. Відповідно до переважного втілення, тверда фармацевтична композиція пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину відрізняється тим, що включає: a) 17,5 процентів за вагою 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4-триметоксибензил)піперазину; b) 37 процентів за вагою поліетиленоксиду(ів); і c) 0,2 процентів за вагою безводного колоїдного кремнезему; d) 40,63 процентів за вагою моногідрату лактози; e) 1,47 процентів за вагою полівінілпіролідону; f) 1 процент за вагою стеарату магнію; g) 2 проценти за вагою тальку; і h) 0,2 процентів за вагою барвника, при цьому проценти за вагою підраховані відносно загальної ваги композиції. 1-(2,3,4-Триметоксибензил)піперазин, який використовують у фармацевтичній композиції відповідно до даного винаходу, переважно знаходиться у формі дигідрохлориду. Перевага надається застосуванню порошку 1(2,3,4-триметоксибензил)-піперазин дигідрохлориду з малим розміром частинок, так щоб активний інгредієнт однорідно був розподілений в кінцевій фармацевтичній композиції. Переважно використовують порошок 1-(2,3,4триметоксибензил)піперазин дигідрохлориду, середній діаметр частинок якого змінюється від 5 мкм до 30 мкм, більш переважно від 10 мкм до 20 мкм, як виміряно шляхом визначення розміру частинок у сухому стані, як описано у Прикладах. Тверда фармацевтична композиція відповідно до даного винаходу переважно знаходиться у формі таблеток. За допомогою комбінації активного інгредієнта і наповнювачів, які містяться у фармацевтичній композиції за даним винаходом, кінцевий склад у формі таблеток може, фактично, легко бути одержаний простим способом прямого стиснення суміші активного інгредієнта і наповнювачів, фармакотехнічні характеристики яких є оптимальними. 89408 14 Переважно, кожна таблетка містить від 31,5мг до 38,5мг 1-(2,3,4-триметоксибензил)піперазин дигідрохлориду, більш переважно від 34мг до 36мг. Переважно, кожна таблетка має вагу в діапазоні від 180мг до 220мг, більш переважно від 195мг до 205мг. Такі таблетки є прийнятними завдяки хорошій сумісності для частини пацієнтів. Крім того, за допомогою нової комбінації активного інгредієнта і наповнювачів твердої фармацевтичної композиції даного винаходу можливо одержати таблетки, які мають час розкладання таблетки більший ніж 60 хвилин. Подібним чином, за допомогою використання твердої фармацевтичної композиції даного винаходу можливо одержати таблетки, які мають міцність до руйнування в діапазоні від 30 до 120 ньютонів, більш переважно від 60 до 90 ньютонів. Крім того, таблетки, які можуть бути одержані, використовуючи тверду фармацевтичну композицію даного винаходу, можуть мати параметр in vitro розчинення, а також параметр in vivo фармакокінетичний параметр для 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину, які є дуже задовільними, беручи до уваги бажану мету пролонгованого вивільнення активного інгредієнта, і демонструючи хорошу терапевтичну ефективність. Відповідно, за допомогою твердої фармацевтичної композиції даного винаходу можливо одержати таблетки, які мають наступний параметр in vitro розчинення 1-(2,3,4триметоксибензил)піперазину в рН1,2 буферному розчині: - вивільнення від 35 до 65 процентів загального 1-(2,3,4-триметоксибензил)-піперазину за час у 120 хвилин після початку дослідження; і - вивільнення від 65 до 85 процентів загального 1-(2,3,4-триметоксибензил)-піперазину за час у 240 хвилин після початку дослідження; - вивільнення, більше ніж або яке дорівнює 85 процентам загального 1-(2,3,4триметоксибензил)піперазину, за час у 600 хвилин після початку дослідження. За допомогою твердої фармацевтичної композиції даного винаходу можливо одержати таблетки 1-(2,3,4-триметоксибензил)піперазину, які мають наступний in vivo фармакокінетичний параметр: переважно, таблетка 1-(2,3,4триметоксибензил)піперазину даного винаходу має in vivo фармакокінетичний параметр, який характеризується площею під кривою концентрації в плазмі від 0 до нескінченності (AUC0-¥) від 600 до 1170нг.год./мл, переважно, таблетка 1-(2,3,4триметоксибензил)піперазину даного винаходу має in vivo фармакокінетичний параметр, який характеризується максимальним значенням концентрації в плазмі (Смакс) від 40 до 110нг/мл, переважно, таблетка 1-(2,3,4триметоксибензил)піперазину даного винаходу має in vivo фармакокінетичний параметр, який характеризується значенням Тмакс від 2 до 6 годин; 15 кваліфікований в даній галузі фахівець зрозуміє, що "Значення Тмакс" є часом, який вимагається, щоб одержати максимальну концентрацію активного інгредієнта в плазмі, переважно, таблетка 1-(2,3,4триметоксибензил)піперазину даного винаходу має in vivo фармакокінетичний параметр, який характеризується періодом півжиття в плазмі (t1/2) від 4,5 до 10 годин. Винахід стосується також способу одержання таблеток для пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину, який включає стадію одержання суміші 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину з щонайменше одним поліетиленоксидом, щонайменше одним змащувальним агентом і, необов'язково, одним або більше іншим фармацевтично прийнятним наповнювачем, і потім стадію одержання таблеток центральним стисненням суміші, одержаної на попередній стадії. Більш конкретно, винахід стосується способу одержання таблеток для пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину, який включає наступні стадії: а) одержання суміші з наступних складових: - щонайменше частина кінцевої кількості 1(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; і - щонайменше одна домішка, що підвищує текучість; b) додавання до суміші, яку одержують на стадії а): необов'язково, кількості 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину, що вимагається для одержання бажаної кінцевої кількості активного інгредієнту; - щонайменше одного поліетиленоксиду; - щонайменше одного зв'язувального агенту; - щонайменше одного розріджувача; - необов'язково, щонайменше одного барвника; для одержання суміші цих різних складових; c) додавання до суміші, яку одержують на стадії b): - щонайменше одного змащувального агенту; - щонайменше одного антистатику; d) одержання таблеток центральним стисненням суміші, яку одержують на стадії с). Винахід стосується також способу одержання таблеток для пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину, який включає наступні стадії: a) одержання суміші з наступних складових: - щонайменше частина кінцевої кількості 1(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину; і - безводний колоїдний кремнезем; b) додавання до суміші, яку одержують на стадії а): 89408 16 необов'язково, кількості 1-(2,3,4триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину, що вимагається для одержання бажаної кінцевої кількості активного інгредієнту; - щонайменше одного поліетиленоксиду; - полівінілпіролідону; - моногідрату лактози; - необов'язково, щонайменше одного барвника; для одержання суміші цих різних складових; c) додавання до суміші, яку одержують на стадії b): - тальку; - стеарату магнію; d) одержання таблеток центральним стисненням суміші, яку одержують на стадії с). У деяких втіленнях визначених вище способів, на стадії а) включають третину кінцевої кількості 1(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину, і потім на стадії b) включають залишкові дві третини кінцевої кількості 1-(2,3,4-триметоксибензил)піперазину або фармацевтично прийнятної солі 1-(2,3,4триметоксибензил)піперазину. 1-(2,3,4-Триметоксибензил)піперазин, який використовують у способах, вказаних вище, переважно знаходиться у формі дигідрохлориду. Винахід стосується також таблетки для пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину, яку одержують будь-яким визначеним тут вище способом, яка відрізняється тим, що має наступні характеристики: - вона містить від 31,5мг до 38,5мг 1-(2,3,4триметоксибензил)піперазин дигідрохлориду, більш переважно від 34 до 36мг; - її вага знаходиться в діапазоні від 180мг до 220мг, більш переважно від 195мг до 205мг; - час її розкладання складає більше ніж 60 хвилин; - її міцність до руйнування знаходиться в діапазоні від 30 до 120 ньютонів, більш переважно від 60 до 90 ньютонів. Таблетка для пролонгованого вивільнення 1(2,3,4-триметоксибензил)піперазину, яку одержують відповідно до одного з визначених вище способів, головним чином відрізняється тим, що вона має наступний параметр in vitro розчинення 1(2,3,4-триметоксибензил)піперазину в рН1,2 буферному розчині: - вивільнення від 35 до 65 процентів загального 1-(2,3,4-триметоксибензил)-піперазину за час у 120 хвилин після початку дослідження; і - вивільнення від 65 до 85 процентів загального 1-(2,3,4-триметоксибензил)-піперазину за час у 240 хвилин після початку дослідження; - вивільнення, більше ніж або яке дорівнює 85 процентам загального 1-(2,3,4триметоксибензил)піперазину, за час у 600 хвилин після початку дослідження. Таблетка для пролонгованого вивільнення 1(2,3,4-триметоксибензил)піперазину, яку одержують відповідно до одного з визначених вище спо 17 собів, головним чином відрізняється тим, що вона має in vivo фармакокінетичний параметр, визначений щонайменше одним з наступним параметрів або комбінацією цих параметрів: переважно, таблетка 1-(2,3,4триметоксибензил)піперазину даного винаходу має in vivo фармакокінетичний параметр, який характеризується площею під кривою концентрації в плазмі від 0 до нескінченності (AUC0-¥) від 600 до 1170 нг.год./мл, переважно, таблетка 1-(2,3,4триметоксибензил)піперазину даного винаходу має in vivo фармакокінетичний параметр, який характеризується максимальним значенням концентрації в плазмі (Смакс) від 40 до 110нг/мл, переважно, таблетка 1-(2,3,4триметоксибензил)піперазину даного винаходу має in vivo фармакокінетичний параметр, який характеризується значенням Тмакс від 2 до 6 годин; кваліфікований в даній галузі фахівець зрозуміє, що "Значення Тмакс" є часом, який вимагається, щоб одержати максимальну концентрацію активного інгредієнта в плазмі, переважно, таблетка 1-(2,3,4триметоксибензил)піперазину даного винаходу має in vivo фармакокінетичний параметр, який характеризується періодом півжиття в плазмі (t1/2) від 4,5 до 10 годин. Взагалі, таблетки відповідно до даного винаходу складаються з таблеток, які не покривають плівкою. Однак, у деяких втіленнях, може бути забезпечене плівкове покриття, без зміни цим плівковим покриттям фармакотехнічних характеристик, особливо параметру in vitro розчинення 1-(2,3,4триметоксибензил)піперазину, порівняно до не покритих плівкою таблеток. Винахід, більш того, проілюстрований Фігурами і Прикладами, які йдуть далі. Фіг.1 показує криві in vitro розчинення 1-(2,3,4триметоксибензил)піперазину, які одержують для таблеток для пролонгованого вивільнення 1-(2,3,4триметоксибензил)піперазину відповідно до даного винаходу з трьох різних виробничих партій. Ордината відображає процентний вираз вивільнення 1-(2,3,4-триметоксибензил)піперазину у розчин по відношенню до початкової кількості 1(2,3,4-триметоксибензил)піперазину, який міститься у таблетках. Абсциса відображає час розчинення, виражений у хвилинах. Фіг.2 показує порівняння кривих розчинення ніякого таблетки, яка містить гідроксипропілцелюлозу (склад №1), і таблетки 1-(2,3,4триметоксибензил)-піперазину відповідно до даного винаходу (склад №2). Ордината відображає процентний вираз вивільнення 1-(2,3,4-триметоксибензил)піперазину у розчин по відношенню до початкової кількості 1(2,3,4-триметоксибензил)піперазину, який міститься у таблетках Абсциса відображає час розчинення. Фіг.3 показує in vivo фармакокінетичний параметр 1-(2,3,4-триметоксибензил)піперазину. 89408 18 Ордината відображає концентрацію 1-(2,3,4триметоксибензил)піперазину в плазмі, виражену в нг/мл. Абсциса відображає час вивільнення 1-(2,3,4триметоксибензил)піперазину. Приклади Приклад 1: Спосіб одержання фармацевтичної композиції пролонгованого вивільнення, яка містить 1-(2,3,4-триметоксибензил)піперазин дигідрохлорид А. Продукти 1-(2,3,4-Триметоксибензил)піперазин дигідрохлорид: 1-(2,3,4-Триметоксибензил)піперазин дигідрохлорид, який продається на ринку компанією ORGASYNTH або компанією СНЕМІ. Активний інгредієнт знаходиться у формі невеликих кристалів, які мають середній діаметр частинок, залежно від виробничих партій, в діапазоні від 11,828мкм до 16,056мкм з унімодальним розподілом по аналізу шляхом визначення розміру частинок лазером в сухому стані, використовуючи апарат для вимірювання MASTERSIZER® 2000, який продається на ринку компанією MALVERN, обладнаний приладом SCIROCCO 2000 і з завантаженим програмним забезпеченням MASTERSIZER® 2000, версія 3.01, відповідно до наступного методу: - Статична дифракція/розсіювання світла. - Параметри: - діапазон вимірювання: від 0,020 до 2000мкм - Необхідна вага зразка: від 20мг до 100мг - Дисперсія: порошок диспергують за допомогою Venturi при тиску 2 бари. - Процент вібрації SCIROCCO 2000: 70% Безводний колоїдний кремнезем [Ph. Eur. (0434)]: Цей наповнювач використовують як домішку, що підвищує текучість, у складах, які досліджують, для того, щоб забезпечити хороший розподіл активного інгредієнту у суміші, призначеній для стиснення. Безводний колоїдний кремнезем, який використовують, продається на ринку компанією DEGUSSA під комерційним найменуванням Aerosil® 200. Будь-яка інша поставка рівноцінної якості може бути відповідним чином застосована замість цього. Поліетиленоксид: Цей компонент є розчинним у воді неіонним полімером, який продається на ринку під найменуванням POLYOX™ компанією DOW. Він служить як уповільнювач. Цей наповнювач також володіє хорошими властивостями центрального стиснення. Він задовольняє технічним умовам USP монографа (Поліетиленоксид). Застосований POLYOX™ WSR 303 являє собою наповнювач високої молекулярної ваги (# 7 000 000). В'язкість при 25°С в 1% розчині складає від 7 500мПа/сдо 10000мПа/с. Будь-яка інша поставка рівноцінної якості може бути відповідним чином застосована замість цього. Повідон [Ph. Eur. (0685)]: Повідон, який фігурує в композиції готового виробу при рівні 1,47%, включений у формі 19 Ludipress® LCE (дивіться нижче), в якому він служить як зв'язувальна речовина. Застосований повідон продається на ринку компанією BASF (Ludipress® LCE). Будь-яка інша поставка рівноцінної якості може бути відповідним чином застосована замість цього. Моногідрат лактози [Ph. Eur. (0187)]: Цей наповнювач, при рівні 40,63%, служить розріджувачем в композиції. Він включений у формі Ludipress® LCE (дивіться нижче). Будь-яка інша поставка рівноцінної якості може бути відповідним чином застосована замість цього. Ludioress® LCE: Цей наповнювач, який продається на ринку компанією BASF, являє собою агент центрального стиснення. Він складається з 96,5% моногідрату лактози і 3,5% повідону, обидва задовольняють умовам Європейської Фармакопеї. Він поєднує дії розріджувача і зв'язувального агента. Будь-яка інша поставка рівноцінної якості може бути відповідним чином застосована замість цього. Стеарат магнію [Ph. Eur. (0229)]: Цей наповнювач рослинного походження, при рівні 1% в кінцевій суміші, використовують як змащувальну речовину. Стеарат магнію, який використовують в ході розробки, постачається компанією Quarrechim. Будь-яка інша поставка рівноцінної якості може бути відповідним чином застосована замість цього. Тальк [Ph. Eur. (0438)]: Цей наповнювач, при рівні 2% в кінцевій суміші, використовується, як антив'яжучий агент і домішка, що підвищує текучість. Тальк, який використовують в ході розробки, продається на ринку компанією Luzenac. Будь-яка інша поставка рівноцінної якості може бути відповідним чином застосована замість цього. Барвник: Барвник, який вибирають, являє собою "Pigment blend PB 23028 orange", який продається на ринку компанією COLORCON: - Моногідрат лактози [Ph. Eur. (0187)] - Хіноліновий жовтий (Е104) - Кошенільний червоний (Е124) - Жовто-оранжевий S (E110) Будь-яка інша поставка рівноцінної якості може бути відповідним чином застосована замість цього. B. Обладнання Все обладнання забезпечують відповідно до методик, які застосовують, на місці виготовлення, узгоджуючись з Правилами організації виробництва і контролю якості лікарських засобів: - CMA ROBOTAINER посудина придатної місткості (або еквівалент) - СМА ROBOTAINER міксер придатної місткості (або еквівалент) - FETTE ротаційна таблетувальна машина (або еквівалент) 89408 20 - Штампувальні преси: окружність 8R8 - Розмір комірки коміркового неіржавіючого фільтру: 0,800мм C. Опис виробничого процесу Всі стадії, які проводять в ході приготування, виконують відповідно до з Правил організації виробництва і контролю якості лікарських засобів. Попередня Стадія: Обладнання - вихідні матеріали - документація Перевірка: - чистота обладнання і робочої ділянки, - відповідність виробничих документів, - відповідність вихідних матеріалів. Проводять процедури зважування. Стадія а): Попереднє змішування - Попередньо змішують приблизно одну третину кількості 1-(2,3,4-триметоксибензил)піперазин дигідрохлориду з рівноцінним об'ємом безводного колоїдного кремнезему в посудині шляхом перекидання (або аналогічне). Перемішують доти, доки суміш не стане однорідною. - Просіюють попередню суміш через фільтр з розміром комірок 0,8 мм. Перевіряють відсутність великих шматків. Стадія b): Змішування - Вміщують Ludipress® (або еквівалент) (суміш моногідрату лактози і повідону K30), баланс 1(2,3,4-триметоксибензил)піперазин дигідрохлориду і барвника - якщо необхідно заздалегідь просіяного через фільтр з розміром комірок 0,8мм - в міксер. - Додають попередню суміш активний інгредієнт/безводний колоїдний кремнезем. - Вміщують весь поліетиленоксид. - Змішують партію протягом близько 15 хвилин при близько 10 об./хв. Стадія с): Кінцева суміш - Додають стеарат магнію і тальк - заздалегідь просіяний через фільтр з розміром комірок 0,8мм в міксер. - Змішують протягом близько 5 хвилин при близько 10об./хв. Стадія d): Стиснення - Приводять таблетувальну машину у відповідність з відповідними штампувальними пресами круглої форми і діаметром 8мм. - Проводять налагоджування машини таким чином, щоб одержати таблетки, які відповідають бажаним технічним умовам. - Виконують стиснення кінцевої суміші. Додаткова стадія: Пакування Упаковують таблетки в термоформовані блістери PVC/PVDC/Алюміній. D. Якісний і кількісний склад кінцевої композиції Якісний і кількісний склад кінцевої композиції відносно активного інгредієнта і наповнювачів детально викладено в Таблиці 1 нижче. 21 89408 22 Таблиця 1 Найменування складоФормула Промислова формула вого компоненту (кг/партію) Процент (%) Одиниці (мг/таб.) Активний інгредієнт 17,50 35,00 105,00 1-(2,3,4триметоксибензил) піперазин дигідрохлорид Наповнювачі 0,20 0,40 1,20 Безводний колоїдний кремнезем Поліетиленоксид 37,00 74,00 222,00 Моногідрат лактози * 40,63 81,26 243,78 Повідон* 1,47 2,94 8,82 Стеарат магнію 1,00 2,00 6,00 Тальк 2,00 4,00 12,00 Оранжевий барвник 0,20 0,40 1,20 Теоретична вага 200,00мг 600,00кг Посилання на стандарти Ph. Eur. (1741) Ph. Eur. (0434) Внутрішня монографія Ph. Eur. (0187) Ph. Eur. (0685) Ph. Eur. (0229) Ph. Eur. (0438) Внутрішня монографія * Ludipress® LCE: - Моногідрат лактози 96,5% +/-2% - Повідон 3,5% +/-0,5% Приклад 2: Фармакотехнічні характеристики складу у формі таблеток відповідно до даного винаходу. А. Методи Різні методи аналізу фармакотехнічних характеристик композиції у формі таблеток відповідно до даного винаходу детально розкрито у Таблиці 2 нижче. Таблиця 2 Параметри перевірки Посилання Характеристики - Зовнішній вигляд - Колір Дослідження - Вміст води Внутрішня монографія* - Середня вага - Однорідність ваги Ph. Eur. (2.9.5) - Міцність до руйнування Ph. Eur. (2.9.8) - Розкладання Ph. Eur. (2.9.1) - Ламкість Ph. Eur. (2.9.7) - Однорідність вмісту активного інг- Ph. Eur. (2.9.6) редієнту ** - In vitro розчинення в рН Протокол йде нижче 1,2 буфері Визначення і аналіз - Визначення активного Протокол йде нижче інгредієнту (ВЕРХ) - Середній вміст активного інгреді- Протокол йде нижче єнту (ВЕРХ) Вимоги Круглий таблетка Оранжевий 60 хвилин £1,0% Узгоджено з Ph. Eur. від 35% до 65% вивільнення за 120 хвилин від 65% до 85% вивільнення за 240 хвилин > 85% вивільнення за 600 хвилин Зразковий RT, ідентичний посилальному стандартному RT від 33,25 до 36,75мг *визначено, використовуючи зразок 3г±5% за допомогою електронного аналізатора вмісту води типу МА 30 (або еквівалент) при 100°С протягом 15 хвилин; **це дослідження не є обов'язковим відповідно до Європейської Фармакопеї, через те, що кількість активної речовини на таблетку є більшою ніж 2мг і більшою ніж 2% ваги таблетки; однак, дослідження проводять на дослідній партії для того, щоб перевірити, що виконується розподіл активної речовини у зразках таблеток, взятий у різні періоди часу. 23 89408 Спосіб in vitro розчинення Апарат: - Sotax AT7 з обертальною лопаттю - Спектрофотометр типу Perkin Elmer Lambda 20 Умови функціонування: - Середовище розчинення: рН1,2 буфер (Pharmeuropa) - Кількість середовища розчинення на посудину: 1000мл - Швидкість обертання лопаті: 50об./хв. - Температура посудини: 37°С±0,5°С - Кількість посудин: 6 - Кількість одиниць на посудину: 1 - Кварцова комірка циркуляції кругообігу оптичного шляху: 1см - Довжина хвилі: 233нм - Час відбору проб: 15, 30, 60, 120, 180, 240, 360, 480, 600, 720, 840 хвилин - Швидкість роботи перистальтичного насосу: 30об./хв. Посилальний стандартний розчин Використовуючи 500-мл калібровану колбу (клас А), розчиняють 17,5мг 1-(2,3,4триметоксибензил)піперазину, який точно зважують, в середовищі розчинення і поповнюють до калібрувальної мітки, використовуючи той же розчинник. Визначення активного інгредієнту і спосіб випробування Апарат: 24 - Система ВЕРХ: НР1100, Agilent - Програмне забезпечення для збору даних: HPChem, Agilent: Умови функціонування - Тип колонки: Kromasil 100 С18 5мкм, 150´4,6 мм, яку підтримують при 40°С - Довжина хвилі: 240нм - Об'єм ін'єкції: 20мкл - Час утримування: близько 10 хвилин - Час обробки: 15 хвилин - Швидкість потоку: 1,2мл/хв. - Рухома фаза: - 2,87г/л розчину гептансульфонату натрію, 500мл доведеного до рН3,0 з розбавленим Н3РО4 R - метанол 500мл Посилальний стандартний розчин: У 50-мл каліброваній колбі (клас А) розчиняють 35мг 1-(2,3,4-триметоксибензил)піперазину, який точно зважують, у воді R і поповнюють до позначки, використовуючи той же розчинник. Витягують 1,0мл одержаного розчину, вміщують його в 10-мл калібровану колбу (клас А) і поповнюють до позначки, використовуючи рухому фазу. В. Результати Результати аналізу фармакокінетичних характеристик композиції, одержаної відповідно до Прикладу 1, детально розкрито у Таблиці 3 нижче. Таблиця 3 Параметри перевірки Середня вага (мг) Однорідність ваги Розкладання Ламкість (%) Міцність до руйнування (N) Однорідність вмісту активного інгредієнту Середній вміст активного інгредієнту (ВЕРХ) In vitro розчинення в рН1,2 буфері від 35% до 65% вивільнення за 120 хвилин від 65% до 85% вивільнення за 240 хвилин ³85% вивільнення за 600 хвилин Партія № 1 200,4мг Узгоджено 3год. 50хв. 32сек. 60хв. 60хв. 0,04 91 Узгоджено 34,14мг 46,35% 73,06% 100,45% 43,15% 70,12% 99,29% 46,80% 73,45% 102,25% Результати перевірок, які проводять на таблетках, що взяті як зразки з масового продукту кожної з 3 партій, які перевіряють, є задовільними: - середня вага і однорідність ваги відповідають вимогам; - розкладання триває більше ніж 60 хвилин; - ламкість набагато менше ніж 1%; - міцність до руйнування таблеток відповідає вимогам (партія 4003 відхиляється тільки на 1N від очікуваних технічних умов); - однорідність вмісту активного інгредієнту відповідає вимогам, з коефіцієнтом зміни менше ніж 5%; - in vitro розчинення в рН1,2 буфері відповідає вимогам протягом кожного періоду часу; - середній вміст активного інгредієнту відповідає вимогам. Ці результати, крім того, є повторно відтворюваними для 3 партій, які перевіряють. Порівняння параметрів in vitro розчинення партій №1, 2 і 3, розкрите в Таблиці 3 вище, показане на Фіг.1. Результати порівняння показують дуже високий ступінь відтворюваності параметрів in vitro розчинення від однієї виробничої партії до іншої. Приклад 3: Порівняльне дослідження параметрів in vitro розчинення. У цьому Прикладі, порівнюють параметри in vitro розчинення двох складів - склад №1, який містить гідроксипропілцелюлозу, і склад №2, який містить склад відповідно до даного винаходу, відповідно. Склади №1 і 2 мають композиції, які детально розкрито в Таблиці 4 нижче. 25 89408 26 Таблиця 4 Склад Складові компоненти 1-(2,3,4-триметокси- бензил)піперазин Безводний колоїдний кремнезем Гідроксипропіл- целюлоза Поліетиленоксид Ludipress® Стеарат магнію Тальк Барвник (pigment blend 23028) Теоретична вага таблетки (мг) №1 % 17,50 0,20 37,00 42,10 1,00 2,00 0,20 Тільки склад №2 складається з композиції відповідно до даного винаходу Склад №1 складається з композиції, який містить гідроксипропілцелюлозу, але не має поліетиленоксиду. Фіг.2 показує порівняння параметрів in vitro розчинення між складом №1, який містить гідроксипропілцелюлозу, і складом №2, відповідно до даного винаходу. Результати порівняльних досліджень показують наступне: - склад №1, який містить гідроксипропілцелюлозу, має параметр in vitro розчинення, який відрізняється від того, який визначено для складу №2, відповідно до даного винаходу; - склад №2, відповідно до даного винаходу, має параметр in vitro розчинення, який робить можливим одержання in vivo фармакокінетичного параметру (Смакс, AUC, Тмакс і t1/2), як описано у Прикладі 4. Приклад 4: Дослідження параметрів in vivo розчинення таблеток фармацевтичної композиції відповідно до даного винаходу. У цьому Прикладі досліджують in vivo фармакокінетичні параметри таблеток 1-(2,3,4триметоксибензил)піперазин дигідрохлориду, які одержують відповідно до Прикладу 1. А Спосіб аналізу in vivo фармакокшетичних даних Оцінюють рівень і міру абсорбції 1-(2,3,4триметоксибензил)піперазин дигідрохлориду після введення складу таблеток відповідно до даного винаходу і які містять 35мг активного інгредієнту. Визначають наступні фармакокінетичні змінні: - значення ділянки під кривою концентрації в плазмі від 0 до нескінченності (AUC0-¥); - максимальне значення концентрації в плазмі (Смакс); - in vivo фармакокінетичний параметр, який характеризується значенням Тмакс; - період півжиття в плазмі (t1/2). Це дослідження проводять як подвійне контрольне дослідження, і воно складається з двох фаз обробки по 48 годин в кожному випадку. Осіб випадковим чином розподіляють до різних груп. Для цього дослідження, послідовні введення складу відповідно до даного винаходу були розділяють щонайменше на 7, але не більше ніж на 14 днів. мг/таблетку 35,00 0,40 74,00 84,20 2,00 4,00 0,40 200,00 №2 (відповідно до даного винаходу) % мг/таблетку 17,50 35,00 0,20 0,40 37,00 74,00 42,10 84,20 1,00 2,00 2,00 4,00 0,20 0,40 200,00 Особи, які беруть участь у дослідженні, були присутніми 11 годин до введення одного зі складів і продовжували бути присутніми протягом наступних 24 годин. Дослідження проводять на 26 здорових особах чоловічої і жіночої статі для того, щоб провести дослідження, використовуючи щонайменше 24 суб'єктів, яких можна оцінити. Досліджуваний продукт складається з таблеток зміненого вивільнення, що містять 35мг 1(2,3,4-триметоксибензил)піперазин дигідрохлориду, як описано в даній заявці на видачу патенту, більш конкретно, у Прикладі 1. Суб'єкти отримують єдину оральну дозу 35мг 1-(2,3,4-триметокси-бензил)піперазин дигідрохлориду (1 таблетка зміненого вивільнення) на фазу обробки. Для того, щоб виконати дослідження, 18 зразків об'єму 10мл венозної крові збирають у гепаринізовані скляні трубки, взяті протягом 48-годинного періоду. Загальний об'єм крові, взятий у суб'єкта, не перевищує 380мл, що виключає повторення досліджень у лабораторії (180мл крові збирають протягом фази обробки і 21мл крові для лабораторних досліджень до і після вивчення). Зразки об'єму 10мл венозної крові від кожної особи збирають у гепаринізовані скляні трубки, більш конкретно перед оральним введенням таблетки досліджуваного складу відповідно до даного винаходу і у проміжки часу 1, 2, 3, 4, 4,5, 5, 5,5, 6, 7, 8, 10, 12, 16, 24, 30, 36 і 48 годин після орального введення таблетки. Концентрацію 1-(2,3,4триметоксибензил)піперазин дигідрохлориду, виражена в нг/мл, вимірюють в кожному з взятих зразків крові. Статистичні аналізи параметрів Смакс, AUC (0¥) і t1/2 включає дисперсійний аналіз, з наступним логарифмічним перетворенням даних. 90% довірчі інтервали також підраховують на кожну вимірювану точку. В. Результати Дані, які збирають під час досліджень, показують, що таблетки 1-(2,3,4-триметоксибензил)піперазин дигідрохлориду, одержані відповідно до Прикладу 1, мають наступні in vivo фармакокінетичні параметри: 27 89408 - значення площі під кривою концентрації в плазмі від 0 до нескінченності (AUC0-¥) від 600 до 1170нг.год./мл; - максимальне значення (Смакс) концентрації в плазмі від 40 до 110нг/мл; - значення Тмакс від 2 до 6 годин; Комп’ютерна верстка Т. Чепелева 28 - період півжиття у плазмі (t1/2) від 4,5 до 10 годин. In vivo параметр вивільнення 1-(2,3,4триметоксибензил)піперазин дигідрохлориду показаний на Фіг.3. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSustained release solid pharmaceutical composition of 1-(2,3,4-trimethoxybenzyl)piperazine and a method for the preparation thereof
Автори англійськоюBesse Jerome
Назва патенту російськоюТвердая фармацевтическая композиция пролонгированного высвобождения 1-(2,3,4-триметоксибензил)пиперазина и способ ее получения
Автори російськоюБессе Жером
МПК / Мітки
МПК: A61K 9/20, A61K 31/495
Мітки: 1-(2,3,4-триметоксибензил)піперазину, фармацевтична, спосіб, композиція, пролонгованого, вивільнення, тверда, одержання
Код посилання
<a href="https://ua.patents.su/14-89408-tverda-farmacevtichna-kompoziciya-prolongovanogo-vivilnennya-1-234-trimetoksibenzilpiperazinu-i-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Тверда фармацевтична композиція пролонгованого вивільнення 1-(2,3,4-триметоксибензил)піперазину і спосіб її одержання</a>