Похідні тіоксантину, композиція, що їх містить, та їх застосування у терапії
Формула / Реферат
1. Сполука формули (І)
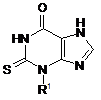 , (І)
, (І)
де R1 вибрано з С1-С6алкілу, а вказаний С1-С6алкіл є заміщеним С1-С6алкоксилом; та принаймні один з вказаних С1-С6алкілу або С1-С6алкоксилу є розгалуженим;
або її фармацевтично прийнятна сіль, сольват або сольват її солі.
2. Сполука за п. 1, де у С1-С6алкілі R1 є С2-4алкіл.
3. Сполука за п. 1 або п. 2, де вказаний алкіл вибрано з групи: ізобутил, етил та пропіл.
4. Сполука за будь-яким з пп. 1-3, де вказаний алкіл є заміщеним С1-3алкоксилом.
5. Сполука за будь-яким з пп. 1-3, де вказаний алкіл є заміщеним С1алкоксилом.
6. Сполука за будь-яким з пп. 1-3, де вказаний алкіл є заміщеним С2алкоксилом.
7. Сполука за будь-яким з пп. 1-3, де вказаний алкіл є заміщеним пропоксилом або ізопропоксилом.
8. Сполука, вибрана з групи:
3-(2-етокси-2-метилпропіл)-2-тіоксантин;
3-(2-пропокси-2-метилпропіл)-2-тіоксантин;
3-(2-метокси-2-метилпропіл)-2-тіоксантин;
3-(2-ізопропоксіетил)-2-тіоксантин;
3-(2-етоксипропіл)-2-тіоксантин;
3-(2S-етоксипропіл)-2-тіоксантин;
3-(2R-етоксипропіл)-2-тіоксантин;
або її фармацевтично прийнятна сіль, сольват або сольват її солі.
9. Сполука за будь-яким з пп. 1-8 або її фармацевтично прийнятна сіль для застосування як медикаменту.
10. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-8 або її фармацевтично прийнятну сіль, необов'язково у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
11. Спосіб лікування або зменшення ризику хвороб або станів, у котрих є корисним інгібування ферменту МРО, при якому особі, яка потерпає від вказаної хвороби або стану, або при її ризику, вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-8 або її фармацевтично прийнятної солі.
12. Спосіб лікування або зменшення ризику запальних розладів, при якому особі, яка потерпає від вказаної хвороби або стану, або при їїризику, вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-8 або її фармацевтично прийнятної солі.
13. Спосіб за п. 12, де вказаними запальними розладами є нейрозапальні розлади.
14. Спосіб за п. 13, де вказаним нейрозапальним розладом є розсіяний склероз.
15. Спосіб за п. 13, де вказаним нейрозапальним розладом є хвороба Паркінсона.
16. Спосіб за п. 11, де вказаною хворобою або станом є серцево-судинні та церебрально-васкулярні атеросклеротичні розлади або хвороба периферійних артерій, серцева недостатність або респіраторні розлади.
17. Спосіб за п. 16, де вказаною хворобою або станом є атеросклероз.
18. Спосіб за п. 16, де вказаною хворобою або станом є хронічна обструктивна хвороба легень (COPD).
19. Спосіб за п. 16, де вказаною хворобою або станом є бронхіт, охоплюючи інфекційний та еозинофільний бронхіт; емфізема; бронхоектаз або кістозний фіброз.
20. Спосіб лікування або зменшення ризику інсульту, при якому особі, яка потерпає від вказаної хвороби або стану, або при її ризику, вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-8 або її фармацевтично прийнятної солі.
Текст
1. Сполука формули (І) O H N HN 2 (19) 1 3 94606 4 18. Спосіб за п. 16, де вказаною хворобою або станом є хронічна обструктивна хвороба легень (COPD). 19. Спосіб за п. 16, де вказаною хворобою або станом є бронхіт, охоплюючи інфекційний та еозинофільний бронхіт; емфізема; бронхоектаз або кістозний фіброз. 20. Спосіб лікування або зменшення ризику інсульту, при якому особі, яка потерпає від вказаної хвороби або стану, або при її ризику, вводять терапевтично ефективну кількість сполуки за будьяким з пп. 1-8 або її фармацевтично прийнятної солі. Заявлений винахід стосується нових похідних тіоксантину, композицій, що їх містять та їх застосування у терапії. Мієлопероксидаза (МРО) є гемовмісним ферментом, знайденим переважно у поліморфонуклеарних лейкоцитах (PMN). МРО є одним членом родини відмінних білків пероксидаз ссавців, що також охоплює пероксидазу еозинофілів, пероксидазу щитовидної загози слинних пероксидазу залоз, лактопероксидазу, синтазу простагландину Η та інші. Готовий фермент є димером ідентичних половинок Кожна половина молекули містить ковалентно зв'язаний гем, що виявляє незвичайні спектральні властивості, відповідні за зелений колір МРО. Розщеплення дисульфідного містка, що зв'язує дві половини МРО, дає геміфермент, що виявляє спектральні та каталітичні властивості невідрізнювані від властивостей цілого ферменту. Фермент застосовує гідроген пероксид для окиснення хлориду до гіпохлоритної кислоти. Інші галогеніди та псевдогалогеніди (типу тіоціанату) є також фізіологічними субстратами МРО. ΡΜΝ є особливо важливими для подолання інфекцій. Ці клітини містять МРО, із добре документованою мікробіцидною дією ΡΜΝ діють неспецифічно через фагоцитоз, поглинаючи мікроорганізми, уводячи їх у вакуолі - фагосоми, котрі конденсуються з гранулами, що містять мієлопероксидаз для утворення фаголізосом. У фаголізосомах ферментна активність мієлопероксидази призводить до утворення гіпохлоритної кислоти, потужної бактерицидної сполук. Гіпохлоритна кислота є окисником та реагує найбільш сильно з тіолами та тіоетерами, але також перетворює аміни у хлораміни, та хлорує ароматичні амінокислоти Макрофаги є великими фагоцитними клітинами, котрі, типу ΡΜΝ здатні до фагоцитозу мікроорганізмів Макрофаги можуть створювати гідроген пероксид та при активації також утворюють мієлопероксидазу. МРО та гідроген пероксид можуть також вивільнятися назовні клітини, де реакція з хлоридом може індукувати пошкодження сусідніх тканин. Взаємозв'язок активності мієлопероксидази з хворобою призводить до неврологічних хвороб з нейрозалальною реакцією, охоплюючи розсіяний склероз, хворобу Альцгеймера, хворобу Паркінсона та інсульт, а також інші запальні хвороби або стани, як-то астма, хронічна обструктивна хвороба легень, кістозний фіброз, атеросклероз, ішемічна серцева хвороб, серцева недостатність, запальна хвороба кишечнику, ниркові гломерулярні пошкодження та ревматоїдниий артрит. Рак легень, як також вважають, асоційований з високими рівнями МРО. Розсіяний склероз (MS) МРО-позитивні клітини є надзвичайно присутніми у циркуляції та у тканинах із запаленням Більш конкретно макрофаги та мікроглія, що містять МРО документовані у ЦНС при хворобі, розсіяному склерозі (Nagra RM, et al. Journal of Neuroimmunology 1997, 78(1-2) 97-107), хворобі Паркінсона (Choi D-K et al. J Neurosci 2005, 25(28) 6594-600) та хворобі Альцгеймера (Green PS et al. Journal of Neurochemistry 2004, 90(3) 724-33). Припускають що деяк аспекти хронічного запалення призводять до непереборного руйнування, де агенти з реакцій МРО грають важливу роль. Фермент вивільняється зовнішньоклітинно, а також у фаголізосоми у нейтрофілах (Hampton MB, Kettle AJ, Winterbourn CC. Blood 1998; 92(9) 300717). Передумовою активності МРО є присутність гідроген пероксиду, створеного NADPH-оксидазою, та наступна дисмутація супероксиду. Окиснений фермент є здатним до застосування багатьох відмінних субстратів, з котрих хлорид є найбільш явним У цій реакції утворюється сильний нерадикальний окисник - гіпохлоритна кислота (НОСІ) НОСІ окиснює амінокислоти що містять сульфур, типу цистеїну та метіоніну, дуже ефективно (Peskin AV, Winterbourn CC. Free Radical Biology та Medicine 2001; 30(5) 572-9). Він також утворює хлораміни з аміногруп у білках та інших біомолекулах (Peskin AV et al. Free Radical Biology та Medicine 2004; 37(10) 1622-30). Він хлорує феноли (типу тирозину) (Hazen SL. et al. Mass Free Radical Biology та Medicine 1997; 23(6): 909-16) та ненасичені зв'язки у ліпідах (Albert CJ et al. J Biol Chem 2001; 276(26): 23733-41), окиснює ферум-центри (Rosen Η Klebanoff SJ Journal of Biological Chemistry 1982; 257(22): 13731-354) та перехресно зв'язує білки (Fu X, Mueller DM, Hemecke JW Biochemistry 2002; 41(4): 1293-301). Протеолітичні каскади приймають участь в інфільтрації клітин через ВВВ, а також руйнуванні ВВВ, мієліну та нервових клітин (Cuzner МЛ, Opdenakker G Journal of Neuroimmunology 1999; 94(1-2): 1-14, Yong VW et al. Nature Reviews Neuroscience 2001; 2(7): 5 02-11). Активація матриксних металопротеїназ (ММР) може завершуватися дією вищерозташованої протеази у каскаді, а також через окиснення дисульфідного містку Fu X. et al. J. Biol. Chem. 2001; 276(44): 41279-87; Gu Ζ et al. Science 2002; 297(5584): 1186-90). Це окиснення може бути нітрозилуванням або НОСІопосередкованим окисненням. Обидві реакції мо 5 жуть бути наслідком активності МРО. Кілька повідомлень свідчать про роль ММР взагалі, а ММР-9 зокрема, як впливаючу на інфільтрацію клітин, а також пошкодження тканин (розпад та демієлінування ВВВ), у MS та ЕАЕ (для огляду дивись Yong VW et al. вище). Важливість цих специфічних механізмів у MS походить від досліджень, де збільшена активність та присутність протеаз ідентифіковані у тканині мозку при MS та CSF Підтримувальні дані також отримані у дослідженнях ЕАЕ з мишами з дефіцитом деяких протеаз що приймають участь у патології MS, або застосовуючи фармакологічні підходи. Демієлінування як припускають, є залежним від цитотоксичних Т-клітин та токсичних продуктів, створених активованими фагоцитами (Lassmann Η. J Neurol Neurosurg Psychiatry 2003; 74(6): 6957). Аксональна втрата є таким чином викликаною протеазами та реактивними інтермедіатами оксигену та нітрогену. Коли МРО є присутньою вона повинна очевидно мати здатність активувати протеази (безпосередньо, а також через розгальмування впливом інгібіторів протеаз) та створення реактивних радикалів. Хронічна обструктивна хвороба легень (COPD) Хронічна обструктивна хвороба легень (COPD) є хворобою, що характеризується обмеженням потоку повітря, що не є повністю оборотною .Обмеження потоку повітря є звичайно поступовим та асоційованим з анормальною запальною реакцією легень на шкідливі частинки або гази COPD є головною проблемою здоров'я населення. Вона є четвертою головною причиною хронічної захворюваності та смертності у США та припускають, що буде п'ятою серед важких хвороб у 2020 році в усьому світі. У Великобританії поширеність COPD є 1,7% у чоловіків та 1,4% у жінок COPD охоплює межі суворості від помірної до дуже суворої, з вартістю лікування, що швидко зростає, коли суворість збільшується. Рівні МРО у слині та BAL є набагато більшими у пацієнтів з COPD, ніж у нормальних контрольних пацієнтів, що не палять (Keatings V.Μ., Barnes P.J. Am J Respir Cnt Care Med 1997; 155: 449-453; Pesci, A et al. Eur Respir J 1998; 12: 380-386). Рівні МРО є крім того підвищеними при загостреннях хвороб (Fionni G et al. Biomedicine & Prarmacotherapy 2000; 54: 274-278; Crooks S. W. et al. European Respiratory Journal 15(2): 274-80, 2000). Роль МРО є ймовірно більш важливою при загостреннях COPD (Sharon SD et al. Am J Respir Cnt Care Med 2001; 163: 349-355). На додаток до деструктивної здатності МРО є сильний клінічний зв'язок із судинними хворобами (Baldus S et al. Circulation 2003; 108: 1440-5). Дисфункцioнальні поліморфізми МРО є асоційованими із зменшеним ризиком смертності від хвороб коронарних артерій (Nikpoor В. et al. Am Heart J 2001; 142: 336), та пацієнти із високими рівнями МРО у сироватці мають збільшений ризик гострого коронарного синдрому. Дія МРО на судинну хворобу може продовжуватися до COPD, оскільки є вагоме свідоцтво, що судинна мережа легень є одною з найранішніх ділянок участі у легенях кур 94606 6 ців. Описані вражаючі зміни в інтимі легеневих артерій, котрі показують зв'язок дози з палінням (Hale Κ.Α., Niewoehner D.Ε., Cosio Μ.G. Am Rev Resp Dis 1980; 122; 273-8). Фізіологічна функція МРО є асоційованою з природженими захисними механізмами хазяїна Це роль, однак не є критичною, оскільки у більшості випадків пацієнти з нестачею МРО мають відносно доброякісні симптоми (Parry Μ.F. et al. Ann Int Med. 1981; 95: 293-301, Yang, K.D., Hill, Η.R. Pediatr Infect Dis J. 2001; 20: 889-900). Загалом, є важливе свідоцтво, що підвищені рівні МРО у COPD можуть сприяти хворобі за кількома механізмами Селективний інгібітор МРО, як можна тому передбачувати, полегшить аспекти гострої та хронічної запальної COPD та зможе зменшувати розвиток емфіземи. Атеросклероз Інгібітор МРО повинен зменшувати атеросклеротичну важкість та/або уразливість існуючих атеросклеротичних уражень та таким чином зменшувати ризик гострого інфаркт міокарду, нестабільної стенокардії або інсульту, та зменшувати ішемічнореперфузійного пошкодження при гострому коронарному синдромі та ішемічноцереброваскулярних випадків. Кілька серій даних підтримують роль МРО у атеросклерозі МРО експресується у плечових регіонах та некротичну серцевину атеросклеротичних уражень людини та активний фермент виділено зі зразків аутопсії уражень людини (Daugherty, A. et al. (1994) J Clin Invest 94(1): 437-44). В еродованих та зруйнованих ураженнях людини, у порівнянні з жирними прожилками, збільшене число МРО, що експресують макрофаги, продемонструвало свідчення про конкретну роль МРО у гострому коронарному синдромі (Sugiyama, S et al. (2001) Am J Pathol 158(3): 879-91). Пацієнти з встановленою хворобою коронарних артерій мають вищі рівні МРО та лейкоцитів у плазмі ніж здорові контролі (Zhang, R. et al. (2001) Jama 286(17): 2136-42). Більш того, у двох великих очікуваних дослідженнях рівнів МРО у плазмі передбачено ризик майбутніх коронарних випадків або заміни кров'яних судин (Baldus, S. et al. (2003) Circulation 108(12): 1440-5; Brennan, Μ. et al. (2003) N Engl J Med 349(17): 1595-604). Загальний дефіцит МРО у людей має велику поширеність 1 на 2000-4000 індивідуалів. Ці індивідуали є в принципі здоровими, але повідомлено про кілька випадків суворої інфекції Candida. Цікаво, люди з нестачею МРО є менш враженими серцевосудинними хворобами, ніж контролі з нормальними рівнями МРО (Kutter, D. et al. (2000) Acta Haematol 104(1)). Поліморфізм у промотері МРО вражає експресію, призводячи до високого та низького МРО, що експресують індивідуали. У трьох відмінних дослідженнях генотип високої експреси асоційовано із збільшеним ризиком серцевосудинних хвороб (Nikpoor, В. et al. (2001) Am Heart J. 142(2): 336-9, Makela, R., Ρ. J. Karhunen, et al. (2003) Lab Invest 83(7): 919-25; Asselbergs, F.W., et al. (2004) Am J. Med 116(6); 429-30). Дані, накопичені в останні 10 років, вказують, що проатерогенна дія МРО охоплює окиснення ліпопротеї-нів, індукування ендотеліальної дисфункції через пог 7 94606 линання нітроген-оксиду та дестабілізацію атеросклеротичних уражень активацією протеази (Nicholls, S. J. та S. L. Hazen (2005) Arterioscler Thromb Vase Biol 25(6): 1102-11). Нещодавно кілька досліджень сфокусовано на модифікаціях нітрота хлортирозинів ліпопротеїнів LDL та HDL Оскільки модифікації хлортирозину in vivo можна створити тільки гіпохлоритною кислотою, виробленою МРО ці модифікації вважають специфічними маркерами активності МРО (Hazen, S. L. та J. W. Heinecke (1997) J. Clin Invest 99(9): 2075-81). LDLчастинки, піддані дії МРО in vitro, стають агрегованими, призводячи до полегшення поглинання поглинальними рецепторами макрофагів та утворення пінистих клітин (Hazell, L. J. та R. Stocker (1993) Biochem J 290 (Pt 1): 165-72). Модифікація хлортирозину ароА1, головного аполіпопротеїну HDLхолестерину, призводить до порушеної акцепторної функції холестерину (Bergt, С., S. et al. (2004) Proc Natl Acad Sci USA; Zheng, L. et al. (2004) J. Clin Invest 114(4): 529-41). Систематичні дослідження цих механізмів показали, що МРО зв'язується з та переміщується з ароА1 у плазмі. Більш того, МРО специфічно націлює ті залишки тирозину ароА1, що фізично взаємодіють з касетним транспортером макрофагу АВСА1 при витоку холестерину з макрофагу (Bergt, С. et al. (2004) J Biol Chem 279(9): 7856-66, Shao, В. et aІ. (2005) J Biol Chem 280(7): 5983-93; Zheng et al. (2005) J Biol Chem 280(1): 38-47). Таким чином, МРО може мати дуальну подразнювальну роль при атеросклеротичних ураженнях, тобто збільшенні накопичення ліпіду агрегацією LDLчастинок та зменшенні зворотного транспорту холестерину атакою на HDL-білок ароА1. Заявлений винахід розкриває нові тіоксантини, що несподівано виявляють корисні властивості як інгібітори ферменту МРО. Крім того, нові сполуки заявленого винаходу виявляють одне або більше з нижченаведеного (і) поліпшену селективність проти ТРО, (іі) непередбачувано високу інпбіторну активність проти МРО, (ііі) поліпшену мозкову проникність, (іν) поліпшену розчинність та/або (ν) поліпшений період напівперетворення, при порівнянні з відомими тіоксантинами. Такі тіоксантини є розкритими, наприклад, у WO 03/089430 та WO 05/037835. Заявлений винахід стосується сполуки формули (І) (І) де 1 R вибрано з С1-С6 алкілу, та вказаний С1-С6 алкіл є заміщеним С1-С6 алкоксилом; та принаймні один з вказаних С1-С6 алкілу або С1-С6 алкоксилу є розгалуженим; або її фармацевтично прийнятної солі, сольвату або сольвату її солі. Згідно з одним аспектом заявленого винаходу, 1 С1-С6 алкіл з R - С24алкіл. 8 Згідно з одним втіленням заявленого винаходу, вказаний алкіл вибрано з групи ізобутил, етил та пропіл. Згідно з одним втіленням заявленого винаходу, вказаний алкіл є заміщеним С1-3алкоксилом. Згідно з одним втіленням заявленого винаходу, вказаний алкіл є заміщеним С1-алкоксилом. Згідно з одним втіленням заявленого винаходу, вказаний алкіл є заміщеним С2-алкоксилом. Згідно з одним втіленням заявленого винаходу, вказаний алкіл є заміщеним пропоксилом або ізо-пропоксилом. Заявлений винахід також стосується сполуки, вибраної з групи: 3-(2-Етокси-2-метилпропіл)-2-тіоксантин, 3-(2-Пропокси-2-метилпропіл)-2-тіоксантин, 3-(2-Метокси-2-метилпропіл)-2-тіоксантин, 3-(2-ізопропоксіетил)-2-тіоксантин, 3-(2-Етоксипропіл)-2-тіоксантин, 3-(2S-Етоксипропіл)-2-тіоксантин, 3-(2R-Етоксипропіл)-2-тіоксантин, або її фармацевтично прийнятної сіль, сольвату або сольвату солі. Сполуки формули (І) можуть існувати у таутомерних формах. Усі так таутомери та суміші таутомеріє охоплені рамками заявленого винаходу. Сполуки формули (І) можуть існувати в енантіомерних формах. Треба розуміти, що усі енантіомери, діастереомери, рацемати та їх суміші охоплені рамками винаходу. Якщо не визначене інше, термін «С1-С6 алкіл» тут означає алкіл з розгалуженим або нерозгалуженим ланцюгом, що має від 1 до 6 атомів карбону. Приклади таких груп охоплюють метил, етил, н-пропіл н-бутил, ізо-бутил, трет-бутил, пентил та гексил. Термін «С2-С4 алкіл» слід розуміти аналогічно. Треба розуміти, що коли алкіл означає С1 або С2 алкіл, так алкіли не можуть бути розгалуженими. Якщо не визначене інше, термін «С1-С6 алкокси» тут означає алкоксил з розгалуженим або нерозгалуженим ланцюгом, що має від 1 до 6 атомів карбону. Приклади таких груп охоплюють метоксил, етоксил, 1-пропоксил, 2-пропоксил, 1бутоксил, ізо-бутоксил трет-бутоксил та пентоксил. Термін «С1-С3 алкокси» слід розуміти аналогічно. Треба розуміти, що коли алкоксил означає С1 або С2-алкоксил, так алкоксили не можуть бути розгалуженими. Згідно з наступним аспектом заявленого винаходу запропоновано застосування нових сполук формули (І) або їх фармацевтично прийнятних солей як медикаменту. Згідно з наступним аспектом заявленого винаходу запропоновано застосування сполуки формули (І)або її фармацевтично прийнятної солі у виробництві медикаменту для лікування або профілактики хвороб або станів, де є корисним інгібування ферменту МРО. Згідно з наступним аспектом заявлений винахід стосується застосування сполуки формули (І), або и фармацевтично прийнятної солі у виробництві медикаменту для лікування або профілактики нейрозапальних розладів, серцево-судинних та цереброваскулярних атеросклеротичних розладів 9 та хвороб периферійних артерій, серцевої недостатності та респіраторних розладів, як-то хронічна обструктивна хвороба легень (COPD). Згідно з ще одним аспектом заявлений винахід стосується застосування сполуки формули (І), або її фармацевтично прийнятної солі у виробництві медикаменту для лікування або профілактики розсіяного склерозу. Лікування може охоплювати уповільнення прогресування хвороби. Згідно з ще одним аспектом заявлений винахід стосується застосування сполуки формули (І), або її фармацевтично прийнятної солі у виробництві медикаменту для лікування або профілактики хвороби Паркінсона. Лікування може охоплювати уповільнення прогресування хвороби. Згідно з ще одним аспектом заявлений винахід стосується застосування сполуки формули (І)або її фармацевтично прийнятної солі, у виробництві медикаменту для лікування або профілактики атеросклерозу запобіганням та/або зменшенням утворення нових атеросклеротичних уражень або кров'яних бляшок та/або запобіганням або уповільненням прогресування існуючих уражень та кров’яних бляшок. Згідно з ще одним аспектом заявлений винахід стосується застосування сполуки формули (І) або її фармацевтично прийнятної солі, у виробництві медикаменту для лікування або профілактики атеросклерозу зміною складу кров'яних бляшок для зменшення ризику руйнування кров'яних бляшок та випадків атеротромбозу. Згідно з ще одним аспектом заявлений винахід стосується застосування сполуки формули (І) або її фармацевтично прийнятної солі, у виробництві медикаменту для лікування або профілактики респіраторних розладів, як-то хронічна обструктивна хвороба легень. Лікування може охоплювати уповільнення прогресування хвороби. Згідно з заявленим винаходом, також запропоновано спосіб лікування, або зменшення ризику хвороб або станів, де є корисним інгібування ферменту МРО котрий полягає у застосуванні до особи, яка потерпає від вказаної хвороби або стану або при її ризику терапевтично ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі. Крім того, також запропоновано спосіб лікування, або зменшення ризику нейрозапальних розладів серцево-судинних та цереброваскулярних атеросклеротичних розладів або хвороб периферійних артерій, або серцевої недостатності чи респіраторних розладів, як-то хронічна обструктивна хвороба легень (COPD), у особи, яка потерпає від вказаної хвороби або стану або при її ризику, спосіб полягає у застосуванні до особи терапевтично ефективної кількості сполуки формули (І)або її фармацевтично прийнятної солі. Крім того, також запропоновано спосіб лікування, або зменшення ризику розсіяного склерозу у особи, яка потерпає від вказаної хвороби або стану або при й ризику, спосіб полягає у застосуванні до особи терапевтично ефективної кількості сполуки формули (І)або її фармацевтично прийнятної солі. 94606 10 Крім того, також запропоновано спосіб лікування, або зменшення ризику хвороби Паркінсона у особи, яка потерпає від вказаної хвороби або стану або при її ризику, спосіб полягає у застосуванні до особи терапевтично ефективної кількості сполуки формули (І),або її фармацевтично прийнятної солі. Також запропоновано спосіб лікування, або зменшення ризику атеросклерозу запобіганням та/або зменшенням утворення нових атеросклеротичних уражень або кров’яних бляшок та/або запобіганням або уповільненням прогресування існуючих уражень та кров’яних бляшок у особи, яка потерпає від вказаної хвороби або стану або при и ризику, спосіб полягає у застосуванні до особи терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Також запропоновано спосіб лікування, або зменшення ризику атеросклерозу зміною складу кров'яних бляшок так, щоб зменшити ризик руйнування кров'яних бляшок та випадків атеротромбозу у особи, яка потерпає від вказаної хвороби або стану або при її ризику спосіб полягає у застосуванні до особи терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Згідно з ще одним аспектом заявлений винахід стосується фармацевтичної композиції що містить терапевтично ефективну кількість сполуки формули (І), або її фармацевтично прийнятної солі, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм, для застосування для лікування або профілактики хвороб або станів, де є корисним інгібування ферменту МРО. Згідно з наступним аспектом заявлений винахід стосується фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (І), або її фармацевтично прийнятної солі, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм, для застосування для лікування або профілактики нейрозапальних розладів. Згідно з наступним аспектом заявлений винахід стосується фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (І),або її фармацевтично прийнятної солі, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм, для застосування для лікування або профілактики розсіяного склерозу, серцево-судинних та цереброваскулярних атеросклеротичних розладів та хвороб периферійних артерій та серцевої недостатності та респіраторних розладів, як-то хронічна обструктивна хвороба легень. Згідно з ще одним аспектом заявлений винахід стосується фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (І),або її фармацевтично прийнятної солі, у суміші з фармацевтично прийнятним ад'ювантом розріджувачем або носієм, для застосування для лікування або профілактики атеросклерозу запобіганням та зменшенням утворення нових атеросклеротичних уражень та/або кров'яних бляшок та/або запобіганням або уповільненням прогресування існуючих уражень та кров’яних бляшок. 11 Згідно з ще одним аспектом заявлений винахід стосується фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (І), або її фармацевтично прийнятної солі, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм, для застосування для лікування або профілактики атеросклерозу зміною складу кров'яних бляшок так, щоб зменшити ризик руйнування кров'яних бляшок та випадків атеротромбозу. Заявлений винахід крім того стосується терапії для лікування вибраного з групи: Нейродегенеративні розлади, охоплюючи, але без обмеження хворобу Альцгеймера (AD), деменцію, когнітивну недостатність при шизофренії (CDS), помірне когнітивне порушення (МСІ), асоційоване з віком порушення пам'яті (ААМІ), асоційований з віком когнітивний занепад (ARCD), когнітивна недостатність без деменції (CIND), розсіяний склероз, хворобу Паркінсона (PD), постенцефалітний паркінсонізм, хворобу Хантингтона, аміотрофічнй бічний склероз (ALS), хвороби моторних нейронів (MND), мультиплярну системну атрофію (MSA), кортикобазальне переродження, прогресуючий супрануклеарный парез синдром ДжилліанаБарре (GBS), та хронічну запальну демієлінізувальну поліневропатіу (CIDP). Деменція охоплює, але без обмеження, синдром Дауна, судинну деменцію деменцію з тільцями Леві, ВІЛ-деменцію, фронтотемпоральну деменцію типу Паркінсона (FTDP), хворобу Піка, хворобу Нейманна-Піка, травматичне пошкодження мозку (ТВІ), деменцію боксерів хворобу Крейтцфельда-Якоба та пріонні хвороби. Заявлений винахід крім того стосується терапії для лікування вибраного з групи: Нейрозапальні розлади, охоплюючи, але без обмеження, розсіяний склероз (MS), хворобу Паркінсона, мультиплярну системну атрофію (MSA), кортикобазальне переродження, прогресуючий супрануклеарный парез, синдром ДжилліанаБарре (GBS), хронічну запальну демієлінізувальну поліневропатію (CIDP). Розсіяний склероз (MS) охоплює рецидивний переміжний розсіяний склероз (RRMS), вторинний прогресуючий розсіяний склероз (SPMS), та первинний прогресуючий розсіяний склероз (PPMS). Заявлений винахід крім того стосується терапії для лікування вибраного з групи: Когнітивні розлади, охоплюючи, але без обмеження a) деменцію, охоплюючи, але без обмеження хворобу Альцгеймера (AD), синдром Дауна, судинну деменцію, хворобу Паркінсона (PD), постенцефалітний паркінсонізм, деменцію з тільцями Леві, ВІЛ-деменцію, хворобу Хантингтона, аміотрофний бічний склероз (ALS), хвороби моторних нейронів (MND), фронтотемпоральну деменцію типу Паркінсона (FTDP), прогресуючий супрануклеарный парез (PSP), хворобу Піка, хворобу Нейманна-Піка, кортикобазальне переродження, травматичне пошкодження мозку (ТВІ), деменцію боксерів, хворобу Крейтцфельда-Якоба та пріонні хвороби; b) Когнітивну недостатність при шизофренії (CDS); 94606 12 c) Помірне когнітивне порушення (МСІ); d) Асоційоване з віком порушення пам'яті (ААМІ); є) Асоційований з віком когнітивний занепад (ARCD); f) Когнітивну недостатність без деменції (CIND). Заявлений винахід крім того стосується терапії для лікування вибраного з групи: Дефіцит уваги та розлад з руйнівною поведінкою, охоплюючи, але без обмеження розлад з дефіцитом уваги (ADD), розлад з дефіцитом уваги та гіперактивністю (ADHD) та афективні розлади. Заявлений винахід також стосується лікування нижченаведених хвороб та станів, котрі можна лікувати сполуками заявленого винаходу: респіраторний тракт: обструктивні хвороби дихальних шляхів, у тому числі: астма, охоплюючи бронхіальну, алергічну, притаманну, набуту, індуковану фізичними вправами, індуковану ліками (охоплюючи аспірин та індуковану NSAID) та індукована пилом астма, періодична та постійна та будь-якої суворості, та інші причини гіперреактивності дихальних шляхів, хронічна обструктивна хвороба легень (ХОХЛ); бронхіт, охоплюючи інфекційний га еозинофільний бронхіт; емфізема, бронхоектаз, кистозний фіброз, саркоїдоз, легені фермера та пов'язані хвороби, пневмоніт з гіперчутливістю; фіброз легень, охоплюючи кріптогенний фіброзувальний альвеоліт, ідіопатичні інтерстиціальні пневмонії, ускладнююча фіброз анти-неопластична терапія та хронічна інфекція, охоплюючи туберкульоз та аспергильоз та інші грибкові інфекції; ускладнення від трансплантації легень, заскулітичні та тромботичні розлади судинної мережі легень, та гіпертензія легень; проткашльова активність, охоплюючи лікування хронічного кашлю, асоційованого із запальними та/або секреторними станами дихальних шляхів, ятрогенного кашлю, гострий та хронічний риніт, медикаментозний охоплюючи риніт, та вазомоторний риніт; багаторічний та сезонний алергічний риніт, охоплюючи поліноз (сінна лихоманка), назальний поліпоз; гостра вірусна інфекція, охоплюючи звичайну застуду, та інфекція внаслідок респіраторного синцитіального вірусу, грип, коронавірус (охоплюючи SARS) або аденовірус; кістки та суглоби: артритиди, асоційовані із остеоартритом/остеоартрозом, первинними та вторинними стосовно, наприклад, уродженої дисплазм стегна; шийний та поперековий спондиліт, та біль знизу спини та шиї; ревматоїдний артрит та хвороба Стилла; серонегативні спондилоартропати, охоплюючи анкілозувальний спондиліт, псоріазний артрит, реактивний артрит та недиференційовані спондартропатії, септичний артрит та інші інфекції, пов'язані з артропатіями та розладами кісток, як-то туберкульоз, охоплюючи хворобу Потта та синдром Понсе; гострий та хронічний індукований кристалами синовіт охоплюючи уратну подагру, хворобу відкладення кальцій пірофосфату, та пов'язаний з кальцій апатитом тендон, синовіально-сумкове та синовіальне запалення, хвороба Бехчета, первинний та вторинний синдром Сьоргена, системний склероз та обмежена склеродер 13 мія, системний червоний вовчак, змішана хвороба сполучних тканин, та недиференційована хвороба сполучних тканин; запальні міопатії, охоплюючи дермітоміозити та поліміозит, ревматична поліміалгія, ювенільний артрит, охоплюючи ідіопатичні запальні артритиди будь-якого суглобового розподілення та асоційовані синдроми та ревматична лихоманка та її системні ускладнення, васкулітиди, охоплюючи артеріїт велетенських клітин, артеріїт Такайясу, гранулематозний алергічний ангіїт, нодозний поліартеріїт, мікроскопічний поліартеріїт, та васкулітиди, асоційовані з вірусними інфекціями, реакції гіперчутливості, кріоглобуліни, та парапротеїни; біль знизу спини, родинна середноземноморська лихоманка, синдром Майкла-Велла, та родинна ірландська лихоманка хвороба Кікучі; індуковані ліками артралгії, тендонітиди, та міопатії. Заявлений винахід крім того стосується комбінаційної терапії, де сполуку формули (І) або її фармацевтично прийнятну сіль, або фармацевтичну композицію чи композицію що містить сполуку формули (І) застосовують одночасно або послідовно із терапією та/або агентом для лікування будьякого серцево-судинного та цереброваскулярного атеросклеротичного розладу та хвороби периферійних артерій. Заявлений винахід стосується сполук формули (І) та також вказаних сполук у форм їх солей. Придатні солі охоплюють утворені з органічними або неорганічними кислотами або органічними або неорганічними основами. Такі солі повинні звичайно бути фармацевтичне прийнятними, хоча солі фармацевтично неприйнятних кислот або основ можна застосовувати при отриманні та очистці розглянутих сполуки. Таким чином, кислотноадитивні солі охоплюють серед іншого утворені з хлоридної кислоти або трифлуороцтової кислоти. Основно-адитивні солі охоплюють солі де катіонами є серед іншого натрій або калій. Утворену сполуку формули (І), або ще одну її сіль, можна при необхідності перетворювати у її фармацевтично прийнятну сіль, або перетворювати утворену сполуку формули (І) у наступну сполуку формули (І), а де потрібно, перетворювати утворену сполуку формули (І) в її оптичний ізомер. Сполуки винаходу та їх інтермедіати можна виділяти з їх реакційних сумішей, а якщо необхідно крім того очищати стандартними способами. Сполуки формули (І) можуть існувати в енантіомерних формах. Тому, усі енантіомери, діастереомери, рацемати, таутомери та їх суміші охоплені рамками винаходу. Різні оптичні ізомери можна виділяти розділенням рацемічної суміші сполук, застосовуючи звичайні способи наприклад, фракційну кристалізацію, або ВЕРХ. Альтернативно різні оптичні ізомери можна отримувати безпосередньо, застосовуючи оптично активні вихідні матеріали. Сполуки формули (І) та їх фармацевтично прийнятні солі є корисними, оскільки вони виявляють фармакологічну активність як інгібітори ферменту МРО. Для вищезгаданих терапевтичних показань, дозування, безумовно, залежатиме від застосову 94606 14 ваної сполуки, режиму застосування та бажаного лікування. Однак, загалом, задовільні результати отримують, коли сполуки застосовують при дозуванні твердої форми між 1 мг та 2000 мг на добу. Сполуки формули (І) та їх фармацевтично прийнятні похідні можна застосовувати cavil по собі, або у формі прийнятних фармацевтичних композицій, у котрих сполука або похідне є у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм Тому, згідно з одним втіленням винахід стосується фармацевтичної композиції, що містить нову сполуку формули (І), або її фармацевтично прийнятну сіль у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм Застосування може бути, але без обмеження, ентеральним (охоплюючи пероральне, сублінгвальне або ректальне) ін^раназальним, інгаляційним, внутрішньовенним, місцевим або іншими парентеральними шляхами Звичайні способи відбору та отримання придатних фармацевтичних композицій описані у, наприклад, "Pharmaceuticals - The Science of Dosage Form Designs", Μ. Ε. Aulton, Churchill Livingstone 1988. Фармацевтична композиція переважно містить менше, ніж 80% та більш переважно менше, ніж 50% сполуки формули (І), або її фармацевтично прийнятної солі. Також запропоновано спосіб отримання такої фармацевтичної композиції, котрий полягає у змішуванні інгредієнтів. Сполуку формули (І) або її фармацевтично прийнятну сіль можна застосовувати в асоціації зі сполуками з одної або більше наступних груп: 1) антизапальні агенти, наприклад, a) NSAІD (наприклад, ацетилсаліцилова кислота, ібупрофен, напроксен, флурбіпрофен, диклофенак, індометацин); b) інгібітори синтезу лейкотриєну (інгібітори 5LO, наприклад, AZD4407, зилейтон, лікофелон, CJ13610, CJ13454, інгібітори FLAP, наприклад, BAY-Y-1015, DG-031, MK591, МК886, А81834, інгібітори гідролази LTA4, наприклад, SC56938, SC57461A); c) антагоністи рецептору лейкотриєну (наприклад, СР195543, амелубант, LY293111, аколат, МК571); 2) антигіпертензивніагенти, наприклад, a) бета-блокатори (наприклад, метопролол, атенолол, соталол); b) інгібітори ферменту перетворення анпотензину (наприклад, каптоприл, раміприл, хінаприл, еналаприл); c) блокатори каналу кальцію (наприклад, верапаміл, дилтіазем, фелодипін, амлодипін); d) антагоністи рецептору анпотензину II (наприклад, ірбесартан, кандесартан, телемісартан, лосартан); 3) антикоагулянти, наприклад, a) інгібітори тромбіну (наприклад, ксимелагартан), гепарини, інгібітори фактору Ха; b) інгібітори агрегації тромбоцитів (наприклад, клопідогрел, тиклопідин, празугел, AZ4160; 4) модулятори метаболізму ліпідів, наприклад, 15 a) сенсибілізатори інсуліну, як-то агоністи PPAR (наприклад, піоглітазон, розиглітазон, галіда, мураглітазар, гефемпрозил, фенофібрат); b) інгібітори HMG-CoA-редуктази, статини (наприклад, симвастатин, правастатин, аторвастатин, розувастатин, флувастатин; c) інгібітори абсорбції холестерину (наприклад, езетиміб); d) інгібітори І ВАТ (наприклад, AZD-7806); e) агоністи LXR (наприклад, GW-683965A, Т0901317); f) модулятори рецептору FXR; r) інгібітори фосфоліпази; 5) агенти проти стенокардії наприклад, нітрати та нітрити; 6) модулятори оксидативного стресу, наприклад, антіоксиданти (наприклад, пробукол, AG1067). Способи отримання Згідно з заявленим винаходом, нами крім того запропоновано спосіб отримання сполуки формули (І) або її фармацевтично прийнятної солі, сольвату, енантіомеру, діастереомеру або рацемату, 1 де R визначено у формулі (І). У наступному описі таких процесів треба розуміти, що де прийнятно, слід додавати до різних реагентів та інтермедіатів придатні захисні групи, а далі їх видаляти таким чином, що повинен бути очевидним спеціалістам. Звичайні процедури застосування захисних груп а також приклади придатних захисних груп описані, наприклад, у «Protective Groups у Organic Synthesis», TW Green, PGM Wuts, Wiley-lnterscience, New York (1999). Треба також розуміти, що перетворення групи або замісника у ще одну групу або замісник хімічним шляхом можна проводити на будь-якому інтермедіаті або кінцевому продукті на шляху синтезу кінцевого продукту, де можливий тип перетворення є обмеженим тільки природною несумісністю інших функціональних груп молекули з умовами або реаСхема 1 94606 16 гентами, застосовуваними у перетворенні. Така природна несумісність та шляхи м обходу проведенням прийнятних перетворень та етапів синтезу у придатному порядку повинні бути очевидними спеціалістам. Приклади перетворень представлені нижче, треба розуміти, що описані перетворення не є обмеженими тільки загальними групами або замісниками, для котрих перетворення є показовими. Посилання та опис інших придатних перетворень є у «Comprehensive Organic Transformations - A Guide to Functional Group Preparations" R. С. Larock, VHC Publishers, Inc. (1989). Посилання та описи інших придатних реакцій описані у довідниках з органічної хімії, наприклад, «Advanced Organic Chemistry», March 4th ed. McGraw Hill (1992) або, «Organic Synthesis» Smith, McGraw Hill, (1994). Способи очистки інтермедіатів та кінцевих продуктів охоплюють наприклад, прямо- та зворотно-фазову хроматографію на колонці або обертовому планшеті, перекристалізацію, відгонку та екстракцію рідина-рідина або твердий матеріал-рідина, що повинно бути очевидним спеціалістам. Визначення замісників та груп є у формулі (І) за винятком того, де визначено інакше. Терміни «кімнатна температура» та «температура довкілля» означають, якщо не визначено інше, температуру між 16 та 25°С. Термін «при кипінні під зворотним холодильником» означає, якщо не визначено інше з посиланням на застосовуваний розчинник, температуру кипіння цього розчиннику. Зрозуміло що мікрохвилі можна застосовувати для нагрівання реакційної суміші. Терміни «флешхроматографія» або «колонкова флешхроматографія» означають препаративно хроматографію на оксиді силіцію, застосовуючи органічні розчинники, або їх суміші як рухому фазу. Отримання кінцевих продуктів 1 1. Спосіб отримання сполук формули (І), де R визначено у формулі (І) показано на схемі 1 17 Сполуки формули (II), (III), (IV), (V) та (VI) є корисними інтермедіатами при отриманні сполуки 1 формули (І), де у R визначено у формулі (І). Сполуки формули (II)-(VI) є у продажу, або можуть бути отриманими з наявних у продажу, або описаних у літературі сполук (Ouwerkerk et al. Eur J. Org. Chem. 2002, 14, 2356). a) Реакція етил ціаноацетату (II) з тіосечови1 ною формули (III), де у R визначено у формулі (І) У способі етил ціаноацетат (II) та прийнятну тіосечовину (III) розчиняють або суспендують у придатному спирті, як-то етанол, та алкоксид, як-то натрій етоксид, додають. Температура є звичайно від 70°С до температури кипіння під зворотним холодильником реакційної суміші. 1 b) Реакція тіоурацилу формули (IV), де у R визначено вище з натрій нітритом у кислотному розчині. У способі тіоурацил (IV) суспендують у розчинник, як-то оцтова кислота (10 до 100% у водному розчині) та хлоридна кислота (водн 1М) та перемішують при придатній температурі між 0°С та 85°С протягом 10-20 хвилин перед додаванням краплями розчиненого у воді натрій нітриту. c) Відновлення нітрозосполуки формули (V), 1 де R визначено вище. У способі, відновлення нітрозосполуки формули (V) можна зручно проводити придатним відновником, як-то натрій дитіоніт або газуватий водень (Н2 (газ)), у придатній суміші розчинників, як-то вода та розчин аміаку або натрій гідроксид (водн 1Н) при температурі між кімнатною температурою та 75°С протягом 30 хвилин - 24 годин. Альтернативно натрій дитіоніт можна додавати безпосередньо на етапі b. 1 d) Реакцію діаміну формули (VI), де R визначено вище із і) мурашиною кислотою, іі) формамідин ацетатом або ііі) триалкілортоестером описано нижче: (і) У способі (d) діамін формули (VI) обробляють мурашиною кислотою (98%), при придатній Схема 2 94606 18 температурі між температурою довкілля та температурою кипіння під зворотним холодильником реакційної суміші. Процес продовжують протягом придатного часу, звичайно 20 - 30 хвилин. Після видалення мурашиної кислоти, обробка придатною водною основою, наприклад, 10% водним розчином натрій гідроксиду, тоді дає сполуку формули (І). Обробку основою проводять протягом придатного часу при придатній температурі наприклад протягом приблизно 30 - 90 хвилин при температурі між температурою довкілля та температурою кипіння реакційної суміші під зворотним холодильником. Альтернативно реакцію можна проводити у розчиннику, як-то вода, до котрої додають мурашину кислоту та сульфатну кислоту. Реакційну суміш тоді нагрівають при температурі кипіння під зворотним холодильником протягом ночі, що після нейтралізації дає сполуку формули (І). (іі) У способі (d) діамін формули (VI) обробляють формамідин ацетатом у розчиннику як-то диметилсульфоксид при придатній температурі, наприклад, 70°С, до закінчення реакції звичайно протягом 1-3 год. (iiі) У способі (d) діамін формули (VI) обробляють при придатній температурі надлишком прийнятного ортоестеру, як-то триетилортоформіат та трипропілортоформіат, необов'язково у присутності придатного розчиннику, як-то спирт, до закінчення реакції. Температура є звичайно температурою кипіння реакційної суміші під зворотним холодильником а час реакції є загалом від 30 хвилин до протягом ночі. Iнші способи перетворення діаміну формули (VI) у сполуку формули (І) описані у літературі, що повинно бути очевидним спеціалістам. 1 2. Спосіб отримання сполук формули (І), де R визначено у формулі (І) (Сузукі et al. Chem. Pharm. Bull. 2002, 50, 1163) показано на схемі 2 19 Сполуки формул (VII), (VIII), (IX) та (X) є корисними інтермедіатами при отриманні сполук фор1 мули (І), де R визначено у формулі (І). Сполуки формул (VII) - (X) є у продажу, або їх можна отримувати з наявних у продажу або описаних у літературі сполук. a) Реакція 5-аміноімідазол-4-карбксаміду (VII) 1 із прийнятним альдегідом формули (VIII) де R визначено у формулі (І), та натрій ціаноборогідридом, натрій ацетоксиборогідридом або натрій борогідридом у придатному розчиннику, як-то метанол, необов'язково з додаванням оцтової кислоти, при кімнатній температурі або з нагріванням до 50°С дає інтермедіат (IX). Альтернативно утворений імін виділяють та відновлюють каталітичним гідруванням при температурі довкілля з каталізатором, як-то платина оксид у придатному розчиннику, як-то метанол, отримуючи інтермедіат (IX). 1 b) Реакція інтермедіату (IX), де R визначено у формулі (І), з ізотіоціанатом, як-то бензоілізотіоціанат або етоксикарбоніл ізотіоціанат у розчиннику, як-то дихлорметан при кімнатній температурі або з нагріванням до температури кипіння під зворотним холодильником дає інтермедіат (X). 1 c) Реакція інтермедіату (X), де R визначено у формулі (І), з основою, як-то натрій гідроксид або аміак (7Н у метанолі) при температурі між 80°С та температурою кипіння розчиннику під зворотним холодильником тоді дає сполуку формули (І). Загальні способи Усі застосовувані розчинники були у продажу та були безводними або аналітичного ґатунку. Реакції звичайно перебігали в інертній атмосфері азоту або аргону. 1 13 Н та С ЯМР-спектри реєстрували при 400 МГц для протонів та 100 МГц для кар-бону-13 на спектрометрі Varian Unity+ 400 ЯМР, оснащеному зондом ВВО, або спектрометрі Bruker Avance ЯМР оснащеному подвійною інверсною голівкою потоку зонду із 60 мкл з Z-градієнтами, застосовуючи рідинний маніпулятор BEST 215 для ін'єкції зразку, або спектрометрі Bruker DPX400 NMR, оснащеному 4-центровою голівкою зонду з Z-градієнтами. Якщо не визначено у прикладах, спектри реєстрували при 400 MHz м та 100 MHz для карбону-13. Як внутрішній стандарт застосовували серед1 13 ню лінію ДМСО-d6 δ 2,50 ( Н), δ 39,51 ( С) серед1 13 ню лінію CD3OD δ 3,31 ( Н) або δ 49,15 ( С), аце1 13 1 тону-d6 2,04 ( Н), 206,5 ( С), та CDCI3 δ 7,26 ( Н), 13 середню лінію CDCI3 δ 77,16 ( С) (якщо не визначене інше). Мас-спектри реєстрували на Waters MS, що складається з детектору Alliance 2795 (LC), Waters PDA 2996, та ELS (Sedex 75 та одиничного квадрупольного мас-спектрометра ZMD. Масспектрометр було оснащено джерелом електророзпилення іонів (ЕР) з режимом позитивних або негативних іонів Капілярна напруга була 3 кВ та напруга конуса була 30 V. Мас-спектрометр сканували між m/z 100-600 з часом сканування 0,7s Температура колонки була до 40°С. Фотодioдний детектор сканували при 200-400 нм. Температуру детектору ELS доводили до 40°С та тиск доводили до 1,9 бар. Для РХ розділення лінійний градієнт застосовували, вихідний при 100% А (10 мМ амо 94606 20 ній ацетату у 5% ацетонітрилу) та кінцевий при 100% В (ацетонітрил) через чотири хвилини. Застосовуваною колонкою була X-Terra MS C8, 3,0 × 50, 3,5 мкм (Waters) при 1,0 мл/хвилин. Альтернативно, мас-спектри реєстрували на ГХ-МС (GC 6890, 5973N MSD) від Agilent Technologies Застосовуваною колонкою була VF-5 MS, ID 0,25 мм × 30m, 0,25 мкм (Varian Inc.). Лінійний температурний градієнт застосовували вихідний при 40°С (1 хвилина) та кінцевий при 300°С (= 1 хвилина), 25°С/хвилин МС було оснащено XIджерелом іонів та реагентним газом був метан МС сканували між m/z 50-500 та швидкість сканування була 3,25 сканувань/с. МС було оснащено Elджерелом іонів МС сканували між m/z 50-500 та швидкість сканування була 3,25 сканувань/с. Напруга електронів була до 70 eV. ВЕРХ-аналізи проводили на системі Agilent HP1100, що складається з дегазатору G1379A Micro Vacuum, бінарного насосу G1312A, планшетного пробовідбірнику G1367A, термостатованого ярусу колонки G1316A та фотодioдного детектору G1315B. Колонка X-Terra MS Waters, 3,0 × 100 мм, 3,5 мкм. Температура колонки була до 40°С та швидкість потоку до 1,0 мл/хвилин. Фотодioдний детектор сканували при 210-300 нм, етап та ширину пік були 2 нм та 0,05 хвилин, відповідно. Лінійний градієнт застосовували, вихідний при 100% А (10 мМ амоній ацетат у 5% ацетонітрилу) та кінцевий при 100% В (MeCN), протягом 6 хвилин. ГХ-МС-аналіз проводили на системі GC 6890, 5973N MSD, від Agilent Technologies. Застосовуваною колонкою була VF-5 MS, ID 0,25 мм × 30m, 0,25 мкм (Vanan Inc). Лінійний температурний градієнт застосовували вихідний при 40°С (1 хвилина) та кінцевий при 300°С (= 1 хвилина), 25°С/хвилин МС було оснащено XI- джерелом іонів та реагентним газом був метан МС сканували між m/z 50-500 та швидкість сканування була 3,25 сканувань/с МС було оснащено El-джерелом іонів. МС сканували між m/z 50-500 та швидкість сканування була 3,25 сканувань/с. Напруга електронів була до 70 eV. Мікрохвильове нагрівання проводили на системі Initiator або у шафі Smith Synthesizer, отримуючи безперервне випромінювання при 2450 МГц. Звичайна процедура обробки після реакції складалася з екстракції продукту розчинником якто етилацетат промиваючи водою, а потім сушки органічної фази безводним магній сульфатом або натрій сульфатом, фільтрування та концентрації розчину під вакуумом. Тонко-шарову хроматографію (ТШХ) проводили на ТШХ-планшетах Merck (Silica gel 60 F254) та УФ застосовували для візуалізації плям. Флеш-хроматографі проводили на Combi Flash® Companion™ застосовуючи нормальнофазові флеш-колонки RediSep™. Звичайними застосовуваними розчинниками були суміші хлороформ/ метанол, дихлорметан/метанол та гептан/етилацетат. Препаративну хроматографію проводили на системі Waters autopunfication HPLC з фотодioдним детектором. Застосовуваною колонкою була XTerra MS С8, 10 мкм, 19 × 300 мм, або Atlantis C18, 5 мкм, 19 × 100 мм. Вузькі градієнти 21 сумішшю ацетонітрил/(95:5 0 1 Μ амоній ацетат ацетонітрил) застосовували при швидкості потоку 20 мл/хвилин. Градієнт сумішшю ацетонітрил/0,1 Μ амоній ацетат у 5% ацетонітрилу у воді MilhQ, перебіг 0 - 35-50% ацетонітрилу, 15 хвилин. Швидкість потоку 15 мл/хвилину. Альтернативно очистки досягали за допомогою напівпрепаративної оснащеної УФ-детектором ВЕРХ Shimadzu PX-8A з Shimadzu SPD-10A з колонкою Waters Symmetry® (C18, 5 мм, 19 мм × 100 мм). Вузькі градієнти сумішшю ацетонітрил/0,1% трифлуороцтової кислоти у воді застосовували при швидкості потоку 10 мл/хвилин. Скорочення: м-ХПБК 3-хлорпероксибензойна кислота; DEAD діетил азодикарбоксилат; ДМФ Ν,Ν-диметилформамід; ДМСО диметилсульфоксид; НОАс оцтова кислота; NaCNBH3 натрій ціаноборогідрид; NaOH натрій гідроксид; Na2SO4 натрій сульфат; THF тетрагідрофуран; Вос2O ді-трет-бутил дикарбонат; МеОН метанол; ЕtOН етанол; EtOAc етилацетат; ТФОК трифлуороцтова кислота; DIPEA Ν,Ν-діізопропілетиламін; СН2СІ2 метиленхлорид; СНСІ3 хлороформ; TEMPO 2,2,6,6-тетраметил-1піперидинілоксил-радикал; Вихідні матеріали були у продажу або отриманими літературними способами та мали відповідні експериментальні дані. Наступні приклади вихідного матеріалу отримували літературними способами: Приклади Винахід ілюстровано, але без обмеження, наступними прикладами. Приклад 1 3-(2-Етокси-2-метилпропіл)-2тіоксантин (a) 2-Бром-1,1-діетокси-2-метилпропан Продукт синтезували модифікованим способом, описаним у US 3,652,579. Бромну воду (2,95 мл, 57,6 ммоль) додавали краплями до ізобутиральдегіду (4,82 г, 66,8 ммоль) у ЕtOН (22 мл) та утворену суміш перемішували при кімнатній температурі протягом 4,0 хвилин. Ще додавали бромну воду (0,3 мл, 5,86 ммоль). Реакційну суміш нейтралізували додаванням кальцій карбонату (3,5 г, 25,3 ммоль) Залишковий кальцій карбонат відфільтровували та фільтрат виливали на суміш лід-вода. Водну фазу екстрагували СН2СІ2, сушили безводним натрій сульфатом, фільтрували та концентрували. Після вакуумної перегонки заголовний продукт отримували з виходом 67% (10,10 г). 1 -1 Н ЯМР (400 МГц, ДМCO-d6) δ млн 4,43 (s, 1Η), 3,80-3,73 (m, 2Η), 1,64 (s, 6Η), 1,15 (t, 6Η). (b) 2-Етокси-2-метилпропаналь Продукт синтезували способом, описаним у US 3,652,579. 94606 22 2-Бром-1,1-діетокси-2-метилпропан (5,63 г, 25 ммоль), що отримано з 1а додавали краплями до калій бітартрату (2,35 г, 12,5 ммоль) у дефлегмаційній дейонізованій воді (22,5 мл) протягом 50 хвилин. Утворену суміш гріли при кипінні під зворотним холодильником протягом 1 годин 10 хвилин. Розчинник та продукт відганяли, амоній сульфат (загалом 8,5 г) додавали до суміші продуктрозчинник. Суміш перемішували. Дві фази відокремлювали та вищу фазу відганяли з кальцій хлориду, отримуючи 55% (1,60 г) заголовного продукту МС (СІ) m/z 117 (М+1). (c) 4-[(2-Етокси-2-метилпропіл)аміно]-1Німідазол-5-карбоксамід NaCNBH3 (0,077 г, 1,23 ммоль) додавали до 5аміно-4-імідазолкарбоксамід гідрохлориду (0,200 г 1,23 ммоль) та оцтової кислоти (141 мкл, 2,46 ммоль) у метанол (1,5 мл). 2-Етокси-2метилпропаналь (0,286 г, 2,46 ммоль), що отримано з прикладу 1(b), додавали краплями. Через 1,5 години ще 2-Етокси-2-метилпропаналь (0,300 г 2,58 ммоль) додавали, а потім ще 2-Етокси-2метилпропаналь через 0,5 годин (0,424 мг, 3,65 ммоль). Реакційну суміш перемішували при кімнатній температурі 17 годин, після чого її концентрували та очищали флеш-хроматографією на силікагелі (СНСІ3/МеОН, 20:1-9,1), отримуючи заголовну сполуку як оливу з виходом 90% (0,251 г) МС (ІЕР) m/z 227 (Μ + 1). (d) 3-(2-Етокси-2-метилпропіл)-2-тіоксантин Етоксикарбоніл ізотіоціанат (0,171 г, 1,30 ммоль) додавали при перемішуванні до розчину 4[(2-Етокси-2-метилпропіл)аміно]-1Н-імідазол-5карбоксаміду (0,246 г, 1,09 ммоль) що було отримано з прикладу 1(с), у СН2СІ2 (1,1 мл) при кімнатній температурі протягом 0,5 годин, тоді реакційну суміш не перемішували при 4°С протягом 16 годин. Реакційну суміш гріли до кімнатної температури протягом 1 годин та розчинник випарювали залишок розчиняли у 2% натрій гідроксид (водн.) (27 мл) та реакційну суміш гріли при 50°С протягом 5,5 годин рН доводили до нейтрального концентрованою НСІ та 1М НСІ. Осад збирали фільтруванням, промивали водою та очищали флешхроматографією на силікагелі (СНСІ3/МеОН, 20:1), отримуючи заголовну сполуку з виходом 47% (96 мг). 1 -1 Н ЯМР (400 МГц, ДMCO-d6) δ млн. 13,76 (br s, 1Η) 12,42 (s, 1Η), 8,13 (s, 1Η), 4,69 (brs 2Η), 3,54 (q, 2Η), 1,21 (s, 6Η), 1,02 (t, 3Η) МС (ІЕР) m/z 267 (Μ-1). Приклад 2 3-(2-Пропокси-2-метилпропіл)-2тіоксантин (а) 2-Бром-2-метил-1,1-дипропоксипропан 2-Бром-2-метил-1,1-дипропоксипропан отримували модифікованим способом, описаним у US 3,652 579. Ізобутиральдепд (7,2 г, 0,10 моль) та 1пропанол (12 мл) охолоджували у льодяній бані. Бром (4,4 мл, 0,086 моль) додавали краплями протягом 20 хвил. Перемішування продовжували при зовнішній температурі протягом 5 хвил та тоді при 55°С протягом 30 хвил. Кальцій карбонат (3 г, 0,030 моль) додавали порціями. Утворену суміш перемішували при зовнішній температурі протягом 23 1 годин. Суміш фільтрували та тверді матеріали промивали діетил-етером. Воду (15 мл) тоді додавали. Органічну фазу відокремлювали, сушили безводним натрій сульфатом та концентрували у вакуумі при зовнішній температурі. Цей сирий продукт (13,5 г, 53%) застосовували на наступному етапі без очистки. 1 -1 Н ЯМР (CDCI3) δ млн 4,40 (s, 1Η), 3,73-3,79 (m, 2H), 3,51-3,57 (m, 2H), 1,73 (s, 6H), 1,60-1,66 (m, 4H) 0,93-0,97 (m, 6H). (b) 2-Метил-2-пропоксипропаналь 2-Метил-2-пропоксипропаналь отримували модифікованим способом, описаним у US 3,652 579. Суспензію 2-бром-2-метил-1,1дипропоксипропану, що отримано з прикладу 2(а) (6,5 г 0,026 моль), калій гідрогентартрату (4,8 г, 0,026 моль) у воді (75 мл) гріли при кипінні під зворотним холодильником протягом 7 годин. Виконали перегонку та рідину що відганяли при 82-90°С, збирали. Органічну фазу відокремлювали. Отриманий сирий продукт (1,9 г, 56%) застосовували без очистки. 1 -1 Н ЯМР (CDCI3) δ млн. 9,58 (s, 1H), 3,31-3,34 (m, 2H), 1,54-1,64 (m, 2H), 1,26 (s, 6H) 0,92-0 96 (m, 3Н). (c) 4-[(2-Метил-2-пропоксипропіл)аміно]-1Німідазол-5-карбоксамід Реакційну суміш 2-метил-2пропоксипропаналю, котрий отримували з прикладу 2(b), (1,0 г, 8,3 ммоль), 5-аміно-4імідазолкарбоксаміду (0,5 г, 4,0 ммоль), натрій ціаноборогідриду (0,25 г 4,0 ммоль) та оцтової кислоти (0,45 мл, 7,9 ммоль) у 10 мл метанолу перемішували при зовнішній температурі протягом 1 години. Розчинник видаляли у вакуумі. Воду (20 мл) та етилацетат (20 мл) додавали. Органічну фазу відокремлювали та розчинник видаляли у вакуумі. Очистка за допомогою ISCO флеш(ЕtOАс:Гептан, градієнт елювання 1:1 - 100% EtOAc) дала 0,19 г (20%) заголовної сполуки. 1 -1 Н ЯМР (CDCI3) δ млн. 6,98 (s, 1H), 6,39 (br s, 1H), 3,40 (t, 2H, J=6,7 Гц), 3 14 (d, 2H, J=4,3 Гц), 1,56-1,65 (m, 2H), 1,22 (s, 6H), 0,95 (t, 3H, J=7,5 Гц), MC (IEP) m/z 241 (M+1). (d) 3-(2-Пропокси-2-метилпропіл)-2-тіоксантин 4-[(2-Мeтил-2-пропоксипропіл)аміно]-1Німідазол-5-карбоксамід, що отримано з прикладу 2(с) розчиняли (0,19 г, 0,78 ммоль) у 7 мл дихлорметану. Отриманий розчин перемішували при зовнішній температурі. Бензоїл ізотіоціанат (0,50 г, 3,1 ммоль) додавали порціями протягом 6 годин. Реакційну суміш перемішували протягом ночі та розчинник тоді видаляли у вакуумі. Аміак у метанолі (7 мл 7 Μ розчину) додавали та отриманий розчин гріли при 50°С протягом 3 годин та тоді при 80°С протягом 3 годин у герметизованому балоні. Охолоджену реакційну суміш концентрували та сирий продукт очищали зворотно-фазовою ВЕРХ. Продукт отримували з виходом 22% (48 мг). 1 -1 Н ЯМР (ДMCO-d6) δ млн. 13,70 (дуже широкий s, 1Н), 12,39 (br s, 1Н), 8,12 (s 1Н), 4,69 (br s, 2Н), 3,41 (t, 2Н, J=6,6 Гц), 1,36-1,44 (m, 2H), 1,21 (s, 6H), 0,81 (t, 3Н, J=7,5 Гц), 94606 24 13 -1 С ЯМР (ДМСО-d6) δ млн. 175,3, 152,5, 149,9, 140,7, 111,0, 75,9, 62,7, 53,5, 25,4, 23,2, 10,6; МС (IΕΡ) m/z 283 (М+1). Приклад 3 3-(2-Метокси-2-метилпропіл)-2тіоксантин (a) 2-Метокси-2-метилпропаналь Продукт синтезували способом, описаним у US 3,652,579. (b) 4-[(2-Метокси-2-метилпропіл)аміно]-1Німідазол-5-карбоксамід 5-Аміно-4-імідазолкарбоксамід гідрохлорид (0,162 г, 1,0 ммоль) та 2-метокси-2метилпропаналь, котрий отримували з прикладу 3(а) (0,204 г, 2,0 ммоль), змішували у метанолі (3 мл) при кімнатній температурі. Оцтову кислоту (141 мкл, 2,46 ммоль) мл) тоді додавали та суміш перемішували протягом 30 хвил з наступним додаванням NaCNBH3 (0,063 г, 1,0 ммоль). Через 3 години ще додавали 2-метокси-2-метилпропаналь (0,060 г, 0,59 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 17 годин та тоді концентрували та очищали флешхроматографією на силікагелі (СНСІ3:МеOН=5:1). Заголовну сполуку отримували як оливу з виходом 73% (0,155 г); MC (IEP) m/z 213 (M+1). (c) 3-(2-Метокси-2-метилпропіл)-2-тіоксантин Етоксикарбоніл ізотіоціанат (0,144 г, 1,1 ммоль) додавали при перемішуванні до розчину 4[(2-метокси-2-метилпропіл)аміно]-1Н-імідазол-5карбоксаміду (0,155 г, 0,73 ммоль), котрий отримували з прикладу 3(b), у СН2СІ2 (2,5 мл) при кімнатній температурі протягом 16 годин. Розчинник випарювали та залишок тоді розчиняли у 2% водному розчині натрій гідроксиду (NaOH) (10 мл) та гріли при 50°С протягом 3 годин. рН доводили до нейтрельного 2 Μ НСІ та утворений осад збирали фільтруванням, а потім очищали ВЕРХ. Заголовну сполуку отримували як білий твердий продукт з виходом 32% (60 мг). 1 -1 Н ЯМР (400 МГц, ДМСО-d) δ млн 12,41 (s, 1Η), 8,13 (s, 1Η), 4,68 (s, 2Η), 3,21 (s, 3Η), 1,20 (s, 6Η); МС (IΕΡ) m/z 255 (М+1). Приклад 4 3-(2-ізопропоксіетил)-2-тіоксантин (а) 4-[(2-ізопропоксіетил)аміно]-1 Н-імідазол-5карбоксамід Трихлорціанурову кислоту (1,23 г, 5,29 ммоль) додавали до розчину 2-ізопропоксіетанолу (0,50 г, 4,80 ммоль) у СН2СІ2 (3 мл). Реакційну суміш охолоджували до 0°С та обережно додавали TEMPO (0,015 г, 0,09 ммоль) невеликими порціями. Суміш перемішували при кімнатній температурі протягом 20 хвилин та тоді фільтрували через целіт та промивали СН2СІ2. Фільтрат витримували холодним, 0°С, протягом фільтрування. Отриманий розчин альдегіду додавали при перемішуванні до суміші 4-аміно-1Н-імідазол-5-карбоксамід гідрохлориду (0,78 г, 4,80 ммоль), котрий отримували з прикладу 3(b) при 0°С у МеОН (5 мл). Суміш перемішували протягом 20 хвилин, тоді додавали NaCNBH4 (0,30 г, 4,80 ммоль). Після перемішування при кімнатній температурі протягом 5 годин суміш концентрували та очищали флеш-хроматографією (СН2СІ2/метанол градієнт, 0 до 5% метанол), отримуючи заголовну сполуку (0,39 г, 38%) як оливу. 25 1 94606 -1 Н ЯМР (ДMCO-d6) δ млн. 7,58 - 7,45 (1Η, m), 6,84 - 6,66 (2Η, m), 6,23 (1Η, br s), 3,59 - 3,49 (1Η m), 3,49 - 3,43 (2Η, m), 3,35 - 3,28 (2Η, m), 1,10-1 06 (6Η, m); MC (IEP) m/z 13 (M + 1). (b) 3-(2-ізопропоксіетил-2-тіоксо-1,2,3,7тетрагідро-6Н-пурин-6-он 4-[(2-ізопропоксіетил)аміно]-1Н-імідазол-5карбоксамід, котрий отримували з прикладу 4(а) (0,37 г, 1,74 ммоль) розчиняли у СН2СІ2 (5 мл). Етоксикарбонілізотіоціанат (0,27 г, 2,09 ммоль) додавали та суміш перемішували при кімнатній температурі протягом 30 хвилин. Суміш концентрували у вакуумі та розчиняли у 2М натрій гідроксиді (2 мл). Реакцію проводили у мікрохвильовці при 120°С протягом 10 хвилин рН розчину доводили до нейтрального рН 2М НСІ та осад збирали фільтруванням та промивали водою. Очищали препаративною ВЕРХ, отримуючи заголовну сполуку (0,14 г, 32%) як твердий матеріал. 1 -1 Н ЯМР (ДМСО-d6) δ млн. 13,82 (1Η, br s), 12,44 (1Η, br s), 8,16 (1H, s), 4,72 -4,51 (2Η m) 3,80 - 3,67 (2H, m), 3,67 - 3,56 (1H, m), 1,04 (6H, d, J=6,0 Гц); MC (IEP) m/z 255 (M + 1). Приклад 5 3-(2-Етокси-пропіл)-2-тіоксантин (a) (2-Етокси-пропіл)-тіосечовина 2-Етокси-пропіламін (1,50 г, 14,5 ммоль) та бензоілізотіоціанат (2,61 г, 16,0 ммоль) у хлороформі (,50 мл) гріли при кипінні під зворотним холодильником при 75°С протягом 1 години. Розчинник видаляли під зменшеним тиском та додавали метанол (15 мл) та воду (30 мл). Калій карбонат (2,0 г, 14,5 ммоль) додавали та суміш гріли при 75°С протягом 2 годин. Після охолодження до кімнатної температури, суміш нейтралізували 2М сульфатною кислотою та розчинник видаляли під зменшеним тиском. Сирий продукт розчиняли у метанолі та нерозчинний матеріал видаляли фільтруванням. Розчинник відганяли та утворений твердий матеріал промивали дихлорметан та розчиняли в етанолі. Нерозчинний матеріал видаляли фільтруванням та розчинник видаляли під зменшеним тиском. Це дало заголовну сполуку як білий твердий матеріал (1,6 г, 59% виходу). 1 -1 Н ЯМР (ДMCO-d6) δ млн 7,52 (1Η, широкий s), 7,02 (2Η, широкий s), 3,58 - 3,33 (5Η, m), 1,09 (3Η, t, J=6,95 Гц), 1,03 (3Η, d, J=6,06 Гц); MC (ЕР) m/z 161 (Μ - 1). (b) 6-Аміно-1-(2-етокси-пропіл)-2-тіоксо-2,3дигідро-1Н-піримідин-4-он (2-Етокси-пропіл)-тіосечовину (1,5 г, 1,4 ммоль), що отримано з прикладу 5(а) та етил ціаноацетат (1,75 г, 15,5 ммоль) додавали до розчину натрій етоксиду [зроблено з натрію (0,35 г, 15,2 ммоль) та абсолютного етанолу (15 мл)]. Утворену суміш гріли при кипінні під зворотним холодильником протягом ночі. Після охолодження до кімнатної температури додавали воду та отриману суміш нейтралізували 2 Μ сульфатною кислотою. Утворений осад збирали фільтруванням та твердий матеріал промивали водою, отримуючи бажаний продукт (1,2 г, 71% виходу). 1 -1 Н ЯМР (ДМСО-d6) δ млн. 11,86 (1Η, широкий s), 6,73 (2Η, широкий s), 4,91 (1Η, s) 4,54 (1Η, широкий s), 4,00 - 3,85 (1Η m) 3,66 - 3,46 (1Η, m), 3,39 26 - 3,23 (2Η, m), 1,12 (3Η, d J=6 32 Гц), 1 03 (3Η t, J=7,07 Гц); МС (ЕР) m/z 230 (Μ + 1). (c) 6-Аміно-1-(2-етокси-пропіл)-5-нітрозо-2тіоксо-2,3-дигідро-1Н-піримідин-4-он 6-Аміно-1-(2-етокси-пропіл)-2-тіоксо-2,3дигідро-1Н-піримідин-4-он (1,1 г, 4,8 ммоль) що отримано з прикладу 5b суспендували у 10% оцтовій кислоті (20 мл) та суміш перемішували протягом 15 хвилин. Натрій нітрит (0,36 г, 5,3 ммоль) додавали та утворену суміш гріли при 75°С протягом 1 години. Реакційна суміш стала рожевою та тоді пурпуровою. Суміш охолоджували до кімнатної температури, та пурпуровий твердий продукт збирали фільтруванням та промивали водою, отримуючи заголовну сполуку (1 05 г, 70% виходу). Цей твердий продукт застосовували у прикладі 5(d) без очистки. 1 -1 Н ЯМР (ДМСО-d6) δ млн. 13,16 (1Η, широкий s), 12,61 (1Η, широкий s), 4,50 (1Η, широкий s), 4 24 (1Η, широкий s), 3,96 - 3 84 (1Η, m), 3,56 - 3,43 (1Η, m), 3,34 - 3,20 (2Η, m), 1 13 (3Η, d, J=6,32 Гц), 0,95 (3Η, t, J=6,95 Гц); МС (ЕР) m/z 259 (Μ + 1). (d) 5 6-Діаміно-1-(2-етокси-пропіл)-2-тіоксо-2,3дигідро-1Н-піримідин-4-он 6-Аміно-1-(2-етокси-пропіл)-5-нітрозо-2-тіоксо2,3-дигідро-1Н-піримідин-4-он (1,0 г, 3,9 ммоль) що отримано з прикладу 5(с) суспендували у 32% аміаку (5 мл) та додавали воду (10 мл). Цю суміш гріли при 75°С та додавали натрій дитіоніт (1,7 г, 9,7 ммоль) невеликими порціями. Після нагрівання протягом ще 5 хвилин реакційну суміш видаляли з оливової бані та перемішували при зовнішній температурі протягом 2 годин рН суміші доводили до нейтрального рН 2М H2SO4. Твердий матеріал збирали фільтруванням та промивали водою i сушили, отримуючи діамін (0,6 г, 41% виходу). Цей продукт застосовували у прикладі 5(е) без очистки. 1 -1 Н ЯМР (ДMCO-d6) δ млн. 5,91 (2Η, широкий s), 4,59 (1Η, широкий s), 4,11 (1Η, широкий s), 3,99 - 3,85 (1Η, m), 3,68 - 3,42 (3Η, m), 3,39 - 3,20 (2Η, m), 1,14 (3Н, d, J=6,32 Гц), 1,03 (3Η, t, J=6,95 Гц); МС (ЕР) m/z 245 (Μ + 1). (e) 3-(2-Етокси-пропіл)-2-тіоксантин 5,6-Діаміно-1-(2-етокси-пропіл)-2-тіоксо-2,3дигідро-1Н-піримідин-4-он (0,60 г, 2,45 ммоль), що отримано з прикладу 5(d) суспендували у мурашиній кислоті (6 мл) та отриманий розчин гріли при 70°С протягом 2 годин Надлишок мурашиної кислоти випарювали під зменшеним тиском 10% натрій гідроксид (6 мл) додавали до твердого матеріалу та отриманий розчин гріли при 70°С протягом 2 годин рН розчину доводили до нейтрального рН 2М сульфатною кислотою. Отриманий осад збирали фільтруванням та промивали водою. Очищали препаративною ВЕРХ, заголовну сполуку (0,18 г, 29% виходу) отримували як твердий матеріал. 1 -1 Н ЯМР (ДМСО-d6) δ млн. 13,77 (1Н, широкий s), 12,41 (1Η, широкий s), 8,13 (1Η, s), 4,64 - 4,51 (1Η, m), 4,47 - 4,33 (1Η, m), 4,25 - 4,12 (1Η, m), 3,58 - 3,42 (1Η, m), 3,43 -3,31 (1Η, m) 1,06 (3Η, d, J=6,32 13 Гц), 0,95 (3Н, t, J=6,95 Гц), С ЯМР (ДMCO-d6) δ -1 млн 174,22, 152,96, 150,18, 141,54, 111,16,71,15, 63,78, 52,13, 18,33, 15,80; MC (ЕР) m/z 255 (M + 1). 27 94606 Приклад 6 3-(2S-Етокси-пропіл)-2-тіоксантин та 3-(2R-Етокси-пропіл)-2-тіоксантии Розчин рацемічного 3 -(2-Етокси-пропіл)-2тіоксантину (5 мг/мл), що отримано з прикладу 6 відокремлювали на два енантіомери за допомогою хіральної ВЕРХ на колонці Chiralpak AD (21,2 × 250 мм, 10мкм). Рухомою фазою був 100% метанол та швидкість потоку 8 мл/хвил. Об'єм ін'єкції 2 мл. Ельований першим енантіомер - 3-(2S-Етоксипропіл)-2-тіоксантин та цей енантіомер досліджували дифракцією одиничного кристала при 200 К, eн 98%;МС (ЕР) m/z 255 (М + 1). Ельований другим енантіомер - 3-(2R-Етоксипропіл)-2-тіоксантин, eн 98%; МС (EP) m/z 255 (M + 1). Відбір Способи визначення активності інгібітору МРО є розкритими у патентній заявці WO 02/090575 Фармакологічну активність сполук згідно з винаходом тестували у наступному дослід/кенні, де сполуки були тестованими поодинці або у присутності доданого тирозину. Буфер для дослідження 20 мМ натрій/калій фосфатний буфер з рН 6,5, що містить 10 мМ таурину та 100 мМ NaCI. Проявний реагент 2 мМ 3,3',5,5'тетраметилбензидину (ТМВ), 200 мкМ КІ, 200 мМ ацетатного буферу з рН 5,4 з 20% ДМФ. Комп’ютерна верстка Т. Чепелева 28 До 10 мкл розбавленої сполуки у буфері для дослідження, 40 мкл МРО людини (кінцева концентрація 2,5 нМ), з 20 мкМ тирозину (кінцева концентрація, якщо він є, 8 мкМ) або без нього додавали та суміш інкубували протягом 10 хвилин при температурі довкілля. Тоді додавапи 50 мкл Н2О2 (кінцева концентрація 100 мкМ), або буферу для дослідження поодинці як контролю. Після інкубування протягом 10 хвилин при температурі довкілля реакцію припиняли додаванням 10 мкл 0,2 мг/мл каталази (кінцева концентрація 18 мкг/мл). Реакційну суміш залишали ще на 5 хвилин перед додаванням 100 мкл ТМВ проявного реагенту. Кількість утвореного окисненого 3,3',5,5'тетраметилбензидину тоді вимірювали приблизно через 5 хвилин, застосовуючи спектроскопію поглинання приблизно при 650 нМ. Значення ІК50 тоді визначали, застосовуючи стандартні способи. При тестуванні у принаймні одному з вищенаведених досліджень, сполуки прикладів 1-51 дали значення ІК50 менше, ніж 60 мкМ, вказуючи, що вони, як передбачено, показують корисну терапевтичну активність. Репрезентативні результати показані у нижченаведеній Таблиці. Сполука Приклад 5 Підписне Інгібування МРО (у присутності тирозину) ІК50 мкМ 0,5 Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською2-thioxanthine derivatives, composition containing the compound and the use thereof in therapy
Автори англійськоюTiden Anna-Karin
Назва патенту російськоюПроизводные тиоксантина, композиция, которая их содержит, и их применение в терапии
Автори російськоюТиден Анна-Карин
МПК / Мітки
МПК: C07D 473/22, A61P 9/00, A61P 29/00, A61K 31/522, A61P 11/00, A61P 25/28
Мітки: похідні, терапії, застосування, містить, композиція, тіоксантину
Код посилання
<a href="https://ua.patents.su/14-94606-pokhidni-tioksantinu-kompoziciya-shho-kh-mistit-ta-kh-zastosuvannya-u-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні тіоксантину, композиція, що їх містить, та їх застосування у терапії</a>
Попередній патент: Бета-галактозидаза з трансгалактозилуючою активністю
Наступний патент: Спосіб і пристрій для видалення льоду і снігу і чищення вентиляторів
Випадковий патент: Комбінації протиблювотного засобу та інгібітора енкефалінази для лікування гастроентериту та діареї


















