Похідні діоксоантраценсульфонату
Формула / Реферат
1. Сполука формули (І):
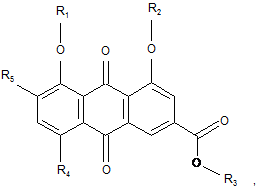
де кожний з R1, R2, R3 незалежно від інших - Н або С1-4-алкіл, або С2-4-ацил;
кожний з R4 та R5 незалежно від іншого - Η або група формули -SO3R6, де R6 - Н або С1-4-алкіл, або С2-4ацил;
за умови, що щонайменше одна з груп R4 та R5 є групою формули -SO3R6, або фармацевтично прийнятна сіль такої сполуки.
2. Сполука за п. 1, де Rl, R2 незалежно один від одного є Н або С1-4-алкіл, або С2-4-ацил, R3 та R4 - Н, та R5 - група -SO3H.
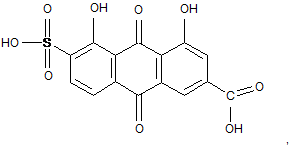
3. Сполука за п. 1 або п. 2, яка має формулу (III):
4. Сполука за будь-яким із пп. 1-3 для застосування як лікарського засобу.
5. Сполука за будь-яким із пп. 1-3 для лікування стану, на який впливають або який опосередковують прозапальні цитокіни групи IL-1.
6. Сполука за будь-яким із пп. 1-3 для застосування як лікарського засобу для лікування запального або аутоімунного стану.
7. Сполука за будь-яким із пп. 1-3 для лікування стану, вибраного з групи, яку складають ревматоїдний артрит, остеоартрит, остеопороз, псоріатичний артрит, псоріаз, артросклероз, хвороба Педжета, хронічні серцеві захворювання, запальні кишкові захворювання, в тому числі виразковий коліт та хвороба Крона, ендометріоз, гранулематоз Вегенера, неврологічні дисфункції, такі як хвороба Альцгеймера та хвороба Паркінсона, мієлома, мієлоїдний лейкоз, кістковий метастаз, діабетичний нефроз, емфізема легенів, астма.
8. Сполука за п. 7, для лікування стану, вибраного з групи, яку складають остеоартрит, ревматоїдний артрит, псоріатичний артрит та псоріаз.
9. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким із пп. 1-3 або її фармацевтично прийнятну сіль.
10. Фармацевтична композиція за п. 9, призначена для парентерального застосування.
11. Фармацевтична композиція за п. 9, призначена для перорального застосування.
12. Фармацевтична композиція за п. 9, призначена для місцевого застосування.
13. Спосіб лікування стану, на який впливають або який опосередковується прозапальними цитокінами групи IL-1, який включає введення в організм пацієнта терапевтично ефективної кількості сполуки за будь-яким із пп. 1-3 або фармацевтично прийнятної солі такої сполуки.
14. Спосіб лікування запального або аутоімунного захворювання, який включає введення в організм пацієнта терапевтично ефективної кількості сполуки за будь-яким із пп. 1-3 або фармацевтично прийнятної солі такої сполуки.
15. Спосіб за п. 13, який відрізняється тим, що згадане захворювання вибране з групи, яку складають остеоартрит, ревматоїдний артрит, псоріатичний артрит та псоріаз.
16. Застосування сполуки за будь-яким із пп. 1-3 для виготовлення лікарського засобу для лікування станів, на які впливають або які опосередковуються прозапальними цитокінами групи IL-1.
17. Спосіб одержання сполуки формули (І):

де кожний з R1, R2, R3 незалежно від інших - Н або С1-4-алкіл, або С2-4-ацил;
кожний з R4 та R5 незалежно від іншого - Η або група формули -SO3R6, де R6 - Η або С1-4-алкіл, або С2-4-ацил;
за умови, що щонайменше одна з груп R4 та R5 є групою формули -SO3R6,
або фармацевтично прийнятної солі такої сполуки, який включає оброблення концентрованою сірчаною кислотою сполуки формули (II)
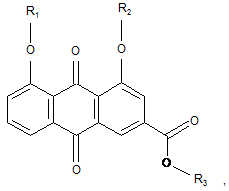
де R1, R2, R3 є Η.
Текст
Реферат: Сполуки, які можуть мати протизапальну активність, мають загальну формулу (І): R2 R1 O O O R5 O R4 O O R3 , де кожний з R1, R2, R3 незалежно від інших - Н або С1-4-алкіл, або С2-4-ацил; кожний з R4 та R5 незалежно від іншого - Η або група формули -SO3R6, де R6 - Η або С1-4-алкіл, або С2-4-ацил; за умови, що щонайменше одна з груп R4 та R5 є групою формули -SO3R6, або фармацевтично прийнятні солі таких сполук. UA 99745 C2 (12) UA 99745 C2 UA 99745 C2 5 10 15 20 25 30 35 40 45 50 55 Цей винахід стосується деяких похідних діоксоантраценсульфонату, способу їх одержання та застосування цих сполук як лікарських засобів, зокрема, при лікуванні станів, на які впливають прозапальні цитокіни групи IL-1, зокрема, запальних та аутоімунних захворювань, наприклад, артритних захворювань. Відомими є численні фармацевтичні застосування реїну -4,5-дигідрокси-9,10-діоксо-2антраценкарбонової кислоти, та її діацетильованого похідного - діацереїну. Зокрема, відомим є застосування реїну та діацереїну для лікування артритних захворювань, зокрема, остеоартриту та ревматоїдного артриту, як описано, наприклад, у US 4,244,968, GB 1 578 452, ЕР 544 880 В1, ЕР 636 602 В1 та US 6,610,750, а також псоріазу та пов'язаних із ним патологічних станів, як описано у ЕР 1 248 608 В1. Описано також реїн та діацереїн як засоби для лікування різноманітних патологічних станів, наприклад, запальних захворювань, аутоімунних захворювань, захворювань судин, діабетичного нефрозу, а також для знеболювання. Вважається, що цитокіни IL-1 (, ß) та TNF- відіграють суттєву роль в опосередкуванні запальних процесів та дегенерації хрящів. Також вважається, що IL-1 та TNF- беруть участь в опосередкуванні біологічних реакцій на ендотоксини та інші інфекційні подразники. Широкий огляд прозапальних та протизапальних цитокінів дають Динарелло та Молдауер у посібнику для клініцистів-початківців С.А. Dinarello, MD et L.L. Moldawer, PhD, "Proinflammatory and Antiinflammatory Cytokines in Rheumatoid Arthritis", 2000, Amgen Inc. Цитокіни IL-1 та TNF- є елементами механізму численних запальних та аутоімунних патологічних станів, таких як остеоартрит, ревматоїдний артрит, псоріатичний артрит, псоріаз, хвороба Педжета, остеопороз, запальні кишкові захворювання, в тому числі виразковий коліт та хвороба Крона, ендометріоз, грануломатоз Вегенера, неврологічні дисфункції, такі як хвороба Альцгеймера та хвороба Паркінсона, мієлома, мієлоїдний лейкоз, кістковий метастаз, діабетичний нефроз, хронічні серцеві захворювання, артросклероз, астма. Відомо, що діацереїн та його активний метаболіт реїн інгібують синтез та активність прозапальних катаболічних цитокінів групи інтерлейкіну-1 (IL-1), зокрема, IL-1ß. Було доведено, що реїн та діацереїн інгібують експресію IL-6, IL-8 та інших цитокінів, таких як фактор некрозу тканин (TNF-). Інгібування запальних цитокінів IL-1 та TNF- реїном та діацереїном описано, наприклад, у WO 02/058681, WO 01/051044, а також у публікаціях Мартель-Пельтьє та ін. (J. Martel-Pelletier et al. Journal of Rheumatology, 1998, 25(4), 753-762), Доуні та ін. (Е. Douni et al. Arthritis Res. Ther., 2004, 6: R65-R72). У хондроцитах пацієнтів, які страждають на ці патологічні стани, експресуються високі рівні TNF- та IL-1 у порівнянні з хондроцитами здорових осіб, і вважається, що цим специфічним механізмом дії реїну як інгібітора IL-1 пояснюється, принаймні частково, ефективністю реїну та діацереїну при лікуванні певних артритних станів, наприклад, ревматоїдного артриту, остеоартриту та псоріатичного артриту. Однак показано, що метаболіт алое-емодин, присутній в діацереїні, викликає кластогенні явища у клітинах товстої кишки та нирок. Про генотоксичність алое-емодину, випробувану за методом Комета (Comet) сповіщають, наприклад, Мюллер та ін. (S.O. Müller et al., Mutation Research, 371, (1996), 165-173). Крім того, вадою реїну та діацереїну є низька розчинність у водних розчинах, яка утруднює виготовлення фармацевтичних лікарських форм, які забезпечують біодоступність лікувального засобу. Низька розчинність реїну та діацереїну викликає особливі утруднення з точки зору виготовлення лікарських форм для парентерального введення. Відомо, що діацереїн та його активний метаболіт реїн мають певну проносну дію на пацієнтів при довготривалому лікуванні. Вважається, що ця проносна дія може бути зумовлена, принаймні частково, дуже низькою розчинністю реїну та діацереїну. Існує постійна потреба у віднайденні нових сполук для лікування або терапії станів, на які впливають або які опосередковують прозапальні цитокіни групи IL-1, зокрема, запальних та аутоімунних захворювань, в тому числі артритних захворювань. Крім того, доцільно було б запропонувати альтернативні сполуки, які інгібують прозапальні цитокіни групи IL-1 та позбавлені певних вад реїну та/або діацереїну. Крім того, доцільно було б запропонувати сполуку, яка виявляє підвищену активність інгібування прозапальних цитокінів групи IL-1. Цей винахід пропонує нові фармацевтичні сполуки формули (І): 1 UA 99745 C2 5 10 15 20 де кожний з R1, R2, R3 незалежно від інших - Н або С1-4-алкіл або С2-4-ацил; кожний з R4 та R5 незалежно від іншого - Н або група формули –SO3R6, де R6 - Н, або С1-4алкіл або С2-4-ацил; за умови, що щонайменше одна з груп R4 та R5 є групою формули -SO3R6. За конкретним варіантом здійснення цього винаходу пропонується сполука формули (І), де R1 R2, R3 та R4 - Н, та R5 - -SO3H (формула (III)). Авторами цього винаходу несподівано було виявлено, що сполуки формули (І) здатні інгібувати продукування прозапальних цитокінів групи IL-1. Показано також, що сполуки формули (І), де R4 та/або R5 є групами –SO3H, мають сприятливі характеристики розчинності. За одним з аспектів цього винаходу пропонується спосіб одержання сполуки формули (І), який включає оброблення сірчаною кислотою відповідної сполуки формули (II): де кожний з R1, R2, R3 незалежно від інших - Н. За одним з аспектів цього винаходу пропонується фармацевтична композиція, яка містить сполуку формули (І) у комбінації з відповідними фармацевтично прийнятними допоміжними речовинами. За подальшими аспектами цей винахід стосується сполуки формули (І) для застосування як лікарського засобу у медицині та ветеринарії; сполуки формули (І) для лікування станів, на які впливають або які опосередковують прозапальні цитокіни групи IL-1, зокрема, для лікування запальних та аутоімунних захворювань; застосування сполуки формули (І) для виготовлення лікарського засобу для лікування станів, на які впливають або які опосередковують прозапальні цитокіни групи IL-1, зокрема, запальних та аутоімунних захворювань; та способу лікування 2 UA 99745 C2 5 10 стану, на який впливають або який опосередковують прозапальні цитокіни групи IL-1, який включає введення в організм пацієнта терапевтично ефективної кількості сполуки формули (І). Інші цілі та переваги цього винаходу будуть ясні з формули винаходу та з поданого нижче детального опису, прикладів та фігур, які додаються. 1 На Фіг. 1(а), Фіг. 1(b) та Фіг. 1(с) показані H-ЯМР спектри сполуки за цим винаходом; на Фіг. 2 показані мас-спектр тієї самої сполуки за цим винаходом; на Фіг. 3 показаний графік, який ілюструє вплив сполуки за цим винаходом на інгібування продукування цитокіну IL-1ß у людських хондроцитах; і на Фіг. 4 показаний графік, який ілюструє дозозалежне інгібування продукування цитокіну IL1ß у людських хондроцитах сполукою за цим винаходом. Цей винахід пропонує сполуку формули (І): 25 де кожний з R1, R2, R3 незалежно від інших - Н або С1-4-алкіл або С2-4-ацил; кожний з R4 та R5 незалежно від іншого - Н або група формули -SO3R6, де R6 - Н, або С1-4алкіл або С2-4-ацил; за умови, що щонайменше один з R4 та R5 є групою формули - SO3R6. За одним із варіантів здійснення цього винаходу R1 та R2 незалежно один від одного вибрані з групи, яку складають Н, С1-4-алкіл та С2-4-ацил; R3 - Н, і R4 та R5 можуть бути Н або групами SO3H, за умови, що щонайменше один з R4 та R5 є групою -SO3H. За одним із варіантів, якому віддається перевага, обидва R1 та R2 є або Н, або ацетильні групи, обидва R3 та R4 є Н, та R5 є групою -SO3H. За одним із варіантів здійснення винаходу R1 R2, R3 є Н, і R4 та R5 незалежно один від одного є Н або -SO3H, за умови, що щонайменше одна з груп R4 та R5 є групою -SO3H. За одним із варіантів здійснення винаходу, якому віддається перевага, запропонована сполука формули (III) (6-сульфо-4,5-дигідрокси-9,10-діоксо-2-антраценкарбонова кислота): 30 Сполуки за цим винаходом можуть мати форму їхніх фармацевтично прийнятних солей. Зокрема, маються на увазі натрієві, калієві або амонієві солі. Сполуки формули (І) можуть бути одержані способом за цим винаходом, який включає оброблення сірчаною кислотою відповідної сполуки формули (II) 15 20 3 UA 99745 C2 5 10 15 20 25 30 35 40 45 де кожний з R1, R2 та R3 незалежно від інших - Н, для одержання відповідної сполуки формули (І) у формі сульфонової кислоти. На наступній стадії може бути здійснене селективне заміщення бажаними С1-4-алкілами або С2-4-ацилами з використанням звичайних способів. Наприклад, можна застосовувати реакцію з С2-4-ацилгалогенідом або з відповідним ацилангідридом для введення бажаної С2-4-ацилоксигрупи, реакцію з С1-4-спиртом для одержання відповідного складного ефіру або, наприклад, реакцію з діазометаном (CH2N2) для введення С1-алкілу або з С2-4-алкілгалогенідом для введення відповідного С2-4-алкілу. Залежно від бажаного замісника, можуть бути в разі необхідності введені відомі групи захисту з подальшим їх відщепленням відомими способами. За альтернативним варіантом сірчана кислота може бути замінена піросірчаною кислотою. За варіантом, якому віддається перевага, реакцію із сірчаною кислотою виконують при температурі від 60 °C до 120 °C, перевага віддається температурі приблизно 100 °C. Тривалість реакції з кислотою може змінюватися залежно, наприклад, від температури реакції, застосовуваної кислоти, бажаного продукту (наприклад, ди- або моносульфонової кислоти) тощо. Як загальний показник можна передбачати тривалість реакції від 1 год. до 48 год., наприклад, приблизно 24 год. Хід реакції доцільно контролювати, наприклад, методом РХВЕ, і припиняти реакцію після завершення утворення бажаного ди- або моносульфонату. Одержаний продукт може бути виділений у формі відповідної солі, наприклад, шляхом додання галогеніду відповідного металу (наприклад, NaCl) або відповідного лужного реагента (такого як NaOH, KОН або NH3). До можливих солей належать будь-які фармацевтично прийнятні солі, такі як, наприклад, солі натрію, калію або амонію. Одержану таким чином сполуку формули (І) можна очистити, застосовуючи будь-який відомий спосіб очистки, наприклад, препаративну РХВЕ або розподілення між рідинами. Сполуки формули (І) за цим винаходом виявляють активність щодо інгібування прозапальних цитокінів групи IL-1. При дослідженні на людських хондроцитах in vitro несподівано з'ясовано, що сполуки формули (І) виявляють підвищену здатність до інгібування інтерлейкіну-1 (IL-1ß) у порівнянні з реїном. Перевагою сполук формули (І) є те, що вони дозволяють усунути метаболіт алое-емодин, присутній у діацереїні. З урахуванням активності сполук за цим винаходом при інгібуванні прозапальних цитокінів групи IL-1, ці сполуки можна застосовувати для лікування станів, які характеризуються ненормально високим або підвищеним рівнем IL-1. До станів, які можна лікувати сполуками за цим винаходом, належать запальні та аутоімунні захворювання. Серед таких станів можна згадати ревматоїдний артрит, остеоартрит, остеопороз, псоріатичний артрит, псоріаз, артросклерозу, хворобу Педжета, хронічні серцеві захворювання, запальні кишкові захворювання, в тому числі виразковий коліт та хворобу Крона, ендометріоз, грануломатоз Вегенера, неврологічні дисфункції, такі як хвороба Альцгеймера та хвороба Паркінсона, мієлому, мієлоїдний лейкоз, кістковий метастаз, діабетичний нефроз, емфізему легенів, астму. Відповідно, один з аспектів цього винаходу стосується способу лікування станів, які характеризуються підвищеними рівнями IL-1 у порівнянні зі здоровими особами, який включає введення в організм пацієнта ефективної кількості сполуки за цим винаходом або її фармацевтично прийнятної солі. Згаданими станами за варіантом, якому віддається перевага, є 4 UA 99745 C2 5 10 15 20 25 30 35 40 45 50 55 60 запальні захворювання або аутоімунні захворювання. Зокрема, до станів, які підлягають лікуванню, належать запальні захворювання суглобів, зокрема, остеоартрит або ревматоїдний артрит. До таких станів також можна віднести, зокрема, псоріатичний артрит та псоріаз. Ймовірно, що сполуки за цим винаходом можуть виявитися клінічно корисними стосовно до широкого кола запальних та аутоімунних захворювань, перелічених вище, також завдяки фізичним властивостям згаданих сполук, покращеним у порівнянні з реїном. За одним з аспектів цього винаходу пропонується фармацевтична композиція, яка містить сполуку формули (І) у комбінації з відповідними фармацевтично прийнятними допоміжними речовинами. Фармацевтичні композиції за цим винаходом можуть бути призначені для застосування у медицині або у ветеринарії. Фармацевтичні композиції за цим винаходом можуть виготовлятися у формах, придатних для введення будь-яким шляхом, в тому числі, наприклад, пероральним, внутрішньом'язовим, внутрішньовенним, підшкірним, ректальним, місцевим, черезшкірним, назальним, внутрішньосуглобовим, під'язичним та внутрішньоочеревинним шляхами. До лікарських форм для перорального застосування можуть належати, наприклад, таблетки, тверді або м'які желатинові капсули, пастилки, суспензії на водній або масляній основі, дисперговні порошки або гранули, призначені для відновлення, сиропи та емульсії. Лікарські препарати для парентерального застосування можуть мати будь-яку прийнятну фармацевтичну форму, таку як стерильний водний буферований розчин або суспензія для ін'єкцій, стерильний розчин або суспензія для ін'єкцій на основі будь-якого іншого прийнятного для парентерального введення розріджувача або розчинника, або ліофілізовану форму для відновлення безпосередньо перед застосуванням. Композиціям за цим винаходом може бути надана також лікарська форма, придатна для місцевого застосування, наприклад, форма крему, гелю, мазі або емульсії у водному або іншому носії. Очікується, що сполуки формули (І) за цим винаходом будуть краще розчинятися у воді, ніж реїн або діацереїн, в результаті присутності групи сульфонової кислоти. Наприклад, показано, що сполуки формули (І) за цим винаходом, де R1, R2, R3 є Н, та один з R4 та R5 незалежно від іншого або обидва є групами SO3H, мають особливо сприятливу розчинність у водному середовищі. Наприклад, сполука формули (III) має розчинність у воді 1,2 мг/мл, тоді як реїн та діацереїн практично не розчиняються у воді. Сприятливі характеристики розчинності сполук за цим винаходом уможливлюють їх застосування парентеральними шляхами, наприклад, шляхом ін'єкції або інфузії, зокрема, внутрішньосуглобової, внутрішньом'язової, внутрішньовенної або підшкірної ін'єкції або інфузії. Фармацевтичні композиції можуть виготовлятися способами, відомими у галузі, з використанням відповідних відомих фармацевтичних допоміжних речовин та/або домішок. Маються на увазі будь-які відповідні фармацевтично прийнятні допоміжні речовини, наприклад, розріджувачі, в'яжучі, поверхнево-активні речовини, змащувальні засоби, суспендувальні засоби, емульгатори, буферні засоби проти злежування, водні або масляні носії, розпушувальні засоби, консерванти, смакоароматичні засоби, підсолоджувачі, забарвлювальні засоби, залежно від обраного шляху застосування. Прийнятні схеми дозування можуть змінюватися залежно, зокрема, від таких чинників, як терапевтичне застосування, тяжкість патологічного стану та стан пацієнта, який підлягає лікуванню. Типові добові дози можуть змінюватися від приблизно 0,05 мг до приблизно 150 мг на кілограм маси тіла пацієнта на добу. Загалом, можна передбачати добові дози від приблизно 10 мг на добу до 500 мг на добу, наприклад, від приблизно 10 мг на добу до приблизно 250 мг на добу. Кількість активного засобу у дозованій одиниці лікарської форми залежить від вищезгаданих чинників, а також від обраного шляху застосування і, як правило, становить від 1 мг до 500 мг активного інгредієнта на дозовану одиницю. Винахід додатково ілюструється поданими нижче необмежувальними прикладами. ПРИКЛАДИ Приклад 1 Одержання 6-сульфо-4,5-дигідрокси-9,10-діоксо-2-антраценкарбонової кислоти Реїн (1г), одержаний шляхом деацетилювання чистого діацереїну, із характеристикою чистоти понад 99 %, розчиняли у концентрованій сірчаній кислоті (100 мл). Розчин витримували при 100 °C при перемішуванні протягом 24 год. Хід реакції контролювали у реальному масштабі часу, застосовуючи РХВЕ, до завершення реакції. Реакційній суміші давали охолодитися, і виливали у 2 л води при перемішуванні. Одержаний розчин потім витримували протягом ночі при 4 °C. Здатний до утворення солей реїн, який не вступив у реакцію, видаляли центрифугуванням. Цільову сполуку, 6-сульфо-4,5 5 UA 99745 C2 5 10 15 20 25 30 35 40 45 50 55 60 дигідрокси-9,10-діоксо-2-антраценкарбонову кислоту, осаджували у формі її натрієвої солі шляхом додання 110 г хлориду натрію. Одержану суспензію охолоджували до 4 °C, потім центрифугували для відділення твердого продукту, і сушили його у вакуумі. Одержали 2,32 г продукту. Видалення солей: Продукт, одержаний як описано вище, додавали до води (115 мл) при перемішуванні при 4 °C протягом 30 хв. Потім суспензію центрифугували та декантували для відділення надосадової рідини із залишковими солями. Цю операцію повторювали сім разів до досягнення постійної провідності (приблизно 330 мкСм/см), яку вимірювали за допомогою кондуктометра (Radiometer CDM 206). Потім залишок після центрифугування сушили у вакуумі, і одержували 480 мг продукту зі ступенем чистоти 95,6 % за даними РХВЕ. Приклад 2 Визначення характеристик 1 Аналіз H-ЯМР: 1 Спектр H-ЯМР продукту, одержаного за Прикладом 1, знімали в диметилсульфоксиді (DMSO), застосовуючи спектрометр Bruker®, на частоті 400 МГц. Одержані спектри, показані на Фіг. 1(а)-1(с), узгоджуються зі спектром 6-сульфо-4,5-дигідрокси-9,10-діоксо-2антраценкарбонової кислоти. 1 Спектри H-ЯМР посвідчують присутність лише чотирьох ароматичних протонів, двох у мета-положенні та двох в орто-положенні. Спектри свідчать, що заміщення групою сульфонової кислоти відбулося у циклі, який раніше мав тільки гідроксильний замісник. Хімічні зсуви при порівнянні із хімічними зсувами, обчисленими на основі інкрементів, свідчать, що заміщення групою сульфонової кислоти пройшло в орто-положенні. Mac-спектрометричний (MS) аналіз: Мас-спектроскопію продукту за Прикладом 1 виконували на приладі Agilent 1100 LC-MS Spectrometer, з іонізацією під атмосферним тиском у режимі негативного електророзпилення. Одержаний спектр, показаний на Фіг. 2, включає пік з масою 364, отже, узгоджується з 6сульфо-4,5-дигідрокси-9,10-діоксо-2-антраценкарбоновою кислотою, формула (III). Приклад 3 Одержання натрієвої солі 6-сульфо-4,5-дигідрокси-9,10-діоксо-2-антраценкарбонової кислоти Реїн (1г), одержаний шляхом деацетилювання чистого діацереїну, з характеристикою чистоти понад 99 %, розчиняли у концентрованій сірчаній кислоті (100 мл). Розчин витримували при 100 °C при перемішуванні протягом 24 год. Хід реакції контролювали у реальному часі, застосовуючи РХВЕ, до завершення реакції. Реакційній суміші давали охолодитися, і виливали у 2 л води при перемішуванні. Одержаний розчин потім витримували протягом ночі при 4 °C. Здатний до утворення солей реїн, який не вступив у реакцію, видаляли центрифугуванням. Встановлювали pH надосадової рідини 7,0 за допомогою 1 М розчину NaOH. Продукт, 6сульфо-4,5-дигідрокси-9,10-діоксо-2-антраценкарбонову кислоту у формі натрієвої солі, відділяли та очищали з розчину шляхом препаративної РХВЕ, застосовуючи колонку з оберненою фазою С18-силікагель та суміш метанол-вода-Н3РO4 як елюент. Виділили 1 г продукту, який характеризували як натрієву сіль 6-сульфо-4,5-дигідрокси-9,10-діоксо-2антраценкарбонової кислоти, застосовуючи аналізи ЯМР та MS, як описано у прикладі 2. Приклад 4 Дослідження інгібування IL-1ß у людських хондроцитах in vitro Досліджувалася активність сполуки за прикладом 1 та реїну при інгібуванні стимульованого ліпополісахаридами (LPS) продукування цитокіну IL-1ß нормальними та остеоартритними (ОА) людськими хондроцитами. Матеріали та методи Людські хрящові тканини були одержані при ортопедичній хірургічній операції повного протезування стегна з приводу травматичного перелому у здорових осіб та пацієнтів, які страждали на ОА. Пацієнтів з ОА вибирали, виходячи з таких критеріїв: (1) двобічний ОА, (2) діагноз помірного ОА (ступінь І-ІІІ за Келлгреном-Лорансом (Kellgren-Laurence)), підтверджений даними рентгенологічного та лабораторного досліджень. Були виготовлені суспензії ізольованих хондроцитів зі зразків хрящів, одержаних від чотирьох пацієнтів з ОА та дев'яти здорових осіб. Зразки відбирали та зберігали в асептичних умовах. Хрящ розрізали на дрібні фрагменти та інкубували з розчином колагенази бактерій Clostridium (1 мг/мл) у карбонатно-бікарбонатному буфері протягом 48 год. при 37 °C. Після відділення від хрящової матриці хондроцити центрифугували при швидкості 1500 об/хв. протягом 5 хв. В експериментах використовували відділені хондроцити, суспендовані у 6 UA 99745 C2 5 10 15 20 живильному середовищі (DMEM з домішкою 10 % сироватки плоду корови SCF). Життєздатність клітин оцінювали за витісненням барвника трипанового синього. Стимуляцію хондроцитів in vitro бактеріальним ендотоксином (LPS) для продукування IL-1ß виконували, як описано нижче. 6 Аліквотні кількості по 110 клітин/мл у живильному середовищі висівали у пробірки Falcon місткістю 15 мл, і витримували при перемішуванні на ротаційному струшувані (100 об/хв.). Хондроцити культивували протягом 48 год. у присутності LPS (10 мкг/мл) з 20 мкг/мл реїну або зі зростаючими концентраціями (1 мкг/мл, 5 мкг/мл, 10 мкг/мл, 20 мкг/мл та 30 мкг/мл) випробовуваної сполуки (сполуки за прикладом 1). Проби з реїном піддавали ультразвуковому обробленню протягом 5 хв. з метою зведення до мінімуму ускладнень, пов'язаних із гідрофобною природою реїну. Щодо проб із випробовуваною сполукою, таких ускладнень не спостерігалося завдяки задовільній розчинності сполуки. Продукування IL-1ß хондроцитами у різних зразках культур визначали у живильному середовищі із застосуванням набору для твердофазового імуноферментного аналізу (ELISA). На Фіг. 3 показані результати, одержані при застосуванні реїну та сполуки за прикладом 1, які стосуються продукування IL-1ß' у стимульованих LPS хондроцитах, одержаних від здорових осіб та від хворих, на ОА, за даними ELISA. На Фіг. 4 показано дозозалежне інгібування випробовуваною сполукою (сполука за прикладом 1) продукування IL-1ß нормальними хондроцитами. Результати, ілюстровані Фіг. 3, свідчать, що сполука за цим винаходом виявляє значно вищу активність інгібування IL-1ß у порівнянні з реїном. Фіг. 4 свідчить, що сполука за цим винаходом забезпечує значне інгібування продукування IL-1ß, максимальне інгібування відповідає концентраціям від 10 мкг/мл до 20 мкг/мл. ФОРМУЛА ВИНАХОДУ 25 1. Сполука формули (І): R2 R1 O O O R5 O R4 30 35 O O R3 , де кожний з R1, R2, R3 незалежно від інших - Н або С1-4-алкіл, або С2-4-ацил; кожний з R4 та R5 незалежно від іншого - Η або група формули -SO3R6, де R6 - Н або С1-4-алкіл, або С2-4ацил; за умови, що щонайменше одна з груп R4 та R5 є групою формули -SO3R6, або фармацевтично прийнятна сіль такої сполуки. 2. Сполука за п. 1, де R1, R2 незалежно один від одного є Н або С1-4-алкіл, або С2-4-ацил, R3 та R4 - Н, та R5 - група -SO3H. 3. Сполука за п. 1 або п. 2, яка має формулу (III): O HO OH O OH S O C O 40 O OH . 4. Сполука за будь-яким із пп. 1-3 для застосування як лікарського засобу. 5. Сполука за будь-яким із пп. 1-3 для лікування стану, на який впливають або який опосередковують прозапальні цитокіни групи IL-1. 6. Сполука за будь-яким із пп. 1-3 для застосування як лікарського засобу для лікування запального або аутоімунного стану. 7 UA 99745 C2 5 10 15 20 25 7. Сполука за будь-яким із пп. 1-3 для лікування стану, вибраного з групи, яку складають ревматоїдний артрит, остеоартрит, остеопороз, псоріатичний артрит, псоріаз, артросклероз, хвороба Педжета, хронічні серцеві захворювання, запальні кишкові захворювання, в тому числі виразковий коліт та хвороба Крона, ендометріоз, гранулематоз Вегенера, неврологічні дисфункції, такі як хвороба Альцгеймера та хвороба Паркінсона, мієлома, мієлоїдний лейкоз, кістковий метастаз, діабетичний нефроз, емфізема легенів, астма. 8. Сполука за п. 7 для лікування стану, вибраного з групи, яку складають остеоартрит, ревматоїдний артрит, псоріатичний артрит та псоріаз. 9. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким із пп. 1-3 або її фармацевтично прийнятну сіль. 10. Фармацевтична композиція за п. 9, призначена для парентерального застосування. 11. Фармацевтична композиція за п. 9, призначена для перорального застосування. 12. Фармацевтична композиція за п. 9, призначена для місцевого застосування. 13. Спосіб лікування стану, на який впливають або який опосередковується прозапальними цитокінами групи IL-1, який включає введення в організм пацієнта терапевтично ефективної кількості сполуки за будь-яким із пп. 1-3 або фармацевтично прийнятної солі такої сполуки. 14. Спосіб лікування запального або аутоімунного захворювання, який включає введення в організм пацієнта терапевтично ефективної кількості сполуки за будь-яким із пп. 1-3 або фармацевтично прийнятної солі такої сполуки. 15. Спосіб за п. 13, який відрізняється тим, що згадане захворювання вибране з групи, яку складають остеоартрит, ревматоїдний артрит, псоріатичний артрит та псоріаз. 16. Застосування сполуки за будь-яким із пп. 1-3 для виготовлення лікарського засобу для лікування станів, на які впливають або які опосередковуються прозапальними цитокінами групи IL-1. 17. Спосіб одержання сполуки формули (І): R2 R1 O O O R5 O R4 30 O O R3 , де кожний з R1, R2, R3 незалежно від інших - Н або С1-4-алкіл, або С2-4-ацил; кожний з R4 та R5 незалежно від іншого - Η або група формули -SO3R6, де R6 - Η або С1-4-алкіл, або С2-4-ацил; за умови, що щонайменше одна з груп R4 та R5 є групою формули -SO3R6, або фармацевтично прийнятної солі такої сполуки, який включає оброблення концентрованою сірчаною кислотою сполуки формули (II) R2 R1 O O O O O O R3 , де R1, R2, R3 є Η. 8 UA 99745 C2 9 UA 99745 C2 10 UA 99745 C2 11 UA 99745 C2 Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюDioxoanthracene sulphonate derivatives
Автори англійськоюCarlino, Stefano, Di Napoli, Alessandro
Назва патенту російськоюПроизводные диоксоантраценсульфоната
Автори російськоюКарлино Стефано, Ди-Наполи Алессандро
МПК / Мітки
МПК: A61K 31/10, C07C 317/46, A61P 29/00
Мітки: діоксоантраценсульфонату, похідні
Код посилання
<a href="https://ua.patents.su/14-99745-pokhidni-dioksoantracensulfonatu.html" target="_blank" rel="follow" title="База патентів України">Похідні діоксоантраценсульфонату</a>
Попередній патент: Дозувальний пристрій для інгаляції порошкоподібної речовини
Наступний патент: Кристалічний хіміотерапевтичний засіб на основі індазолу
Випадковий патент: Стійлове обладнання з пристроєм для фіксації тварин в боксі












