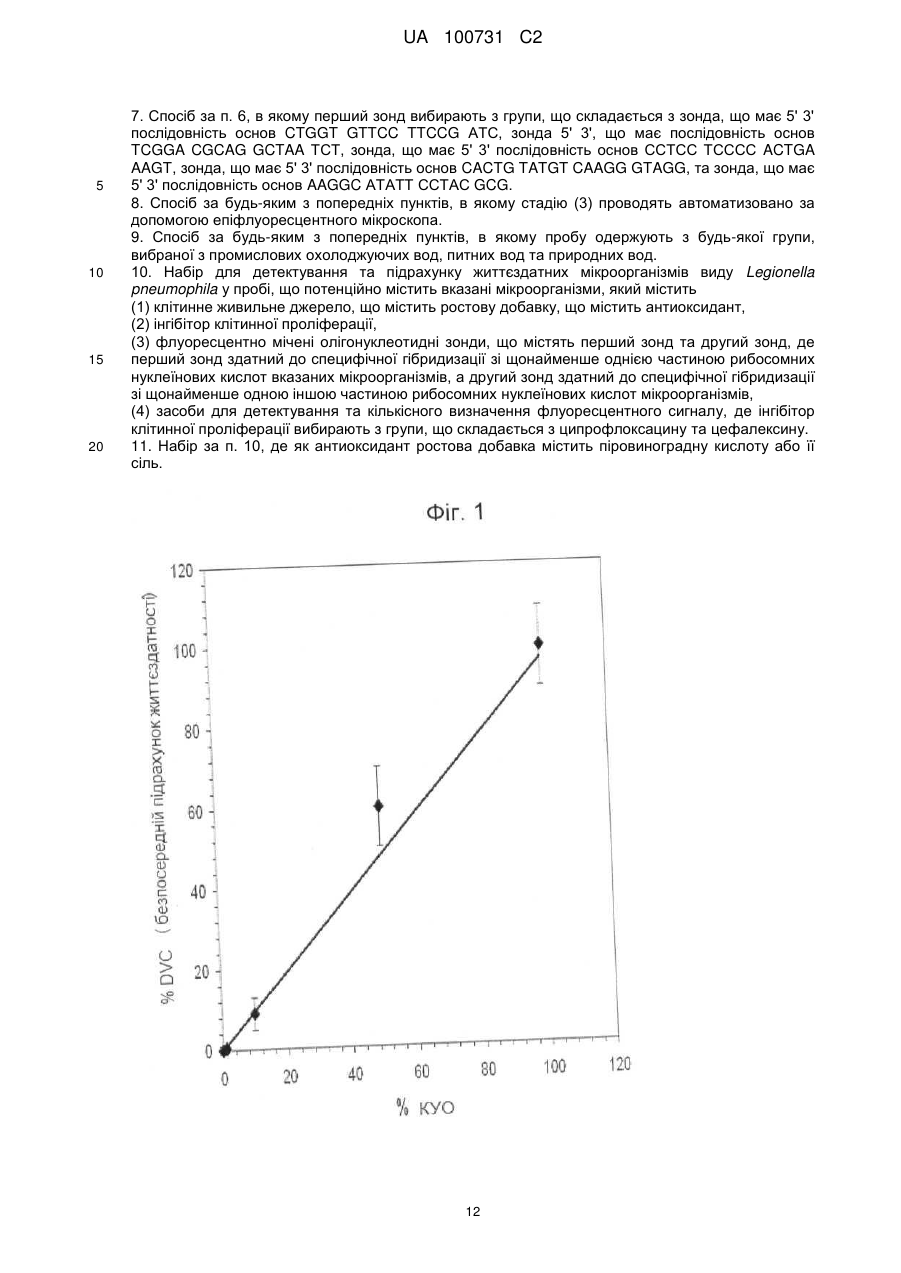
Детекція та підрахунок мікроорганізмів
Формула / Реферат
1. Спосіб детектування та підрахунку життєздатних мікроорганізмів у пробі, що потенційно містить вказані мікроорганізми, який включає
(1) контактування вказаної проби з клітинним живильним джерелом та інгібітором клітинної проліферації, у якій клітинне живильне джерело містить ростову добавку, що містить антиоксидант,
(2) контактування вказаної проби зі щонайменше одним флуоресцентно міченим олігонуклеотидним зондом, здатним до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, причому вказану пробу приводять у контакт зі щонайменше першим зондом та другим зондом, де перший зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, а другий зонд здатний до специфічної гібридизації зі щонайменше одною іншою частиною рибосомних нуклеїнових кислот мікроорганізмів,
(3) детектування та кількісне визначення флуоресцентного сигналу, де мікроорганізми належать до виду Legionella pneumophila та де інгібітор клітинної проліферації вибирають з групи, що складається з ципрофлоксацину та цефалексину.
2. Спосіб за п. 1, де як антиоксидант ростова добавка містить піровиноградну кислоту або її сіль
3. Спосіб за п. 1 або 2, де клітинне живильне джерело стадії 1) містить глютамінову кислоту або її сіль.
4. Спосіб за будь-яким з попередніх пунктів, де клітинне живильне джерело стадії 1) містить глютамінову кислоту (або її сіль) та піровиноградну кислоту (або її сіль).
5. Спосіб за будь-яким з попередніх пунктів де олігонуклеотидний зонд вибирають з групи, що складається з зонда, що має 5' 3' послідовність основ АТС TGA CCG ТСС CAG GTT, зонда, що має 5' 3' послідовність основ ATCTG ACCGT CCCAG GTT, та зонда, що має 5' 3' послідовність основ AGCTT ТСАТС CAAAG АТА.
6. Спосіб за будь-яким з попередніх пунктів, в якому на стадії (2) вказану пробу приводять у контакт зі щонайменше першим зондом та другим зондом, де перший зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот, всі з яких належать до роду Legionella, та де другий зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот, всі з яких належать до виду Legionella pneumophila.
7. Спосіб за п. 6, в якому перший зонд вибирають з групи, що складається з зонда, що має 5' 3' послідовність основ CTGGT GTTCC TTCCG АТС, зонда 5' 3', що має послідовність основ TCGGA CGCAG GCTAA ТСТ, зонда, що має 5' 3' послідовність основ ССТСС ТСССС ACTGA AAGT, зонда, що має 5' 3' послідовність основ CACTG TATGT CAAGG GTAGG, та зонда, що має 5' 3' послідовність основ AAGGC АТАТТ ССТАС GCG.
8. Спосіб за будь-яким з попередніх пунктів, в якому стадію (3) проводять автоматизовано за допомогою епіфлуоресцентного мікроскопа.
9. Спосіб за будь-яким з попередніх пунктів, в якому пробу одержують з будь-якої групи, вибраної з промислових охолоджуючих вод, питних вод та природних вод.
10. Набір для детектування та підрахунку життєздатних мікроорганізмів виду Legionella pneumophila у пробі, що потенційно містить вказані мікроорганізми, який містить
(1) клітинне живильне джерело, що містить ростову добавку, що містить антиоксидант,
(2) інгібітор клітинної проліферації,
(3) флуоресцентно мічені олігонуклеотидні зонди, що містять перший зонд та другий зонд, де перший зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, а другий зонд здатний до специфічної гібридизації зі щонайменше одною іншою частиною рибосомних нуклеїнових кислот мікроорганізмів,
(4) засоби для детектування та кількісного визначення флуоресцентного сигналу, де інгібітор клітинної проліферації вибирають з групи, що складається з ципрофлоксацину та цефалексину.
11. Набір за п. 10, де як антиоксидант ростова добавка містить піровиноградну кислоту або її сіль.
Текст
Реферат: Винахід стосується способу детектування та підрахунку життєздатних мікроорганізмів у пробі, що потенційно містить вказані мікроорганізми, який включає: UA 100731 C2 (12) UA 100731 C2 (1) контактування вказаної проби з клітинним живильним джерелом та інгібітором клітинної проліферації, у якій клітинне живильне джерело містить ростову добавку, що містить антиоксидант, (2) контактування вказаної проби зі щонайменше одним флуоресцентно міченим олігонуклеотидним зондом, здатним до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, причому вказану пробу приводять у контакт зі щонайменше першим зондом та другим зондом, де перший зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, а другий зонд здатний до специфічної гібридизації зі щонайменше одною іншою частиною рибосомних нуклеїнових кислот мікроорганізмів, (3) детектування та кількісне визначення флуоресцентного сигналу, де мікроорганізми належать до виду Legionella pneumophila та, де інгібітор клітинної проліферації вибирають з групи, що складається з ципрофлоксацину та цефалексину. Винахід також стосується набору для детектування та підрахунку життєздатних мікроорганізмів виду Legionella pneumophila у пробі, що потенційно містить вказані мікроорганізми. UA 100731 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується способу детекції та підрахунку життєздатних мікроорганізмів виду Legionella pneumophila у пробі. Даний винахід також включає комплект, придатний для застосування у вказаному способі. Даний спосіб та комплект дозволяють більш швидке кількісне визначення життєздатних мікроорганізмів. Бактерії Legionella є убіквітарними у мокрих чи вологих середовищах, таких, як грунт та неморські водні середовища. Вони можуть також зустрічатися в водопроводах теплої та холодної води, стояках водяного охолодження систем кондиціонування повітря та зволожувачів повітря. Legionella, особливо Legionella pneumophila, є патогенами. Що можуть спричиняти гострі бактеріальні пневмонії, загальновідомі як "хвороба легіонерів", яка часто є летальною для інфікованих осіб. Традиційно детекцію підрахунок Legionella pneumophila здійснюють шляхом культивування клітин. Цей спосіб може бути реалізований шляхом вимірювання бактерій, які можуть бути культивовані, за допомогою підрахунку шляхом висівання на чашках Петрі чи вимірювання мікроколоній із застосуванням способу фільтрувальних мембран. Ці способи оцінюють здатність життєздатних бактерій утворювати колонію чи мікроколонію. На жаль, такі способи зазвичай потребують від 3 до 10 днів для того, щоб дозволити утворення колоній чи мікроколоній. У разі експлуатації водопроводів існує неприйнятний ризик інфікування людей протягом цього часу. Інші способи детекції загальної кількості мікроорганізмів Legionella включають методи ПЛР (полімеразної ланцюгової реакції). ПЛР застосовує ДНК полімеразу для ампліфікації частини ДНК за допомогою ферментної реплікації in vitro. Протягом використання методу генеровану ДНК застосовують як темплату для реплікації, що запускає ланцюгову реакцію, в якій темплата ДНК експоненційно ампліфікується. ПЛР дозволяє ампліфікацію однієї чи декількох копій частин ДНК шляхом генерування мільйонів чи більше копій частин ДНК. Типово такий спосіб описано у Diederen та інші, J Med Microbiol. 2007 Jan; 56 (Pt 1):94-101. Проте недолік ПЛР полягає у тому, що проби мають тенденцію до вмісту інгібіторів реакції полімеризації та тому не забезпечують відповідні кількісні результати. Додатково, метод засновано на стадії попереднього очищення ДНК, що може призвести до втрати ДНК з наступною недостатньою оцінкою наявних Legionella. Деякою мірою такі недоліки долають ПЛР у режимі реального часу, що є кількісною. Проте такий метод не може розрізняти життєздатні клітини та нежиттєздатні клітини. Іншим методом є флуоресцентна гібридизація in situ (FISH), в якій олігонуклеотидний зонд, мічений флуоресцентною речовиною, проникає у клітини бактерій. Якщо рибосомні нуклеїнові кислоти (рРНК) мають послідовність, що відповідає зонду, відому як мішень, то зонд приєднається до своєї мішені та не буде видалений жодною наступною стадією промивання. Бактерії, в яких зонд зафіксовано, будуть потім випромінювати флуоресцентний сигнал. Цей флуоресцентний сигнал може бути кількісно оцінений за допомогою таких методів, як проточна цитометрія, твердофазна цитометрія чи епіфлуоресцентна мікроскопія. Типову методику FISH описано у Dutil S та інші J АррІ Microbiol. 2006 May; 100(5):955-63. Проте, при застосуванні методу FISH окремо може бути детектована загальна кількість життєздатних Legionella pneumophila, проте на жаль цей спосіб не може ідентифікувати виключно такі бактерії Legionella pneumophila, що здатні ділитися та у результаті утворювати колонію. Додатковий спосіб підрахунку життєздатних Legionella pneumophila включає ChemChrome V6 та описано Delgado-Viscogliosi та інші АррІ Environ Microbiol. 2005 Jul;71(7):4086-96. Даний спосіб дозволяє кількісне визначення Legionella pneumophila, а також диференціацію життєздатних та нежиттєздатних бактерій. Він сполучає специфічну детекцію клітин Legionella і застосуванням антитіл та маркеру бактеріальної життєздатності (ChemChrome V6) та задіє епіфлуоресцентну мікроскопію для підрахунку. Проте, хоча даний метод розрізнює життєздатні та нежиттєздатні бактерії, він не здатний окремо ідентифікувати такі колонієутворюючі бактерії. На сьогодні тільки способи, що дозволяють детекцію бактерій Legionella pneumophila, здатних ділитися, засновані на способі мікроколонії (Scan-VIT). Проте цей спосіб потребує близько 72 годин. Аrаnа та інші "Detection and enumeration of viable but non-culturable transconjugants of Escherichia coli during the survival of recipient cells in river water" pp 340-346, J. App. Microbiol. Vol 83, 1997 описує застосування безпосереднього підрахунку життєздатності (DVC) за допомогою специфічних маркерів. Як Piqueres та інші "A combination of direct viable count and fluorescent in situ hybridisation for estimating Helicobacter pylori cell viability" pp 345-349 Res. Macrobiol. Vol 157, 2006, так і Jjemba та інші "In situ enumeration and probing of pyrene degrading soil bacteria" pp 287-298 FEMS Microbiol. Ecol. Vol. 55, 2006, описують DVC-FISH, але для мікроорганізмів, що не належать до Legionella pneumophila. 1 UA 100731 C2 5 10 15 20 25 30 35 40 45 50 55 ЕР-А-1852512 описує спосіб ідентифікації та підрахунку декількох патогенних мікроорганізмів, включаючи Legionella pneumophila. Даний спосіб включає безпосередній підрахунок життєздатності (DVC) та флуоресцентну гібридизацію in situ (FISH), але також застосовує хелперний зонд для ампліфікації сигналу. Хелперні проби являють собою немічені олігонуклеотиди, що зв'язують ділянки, прилеглі до ділянок-мішеней специфічного міченого зонда. Це підвищує доступність in situ та тому зонд надає сигнал. Даний спосіб описано у ЕР-А-1852512, в ньому описано застосування ДНК-гіразного інгібітору, такого, як налідиксова кислота, що припиняє ділення клітин, підвищення вмісту внутрішньоклітинної рРНК та клітинної довжини чутливих клітин. Проте, на практиці налідиксова кислота не є надійним ефективним ДНК-гіразним інгібітором для Legionella pneumophila. Додатково, у вказаному документі не описано проблеми неточного підрахунку, що може мати місце через присутність природних флуоресцентних мікроорганізмів. Може бути бажаним забезпечення способу надійної кількісної оцінки життєздатних Legionella pneumophila, здатних утворювати колонії у пробі, більш швидкого, ніж відомі методи. Додатково, переважним буде досягнення цього з більшою точністю. Відповідно до даного винаходу, ми забезпечуємо спосіб детекції та підрахунку життєздатних мікроорганізмів у пробі, що потенційно містить вказані мікроорганізми, що включає: (1) контактування вказаної проби з живильним клітинним середовищем та інгібітором клітинної проліферації, (2) контактування вказаної проби зі щонайменше одним флуоресцентно міченим олігонуклеотидним зондом, здатним до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, (3) детекцію та кількісне визначення флуоресцентного сигналу, де мікроорганізми належать до виду Legionella pneumophila та в яких інгібітор клітинної проліферації вибирають з групи, що складається з ципрофлоксацину та цефалексину. Загалом, кожну зі стадій здійснюють послідовно, та стадію (2) проводять з пробою, таким чином обробленою на стадії (1), та стадію (3) проводять після стадії (2). Стадія 1 способу відповідно до даного винаходу відома як безпосередній підрахунок життєздатності (DVC), заснований на інкубуванні бактерій у присутності антибіотику чи ДНКгіразного інгібітору, що блокує ділення клітин без погіршення клітинного метаболізму. Тому живі бактерією матимуть тенденцію до продовження, а не ділення, тобто вони можуть бути розрізнені від мертвих бактерій, що не змінюють свій розмір. Тому існує можливість ідентифікації життєздатних бактерій за допомогою мікроскопії. Перед проведенням стадії DVC може бути бажаним концентрація проби та попередня обробка, наприклад, кислотою, та/або теплова обробка відповідно до стандартного способу Т 90-431 (ISSN 0335-3931), редагованого та розповсюдженого Французькою асоціацією нормалізації (AFNOR) 11, Avenue Francis de Pressense-93571 St Denis La Plaine Cedex, France. Неочікувано нами було відкрито, що ципрофлоксацин та цефалексин є дуже ефективними ДНК-гіразними інгібіторами. Як ципрофлоксацин, так і цефалексин дозволяють клітинам Legionella pneumophila подовжуватися при підготовці до ділення клітин, проте фактично блокувати ділення таких подовжених клітин. Навпаки, налідиксова кислота не забезпечує достатнє подовження клітин Legionella pneumophila, яке було ефективним для даного способу. Корисним є наше відкриття того, що спосіб за даним винаходом дозволяє надійну ідентифікацію та кількісне визначення Legionella pneumophila у шкалі часу, що стандартно становить менш ніж 24 години. Це забезпечує значні покращення при санітарному контролі води. Ципрофлоксацин чи цефалексин можуть бути застосовані у будь-яких ефективних кількостях. Типово це можуть бути концентрації до 20 мг/л чи вище у середовищі, яке містить клітинне живильне джерело. Переважно, концентрації становлять від 1 до 10 мг/л. Переважно, інгібітором клітинної проліферації є ципрофлоксацин. Ми знайшли, що найбільше подовження клітин може бути досягнуто, коли концентрація ципрофлоксацину становить від 2 до 6 мг/л через 12 годин, особливо від 3 до5 мг/л. Живильне клітинне джерело повинно містити будь-яку придатну композицію середовище живлення, застосовну до способу DVC та прийнятну для Legionella pneumophila. Придатна композиція середовища може містити середовище, селективну добавку, інгібітор клітинної проліферації (ципрофлоксацин чи цефалексин), та живильну добавку. Дане середовище забезпечує мінімальне живлення, необхідне для того, щоб дозволити зростання Legionella pneumophila. Це може бути будь-яке прийнятне середовище, описане у літературі, наприклад, відповідно до рекомендацій стандартного способу Т 90-431 (вказаного вище) без агару та деревного вугілля. 2 UA 100731 C2 5 10 15 20 25 30 35 40 45 50 55 60 Селективне середовище часто необхідно для обмеження розвитку мікроорганізмів, що перешкоджають. Антибіотиком може бути будь-яка відома добавка, придатна для способу DVC, наприклад, описаний у стандартному способі Т 90-431 (як наведено вище). Тим не менш, концентрація будь-якого антибіотика, взагалі, має бути адаптована до конкретного рідкого середовища. Проте, це не є обов'язково шкідливим у випадках, коли ці інші мікроорганізми не повністю знищено, оскільки стадія 2 зазвичай буде достатньою специфічною для того, щоб здолати вплив бактерій, що перешкоджають. Хоча живильне середовище є суттєвим для того, щоб дозволити зростання бактерій Legionella pneumophila, воно може оптимізувати їх зростання. Legionella pneumophila характеризується подвоєнням за 120 хв. (за оптимальних умов). Проте, ми знайшли, що у деяких випадках життєздатні бактерії Legionella pneumophila, здатні утворювати колонії, можуть необов'язково утворювати колонії негайно, а замість цього вони мають затримку чи лаг-фазу перед початком зростання. Така лаг-фаза може відбуватися від 8 до більш, ніж 20 годин у функції початкового фізіологічного стану. У переважній формі даного винаходу лаг-фаза для Legionelia pneumophila може бути зменшена, шляхом включення живильного середовища та антиоксидантного реагенту у клітинне живильне джерело. Антиоксидантний реагент може діяти безпосередньо на активні форми кисню (ROS) чи іншим чином, наприклад, шляхом впливу на метаболізм мікроорганізму, безпосередньо чи опосередковано, що викликає зменшення ROS. Придатні антиоксидантні реагенти включають каталазу, аскорбінову кислоту, мета бісульфіт натрію, диметилсульфоксид, TDPA (3,3'-тіодипропіонову кислоту) та піруват та інш. Переважно, антиоксидантним агентом є піруват. Переважні доза антиоксидантного реагенту, особливо для пірувату, становлять від 0,5 до 1,5 г/л, особливо приблизно 1 г/л. Клітинне живильне джерело може містити щонайменше одну сполуку, що опосередковано інгібує утворення та/або розкладає активні форми кисню (ROS), де вказана сполука може призводити до зниження рівнів ROS шляхом перешкоджання метаболізму мікроорганізму. Типово такі сполуки включатимуть амінокислоти чи їх солі. Особливо переважною сполукою є глютамінова кислота чи глютаматна сіль. В ще одній додатковій переважній формі даного винаходу клітинне живильне джерело включатиме глютамінову кислоту чи глютаматну сіль, особливо натрієву сіль. Загалом, кількість глютамінової кислоти чи глютамату становитиме від 0,01 до 5 % за масою у розрахунку на натрієву сіль. Особливо переважним є, щоб клітинне живильне джерело містило як піровиноградну кислоту чи піруват (особливо натрієву сіль) разом із глютаміновою кислотою чи глютаматом (особливо у вигляді натрієвої солі). Така комбінація піровиноградної кислоти чи пірувату з глютаміновою кислотою чи глютаматом, здається, викликає синергічний ефект, який полягає у тому, що він дозволяє більш достовірну оцінку (і тому більш точну оцінку) здатних до культивування Legionella, ніж будь-яка зі сполук, яку відповідно застосовують окремо. Додатково ми знайшли, що така комбінація викликає додаткове зменшення лаг-фази протягом розвитку Legionella pneumophila, зокрема у рідкому середовищі. Таке зменшення лаг-фази у рідкому середовищі призводить до зменшення часу, необхідного для одержання видимої колонії на агаровій пластинці. Бажана кількість пірувату та глютамату буде такою, як вказано вище. Особливо переважним є, щоб співвідношення глютамату до пірувату знаходилося у діапазоні від 1:1 до 50:1, особливо від 5:1 до 20:1 та більш особливо від 7:1 до 15:1. Глютамат невідомий як антиоксидант. Проте, здається, що опосередковано глютамат може зменшувати ендогенне продукування ROS, природно утворених протягом зростання чи їх впливи на макромолекули (окиснення). Не обмежуючись теорією, вважають, що глютамінова кислота змінює метаболізм Legionella для підвищення впливу пірувату, та що це перешкоджає метаболізму Legionella та опосередковано інгібує утворення та/або розкладає внутрішньоклітинні ROS. Спосіб за даним винаходом може дозволити застосування більш короткого періоду інкубування, що, бажано, не перевищує 24 години. Переважно, він може бути зменшений до 12 годин, особливо при низькому бактеріальному втручанні та/або високій концентрації бактерій Legionella pneumophila. Проба може бути зібрана з будь-якого придатного місця. Це може бути, наприклад, проба води зі зворотної води у системі охолодження. Проте, бажаним є, щоб проба могла бути одержана з води у вигляді аерозолю. Типово, аерозоль може бути розташований у стояку водяного охолодження чи кондиціонері повітря. Бажано, щоб вода була сконденсована з аерозолю перед аналізом відповідно до способу за даним винаходом. 3 UA 100731 C2 5 10 15 20 25 30 35 40 45 50 55 60 Такий режим інкубації може бути таким, як визначено у літературі, де описано процедуру DVC. Такий спосіб може включати фільтрування проби та потім інкубацію на фільтрі на прокладках, просочених середовищем. Переважно відповідно до даного винаходу, пробу, чи концентровану пробу, безпосередньо інкубують у середовищі та потім фільтрують. Таким чином ми можемо зменшити ризик втрати бактерій протягом процесу інкубації та забезпечити кращі умови протягом інкубації, наприклад, перенос кисню чи перемішування проби. Стадія 2 способу відповідно до даного винаходу може застосовувати стандартний протокол FISH. У першій частині процедури FISH клітини можуть бути зафіксовані шляхом обробки зовнішньої мембрани чи оболонки клітини, щоб надати ній проникність до олігонуклеотидного зонда. Загалом, це може бути досягнуто шляхом застосування фіксуючих розчинів, що являють собою водні розчини спиртів чи альдегідів, що змішуються з водою при 25 °C. Придатні спирти чи альдегіди включають формальдегід, параформальдегід, етанол та/або метанол. Типово, розчини формальдегіду чи параформальдегіду можуть складати аж до 10 % за масою та переважно від 1 до 5 %. Зазвичай спирти складатимуть щонайменше 50 % за масою та загалом, від 60 до 90 % за масою. Переважно, така обробка може бути досягнута шляхом послідовної обробки одним чи більше з цих розчинів. Переважно, обробка може включати обробку розчином від 1 до 5 % формальдегіду чи параформальдегіду з наступною обробкою двома чи трьома розчинами етанолу чи метанолу, міцність яких зростає від 50 % до 90 %. Потім процедура FISH застосовує процедуру гібридизації шляхом використання гібридизаційного буферу, що містить щонайменше один флуоресцентно мічений олігонуклеотидний зонд, який містить олігонуклеотид із приєднаним флуоресцентним маркером, в якому олігонуклеотид здатний націлюватися на специфічну послідовність всередині клітини. Олігонуклеотидні зонди проходять через зовнішню мембрану клітин та зв'язують послідовністьмішень, яка відповідає олігонуклеотиду. Має бути зрозумілим, що зв'язування означає утворення водневих зв'язків між комплементарними частинами нуклеїнових кислот. У методі FISH олігонуклеотидні зонди є комплементарними та здатними зв'язуватися до певної ділянки рибосомної послідовності-мішені всередині мікроорганізму. Типово, зонди мають довжину від 15 до 30 основ як частини одно ланцюгових дезоксирибонуклеотидних кислот, та направлені на специфічну ділянку-мішень, специфічну до мікроорганізму. Олігонуклеотидний зонд має бути, бажано, специфічним рибосомним ARN 16S зондом Legionella pneumophila. Можуть бути застосовані будь-які олігонуклеотидні зонди, що специфічно націлені на мікроорганізми виду Legionella pneumophila. Переважно зонд буде вибраний з групи, що складається з зонду PNE 1, який описано Grimm та інші 1998 з 5' 3' послідовністю основ АТС TGA CCG ТСС CAG GTT, зонду LEGPNE 1 (SEQ ID No 22), описаного Grimm та інші 1998 та Declerck та інші 2003, що має 5' 3' послідовність основ ATCTG ACCGT CCCAG GTT, та зонду LP2 (SEQ ID No 23), описаного Yamamoto та інші 1993, що має 5' 3' послідовність основ AGCTT ТСАТС CAAAG АТА. Також може бути бажаним альтернативне застосування зондів з послідовностями, що мають щонайменше 70 %, переважно щонайменше 80 % та більш переважно щонайменше 90 % ідентичність до будь-якого з трьох зондів: зонд PNE 1, зонд LEGPNE 1, чи зонд LP2. Для подолання ризику неправильно ідентифікованих мікроорганізмів. Що є природно флуоресцентними, переважна форма даного винаходу застосовує дві нуклеотидні зонди. Один зонд націлений на всі мікроорганізми роду Legionella, а другий зонд розроблено для гібридизації специфічних мікроорганізмів виду Legionella pneumophila. Кожна з проб мічена різними флуоресцентними барвниками. Мікроорганізми, що є природно флуоресцентними, будуть флуоресцентними тільки при конкретній довжині хвилі чи більш вузькій смузі довжин хвиль, та, таким чином, застосування двох зондів з різними барвниками, що флуоресціюють при різних довжинах хвиль, дозволяють знищення мікроорганізмів, що мають природну флуоресценцію, які не є специфічними Legionella pneumophila. У цій переважній формі даного винаходу перший зонд буде гібридизувати мікроорганізми, що належать до роду Legionella, що включає, але не обмежений Legionella longbeachae, Legionella jordanis, Legionella anisa, Legionella pneumophila. Такий перший зонд може містити нуклеотид, що може зв'язувати рибосомну послідовність-мішень від будь-яких бактерій у роді Legionella. Типово, перший зонд може бути будь-яким зондом, вибраним з групи, що складається з зонду LEG705 (SEQ ID No 7), описаного у Manz та інші (Manz та інші 1995) з 5' 3' послідовністю основ CTGGT GTTCC TTCCG АТС, зонду EG226 (SEQ ID No 8), описаного у Manz та інші (Manz та інші 1995), з 5' 3' послідовністю основ TCGGA CGCAG GCTAA ТСТ, зонду LegallH (SEQ ID No 9), описаного у Leskela та інші (Leskela та інші 2005), з 5' 3' послідовністю основ ССТСС ТСССС ACTGA AAGT, зонду Legall22 (SEQ ID No 10), описаного у Leskela та інші 4 UA 100731 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Leskela та інші 2005) з 5' 3' послідовністю основ CACTG TATGT CAAGG GTAGG, зонду Leg120v (SEQ ID No 11), описаного у Buchbinder та інші (Bushbinder та інші 2002) з 5' 3' послідовністю основ AAGGC АТАТТ ССТАС GCG. Також може бути бажаним альтернативне застосування зондів із послідовностями, що мають щонайменше 70 %, переважно щонайменше 80 % та більш переважно щонайменше 90 % ідентичність до будь-якого з трьох зондів: зонду LEG705, зонду LEG226, зонду LegallH, зонду Legall22, та зонду Leg120v. Другий зонд може гібридизувати лише специфічні види Legionella pneumophila та можу бути будь-яким зі вказаних вище нуклеотидних зондів з такою характеристикою, наприклад, будь-ким з трьох зондів: зонду PNE 1, зонду LEGPNE 1, чи зонду LP2. Може бути застосований будь-який з флуоресцентних барвників, відомих як сумісні із відповідними спектрами випромінювання/збудження FITC (наприклад, Syto9, Алекса 488 та інш.) чи Су3 (наприклад, родамін, Алекса 583 та інш.). Стадія 3 включає кількісне визначення релевантних бактерій за допомогою мікроскопу. Це може бути досягнуто вручну чи автоматично, наприклад, з застосуванням епіфлуоресцентного мікроскопу. Переважно, детекція та підрахунок бактерій, мічених за допомогою гібридизації in situ, та зафіксованих на фільтрі, потребують застосування мікроскопу, оснащеного флуоресцентною системою. Придатні системи детекції включають ChemScan RDI та ScanVIT-Legionella TM (Vernicon AG, Munich, Germany). Можливим є застосування chemscan (твердо фазної цитометрії, розробленої AESChemunex) для детекції та підрахунку мічених бактерій. Проте, така система може використовувати тільки 1 комплект дзеркал випромінювання/збудження (488 нм) та таким чином лімітує наш протокол застосуванням лише однієї міченої проби. ScanVIT-Legionella TM є особливо переважним відповідно до вказаного вище переважного аспекту даного винаходу, що застосовує щонайменше два зонди, оскільки такий метод дозволяє застосування двох різних флуоресцентних сигналів для знищення природних флуоресцентних мікроорганізмів, що не є Legionella pneumophila. Спосіб відповідно до даного винаходу сприяє точному та точному кількісному визначенню наявності Legionella pneumophila. Спосіб є придатним для детекції Legionella pneumophila у пробах, одержаних з будь-якої групи, вибраної з промислових вод охолодження, питних вод та природних вод. Даний винахід також включає комплект для більш швидкої детекції та підрахунку життєздатних мікроорганізмів виду Legionella pneumophila у пробі, що потенційно містить вказані мікроорганізми, який містить: (1) клітинне джерело живлення, (2) а інгібітором клітинної проліферації, (3) щонайменше одним флуоресцентно міченим олігонуклеотидним зондом здатним до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, (4) засоби детекції та кількісного визначення флуоресцентного сигналу, в яких інгібітор клітинної проліферації вибирають з групи, що складається з ципрофлоксацину та цефалексину. У переважній формі комплект може містити такі розчини: композицію середовища (як визначено вище), що може бути зневоднена для тривалого зберігання; а розчин для фіксації зовнішньої мембрани бактерій, наприклад, формальдегід; гібридизаційний розчин, наприклад, такий, як описано вище, що має бути одержаний негайно перед застосуванням; промивний розчин, наприклад, такий, як описано вище, що має бути одержаний негайно перед застосуванням; нуклеїновокислотний флуоресцентний барвник, наприклад, DAPI, що може бути зневоднений для тривалого зберігання; та підтримуючий агент проти втрати кольору. Переважно, комплект може містити фільтри. Більш переважно, комплект може додатково містити фізіологічний буфер; розчини етанолу різної міцності, що варіюється від 50 до 90 %; та стерильну воду. Комплект може також містити оппендорф, наприклад, на 2 мл. Комплект може також містити будь-які зі втілень, описаних по відношенню до першого аспекту даного винаходу. Комплект є придатним для застосування у способі за даним винаходом та дозволяє швидкий та надійний підрахунок Legionella pneumophila. Даний винахід проілюстровано наступними прикладами. Приклад 1 6 Суспензію Legionella pneumophila кінцевої концентрації 10 бактерій/мл розподіляли на 2 суспензії однакового об'єму. Тільки першу суспензію (S1) фіксували у 3,7 % (об.) формальдегіді при температурі оточуючого середовища (20-22 °C) протягом 30 хв. Обидві суспензії потім тричі 5 UA 100731 C2 промивали при центрифугуванні (6,000 г, 5 хв. при 20 °C), у PBS (фосфатно-сольовому буферному розчині) pH 77,4. Обидві суспензії остаточно змішували відповідно до таблиці 1. Таблиця 1 % життєздатних клітин 100 50 10 1 0 S1 [мл] 0 1 1,8 1,98 2 S2 [мл] 2 1 0,2 0,02 0 5 10 15 20 25 30 35 Кожну з суміші обробляли відповідно до протоколу експерименту, який наведено нижче. Результати Результати представлено на Фігурі 1. На Фігурі 1 показано кореляцію між стандартним способом AFNOR (8 днів) та способом за даним винаходом, що потребує менш ніж 24 години. Ці результати вказують на добру кореляцію між двома способами у термінах точності ідентифікації Legionella pneumophila. Експериментальний протокол Проби (V1) фільтрували через білу полікарбонатну мембрану діаметром 25 мм, з розміром пор 0,2 мкм (Millipore, GTTP02500). Фільтри двічі промивали 10 мл розчину А та розміщували у стерильній пробірці (оппендорф 2 мл), що містила 1 мл розчину А. Пробірки струшували протягом 1 хвилини при 30 Гц (4 °C). Після видалення фільтрів, кожну суспензію розподіляли таким чином: 1. 500 мкл суспензії розміщували асептичним чином у стерильній пробірці, що містила 500 мкл розчину В. Пробірки інкубували протягом 24 годин при 37 °C чи 45 °C з перемішуванням. Після інкубації, суспензію фільтрували через білу полікарбонатну мембрану діаметром 25 мм, з розміром пор 0,2 мкм (МiIIiроrе, GTTP02500) та фіксували за допомогою розчину С при температурі оточуючого середовища (20-22 °C) протягом 30 хвилин. Фільтри промивали двічі фосфатним буферним сольовим розчином (pH 7,4) та висушували на повітрі. 2. 500 мкл суспензій безпосередньо фільтрували через білу полікарбонатну мембрану діаметром 25 мм, з розміром пор 0,2 мкм (Millipore, GTTP02500) та фіксували за допомогою розчину С при температурі оточуючого середовища (20-22 °C) протягом 30 хвилин. Фільтри промивали двічі фосфатним буферним сольовим розчином (pH 7,4) та висушували на повітрі. Фільтри зневоднювали послідовним промиванням у розчині D, розчині Е та розчині F (по 2 мл кожного) та потім висушували шляхом інкубування протягом 30 хвилин при 37 °C. Фільтри розміщували на предметному склі, та 50 мкл розчину G наносили на фільтр. Покривне скло розміщували на фільтрі для уникнення зневоднення. Гібридизацію проводили протягом 2 голин при 46±1 °C у вологій камері. Потім фільтри тричі промивали 5 мл розчину Н, що був попередньо нагрітий при 46 °C, а потім двічі промивали стерильною водою. Фільтри інкубували протягом 5 хвилин 1 мл розчину І та двічі промивали стерильною водою. Після висушування на повітрі, фільтри остаточно монтували на покривному склі з 20 мкл розчину J. Гібридизовані клітини візуалізували за допомогою епіфлуоресцентної мікроскопії з імерсійними лінзами об'єктиву 100 та 2 фільтрами випромінювання/збудження: фільтр збудження 510-550 нм та бар'єрний фільтр 590 нм. Розчини 40 6 UA 100731 C2 Таблиця 2 Розчин А В С D Е F G Н I J Компоненти Загальний опис Фосфатний буферний сольовий розчин pH Фізіологічний буфер 7,4 (PBS) Середовище Див. Таблицю 3 Формальдегід [3.7 %] (Sigma, F-1635) Етанол 50 % Етанол 80 % Етанол 90 % Гібридизаційний розчин Див. Таблицю 4 Промивний розчин Див. Таблицю 5 Нуклеїновокислотний флуоресцентний DAPI [0,5мкг/мл] (Sigma, D-95421) барвник Підтримуючий реагент проти втрати Citifluor (Ted Pella, INC., 19476-A) кольору Середовище 2Х Таблиця 3 Середовище Селективна добавка Антибіотик, що блокує ділення клітин Ростова добавка Сполуки Екстракт дріжджів Пірофосфат заліза L-цистеїн (хлорогідрат) -кетоглютарат Буфер ACES/Гідроксид калію Гліцин Ванкоміцин Поліміксин Циклогексимід Піруват CAS 8 мг/л Ципрофлоксацин Концентрація 20г/л 0,5 г/л 0,8 г/л 2 г/л 2 г/л 6 мг/л 2 мкг/л 160 М.О./л 160 мкг/л 85721-33-1 2 г/л 5 Усі реагенти стерилізували шляхом фільтрування через нітроцелюлозну мембрану з розміром пор 0,2 мкм (Millipore, SLGS025 0S). Компоненти кожного комплекту реагентів наведено нижче. Гібридизаційний розчин 10 Таблиця 4 Концентрація 20 % 0,9 M 0,1 % 20 mM формамід (Sigma, F-9037) NaCI (Sigma, S-9625) SDS (Sigma, L-4522) Tris-HCI pH 7,2 (Sigma, T-2538) 15 Усі реагенти стерилізували шляхом фільтрування через нітроцелюлозну мембрану з розміром пор 0,2 мкм (Millipore, SLGS025 0S). Зондами, які застосовували для детекції FISH були: LEG705 (Eurogentec: 5'CTGGTGTTCCTTCCGATC-3'), специфічний до Legionellaceae та мічений FITC (ізотіоціанат флуоресцеїну) та PNE1 (Eurogentec: 5'-CTGGTGTTCCTTCCGATC-3'), специфічний до роду Legionella pneumophila та мічений Су3. Зонди додавали до гібридазіційного розчину при остаточній концентрації 1 нг/мкл. Промивний розчин 20 7 UA 100731 C2 Таблиця 5 Сполуки NaCI (Sigma, S-9625) SDS (Sigma, L-4522) Tris-HCI pH 7,2 (Sigma T-2538), 5 10 15 20 25 30 35 Концентрація 215 мМ 0,1 % 20 мМ Усі реагенти стерилізували шляхом фільтрування через нітроцелюлозну мембрану з розміром пор 0,2 мкм (Millipore, SLGS025 0S). Приклад 2 Експериментальний протокол Прикладу 1 застосовували до проби, де використовували перший зонд Іед705, мічений зеленим флуоресцентним барвником, та другий зонд PNE1, мічений червоним флуоресцентним барвником. На Фігурі 2 показано чотири випадки, що дозволяють розрізнення Legionella pneumophila від природних флуоресцентних бактерій. Звертаючись до Фігури 2: Випадок 1 - ані зелена, ані червона флуоресцентна бактерія - бактерія не належить до роду Legionella та виду Legionella pneumophila; Випадок 2 - Лише зелена флуоресцентна бактерія - бактерія належить до роду Legionella АБО є природно флуоресцентною; Випадок 3 - Лише червона бактерія - Незважаючи на червону флуоресценцію, бактерія не належить до виду Legionella pneumophila, оскільки не має зеленої флуоресценції та тому не належить до роду Legionella. Ця бактерія є природно флуоресцентною; та Випадок 4-зелена та червона флуоресцентна бактерія - бактерія належить до роду Legionella ТА виду Legionella pneumophila. Із застосуванням цих способів ми можемо точно детектувати Legionella pneumophila шляхом обмеження детекції природно флуоресцентних бактерій, що може в іншому випадку неправильно детектувати такі бактерії. Зонд PNE1 вперше було описано у Grimm та інші (Grimm та інші, 1998). Специфічна послідовність: 5'-АТС TGA CCG ТСС CAG GTT-3' Зонд Leg705 вперше було описано у Manz та інші (Manz та інші, 1995). Специфічна послідовність: 5'-CTGGTGTTCCTTCCGATC-3' У даному аналізі використовували наступним чином три барвника: Перший барвник використовували для забарвлення нуклеїнової кислоти усіх мікроорганізмів. DAPI використовували для забарвлення бактерій блакитним кольором під дією УФ-збудження. Цей барвник не сполучали із олігонуклеотидним зондом. Другі два барвники сполучали із олігонуклеотидним зондом, щоб дозволити специфічну детекцію. Ці два барвники мають бути охарактеризовані двома різними спектрами збудження/випромінювання. В аналізі застосовували FITC та Су3, що є найбільш розповсюдженими барвниками для детекції FISH, проте доступною є велика кількість барвників з відповідними аналогічними спектрами. Таблиця 6 Застосовані барвники DAPI збудження [нм] випромінювання [нм] 350 461 FITC 494 521 Су3 550 570 8 Доступні барвники Алекса 488, Пліт 488, Ділайт 488, Родамін, Алекса 555, Пліт 555, … UA 100731 C2 9 UA 100731 C2 10 UA 100731 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 1. Спосіб детектування та підрахунку життєздатних мікроорганізмів у пробі, що потенційно містить вказані мікроорганізми, який включає (1) контактування вказаної проби з клітинним живильним джерелом та інгібітором клітинної проліферації, у якій клітинне живильне джерело містить ростову добавку, що містить антиоксидант, (2) контактування вказаної проби зі щонайменше одним флуоресцентно міченим олігонуклеотидним зондом, здатним до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, причому вказану пробу приводять у контакт зі щонайменше першим зондом та другим зондом, де перший зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, а другий зонд здатний до специфічної гібридизації зі щонайменше одною іншою частиною рибосомних нуклеїнових кислот мікроорганізмів, (3) детектування та кількісне визначення флуоресцентного сигналу, де мікроорганізми належать до виду Legionella pneumophila та де інгібітор клітинної проліферації вибирають з групи, що складається з ципрофлоксацину та цефалексину. 2. Спосіб за п. 1, де як антиоксидант ростова добавка містить піровиноградну кислоту або її сіль. 3. Спосіб за п. 1 або 2, де клітинне живильне джерело стадії 1) містить глютамінову кислоту або її сіль. 4. Спосіб за будь-яким з попередніх пунктів, де клітинне живильне джерело стадії 1) містить глютамінову кислоту (або її сіль) та піровиноградну кислоту (або її сіль). 5. Спосіб за будь-яким з попередніх пунктів де олігонуклеотидний зонд вибирають з групи, що складається з зонда, що має 5' 3' послідовність основ АТС TGA CCG ТСС CAG GTT, зонда, що має 5' 3' послідовність основ ATCTG ACCGT CCCAG GTT, та зонда, що має 5' 3' послідовність основ AGCTT ТСАТС CAAAG АТА. 6. Спосіб за будь-яким з попередніх пунктів, в якому на стадії (2) вказану пробу приводять у контакт зі щонайменше першим зондом та другим зондом, де перший зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот, всі з яких належать до роду Legionella, та де другий зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот, всі з яких належать до виду Legionella pneumophila. 11 UA 100731 C2 5 10 15 20 7. Спосіб за п. 6, в якому перший зонд вибирають з групи, що складається з зонда, що має 5' 3' послідовність основ CTGGT GTTCC TTCCG АТС, зонда 5' 3', що має послідовність основ TCGGA CGCAG GCTAA ТСТ, зонда, що має 5' 3' послідовність основ ССТСС ТСССС ACTGA AAGT, зонда, що має 5' 3' послідовність основ CACTG TATGT CAAGG GTAGG, та зонда, що має 5' 3' послідовність основ AAGGC АТАТТ ССТАС GCG. 8. Спосіб за будь-яким з попередніх пунктів, в якому стадію (3) проводять автоматизовано за допомогою епіфлуоресцентного мікроскопа. 9. Спосіб за будь-яким з попередніх пунктів, в якому пробу одержують з будь-якої групи, вибраної з промислових охолоджуючих вод, питних вод та природних вод. 10. Набір для детектування та підрахунку життєздатних мікроорганізмів виду Legionella pneumophila у пробі, що потенційно містить вказані мікроорганізми, який містить (1) клітинне живильне джерело, що містить ростову добавку, що містить антиоксидант, (2) інгібітор клітинної проліферації, (3) флуоресцентно мічені олігонуклеотидні зонди, що містять перший зонд та другий зонд, де перший зонд здатний до специфічної гібридизації зі щонайменше однією частиною рибосомних нуклеїнових кислот вказаних мікроорганізмів, а другий зонд здатний до специфічної гібридизації зі щонайменше одною іншою частиною рибосомних нуклеїнових кислот мікроорганізмів, (4) засоби для детектування та кількісного визначення флуоресцентного сигналу, де інгібітор клітинної проліферації вибирають з групи, що складається з ципрофлоксацину та цефалексину. 11. Набір за п. 10, де як антиоксидант ростова добавка містить піровиноградну кислоту або її сіль. 12 UA 100731 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюDetection and calculation of microorganisms
Автори англійськоюFovet, Yannick, Dukan, Sam, Ducret, Adrien
Назва патенту російськоюДетекция и подсчет микроорганизмов
Автори російськоюФове Янник, Дюкон Сем, Дюкре Адриэн
МПК / Мітки
МПК: C12Q 1/68
Мітки: детекція, мікроорганізмів, підрахунок
Код посилання
<a href="https://ua.patents.su/15-100731-detekciya-ta-pidrakhunok-mikroorganizmiv.html" target="_blank" rel="follow" title="База патентів України">Детекція та підрахунок мікроорганізмів</a>
Попередній патент: Спосіб і пристрій для одержання мінерального розплаву
Наступний патент: Гідрування імінів
Випадковий патент: Приймальний вузол стріляючого пристрою ігрового автомата "російська рулетка"