Склад сухого порошку, який містить антимускариновий засіб
Формула / Реферат
1. Склад інгальованого сухого порошку, який містить як активний інгредієнт мікронізовані частинки сполуки загальної формули (І)
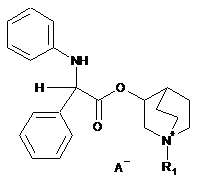 , (I)
, (I)
де:
R1 являє собою групу формули (Y)
![]() , (Y)
, (Y)
де
р являє собою 0 або ціле число від 1 до 4;
Р відсутній або вибраний з групи, яка складається з О, S, SO, SO2 і CO;
W вибраний з групи, яка складається з Н, арилу і гетероарилу, де арил і гетероарил необов'язково заміщені одним або декількома замісниками, вибраними з групи, яка складається з атомів галогену, ОН, SH, NO2, CN, СООН і NH2;
Аˉ являє собою фізіологічно прийнятний аніон;
фракцію мікрочастинок, складену з суміші, яка складається з частинок моногідрату α-лактози і частинок стеарату магнію, вказані частинки мають медіанно-масовий діаметр (MMD), що дорівнює або менший 15 мікронів; і
фракцію великих частинок моногідрату α-лактози, що має шорстку поверхню і масовий діаметр від 150 до 400 мікронів.
2. Інгальований порошок за п. 1, де фізіологічно прийнятний аніон Аˉ вибраний з групи, яка складається з хлориду, броміду, йодиду, трифторацетату, форміату, сульфату, фосфату, метансульфонату, нітрату, малеату, ацетату, цитрату, фумарату, тартрату, оксалату, сукцинату, бензоату і п-толуолсульфонату.
3. Інгальований порошок за п. 1 або 2, де активний інгредієнт вводять в разовій дозі від 5 мкг до 2500 мкг.
4. Інгальований порошок за п. 3, де разова доза складає від 10 мкг до 2000 мкг.
5. Інгальований порошок за п. 4, де разова доза складає від 15 мкг до 1000 мкг.
6. Інгальований порошок за п. 5, де разова доза складає від 20 мкг до 800 мкг.
7. Інгальований порошок за п. 6, де разова доза складає від 25 мкг до 600 мкг.
8. Інгальований порошок за будь-яким з пп. 1-7, де носієм є кристалічний цукор, вибраний з групи, яка складається з глюкози, арабінози, мальтози, сахарози, декстрози і лактози, або поліспирт, вибраний з групи, яка складається з маніту, мальтиту, лактиту і сорбіту.
9. Інгальований порошок за п. 8, де масовий діаметр складає від 212 до 355 мікронів.
10. Інгальований порошок за будь-яким з пп. 1-9, який додатково містить один або декілька додаткових матеріалів, вибраних з групи, яка складається з амінокислот, розчинних у воді поверхнево-активних речовин, мастильних речовин і речовин, які сприяють ковзанню.
11. Інгальований порошок за п. 10, де додатковим матеріалом є мастильна речовина.
12. Інгальований порошок за будь-яким з пп. 1-11, де стеарат магнію присутній в кількості, яка складає від 0,01 до 2 % по масі з розрахунку на загальну масу складу.
13. Інгальований порошок за п. 12, де кількість стеарату магнію складає від 0,02 до 1 % мас./мас.
14. Інгалятор сухого порошку, який містить склад інгальованого сухого порошку за будь-яким з пп. 1-13.
15. Склад інгальованого сухого порошку за будь-яким з пп. 1-13 для застосування для профілактики і/або лікування астми і хронічного обструктивного захворювання легенів (COPD).
16. Упаковка, що містить склад інгальованого сухого порошку за будь-яким з пп. 1-13 і інгалятор сухого порошку.
Текст
Реферат: Винахід належить до фармацевтики та медицини і стосується складу сухого порошку, придатного для інгаляційного введення за допомогою інгалятора сухого порошку, який містить антимускариновий засіб як активний інгредієнт, фракцію мікрочастинок, складену з суміші частинок моногідрату α-лактози і частинок стеарату магнію, які мають медіанно-масовий діаметр (MMD), що дорівнює або менший 15 мікронів, і фракцію великих частинок моногідрату α-лактози, що має шорстку поверхню і масовий діаметр від 150 до 400 мікронів. Також винахід стосується застосування вказаного складу для попередження і/або лікування астми та хронічного обструктивного захворювання легень (COPD), інгалятору та упаковки, що його містять. UA 107499 C2 (12) UA 107499 C2 UA 107499 C2 5 10 15 20 25 30 35 40 45 50 ГАЛУЗЬ ВИНАХОДУ Винахід стосується складу сухого порошку, придатного для інгаляційного введення за допомогою інгалятора сухого порошку, що містить як активний інгредієнт антимускариновий засіб. Також винахід стосується способу отримання складу і застосування його для попередження і/або лікування широкого діапазону станів, включаючи респіраторні розлади. РІВЕНЬ ТЕХНІКИ, ДО ЯКОГО НАЛЕЖИТЬ ВИНАХІД Обструкція дихальних шляхів характеризує ряд тяжких респіраторних захворювань, включаючи астму і хронічне обструктивне захворювання легенів (COPD). Події, що ведуть до обструкції дихальних шляхів, включають набряк стінок дихальних шляхів, збільшення продукції слизу і запалення. Лікарські засоби для лікування респіраторних захворювань, таких як астма і COPD, в цей час вводять шляхом інгаляції. Однією з переваг інгаляційного шляху над системним є можливість доставки лікарського засобу безпосередньо в осередок дії, уникаючи яких-небудь системних побічних ефектів, таким чином, забезпечуючи більш швидку клінічну відповідь і більш високе терапевтичне відношення. Важливим класом лікарських засобів, що використовується як бронходилятатори, є інгібітори-антагоністи мускаринових рецепторів, що належать до класу четвертинних солей амонію, і, зокрема, селективні антагоністи рецептора M3 (далі антагоністи M3). Наприклад, антагоністи M3 описані в WO 02/051841, WO 03/053966 і WO2008/012290. Додаткові антагоністи рецепторів M3, що мають високу ефективність і більш тривалу дію, які після всмоктування деградують до неактивних сполук, позбавлених яких-небудь системних побічних ефектів, типових для мускаринових антагоністів, є об'єктом заявки № PCT/EP2009/008870, що спільно розглядається, включеної в даний опис як посилання. Зокрема, виявилося, що ці останні сполуки є особливо селективними і мають високу ефективність. Таким чином, вказані сполуки можуть забезпечити значну терапевтичну користь при лікуванні респіраторних захворювань, таких як астма і COPD, при введенні шляхом інгаляції. Вказані лікарські засоби можна вводити в дихальні шляхи за допомогою інгаляції в формі сухого порошку за допомогою придатних інгаляторів, відомих як інгалятори сухих порошків (DPI). Метою даного винаходу є надання композиції інгальованого сухого порошку, яка містить описані вище сполуки як активні інгредієнти. В оптимальному випадку вказаний склад має хорошу текучість, хорошу одноманітність розподілу активного інгредієнта і належну хімічну і фізичну стабільність в пристрої перед застосуванням. Також він забезпечує хорошу вдихувану фракцію, а також доставку точної терапевтично активної дози активного інгредієнта. СУТЬ ВИНАХОДУ Винахід стосується складу сухого порошку, придатного для інгаляційного введення за допомогою інгалятора сухого порошку, що містить складне аміноефірне похідне формули (I), яке діє як антагоніст мускаринових рецепторів. Також винахід стосується способу отримання складу, його застосування для попередження і/або лікування широкого діапазону станів, включаючи респіраторні розлади, такі як хронічне обструктивне захворювання легенів (COPD) і астма, упаковок, що містять склад інгальованого сухого порошку, і інгалятора сухого порошку. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Композиції за винаходом являють собою фармацевтичні склади в формі інгальованого сухого порошку, які містять як активний інгредієнт мікронізовані частинки сполуки загальної формули (I) 1 UA 107499 C2 , де: R1 являє собою групу формули (Y) 5 10 15 20 25 30 35 40 45 ---(CH2)p---P---W , (Y) де р являє собою 0 або ціле число від 1 до 4; Р відсутній або вибраний з групи, яка складається з O, S, SO, SO 2 і CO; W вибраний з групи, яка складається з Н, арилу і гетероарилу, де арил і гетероарил необов'язково заміщені одним або декількома замісниками, вибраними з групи, яка складається з атомів галогену, OH, SH, NO2, CN, COOH і NH2; А являє собою фізіологічно прийнятний аніон; і частинки фізіологічно прийнятного фармакологічно інертного твердого носія. У даному описі, якщо немає інших вказівок, термін "галоген" включає атоми фтору, хлору, брому і йоду. Вираз "арил" стосується моно-, бі- або трициклічних кільцевих систем, які мають від 6 до 20 атомів кільця, переважно від 6 до 15, і де щонайменше одне кільце є ароматичним. Вираз "гетероарил" стосується моно- або біциклічних кільцевих систем з 5-20 атомами вуглецю, переважно 5-15, в яких щонайменше одне кільце є ароматичним, і в яких щонайменше один атом кільця являє собою гетероатом або гетероароматичну групу (наприклад N, NH, S або О). Приклади придатних арильних або гетероарильних моноциклічних систем включають, наприклад, радикали тіофену, бензолу, піролу, піразолу, імідазолу, ізоксазолу, оксазолу, ізотіазолу, тіазолу, піридину, імідазолідину, фурану і т. п. Приклади придатних арильних або гетероарильних біциклічних систем включають радикали нафталіну, біфенілену, пурину, птеридину, бензотриазолу, хіноліну, ізохіноліну, індолу, ізоіндолу і т. п. Переважно, фізіологічно прийнятний аніон А вибраний з групи, яка складається з хлориду, броміду, йодиду, трифторацетату, форміату, сульфату, фосфату, метансульфонату, нітрату, малеату, ацетату, цитрату, фумарату, тартрату, оксалату, сукцинату, бензоату і птолуолсульфонату. У першому переважному варіанті здійснення р дорівнює 1, Р відсутній і W являє собою Н. У другому переважному варіанті здійснення, р дорівнює 1, Р являє собою CO і W являє собою феніл або тіофеніл. У третьому переважному варіанті здійснення р дорівнює 2, Р являє собою О і W являє собою феніл. У четвертому переважному варіанті здійснення р дорівнює 3, Р являє собою О і W являє собою феніл. Терміни "активний лікарський засіб", "активний інгредієнт", "активний агент" і "активна речовина", "активна сполука" і "лікарський засіб" використовують як синоніми. Терміни "антагоністи мускаринових рецепторів", "антимускаринові засоби" і "антихолінергічні лікарські засоби" використовують як синоніми. Термін "по суті чистий" означає сполуку, що має оптичну чистоту більшу 90 % з розрахунку на масу вказаної сполуки, переважно більшу 95 % мас./мас., переважно більшу 98 % мас./мас., більш переважно більшу 99 % мас./мас. Під "разовою терапевтично ефективною дозою" мають на увазі кількість активного інгредієнта, що вводиться за один раз шляхом інгаляції при спрацюванні інгалятора. Вказана доза може бути доставлена за одне або декілька спрацювань, переважно за одне спрацювання (пуск) інгалятора. 2 UA 107499 C2 5 10 15 20 25 30 35 40 45 50 55 "Спрацювання" стосується вивільнення активного інгредієнта з пристрою при однократній активації (наприклад, механічній або шляхом вдиху). Один аспект винаходу забезпечує фармацевтичний склад в формі інгальованого сухого порошку, що містить одну або декілька сполук формули (I) як активні інгредієнти, і частинки фізіологічно прийнятного фармакологічно інертного твердого носія. Винахід стосується інгалятора сухого порошку, що містить інгальований сухий порошок за винаходом. Також винахід стосується застосування складу інгальованого сухого порошку за винаходом як лікарського засобу. Наступний аспект винаходу стосується застосування інгальованого сухого порошку за винаходом для попередження і/або лікування запального або обструктивного захворювання легенів, такого як астма або хронічне обструктивне захворювання легенів (COPD). Наступний аспект даного винаходу стосується способу попередження і/або лікування запального або обструктивного захворювання дихальних шляхів, такого як астма або хронічне обструктивне захворювання легенів (COPD), який включає введення шляхом інгаляції ефективної кількості інгальованого сухого порошку за винаходом. Нарешті, даний винахід стосується упаковки, що містить склад інгальованого сухого порошку за винаходом і інгалятор сухого порошку. Звичайно розмір частинок кількісно визначають шляхом вимірювання характеристичного діаметра еквівалентних сфер, відомого як об'ємний діаметр, за допомогою лазерної дифракції. Розмір частинок також можна кількісно визначати шляхом вимірювання масового діаметра за допомогою придатних відомих пристроїв, наприклад, таких як ситовий аналізатор. Об'ємний діаметр (VD) пов'язаний з масовим діаметром (MD) густиною частинок (передбачаючи незалежну від розміру густину частинок). У представленому нижче описі розмір частинок виражений як масовий діаметр (MD) і розподіл розміру частинок виражено як: i) медіанно-масовий діаметр (MMD), який відповідає діаметру 50 процентів по масі або об'єму, відповідно, частинок, і ii) MD в мікронах 10 % і 90 % частинок, відповідно. Терміни MMD і середній розмір частинок використовують як синоніми. Термін "хороша текучість" стосується складу, яким легко маніпулювати в процесі виготовлення і який здатний забезпечити точну і відтворювану доставку терапевтично ефективної дози. Характеристики текучості можна оцінювати вимірюванням індексу Карра; індекс Карра менший 25 звичайно вважають таким, що вказує на хороші характеристики текучості. Вираз "хороша гомогенність" стосується складу, де при змішуванні одноманітність активного інгредієнта, виражена як відносне стандартне відхилення (RSD), складає менше 5 %. Вираз "хімічно стабільний" стосується складу, який задовольняє вимогам ICH Guideline Q1A, що належать до "Stability Testing of new Active Substances (and Medicinal Products)". Вираз "фізично стабільний в пристрої перед застосуванням" стосується складу, де активні частинки по суті не сегрегують і/або відділяються від поверхні частинок носія в процесі виготовлення сухого порошку і в пристрої для доставки перед застосуванням. Тенденцію до сегрегації можна оцінювати відповідно до Staniforth et al. J. Pharm. Pharmacol. 34,700-706, 1982, і її можна вважати прийнятною, якщо розподіл активного інгредієнта в порошковому складі після дослідження, виражений як відносне стандартне відхилення (RSD), не змінюється значно відносно складу до дослідження. Вираз "вдихувана фракція" стосується індексу, що складається в проценті активних частинок, які проникають глибоко в легені пацієнта. Вдихувану фракцію, яка також називається фракцією тонких частинок, оцінюють з використанням придатного пристрою in vitro, такого як Multistage Cascade Impactor або Multi Stage Liquid Impinger (MLSI), відповідно до методик, описаних в звичайних фармакопеях. Її обчислюють по співвідношенню між дозою, що доставляється, і масою тонких частинок (раніше доза тонких частинок). Дозу, що доставляється, обчислюють з сукупного накопичення в пристрої, в той час як масу тонких частинок обчислюють з накопичення від рівня 3 (S3) до фільтра (AF), що відповідає частинкам ≤ 4,7 мікронів. Вдихувана фракція більше 30 % є показником хороших інгаляційних характеристик. Вираз "точна терапевтично активна доза активного інгредієнта" стосується складу, де відхилення між середньою добовою дозою, що доставляється, і середньою дозою, що випускається, дорівнює або складає менше 15 %, переважно менше 10 %. 3 UA 107499 C2 Відповідно до конкретних варіантів здійснення винаходу конкретні приклади сполук формули (I), представлені в таблиці 1. Таблиця 1 Сполука C1 Хімічна назва і структура (R)-1-(2-феноксіетил)-3-((R)-2-феніл-2-феніламіноацетокси)-1азонійбіцикло[2.2.2]октан трифторацетат C2 (R)-1-(2-оксо-2-(тіофен-2-іл)етил)-3-(2-феніл-2-(феніламіно)ацетокси)-1азонійбіцикло[2.2.2]октан трифторацетат C3 (R)-1-(3-феноксипропіл)-3-(2-феніл-2-(феніламіно)ацетокси)-1азонійбіцикло[2.2.2]октан трифторацетат C4 (R)-1-метил-3-(2-феніл-2-(феніламіно)ацетокси)-1-азонійбіцикло[2.2.2]октан трифторацетат 5 4 UA 107499 C2 C5 (R)-1-(2-оксо-2-фенілетил)-3-(2-феніл-2-(феніламіно)ацетокси)-1азонійбіцикло[2.2.2]октан хлорид Сполуки загальної формули (I) мають щонайменше два хіральні центри, які відображені атомами вуглецю, позначеними зірочками. 5 10 15 20 25 30 35 Таким чином, формула (I) також охоплює будь-які оптичні стереоізомери, діастереоізомери і їх суміші, в будь-якому співвідношенні. Склад за винаходом виявляє хорошу текучість, хорошу одноманітність розподілу активного інгредієнта і належну хімічну і фізичну стабільність в пристрої перед застосуванням. Також він забезпечує хорошу вдихувану фракцію і здатний доставляти точну терапевтично активну дозу активного інгредієнта. Склад за винаходом містить активний інгредієнт в такій кількості, щоб при введенні шляхом інгаляції з інгаляторів терапевтично ефективна разова доза (далі разова доза) переважно містила від 5 мкг до 2500 мкг, більш переважно від 10 мкг до 2000 мкг, переважно від 15 до 1000 мкг, більш переважно від 20 до 800 мкг, ще більш переважно від 25 до 600 мкг. Разова доза залежить від типу і тяжкості захворювання і стану (маса, стать, вік) пацієнта і її необхідно вводити один або декілька разів на добу, переважно, один раз або два рази на добу. Не обмежуючи об'єм винаходу цим, фармацевтичний склад може містити будь-яку зі сполук C1-C5 в формі вказаних вище солей, так щоб разова доза, що вводиться, містила від 10 до 600 мкг, переважно від 20 до 500 мкг. У конкретному варіанті здійснення разова доза може складати від 20 до 50 мкг, а в інших варіантах здійснення вона може складати від 40 мг до 100 мкг або від 50 до 150 мкг або від 100 до 300 мкг, або від 300 до 500 мкг. У ще більш конкретних варіантах здійснення разова доза може становити 20, або 25, або 50, або 100, або 200, або 500 мкг. Якщо використовувати іншу сіль, разова доза буде варіювати на основі відмінної молекулярної маси протиіона. Добова доза фармацевтичної композиції за винаходом складає від 20 мкг до 3000 мкг, переважно від 40 мкг до 1000 мкг і більш переважно від 50 мкг до 500 мкг. У одному варіанті здійснення добова доза може бути досягнута шляхом однократного або двократного введення. У іншому переважному варіанті здійснення добова доза може бути досягнута шляхом однократного введення і може бути доставлена за одне спрацювання інгалятора. У іншому переважному варіанті здійснення добова доза може бути досягнута шляхом однократного введення і може бути доставлена за більшу кількість спрацьовувань інгалятора, переважно за два. У іншому переважному варіанті здійснення добова доза може бути досягнута шляхом двократного введення і може бути доставлена за одне спрацювання інгалятора. 5 UA 107499 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому переважному варіанті здійснення добова доза може бути досягнута шляхом двократного введення і може бути доставлена за більшу кількість спрацьовувань інгалятора, переважно два. Частинки сполуки формули (I) в складі за винаходом повинні знаходитися в тонкоподрібненій (мікронізованій формі), тобто їх медіанно-масовий діаметр, як правило, повинен дорівнювати або бути меншим ніж 10 мкм, переважно меншим ніж 6 мкм, більш переважно він складає від 1 до 6 мкм. У певних варіантах здійснення винаходу розмір частинок може задовольняти наступним вимогам: i) не більше 10 % частинок мають масовий діаметр менше 0,8 мкм; ii) не більше 50 % частинок мають масовий діаметр менше 1,7 мікрон, переважно від 1,8 до 2,5 мікрон; і iii) щонайменше 90 % частинок мають масовий діаметр менше 6 мікрон. Активний інгредієнт можна отримувати з бажаним розміром частинок з використанням відомих способів, наприклад, подрібнення, прямого осадження, розпилювального сушіння, ліофілізації або надкритичних рідин. Частинки носія можуть бути виготовлені з будь-якого фізіологічно прийнятного фармакологічно інертного матеріалу або комбінації матеріалів, придатних для інгаляційного використання. Наприклад, частинки носія можуть складатися з одного або декількох матеріалів, вибраних з спиртів цукрів; поліолів, наприклад, сорбіту, маніту і ксиліту, і кристалічних цукрів, включаючи моносахариди і дисахариди; неорганічних солей, таких як натрію і карбонат кальцію; органічних солей, таких як лактат натрію; і інших органічних сполук, таких як сечовина, полісахариди, наприклад, крохмаль і його похідні; олігосахариди, наприклад, циклодекстрини і декстрини. Переважно, частинки носія виготовляють з кристалічного цукру, наприклад, моносахариду, такого як глюкоза або арабіноза, або дисахариду, такого як мальтоза, сахароза, декстроза або лактоза. Переважно, частинки носія виготовляють з лактози, більш переважно з моногідрату αлактози. У одному варіанті здійснення винаходу порошковий склад може бути в формі агломерованих сферонізованих частинок, також відомих як м'які гранули, де як частинки сполуки загальної формули (I), так і частинки носія, надані в тонкоподрібненій формі, тобто їх медіанно-масовий діаметр, як правило, складає менше 10 мікрон, переважно від 1 до 6 мікрон. Склади вказаного типу можна отримувати відомими способами. Як правило, спосіб включає стадії: i) спільної мікронізації активного інгредієнта і носія; ii) агломерації і сферонізації отриманої співмікронізованої суміші. Альтернативно спосіб включає наступні стадії: i) мікронізація активного інгредієнта і носія окремо; ii) змішування мікронізованих компонентів; і iii) агломерація і сферонізація отриманої суміші. У іншому варіанті здійснення винаходу склад містить великі частинки носія разом з лікарським засобом в тонкоподрібненій формі, в типі складу, відомому як впорядкована суміш. Переважно, вказані великі частинки носія мають масовий діаметр (MD) щонайменше 50 мікрон, більш переважно більше 80 мікрон. Переважно, MD складає від 90 мікрон до 500 мікрон. У певних варіантах здійснення винаходу MD може складати від 90 до 150 мікрон. У інших варіантах здійснення MD може складати від 150 до 400 мікрон, причому MMD переважно перевищує 175 мікрон, і більш переважно MD може складати від 210 до 355 мікрон. Бажаний розмір частинок можна отримувати шляхом просіювання відомими способами. Коли MD великих частинок носія складає від 150 до 400 мікрон, вони переважно мають поверхню, що високо розтріскалася, тобто на них присутні щілини і борозни і інші поглиблені ділянки, які в сукупності називаються в даному описі тріщинами. "Відносно великі частинки, що високо розтріскалися" можуть бути визначені в значеннях індексу розтріскування або коефіцієнта шорсткості, як описано в WO 01/78695 і WO 01/78693, включених в даний опис як посилання, і вони можуть бути охарактеризовані згідно з описом, описаним в цих посиланнях. Вказані великі частинки носія також можуть бути охарактеризовані за допомогою насипної густини або загального об'єму проникнення, які вимірюються, як описано в WO 01/78695. 3 Насипна густина великих частинок носія переважно складає менше 0,8 г/см , переважно від 3 0,8 до 0,5 г/см . 6 UA 107499 C2 3 Загальний об'єм проникнення складає щонайменше 0,8 см , переважно щонайменше 0,9 см . Коли склад за винаходом знаходиться в формі згаданої вище впорядкованої суміші, він переважно може містити додатковий матеріал, здатний забезпечувати вивільнення активних частинок з частинок носія при спрацюванні інгалятора, і, таким чином, може бути здатний збільшувати вдихувану фракцію. Додатковий матеріал, який переважно пов'язаний з поверхнею великих частинок носія, являє собою матеріал, відмінний від матеріалу частинок носія. Переважно, додатковий матеріал являє собою амінокислоту, переважно вибрану з групи, яка складається з лейцину, ізолейцину, лізину, валіну, метіоніну, фенілаланіну. Добавка може являти собою сіль похідного амінокислоти, наприклад аспартам або ацесульфам K. У одному варіанті здійснення винаходу додаткові частинки по суті складаються з лейцину, переважно L-лейцину. Альтернативно додатковий матеріал може включати або складатися з одного або декількох розчинних у воді поверхнево-активних матеріалів, наприклад, лецитину, зокрема, соєвого лецитину. У конкретному варіанті здійснення винаходу додатковий матеріал може включати або складатися з однієї або декількох мастильних речовин, вибраних з групи, яка складається зі стеаринової кислоти і її солей, такої як стеарат магнію, лаурилсульфат натрію, стеарилфумарат натрію, стеариловий спирт, монопальмітат сахарози. Інші можливі додаткові матеріали включають тальк, діоксид титану, діоксид алюмінію і діоксид кремнію. Переважно, додаткові частинки мають початковий середній розмір частинок менший 35 мікрон. Переважно вони мають середній розмір не більший 15 мікрон, більш переважно не більший 10 мікрон. Оптимальна кількість додаткового матеріалу залежить від хімічної композиції і інших властивостей додаткового матеріалу. Як правило, кількість додаткового матеріалу складає не більше 10 % по масі, з розрахунку на загальну масу складу. Однак вважають, що для більшості добавок кількість додаткового матеріалу повинно складати не більше 5 %, переважно не більше 2 % або навіть не більше 1 % по масі або не більше 0,5 % з розрахунку на загальну масу складу. Як правило, кількість додаткового матеріалу складає щонайменше 0,01 % по масі з розрахунку на загальну масу складу. У одному з переважних варіантів здійснення винаходу додатковим матеріалом є стеарат магнію. Кількість стеарату магнію, як правило, складає від 0,01 до 2 %, переважно від 0,02 до 1 %, більш переважно від 0,1 % до 0,5 % по масі з розрахунку на загальну масу складу. У деяких варіантах здійснення стеарат магнію може покривати поверхню частинок носія таким чином, щоб ступінь покриття молекулярної поверхні складав щонайменше 5 %, переважно більше 10 %, більш переважно більше 15 %, ще більш переважно, щоб він дорівнював або перевищував 25 %. Для дуже високого ступеня покриття поверхні, тобто більше 60 %, покриття можна провести з використанням процесу, описаного в заявці EP 10158951.3, що спільно розглядається. Ступінь покриття молекулярної поверхні, який вказує на процент загальної поверхні частинок носія, покритих стеаратом магнію, можна визначати шляхом вимірювання кута водного контакту, як описано в WO 00/53157. Ступінь, з яким стеарат магнію покриває поверхню частинок лактози, також можна визначати за допомогою скануючої електронної мікроскопії (SEM) - універсального аналітичного способу, добре відомого в даній галузі. Такий мікроскоп може бути обладнаний EDX-аналізатором (енергодисперсійний рентгенівський аналізатор), який може видавати зображення, селективне до певних типів атомів, наприклад, до атомів магнію. Таким шляхом можна отримати чіткий набір даних про розподіл стеарату магнію на поверхні частинок носія. Альтернативно SEM можна поєднувати зі ІЧ-спектроскопією або раман-спектроскопією для визначення ступеня покриття згідно з відомими методиками. Іншим аналітичним способом, які переважно можна використовувати, є рентгенівська фотоелектронна спектроскопія (XPS), за допомогою якої можна обчислювати як ступінь покриття, так і глибину плівки стеарату магнію навколо частинок з лактози. 3 5 10 15 20 25 30 35 40 45 50 55 7 UA 107499 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вимірювання XPS можна провести за допомогою комерційно доступних пристроїв, таких як пристрій Axis-Ultra від Kratos Analytical (Manchester, Великобританія), як правило, з використанням монохроматичного A1 Kα-випромінювання відповідно до відомих методик. Склади за винаходом в формі впорядкованої суміші також можуть містити тонкі частинки фізіологічно прийнятного фармакологічно інертного матеріалу з медіанно-масовим діаметром (MMD), який дорівнює або менший 15 мікрон, переважно дорівнює або менший 10 мікрон. Процент тонких частинок фізіологічно прийнятного фармакологічно інертного матеріалу переважно складає від 0,1 до 40 % від загальної кількості складу. Переважно, великі частинки і тонкі частинки складаються з одного і того ж фізіологічно прийнятного фармакологічно інертного матеріалу. У переважному варіанті здійснення винаходу, зокрема, коли однократна доза активного інгредієнта дорівнює або менша 300 мкг, переважно дорівнює або менша 200 мкг, склад має форму твердих гранул згідно з ідеями WO 01/78693. Таким чином, вказаний склад містить: i) частинки сполуки загальної формули (I) в мікронізованій формі; ii) фракція мікрочастинок, яка складається з суміші, що складається з частинок фізіологічно прийнятного фармакологічно інертного матеріалу і частинок додаткового матеріалу, причому вказані мікрочастинки мають MMD, який дорівнює або менший 10 мікрон; і iii) фракція частинок фізіологічно прийнятного фармакологічно інертного матеріалу, що має поверхню, яка високо розтріскалася, і масовий діаметр (MD), що складає від 150 мікрон до 400 мікрон, переважно від 212 до 355 мікрон. Переважно фракція мікрочастинок складається на від 90 до 99,5 % по масі з фізіологічно прийнятного фармакологічно інертного матеріалу і на від 0,5 до 10 % по масі з додаткового матеріалу, і співвідношення між фракцією мікрочастинок і фракцією великих частинок складає від 1:99 до 40:60 % по масі, переважно від 5:95 до 30:70 % по масі, ще більш переважно від 10:90 до 20:80 % по масі. Переважно фізіологічно прийнятним інертним матеріалом є моногідрат α-лактози і додатковим матеріалом є стеарат магнію. У більш переважному варіанті здійснення фракція мікрочастинок складається на від 98 до 99 % по масі з моногідрату α-лактози і на від 1 до 2 % по масі з стеарату магнію і співвідношення між фракцією мікрочастинок і фракцією великих частинок, виготовлених з моногідрату α-лактози становить 10:90 % по масі, відповідно. Кількість стеарату магнію в кінцевому складі переважно складає від 0,01 до 1,0 % по масі, переважно від 0,05 до 0,5 % по масі, більш переважно від 0,1 до 0,4 % по масі з розрахунку на загальну масу складу. Склад в формі впорядкованої суміші за винаходом можна отримувати відомими способами. Вказані способи включають стадію змішування великих частинок носія, необов'язково тонких частинок носія і додаткових частинок, і, нарешті, додавання до отриманої суміші тонкоподрібненої фармацевтично активної сполуки. Особливо переважний склад за винаходом можна отримувати способами, описаними в WO 01/78693. Серед способів, описаних в цьому посиланні, склад переважно отримують способом, який включає наступні стадії: a) отримання мікрочастинок, які складаються з суміші, що складається з частинок, виготовлених з фізіологічно прийнятного фармакологічно інертного матеріалу, і частинок добавки, причому інертний матеріал і добавку спочатку змішують, потім співмікронізують; b) змішування мікрочастинок стадії a) з великими частками фізіологічно прийнятного фармакологічно інертного матеріалу, так щоб мікрочастинки прилипали до поверхні великих частинок; c) додавання шляхом змішування активних частинок в мікронізованій формі до частинок стадії b). Стадію співмікронізації можна провести відомими способами, такими як способи, описані в WO 02/00197. Переважно вказану стадію проводять шляхом розмелювання, більш переважно, з використанням струминного млина в умовах, описаних в WO 01/78693. У переважному варіанті здійснення мікрочастинки стадії a), отримані співмікронізацією, піддають стадії кондиціонування в умовах, описаних в заявці EP 10160565.7, що спільно розглядається. Переважно на стадії a) добавка може бути завантажена в частинки, що утворилися, або альтернативно у випадку мастильної речовини, такої як стеарат магнію, добавка може 8 UA 107499 C2 5 10 15 20 25 30 35 покривати поверхню частинок носія таким чином, щоб ступінь покриття молекулярної поверхні складав щонайменше 5 %, переважно більше 10 %, більш переважно більше 15 %, ще більш переважно більше 35 %. Ступінь покриття молекулярної поверхні вказує на процент загальної поверхні частинок носія, покритих стеаратом магнію. Присутність додаткового матеріалу, завантаженого в мікрочастинки, можна виявляти відомими способами, наприклад, електронною скануючою мікроскопією, зв'язаною з мікрокалориметрією. Навпаки, як описано вище, ступінь покриття молекулярної поверхні можна визначати шляхом вимірювання кута водного контакту, як описано в WO 00/53157, або за допомогою будьяких інших відомих інструментів. Склади за винаходом, крім того, можуть містити інші лікарські засоби, придатні для попередження і/або лікування респіраторного захворювання, наприклад бета2-агоністи, такі як сальметерол, мілветерол і вілантерол; кортикостероїди, такі як флукатизон пропіонат або фуроат, флунізолід, мометазон фуроат, рофлепонід і циклесонід; інгібітори фосфодіестерази-4 (PDE4), такі як рофлуміласт і їх комбінації. Склад сухого порошку, описаний в даному описі, можна використовувати у всіх стандартних інгаляторах сухого порошку, таких як однодозові або багатодозові інгалятори. Наприклад, склад за винаходом може бути заповнений в тверді желатинові капсули, в свою чергу вміщені в інгалятор разової дози, такий як Aerolizer™. Альтернативно склад як порошок може бути заповнений в багатодозовий інгалятор, що містить місткість для порошку, як описано в WO 2004/012801. Введення складу за винаходом може бути призначене для профілактичних цілей або для пом'якшення симптомів широкої множини станів, включаючи респіраторні розлади, такі як хронічне обструктивне захворювання легенів (COPD) і астма всіх типів. Інші респіраторні розлади, при яких склади за винаходом можуть бути корисними, являють собою розлади, що характеризуються обструкцією периферичних дихальних шляхів в результаті запалення і присутності слизу, таких як хронічний обструкційний бронхіоліт, хронічний бронхіт, емфізема, гостре пошкодження легень (ALI), кістозний фіброз, риніт і дорослий респіраторний дистрессиндром (ARDS). Крім того, склад за винаходом може бути придатний для лікування порушень гладких м'язів, таких як нетримання сечі і синдром подразненої кишки; шкірних захворювань, таких як псоріаз; гіпергідрозу і сіалореї; і шлунково-кишкових виразок. Винахід краще проілюстрований за допомогою наступних прикладів. ПРИКЛАДИ Приклад 1 - Склад інгальованого сухого порошку, який містить C1 (склад 1) Склад порошку за винаходом має композицію, описану в таблиці 2: Таблиця 2 Компоненти Кількість На пуск інгалятора Однократна доза мг % мкг 0,2 1,0 200 17,82 89,1 1,98 9,9 C1 Моногідрат альфа-лактози, 212-355 мкм Співмікронізовані частинки Загальна маса 40 45 50 20 C1 мікронізують відомими способами для отримання активної речовини в формі частинок, що має типовий розмір частинок, прийнятний для інгаляції. Співмікронізовані частинки складаються з суміші моногідрату α-лактози і стеарату магнію в співвідношенні 98:2 мас./мас., і їх отримують шляхом спільного подрібнення в струминному млині частинок моногідрату α-лактози, що мають середній розмір частинок менший 250 мікрон, і частинок стеарату магнію, що мають середній розмір частинок менший 35 мікрон. Кінцевим складом заповнюють тверді желатинові капсули і їх вміщують в інгалятор Aerolizer™. Характеристики аерозолю оцінюють з використанням багатоступінчастого рідинного імпінджера (MSLI) по методиці, описаній в European Pharmacopoeia, 2-е видання, 1995, частина V.5.9.1, стор. 15-17. 9 UA 107499 C2 Приклад 2 - Склад інгальованого сухого порошку, який містить C2 (склад 2) Отримують склад порошку з композицією, схожою з композицією прикладу 1, але з використанням C2. Композиція представлена в таблиці 3. 5 Таблиця 3 Компоненти Кількість На пуск інгалятора Однократна доза мг % мкг 0,2 1,0 200 17,82 89,1 1,98 9,9 C2 Моногідрат альфа-лактози, 212-355 мкм Співмікронізовані частинки Загальна маса 10 20 Складом заповнюють тверді желатинові капсули і їх вміщують в інгалятор Aerolizer™. Характеристики аерозолю визначають, як описано в прикладі 1. Приклад 3 - Склад інгальованого сухого порошку, який містить C3 (склад 3) Отримують наступний склад порошку за винаходом з композицією, описаною в таблиці 4. Таблиця 4 Компоненти Кількість На пуск інгалятора мг % 0,100 1,0 8,91 89,1 0,99 9,9 C3 Моногідрат альфа-лактози, 90-150 мкм Стеарат магнію Загальна маса 15 Однократна доза мкг 100 10 Складом заповнюють багатодозовий інгалятор сухогопорошку, описаний в WO 2004/012801. Приклад 4 - Склад інгальованого сухого порошку, який містить C4 (склад 4) Отримують наступний склад порошку за винаходом з композицією, описаною в таблиці 5. Таблиця 5 Компоненти Кількість На пуск інгалятора Однократна доза мг % мкг 0,200 2,0 200 8,82 97,90 0,98 0,10 C4 Моногідрат альфа-лактози, 90-150 мкм Стеарат магнію Загальна маса 20 10 Складом заповнюють багатодозовий інгалятор сухого порошку, описаний в WO 2004/012801. Приклад 5 - Склад інгальованого сухого порошку, який містить C5 (склад 5) Отримували склад порошку з композицією, схожою з композицією прикладу 1, але з використанням C5. Композиція представлена в таблиці 6. 25 10 UA 107499 C2 Таблиця 6 Компоненти Кількість На пуск інгалятора Однократна доза мг % мкг 0,2 1,0 200 17,82 89,1 1,98 9,9 C5 Моногідрат альфа-лактози, 212-355 мкм Співмікронізовані частинки Загальна маса 5 20 Кінцевим складом заповнювали тверді желатинові капсули і його вміщували в інгалятор Aerolizer™. Характеристики аерозолю оцінювали, як описано в прикладі 1. Результати, як середнє значення для двох визначень, в значеннях дози (DD), що доставляється, кінцевої маси частинок (FPM), фракції тонких частинок (FPF) і медіанномасового аеродинамічного діаметра (MMAD) представлені в таблиці 7. Таблиця 7 DD мкг 61,1 FPM мкг 39,8 MMAD мкм 2,2 FPF % 65,0 10 15 Виявилося, що FPF є чудовою, вказуючи на те, що вказаний тип складу здатний забезпечувати хороші характеристики аерозолю. Приклад 6 - Додаткові склади інгальованих сухих порошків, які містять C5 Отримують склади порошків з композицією, схожою з композицією прикладу 5, з використанням різних кількостей C5 і різних процентів співмікронізованих частинок. Композиції представлені в таблиці 8 і 9. Таблиця 8 Кількість Моногідрат α-лактози, 212-355 мкм (мг) Моногідрат α-лактози, 212-355 мкм (%) Співмікронізовані частинки (мг) Співмікронізовані частинки (%) C5 (мг) C5 (%) Всього 20 Складом заповнюють 2004/012801. багатодозовий 10 мкг/ 10 мг 8,991 89,9 0,999 10 0,010 0,1 10 мг інгалятор 10 мкг/ 10 мг 8,4915 84,9 1,4985 15 0,010 0,1 10 мг сухого 100 мкг/ 10 мг 8,415 84,0 1,485 15 0,100 1 10 мг порошку, 200 мкг/ 10 мг 8,82 88,0 0,98 10 0,200 2,0 10 мг описаний в WO Таблиця 9 Кількість Моногідрат α-лактози, 212-355 мкм (мг) Моногідрат α-лактози, 212-355 мкм (%) Співмікронізовані частинки (мг) Співмікронізовані частинки (%) C5 (мг) C5 (%) Всього 20 мкг/ 20 мг 17,982 89,9 1,998 10 0,020 0,1 20 мг 20 мкг/ 20 мг 16,803 84,9 2,997 15 0,020 0,1 20 мг 200 мкг/ 20 мг 16,83 84,0 2,97 15 0,200 1,0 20 мг Складом заповнюють тверді желатинові капсули і їх вміщують в інгалятор Aerolizer™. 11 UA 107499 C2 5 10 15 20 Приклад 7 - Оцінка активності сполук за винаходом відносно розширення бронхів Реактивність дихальних шляхів визначають з використанням барометричної плетизмографії (Buxco, США). Самців морських свинок (500-600 г) окремо кожного вміщують в камери з плексигласу. Після періоду акліматизації на тваринах впливають розпиленим фізіологічним розчином протягом 1 хв. для отримання вихідних даних для дихальних шляхів. Після цього йде навантаження протягом 1 хв. розпиленим ацетилхоліном (Ach) - 2,5 мг/мл. Через 60 хв. застосовують розпилювання протягом 5 хв. носія або переважних сполук за винаходом в діапазоні 0,1-1 мМ, а потім повторюють навантаження Ach через 2, 5, 24, 48 і 72 годин (год.). Дані коливань тиску в камерах отримують протягом 5 хв. після кожного розпилювання і аналізують для обчислення посиленої паузи (Penh). Реактивність дихальних шляхів виражають як процентне збільшення Penh в порівнянні з величинами Penh для розпилювання носія. Через дві години після закінчення розпилювання індуковане Ach збільшення Penh інгібується сполуками дозозалежним чином з максимальним ефектом при приблизно 1 мМ. Що стосується ефекту з плином часу, вказані сполуки демонструють збільшення тривалості дії при збільшенні дози. Після інгаляції 0,1 мМ вказаних сполук ефект істотно продовжувався аж до 24 год. Оцінка рівнів в легенях вказаних сполук, досягнутих після розпилювання дози, що забезпечує субмаксимальну активність розширення бронхів через 2 год. після введення, показала, що їх залишкова доза в органі-мішені складає менше 5 мкг/кг. Якщо проводити екстраполювання цих результатів з морської свинки на людину, можна передбачити, що у пацієнтів добова доза може складати від 20 до 500 мкг. ФОРМУЛА ВИНАХОДУ 25 1. Склад інгальованого сухого порошку, який містить як активний інгредієнт мікронізовані частинки сполуки загальної формули (І) NH H O O + N A 30 , (I) де: R1 являє собою групу формули (Y) (CH2)p 35 40 45 R1 P W , (Y) де р являє собою 0 або ціле число від 1 до 4; Р відсутній або вибраний з групи, яка складається з О, S, SO, SO 2 і CO; W вибраний з групи, яка складається з Н, арилу і гетероарилу, де арил і гетероарил необов'язково заміщені одним або декількома замісниками, вибраними з групи, яка складається з атомів галогену, ОН, SH, NO2, CN, СООН і NH2; Аˉ являє собою фізіологічно прийнятний аніон; фракцію мікрочастинок, складену з суміші, яка складається з частинок моногідрату α-лактози і частинок стеарату магнію, вказані частинки мають медіанно-масовий діаметр (MMD), що дорівнює або менший 15 мікронів; і фракцію великих частинок моногідрату α-лактози, що має шорстку поверхню і масовий діаметр від 150 до 400 мікронів. 2. Інгальований порошок за п. 1, де фізіологічно прийнятний аніон Аˉ вибраний з групи, яка складається з хлориду, броміду, йодиду, трифторацетату, форміату, сульфату, фосфату, метансульфонату, нітрату, малеату, ацетату, цитрату, фумарату, тартрату, оксалату, сукцинату, бензоату і п-толуолсульфонату. 3. Інгальований порошок за п. 1 або 2, де активний інгредієнт вводять в разовій дозі від 5 мкг до 2500 мкг. 12 UA 107499 C2 5 10 15 20 4. Інгальований порошок за п. 3, де разова доза складає від 10 мкг до 2000 мкг. 5. Інгальований порошок за п. 4, де разова доза складає від 15 мкг до 1000 мкг. 6. Інгальований порошок за п. 5, де разова доза складає від 20 мкг до 800 мкг. 7. Інгальований порошок за п. 6, де разова доза складає від 25 мкг до 600 мкг. 8. Інгальований порошок за будь-яким з пп. 1-7, де носієм є кристалічний цукор, вибраний з групи, яка складається з глюкози, арабінози, мальтози, сахарози, декстрози і лактози, або поліспирт, вибраний з групи, яка складається з маніту, мальтиту, лактиту і сорбіту. 9. Інгальований порошок за п. 8, де масовий діаметр складає від 212 до 355 мікронів. 10. Інгальований порошок за будь-яким з пп. 1-9, який додатково містить один або декілька додаткових матеріалів, вибраних з групи, яка складається з амінокислот, розчинних у воді поверхнево-активних речовин, мастильних речовин і речовин, які сприяють ковзанню. 11. Інгальований порошок за п. 10, де додатковим матеріалом є мастильна речовина. 12. Інгальований порошок за будь-яким з пп. 1-11, де стеарат магнію присутній в кількості, яка складає від 0,01 до 2 % по масі з розрахунку на загальну масу складу. 13. Інгальований порошок за п. 12, де кількість стеарату магнію складає від 0,02 до 1 % мас./мас. 14. Інгалятор сухого порошку, який містить склад інгальованого сухого порошку за будь-яким з пп. 1-13. 15. Склад інгальованого сухого порошку за будь-яким з пп. 1-13 для застосування для профілактики і/або лікування астми і хронічного обструктивного захворювання легенів (COPD). 16. Упаковка, що містить склад інгальованого сухого порошку за будь-яким з пп. 1-13 і інгалятор сухого порошку. Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюDry powder formulation comprising an antimuscarinic drug
Автори англійськоюSchiaretti, Francesca
Автори російськоюСкьяретти Франческа
МПК / Мітки
МПК: A61K 9/14, A61P 11/06, A61K 31/439, A61P 11/08
Мітки: антимускариновий, порошку, засіб, сухого, склад, містить
Код посилання
<a href="https://ua.patents.su/15-107499-sklad-sukhogo-poroshku-yakijj-mistit-antimuskarinovijj-zasib.html" target="_blank" rel="follow" title="База патентів України">Склад сухого порошку, який містить антимускариновий засіб</a>
Попередній патент: Спосіб високої напіввідкритої ампутації гомілки при ішемічній гангрені у дітей
Наступний патент: Спосіб лікування варусної деформації шийки стегна у хворих на недосконалий остеогенез
Випадковий патент: Профілометр для контролю поверхні циліндрів друку












