Кристалічні фармацевтично активні форми
Номер патенту: 109560
Опубліковано: 10.09.2015
Автори: Катаіне Фаддьяш Каталін, Лукач Гіула, Кованьїне Лакс Дьйордь, Мезеварі Моніка, Хаморі Чаба, Юрак Ференц, Рунге Жолт, Волк Балаж, Хаваші Балаж, Шіпош Ева, Фодорне Кочмар Кристина, Марковітш Імре
Формула / Реферат
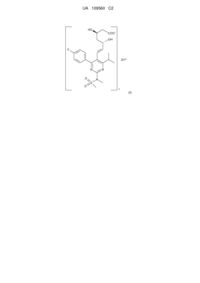
1. Кристалічна форма V цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигeпт-6-eнової кислоти] формули (І)
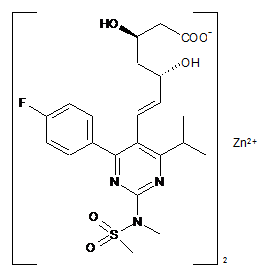 , (I)
, (I)
яка відрізняється тим, що рентгенівські дифракційні лінії виміряні з використанням випромінювання СuKa, з наступним кутом дифракції 2q (± 0,2°2q): 4,746 градуса.
2. Кристалічна форма V цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6-енової кислоти] формули (І), яка відрізняється рентгенівськими дифракційними лініями, виміряними з використанням випромінювання СuKa, з наступними кутами дифракції 2q (± 0,2°2q): 4,746 і 15,371 градуса.
3. Кристалічна форма V цинкової солі розувастатину (2:1) за п. 1 або за п. 2, яка відрізняється тим, що має порошкову рентгенівську дифрактограму, представлену на фіг. 1, і наступні лінії рентгенівської дифракції, виміряні за допомогою випромінювання СuKa:
2q [°]
d-значення [Å]
Відносна інтенсивність [%]
4,764
18,5324
100,0
5,873
15,0352
20,9
8,941
9,8823
11,1
9,547
9,2561
12,5
10,960
8,0664
20,7
11,773
7,5111
19,0
12,224
7,2347
20,6
12,870
6,8733
8,8
13,118
6,7438
21,1
13,979
6,3303
13,9
14,401
6,1454
9,8
15,371
5,7599
61,6
15,997
5,5359
13,2
16,357
5,4148
10,4
16,852
5,2570
8,0
17,641
5,0235
6,9
17,995
4,9256
29,6
18,783
4,7206
5,8
19,394
4,5733
31,9
19,977
4,4411
9,2
20,741
4,2792
5,1
20,959
4,2352
4,6
21,700
4,0922
12,3
22,263
3,9899
17,5
22,736
3,9080
9,7
23,367
3,8038
14,9
23,659
3,7575
12,9
24,235
3,6695
29,8
24,716
3,5992
10,5
25,245
3,5250
19,3
26,034
3,4199
9,5
26,485
3,3627
8,0
27,028
3,2964
12,9
28,016
3,1824
8,3
28,667
3,1115
8,0
29,662
3,0093
8,6
30,967
2,8854
9,2
32,668
2,7390
6,9
33,032
2,7096
8,0
33,342
2,6851
7,2
33,989
2,6355
5,6
34,452
2,6011
6,8
4. Цинкова сіль розувастатину (2:1), яка відрізняється тим, що вона має порошкову рентгенівську дифрактограму, представлену на фіг. 1, виміряну з використанням випромінювання СuKa.
5. Цинкова сіль розувастатину (2:1) за будь-яким з пп. 1-3, яка відрізняється тим, що містить від 1 до 10 моль, переважно від 1 до 6 моль води.
6. Суміш кристалічної цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 з аморфною цинковою сіллю розувастатину (2:1).
7. Спосіб одержання кристалічної форми V цинкової солі розувастатину (2:1), який відрізняється тим, що включає перетворення аморфної цинкової солі розувастатину (2:1) в кристалічну форму III цинкової солі розувастатину (2:1), перемішування отриманого таким шляхом продукту в 2-100-кратному, переважно 2-50-кратному, найбільш переважно 2,5-25-кратному надлишку води, або в суміші води і спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40 °C, переважно від 10 до 30 °C, протягом періоду від 1 до 168 годин, переважно від 4 до 120 годин, виділення і можливо висушування продукту.
8. Спосіб одержання кристалічної форми V цинкової солі розувастатину (2:1) формули (І), який відрізняється тим, що включає перемішування кристалічної форми III цинкової солі розувастатину (2:1) в 2-100-кратному, переважно 2-50-кратному, найбільш переважно 2,5-25-кратному надлишку води, або в суміші води і спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40 °C, переважно від 10 до 30 °C, протягом періоду від 1 до 168 годин, переважно від 4 до 120 годин, виділення і можливо висушування продукту.
9. Спосіб за п. 7 або 8, який відрізняється тим, що перемішування, виділення і можливе висушування виконують в атмосфері інертного газу.
10. Спосіб за п. 7 або 8, який відрізняється тим, що висушування виконують при температурі від 0 до 30 °C.
11. Лікарські засоби, що містять кристалічну форму V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 в терапевтично ефективній кількості, можливо в суміші фармацевтично прийнятного носія.
12. Спосіб одержання лікарських засобів за п. 11, який відрізняється тим, що включає можливе змішування кристалічної форми V цинкової солі розувастатину за будь-яким з пп. 1-4 з фармацевтично прийнятним носієм і переведення у фармацевтичну лікарську форму.
13. Кристалічна форма V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 для застосування в терапії.
14. Застосування кристалічної форми V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 для лікування метаболізму ліпідів, включаючи гіперхолестеринемію, гіперліпідемію, дисліпідемію або атеросклероз.
15. Застосування кристалічної форми V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 для лікування розладів метаболізму ліпідів, що включають гіперхолестеринемію, гіперліпідемію, дисліпідемію або атеросклероз.
16. Спосіб лікування розладів метаболізму ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію або атеросклероз, де даний спосіб включає введення пацієнту, що потребує такого лікування, лікарського засобу, що містить терапевтично ефективну кількість кристалічної форми V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4.
17. Кристалічна форма III цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6-енової кислоти] формули (І), яка відрізняється рентгенівською дифракційною лінією, що виміряна з використанням випромінювання СuKa, з наступним кутом дифракції 2q (± 0,2°2q): 18,961 градуса.
18. Кристалічна форма III цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6-енової кислоти] формули (І), яка відрізняється рентгенівськими дифракційними лініями, виміряними з використанням випромінювання СuKa, з наступними кутами дифракції 2q (± 0,2°2q): 6,259, 13,414 і 18,961 градуса.
19. Кристалічна форма III цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6-енової кислоти] формули (І), яка відрізняється рентгенівськими дифракційними лініями, виміряними з використанням випромінювання СuKa, з наступними кутами дифракції 2q (± 0,2°2q): 6,259; 10,982; 13,414; 16,401; 18,600; 18,961; 19,409; 20,462 і 22,302 градуса.
20. Кристалічна форма III цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6-енової кислоти] формули (І), яка відрізняється рентгенівськими дифракційними лініями, виміряними з використанням випромінювання СuKa, з наступними кутами дифракції 2q (± 0,2°2q): 6,259; 9,400; 10,982; 13,414; 15,480; 16,401; 16,623; 16,926; 18,338; 18,600; 18,961; 19,409; 20,462; 21,846; 22,302; 22,779; 23,232; 26,451; 27,178; 27,603; 31,311 і 31,861 градуса.
21. Кристалічна форма III цинкової солі розувастатину (2:1), яка відрізняється тим, що вона має порошкову рентгенівську дифрактограму, представлену на фіг. 2, виміряну з використанням випромінювання СuKa.
22. Кристалічна форма III цинкової солі розувастатину (2:1), яка відрізняється тим, що має характеристичні показники відображення в порошковій рентгенівській дифрактограмі, виміряні з використанням випромінювання СuKa, у відповідності з наступною таблицею:
2q
d (Å)
Відносна інтенсивність (%)
2q
d (Å)
Відносна інтенсивність (%)
6,259
14,11083
90,2
20,462
4,33695
53,2
9,400
9,40131
36
21,383
4,15201
12,6
10,982
8,04997
62,4
21,846
4,06507
47,1
11,318
7,81202
15,4
22,302
3,98297
58,1
12,565
7,03939
12,1
22,779
3,90066
39,5
13,414
6,59524
92,8
23,232
3,82568
35,6
14,437
6,13017
5,4
24,055
3,69663
10,4
14,806
5,97820
19,6
24,690
3,60288
17,4
15,48
5,71948
20,5
25,388
3,50540
16,9
15,776
5,61288
18,7
26,451
3,36697
33,9
16,059
5,51479
15,4
27,178
3,27846
22,5
16,401
5,40024
50,1
27,603
3,22900
20,6
16,623
5,32865
44,8
28,472
3,13240
16,2
16,926
5,23406
43,6
29,938
2,98221
14,8
17,572
5,04319
15,4
30,180
2,95883
16,7
17,894
4,95294
15,4
31,311
2,85449
21,8
18,338
4,83405
48,9
31,861
2,80646
25,7
18,600
4,76648
50,4
32,695
2,73674
14,6
18,961
4,67672
100
33,177
2,69812
13,2
19,409
4,56959
58,2
34,134
2,62459
8
23. Спосіб одержання кристалічної форми III цинкової солі розувастатину (2:1), який відрізняється тим, що включає перемішування аморфної цинкової солі розувастатину (2:1) при температурі від -10 до +40 °C, переважно від 0 до 10 °C в 5-100-кратному, переважно 20-60-кратному надлишку маси води, або у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, можливо містить 0,0001-0,01, переважно 0,005-0,01 молярних еквівалентів гідроксиду натрію, розраховане на молярну кількість цинкової солі розувастатину формули (І), протягом періоду від 1 до 48 годин, переважно від 2 до 8 годин, найбільш переважно протягом 4 годин, фільтрування суспензії, можливе повторення перемішування в 5-100-кратному, переважно 20-60-кратному надлишку маси води, або у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40 °C, переважно від 0 до 10 °C, протягом періоду від 1 до 48 годин, переважно від 2 до 8 годин, найбільш переважно протягом 4 годин, і можливо промивання і висушування продукту.
24. Спосіб одержання аморфної цинкової солі розувастатину (2:1), який відрізняється тим, що включає забезпечення розчину трет-бутиламінової солі розувастатину у воді або у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, додавання в зазначений розчин водного розчину солі цинку, переважно сульфату цинку, при кімнатній температурі, змішування і перемішування зазначеного розчину з 2-50-кратним, переважно 4-10-кратним надлишком об'єму води, охолодженої до температури від -10 до +20 °C, переважно від 0 до 10 °C.
Текст
Реферат: Даний винахід стосується кристалічних форм цинкової солі розувастатину (2:1). Поліморфи придатні для застосування як фармацевтично активних інгредієнтів при лікуванні захворювань, обумовлених метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпідемію, дисліпідемію або атеросклероз. UA 109560 C2 (12) UA 109560 C2 HO COO OH F Zn2+ N O O S N N 2 (I) UA 109560 C2 Даний винахід відноситься до кристалічним формам цинкової солі (+)-7-[4-(4-фторфеніл)-6ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти формули (I). 5 10 15 20 25 Сполука (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл](3R, 5S)-дигідрокси-гепт-6-енова кислота формули (II) , відомо під міжнародною непатентованою назвою розувастатин і застосовується в медицині як фармацевтично активний інгредієнт при лікуванні розладів метаболізму ліпідів. Активність розувастатину здійснюється за допомогою інгібування 2-гідрокси-2-метил-глутарил-коензим A редуктази, що присутня в печінці, результатом чого є зниження швидкості біосинтезу холестерину в печінці та концентрації холестерину в крові. Розувастатин, в основному, у формі його солей, можна застосовувати для лікування гіперхолестеринемії, гіперліпопротеїнемії та атеросклерозу. Об'єктом даного винаходу є кристалічна форма V цинкової солі (+)-7-[4-(4-фторфеніл)-6ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти (2:1) формули (I), спосіб її одержання та її застосування при отриманні лікарських засобів. Інший об'єкт даного винаходу становить кристалічна форма III цинкової солі (+)-7-[4-(4фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R, 5S)-дигідроксигепт-6-енової кислоти (2:1) формули (I), яку можна успішно застосовувати в якості вихідної речовини в процесі отримання кристалічної форми V розувастатину. Ще одним іншим об'єктом даного винаходу є спосіб одержання цинкової солі розувастатину (2:1) в аморфній формі. Попередній рівень техніки (+)-7-[4-(4-Фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)-піримідин-5-іл]-(3R, 5S)дигідрокси-гепт-6-енова кислота формули (II) (розувастатин) відома з рівня техніки. Розувастатин вперше розкритий в європейському патенті № 521471 у вигляді вільної кислоти та деяких її фармацевтично прийнятних солей, таких як кальцієва сіль формули (III) 1 UA 109560 C2 5 10 15 20 25 30 35 40 45 , амонієва сіль. У публікації міжнародної заявки на патент WO 01/060804 розкриті кристалічні літієві, магнієві солі розувастатину та кристалічні солі даної сполуки з певними амінами. У публікаціях міжнародних заявок на патент WO 2005023779, WO 2006079611 і WO 2008036286 розкрито кілька різних кристалічних форм гідратів розувастатину кальцію формули (III). Міжнародні заявки на патент WO 2005051921 і WO 2008038132 відносяться до додаткових солям розувастатину з амінами або діамінами. У міжнародній заявці на патент WO 2005077917 розкрита аморфна магнієва сіль розувастатину. У публікації міжнародної заявки на патент WO 2007086082 розкрита аморфна і кристалічна калієва сіль і спосіб її одержання. Цинкова сіль розувастатину (2:1) формули (I) вперше розкрита в заявці на патент Угорщини P0600293 і у відповідній міжнародній заявці на патент WO 2007119085. Заявка на патент Угорщини P0600293 і відповідна публікація міжнародної заявки на патент WO 2007119085 відносяться до додаткових способів отримання цинкової солі розувастатину формули (I), де в якості вихідних речовин використовують розувастатін формули (II), його натрієву сіль, його алкіловим ефір, лактон розувастатину або складний ефір кеталя розувастатину. У міжнародній заявці на патент WO 2008015563 розкритий спосіб одержання цинкової солі розувастатину формули (I), який включає перетворення трет-бутиламінової солі розувастатину у натрієву сіль розувастатину та одержання цинкової солі шляхом взаємодії зазначеної натрієвої солі розувастатину з іонами цинку і відфільтровування продукту з водного розчинника. Заявка на патент Угорщини P0900019 відноситься до додаткового способу одержання цинкової солі розувастатину формули (I), де цинкова сіль розувастатину формули (I) одержують безпосередньо, починаючи з трет-бутіламіновой солі розувастатину та виділяючи зазначений продукт з органічного розчинника. Цинкова сіль розувастатину формули (I), отримана способами, описаними в заявках на патенти Угорщини P0600293, P070667 і P0900019, або способом, розкритим у міжнародній заявці на патент WO 2008015563, має аморфну морфологію. Міжнародна заявка на патент PCT/HU2009/00064 відноситься до кристалічній формі I розувастатину цинку (2:1). Якість фармацевтично активних інгредієнтів, що застосовуються в лікарських препаратах, визначається строгими критеріями, встановленими органами охорони здоров'я. Деякі з цих критеріїв відносяться до хімічної чистоти і стабільності активного інгредієнта. Додаткові критерії застосовні до якості і стабільності лікарського препарату. Ці критерії встановлені й опубліковані в фармакопеях. Основною умовою для видачі реєстраційного свідоцтва є дотримання вимог якості, що стосуються як фармацевтично активних інгредієнтів, так і лікарських препаратів. При застосуванні розувастатину при виготовленні лікарських засобів існує необхідність в отриманні фармацевтично активного інгредієнта високої чистоти, хімічно стабільного і що знаходиться у формі, якою можна легко маніпулювати при виготовленні готової лікарської форми. Нещодавно у фармацевтичній промисловості виникла певна потреба в наданні відтворюваних способів отримання фармацевтично активних інгредієнтів в хімічно та морфологічно чистій формі. Одержання фармацевтично активного інгредієнта в гомогенному твердому стані становить неодмінну умову дотримання вимог промислового виробництва готових лікарських форм. Добре відомий факт, що тверді форми одного і того ж активного інгредієнта, що мають різну морфологію, можуть проявляти значні відмінності в швидкості розчинення, біодоступності та хімічної стабільності. З точки зору промислової хімічної та фармацевтичної технології важливо, щоб різні тверді форми активного інгредієнта могли володіти властивостями, що значно відрізняються щодо технологічних операцій, наприклад, 2 UA 109560 C2 5 10 15 20 25 30 35 40 45 50 55 60 швидкості фільтрування або висушування, розчинності, поведінки під час таблетування. Згадані вище властивості безпосередньо впливають на ефективність, економічність, відтворюваність і складність процесу промислового виробництва, і, в той же час, результатом є морфологічно однорідний продукт. У цілому прийнято вважати, що кристалічні форми фармацевтично активних інгредієнтів володіють покращеною хімічною стабільністю порівняно з аморфною формою. Внаслідок різних процесів розкладання при виготовленні та зберіганні готової лікарської форми дане припущення має величезну значимість. Отже, виробники лікарських препаратів при фармацевтичній розробці віддають перевагу застосовуванню кристалічній формі активних інгредієнтів. Оскільки активні інгредієнти, що належать до групи статинів, явно схильні до розкладання (Ravi P. Shah, Vijay Kumar and Saranjit Singh, LC-MS/MS Studies on Identification and Characterization of Hydrolytic Products of Atorvastatin, Proceedings of 12th ISMAS Symposium cum Workshop on Mass Spectrometry, March 25-30, 2007, Cidade de Goa, Dona Paula, Goa), існує певна потреба в розробці форм активних інгредієнтів, що належать до цієї групи, які виявляють підвищену хімічну стабільність. Наприклад, відомо, що аморфна форма аторвастатину, що має структуру, подібну структурі розувастатину (тобто обидві сполуки мають загальне групування 3,5-дигідроксиалканової кислоти), або навіть морфологічно неоднорідна суміш аморфної і кристалічної форм, розкрита в європейському патенті 409281, менш стабільні, ніж кристалічні форми тієї ж сполуки. Таким чином, розробка кристалічних форм I, II і IV аторвастатину, що виявляють поліпшені властивості під час хімічних або фармацевтичних маніпуляцій (наприклад, легкість фільтрування) і підвищену стабільність, як розкрито в публікації міжнародної заявки на патент WO 97/03959, ініціювала роботу з розробки від особи декількох фармацевтичних фірм, результатом якої стала розробка більш сорока кристалічних форм аторвастатину. Розувастатін особливо схильний до розкладання в результаті впливу світла, кисню і тепла. Наприклад, під дією світла продукти розкладання, описані Astrarita з співавторами, утворюються навіть у твердому стані (J. Photochem. Photobiol. A. Chem. 2007, 187, 263-268). Поліморфізм фармацевтично активного інгредієнта можна використовувати кількома шляхами. Як обговорюється вище, першорядну важливість має застосування кристалічної форми, що володіє належною стабільністю і складом домішок (чистотою), при виготовленні готової лікарської форми. Також важливо, щоб кристалічний активний інгредієнт володів належними властивостями для маніпуляцій широкомасштабного виготовлення і фармацевтичної технології в промисловому масштабі. Проте, в процесі розробки різних готових лікарських форм можна також використовувати різні властивості поліморфів, наприклад, швидкість розчинення, розмір частки і т.д. Поліморф, що має більш низьку швидкість розчинення, може вносити внесок у властивості лікарської форми з уповільненим вивільненням, в той же час, фахівець у даній галузі техніки може високо оцінювати форму, що має більш високу розчинність або більш високу швидкість розчинення при виготовленні у вигляді препарату лікарської форми з негайним вивільненням. Короткий опис винаходу У зв'язку з вищезазначеними фактами існує крайня необхідність у розробці кристалічних солей розувастатину формули (II). Завдання науково-дослідної та дослідно-конструкторської розробки полягала в розробці цинкової солі розувастатину (2:1) у кристалічній формі, яка є придатною для виготовлення лікарських засобів, та яка може бути отримана відповідно високої якості в промислових умовах. Вищевказана задача вирішена даним винаходом. Несподівано виявили, що цинкова сіль розувастатину (2:1) може бути синтезована більш ніж в одній морфологічно однорідній кристалічній формі, яка володіє належною стабільністю, переважним складом домішок і переважними фізико-хімічними властивостями, яка може бути відтворено виготовлена в промисловому масштабі при використанні простого способу. Відомо, що кристалічні форми розувастатину кальцію, вперше розкриті в 1991 році, стали доступні тільки через більш 10 років після відкриття аморфної форми. Незважаючи на той факт, що кристалічні форми розувастатину кальцію були отримані, зазначені кристалічні форми досі не застосовують для виготовлення лікарських засобів. Це явище відображає той факт, що ® навіть оригінальний продукт CRESTOR містить розувастатін кальцій в аморфній формі. Несподівано, що цинкова (2:1) сіль розувастатину може бути отримана в кристалічній формі, оскільки добре відомо утворення комплексів перехідного металу цинку як з органічними лігандами, так і з водою або з іншими неорганічними сполуками та іонами. Крім того, на рівні техніки не існує способу, який можна було б застосовувати як для передбачення ймовірностей утворення кристала для хімічної сполуки або солі, відомих тільки в аморфній формі, так і для оцінки фізико-хімічних властивостей нової кристалічної форми. 3 UA 109560 C2 5 10 15 20 25 30 35 Відповідно до першого аспекту даного винаходу запропонована кристалічна форма V цинкової солі (2:1) (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти формули (I). Відповідно до другого аспекту даного винаходу запропоновані способи виготовлення кристалічної форми V цинкової солі розувастатину (2:1). Згідно з третім аспектом винаходу запропоновано способи застосування кристалічної форми V цинкової солі розувастатину (2:1) формули (I) для виготовлення лікарських засобів. Наступний аспект даного винаходу складає застосування кристалічної форми V цинкової солі розувастатину (2:1) для лікування розладів, обумовлених порушеним метаболізмом холестерину і ліпідів. Згідно ще одному іншому аспекту даного винаходу запропонована кристалічна форма III цинкової солі розувастатину (2:1) формули (I), яка є переважною вихідною речовиною для виготовлення кристалічної форми V цинкової солі розувастатину (2:1), та запропоновано спосіб її отримання. Відповідно до іншого аспекту даного винаходу запропоновано вдосконалений спосіб отримання аморфної цинкової солі розувастатину (2:1), що володіє високою чистотою. Детальний опис винаходу Цинкова сіль розувастатину (2:1) формули (I), отримана згідно способу, розкритому в заявках на патенти Угорщини P0600293, P070667 і P0900019, не має чіткої, добре визначеної точки плавлення, що вказує на аморфну речовину. Плавлення починається при 137 °C і відбувається протягом широкого температурного діапазону. Цинкова сіль розувастатину (2:1), отримана способом, описаним у міжнародній заявці на патент WO 2008015563, охарактеризована за допомогою аналізу методом порошкової рентгенівської дифракції. Результати аналізу, розкриті у зазначеній заявці на патент, чітко вказують на те, що отриманий продукт має аморфну морфологію. Точка плавлення не розкрита. Наразі несподівано виявили, що існують нові кристалічні форми цинкової солі розувастатину (2:1) формули (I). Відповідно до першого аспекту даного винаходу запропонована кристалічна форма V цинкової солі (2:1) (+)-7-[4-(4-фторфеніл)-6-ізопропіл-2-(метансульфоніл-метил-аміно)піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти формули (I). Кристалічна форма V цинкової солі розувастатину (2:1) є новою. Порошкова рентгенівська дифрактограма, отримана для кристалічної форми V цинкової солі розувастатину (2:1) (визначена з використанням випромінювання CuKα), представлена на фіг. 1. Характеристичні кути і відповідні відносні інтенсивності рентгенівської дифрактограми для кристалічної форми V солі розувастатину цинку (2:1) наведені нижче в таблиці 1. Таблиця 1 Дані за порошковою рентгенівською дифракцією кристалічної форми V цинкової солі розувастатину (2:1) 2 Тета [°] 4,764 5,873 8,941 9,547 10,960 11,773 12,224 12,870 13,118 13,979 14,401 15,371 15,997 16,357 16,852 17,641 d-значення [Ǻ] 18,5324 15,0352 9,8823 9,2561 8,0664 7,5111 7,2347 6,8733 6,7438 6,3303 6,1454 5,7599 5,5359 5,4148 5,2570 5,0235 Відносна інтенсивність [%] 100,0 20,9 11,1 12,5 20,7 19,0 20,6 8,8 21,1 13,9 9,8 61,6 13,2 10,4 8,0 6,9 4 UA 109560 C2 Таблиця 1 (продовження) 2 Тета [°] 17,995 18,783 19,394 19,977 20,741 20,959 21,700 22,263 22,736 23,367 23,659 24,235 24,716 25,245 26,034 26,485 27,028 28,016 28,667 29,662 30,967 32,668 33,032 33,342 33,989 34,452 5 10 15 20 25 d-значення [Ǻ] 4,9256 4,7206 4,5733 4,4411 4,2792 4,2352 4,0922 3,9899 3,9080 3,8038 3,7575 3,6695 3,5992 3,5250 3,4199 3,3627 3,2964 3,1824 3,1115 3,0093 2,8854 2,7390 2,7096 2,6851 2,6355 2,6011 Відносна інтенсивність [%] 29,6 5,8 31,9 9,2 5,1 4,6 12,3 17,5 9,7 14,9 12,9 29,8 10,5 19,3 9,5 8,0 12,9 8,3 8,0 8,6 9,2 6,9 8,0 7,2 5,6 6,8 Умови вимірювання при аналізі методом порошкової рентгенівської дифракції були наступними: Прилад: Порошковий рентгенівський дифрактометр BRUKER D8 ADVANCE Випромінювання: CuKα1 (λ = 1,54060 Ǻ), CuKα2 (λ = 1,54439 Ǻ) Напруга: 40 кВ Анодний струм: 40 мА Допоміжне обладнання: дзеркало Гебеля, щілинний коліматор Соллера (2,5°), прилад для відбору зразків, положення пропускання Детектор: LynxEye Вимірювання: безперервне сканування Θ/Θ: 4°-35° 2Θ Швидкість зняття: 1,2°/хв Крок: 0,02° Зразок: без попередньої обробки, укладений між майларовий пластинами, кімнатна температура Обертання зразку: 1 об/хв Стандартний зразок: Quarzprobe RA450 (Bruker AXS) Відтворюваність: ±0,2° 2Θ З рівня техніки добре відомо, що попередня обробка зразка (наприклад, розпилення) може дуже значно впливати на відносні інтенсивності порошкової рентгенівської дифрактограми. Тому, попередню обробку зразка не застосовували. Фахівець у даній галузі техніки здатний ідентифікувати морфологію твердого стану відомої речовини за допомогою порошкових рентгенівських дифрактограм. Ця ідентифікація може бути виконана просто шляхом визначення положення (кута дифракції) кількох інтенсивних сигналів рентгенівської дифракції. Така ідентифікація дуже важлива для тестування морфології активного інгредієнта у твердих лікарських формах, оскільки в процесі виготовлення твердої готової лікарської форми можуть відбуватися зміни морфології внаслідок переходу кристалічного активного інгредієнта або в іншу кристалічну модифікацію, або в аморфну форму. 5 UA 109560 C2 5 10 15 20 25 30 Кут дифракції, відповідний самому інтенсивному сигналу дифракції кристалічної форми V цинкової солі розувастатину (2:1), дорівнює 4,764 градусам 2Θ. Даний сигнал рентгенівської дифракції можна найзручніше використовувати для ідентифікації кристалічної форми I цинкової солі розувастатину (2:1). На дифрактограмі кристалічної форми V цинкової солі розувастатину (2:1) кути дифракції дифракційних ліній, де відносна інтенсивність перевищує 50 %, рівні 4,764 і 15,371 градусам 2Θ. Кути дифракції, що належать сигналам дифракції кристалічної форми V цинкової солі розувастатину (2:1), що має відносну інтенсивність щонайменше 20 %, мають такі значення: 4,764, 5,873, 10,960, 12,224, 13,118, 15,371, 17,995, 19,394, 24,235 градусів 2Θ. Кристалічна форма V цинкової солі розувастатину (2:1) за даним винаходом може містити від 1 до 10, переважно від 1 до 6 молярних еквівалентів води, або у формі води гідратів, води канальних гідратів або фізично адсорбованої води. Відповідно до другого аспекту даного винаходу запропоновано спосіб отримання кристалічної форми V цинкової солі розувастатину (2:1) формули (I). Протягом усього даного опису вираз "спирт, який містить від 1 до 6 атомів вуглецю", означає прямоланцюгові або розгалужені насичені аліфатичні спирти, що мають від 1 до 6 атомів вуглецю, наприклад, метанол, етанол, 2-пропанол, 1-пропанол, 1 - бутанол, 2-бутанол і т. п. Спосіб отримання кристалічної форми V цинкової солі розувастатину (2:1) формули (I) включає перемішування цинкової солі розувастатину (2:1) кристалічної форми III в 2-100кратному, переважно 2-50-кратному, найбільш переважно 2,5-25-кратному надлишку води, або в суміші води і спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40 °C, переважно від 10 до 30 °C, протягом періоду від 1 до 168 годин, переважно від 4 до 120 годин, в атмосфері інертного газу. Продукт виділяють і при бажанні висушують при температурі від 0 до 30 °C в інертній атмосфері. Відповідні інертні гази включають, але не обмежуються азотом і аргоном. Вихідною речовиною за вищезазначеним способом одержання вищеописаної форми V цинкової солі розувастатину (2:1) є кристалічна форма III цинкової солі розувастатину (2:1). Зазначена кристалічна форма характеризується даними рентгенівської дифракції таблиці 2, і рентгенівська дифрактограма зазначеної форми представлена на фіг. 2. Вимірювання рентгенівської дифракції виконували в умовах, ідентичних описаним вище умовам для кристалічної форми V. Кристалічна форма III цинкової солі розувастатину (2:1) може бути одержана, починаючи з аморфної цинкової солі розувастатину. Таблиця 2 Положення дифракційних ліній (± 0,2°) і їх відносна інтенсивність (вище 5 %) у кристалічній формі III цинкової солі розувастатину (2:1) Інтенсивність Інтенсивність Пік № 2Θ d (Ǻ) Пік № 2Θ d (Ǻ) (%) (%) 1 6,259 14,11083 90,2 21 20,462 4,33695 53,2 2 9,400 9,40131 36 22 21,383 4,15201 12,6 3 10,982 8,04997 62,4 23 21,846 4,06507 47,1 4 11,318 7,81202 15,4 24 22,302 3,98297 58,1 5' 12,565 7,03939 12,1 25 22,779 3,90066 39,5 6 13,414 6,59524 92,8 26 23,232 3,82568 35,6 7 14,437 6,13017 5,4 27 24,055 3,69663 10,4 8 14,806 5,97820 19,6 28 24,690 3,60288 17,4 9 15,48 5,71948, 20,5 29 25,388 3,50540 16,9 10 15,776 5,61288 18,7 30 26,451 3,36697 33,9 11 16,059 5,51479 15,4 31 27,178 3,27846 22,5 12 16,401 5,40024 50,1 32 27,603 3,22900 20,6 13 16,623 5,32865 44,8 33 28,472 3,13240 16,2 14 16,926 5,23406 43,6 34 29,938 2,98221 14,8 15 17,572 5,04319 15,4 35 30,180 2,95883 16,7 16 17,894 4,95294 15,4 36 31,311 2,85449 21,8 17 18,338 4,83405 48,9 37 31,861 2,80646 25,7 18 18,600 4,76648 50,4 38 32,695 2,73674 14,6 19 18,961 4,67672 100 39 33,177 2,69812 13,2 20 19,409 4,56959 58,2 40 34,134 2,62459 8 6 UA 109560 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кристалічна форма III цинкової солі розувастатину (2:1) може бути ідентифікована за допомогою її головного (основного) показника відбиття при 18,961 градусах 2Θ або за допомогою її характеристичних показників відображення, що перевищують 70 % відносної інтенсивності при 6,259, 13,414 і 18,961 градусах 2Θ. Характеристичні показники відображення кристалічної форми III цинкової солі розувастатину (2:1), що показує відносну інтенсивність більше 50 %, виявлені при 6,259, 10,982, 13,414, 16,401, 18,600, 18,961, 19,409, 20,462 і 22,302 градусах 2Θ. Кристалічна форма III цинкової солі розувастатину (2:1) демонструє додаткові показники відображення, що має відносну інтенсивність вище 20 %, при 6,259, 9,400, 10,982, 13,414, 15,480, 16,401, 16,623, 16,926, 18,338, 18,600, 18,961, 19,409, 20,462, 21,846, 22,302, 22,779, 23,232, 26,451, 27,178, 27,603, 31,311 і 31,861 градусах 2Θ. Наступними об'єктами даного винаходу є способи отримання кристалічної форми III цинкової солі розувастатину (2:1). Перший спосіб отримання кристалічної форми III цинкової солі розувастатину (2:1) включає перемішування аморфної цинкової солі розувастатину (2:1) при температурі від -10 до +40 °C, переважно від 0 до 10 °C, в 5-100-кратному, переважно 20-60-кратному надлишку маси води, чи у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, можливо, містить 0,0001-0,01, переважно 0,005-0,01 молярних еквівалентів гідроксиду натрію, що розраховане на молярну кількість цинкової солі розувастатину формули (I), протягом періоду від 1 до 48 годин, переважно від 2 до 8 годин, найбільш переважно протягом 4 годин, фільтрування суспензії і можливо промивання і висушування продукту. Другий спосіб отримання кристалічної форми III цинкової солі розувастатину (2:1) полягає в перемішуванні аморфної цинкової солі розувастатину (2:1) у 5-100-кратному, переважно 20-60кратному надлишку маси води, чи у суміші води і спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40 °C, переважно від 0 до 10 °C, протягом періоду від 1 до 48 годин, переважно від 2 до 8 годин, найбільш переважно протягом 4 годин, фільтруванні продукту, повторенні перемішування в 5-100-кратному, переважно 20-60-кратному надлишку маси води, чи у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40° C, переважно від 0 до 10 °C, протягом періоду від 1 до 48 годин, переважно від 2 до 8 годин, найбільш переважно протягом 4 годин, фільтруванні суспензії і можливо промиванні і висушуванні кристалічної форми III цинкової солі розувастатину (2:1). Згідно з ще одним іншим аспектом даного винаходу запропоновано спосіб отримання аморфної цинкової солі розувастатину (2:1), що включає отримання розчину трет-бутіламінової солі розувастатину у воді чи у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, додавання в зазначений розчин водного розчину цинкової солі, переважно сульфату цинку, при кімнатній температурі, і змішування, і швидке змішування і перемішування зазначеного розчину з 2-50-кратним, переважно 4-10-кратним надлишком об'єму води, або суміші води і спирту, що містить від 1 до 6 атомів вуглецю, охолодження до температури від -10 до +20 °C, переважно від 0 до 10 °C. Відповідно до іншого аспекту даного винаходу запропоновані лікарські засоби, що містять кристалічну форму V цинкової солі розувастатину (2:1) формули (I). Такі лікарські засоби можуть також містити один або більше ніж один відомий носій або допоміжний агент. Лікарський засіб згідно з даним аспектом винаходу в більшості випадків містить від 0,1 до 95 мас. % кристалічної форми V фармацевтично активного інгредієнта формули (I). Частка активного інгредієнта переважно становить від 5 до 75 мас. %. Лікарські засоби згідно з даним винаходом можна вводити перорально (наприклад, порошки, таблетки, таблетки з покриттям або плівковим покриттям, капсули, мікрокапсули, гранули, пелети, драже, розчини, суспензії або емульсії), парентерально (наприклад, у формі внутрішньовенних, внутрішньом'язових, підшкірних або інтраперитонеальних ін'єкцій або у вигляді інфузії), ректально (наприклад, у формі супозиторіїв) або місцево (наприклад, у вигляді кремів, мазей або пластирів). Тверді, напівтверді або рідкі лікарські засоби згідно з даним винаходом можуть бути отримані згідно способам, відомим з попереднього рівня техніки. Лікарські засоби, придатні для перорального введення, що містять кристалічну форму V цинкової солі розувастатину (2:1) формули (I), можуть перебувати у твердій формі, яка може містити, крім активного інгредієнта, один або більш ніж один носій або наповнювач (наприклад, лактозу, глюкозу, крохмаль, фосфат кальцію, мікрокристалічна целюлоза), сполучна речовина (наприклад, желатин, сорбіт, полівінілпіролідон), розпушувач (наприклад, кроскармелоза, натрієву сіль карбоксиметилцелюлози, кросповідон), допоміжні агенти для таблетування (наприклад, стеарат магнію, тальк, поліетиленгліколь, кремнезем або діоксид кремнію) або поверхнево-активні речовини (наприклад, лаурилсульфат натрію). 7 UA 109560 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рідкі лікарські засоби, призначені для перорального застосування, що містять кристалічну форму V цинкової солі розувастатину (2:1) за даним винаходом, можуть перебувати у вигляді розчинів, суспензій або емульсій, і можуть містити суспендуючі агенти (наприклад, желатин, карбоксиметилцеллюлозу), емульгуючі агенти (наприклад, сорбітан моноолеат), розчинники або рідкі носії (наприклад, воду, масла, гліцерин, пропіленгліколь, етанол), агенти, регулюючі pH (наприклад, ацетатні, фосфатні, цитратні буфери) або стабілізують агенти (наприклад, метил-4гідроксибензоат), змішані з активним інгредієнтом. Лікарські засоби, що містять кристалічну форму V сполуки формули (I), призначені для парентерального застосування, звичайно являють собою стерильні ізотонічні водні розчини або суспензії, які можуть містити агент, регулюючий pH, і консерванти в якості допоміжних агентів. Лікарські засоби, що знаходяться у вигляді напівтвердих препаратів, що містять кристалічну форму V сполуки формули (I), такі як супозиторії, містять активний інгредієнт, гомогенно диспергований в напівтвердої основі (наприклад, в поліетиленгліколь, олії какао). Лікарські засоби, що містять кристалічну форму V цинкової солі розувастатину (2:1) за даним винаходом, можуть бути отримані у вигляді препаратів з модифікованим вивільненням, контрольованим вивільненням або пролонгованим вивільненням. Таким чином, можна досягати тривалого ефекту, або можна збільшувати інтервали між введенням лікарського засобу. Лікарські засоби з модифікованим вивільненням, контрольованим вивільненням або пролонгованим вивільненням можуть бути отримані згідно зі способами, що відомі з попереднього рівня техніки. Відповідно до іншого аспекту даного винаходу запропоновано спосіб виготовлення лікарських засобів, що містять кристалічну форму V цинкової солі розувастатину (2:1) формули (I), який можливо включає змішування кристалічної форми V цинкової солі розувастатину (2:1) з фармацевтично прийнятним носієм і допоміжним агентом і перетворення отриманого таким шляхом продукту у фармацевтичну лікарську форму, використовуючи способи, відомі в даній галузі техніки. Відповідні фармацевтично прийнятні носії та допоміжні агенти, а також способи отримання препаратів описані на попередньому рівні техніки (Remington's Pharmaceutical th Sciences, 18 Edition, Mack Publishing Co., Easton, USA, 1990). Лікарські засоби, що містять кристалічну форму V сполуки формули (I), переважно містять активний інгредієнт в стандартних лікарських формах. Відповідно до іншого аспекту даного винаходу запропоновано застосування кристалічної форми V цинкової солі розувастатину (2:1) формули (I) для лікування захворювань або розладів, обумовлених метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дислипідемію і атеросклероз. Відповідно до іншого аспекту даного винаходу запропоновано спосіб лікування захворювань або розладів, обумовлених метаболізмом ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дислипідемію і атеросклероз, який включає введення пацієнту, що потребує такого лікування, ефективної кількості кристалічної форми V цинкової солі розувастатину (2:1) формули (I). Подібно формі V цинкової солі розувастатину (2:1), сіль форми III можна застосовувати в якості активного інгредієнта фармацевтичних препаратів. Інші аспекти даного винаходу продемонстровані наведеними нижче прикладами без будьякого обмеження винаходу зазначеними прикладами. Приклад 1 Аморфна цинкова сіль (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфоніл-метиламіно)піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 50,0 г (0,09 моль) трет-бутіламінової солі 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфонілметиламіно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти розчиняють в суміші 500 3 3 см етилацетату і 153 см дистильованої води при перемішуванні при 25 °C. В отриману таким 3 шляхом двошарову суміш додають по краплях 55 см 2,23 M розчину сульфату цинку (відповідного 0,122 моль ZnSO4*H2O) протягом 15 хвилин при температурі 25 °C. Після 1годинного інтенсивного перемішування шари розділяють, органічний шар двічі промивають 100 3 3 см 2,23 M розчину сульфату цинку кожен раз і, нарешті, 100 см води. (Під час кінцевої стадії 3 промивання водою додають 12 см етанолу, що сприяє поділу шарів). Висушування органічного шару виконують шляхом азеотропної перегонки у вакуумі при температурі 50 °C і при тиску 50-70 мбар (приблизно 5,0-7,0 кПа) згідно наступного способу. На першій стадії відганяють майже вся кількість розчинника. Отриманий таким шляхом залишок має масу 102,0 г і виглядає як масло, що містить слідові кількості твердих речовин. 3 Даний залишок розчиняють в 500 см етилацетату при температурі приблизно 30 °C, і розчинник повторно відганяють до одержання густої суспензії, що містить тверду кристалічну 8 UA 109560 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 фазу. Залишок, що має масу 154 г, розчиняють в 300 см етилацетату, і суміш перемішують до гомогенності, і розчинник випарюють до утворення густої суспензії. Цю суспензію, що має масу 3 182 г, змішують з 200 см етилацетату і ретельно перемішують. Суміш фільтрують, фільтрат 3 ретельно відокремлюють шляхом відсмоктування і суспендують на фільтрі три рази 90 см етилацетату кожен раз. Продукт обережно укладають шарами в вакуумну сушильну шафу, захищену від світла, і висушують протягом 24 годин при 25 °C при тиску 5 мбар (приблизно 0,5 кПа). Продукт подрібнюють в порошок і повторно висушують протягом 6 годин при температурі 50 °C і при тиску 5 мбар (приблизно 0,5 кПа). Таким чином, отримують 41,74 г (90 %) продукту. ІК (KBr): 3425 (широкий), 2969, 1605, 1547, 1510, 1381, 1230, 1197, 1156, 965, 901, 844, 811, -1 776, 576, 567, 520 см . Точка плавлення: починає плавитися при 137 °C. Вода: 0,85 %. Приклад 2 Аморфна цинкова сіль (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфоніл-метиламіно)піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 3 12,4 г трет-бутіламіновой солі розувастатину суспендується в суміші 40 см 2-пропанолу і 5 3 см води. До цієї суспензії додають розчин 4,4 г ZnSO 4 і 15 мл води, потім утворюється майже 3 прозорий розчин. Цей розчин додають до 320 см води при 4-6 °C протягом 5 хвилин. Після 0,5годинного періоду перемішування при 4-6 °C розчин фільтрують, потім осад на фільтрі висушують при 25 °C у вакуумі в інертному атмосфері. Приклад 3 Аморфна цинкова сіль (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфоніл-метиламіно)піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 10,0 г аморфної або кристалічної форми I цинкової солі розувастатину (2:1) розчиняють в 3 3 3 суміші 35 см 2-пропанолу і 15 см води. Цей розчин додають до 320 см води при 4-6 °C протягом 5 хвилин. Після 0,5-годинного періоду перемішування при 4-6 °C розчин фільтрують, потім осад на фільтрі висушують при 25 °C у вакуумі в інертному атмосфері. Приклад 4 Аморфна цинкова сіль (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфоніл-метиламіно)піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 3 10,0 г трет-бутіламінової солі розувастатину розчиняють в 600 см води. Розчин охолоджують до 0-5 °C, потім до охолодженого розчину додають розчин 3,6 г ZnSO 4 і 15 мл води. Суспензію перемішують протягом 0,5 годин при 4-6 °C, потім її фільтрують, осад на фільтрі висушують при 25 °C у вакуумі в інертному атмосфері. Приклад 5 Аморфна цинкова сіль (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфоніл-метиламіно)піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 3 10,0 г трет- бутіламінової солі розувастатину розчиняють в суміші 36 см 2-пропанолу і 340 3 см води. Розчин охолоджують до 0-5 °C, потім до охолодженого розчину додають розчин 3,6 г ZnSO4 і 15 мл води. Суспензію перемішують протягом 0,5 годин при 4-6 °C, потім її фільтрують, осад на фільтрі висушують при 25 °C у вакуумі в інертному атмосфері. Приклад 6 Кристалічна форма III цинкової солі (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфонілметиламіно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 1,0 г (0,97 ммоль) аморфної цинкової солі розувастатину (2:1), отриманої згідно Прикладу 1, 3 додають до розчину 0,2 мг (0,005 ммоль) гідроксиду натрію в 40 см дистильованої води. Суміш перемішують протягом 4 годин при температурі 40 °C в атмосфері аргону, фільтрують і промивають розчином, що мають таку ж композицію, як суспендуючий агент. Вологий осад на фільтрі, отриманий таким шляхом, повторно перемішують протягом 4 годин на таких же умовах, як і в перший період. Суспензію фільтрують, промивають розчином, що мають таку ж композицію, як суспендуючий розчин, і висушують у вакуумній сушильній шафі при температурі від 25 до 27 °C при тиску 5 мбар (0,5 кПа) протягом 24 годин. Таким чином, отримують 0,75 г (75 %) продукту, що має порошкову рентгенівську дифрактограму, показану на фіг. 2. Точка плавлення: 110-120 °C. Чистота (за ВЕРХ (Високоефективна рідинна хроматографія)): 99,71 %. Вміст цинку: 6,25 % (98,4 % теоретичного). Приклад 7 Кристалічна форма III цинкової солі (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфонілметиламіно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 9 UA 109560 C2 5 10 15 20 25 10,0 г аморфної цинкової солі розувастатину (2:1), отриманої згідно Прикладу 1, 3 суспендується в 600 см води протягом 24 годин при 4-6 °C. Потім її фільтрують, і осад на фільтрі висушують при 25 °C у вакуумі в інертній атмосфері. Приклад 8 Кристалічна форма III цинкової солі (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфонілметиламіно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 10,0 г аморфної цинкової солі розувастатину (2:1), отриманої згідно Прикладу 1, 3 3 суспендують в суміші 36 см 2-пропанолу і 350 см води протягом 24 годин при 4-6 °C. Потім її фільтрують, і осад на фільтрі висушують при 25 °C у вакуумі в інертній атмосфері. Приклад 9 Кристалічна форма V цинкової солі (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфонілметиламіно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 2,0 г цинкової солі розувастатину (2:1), поліморфа форми III, розчиняють у воді при 25 °C, і суміш перемішують протягом 24 годин в атмосфері аргону. Потім суміш охолоджують до 3 °C, і перемішування продовжують додатково протягом 96 годин. Твердий продукт фільтрують і висушують при 25 °C в атмосфері аргону. Приклад 10 Кристалічна форма V цинкової солі (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфонілметиламіно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 3 2, 0 г цинкової солі розувастатину (2:1), поліморфа форми III, суспендується в 7 см 23 пропанолу і 70 см води при 25 °C, і суміш перемішують протягом 24 годин в атмосфері аргону. Твердий продукт фільтрують і висушують при 25 °C у вакуумі в інертній атмосфері. Приклад 11 Кристалічна форма V цинкової солі (2:1) 7-[4-(4-фторфеніл)-6-ізопропіл-2-(метан-сульфонілметиламіно)-піримідин-5-іл]-(3R, 5S)-дигідрокси-гепт-6-енової кислоти 3 2,0 г цинкової солі розувастатину (2:1), поліморфа форми III, суспендується в 20 см води при 25 °C, і суміш перемішують протягом 24 годин в атмосфері аргону. Потім суміш охолоджують до 3 °C, і перемішування продовжують додатково протягом 96 годин. Твердий продукт фільтрують і висушують при 25 °C у вакуумі в інертній атмосфері. 30 ФОРМУЛА ВИНАХОДУ 35 1. Кристалічна форма V цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигeпт-6eнової кислоти] формули (І) HO COO OH F Zn2+ N O O S N N 2 40 , (I) яка відрізняється тим, що рентгенівські дифракційні лінії виміряні з використанням випромінювання СuK, з наступним кутом дифракції 2 (± 0,2°2): 4,746 градуса. 2. Кристалічна форма V цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6енової кислоти] формули (І), яка відрізняється тим, що рентгенівські дифракційні лінії виміряні з використанням випромінювання СuK, з наступними кутами дифракції 2 (± 0,2°2): 4,746 і 15,371 градуса. 10 UA 109560 C2 3. Кристалічна форма V цинкової солі розувастатину (2:1) за п. 1 або за п. 2, яка відрізняється тим, що має порошкову рентгенівську дифрактограму, представлену на фіг. 1, і наступні лінії рентгенівської дифракції, виміряні за допомогою випромінювання СuK: 2 [°] d-значення [Å] 4,764 5,873 8,941 9,547 10,960 11,773 12,224 12,870 13,118 13,979 14,401 15,371 15,997 16,357 16,852 17,641 17,995 18,783 19,394 19,977 20,741 20,959 21,700 22,263 22,736 23,367 23,659 24,235 24,716 25,245 26,034 26,485 27,028 28,016 28,667 29,662 30,967 32,668 33,032 33,342 33,989 34,452 18,5324 15,0352 9,8823 9,2561 8,0664 7,5111 7,2347 6,8733 6,7438 6,3303 6,1454 5,7599 5,5359 5,4148 5,2570 5,0235 4,9256 4,7206 4,5733 4,4411 4,2792 4,2352 4,0922 3,9899 3,9080 3,8038 3,7575 3,6695 3,5992 3,5250 3,4199 3,3627 3,2964 3,1824 3,1115 3,0093 2,8854 2,7390 2,7096 2,6851 2,6355 2,6011 Відносна інтенсивність [%] 100,0 20,9 11,1 12,5 20,7 19,0 20,6 8,8 21,1 13,9 9,8 61,6 13,2 10,4 8,0 6,9 29,6 5,8 31,9 9,2 5,1 4,6 12,3 17,5 9,7 14,9 12,9 29,8 10,5 19,3 9,5 8,0 12,9 8,3 8,0 8,6 9,2 6,9 8,0 7,2 5,6 6,8 5 10 4. Цинкова сіль розувастатину (2:1), яка відрізняється тим, що вона має порошкову рентгенівську дифрактограму, представлену на фіг. 1, виміряну з використанням випромінювання СuK. 5. Цинкова сіль розувастатину (2:1) за будь-яким з пп. 1-3, яка відрізняється тим, що містить від 1 до 10 моль, переважно від 1 до 6 моль води. 6. Суміш кристалічної цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 з аморфною цинковою сіллю розувастатину (2:1). 7. Спосіб одержання кристалічної форми V цинкової солі розувастатину (2:1), який відрізняється тим, що включає перетворення аморфної цинкової солі розувастатину (2:1) в 11 UA 109560 C2 5 10 15 20 25 30 35 40 45 50 55 60 кристалічну форму III цинкової солі розувастатину (2:1), перемішування отриманого таким шляхом продукту в 2-100-кратному, переважно 2-50-кратному, найбільш переважно 2,5-25кратному надлишку води, або в суміші води і спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40 °C, переважно від 10 до 30 °C, протягом періоду від 1 до 168 годин, переважно від 4 до 120 годин, виділення і можливо висушування продукту. 8. Спосіб одержання кристалічної форми V цинкової солі розувастатину (2:1) формули (І), який відрізняється тим, що включає перемішування кристалічної форми III цинкової солі розувастатину (2:1) в 2-100-кратному, переважно 2-50-кратному, найбільш переважно 2,5-25кратному надлишку води, або в суміші води і спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40 °C, переважно від 10 до 30 °C, протягом періоду від 1 до 168 годин, переважно від 4 до 120 годин, виділення і можливо висушування продукту. 9. Спосіб за п. 7 або 8, який відрізняється тим, що перемішування, виділення і можливе висушування виконують в атмосфері інертного газу. 10. Спосіб за п. 7 або 8, який відрізняється тим, що висушування виконують при температурі від 0 до 30 °C. 11. Лікарські засоби, що містять кристалічну форму V цинкової солі розувастатину (2:1) за будьяким з пп. 1-4 в терапевтично ефективній кількості, можливо в суміші фармацевтично прийнятного носія. 12. Спосіб одержання лікарських засобів за п. 11, який відрізняється тим, що включає можливе змішування кристалічної форми V цинкової солі розувастатину за будь-яким з пп. 1-4 з фармацевтично прийнятним носієм і переведення у фармацевтичну лікарську форму. 13. Кристалічна форма V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 для застосування в терапії. 14. Застосування кристалічної форми V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 для лікування метаболізму ліпідів, включаючи гіперхолестеринемію, гіперліпідемію, дисліпідемію або атеросклероз. 15. Застосування кристалічної форми V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4 для лікування розладів метаболізму ліпідів, що включають гіперхолестеринемію, гіперліпідемію, дисліпідемію або атеросклероз. 16. Спосіб лікування розладів метаболізму ліпідів, що включають гіперхолестеринемію, гіперліпопротеїнемію, дисліпідемію або атеросклероз, де даний спосіб включає введення пацієнту, що потребує такого лікування, лікарського засобу, що містить терапевтично ефективну кількість кристалічної форми V цинкової солі розувастатину (2:1) за будь-яким з пп. 1-4. 17. Кристалічна форма III цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6енової кислоти] формули (І), яка відрізняється тим, що рентгенівські дифракційні лінії виміряні з використанням випромінювання СuK, з наступним кутом дифракції 2 (± 0,2°2): 18,961 градуса. 18. Кристалічна форма III цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6енової кислоти] формули (І), яка відрізняється тим, що рентгенівські дифракційні лінії виміряні з використанням випромінювання СuK, з наступними кутами дифракції 2 (± 0,2°2): 6,259, 13,414 і 18,961 градуса. 19. Кристалічна форма III цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6енової кислоти] формули (І), яка відрізняється тим, що рентгенівські дифракційні лінії виміряні з використанням випромінювання СuK, з наступними кутами дифракції 2 (± 0,2°2): 6,259; 10,982; 13,414; 16,401; 18,600; 18,961; 19,409; 20,462 і 22,302 градуса. 20. Кристалічна форма III цинкової солі розувастатину (2:1) [напівцинкової солі (+)-7-[4-(4фторфеніл)-6-ізопропіл-2-(метансульфонілметиламіно)-піримідин-5-іл]-(3R,5S)-дигідроксигепт-6енової кислоти] формули (І), яка відрізняється тим, що рентгенівські дифракційні лінії виміряні з використанням випромінювання СuK, з наступними кутами дифракції 2 (± 0,2°2): 6,259; 9,400; 10,982; 13,414; 15,480; 16,401; 16,623; 16,926; 18,338; 18,600; 18,961; 19,409; 20,462; 21,846; 22,302; 22,779; 23,232; 26,451; 27,178; 27,603; 31,311 і 31,861 градуса. 21. Кристалічна форма III цинкової солі розувастатину (2:1), яка відрізняється тим, що вона має порошкову рентгенівську дифрактограму, представлену на фіг. 2, виміряну з використанням випромінювання СuK. 22. Кристалічна форма III цинкової солі розувастатину (2:1), яка відрізняється тим, що має характеристичні показники відображення в порошковій рентгенівській дифрактограмі, виміряні з використанням випромінювання СuK, у відповідності з наступною таблицею: 12 UA 109560 C2 2 6,259 9,400 10,982 11,318 12,565 13,414 14,437 14,806 15,48 15,776 16,059 16,401 16,623 16,926 17,572 17,894 18,338 18,600 18,961 19,409 5 10 15 20 d (Å) 14,11083 9,40131 8,04997 7,81202 7,03939 6,59524 6,13017 5,97820 5,71948 5,61288 5,51479 5,40024 5,32865 5,23406 5,04319 4,95294 4,83405 4,76648 4,67672 4,56959 Відносна інтенсивність (%) 90,2 36 62,4 15,4 12,1 92,8 5,4 19,6 20,5 18,7 15,4 50,1 44,8 43,6 15,4 15,4 48,9 50,4 100 58,2 2 d (Å) 20,462 21,383 21,846 22,302 22,779 23,232 24,055 24,690 25,388 26,451 27,178 27,603 28,472 29,938 30,180 31,311 31,861 32,695 33,177 34,134 4,33695 4,15201 4,06507 3,98297 3,90066 3,82568 3,69663 3,60288 3,50540 3,36697 3,27846 3,22900 3,13240 2,98221 2,95883 2,85449 2,80646 2,73674 2,69812 2,62459 Відносна інтенсивність (%) 53,2 12,6 47,1 58,1 39,5 35,6 10,4 17,4 16,9 33,9 22,5 20,6 16,2 14,8 16,7 21,8 25,7 14,6 13,2 8 23. Спосіб одержання кристалічної форми III цинкової солі розувастатину (2:1), який відрізняється тим, що включає перемішування аморфної цинкової солі розувастатину (2:1) при температурі від -10 до +40 °C, переважно від 0 до 10 °C в 5-100-кратному, переважно 20-60кратному надлишку маси води, або у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, можливо містить 0,0001-0,01, переважно 0,005-0,01 молярних еквівалентів гідроксиду натрію, розраховане на молярну кількість цинкової солі розувастатину формули (І), протягом періоду від 1 до 48 годин, переважно від 2 до 8 годин, найбільш переважно протягом 4 годин, фільтрування суспензії, можливе повторення перемішування в 5-100-кратному, переважно 2060-кратному надлишку маси води, або у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, при температурі від -10 до +40 °C, переважно від 0 до 10 °C, протягом періоду від 1 до 48 годин, переважно від 2 до 8 годин, найбільш переважно протягом 4 годин, і можливо промивання і висушування продукту. 24. Спосіб одержання аморфної цинкової солі розувастатину (2:1), який відрізняється тим, що включає забезпечення розчину трет-бутиламінової солі розувастатину у воді або у суміші води та спирту, що містить від 1 до 6 атомів вуглецю, додавання в зазначений розчин водного розчину солі цинку, переважно сульфату цинку, при кімнатній температурі, змішування і перемішування зазначеного розчину з 2-50-кратним, переважно 4-10-кратним надлишком об'єму води, охолодженої до температури від -10 до +20 °C, переважно від 0 до 10 °C. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline pharmaceutically active ingredients
Автори англійськоюMarkovits, Imre, Jurak, Ferenc, Kovanyine Lax, Gyorgyi, Hamori, Csaba, Havasi, Balazs, Sipos, Eva, Volk, Balazs, Runge, Zsolt, Fodorne Kocsmar, Krisztina, Lukacs, Gyula, Kataine Fadgyas, Katalin, Mezovari, Monika
Автори російськоюМарковитш Имре, Юрак Ференц, Каваньйине Лакс Дьёрдь, Хамори Чаба, Хаваши Балаж, Шипош Ева, Волк Балаж, Рунге Жолт, Фодорне Кочмар Кристина, Лукач Гиула, Катаине Фаддьяш Каталин, Мезевари Моника
МПК / Мітки
МПК: C07D 239/42
Мітки: фармацевтично, форми, активні, кристалічні
Код посилання
<a href="https://ua.patents.su/15-109560-kristalichni-farmacevtichno-aktivni-formi.html" target="_blank" rel="follow" title="База патентів України">Кристалічні фармацевтично активні форми</a>
Попередній патент: Пристрій для підготовки суцільнокерамічних мікропротезів до фіксації
Наступний патент: Спосіб спільного одержання бензину з низьким октановим числом та бензину з високим октановим числом
Випадковий патент: Спосіб отримання насіння стевії (stevia rebaudiana bertoni)