Фармацевтичні композиції, що містять 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1н-бензімідазол-2-іл]-1н-хінолін-2-ону лактату моногідрат
Формула / Реферат
1. Фармацевтична композиція для перорального введення, що містить:
a) внутрішньогранулярну фaзy, яка включає:
4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Н-бензімідазол-2-іл]-1Н-хінолін-2-ону монолактату моногідрат у кількості від 40 до 65 % мас.,
один або більше наповнювачів, вибраних з групи, яка включає кондитерський цукор, пресований цукор, декстрат, декстрин, декстрозу, лактозу, маніт, мікрокристалічну целюлозу, порошкоподібну целюлозу, сорбіт, сахарозу, дикальційфосфат, крохмаль, прежелатинізований крохмаль, тальк та їх комбінації у кількості від 30 до 60 % мас.,
розпушувач, вибраний з групи, яка включає крохмаль, глину, целюлозу, альгінат, смолу, поперечно зшитий полімер, полісахарид сої та їх комбінації у кількості від 1 до 15 % мас.,
речовину, що сприяє ковзанню та/або змащувальну речовину, вибрану з групи, яка включає колоїдний діоксид кремнію, трисилікат магнію, крохмаль, тальк, трьохосновний фосфат кальцію, стеарат магнію, стеарат алюмінію, стеарат кальцію, карбонат магнію, оксид магнію, поліетиленгліколь, порошкову целюлозу, мікрокристалічну целюлозу та їх комбінації у кількості від 0,1 до 10 % мас., та
b) позагранулярну фазу, яка включає:
один або більше наповнювачів, які визначені вище, у кількості від 3 до 5 % мас.,
розпушувач, який визначений вище, у кількості від 1 до 5 % мас.,
речовину, що сприяє ковзанню, та/або змащувальну речовину, яка визначена вище, у кількості від 1 до 3 % мас.,
причому:
зазначена внутрішньогранулярна фаза виготовлена за допомогою ущільнення валками
та
зазначена фармацевтична композиція одержана методом сухої грануляції.
2. Фармацевтична композиція за п. 1, у якій один або більше наповнювачів вибрані з переліку, що включає мікрокристалічну целюлозу, маніт або їх комбінації.
3. Фармацевтична композиція за п. 1 або 2, де зазначена фармацевтична композиція представлена у вигляді капсули і де наповнювач являє собою маніт.
4. Фармацевтична композиція за п. 1, що містить
4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Н-бензімідазол-2-іл]-1Н-хінолін-2-ону монолактату моногідрат у кількості від 40 до 65 % мас.,
речовину, що сприяє ковзанню, та/або змащувальну речовину, які являють собою діоксид кремнію та/або стеарат магнію в кількості від 0,1 до 10 % мас.,
де кількості за масою основуються на загальній масі композиції.
5. Фармацевтична композиція за будь-яким з пп. 1-4, у якій розпушувач присутній у внутрішньогранулярній фазі у кількості від 5 до 8 % мас.
6. Фармацевтична композиція за будь-яким з пп. 1-5, у якій речовина, що сприяє ковзанню, міститься в кількості від 0,5 до 2 % мас., а змащувальна речовина міститься в кількості від 1 до 4 % мас. у внутрішньогранулярній та/або позагранулярній фазі.
7. Спосіб одержання капсули, що містить композицію, як вона заявлена у будь-якому з пп. 1-6, у якому:
(і) готують суміш для внутрішньогранулярної фази з 4-аміно-5-фтор-3-[6-(4-мeтилпiпepaзин-l-iл)-1H-бензiмiдaзoл-2-iл]-lH-xiнoлiн-2-oнy моногідрату монолактату,
одного або більше наповнювача (ів), розпушувача та речовини, що сприяє ковзанню, та/або
змащувальної речовини,
(іі) просівають суміш зі стадії (і),
(ііі) змащують суміш зі стадії (іі) змащувальною речовиною,
(iv) обробляють суміш зі стадії (ііі) за допомогою ущільнення валками,
(v) об'єднують мелений гранулят зі стадії (iv) з розпушувачем і речовиною, що сприяє ковзанню,
(vi) змащують змащувальною речовиною, і
(vii) інкапсулюють суміш зі стадії (vi).
8. Спосіб одержання таблетки, що містить композицію, як вона заявлена у будь-якому з пп. 1-6, у якому:
(і) готують суміш для внутрішньогранулярної фази з 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Н-бензімідазол-2-іл]-1Н-хінолін-2-ону моногідрату монолактату,
одного або більше наповнювача(ів), розпушувача, та речовини, що сприяє ковзанню, та/або змащувальної речовини,
(іі) просівають суміш,
(ііі) додають змащувальну речовину, як визначена вище,
(iv) обробляють суміш зі стадії (ііі) шляхом ущільнення валками,
(v) об'єднують мелений гранулят зі стадії (iv) з речовиною, що сприяє ковзанню, наповнювачем і розпушувачем, та змішують,
(vi) змащують змащувальною речовиною, і
(vii) формують таблетки шляхом пресування композиції зі стадії (vi).
9. Композиція за будь-яким з пп. 1-6, у якій лактат 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Н-бензімідазол-2-іл]-1Н-хінолін-2-ону представлений у формі НА.
Текст
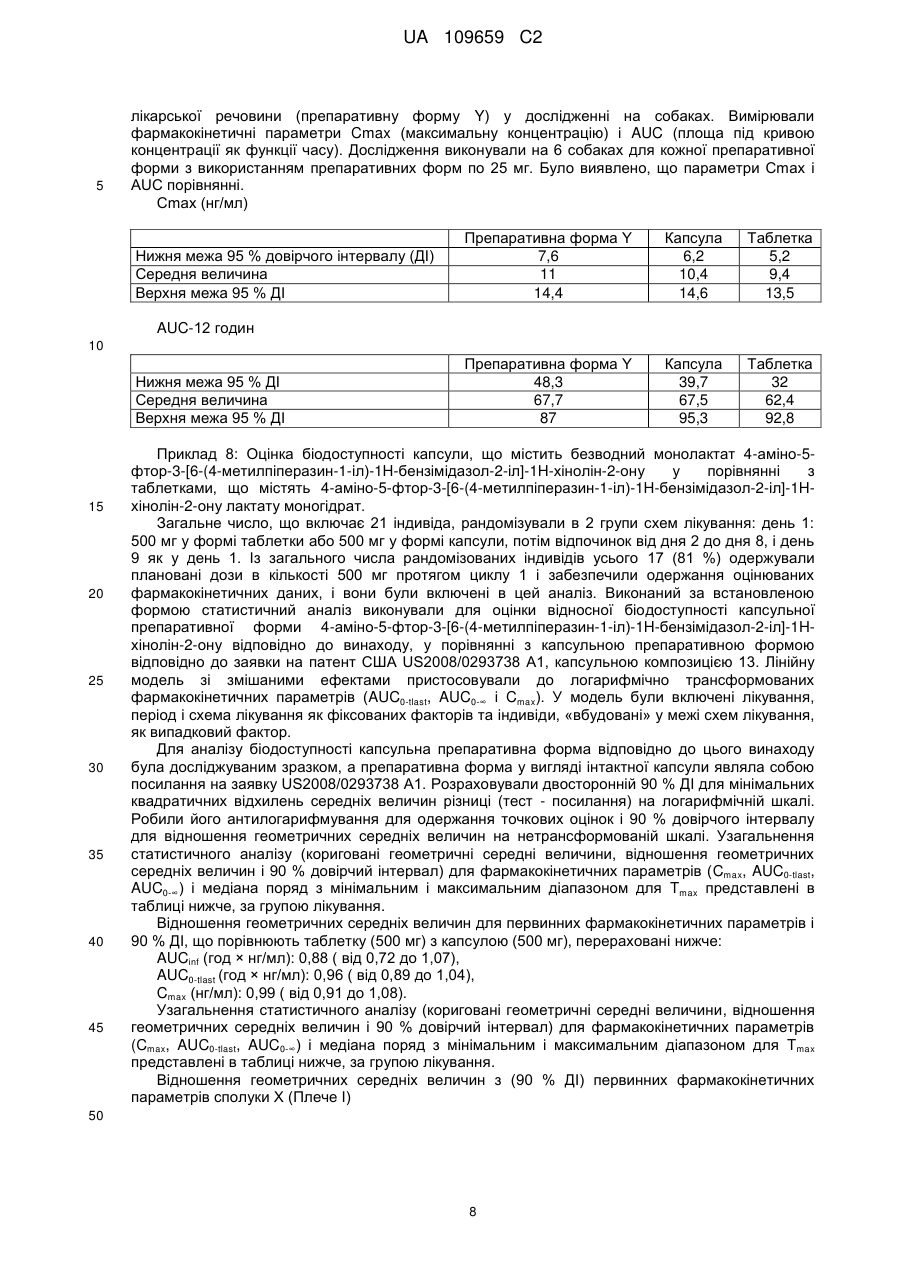
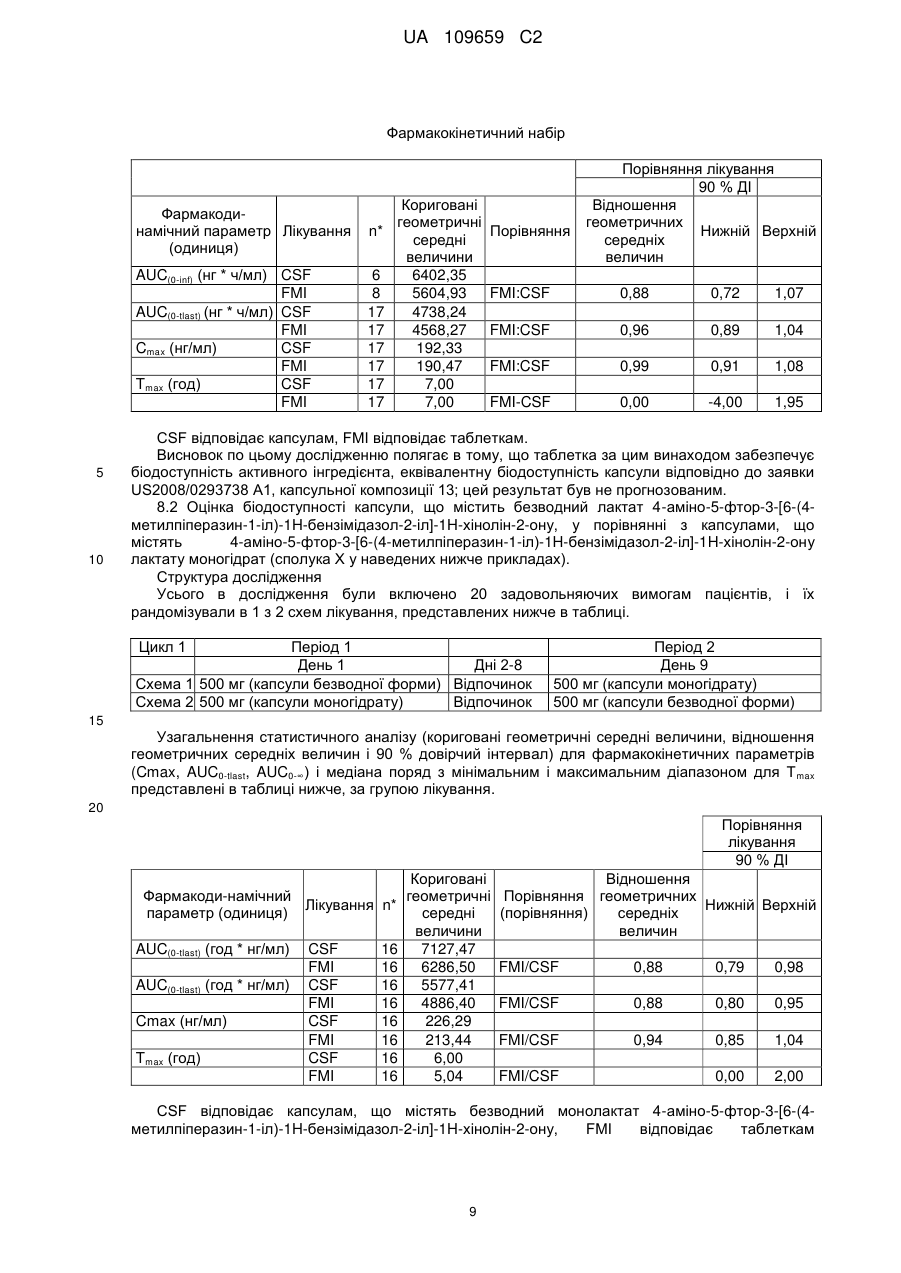
Реферат: Фармацевтична композиція для перорального введення, що містить внутрішньогранулярну фaзy, яка включає: 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Н-бензімідазол-2-іл]-1Нхінолін-2-ону монолактат моногідрат у кількості від 40 до 65 % мас., наповнювач у кількості від 30 до 60 % мас., розпушувач у кількості від 1 до 15 % мас., речовину, що сприяє ковзанню, і/або змащувальну речовину в кількості від 0,1 до 10 % мас., та позагранулярну фазу, яка включає: один або більше наповнювачів у кількості від 3 до 5 % мас., розпушувач у кількості від 1 до 5 % мас., речовину, що сприяє ковзанню, та/або змащувальну речовину у кількості від 1 до 3 % мас.; причому: зазначена внутрішньогранулярна фаза виготовлена за допомогою ущільнення валками та зазначена фармацевтична композиція одержана методом сухої грануляції. UA 109659 C2 (12) UA 109659 C2 UA 109659 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід відноситься до фармацевтичних композицій, зокрема, до композицій для введення 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону або його таутомера, фармацевтично прийнятної солі або гідрату або сольвату і до способу одержання таких композицій, наприклад, моногідратної форми його лактатної солі. В опублікованій заявці PCT WO 2007/064719 описані фармацевтичні композиції 4-аміно-5фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону або фармацевтично прийнятної солі або гідрату або сольвату. У варіантах здійснення WO 2007/064719 сіль молочної кислоти являє собою безводну кристалічну форму, таку як форма A. Безводна форма має недоліки, що полягають у тому, що вона не є термодинамічно стійкою в процесі одержання. Існує потреба в економічній і стійкій композиції, яка не має описаних вище недоліків. Однак заявники зіштовхнулися з проблемою одержання препаративної форми, що містить активний інгредієнт у термодинамічно стійкій формі, у той же час, зберігаючи таку ж біодоступність, як препаративна форма, що містить безводну форму того ж активного інгредієнта. Препаративна форма відповідно до даного винаходу забезпечує фармацевтичну препаративну форму з більш високим лікарським навантаженням, що має менший розмір і, таким чином, ще зручнішу для користувача. Кількості ексципієнтів і активних інгредієнтів у фармацевтичних композиціях відповідно до винаходу, як описано нижче, виражені у відсотках за масою від загальної маси композиції. В одному аспекті цей винахід відноситься до твердої фармацевтичної композиції для перорального введення, що містить 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Hбензімідазол-2-іл]-1H-хінолін-2-он або фармацевтично прийнятну сіль або гідрат або сольват у кількості до 70 % мас., наприклад, від 40 % до 60 або 70 %, наповнювач, наприклад, мікрокристалічну целюлозу в кількості від 15 до 70 % мас., розпушувач у кількості менш ніж 15 % мас., речовину, що сприяє ковзанню, і/або змащувальну речовину в кількості від 0,1 до 10 % мас., де кількості за масою базуються на загальній масі композиції. Фармацевтична композиція може необов'язково містити додатковий наповнювач, наприклад, маніт, який присутній у кількості від 0,1 до 5 % мас., де кількості за масою базуються на загальній масі композиції. Фармацевтична композиція може додатково містити зв’язувальну речовину в кількості від 10 до 40 % мас. У додатковому аспекті цей винахід відноситься до твердої фармацевтичної композиції для перорального введення, що містить 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Hбензімідазол-2-іл]-1H-хінолін-2-он або фармацевтично прийнятну сіль у кількості до 70 % мас., мікрокристалічну целюлозу в кількості від 15 до 60 % мас., маніт у кількості від 10 до 40 % мас., розпушувач у кількості менш ніж 15 % мас., речовину, що сприяє ковзанню, і/або змащувальну речовину в кількості від 0,1 до 10 % мас., де кількості за масою базуються на загальній масі композиції. У додатковому аспекті цей винахід відноситься до твердої фармацевтичної композиції для перорального введення, що містить 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Hбензімідазол-2-іл]-1H-хінолін-2-он або фармацевтично прийнятну сіль у кількості до 70 % мас., мікрокристалічну целюлозу в кількості від 15 до 60 % мас., маніт у кількості до 10 %, кросповідон у кількості до 8 %, речовину, що сприяє ковзанню, і/або змащувальну речовину в кількості від 0,1 до 10 % мас., де кількості за масою базуються на загальній масі композиції. В описаних вище варіантах здійснення 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Hбензімідазол-2-іл]-1H-хінолін-2-он лактату моногідрат. 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-он або фармацевтично прийнятна сіль або гідрат або сольват має структуру, показану у формулі I: . Одержання цієї сполуки та її солей, включаючи сіль моно-молочної кислоти, описані в патентах США №№ 6605617, 6774237, 7335774 і 7470709 і в заявках на патенти США під 1 UA 109659 C2 5 10 15 20 25 30 35 40 45 50 55 60 серійними номерами 10/982757, 10/982543 і 10/706328, і в опублікованих заявках PCT WO 2006/127926 і WO2009/115562, причому кожний із зазначених документів повністю включений у цей опис шляхом посилання. Лактатна сіль сполуки формули I існує в різноманітних кристалічних формах, включаючи, наприклад, безводну форму, таку як форма A, і моногідратну форму, таку як форма HA, також описану у вигляді форми B у заявці PCT WO 2006/127926. У деяких визначених варіантах здійснення сіль молочної кислоти являє собою моногідратну кристалічну форму, таку як, наприклад, форма HA, також описана як форма B. Кристалічна форма B солі молочної кислоти сполуки формули I має тип дифракції рентгенівських променів, що містить характерні піки відносно 2θ приблизно на 17,6°, приблизно 19,3° і приблизно 26,0°. Тип дифракції рентгенівських променів форми B може додатково містити характерні піки відносно 2θ приблизно на 23,3°, приблизно 23,5° і приблизно 28,2°. Тип дифракції рентгенівських променів форми B може додатково містити характерні піки відносно 2θ приблизно на 11,9°, приблизно 15,3°, приблизно 16,1° і приблизно 18,5°. Тип дифракції рентгенівських променів форми B може додатково містити характерні піки відносно 2θ приблизно на 10,2° і приблизно 12,9°. Кристалічна форма B має тип дифракції рентгенівських променів, що містить щонайменше 3 характерних піки відносно 2θ, обраних з приблизно на 10,2, приблизно на 11,3, приблизно на 11,6, приблизно на 11,9, приблизно на 12,9, приблизно на 15,3, приблизно на 15,6, приблизно на 16,1, приблизно на 17,6, приблизно на 18,5, приблизно на 19,3, приблизно на 22,3, приблизно на 23,3, приблизно на 23,5, приблизно на 23,9, приблизно на 26,0, приблизно на 28,2, приблизно на 29,3, приблизно на 29,8, приблизно на 30,7, приблизно на 32,2, приблизно на 32,6, приблизно на 33,1 і приблизно на 34,3°. Тип графічного зображення дифракції рентгенівських променів форми B являє собою речовину, як по суті показано на фіг. 6 заявки PCT WO 2006/127926. Термін «розпушувач» позначає речовину або суміш речовин, яка сприяє розпаду композиції після введення для того, щоб активний інгредієнт якомога ефективніше вивільнився для забезпечення можливості його розчинення (див., наприклад, керівництво «Remington's Pharmaceutical Science» 18th edition (1990), «The Theory and Practice of Industrial Pharmacy» Lachman et al. Lea & Febiger (1970)). Як розпушувач композиція за цим винаходом може містити крохмалі, глини, целюлози, альгінати, смоли, поперечно зшиті полімери, наприклад, поперечно зшитий полівінілпірролідон або кросповідон, наприклад, колідон, що випускається компанією BASF, наприклад, поліпласдон, що випускається компанією International Speciality Products (Wayne, NJ), наприклад, кросповідон XL, поперечно зшиту натрій-карбоксиметилцелюлозу або натрій-кроскармелозу, наприклад, AC-DI-SOL, що випускається компанією FMC, поперечно зшиту кальцію карбоксиметилцелюлозу, полісахариди сої і гуарову смолу. Розпушувач може бути присутнім у кількості від приблизно 0,1 % до приблизно 10 % мас. композиції. В одному варіанті здійснення розпушувач присутній у кількості від приблизно 4 % до приблизно 8 % мас. композиції або в кількості більш ніж від 4 % до 8 %, наприклад, від 5 % до 8 % мас. композиції, наприклад, від 6 % до 8 %, наприклад, від 6,5 до 7,5 %. Розпушувач може являти собою кросповідон, наприклад, кросповідон XL, який краще не розчинний у воді. В ідеалі, розпушувач швидко проявляє високу капілярну ємність або виражену гідратаційну здатність з невеликою тенденцією до утворення гелю. Відповідно до цього винаходу кросповідон, наприклад, кросповідон XL, присутній у кількості більш ніж від 4 % до 8 %, наприклад, від 5 % до 8 % мас., наприклад, від 6 % до 8 %, наприклад, від 6,5 % до 7,5 %, де кількості за масою базуються на загальній масі композиції. Композиція за цим винаходом може додатково містити один або більше наповнювачів. Приклади фармацевтично прийнятних наповнювачів включають без обмеження кондитерський цукор, пресований цукор, декстрати, декстрин, декстрозу, лактозу, маніт, мікрокристалічну целюлозу, порошкоподібну целюлозу, сорбіт, сахарозу, дикальцій фосфат, крохмаль, прежелатинізований крохмаль і тальк; в одному варіанті здійснення винаходу наповнювачі являють собою мікрокристалічну целюлозу, наприклад, MCC 102, MCC 105, MCC 112, MCC 200 або/і маніт. Наповнювач може бути присутнім у кількості від приблизно 15 % до приблизно 60 % мас., наприклад, один або більше наповнювачів присутні в кількості від 30 % до 60 %, наприклад, від 35 % до 60 %, наприклад, від 38 до 50 % мас., де кількості за масою базуються на загальній масі композиції. Композиція за винаходом містить один або більше наповнювачів, обраних з мікрокристалічної целюлози, наприклад, MCC 102, MCC 105, MCC 200, і маніту, у загальній кількості наповнювача від 30 до 60 %, наприклад, від 32 до 50 %, наприклад, від 32 до 46 % мас., де кількості за масою базуються на загальній масі композиції. Композиція за винаходом може додатково містити зв’язувальну речовину. Приклади фармацевтично прийнятних зв’язувальних речовин включають без обмеження крохмалі, 2 UA 109659 C2 5 10 15 20 25 30 35 40 45 50 55 60 целюлози та їх похідні, наприклад, мікрокристалічну целюлозу, наприклад, гідроксипропілцелюлозу, наприклад, гідроксиетилцелюлозу, наприклад, гідроксипропілметилцелюлозу, сахарозу, декстрозу, кукурудзяний сироп, полісахариди, желатин, полівінілпірролідон, коповідон, наприклад, колідон VA64, що випускається компанією BASF. Зв’язувальна речовина може бути присутня у кількості від приблизно 0% до приблизно 50 %, наприклад, 10-40 % мас. композиції. Композиція за цим винаходом може додатково містити змащувальну речовину або речовину, що сприяє ковзанню. Приклади фармацевтично прийнятних змащувальних речовин і фармацевтично прийнятних речовин, що сприяють ковзанню, включають без обмеження колоїдний діоксид кремнію, наприклад, трисилікат магнію, крохмалі, тальк, триосновний фосфат кальцію, стеарат магнію, стеарату алюмінію, стеарат кальцію, карбонат магнію, оксид магнію, поліетиленгліколь, порошкову целюлозу та мікрокристалічну целюлозу. Змащувальна речовина, наприклад, може бути присутня у кількості від приблизно 0,1 % до приблизно 5 % мас. за масою композиції; тоді як речовина, що сприяє ковзанню, наприклад, може бути присутня у кількості від приблизно 0,1 % до приблизно 10 % мас. композиції, наприклад, діоксид кремнію може бути присутнім у кількості від 0,5 до 2 %; стеарат магнію може бути присутнім у кількості від 1 до 4 % мас. за масою композиції. Інші ексципієнти, описані в літературі, такі як, наприклад, зазначені в публікаціях Fiedler's «Lexicon der Hilfstoffe», 4th Edition, ECV Aulendorf 1996 і «Handbook of Pharmaceutical Excipients» Wade and Weller Ed. (1994), зміст яких включено в цю заявку шляхом посилання, можуть використовуватися у фармацевтичних композиціях відповідно до винаходу. Маніт може використовуватися як наповнювач. Маніт являє собою гідрофільний компонент. Тому, якщо маніт вступає в контакт з водою, наприклад, шлунковий сік швидко солюбілізує його, залишаючи пористу структуру, у яку може легко проникати вода. Це має перевагу в тому, що він збільшує швидкість розчинення, що являє собою ключовий фактор для негайного вивільнення фармацевтичної композиції за цим винаходом. У додатковому аспекті цей винахід відноситься до способу одержання композицій за винаходом. Композиції за винаходом можуть бути отримані обробкою активної речовини з ексципієнтами. Описані способи являють собою способи сухого гранулювання. Спосіб сухого гранулювання забезпечує переваги подолання таких характеристик лікарської речовини як прилипання лікарської речовини і ексципієнтів під час виробничого процесу. У цілому, композиція за винаходом може бути отримана приготуванням суміші 4-аміно-5-фтор-3-[6-(4метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону із зазначеними вище фармацевтичними ексципієнтами, такими як наповнювач, додатковий наповнювач, розпушувач, речовина, що сприяє ковзанню, змазувальна речовина і т.д., стандартними способами, обробкою суміші ущільненням прокаткою для забезпечення виходу меленого гранулята і переробкою меленого гранулята в капсули або таблетки стандартними способами. Спосіб A Композиція за винаходом може бути отримана (i) приготуванням суміші 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]1H-хінолін-2-ону, одного або більше наповнювачів, наприклад, наповнювача, додаткового наповнювача, розпушувача і речовини, що сприяє ковзанню, (ii) просіванням суміші зі стадії (i), (iii) змазуванням суміші зі стадії (ii) змащувальною речовиною, (iv) переробкою суміші зі стадії (iii) ущільненням прокаткою, (v) гомогенізацією меленого гранулята стадії (iv) з розпушувачем і речовиною, що сприяє ковзанню, (vi) змазуванням змащувальною речовиною, (vii) інкапсуляцією суміші стадії (vi). Спосіб B Композиція за винаходом може бути отримана (i) приготуванням суміші 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]1H-хінолін-2-ону або фармацевтично прийнятної солі або гідрату або сольвату, наповнювача, розпушувача і змащувальної речовини, (ii) просіванням суміші, (iii) додаванням змащувальної речовини, (iv) переробкою суміші зі стадії (iii) ущільненням прокаткою, (v) гомогенізацією меленого гранулята стадії (iv) з речовиною, що сприяє ковзанню, наповнювачем і розпушувачем і змішуванням, (vi) змазуванням змащувальною речовиною, 3 UA 109659 C2 5 10 15 20 25 30 35 40 45 50 55 60 (vii) формуванням таблеток пресуванням, (viii) на таблетки може бути необов'язково нанесене покриття. Отримані порошкові суміші стадії (vii) пресують на одноштамповому пресі (Korsh EKO), 6станційному роторному пресі (Korsh PH 106), 17-станційному роторному пресі (Korsh PH 230) або 43-станційному роторному пресі (Fette PT2090). Композиція за винаходом може бути складена в препаративну форму у вигляді желатинової капсули, такої як тверда желатинова капсула. Тверда желатинова капсула, також відома як капсула, заповнена сухим порошком, складена з двох секцій, однієї, що насаджується на іншу, у такий спосіб повністю оточуючи (інкапсулюючи) лікарську препаративну форму. Композиція за цим винаходом може бути складена у вигляді таблетки. В одному варіанті здійснення цей винахід відноситься до таблеткових композицій з середньою твердістю, наприклад, від 60 до 250 ньютон (Н), краще від 110 Н до 190 Н. Частинки або гранули, отримані описаними вище способами одержання B, або таблетки можуть бути покриті не функціональним покриттям, як відомо в цій області, наприклад, покриттям з гідроксипропілметилцелюлози (HPMC). Прийнятні покриття включають покриття на основі целюлози або похідних, наприклад, етилцелюлози, наприклад, гідроксипропілметилцелюлози, наприклад, карбоксиметилцелюлози, наприклад, гідроксиетилцелюлози, наприклад, ацетату целюлози, наприклад, ацетату фталату целюлози, наприклад, сукцинату гідроксипропілметилцелюлози, метилакрилату або поліметилакрилату, полімеру метакрилової кислоти, наприклад, еудрагіту. Можливість застосування фармацевтичних композицій за цим винаходом може спостерігатися в стандартних клінічних тестах, включаючи тести біодоступності, наприклад, з використанням відомих показників лікарських дозувань, що забезпечують терапевтично ефективні рівні в крові терапевтичної сполуки; наприклад, використовуючи дозування в діапазоні 25-1000 мг терапевтичної сполуки на день або альтернативні схеми введення для ссавця масою 75 кг, наприклад дорослої людини, і на стандартних експериментальних моделях. Залежно від виду, віку, стану індивіда та розглянутої клінічної картини, людині вводяться ефективні дози, наприклад, щотижневі дози приблизно від 500 до 4000 мг 4-аміно-5-фтор-3-[6(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону або фармацевтично прийнятної солі або гідрату або сольвату. Винахід відноситься до фармацевтичної композиції, що містить 4-аміно-5-фтор-3-[6-(4метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону моногідрат монолактату у кількості від 40 до 65 % мас., наприклад, 50 %, один або більше наповнювачів, наприклад, мікрокристалічну целюлозу (MCC) 102, 105 і/або 200, наприклад, MCC102 і MCC200 або MCC105 і MCC200, кросповідон, наприклад, кросповідон XL, у кількості від 5 до 7 % мас., діоксид кремнію від 1 до 1,5 % мас., стеарат магнію в кількості від 2 до 3 % мас./мас. загальної маси препаративної форми. Фармацевтична композиція відповідно до винаходу, що містить у внутрішньогранулярній фазі 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону моногідрат монолактату у кількості від 40 до 65 % мас., наприклад, 50 %, один або більше наповнювач, наприклад, мікрокристалічну целюлозу або мікрокристалічну целюлозу і маніт, наприклад, мікрокристалічну целюлозу 102, 105 або їхню суміш, наприклад, у кількості від 30 до 50 % мас., кросповідон, наприклад, кросповідон XL, у кількості від 2 до 7 % мас., діоксид кремнію від 0,5 до 1 % мас., стеарат магнію в кількості від 0,1 до 1 % мас., і у позагранулярній фазі діоксид кремнію, наприклад, у кількості від 0,2 до 1 % мас., стеарат магнію в кількості від 1 до 3 % мас., кросповідон, наприклад, кросповідон XL, у кількості від 1 до 5 % мас./мас. загальної маси препаративної форми. Коли композиція являє собою таблетку, то позагранулярна фаза містить наповнювач, наприклад, мікрокристалічну целюлозу в кількості від 3 до 7 % мас./мас. загальної маси препаративної форми. Таблеткова композиція відповідно до цього винаходу містить у внутрішньогранулярній фазі 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону моногідрат монолактату у кількості від 40 до 65 % мас., наприклад, 50 %, один або більше наповнювачів, наприклад, мікрокристалічну целюлозу, наприклад, мікрокристалічну целюлозу 102, 105 або їхню суміш, наприклад, у кількості від 30 до 50 % мас., кросповідон, наприклад, кросповідон XL, у кількості від 2 до 6 % мас., діоксид кремнію від 0,5 до 1 % мас., стеарат магнію в кількості від 0,1 до 0,5 % мас., і у позагранулярній фазі діоксид кремнію, наприклад, у кількості від 0,2 до 1 % мас., стеарат магнію в кількості від 1 до 3 % мас., кросповідон, наприклад, кросповідон XL, у кількості від 3 до 5 % мас., наприклад, від 4 до 5 % мас., наповнювач, наприклад, мікрокристалічну целюлозу, наприклад, MCC 200, наприклад у кількості від 3 % до 5 % мас./мас. 4 UA 109659 C2 5 10 15 20 25 30 35 40 загальної маси препаративної форми. Таблетки відповідно до цього винаходу являють собою таблетки з плівковим покриттям. Капсульна композиція відповідно до цього винаходу містить у внутрішньогранулярній фазі 4аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону моногідрат монолактату у кількості від 30 до 50 % мас., наприклад, від 40 до 42 % мас., один або більше наповнювачів, наприклад, мікрокристалічну целюлозу, наприклад, мікрокристалічну целюлозу 102, 105, 200, маніт або їх суміш, наприклад, у кількості від 30 до 50 % мас., кросповідон, наприклад, кросповідон XL, у кількості від 4 до 6% мас., діоксид кремнію від 0,5 до 1% мас., стеарат магнію в кількості від 0,1 до 0,5 % мас., і у позагранулярній фазі діоксид кремнію, наприклад, у кількості від 0,2 до 1 % мас., стеарат магнію в кількості від 1 до 3 % мас., кросповідон, наприклад, кросповідон XL, у кількості від 3 до 5 % мас., наприклад, від 4 до 5 % мас., наповнювач, наприклад, мікрокристалічну целюлозу, наприклад, MCC 200, наприклад, у кількості від 3 % до 5 % мас., де кількості за масою базуються на загальній масі композиції. Таблетка є або може бути покритою, наприклад, плівковим покриттям. Винахід відноситься до фармацевтичної композиції для перорального введення, що містить 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-он або фармацевтично прийнятну сіль або гідрат або сольват у кількості до 45 % мас., наповнювач у кількості від 15 до 70 % мас., розпушувач у кількості менш ніж 15 % мас., речовину, що сприяє ковзанню, і/або змащувальну речовину в кількості від 0,1 до 10 % мас., де кількості за масою базуються на загальній масі композиції; зазначена композиція може, крім того, містити додатковий наповнювач, який може являти собою маніт, наприклад, у кількості від 0,1 до 5 % мас./мас. загальної маси композиції. Винахід також відноситься до фармацевтичної композиції для перорального введення, що містить 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-он або фармацевтично прийнятну сіль у кількості до 45 % мас., мікрокристалічну целюлозу в кількості від 15 до 60 % мас., маніт у кількості від 10 до 40 % мас., розпушувач у кількості менш ніж 15 % мас., речовину, що сприяє ковзанню, і/або змащувальну речовину в кількості від 0,1 до 10 % мас., де кількості за масою базуються на загальній масі композиції, наприклад, де розпушувач являє собою кросповідон і/або де речовина, що сприяє ковзанню, являє собою стеарат магнію. Далі наведені необмежуючі опис приклади. Відповідно до представлених нижче прикладів і наведених вище описів доза в капсулі або таблетці відноситься до маси молочнокислого 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Hбензімідазол-2-іл]-1H-хінолін-2-ону, присутнього в препаративній формі, наприклад, таблетка по 100 мг містить 100 мг молочнокислого 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Hбензімідазол-2-іл]-1H-хінолін-2-ону, тим самим, 128 мг молочнокислого 4-аміно-5-фтор-3-[6-(4метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону монолактату моногідрату. Процентні частки в композиції, як докладно описане нижче, виражені в мас./мас. на підставі загальної маси таблетки, і у випадку активного інгредієнта процентна частка відповідає процентному вмісту його моногідрату монолактату, присутньому в композиції. Приклад 1: 100 мг капсулу 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2іл]-1H-хінолін-2-ону лактату моногідрату (сполука X) одержують, використовуючи спосіб сухого гранулювання Компонент Сполука X Мікрокристалічна целюлоза Маніт Кросповідон Діоксид кремнію, наприклад, аеросил Стеарат магнію 45 50 % мас./мас. 41,29 45,32 3,23 7,42 0,97 1,78 Утворюють суміш сполуки X, мікрокристалічної целюлози, кросповідону, маніту і аеросилу. Цю суміш просівають і змазують стеаратом магнію. Суміш переробляють ущільненням прокаткою. Отриманий мелений гранулят змішують з кросповідоном і аеросилом. Суміш змазують стеаратом магнію і суміш інкапсулюють. Приклад 2:25 мг капсулу 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]1H-хінолін-2-ону лактату моногідрату (сполука X) одержують, використовуючи спосіб сухого гранулювання 5 UA 109659 C2 Компонент Сполука X Мікрокристалічна целюлоза Маніт Кросповідон Діоксид кремнію, наприклад, аеросил Стеарат магнію 5 % мас./мас. 41,29 41,13 45,32 45,5 3,23 3,22 7,42 7,49 0,97 0,96 1,78 1,77 Утворюють суміш сполуки X, мікрокристалічної целюлози, кросповідону, маніту і аеросилу. Цю суміш просівають і змазують стеаратом магнію. Суміш переробляють ущільненням прокаткою. Отриманий мелений гранулят змішують з кросповідоном і аеросилом. Суміш змазують стеаратом магнію і суміш інкапсулюють. Приклад 3: Таблетку 100 мг 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2іл]-1H-хінолін-2-ону лактату моногідрату (сполука X) одержують, використовуючи спосіб сухого гранулювання 10 Компонент Сполука X Мікрокристалічна целюлоза Кросповідон Діоксид кремнію, наприклад, аеросил Стеарат магнію 15 % мас./мас. 49,80 41,50 5,0 1,2 2,5 Утворюють суміш сполуки X, мікрокристалічної целюлози, кросповідону і аеросилу. Цю суміш просівають і змазують стеаратом магнію. Суміш переробляють ущільненням прокаткою. Отриманий мелений гранулят змішують з аеросилом і кросповідоном. Суміш змазують стеаратом магнію. Таблетки формують пресуванням. Приклад 4: Таблетку 250 мг 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2іл]-1H-хінолін-2-ону лактату моногідрату (сполука X) одержують, використовуючи спосіб сухого гранулювання Компонент Сполука X Мікрокристалічна целюлоза Кросповідон Діоксид кремнію, наприклад, аеросил Стеарат магнію % мас./мас. 49,80 41,50 5,0 1,2 2,5 20 25 Утворюють суміш сполуки X, мікрокристалічної целюлози, кросповідону і аеросилу. Цю суміш просівають та змазують стеаратом магнію. Суміш переробляють ущільненням прокаткою. Отриманий мелений гранулят змішують з аеросилом і кросповідоном. Суміш змазують стеаратом магнію. Таблетки формують пресуванням. Приклад 5: Таблетку 25 мг 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2іл]-1H-хінолін-2-ону лактату моногідрату (сполука X) одержують, використовуючи спосіб сухого гранулювання Компонент Сполука X Мікрокристалічна целюлоза Коповідон, наприклад, колідон VA64 Кросповідон Діоксид кремнію, наприклад, аеросил Стеарат магнію 30 % мас./мас. 50,0 30,7 8,0 7,0 1,0 2,4 Утворюють суміш сполуки X, мікрокристалічної целюлози, кросповідону, колідону VA64 і аеросилу. Цю суміш просівають і змазують стеаратом магнію. Суміш переробляють ущільненням прокаткою. Отриманий мелений гранулят змішують з аеросилом і кросповідоном. Суміш змазують стеаратом магнію. Таблетки формують пресуванням. 6 UA 109659 C2 5 Приклад 6: Капсули і таблетки забезпечують швидке вивільнення активної речовини. Швидкості розчинення вимірюють у стандартних тестах розчинення, наприклад, здійснюваних використанням апарата 2 (роторної лопатки) за Фармакопеєю США при 37 градусах Цельсія в середовищі A для визначення швидкості розчинення (pH приблизно 1,5; 0,04 молярна HCl + 2 г/л NaCl) і в середовищі B для визначення швидкості розчинення (pH 4,5, ацетатний буфер) при швидкості перемішування 50 об/хв і на підставі середньої величини 6 або більше, наприклад, 12 лікарських форм. Швидкості розчинення капсул 100 мг для n=6: Час (хв) 10 20 30 45 60 Середовище A, % вивільнення 82 89 92 94 97 Середовище B, % вивільнення 65 76 77 86 88 10 Швидкості розчинення капсул 25 мг для n=6 Час (хв) 10 20 30 45 60 Середовище A, % вивільнення 84 94 99 100 100 Середовище B, % вивільнення 59 72 76 81 84 Швидкості розчинення таблеток 100 мг для n=6 15 Час (хв) 10 15 20 30 45 60 Середовище A, % вивільнення 90 99 100 101 102 102 Середовище B, % вивільнення 80 88 89 92 94 96 Швидкості розчинення таблеток 250 мг для n=12 для pH 1,5 і n=6 для pH 4,5 Час (хв) 10 15 20 30 45 60 20 Середовище B, % вивільнення 87 91 94 95 97 97 Швидкості розчинення таблеток 25 мг для n=6 Час (хв.) 10 20 30 45 60 75 25 Середовище A, % вивільнення 91 96 97 98 99 100 Середовище A, % вивільнення 99 99 99 99 99 99 Середовище B, % вивільнення 90 94 95 93 94 94 Приклад 7: Аналіз біодоступності Тестували композиції за винаходом (таблетку і капсулу) 4-аміно-5-фтор-3-[6-(4метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону лактату моногідрату і порівнювали з препаративною формою, описаною в заявці WO 2007/064719, використовуючи безводну форму 7 UA 109659 C2 5 лікарської речовини (препаративну форму Y) у дослідженні на собаках. Вимірювали фармакокінетичні параметри Cmax (максимальну концентрацію) і AUC (площа під кривою концентрації як функції часу). Дослідження виконували на 6 собаках для кожної препаративної форми з використанням препаративних форм по 25 мг. Було виявлено, що параметри Cmax і AUC порівнянні. Cmax (нг/мл) Нижня межа 95 % довірчого інтервалу (ДІ) Середня величина Верхня межа 95 % ДІ Препаративна форма Y 7,6 11 14,4 Капсула 6,2 10,4 14,6 Таблетка 5,2 9,4 13,5 Препаративна форма Y 48,3 67,7 87 Капсула 39,7 67,5 95,3 Таблетка 32 62,4 92,8 AUC-12 годин 10 Нижня межа 95 % ДІ Середня величина Верхня межа 95 % ДІ 15 20 25 30 35 40 45 Приклад 8: Оцінка біодоступності капсули, що містить безводний монолактат 4-аміно-5фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону у порівнянні з таблетками, що містять 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1Hхінолін-2-ону лактату моногідрат. Загальне число, що включає 21 індивіда, рандомізували в 2 групи схем лікування: день 1: 500 мг у формі таблетки або 500 мг у формі капсули, потім відпочинок від дня 2 до дня 8, і день 9 як у день 1. Із загального числа рандомізованих індивідів усього 17 (81 %) одержували плановані дози в кількості 500 мг протягом циклу 1 і забезпечили одержання оцінюваних фармакокінетичних даних, і вони були включені в цей аналіз. Виконаний за встановленою формою статистичний аналіз виконували для оцінки відносної біодоступності капсульної препаративної форми 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1Hхінолін-2-ону відповідно до винаходу, у порівнянні з капсульною препаративною формою відповідно до заявки на патент США US2008/0293738 A1, капсульною композицією 13. Лінійну модель зі змішаними ефектами пристосовували до логарифмічно трансформованих фармакокінетичних параметрів (AUC0-tlast, AUC0-∞ і Cmax). У модель були включені лікування, період і схема лікування як фіксованих факторів та індивіди, «вбудовані» у межі схем лікування, як випадковий фактор. Для аналізу біодоступності капсульна препаративна форма відповідно до цього винаходу була досліджуваним зразком, а препаративна форма у вигляді інтактної капсули являла собою посилання на заявку US2008/0293738 A1. Розраховували двосторонній 90 % ДІ для мінімальних квадратичних відхилень середніх величин різниці (тест - посилання) на логарифмічній шкалі. Робили його антилогарифмування для одержання точкових оцінок і 90 % довірчого інтервалу для відношення геометричних середніх величин на нетрансформованій шкалі. Узагальнення статистичного аналізу (кориговані геометричні середні величини, відношення геометричних середніх величин і 90 % довірчий інтервал) для фармакокінетичних параметрів (Cmax, AUC0-tlast, AUC0-∞) і медіана поряд з мінімальним і максимальним діапазоном для Tmax представлені в таблиці нижче, за групою лікування. Відношення геометричних середніх величин для первинних фармакокінетичних параметрів і 90 % ДІ, що порівнюють таблетку (500 мг) з капсулою (500 мг), перераховані нижче: AUCinf (год × нг/мл): 0,88 ( від 0,72 до 1,07), AUC0-tlast (год × нг/мл): 0,96 ( від 0,89 до 1,04), Cmax (нг/мл): 0,99 ( від 0,91 до 1,08). Узагальнення статистичного аналізу (кориговані геометричні середні величини, відношення геометричних середніх величин і 90 % довірчий інтервал) для фармакокінетичних параметрів (Cmax, AUC0-tlast, AUC0-∞) і медіана поряд з мінімальним і максимальним діапазоном для Tmax представлені в таблиці нижче, за групою лікування. Відношення геометричних середніх величин з (90 % ДІ) первинних фармакокінетичних параметрів сполуки X (Плече I) 50 8 UA 109659 C2 Фармакокінетичний набір Фармакодинамічний параметр Лікування (одиниця) AUC(0-inf) (нг * ч/мл) CSF FMI AUC(0-tlast) (нг * ч/мл) CSF FMI Cmax (нг/мл) CSF FMI Tmax (год) CSF FMI 5 10 n* 6 8 17 17 17 17 17 17 Кориговані геометричні середні величини 6402,35 5604,93 4738,24 4568,27 192,33 190,47 7,00 7,00 Порівняння Порівняння лікування 90 % ДІ Відношення геометричних Нижній Верхній середніх величин FMI:CSF 0,88 0,72 1,07 FMI:CSF 0,96 0,89 1,04 FMI:CSF 0,99 0,91 1,08 FMI-CSF 0,00 -4,00 1,95 CSF відповідає капсулам, FMI відповідає таблеткам. Висновок по цьому дослідженню полягає в тому, що таблетка за цим винаходом забезпечує біодоступність активного інгредієнта, еквівалентну біодоступність капсули відповідно до заявки US2008/0293738 A1, капсульної композиції 13; цей результат був не прогнозованим. 8.2 Оцінка біодоступності капсули, що містить безводний лактат 4-аміно-5-фтор-3-[6-(4метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону, у порівнянні з капсулами, що містять 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону лактату моногідрат (сполука X у наведених нижче прикладах). Структура дослідження Усього в дослідження були включено 20 задовольняючих вимогам пацієнтів, і їх рандомізували в 1 з 2 схем лікування, представлених нижче в таблиці. Цикл 1 Період 1 День 1 Дні 2-8 Схема 1 500 мг (капсули безводної форми) Відпочинок Схема 2 500 мг (капсули моногідрату) Відпочинок Період 2 День 9 500 мг (капсули моногідрату) 500 мг (капсули безводної форми) 15 Узагальнення статистичного аналізу (кориговані геометричні середні величини, відношення геометричних середніх величин і 90 % довірчий інтервал) для фармакокінетичних параметрів (Cmax, AUC0-tlast, AUC0-∞) і медіана поряд з мінімальним і максимальним діапазоном для T max представлені в таблиці нижче, за групою лікування. 20 Порівняння лікування 90 % ДІ Кориговані Відношення Фармакоди-намічний геометричні Порівняння геометричних Лікування n* Нижній Верхній параметр (одиниця) середні (порівняння) середніх величини величин AUC(0-tlast) (год * нг/мл) CSF 16 7127,47 FMI 16 6286,50 FMI/CSF 0,88 0,79 0,98 AUC(0-tlast) (год * нг/мл) CSF 16 5577,41 FMI 16 4886,40 FMI/CSF 0,88 0,80 0,95 Cmax (нг/мл) CSF 16 226,29 FMI 16 213,44 FMI/CSF 0,94 0,85 1,04 Tmax (год) CSF 16 6,00 FMI 16 5,04 FMI/CSF 0,00 2,00 CSF відповідає капсулам, що містять безводний монолактат 4-аміно-5-фтор-3-[6-(4метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1H-хінолін-2-ону, FMI відповідає таблеткам 9 UA 109659 C2 5 10 15 20 моногідрату лактату 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1H-бензімідазол-2-іл]-1Hхінолін-2-ону. Відношення геометричних середніх величин для первинних фармакокінетичних параметрів і 90 % ДІ, що порівнюють FMI (500 мг) з CSF (500 мг), перераховані нижче: AUCinf (год × нг/мл): 0,88 (від 0,79 до 0,98), AUC0-tlast (год × нг/мл): 0,88 (від 0,80 до 0,95), Cmax (нг/мл): 0,94 (від 0,85 до 1,04). Міжіндивідуальна варіабельність усіх описаних вище фармакокінетичних параметрів була однаковою між капсулою відповідно до заявки US2008/0293738 A1, капсульною композицією 13 і капсулою відповідно до цього винаходу. Результати дослідження фармакодинаміки демонструють, що зазначені дві капсули мають порівнянну біодоступність. Приклад 9: Наступну суміш, отриману зі сполуки X як активний інгрідієнт 36,6 %, MCC 200 40 %, маніту 10 %, гідроксипропілцелюлози 4 %, кроскармелози натрію 6 %, діоксиду кремнію 0,86 %, стеарату магнію 2,57 %, пресували в таблетки. Крім профілю повільного вивільнення, параметри таблеток, головним чином крихкість, були незадовільними. Приклад 9біс: Одержували наступну суміш: активний інгредієнт 36,6 %, MCC 112 42,6 %, MCC 200 4,8 %, PVPK30 4,9 %, кросповідон XL 8 %, діоксид кремнію 1,14 %, стеарат магнію 2 % і пресували в таблетки. Профіль вивільнення при розчиненні був швидшим, ніж у прикладі 8, однак таблетки не пройшли тесту на крихкість, незважаючи на присутність зв’язувальної речовини. Приклад 10: Таблетки відповідно до винаходу мають наступну композицію Композиція Внутрішньогранулярна фаза Сполука X Мікрокристалічна целюлоза (MCC105) Повідон K30 Кросповідон XL Колоїдний діоксид кремнію Стеарат магнію Позагранулярна фаза Стеарат магнію Колоїдний діоксид кремнію Кросповідон XL 25 30 35 40 45 % мас./мас. 44,3 40,1 4,8 2,8 0,7 0,7 1,4 0,35 4,8 Таблетки одержували ущільненням прокаткою, і час розчинення та результати визначення крихкості були задовільними. Відповідна таблетка, що містить MCC 101 або MCC 112 замість MCC 105 і менше кросповідону, виявила прилипання до ротора і більш низьке середнє вивільнення при розчиненні в ацетатному буфері при pH 4,5 і в CSF через 10 хвилин. Тому, на диво, у зв'язку з результатами тестування представляється, що MCC 101 веде до змін відносно способу пресування при одержанні таблетки відповідно до цього винаходу. Приклад 11: Одержували препаративну форму, подібну до препаративної форми прикладу 10, що містить 63 % активного інгредієнта і відповідно зменшена кількість MCC 105 і збільшений зміст інших ексципієнтів. Препаративна форма дала задовільні результати тестів на крихкість та час повного розпаду, хоча розчинення при pH 4,5 було низьким. Приклад 12: Одержували препаративну форму, подібну до препаративної форми прикладів 10 і 11, що містить 11,3 % MCC 105 і прежелатинізований крохмаль 15 %, наприклад, крохмаль 1500, замість MCC 105 і PVPK30. Таблетки не пройшли тест на крихкість, і розчинення було повільним в обох середовищах, навіть хоча час повного розпаду перебував у межах 10 хв, на диво, показуючи, що прежелатинізований крохмаль може бути невідповідним у комбінації з моногідратною формою активного інгредієнта. Приклад 13: Препаративна форма, аналогічна прикладу 10, з лікарським навантаженням 55 % пройшла і тест на крихкість і тест на розчинення, незважаючи на те, що час розпаду склав 15 хв. Приклад 14 відповідає препаративній формі, аналогічній препаративній формі прикладу 13, з лікарським навантаженням 55 %, де повідон K30 заміщений коповідоном, наприклад, Kollidon VA64 Fine, 8 %, і відповідно знижена кількість MCC 105. Крихкість збільшилася у порівнянні з прикладом 13, і швидкість розчинення впала на 10 %, зокрема, у точку часу через 10 хв. На диво, швидкість розчинення була високою, незважаючи на час розпаду від 16 до 18 хв. 10 UA 109659 C2 5 Приклад 15: Препаративна форма мала лікарське навантаження 50 %, Kollidon VA64 Fine 8 % і певну кількість інших ексципієнтів. Спостерігали прилипання на ролику голівки екструдера під час ущільнення прокаткою. Підводячи підсумки прикладів 14 і 15, слід зазначити, що всупереч очікуванням, коповідон як ексципієнт не поліпшив характеристики препаративної форми відносно крихкості. Приклад 16 Внутрішньогранулярна фаза Сполука X Мікрокристалічна целюлоза (MCC105) Кросповідон XL Колоїдний діоксид кремнію Стеарат магнію Позагранулярна фаза Мікрокристалічна целюлоза (MCC200) Колоїдний діоксид кремнію Кросповідон XL Стеарат магнію Усього у % мас./мас. 10 15 20 30 5,0 0,34 1,1 1,1 100,0 Препаративна форма виявила гарну придатність до переробки без прилипання, однак спостерігалася нерівність поверхні таблеток, яку можна було усунути додаванням 0,5 % стеарату магнію на внутрішньогранулярній фазі або збільшенням сили пресування. В альтернативному варіанті кількість стеарату магнію у позагранулярній фазі збільшували на 0,5 %, коли стеарат магнію був присутній у внутрішньогранулярній фазі, і процес припиняли внаслідок проблем прилипання. Приклад 17: Ця препаративна форма відповідає препаративній формі прикладу 16, де кросповідон присутній у загальній кількості 4 %, MCC200 відсутній у позагранулярній фазі, і коповідон присутній у кількості 4 %. Спостерігали прилипання до ролика, а також недостатнє вивільнення при розчиненні та занадто повільний час розпаду. Ці дані підтверджують, що коповідон не повинен використовуватися в препаративній формі і може перешкоджати належному профілю вивільнення. Приклад 18: Номер препаративної форми Внутрішньогранулярна фаза Сполука X Мікрокристалічна целюлоза (MCC105) Мікрокристалічна целюлоза (MCC102) Кросповідон XL Колоїдний діоксид кремнію Стеарат магнію Позагранулярна фаза Мікрокристалічна целюлоза (MCC200) Колоїдний діоксид кремнію Кросповідон XL Стеарат магнію Усього в % мас./мас. 25 50 40,7 1,1 0,7 0 або 0,5 A B C 50 36,3 2,0 0,7 1,0 49,8 34,8 2,7 0,7 0,25 50 31,6 3 0,7 0,5 5,0 0,5 3,0 1,5 100,0 5,0 0,5 4,1 2,0 100,0 7,5 0,5 4,5 1,75 100,0 Ці препаративні форми успішно пройшли всі виконані тести, і під час процесу виробництва не виникали проблеми. Приклад 20: Капсули, що містять форму лактату моногідрату сполуки X, повинні мати профіль вивільнення якнайближче до однієї з капсул, що містять сполуку X у безводній формі. Композиція препаративної форми також повинна забезпечити можливість проведення надійного процесу. Зрештою, препаративна форма повинна відповідати стандарту стійкості. На диво, було виявлено, що використання кроскармелози натрію було неприйнятним, оскільки відбувалася взаємодія між моногідратною формою сполуки X і цим ексципієнтом при pH 4,5, що перешкоджає досягненню задовільного профілю вивільнення, тобто, профілю 11 UA 109659 C2 5 10 вивільнення приблизно від 75 до 80 % у середовищі з pH 4,5 протягом 60 хв. Цього не очікувалося. Варто було розв'язати проблему прилипання до роликів під час процесу одержання. Дефектні капсули були отримані внаслідок переповнення капсул розміру I під час процесу інкапсуляції, і тому розв'язок даної проблеми здійснювали зменшенням повної маси. Гідроксипропілцелюлозу тестували як наповнювач, і вивільнення шляхом розчинення відбувалося повільніше. Був включений маніт у кількості до 10 %, і це не чинило негативного впливу на вивільнення шляхом розчинення. На диво, було виявлено, що MCC 101 приводить до гіршого профілю вивільнення з капсульної препаративної форми, і це було несподіваним з тих же причин, що зазначені вище, а саме, що MCC 101 був зазначений при одержанні препаративної форми відповідно до заявки WO2007/064719. Номер препаративної форми Внутрішньогранулярна фаза Сполука X Мікрокристалічна целюлоза (MCC102) Мікрокристалічна целюлоза (MCC200) Маніт 200 SD Кросповідон XL Колоїдний діоксид кремнію Стеарат магнію Позагранулярна фаза Колоїдний діоксид кремнію Кросповідон XL Стеарат магнію Усього в % мас./мас. A B C D E 41,13 45,5 3,22 5,81 0,64 0,64 41,29 45,32 3,23 5,81 0,65 0,65 41,29 39,03 10,32 4,52 0,65 0,65 41,29 46,29 3,23 5,16 0,65 0,65 41,29 46,93 3,23 4,84 0,65 0,65 0,32 1,61 1,13 100,0 0,32 1,61 1,13 100,0 0,32 2,26 0,97 100,0 0,32 1,29 1,13 100,0 0,32 0,97 1,13 100,0 ФОРМУЛА ВИНАХОДУ 15 20 25 30 35 40 45 1. Фармацевтична композиція для перорального введення, що містить: a) внутрішньогранулярну фaзy, яка включає: 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Н-бензімідазол-2-іл]-1Н-хінолін-2-ону монолактату моногідрат у кількості від 40 до 65 % мас., один або більше наповнювачів, вибраних з групи, яка включає кондитерський цукор, пресований цукор, декстрат, декстрин, декстрозу, лактозу, маніт, мікрокристалічну целюлозу, порошкоподібну целюлозу, сорбіт, сахарозу, дикальційфосфат, крохмаль, прежелатинізований крохмаль, тальк та їх комбінації у кількості від 30 до 60 % мас., розпушувач, вибраний з групи, яка включає крохмаль, глину, целюлозу, альгінат, смолу, поперечно зшитий полімер, полісахарид сої та їх комбінації у кількості від 1 до 15 % мас., речовину, що сприяє ковзанню та/або змащувальну речовину, вибрану з групи, яка включає колоїдний діоксид кремнію, трисилікат магнію, крохмаль, тальк, триосновний фосфат кальцію, стеарат магнію, стеарат алюмінію, стеарат кальцію, карбонат магнію, оксид магнію, поліетиленгліколь, порошкову целюлозу, мікрокристалічну целюлозу та їх комбінації у кількості від 0,1 до 10 % мас., та b) позагранулярну фазу, яка включає: один або більше наповнювачів, які визначені вище, у кількості від 3 до 5 % мас., розпушувач, який визначений вище, у кількості від 1 до 5 % мас., речовину, що сприяє ковзанню, та/або змащувальну речовину, яка визначена вище, у кількості від 1 до 3 % мас., причому: зазначена внутрішньогранулярна фаза виготовлена за допомогою ущільнення валками та зазначена фармацевтична композиція одержана методом сухої грануляції. 2. Фармацевтична композиція за п. 1, у якій один або більше наповнювачів вибрані з переліку, що включає мікрокристалічну целюлозу, маніт або їх комбінації. 3. Фармацевтична композиція за п. 1 або 2, де зазначена фармацевтична композиція представлена у вигляді капсули і де наповнювач являє собою маніт. 4. Фармацевтична композиція за п. 1, що містить 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1Н-бензімідазол-2-іл]-1Н-хінолін-2-ону монолактату моногідрат у кількості від 40 до 65 % мас., 12 UA 109659 C2 5 10 15 20 25 30 35 речовину, що сприяє ковзанню, та/або змащувальну речовину, які являють собою діоксид кремнію та/або стеарат магнію в кількості від 0,1 до 10 % мас., де кількості за масою основуються на загальній масі композиції. 5. Фармацевтична композиція за будь-яким з пп. 1-4, у якій розпушувач присутній у внутрішньогранулярній фазі у кількості від 5 до 8 % мас. 6. Фармацевтична композиція за будь-яким з пп. 1-5, у якій речовина, що сприяє ковзанню, міститься в кількості від 0,5 до 2 % мас., а змащувальна речовина міститься в кількості від 1 до 4 % мас. у внутрішньогранулярній та/або позагранулярній фазі. 7. Спосіб одержання капсули, що містить композицію, як вона заявлена у будь-якому з пп. 1-6, у якому: (і) готують суміш для внутрішньогранулярної фази з 4-аміно-5-фтор-3-[6-(4-мeтилпiпepaзин-l-iл)1H-бензiмiдaзoл-2-iл]-lH-xiнoлiн-2-oнy моногідрату монолактату, одного або більше наповнювача (ів), розпушувача та речовини, що сприяє ковзанню, та/або змащувальної речовини, (іі) просівають суміш зі стадії (і), (ііі) змащують суміш зі стадії (іі) змащувальною речовиною, (iv) обробляють суміш зі стадії (ііі) за допомогою ущільнення валками, (v) об'єднують мелений гранулят зі стадії (iv) з розпушувачем і речовиною, що сприяє ковзанню, (vi) змащують змащувальною речовиною, і (vii) інкапсулюють суміш зі стадії (vi). 8. Спосіб одержання таблетки, що містить композицію, як вона заявлена у будь-якому з пп. 1-6, у якому: (і) готують суміш для внутрішньогранулярної фази з 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1іл)-1Н-бензімідазол-2-іл]-1Н-хінолін-2-ону моногідрату монолактату, одного або більше наповнювача(ів), розпушувача, та речовини, що сприяє ковзанню, та/або змащувальної речовини, (іі) просівають суміш, (ііі) додають змащувальну речовину, як визначена вище, (iv) обробляють суміш зі стадії (ііі) шляхом ущільнення валками, (v) об'єднують мелений гранулят зі стадії (iv) з речовиною, що сприяє ковзанню, наповнювачем і розпушувачем, та змішують, (vi) змащують змащувальною речовиною, і (vii) формують таблетки шляхом пресування композиції зі стадії (vi). 9. Композиція за будь-яким з пп. 1-6, у якій лактат 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)1Н-бензімідазол-2-іл]-1Н-хінолін-2-ону представлений у формі НА. Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical compositions comprising 4-amino-5-fluoro-3-[6-(4-methylpiperazin-1-yl)-1h-benzimidazol-2-yl]-1h-quinolin-2-one lactate monohydrate
Автори англійськоюThakur, Jeewan, Qiu, Zhihui
Автори російськоюТакур Дживан, Чиу Жихуи
МПК / Мітки
МПК: A61P 35/00, A61K 31/496, A61K 9/20
Мітки: лактату, композиції, 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1н-бензімідазол-2-іл]-1н-хінолін-2-ону, моногідрат, фармацевтичні, містять
Код посилання
<a href="https://ua.patents.su/15-109659-farmacevtichni-kompozici-shho-mistyat-4-amino-5-ftor-3-6-4-metilpiperazin-1-il-1n-benzimidazol-2-il-1n-khinolin-2-onu-laktatu-monogidrat.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичні композиції, що містять 4-аміно-5-фтор-3-[6-(4-метилпіперазин-1-іл)-1н-бензімідазол-2-іл]-1н-хінолін-2-ону лактату моногідрат</a>
Попередній патент: Антитіло проти cgrp
Наступний патент: Заміщені 5-фтор-1н-піразолопіридини та їх застосування
Випадковий патент: Спосіб обробки розплаву металу