Похідні 2-аміно-2-фенілалканолу, їх одержання та фармацевтичні композиції, що містять їх
Формула / Реферат
1. Складноефірне похідне 2-аміно-2-фенілалканолу загальної формули:
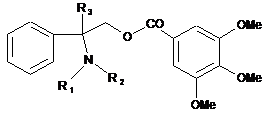 , (I)
, (I)
де:
R1 являє собою атом водню, алкільний радикал, що містить від 1 до 4 атомів вуглецю в лінійному або розгалуженому ланцюзі, алкільний радикал, що містить від 2 до 4С у лінійному або розгалуженому ланцюзі, заміщений гідрокси, алкокси, алкілтіо, ацилокси, аміно, алкіламіно, діалкіламіно, алкілкарбамоїлокси, алкоксикарбоніламіно, уреїдо або алкілуреїдо,
R2 являє собою -CO-R-радикал, у якому R являє собою атом водню, алкільний радикал, арил, гетероцикліл, бензил або гетероциклілметильний радикал, -CO-Y-R4-радикал, у якому Υ являє собою гетероатом, вибраний з -О-, -S-, -ΝΗ-, -Nalk-, де alk являє собою лінійний або розгалужений алкільний радикал, що містить від 1 до 4С, a R4 вибирають з алкільного, арильного, аралкільного або гетероциклілалкільного радикалів, що можуть бути заміщені одним або більше атомами галогену, або гідроксильного, алкільного радикалів, що містять від 1 до 4С у лінійному або розгалуженому ланцюзі, алкокси, алкілтіо, ациламіноалкілтіо, алкоксикарбонілу або ациламіно, алкільні залишки яких містять від 1 до 4С у лінійному або розгалуженому ланцюзі, або оксо, або може бути заміщений R5COO-радикалом, у якому R5 являє собою алкільний радикал, необов'язково заміщений бензилоксикарбоніламіно, ациламіно або амінокислотним залишком, або являє собою гетероциклільний радикал, або
R2 являє собою алкільний радикал, що містить від 2 до 4С, заміщений гідрокси, алкокси, алкілтіо, ацилокси, аміно, алкіламіно, діалкіламіно, алкільні залишки якого можуть утворювати з атомом азоту, до якого вони приєднані, гетероцикл, що має 5 або 6 членів, що необов'язково несе ще один гетероатом, вибраний з кисню або азоту, або заміщений алкілкарбамоїлокси, алкоксикарбоніламіно, уреїдо або алкілуреїдо, при цьому варто розуміти, що вищезгаданий заміщений алкільний радикал являє собою лінійний або розгалужений ланцюг і містить щонайменше 2 атоми вуглецю між атомом азоту, що несе R2 і замісник;
R3 являє собою алкільний радикал, що містить від 1 до 4 атомів вуглецю в лінійному або розгалуженому ланцюзі, у їх R- або S-формах або їх суміші,
а також його фармацевтично прийнятні солі.
2. Похідне складного ефіру 2-аміно-2-фенілалканолу за п. 1, яке відрізняється тим, що воно відповідає або формулі (Іа), що відповідає загальній формулі (І), у якій R1 і R3 визначені в п. 1, a R2 у -NR1R2 являє собою -CO-O-R4-радикал, у якому R4 має структуру:
![]() , (X)
, (X)
причому alk являє собою алкільний радикал, що містить від 1 до 6 атомів вуглецю в лінійному або розгалуженому ланцюзі, a R5 визначений у п. 1; або відповідає формулі (Іа'), що відповідає загальній формулі (І), у якій R3 визначений у п. 1, і в -NR1R2 R1 являє собою атом водню, a R2 являє собою -CO-R-радикал, що визначений у п. 1.
3. Похідне складного ефіру 2-аміно-2-фенілалканолу за п. 2, яке відрізняється тим, що воно відповідає загальній формулі (Іа), у якій R1 являє собою атом водню, алкільний радикал, що містить від 1 до 4 атомів вуглецю, переважно метильний або 2-метоксіетильний радикал, a R2 і R3 визначені в п. 2.
4. Похідне складного ефіру 2-аміно-2-фенілалканолу за п. 1, яке відрізняється тим, що воно відповідає формулі (Іb) загальної формули (І), у якій R1 і R3 визначені в п. 1, a R2 у -NR1R2 являє собою заміщений алкільний радикал, як визначено для R2 у п. 1.
5. Спосіб одержання похідного за п. 1, який відрізняється тим, що на похідне загальної формули:
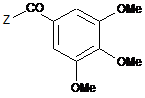 , (II)
, (II)
у якій Ζ являє собою атом галогену, гідроксильний радикал або залишок реакційноздатного складного ефіру, діють 2-аміно-2-фенілалканолом загальної формули:
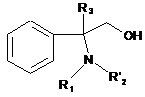 , (III)
, (III)
у якій R1 і R3 визначені вище, a R'2 являє собою атом водню або визначений вище як R2 у п. 1, після чого здійснюють, за необхідності, якщо один з R'2 або R1 являє собою атом водню, заміщення аміногрупи одержаного похідного складного ефіру 2-аміно-2-фенілалканолу загальної формули:
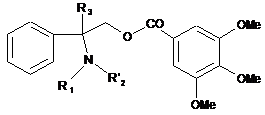 , (IV)
, (IV)
у якій R1, R'2 і R3 визначені вище;
або, якщо R'2 являє собою Н і якщо необхідно одержати похідні, у яких R2 являє собою -CO-R, за допомогою дії реакційноздатного похідного кислоти загальної формули:
![]() , (V)
, (V)
у якій R визначено в п. 1;
або, якщо R'2 являє собою Н і необхідно одержати похідні, у яких R2 являє собою -CO-Y-R4, при цьому Υ являє собою О, S, NH або Nalk,
або за допомогою дії фосгену, після чого здійснюють реакцію зі спиртом або тіолом загальної формули:
![]() , (VI)
, (VI)
у якій R4 являє собою необов'язково заміщений алкільний радикал і, у якому, за необхідності, функціональні групи, що можуть заміщатися в ході реакції, попередньо захищають, або арил, аралкіл або гетероциклілалкільний радикал, a Y являє собою атом кисню або сірки, або ΝΗ- або Nalk-радикал,
- або за допомогою дії галоїду загальної формули:
![]() ,(VII)
,(VII)
у якій R4, визначений у п. 1, являє собою переважно розгалужений арил або алкіл, Υ являє собою атом кисню або сірки, a Hal являє собою атом галогену, переважно хлор,
або, якщо необхідно одержати радикал R4, що несе замісник -C(alk)-O-CO-R5, у якому alk визначений у п. 2, a R5 визначений у п. 1, за допомогою дії хлоралкілхлорформіату, після чого здійснюють реакцію одержаного продукту із сіллю лужного металу відповідної кислоти R5COOH або, як альтернатива, срібною сіллю або сіллю четвертинного амонію вищезгаданої кислоти;
або, якщо R'2 являє собою Н і якщо необхідно одержати похідні, у яких R2 являє собою заміщений алкіл, або було одержане похідне загальної формули (IV), у якому R1 являє собою атом водню, a R'2 визначено як R2 у п. 1, і якщо необхідно одержати продукт загальної формули (І), у якому R1 являє собою необов'язково заміщений алкіл, за допомогою ацилування галогенангідридом або реакційноздатним ефіром зі структурою:
![]() (VIIIa) або
(VIIIa) або
![]() , (VIIIb)
, (VIIIb)
у якій R1 або R2 визначені вище, a Z являє собою атом галогену або залишок реакційноздатного складного ефіру, після чого здійснюють відновлення аміду, що утворився, до аміну;
або також, якщо було одержане похідне загальної формули (IV), у якій R1 являє собою атом водню, a R'2 визначено як R2 у п. 1, і якщо необхідно одержати продукт загальної формули (І), у якій R1 являє собою алкіл, за допомогою дії галогенованого похідного формули:
![]() , (IX)
, (IX)
у якій R1 являє собою алкільний радикал, а X являє собою атом галогену або сульфоновий радикал, у присутності основи,
потім одержаний продукт необов'язково перетворюють у фармацевтично прийнятну сіль.
6. Фармацевтична композиція, що містить щонайменше один продукт за п. 1 в комбінації з одним або більше придатними і фармацевтично прийнятними розріджувачами або допоміжними речовинами.
Текст
Реферат: Винахід стосується похідних складного ефіру 2-аміно-2-фенілалканолу загальної формули (І), у якій: R1 являє собою Н, лінійний або розгалужений алкіл, що містить від 1 до 4С, лінійний або розгалужений алкіл, що містить від 2 до 4С, заміщений ОН, алкокси, алкілтіо, ацилокси, NH2, алкіламіно, діалкіламіно, алкілкарбамоїлокси, алкоксикарбоніламіно, уреїдо або алкілуреїдо, R2 являє собою -CO-R-радикал, у якому R являє собою Н, алкіл, арил, гетероцикліл, бензил або гетероциклілметил, або R2 являє собою -CO-Y-R4-радикал, у якому Υ являє собою -О-, -S-, -ΝΗ, -Nalk-, де alk являє собою лінійний або розгалужений (від 1 до 4С) алкіл, a R4 являє собою алкіл, арил, аралкіл або гетероциклілалкіл, що можуть бути заміщені одним або більше атомами галогену або ОН-радикалами, лінійним або розгалуженим (від 1 до 4С) алкілом, UA 101013 C2 (12) UA 101013 C2 алкокси, алкілтіо, ациламіноалкілтіо, алкоксикарбонілом або ациламіно (від 1 до 4С) лінійним або розгалуженим, або оксо, або може бути заміщений R5COO-радикалом, у якому R5 являє собою алкіл, необов'язково заміщений бензилоксикарбоніламіно, ациламіно або амінокислотним залишком, або являє собою гетероциклільний радикал, або R2 являє собою алкіл (від 2 до 4С), заміщений ОН, алкокси, алкілтіо, ацилокси, NH2, алкіламіно, діалкіламіно, що необов'язково утворюють з атомом азоту, до якого вони приєднані, 5- або 6-членний гетероцикл, що необов'язково несе ще один гетероатом (О або N), або заміщений алкілкарбамоїлокси, алкоксикарбоніламіно, уреїдо або алкілуреїдо, при цьому вищезгаданий лінійний або розгалужений заміщений алкільний радикал містить щонайменше 2С між >N-R2 і замісником; і R3 являє собою алкіл (від 1 до 4С) лінійний або розгалужений, якщо не обговорено спеціально, алкіл або ацил є лінійним або розгалуженим (від 1 до 7С), у їх R- або S-формах або їх суміші, а також їх фармацевтично прийнятні солі. R3 O CO OMe N R1 R2 OMe OMe R1 R2 R3 R4 CH2OCOR7 NR5R6 (I) UA 101013 C2 5 10 Даний винахід відноситься до різним чином заміщених похідних 2-аміно-2-феніл-алканолу, які, зокрема, застосовні головним чином через їх анальгезуючу дію. Даний винахід також відноситься до одержання даних похідних, а також фармацевтичних композицій, що містять їх. (S) 2-метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоат і його застосування в лікуванні хронічного болю було описано в міжнародній заявці WO 99/01417. Застосування тримебутину, 2-диметиламіно-2-фенілбутил-3,4,5-триметокси-бензоату водневистого малеату, або його стереоізомерів у лікуванні запальних порушень і болю було описано в європейській заявці EP 1110549. Складні ефіри аміноспиртів із наведеною нижче структурою описані в Патентній заявці Сполученого Королівства GB 1434826: R4 R1 CH2OCOR7 R2 NR5R6 R3 15 20 у якій з R1 по R3 можуть являти собою, зокрема, атом водню, R4 може являти собою алкільний радикал, R7 може являти собою арил, необов'язково заміщений від 1 до 3 алкоксильними радикалами, і R5 і R6 являють собою атом водню, алкільний або аралкільний радикал або утворюють гетероцикл разом з атомом азоту, до якого вони приєднані. Дані продукти застосовні як спазмолітики. Заявка Сполученого Королівства також описує карбамати, у яких R7 має структуру -NH-R"7. Утворені в такий спосіб арилкарбамати мають анальгетичну і протизапальну активність. Однак подібні модифікації аміну були досить обмеженими і не здатні були приводити до ефективних анальгетиків. У даний час виявлено, що похідні складного ефіру 2-аміно-2-феніл-алканолу загальної формули: R3 CO OMe O (I) N 25 30 35 40 45 R1 OMe R2 OMe де: R1 являє собою атом водню, алкільний радикал, що містить від 1 до 4 атомів вуглецю в лінійному або розгалуженому ланцюзі, алкільний радикал, що містить від 2 до 4C у лінійному або розгалуженому ланцюзі, заміщений гідрокси, алкокси, алкілтіо, ацилокси, аміно, алкіламіно, діалкіламіно, алкілкарбамоїлокси, алкоксикарбоніламіно, уреїдо або алкілуреїдо, R2 являє собою -CO-R радикал, у якому R являє собою атом водню, алкільний радикал, арил, гетероцикліл, бензил або гетероциклілметильний радикал, -CO-Y-R4 радикал, у якому Y являє собою гетероатом, обраний з -O-, -S-, -NH-, -Nalk-, де alk являє собою лінійний або розгалужений алкільний радикал, що містить від 1 до 4C, а R 4 вибирають з алкільного, арильного, аралкільного або гетероциклілалкільного радикалів, що можуть бути заміщені одним або більше атомами галогену, або гідроксильного, алкільного радикалів, що містять від 1 до 4C у лінійному або розгалуженому ланцюзі, алкокси, алкілтіо, ациламіноалкілтіо, алкоксикарбонілу або ациламіно, алкільні залишки яких містять від 1 до 4C у лінійному або розгалуженому ланцюзі, або оксо, або може бути заміщений R5COO- радикалом, у якому R5 являє собою алкільний радикал, необов'язково заміщений бензилоксикарбоніламіно, ациламіно або амінокислотним залишком, або являє собою гетероциклільний радикал, або R2 являє собою алкільний радикал, що містить від 2 до 4C, заміщений гідрокси, алкокси, алкілтіо, ацилокси, аміно, алкіламіно, діалкіламіно, алкільні залишки якого можуть утворювати з атомом азоту, до якого вони приєднані, гетероцикл, що має 5 або 6 членів, що необов'язково несе ще один гетероатом, обраний з кисню або азоту, або заміщений алкілкарбамоїлокси, алкоксикарбоніламіно, уреїдо або алкілуреїдо, при цьому слід розуміти, що вище згаданий заміщений алкільний радикал являє собою лінійний або розгалужений ланцюг і містить, щонайменше, 2 атоми вуглецю між атомом азоту, що несе R2 і замісником; 1 UA 101013 C2 5 10 15 20 25 R3 являє собою алкільний радикал, що містить від 1 до 4 атомів вуглецю в лінійному або розгалуженому ланцюзі, у їх R або S формах або їх суміші, а також їх фармацевтично прийнятні солі, якщо такі існують, мають особливо цінну активність як анальгетики, зокрема, у лікуванні хронічного болю. Варто розуміти, що, якщо не згадано спеціально, то алкільні або ацильні радикали або залишки є лінійними або розгалуженими і містять від 1 до 7 атомів вуглецю, зокрема, ацильні радикали можуть бути ацетильними радикалами. Арильні або аралкільні радикали можуть бути моно або біциклічними радикалами, що містять від 6 до 10 членів, наприклад, феніл, нафтил, бензил, фенетил або нафтилалкіл. Варто розуміти, що гетероциклільні радикали можуть бути моно або біциклічними радикалами, ароматичними або неароматичними, що містять від 5 до 10 членів, і, що містять від 1 до 4 гетероатомів, обраних з кисню, азоту або сірки. Зокрема вони можуть бути обрані з тієнільного, фурильного, піролільного, піролідинільного, піперидильного, піридильного, піразинільного, піримідинільного, піридазинільного, піперазинільного, діоксолільного, імідазолільного, імідазолінільного, піразолільного, тетразолільного, піранільного, тетрагідропіранільного, тетрагідрофуранільного, оксазолільного, тіазолільного, тіазинільного, морфолінільного, тіоморфолінільного, індолільного, індолізинільного, хінолільного, нафтиридинільного радикалів. Варто розуміти, що амінокислоти, згадані вище, можуть бути, зокрема, обрані з гліцину, аланіну, лейцину, ізолейцину, проліну, валіну, фенілаланіну в L або D формах, і що дані групи захищаються перед реакціями синтезу, у вигляді амідів або карбаматів; захист і звільнення захищених радикалів здійснюється у відповідності зі способами, описаними T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 4th Edition ISBN 978-0-471-69754-1, December 2006. Атоми галогену вибирають із хлору, фтору, брому і йоду. Відповідно до кращого варіанта здійснення даного винаходу, алкільний або ацильний радикали є лінійними або розгалуженими і містять від 1 до 4 атомів вуглецю. Відповідно до даного винаходу похідні складного ефіру 2-аміно-2-феніл-алканолу загальної формули (I) одержують за допомогою дії похідного загальної формули: 30 CO OMe Z (II) OMe OMe у якій Z являє собою атом галогену, гідроксильний радикал або залишок реакційноздатного складного ефіру, на похідне 2-аміно-2-фенілалканолу загальної формули: 35 R3 OH (III) N R1 40 R'2 у якій R1 і R3 визначені вище, а R'2 являє собою атом водню або визначено вище як R2, після чого слідує, за необхідності, якщо один з R' 2 або R1 являє собою атом водню, заміщення аміногрупи одержаного похідного складного ефіру 2-аміно-2-феніл-алканолу загальної формули: 2 UA 101013 C2 R3 O OMe CO (IV) N R1 5 10 15 20 25 30 35 40 45 50 OMe R'2 OMe у якій R1, R'2 і R3 визначені вище; або, якщо R'2 являє собою H, і якщо необхідно одержати похідні, у яких R2 являє собою -COR, за допомогою дії реакційноздатного похідного кислоти загальної формули: R-COOH (V) у якій R визначено вище; або, якщо R'2 являє собою H, і необхідно одержати похідні, у яких R2 являє собою -CO-Y-R4, при цьому Y являє собою O, S, NH або Nalk, - або за допомогою дії фосгену, після чого слідує реакція зі спиртом, тіолом або аміном загальної формули: R4-YH (VI) у якій R4 являє собою необов'язково заміщений алкільний радикал і, у якому, за необхідності, функціональні групи, які можуть заміщатися в ході реакції, попередньо захищаються, або арил, аралкіл або гетероциклілалкільний радикал, а Y являє собою атом кисню або сірки, або NH або Nalk радикал, - або за допомогою дії галоїду загальної формули: R4-Y-COHal (VII) у якій R4 визначений вище, являє собою переважно розгалужений арил або алкіл, Y являє собою атом кисню або сірки, а Hal являє собою атом галогену, переважно хлор, - або, якщо необхідно одержати радикал R4, що несе замісник -C(alk)-O-CO-R5, у якому alk визначений у п. 2, а R5 визначений у п. 1, за допомогою дії хлоралкілхлорформіату, після чого слідує реакція одержаного продукту із сіллю лужного металу відповідної кислоти R 5COOH, наприклад, натрієвою сіллю, калієвою сіллю або цезієвою сіллю відповідної кислоти: R 5COOCs, або, як альтернатива, срібною сіллю або сіллю четвертинного амонію (наприклад, третбутиламонієвою сіллю) вище згаданої кислоти; або, якщо R'2 являє собою H, і якщо необхідно одержати похідні, у яких R2 являє собою заміщений алкіл, або було одержане похідне загальної формули (IV), у якому R1 являє собою атом водню, а R'2 визначено як R2, і якщо необхідно одержати продукт загальної формули (I), у якому R1 являє собою необов'язково заміщений алкіл, за допомогою ацилювання галогенангідридом або реакційно здатним складним ефіром зі структурою: R2-CO-Z (VIIIa) або R1-CO-Z (VIIIb) у якій R1 або R2 визначені вище, а Z являє собою атом галогену або залишок реакційноздатного ефіру, після чого слідує відновлення аміду, що утворився, до аміну; або також, якщо було одержане похідне загальної формули (IV), у якій R 1 являє собою атом водню, а R'2 визначено як R2, і якщо необхідно одержати продукт загальної формули (I), у якій R1 являє собою алкіл, за допомогою дії галогенованого похідного формули: R1-X (IX) у якій R1 являє собою алкільний радикал, а X являє собою атом галогену або сульфоновий радикал, у присутності основи. Продукт загальної формули (II) може являти собою реакційноздатне похідне 3,4,5триметоксибензойної кислоти, таке як галогенангідрид або реакційно здатний ефір. Реакція похідного 2-аміно-2-фенілалканолу загальної формули (III) здійснюється переважно із застосуванням похідного, у якому R'2 являє собою атом водню. Якщо продукт загальної формули (II) являє собою реакційноздатне похідне 3,4,5-триметоксибензойної кислоти, таке як галогенангідрид або реакційно здатний складний ефір, то реакція похідного загальної формули (II) з похідним 2-аміно-2-феніл алканолу загальної формули (III) здійснюється переважно в присутності азотвмісної основи, такої як, наприклад, триетиламін, диметиламінопіридин, діізопропілетиламін у випадку галогенангідриду формули (II), і дана реакція звичайно здійснюється в органічному розчиннику, такому як хлорований розчинник (дихлорметан, дихлоретан, хлороформ, наприклад), при температурі, що лежить у діапазоні від 0 до 70ºC, переважно в атмосфері азоту. А у випадку реакційноздатного складного ефіру формули (II), у 3 UA 101013 C2 5 10 15 20 25 30 35 40 45 50 55 присутності метилату натрію в органічному розчиннику, такому як толуол, у присутності спирту, такого як метанол або етанол, при температурі, що лежить у діапазоні від 25 до 150ºC. Якщо Z являє собою атом галогену, то він переважно вибирається з хлору або брому. Якщо продукт загальної формули (II) являє собою 3,4,5-триметоксибензойну кислоту, то реакція звичайно здійснюється в присутності карбодііміду, у галогенованому розчиннику (дихлорметан, дихлоретан, хлороформ, наприклад), при температурі, що лежить у діапазоні від 0 до 70ºC. Варто розуміти, що, якщо необхідно одержати похідне загальної формули (IV) у R або S формі, то реакції піддають похідне 2-аміно-2-фенілалканолу загальної формули (III) у R або S формі. Також варто розуміти, що похідні загальної формули (IV) у R або S формі приводять до похідних загальної формули (I) у R або S формі. Заміщення аміногрупи похідного загальної формули (IV) за допомогою дії реакційноздатного похідного кислоти загальної формули (V) переважно здійснюється із застосуванням галогенангідриду або складного ефіру, зокрема, реакційноздатного складного ефіру, переважно в присутності конденсаційного агента, такого як третинний амін (триетиламін, діізопропілетиламін, диметиламінопіридин, зокрема). Дану реакцію звичайно здійснюють в органічному розчиннику, такому як хлорований розчинник (дихлорметан, дихлоретан, хлороформ, наприклад), при температурі, що лежить у діапазоні від 0 до 70ºC. Якщо необхідно одержати похідне, у якому R2 являє собою форміл, то реакція переважно проводиться за допомогою дії складного ефіру, розведеного за допомогою розчинника. Реакція спирту або тіолу загальної формули (VI) здійснюється після дії фосгену на аміногрупу похідного загальної формули (IV), (у вигляді розчину в ароматичному розчиннику, такому як, наприклад, толуол), в органічному розчиннику, такому як галогенований розчинник (наприклад, хлорований розчинник, такий як дихлорметан, дихлоретан або хлороформ) у присутності четвертинного аміну (триетиламін, діізопропілетиламін, диметиламінопіридин, зокрема) при температурі, що лежить у діапазоні від 0 до 25ºC. Реакція спирту або тіолу загальної формули (VI) здійснюється за допомогою додавання похідного загальної формули (VI) у присутності третинного аміну, як згадано вище, при температурі, що лежить у діапазоні від 0 до 70ºC, у галогенованому розчиннику (дихлорметан, дихлоретан, хлороформ, наприклад). Переважно в атмосфері азоту. Варто розуміти, що якщо існує небезпека того, що замісники будуть заміщатися в ході реакції, то останні захищаються попередньо. Захист і вивільнення захищених радикалів здійснюється у відповідності зі способами, описаними T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 4th Edition ISBN 978-0-471-69754-1, December 2006. Реакція похідного загальної формули (VII) з аміногрупою похідного загальної формули (IV) здійснюється в присутності конденсаційного агента, такого як третинний амін (триетиламін, діізопропілетиламін, диметиламінопіридин, зокрема). Дану реакцію звичайно здійснюють в органічному розчиннику, такому як хлорований розчинник (дихлорметан, дихлоретан, хлороформ, наприклад), або тетрагідрофуран, при температурі, що лежить у діапазоні від 0 до 70ºC. Переважно дана реакція проводиться в атмосфері азоту. Якщо необхідно одержати сполуку, у якій радикал R 4 має замісник -C(alk)-O-CO-R5, то реакцію проводять за допомогою дії хлоралкілхлорформіату на сполуку загальної формули (IV), і дану реакцію проводять в органічному розчиннику, такому як хлорований розчинник (дихлорметан, дихлоретан, наприклад), або, такому як простий ефір (тетрагідрофуран, наприклад), при температурі від -10 до 50ºC. Після цього слідує реакція одержаної сполуки з лужною сіллю відповідної кислоти R5COOH, наприклад, натрієвою сіллю, калієвою сіллю або цезієвою сіллю, срібною сіллю або сіллю четвертинного амонію, в органічному розчиннику, такому як, наприклад, амід, такий як диметилформамід, хлорований розчинник (дихлорметан, наприклад), складний ефір (етилацетат, наприклад), ароматичний вуглеводень (толуол, наприклад), нітрил (ацетонітрил, наприклад), кетон (ацетон, метилетилетилкетон, наприклад), необов'язково в присутності йодиду натрію, при температурі від 0 до 60ºC. Якщо необхідно одержати сполуку загальної формули (I), у якій R 2 являє собою заміщений алкіл або в якій R1 являє собою необов'язково заміщений алкіл, то реакцію алкілування аміногрупи похідного загальної формули (IV) проводять у галогенованому розчиннику (дихлорметан, дихлоретан, наприклад) або в простому ефірі (тетрагідрофуран), при температурі, що лежить у діапазоні від 0 до 70ºC. При необхідності, реакційноздатний складний ефір можна одержати за допомогою гідроксибензотриазолу. Відновлення проводять у присутності борану в тетрагідрофурані, при температурі, що лежить у діапазоні від 0 до 70ºC. Реакцію продукту формули (IX) здійснюють із застосуванням галогенованого похідного, у якому галоген вибирають із хлору, брому або йоду, або із застосуванням сульфонового 4 UA 101013 C2 5 10 15 20 25 30 35 40 45 50 55 60 похідного, такого як тозилат, мезилат або трифлат, у присутності основи, такої як лужний карбонат (NaНСО3 або KHCO3, наприклад). Похідні 3,4,5-триметоксибензойної кислоти загальної формули (II) можна одержати відповідно до звичайних способів перетворення карбонових кислот у їх реакційноздатні похідні, що не змінюють іншу частину молекули. Похідні загальної формули (III) можна одержати у відповідності зі способом, описаним у патентних заявках FR 2765218 або EP 510168 або за аналогією зі способом, описаним у даних заявках. Галогеновані похідні загальної формули (VII) можна одержати за допомогою дії фосгену на відповідний спирт або тіол загальної формули (VI). Дану реакцію здійснюють при умовах аналогічних умовам, описаним раніше для дії фосгену на аміногрупу похідного загальної формули (IV). Варто розуміти, що, якщо необхідно одержати продукт загальної формули (I) у S або R формі, то реакції піддають похідне 2-аміно-2-фенілалканолу загальної формули (III) у S або R формі. Похідні 2-аміно-2-феніл алканолу загальної формули (III) у S або R формі можна одержати у відповідності зі способом, описаним у європейському патенті EP 510168, або за допомогою розділення у відповідності зі стандартними способами розділення енантіомерів, що не впливають на іншу частину молекули. Фармацевтично прийнятні солі можуть бути додатковими солями з кислотами, якщо такі існують. Зокрема, солі з мінеральними кислотами, такими як, наприклад, гідрохлориди, гідроброміди, сульфати, фосфати або солі приєднання органічних кислот, такі як, наприклад, ацетати, малеати, фумарати, тартрати, цитрати. Похідні загальної формули (I) можуть бути очищені відповідно до звичайних способів, зокрема, за допомогою хроматографії або за допомогою кристалізації. Похідні загальної формули (I) особливо застосовні завдяки їх ефективній анальгетичній активності, зокрема, при хронічному болі. Їх активність була продемонстрована in vitro при дослідженні інгібування натрієвих каналів 3 за способом з G. B. Brown, H-batrachotoxinin-A benzoate binding to voltage-sensitive sodium channels: inhibition by the channel blockers tetrodotoxin and saxitoxin, J. Neurosci., 6, 2064 (1986). У даному дослідженні in vitro, продукти відповідно до даного винаходу показали інгібувальні активності від 25 до 90 % при концентраціях 3,2 (M). Більш того, їх активність in vivo була продемонстрована на щурах у дослідженні болю з короткою і довгою фазою, викликаної формаліном, із застосуванням способу узятого з WheelerAceto et al., psychopharmacology, 104, 35-44 (1991). У даному способі продукт Прикладу 4 виявив активність і при короткій фазі, і при довгій у дозі 39,3 мг/кг при підшкірному шляху введення. Активність in vivo також була продемонстрована в дослідженні абдомінального болю, за допомогою ірритації і розтягання товстої кишки в щурів у відповідності зі способом аналогічним способу, описаному в Langlois et al., Euro. J. Pharmacol., 324, 211-217 (1997). У даному дослідженні продукт Прикладу 4 виявив активність у щурів при дозах від 13,1 мг/кг до 26,2 мг/кг при підшкірному шляху введення. Більш того, було показано, після в.в. ін'єкції щурам, що періоди напіввиведення деяких продуктів відповідно до даного винаходу є особливо тривалими. Нарешті, продукти відповідно до даного винаходу не виявляють токсичності. Фактично, у миші при внутрішньоочеревинному шляху введення в дозах 26,2 мг/кг при 7 уведеннях, що повторюються протягом 2 днів, і в щура при пероральному шляху введення в дозах 39,3 мг/кг, не спостерігалося ні смертності, ні ознак аномальної поведінки. Особливо застосовні продукти загальної формули (I), тут і далі називаної (Ia), у якій R 1 і R3 визначені вище, а R2 у -NR1R2 являє собою -CO-O-R4 радикал, у якому R4 має структуру: -C(alk)-O-CO-R5 (X) при цьому alk являє собою алкільний радикал, що містить від 1 до 6 атомів вуглецю в лінійному або розгалуженому ланцюзі, а R5 визначений у загальній формулі (I), або тут і далі називаної (Ia'), у якій R3 визначений вище, і в -NR1R2 R1 являє собою атом водню, а R2 являє собою -CO-R радикал, що визначений вище. А з продуктів загальної формули (Ia) і (Ia') більш кращими є продукти загальної формули (Ia), у якій R1 являє собою атом водню, алкільний радикал, що містить від 1 до 4 атомів вуглецю (зокрема, метил) або 2-метоксиетильний радикал. Також кращими є продукти загальної формули (I), тут і далі називаної (Ib), у якій R 1 і R3 визначені вище, а R2 у -NR1R2 являє собою заміщений алкільний радикал, як визначено вище для R2 у загальній формулі (I). 5 UA 101013 C2 5 Перераховані нижче приклади ілюструють даний винахід. У прикладах, що надані нижче, застосовувані абревіатури мають наступне значення: ДМФА диметилформамід ДМСО диметилсульфоксид ТГФ тетрагідрофуран DIPEA N, N-діізопропілетиламін ТСХ тонкошарова хроматографія Приклад 1 Синтез ORC012: O Cl O O N O O O O N NH O O O O O N 15 20 25 30 ORC012 ORC002 10 0,300 г (0,8 ммоль, 1 екв.) (S) 2-метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоату і 0,442 г (2,4 ммоль, 3 екв.) гідрохлорид нікотиноїлхлориду поміщають в атмосферу азоту, потім суспендують у 3 мл безводного 1,2-дихлоретану. Потім додають 0,4 мл (2,4 ммоль, 3 екв.) N, Nдіізопропілетиламіну. Перемішування підтримують протягом 20 годин при температурі навколишнього середовища. Одержану реакційну суміш обробляють 6 мл насиченого розчину NaHCO 3, потім екстрагують 12 мл дихлорметану. Органічну фазу знову промивають 6 мл насиченого розчину NaHCO 3, потім сушать над Na2SO4, фільтрують і випарюють досуха. Одержаний залишок очищають за допомогою флеш-хроматографії на силікагелі (градієнт етилацетат/циклогексан від 3:7 до 6:4, за об'ємом), для того, щоб одержати 0,189 г (46 %) очікуваного продукту (S) 2-(метил-3піридилкарбоніламіно)-2-феніл-н-бутил-3,4,5-триметоксибензоату у вигляді білої піни. 1 H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,93 (т, J=7,6 Гц, 3H, CH3); 2,27 (м, 1H, діастереотопний CH2); 2,52 (м, 1H, діастереотопний CH2); 2,91 (с, 3H, NCH3); 3,77 (с, 6H, 2×OCH3); 3,82 (с, 3H, OCH3); 5,03 (д, J=11,5 Гц, 1H, OCH2); 5,24 (д, J=11,5 Гц, 1H, OCH2); 7,10-7,40 (м, 8H, ArH); 7,73 + (д, J=7,8 Гц, 1H, ArH); 8,57 (д, J=4,9 Гц, 1H, ArH); 8,66 (м, 1H, ArH). LC-MS (ES): m/z=479 (M+H) . Rf (SiО2, дихлорметан/метанол 98:2): 0,36. (S) 2-метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоат можна одержати у відповідності зі способом, описаним у заявках FR 2765218 і EP 0510168. Приклад 2 Синтез ORC011: O O O O O O O O O O O O O O O Cl O ORC002 40 O O O 35 N N NH O O ORC011 Стадія 1: 1,17 г (2,83 ммоль; 1 екв.) (S) 2-метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоату поміщають в атмосферу азоту, потім розчиняють у 1 мл 1,2-дихлоретану. Потім повільно по краплях додають 0,77 мл (8,50 ммоль; 3 екв.) хлорметилхлороформіату. Одержану реакційну суміш перемішують протягом 6 годин при температурі навколишнього середовища, потім обробляють 10 мл насиченого розчину NaHCO 3, потім екстрагують 20 мл дихлорметану. Органічну фазу знову промивають 10 мл насиченого розчину NaHCO3, сушать над Na2SО4, фільтрують, потім випарюють досуха. 6 UA 101013 C2 5 10 15 20 25 30 35 40 45 50 Одержаний залишок очищають за допомогою флеш-хроматографії на силікагелі (етилацетат/циклогексан 2:8, за об'ємом), для того, щоб одержати 0,830 г (63 %) очікуваного продукту (S) 2-(хлорметоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5-триметоксибензоату у вигляді безбарвного масла. 1 H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,92 (т, J=7,2 Гц, 3H, CH3); 2,24 (м, 1H, діастереотопний CH2); 2,45 (м, 1H, діастереотопний CH2); 3,03 (с(шир), 3H, NCH3); 3,89 (с, 6H, 2×OCH3); 3,91 (с, 3H, OCH3); 4,99 (с(шир), 2H, OCH2); 5,71 (с(шир), 2H, ClCH2); 7,19-7,37 (м, 7H, ArH). MS (Cl, NH3): + +• + m/z (%)=483 [(M+NH4) , 65], 465 [(M ), 10], 343 [(MH-C302NClH5) , 100]. Rf (SiO2, етилацетат/циклогексан, 3:7): 0,41. Стадія 2: 0,289 г (0,62 ммоль; 1 екв.) (S) 2-(хлорметоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоату поміщають у розчин у 10,2 мл N, N-диметилформаміду, потім поміщають при 0ºC. Потім повільно додають білувату суспензію 0,125 г (0,62 ммоль; 1 екв.) ацетату цезію в 4,1 мл N, N-диметилформаміду. Перемішування підтримують протягом 17 годин при температурі навколишнього середовища. Потім додають додатково 0,038 г (0,18 ммоль; 0,3 екв.) ацетату цезію, і продовжують перемішування протягом 7 годин при температурі навколишнього середовища. Потім одержану реакційну суміш розбавляють у 20 мл етилацетату. Органічну фазу промивають 2×12 мл NaHC03 (10 %), 2×12 мл водою і 12 мл насиченого розчину NaCl, сушать над Na2SO4, фільтрують і випарюють досуха. Одержаний залишок очищають за допомогою флеш-хроматографії на силікагелі (градієнт етилацетат/циклогексан від 1:9 до 3:7, за об'ємом), для того, щоб одержати 0,065 г (20 %) очікуваного продукту (S) 2-(ацетоксиметоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоату у вигляді безбарвного масла. 1 H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,80 (т, J=6,5 Гц, 3H, CH3); 1,92 (с, 3H, CH3CO); 2,13 (с(шир), 1H, діастереотопний CH 2); 2,35 (м, 1H, діастереотопний CH2); 2,93 (с(шир), 3H, NCH3); 3,80 (с, 6H, 2×OCH3); 3,82 (с, 3H, OCH3); 4,82 (д, J=10,6Гц, 1H, діастереотопний CH2); 4,96 (м, 1H, діастереотопний OCH2); 5,57 (с(шир), 2H, OCH20); 7,10-7,27 (м, 7H, ArH). MS (CI, NH3): m/z + (%)=479 [(M+NH4-C2H5) , 100], 285 [15], 230 [15]. Rf (SiO2, етилацетат/циклогексан 3:7): 0,21. Приклад 3 Синтез ORC007: 0,40 г (1,07 ммоль; 1 екв.) (S) 2-метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоату поміщають в атмосферу азоту, потім поміщають у розчин у 53 мл дихлорметану. Потім додають 1,3 мл (2,53 ммоль; 2,36 екв.) розчину при 20 % фосгену в толуолі, потім додають 0,16 мл (1,18 ммоль; 1,1 екв.) триетиламіну. Перемішування підтримують протягом 22 годин при температурі навколишнього середовища. Потім додають 0,69 г (5,35 ммоль; 5 екв.) 4-(гідроксиметил)-5метил-1,3-діоксол-2-ону. Через ще 24 години при температурі навколишнього середовища одержану реакційну суміш промивають 2×40 мл водою і 1×40 мл 1M HCl. Одержану органічну фазу сушать над Na2SО4, фільтрують, потім випарюють досуха. Одержаний залишок очищають за допомогою 2 флеш-хроматографії на силікагелі (градієнт дихлорметан, потім етилацетат/циклогексан від 1:9 до 3:7, за об'ємом), для того, щоб одержати 0,085 г (15 %) очікуваного продукту (S) 2-(5-метил-1,3-діоксол-2-он-4-ілметиламіно)-2-феніл-нбутил-3,4,5-триметоксибензоату у вигляді безбарвного масла. 1 H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,78 (т, J=7,2 Гц, 3H, CH3); 1,94 (с, 3H, CH3); 2,02 (м, 1H, діастереотопний CH2); 2,32 (м, 1H, діастереотопний CH2); 3,02 (с(шир), 3H, NCH3); 3,80 (с, 6H, 2×OCH3); 3,82 (с, 3H, OCH3); 4,64 (с(шир), 2H, OCH2Csp2); 4,80 (м, 1H, діастереотопний OCH2); + 4,93 (м, 1H, діастереотопний OCH2); 7,10-7,27 (м, 7H, ArH). MS (CI, NH3): m/z (%)=547 [(M+NH4) , 5], 479 [80], 260 [100]. Rf (SiО2, дихлорметан/метанол, 98:2): 0,16. 7 UA 101013 C2 Приклад 4 Синтез ORC020: 5 10 15 20 25 30 Стадія 1: (S) 2-метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоат (1,49 г; 4,0 ммоль; 1 екв.) поміщають у розчин у 40 мл дихлорметану в 100 мл тригорлій колбі в потоці азоту. Розчин охолоджують до 0ºC. Потім додають розчин фосгену в толуолі при 20 % (4,95 мл; 9,4 ммоль; 2,4 екв.) і N, N-діізопропілетиламін (730 мкл; 4,4 ммоль; 1,1 екв.) при температурі, не перевищуючи 5ºC. Крижану баню видаляють, і одержану суміш перемішують протягом 20 годин. Одержують (S) 2-(хлорформілметиламіно)-2-феніл-н-бутил-3,4,5-триметоксибензоат. Стадія 2: 2,53 мл 4-метоксибензилового спирту (20 ммоль; 10 екв.) поміщають у розчин у 10 мл дихлорметану, потім додають по краплях половину об'єму одержаної реакційної суміші (871,8 мг; 2 ммоль; 1 екв.) (S) 2-(хлорформілметиламіно)-2-феніл-н-бутил-3,4,5-триметоксибензоату (стадія 1), тобто 20 мл одержаного розчину. Після 1 години при температурі навколишнього середовища додають N, N-діізопропілетиламін (1,30 мл; 8 ммоль; 4 екв.), потім перемішування підтримують протягом 20 годин. Одержану реакційну суміш доливають у 20 мл насиченого розчину NH4Cl (pН=7-8). Після декантування водну фазу екстрагують 2×20 мл дихлорметану. Органічні фази поєднують і промивають 2×20 мл насиченого розчину NH4Cl (pН=7, потім pН=6), і 20 мл напівнасиченого розчину NaCl, потім сушать Na 2SО4. Неочищений продукт очищають на силікагелі (35 частин, елюент етилацетат/циклогексан 7/3), для того, щоб одержати прозоре масло (S) 2-(4-метоксибензилоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоату (15 %; 170 мг). Одержане масло розчиняють у 1 мл ефіру і 1 мл пентану, для того, щоб одержати емульсію, яка буде стійкою. Колбу охолоджують протягом 2 годин при 4ºC, потім видаляють супернатант розчинника за допомогою пастерівської піпетки. Тверду речовину сушать за допомогою лопатевого насосу, для того, щоб одержати білу піну. Rf (SiО2, етилацетат/циклогексан 7:3): 0,42. 1 H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,86 (т, J=7,3 Гц, 3H); 2,16 (кв.д, J=7,3 Гц і 14,8 Гц, 1H, CH 2); 2,38 (кв.д, J=7,3 Гц і 14,8 Гц, 1H, CH2); 3,09 (шир.с, 3H); 3,80 (c, 3H); 3,87 (c, 6H); 3,91 (c, 3H); 4,93 (мл, 4H); 6,79 (м, 2H); 7,05 (мл, 1H); 7,18 (м, 2H); 7,30 (м, 6H). MS (CI, NH3): m/z=555 + [(M+NH4) ], 537, 494, 463, 268. Приклад 5 Синтез ORC009: 35 0,081 г (0,54 ммоль; 1 екв.) 4-ацетамідофенолу в атмосфері азоту поміщають у суспензію в 3,6 мл безводного етилацетату і поміщають в умови при температурі 0ºC. Потім додають 0,43 мл (0,82 ммоль; 1,54 екв.) 20 % розчину фосгену в толуолі. Потім додають (також при 0ºC) 0,075 8 UA 101013 C2 5 10 15 мл (0,54 ммоль; 1 екв.) триетиламіну. Потім суміш поміщають в умови при температурі навколишнього середовища. Через 1 годину додають 0,40 г (1,07 ммоль; 2 екв.) (S) 2метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоату. Перемішування продовжують протягом 18 годин при температурі навколишнього середовища. Одержану реакційну суміш розбавляють у 5 мл етилацетату, потім промивають 8 мл води і 8 мл 1M HCl. Органічну фазу сушать над Na2SО4, фільтрують, потім випарюють досуха. Одержаний залишок очищають за допомогою флеш-хроматографії на силікагелі (градієнт від дихлорметану до дихлорметан/метанол 9:1, за об'ємом). Одержаний продукт подрібнюють у порошок двічі в 1,5 мл пентан/ефір 1:1, для того, щоб одержати 0,092 г (31 %) білої твердої речовини (S) 2-(4-ацетиламінофенілоксикарбоніл метиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоату. 1 H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,86 (т, J=6,8 Гц, 3H, CH 3); 2,02 (c, 3H, CH3CO); 2,18 (м, 1H, діастереотопний CH2); 2,43 (м, 1H, діастереотопний CH2); 3,06 (с(b), 3H, NCH3); 3,79 (c, 6H, 2×OCH3); 3,83 (c, 3H, OCH3); 4,87 (д, J=11,1Гц, 1H, діастереотопний CH2); 5,03 (м, 1H, діастереотопний CH2); 6,70 (с(b), 1H, NH); 7,14-7,37 (м, 11H, ArH). MS (CI, NH3): m/z (%)=568 + + + [(M+NH4) , 90], 374 [(MH-C903NH8) , 10], 343 [(MH-C1003N2H11) , 40]. Rf (Si02, дихлорметан/метанол 98:2): 0,28. Приклад 6 Синтез ORC021: Cl O O O O O O O Cl O N O NH O O O O O Cl 20 25 30 35 40 ORC002 ORC021 400 мкл (2,4 ммоль; 3 екв.) DIPEA додають по краплях при температурі навколишнього середовища в атмосфері азоту до розчину 300 мг (0,8 ммоль; 1 екв.) (S) 2-метиламіно-2-фенілн-бутил-3,4,5-триметоксибензоату в 3 мл дихлорметану, потім додають по краплях 337 мкл (2,4 ммоль; 3 екв.) 4-хлорфенілхлорформіату. Одержану суміш перемішують при температурі навколишнього середовища протягом 70 годин. Одержану реакційну суміш доливають у 30 мл насиченого розчину NaHCО3 (pН=7), потім екстрагують 30 мл дихлорметану, потім 10 мл дихлорметану. Органічну фазу промивають 20 мл насиченого розчину NaCl (pН=7-8), потім сушать над Na2SО4 і випарюють досуха, для того щоб одержати масло. Останнє очищають на колонці із силікагелем (50 частин; елюент етилацетат/циклогексан 2/8). Одержане масло охолоджують до -50ºC в атмосфері азоту, для того щоб осадити продукт, додають 2×2 мл пентану. Потім одержаний продукт сушать під вакуумом протягом 1 години, для того щоб одержати білий порошок, що містить 4 % розчинника, який неможливо випарити до кінця. Одержаний порошок розчиняють у 1 мл CH2Cl2, потім випарюють досуха, для того щоб одержати білу піну (S) 2-(4-хлорфеноксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоату (360 мг, 85 %) після вакуумування протягом 20 годин. Rf (SiО2, етилацетат/циклогексан 4:6): 0,66. 1 H-ЯМР (CDCl3, 400 МГц): δ м.д.=0,94 (т, J=7,4 Гц, 3H); 2,27 (м, 1H, CH 2); 2,51 (кв.д, J=7,4 Гц і 14,6 Гц, 1H, CH2); 3,20 (шир.с, 3H); 3,88 (c, 6H); 3,92 (c, 3H); 5,00 (дд, J=10,4 Гц і J=61,1 Гц, 2H, CH2); 6,80 (шир.с, 2H); 7,23 (шир.м, 3H); 7,29 (м, 2H); 7,38 (м, 4H). MS (CI, NH3): m/z=545 + [(M+NH4) ], 343, 195. Приклад 7 Синтез ORC018: 9 UA 101013 C2 O O O O CH3CH2SCOCl O O N NH O O S O O O ORC002 5 10 15 20 ORC018 N, N-діізопропілетиламін (0,4 мл; 2,4 ммоль; 3 екв.) додають по краплях при температурі навколишнього середовища в атмосфері азоту до розчину (S) 2-метиламіно-2-феніл-н-бутил3,4,5-триметоксибензоату (300 мг; 0,8 ммоль; 1 екв.) у дихлоретані, потім по краплях додають етилхлортіоформіат (260 мкл; 2,4 ммоль; 3 екв.). Перемішування підтримують при температурі навколишнього середовища протягом 70 годин. Одержану реакційну суміш доливають у 30 мл насиченого розчину NaHCО3 (pН=7), потім екстрагують 30 мл дихлорметану і 10 мл дихлорметану. Органічну фазу промивають 20 мл насиченого розчину NaCl (pН=7-8), потім сушать над Na2SО4 і випарюють досуха. Одержане масло розчиняють у 3 мл ефіру, потім при м'якому нагріванні додають 3 мл пентану. Одержаний мутний розчин тримають холодним протягом 20 годин, потім видаляють супернатант за допомогою піпетки. Дану операцію проводять двічі 5 мл ефір/пентан. Потім одержані кристали сушать у колбі, для того щоб одержати білий порошок (S) 2-(етилтіокарбонілметиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоату (251 мг, 68 %). Rf (SiО2, етилацетат/циклогексан 1:3): 0,50. 1 H-ЯМР (CDCl3, 400МГц): δ м.д.=0,93 (т, J=7,4 Гц, 3H); 1,24 (т, J=7,3 Гц, 3H); 2,22 (кв.д, J=7,4 Гц і 14,3 Гц, 1H, CH2); 2,41 (кв.д, J=7,4 Гц і 14,3 Гц, 1H, CH2); 2,83 (кв., J=7,3 Гц, 2H); 3,02 (c, 3H); 3,88 (c, 6H); 3,90 (c, 3H); 4,99 (д, J=11,3 Гц, 1H, CH2); 5,11 (д, J=11,3 Гц, 1H, CH2); 7,16 (шир.с, + + 2H); 7,26 (м, 1H); 7,34 (м, 4H). MS (CI, NH3): m/z=479 [(M+NH4) ], 462 [(M+H) ], 343, 250. Приклад 8 Синтез ORC033: O O O N O O O O O O O N O O O O O O N Cl ORC033 25 30 35 40 Нікотинову кислоту (0,081 г, 0,00064 моль) розчиняють у ДМФА (1 мл) в атмосфері азоту. Додають фторид цезію (0,098 г, 0,00064 моль), і одержаний розчин перемішують при температурі навколишнього середовища протягом 15 хвилин. Одержаний розчин охолоджують до 0ºC і додають по краплях (S) 2-(хлорметоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоат (100,0 мг, 0,0002146 моль), попередньо розчинений у ДМФА (1 мл). Одержану суміш нагрівають при 70 °C протягом 17 годин. Після охолодження додають етилацетат (5 мл), і органічну фазу промивають насиченим розчином NaHCO3, потім насиченим розчином хлориду натрію. Органічну фазу сушать над Na2SO4, фільтрують і випарюють, для того щоб одержати 120 мг жовтого масла. Одержаний продукт очищають [(SiO2; циклогексан/AcOEt (3/7)], для того щоб одержати 86 мг (S)-2(нікотинілокси-метоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5-триметокси-бензоату у вигляді аморфної білої твердої речовини. ТШХ: SiO2, циклогексан/AcOEt (3/7) Rf 0,37. 1 ЯМР H (CDCl3): δ 0,86 (3H, т, J=7,55 Гц, CH3-CH2), 2,10-2,22 (1H, м, CH-CH3), 2,40-2,48 (1H, м, CH-CH3), 3,09 (3H, шир.с, NCH3), 3,85-3,88 (9H, д, J=9,79 Гц, 3 OCH3), 4,88-4,95 (2H, шир.д, J=9,61 Гц, CH2-O), 5,91 (2H, шир.с, CH2), 7,14 (2H, с, Harom), 7,25-7,39 (8H, м, Harom), 8,20 (1H, 10 UA 101013 C2 шир.с, Hpyr), 8,77-8,80 (1H, дд, J1=1,69 Гц, J2=4,89 Гц, Hpyr), 9,15 (1H, шир.с, Hpyr). MS (ES+): [M+H]+, m/z: 552. Приклад 9 Синтез ORC035: O O O N O O O O O O O N O O O O O O O N H Cl ORC035 5 10 15 20 25 O N-карбобензилоксигліцин (0,20 г, 0,00096 моль) розчиняють у ДМФА (2 мл) в атмосфері азоту. Додають фторид натрію (0,15 г, 0,00096 моль) і одержану суміш перемішують протягом 15 хвилин при температурі навколишнього середовища. Одержану суміш охолоджують до 0ºC і додають по краплях (S) 2(хлорметоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5-триметоксибензоат (150,0 мг, 0,0003219 моль) у розчині в ДМФА (2 мл). Одержану реакційну суміш перемішують при 70ºC протягом 2 годин. Після охолодження додають етилацетат (8 мл), і органічну фазу промивають насиченим водним розчином бікарбонату натрію (3 мл), потім насиченим розчином хлориду натрію (3 мл), потім органічну фазу сушать над Na 2SO4, фільтрують, потім випарюють, для того щоб одержати жовте масло. Одержаний продукт очищають: SiO 2, циклогексан/AcOEt (7/3 потім 6/4), для того щоб одержати 197 мг (S)-2-[(2-бензилоксикарбоніламіноацетоксиметоксикарбоніл)-метил-аміно]-2-феніл-бутилового складного ефіру 3,4,5-триметоксибензойної кислоти у вигляді жовтого масла. ТШХ: SiO2, циклогексан/AcOEt (3/7) Rf 0,50. 1 ЯМР H (CDCl3): δ м.д.=0,85 (3H, т, J=7,53 Гц, CH3-CH2), 2,08-2,27 (1H, м, CH-СН3), 2,36-2,46 (1H, м, СН-СН3), 3,05 (3Н, шир.с, NCH3), 3,85-3,90 (9Н, д, J=8,29 Гц, 3 OCH3), 4,86 (2H, шир.с, CH2-0), 5,11-5,20 (4H, м, 2 CH2), 5,70 (2H, шир.с, CH2), 7,16 (2H, с, Harom), 7,25-7,40 (10H, м, Harom). MS (ES+) [M+Na]+, m/z: 638. Приклад 10 Синтез ORC036: O O O N O O O O O O O N O O O O O O O Cl N H ORC036 30 35 N-ацетил-гліцин (0,075 г, 0,00064 моль) розчиняють у ДМФА (1 мл, 0,01 моль) в атмосфері азоту. Додають фторид цезію (0,098 г, 0,00064 моль), і одержану суміш перемішують протягом 15 хвилин при температурі навколишнього середовища. Одержану суміш охолоджують до 0ºC і по краплях додають (S) 2-(хлорметоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоат (100,0 мг, 0,0002146 моль) у розчині в ДМФА (1 мл). Одержану реакційну суміш нагрівають при 70ºC протягом 17 годин. Після охолодження додають етилацетат (5 мл), і органічну фазу промивають насиченим водним розчином бікарбонату натрію, потім насиченим водним розчином хлориду натрію (2 мл), і, нарешті, сушать над Na2SO4, фільтрують і випарюють, для того щоб одержати (S)-2-[(2 11 UA 101013 C2 5 ацетиламіно-ацетоксиметоксикарбоніл)-метил-аміно]-2-феніл-бутиловий складний ефір 3,4,5триметокси-бензойної кислоти у вигляді жовтого масла (205 мг). ТШХ: SiO2, циклогексан/AcOEt (1/9) Rf 0,34. 1 ЯМР H (CDCl3): δ м.д.=0,86 (3H, т, J=7,34 Гц, CH3-CH2), 2,04 (3H, с, CH3-CO), 2,18-2,26 (1H, м, CH-CH3), 2,32-2,57 (1H, м, CH-CH3), 3,05 (3H, шир.с, NCH3), 3,86-3,90 (9H, д, J=6,97 Гц, 3 OCH3), 3,96 (2H, шир.с, CH2), 4,83-4.90 (1H, шир.д, J=10,54 Гц, CH-O), 5,03-5,06 (1H, шир.с, CHO), 5,66-5,74 (2H, шир.с, CH2), 5,91-5,95 (1H, шир.с), 7,17 (2H, с, Harom), 7,24-7,37 (5H, м, Harom). MS (ES+) [M+Na]+, m/z: 546. Приклад 11 Синтез ORC037: 10 O OH OH NH2 O OH NH O NH NH O O O O O O ORC037 15 20 25 30 35 40 45 50 Стадія 1: (S)-2-аміно-2-феніл-бутан-1-ол (15,0 г, 0,0908 моль) розчиняють у метиленхлориді (150 мл) в атмосфері азоту. Додають 1-гідроксибензотриазол (13,5 г, 0,0998 моль), метоксиоцтову кислоту (7,82 мл, 0,0998 моль) і N-(3-диметиламінопропіл)-N'-етилкарбодііміду гідрохлорид (19,5 г, 0,0998 моль). Одержаний безбарвний розчин перемішують при температурі навколишнього середовища протягом 4 днів. Одержану суміш промивають 0,1н HCl (100 мл) і потім насиченим розчином хлориду натрію (100 мл). Органічну фазу сушать над Na2SO4, фільтрують і концентрують, для того щоб одержати 22,4 г жовтогарячого масла, яке піддають хроматографії: SiO 2, CH2Cl2/MeOH (99/1 і 98/2), для того щоб одержати 13,12 г злегка жовтуватої твердої речовини. 1 ЯМР H (CDCl3): δ 0,83 (3H, т, J=7,34 Гц, CH3-CH2), 1,97-2,18 (2H, м, CH2-CH3), 3,49 (3H, с, OCH3), 3,82-4,10 (4H, м, 2 CH2), 5,03 (1H, т, J=6,78 Гц, OH), 7,09 (1H, шир.с, NH), 7,28-7,42 (5H, м, Harom). Стадія 2: 13,120 г, 0,055290 моль (N-((S)-1-гідроксиметил-1-феніл-пропіл)-2-метоксиацетаміду) розчиняють у ТГФ (100 мл), в атмосфері азоту. Одержаний розчин охолоджують до 10ºC, потім додають по краплях боран-диметил сульфідний комплекс (16 мл, 0,16 моль). Одержану суміш перемішують при температурі навколишнього середовища протягом 2 днів. Повільно додають 70 мл метанолу, і одержаний розчин перемішують протягом 15 хвилин. Додають 100 мл 10 % розчину карбонату калію, потім додають 400 мл етилацетату. Органічну фазу промивають насиченим розчином хлориду натрію (100 мл), сушать над Na 2SO4, фільтрують, потім випарюють, для того щоб одержати 12,4 г жовтого масла. 1 ЯМР H (CDCl3): δ м.д.=0,69 (3H, т, J=7,34 Гц, CH3-CH2), 1,73-1,82 (1H, м), 1,90-2,01 (1H, м), 2,53-2,67 (2H, м, CH2), 3,30 (3H, с, OCH3), 3,48 (2H, м, CH2), 3,86-3,98 (2H, дд, J1=10,90 Гц, J2=15,07 Гц), 7,24-7,40 (5H, м, Harom). Стадія 3: 12,40 г (0,05553 моль), ((S)-2-(2-метокси-етиламіно)-2-феніл-бутан-1-олу) поміщають у колбу, оснащену відводом для дистиляту, потім розчиняють у суміші толуол (400 мл)/етанол (20 мл). Додають 18,71 г (0,08107 моль) метилового складного ефіру 3,4,5-триметокси-бензойної кислоти. Потім одержаний розчин нагрівають до 130ºC. Порціями додають 1,5 г, 0,028 моль метилату натрію при 130ºC. Одержану білу суспензію перемішують при 130ºC протягом 17 годин. Порціями додають ще 1,0 г метилату натрію при 130ºC, і одержану суспензію перемішують протягом ще 3 годин. Після охолодження одержану реакційну суміш випарюють, потім змішують з 3н розчином NaOH (200 мл). Одержану суміш перемішують протягом 15 хвилин, потім екстрагують етилацетатом (300 мл). Органічну фазу промивають насиченим розчином хлориду натрію (200 мл), сушать над Na2SO4, фільтрують і випарюють, для того щоб одержати 18,6 г жовтогарячого масла. Одержаний продукт очищають: SiO2, CH2Cl2, потім CH2Cl2/MeOH (95/5), для того щоб одержати 8,3 г жовтого масла. 12 UA 101013 C2 5 ТШХ: SiO2, CH2Cl2/MeOH (95/5) Rf 0,41. 1 ЯМР H (CDCl3): δ м.д.=0,80 (3H, т, J=7,34 Гц, CH3-CH2), 1,82-1,93 (2H, м), 2,51-2,57 (1H, м), 2,64-2,72 (1H, м), 3,31 (3H, с, OCH3), 3,46-3,51 (2H, м, CH2), 3,85-3,90 (9H, д, J=8,47 Гц, 3 OCH3), 4,51-4,67 (2H, дд, Jl=11,11 Гц, J2=24,30 Гц), 7,21-7,53 (7H, м, Harom). MS (ES+) [M+H]+, m/z: 417. (S) 2-аміно-2-феніл-н-бутанол можна одержати у відповідності зі способом, описаним у заявках FR 2765218 і EP 510168. Приклад 12 Синтез ORC050: O O O O O O O O O NH N N O O O O O O O O O ORC050 10 15 20 25 30 35 Стадія 1: (S)-2-метиламіно-2-феніл-бутиловий складний ефір 3,4,5-триметокси-бензойної кислоти (2,0 г, 0,0054 моль) розчиняють у метиленхлориді (20 мл) в атмосфері азоту. Додають 1гідроксибензотриазол (796 мг, 0,00589 моль), метоксиоцтову кислоту (541 мг, 0,00589 моль) і N(3-диметиламінопропіл)-N'-етилкарбодііміду гідрохлорид (1150 мг, 0,00589 моль). Безбарвний розчин перемішують при 40ºC протягом 2 днів. Одержану суміш промивають 0,1н хлористоводневою кислотою (20 мл), потім насиченим розчином хлориду натрію (20 мл). Органічну фазу сушать над Na2SO4, фільтрують і випарюють, для того щоб одержати 1,84 г жовтого масла. Одержаний продукт очищають: SiО2, циклогексан/AcOEt (1/1), для того щоб одержати 796 мг жовтого масла. ТШХ: SiO2, циклогексан/AcOEt (1/1) Rf 0,65. 1 ЯМР H (CDCl3): δ м.д.=0,91 (3H, т, J=7,34 Гц, CH3-CH2), 2,18-2,26 (1H, м), 2,38-2,46 (1H, м), 2,94 (3H, с, NCH3), 3,41 (3H, с, OCH3), 3,85-3,90 (9H, д, J=9,79 Гц, 3 OCH3), 4,09 (2H, шир.с, CH2), 4,99 (1H, д, J=11,49 Гц), 5,25 (1H, д, J=11,49 Гц), 7,11 (2H, с, Harom), 7,21-7,39 (5H, м, Harom). Стадія 2: 335 мг попередньо одержаного продукту розчиняють у ТГФ (1 мл). Додають по краплях 0,28 мл (0,0030 моль) боран-диметил сульфідного комплексу, і одержану суміш перемішують при температурі навколишнього середовища протягом 3 днів. До реакційної суміші додають метанол (0,7 мл), і одержаний розчин перемішують протягом 30 хвилин. Додають 10 % розчин карбонату калію (1 мл), а потім 3 мл етилацетату (3 мл). Органічну фазу промивають насиченим розчином хлориду натрію (1 мл), сушать над Na2SO4, фільтрують і випарюють, для того щоб одержати 135 мг злегка жовтуватого масла. Одержаний продукт очищають: SiО2, циклогексан/AcOEt (7/3), для того одержати 221 мг (S)-2-[(2-метоксиетил)-метиламіно]-2-фенілбутилового ефіру 3,4,5-триметокси-бензойної кислоти у вигляді безбарвного масла. 1 ЯМР H (CDCl3): δ м.д.=0,68 (3H, т, J=7,34 Гц, CH3-CH2), 1,87 (2H, кв., J=7,35 Гц, CH2-CH3), 2,44 (3H, с, NCH3), 2,84 (2H, т, J=6,59 Гц, CH2), 3,28 (3H, с, OCH3), 3,44 (2H, т, J=6,59 Гц), 3,823,90 (9H, д, J=16,58 Гц, 3 OCH3), 4,75-4,84 (2H, дд, J1=3,77 Гц, J2=11,87 Гц, CH2), 7,21-7,50 (7H, м, Harom). MS (ES+) [M+H]+, m/z: 431. Приклад 13 Синтез ORC051: 40 O O O O O O O O N O N O NH O O O Cl O O O O O O O O ORC051 45 Стадія 1: 200,0 мг (0,0005356 моль) (R) 2-(хлорметоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5триметоксибензоату розчиняють у метиленхлориді (1,0 мл) в атмосфері азоту. Безбарвний 13 UA 101013 C2 5 10 15 20 25 30 розчин охолоджують до -1ºC, і додають по краплях хлорметилхлорформіат (210 мг, 0,0016 моль). Одержану реакційну суміш перемішують при температурі навколишнього середовища протягом 17 годин. Потім безбарвний розчин охолоджують до -5ºC, і знову по краплях додають хлорметилхлорформіат (0,106 мг, 1,5 екв.). Одержаний розчин перемішують при температурі навколишнього середовища протягом 3 годин. Одержану суміш охолоджують до 0ºC, і знову по краплях додають хлорметилхлорформіат (106 мг, 1,5 екв.). Одержаний розчин перемішують при температурі навколишнього середовища протягом 2 годин, потім нагрівають при 40ºC протягом 1 години, потім перемішують при температурі навколишнього середовища протягом 15 годин. Органічну фазу обробляють насиченим розчином бікарбонату (3,0 мл) після того, як було додано 3 мл метиленхлориду. Органічну фазу промивають насиченим розчином хлориду натрію (3,0 мл), сушать над Na2SO4, фільтрують, потім випарюють, для того щоб одержати 150 мг злегка жовтого масла. 1 ЯМР H (CDCl3): δ м.д.=0,90 (3H, т, J=1,34 Гц, CH3-CH2), 2,17-2,24 (1H, м, CH-CH3), 2,36-2,46 (1H, м, CH-CH3), 3,01 (3H, шир.с, NCH3), 3,87-3,89 (9H, д, J=5,84 Гц, 3 OCH3), 4,93-4,97 (2H, шир.д, J=10,55 Гц, CH2-O), 5,69 (2H, шир.с, CH2-Cl), 7,17 (2H, с, Harom), 7,25-7,36 (5H, м, Harom). Стадія 2: (R)-2-(хлорметоксикарбонілметиламіно)-2-феніл-бутиловий складний ефір 3,4,5-триметоксибензойної кислоти (150,0 мг, 0,0003219 моль) розчиняють у ДМФА (2,0 мл) в атмосфері азоту. Одержаний розчин охолоджують до 0ºC, і по краплях додають ацетат натрію (195 мг, 0,000965 моль), розчинений у ДМФА (2,0 мл). Одержану суміш нагрівають при 70ºC протягом 15 годин. Після охолодження додають етилацетат (13,0 мл) і насичений розчин бікарбонату (13,0 мл). Одержану суміш перемішують протягом 15 хвилин при температурі навколишнього середовища. Органічну фазу промивають насиченим розчином хлориду натрію (10 мл), сушать над Na2SO4, фільтрують, потім випарюють, для того щоб одержати жовте масло. Одержаний продукт очищають на колонці: SiО2, Циклогексан/AcOEt (8/2), для того щоб одержати, після випарювання, 116 мг (R)-2-(ацетоксиметоксикарбонілметиламіно)-2-феніл-н-бутилового складного ефіру 3,4,5-триметокси-бензойної кислоти у вигляді жовтого масла. ТШХ: SiО2, Циклогексан/AcOEt (1/1) Rf: 0,64. 1 ЯМР H (CDCl3): δ м.д.=0,87 (3H, т, J=7,34 Гц, CH3-CH2), 1,99 (3H, шир.с, CH3-CO), 2,14-2,23 (1H, м, CH-CH3), 2,40-2,47 (1H, м, CH-CH3), 3,01 (3H, шир.с, NCH3), 3,87-3,89 (9H, д, J=5,65 Гц, 3 OCH3), 4,87-4,92 (2H, шир.д, J=10,73 Гц, CH2-0), 5,65 (2H, шир.с, CH2-Cl), 7,17 (2H, с, Harom), 7,257,36 (5H, м, Harom). MS (ES+) [M+NH4]+, m/z: 507. Приклад 14 Синтез ORC052: O O O NH N H NH2 45 50 55 O NH2 O N H O O O O 35 40 O OH N H OH OH O ORC052 Стадія 1: У хімічному реакторі розчиняють гідроксид натрію (17,120 г, 0,42803 моль) у воді (74 мл, 4,1 моль), потім додають порціями (5R)-5-етил-5-фенілімідазолідин-2,4-діон (20,0 г, 0,0979 моль). Одержану реакційну суміш нагрівають при 130ºC при перемішуванні протягом 48 годин. Дану суміш охолоджують, і утворюється білий осад. Рівень pН доводять до 7, потім осад промивають етилацетатом. Одержану суміш розбавляють у 300 мл води, охолодженої до 0ºC. Рівень pН доводять до 1 за допомогою 12M HCl (50,0 мл). Одержаний осад цілком розчиняють. Підтримуючи суміш при 0ºC, рівень pН доводять до 7 за допомогою 20 мл розчину 5н NaOH, для того щоб одержати білий осад. Одержану суміш фільтрують, осад промивають водою (150 мл), потім сушать під вакуумом при 40ºC, для того щоб одержати 22,8 г білої твердої речовини. 1 ЯМР H (MeOD): δ м.д.=1,06 (3H, т, J=7,34 Гц, CH 3-CH2), 2,30-2,38 (2H, м, CH2-CH3), 7,33-7,46 (3H, м, Harom), 7,55-7,59 (2H, м, Harom). Стадія 2: (2R)-2-аміно-2-фенілбутанову кислоту (21,60 г, 0,1205 моль) розчиняють у ТГФ (200 мл) в атмосфері азоту. По краплях додають боран-ТГФ 1M у розчині ТГФ (94 мл, 0,96 моль). Одержану суміш нагрівають при 70ºC при перемішуванні протягом 48 годин. По краплях додають боран-ТГФ 1M у розчині ТГФ (47 мл, 4 екв.). Одержану суміш нагрівають при 70ºC протягом 2 годин. Операцію повторюють. 14 UA 101013 C2 5 10 15 20 25 30 35 40 45 50 Зрештою, одержану суміш охолоджують до 0ºC, потім додають насичений розчин бікарбонату натрію (100,0 мл). Після додавання метиленхлориду органічну фазу промивають насиченим розчином хлориду натрію, зрештою, сушать над Na 2SO4, потім фільтрують і випарюють, для того щоб одержати 13,06 г злегка жовтуватої твердої речовини. 1 ЯМР H (MeOD): δ м.д.=0,59 (3H, т, J=7,34 Гц, CH3-CH2), 1,57-1,69 (1H, м, CH-CH3), 1,71-1,84 (1H, м, CH-CH3), 3,52-3,61 (2H, дд, J1=10,92 Гц, J2=4,14 Гц, CH2-OH), 7,09-7,33 (5H, м, Harom). Стадія 3: (R)-2-аміно-2-феніл-бутан-1-ол (13,060 г, 0,079040 моль) розчиняють у метиленхлориді (300 мл) в атмосфері азоту. Метоксиоцтову кислоту (7,99 г, 0,0869 моль), 1-гідроксибензотриазол (11,8 г, 0,0870 моль) і N-(3-диметиламінопропіл)-N'-етилкарбодіімід, (HCl) (16,70 г, 0,08537 моль) додають безпосередньо до суміші з мінімальною кількістю метиленхлориду. Одержаний розчин перемішують при температурі навколишнього середовища протягом 17 годин. Одержану суміш промивають 0,1M HCl (300,0 мл). Водну фазу екстрагують метиленхлоридом (3 рази 200,0 мл). Органічні фази поєднують, промивають насиченим розчином хлориду натрію (600,0 мл), сушать над Na2SO4, фільтрують, потім випарюють, для того щоб одержати 14 г жовтого масла. Одержаний продукт очищають: SiО2, CH2Cl2/MeOH (99/1, 98/2, 100 % MeOH), для того щоб одержати 5,17 г злегка жовтуватого масла. 1 ЯМР H (CDCl3): δ м.д.=0,83 (3H, т, J=7,34 Гц, CH3-CH2), 1,96-2,16 (2H, м, CH2-CH3), 3,49 (3H, с, OCH3), 3,82-4,10 (4H, м, 2 CH2), 5,03 (1H, т, J=6,78 Гц, OH), 7,09 (1H, шир.с, NH), 7,26-7,42 (5H, м, Harom). Стадія 4: N-(1-гідроксиметил-1-феніл-пропіл)-2-метокси-ацетамід (5,170 г, 0,02179 моль) розчиняють у ТГФ (50,0 мл) в атмосфері азоту. Одержаний розчин охолоджують до 10ºC, потім додають по краплях боран-диметил сульфідний комплекс (6,2 мл, 0,065 моль). Одержану суміш перемішують при температурі навколишнього середовища протягом 24 годин. Одержаний розчин охолоджують до 10ºC, потім додають по краплях боран-диметил сульфідний комплекс (6,2 мл, 3 екв.). Одержану суміш перемішують при температурі навколишнього середовища протягом 3 годин. Потім одержану суміш охолоджують до 0ºC, і додають по краплях метанол (27,0 мл). До одержаної суміші додають 40 мл 10 % розчину карбонату калію, потім 80 мл етилацетату. Водну фазу екстрагують етилацетатом. Органічну фазу промивають насиченим розчином хлориду натрію, сушать над Na2SO4, фільтрують, потім випарюють, для того щоб одержати 4,92 г жовтого масла. 1 ЯМР H (CDCl3): δ м.д.=0,66 (3H, т, J=7,34 Гц, CH3-CH2), 1,53-1,69 (1H, м), 1,73-1,89 (1H, м), 2,40-2,60 (2H, м, CH2), 3,36 (3H, с, OCH3), 3,43-3,48 (2H, м, CH2), 3,72-3,88 (2H, дд, J1=10,90 Гц, J2=15,07 Гц), 7,21-7,40 (5H, м, Harom). Стадія 5: (R)-2-(2-метокси-етиламіно)-2-феніл-бутан-1-ол (4,840 г, 0,02167 моль) розчиняють у суміші толуол (150 мл)/метанол (7,60 мл) у колбі, оснащеній відводом для дистиляту. Додають метиловий складний ефір 3,4,5-триметокси-бензойної кислоти (5,50 г, 0,0238 моль), і одержану суміш нагрівають до 130ºC. Порціями додають метилат натрію (0,58 г, 0,011 моль), і одержану суміш перемішують при 130ºC протягом 3 годин. Знову додають порціями метилат натрію (0,47 г, 0,0087 моль), і суміш перемішують при 130 °C протягом 15 годин. Одержану суміш охолоджують і потім випарюють. Додають 70 мл 3M водного розчину гідроксиду натрію, потім одержану суміш перемішують протягом 15 хвилин, перед тим як екстрагувати етилацетатом. Органічну фазу промивають насиченим розчином хлориду натрію, сушать над Na2SO4, фільтрують, потім випарюють, для того щоб одержати 8,87 г жовтогарячого масла. Одержаний продукт очищають на колонці: SiО 2, циклогексан/AcOEt (9/1, 8/2, потім 100 % AcOEt), для того щоб одержати 4,37 г (R)-2-(2-метокси-етиламіно)-2-фенілбутилового складного ефіру 3,4,5-триметокси-бензойної кислоти у вигляді злегка жовтуватого масла. ТШХ: SiO2 CH2Cl2/MeOH (95/5); Rf: 0,34. 1 ЯМР H(CDCl3), δ м.д.=0,80 (3H, т, J=7,34 Гц, CH3-CH2), 1,79-1,95 (2H, м), 2,50-2,57 (1H, м), 2,64-2,72 (1H, м), 3,31 (3H, с, OCH3), 3,46-3,51 (2H, м, CH2), 3,86-3,89 (9H, д, J=8,28 Гц, 3 OCH3), 4,51-4,67 (2H, дд, J1=11,11 Гц, J2=24,30 Гц), 7,21-7,53 (7H, m, Harom). MS (ES+) [M+H]+, m/z: 417. 15 UA 101013 C2 O O O O O O O O N N O O NH O O O O O O O O Cl O O O ORC002 5 10 15 20 25 30 ORC055 Стадія 1: 500 мг (1,34 ммоль; 1,0 екв.) (S) 2-метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоату розчиняють у 1 мл дихлорметану в атмосфері азоту. Одержану суміш охолоджують до 2ºC. При даній температурі по краплях додають 440 мкл (4,0 ммоль; 3,0 екв.) α-хлоретилхлорформіату. Одержану суміш перемішують при температурі навколишнього середовища протягом 5 годин. Дану реакцію контролюють за допомогою ТШХ. Дихлорметан випарюють в атмосфері азоту. Одержаний залишок у вигляді безбарвного масла застосовують на наступній стадії без очищення. 1 H-ЯМР (CDCl3, 300 МГц): δ м.д.=0,94 (м, 3H, CH3); 1,59 (м, 3H, CH3); 2,22 (м, 1H, діастереотопний CH2); 2,45 (м, 1H, діастереотопний CH2); 3,08 (шир., 3H, NCH3); 3,90 (с, 3H, OCH3); 3,91 (с, 3H, OCH3); 3,92 (с, 3H, OCH3); 5,00 (шир., 2H, OCH2); 6,48 (шир., 1H, ClCH); 7,197,39 (м, 7H, ArH). Rf (SiO2, циклогексан/етилацетат, 6/4): 0,8. Стадія 2: (S) 2-[(1-хлор-етоксикарбоніл)-метиламіно]-2-феніл-н-бутил-3,4,5-триметоксибензоат, одержаний на попередній стадії, розчиняють у 2 мл N, N-диметилформаміду. Додають 807 мг (3,67 ммоль, 2,7 екв.) ізобутирату цезію. Одержану суміш перемішують при 55ºC протягом ночі. Дану реакцію контролюють за допомогою ТШХ. До суміші додають 10 мл води. Одержаний продукт екстрагують етилацетатом (3 рази 10 мл), потім органічну фазу промивають послідовно водою і насиченим розчином хлориду натрію (15 мл). Органічні фази сушать над Na2SO4, фільтрують, потім концентрують досуха, для того щоб одержати коричневе масло. Одержане масло очищають за допомогою флешхроматографії на силікагелі (елюент: циклогексан/етилацетат: 85/15), для того щоб одержати 105 мг очікуваного продукту (S) 2-[(l-ізобутирилокси-етоксикарбоніл)-метиламіно]-2-феніл-нбутил-3,4,5-триметоксибензоату у вигляді безбарвного масла (вихід=15 %). 1 H-ЯМР (CDCl3, 300 МГц): δ м.д.=0,91 (м, 3H, CH3 етил); 1,10 (м, 6H, 2×CH3 ізопропіл); 2,2 (шир., 2H, CH2 етил); 2,4 (шир, 3H, CH3CH); 3,05 (шир, 4H, CH3N+CH ізопропіл); 3,89 (с, 6H, CH30); 3,89 (с, 6H, CH30); 3,91 (с, ЗН, СНЗО); 4,89-4,98 (шир, 2H, OCH2); 6,71 (шир, 1H, OCHO); 7,17-7,39 (м, 7H, ArH). Rf (SiO2, циклогексан/етилацетат, 6/4): 0,9. MS (ES+) [M+NH4]+, m/z: 549,2. Приклад 16 Синтез ORC056: 35 O O O O O O O O N O N O NH O O O O O O O Cl O O O O ORC002 NH ORC056 O 40 Стадія 1: 2 м (5,4 ммоль; 1,0 екв.) (S) 2-метиламіно-2-феніл-н-бутил-3,4,5-триметоксибензоату розчиняють у 4 мл дихлорметану в атмосфері азоту. Одержану суміш охолоджують до 2ºC. При даній температурі додають по краплях 884 мкл (8,0 ммоль; 1,5 екв.) α-хлоретилхлорформіату. Одержану суміш перемішують при температурі навколишнього середовища протягом 5 годин. Дану реакцію контролюють за допомогою ТШХ. Дихлорметан випарюють в атмосфері азоту. 16 UA 101013 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержаний залишок у вигляді безбарвного масла застосовують на наступній стадії без додаткового очищення. 1 H-ЯМР (CDCl3, 300 МГц): δ м.д.=0,94 (м, 3H, CH3); 1,59 (м, 3H, CH3); 2,22 (м, 1H, діастереотопний CH2); 2,45 (м, 1H, діастереотопний CH2); 3,08 (шир, 3H, NCH3); 3,90 (с, 3H, OCH3); 3,91 (с, 3H, OCH3); 3,92 (с, 3H, OCH3); 5,00 (шир, 2H, OCH2); 6,48 (шир, 1H, ClCH); 7,197,39 (м, 7H, ArH). (SiO2, циклогексан/етилацетат, 6/4): 0,8. Стадія 2: (S) 2-[(1-хлор-етоксикарбоніл)-метиламіно]-2-феніл-н-бутил-3,4,5-триметоксибензоат, одержаний на попередній стадії, розчиняють у 3 мл N, N-диметилформаміду. Додають 2,0 г (8,03 ммоль, 1,5 екв.) (ацетиламіно)ацетату цезію. Одержану суміш перемішують при 55ºC протягом ночі. Дану реакцію контролюють за допомогою ТШХ. До суміші додають 20 мл води. Одержаний продукт екстрагують етилацетатом (3 рази 50 мл), потім органічну фазу промивають послідовно водою і насиченим розчином хлориду натрію (10 мл). Органічні фази сушать над Na2SO4, фільтрують, потім концентрують досуха, для того щоб одержати коричневе масло. Одержане масло очищають за допомогою флешхроматографії на силікагелі (елюент: циклогексан/етилацетат: 3/7), для того щоб одержати 200 мг очікуваного продукту (S) 2-{[1-(2-ацетиламіно-ацетокси)-етоксикарбоніл]-метиламіно}-2феніл-н-бутил-3,4,5-триметоксибензоату у вигляді коричневої твердої речовини (вихід=7 %). 1 H-ЯМР (CDCl3, 300 МГц): δ м.д.=0,81 (м, 3Н, CH3 етил); 1,94 (с, 3Н, CH3CO); 2,15 (м, 2H, CH2 етил); 2,35 (м, 3H, CH3CH); 3,0 (шир, 3H, CH3N); 3,90 (м, 9H, OCH3); 4,80 (м, 2H, OCH2); 5,95 (шир, 2H, CH2N); 6,65 (шир, 1H, OCHO); 7,10-7,30 (м, 7H, ArH). Rf (Si02, циклогексан/етилацетат, 3/7): 0,2. [M+NH4]+, m/z: 578,2. Продукти загальної формули (I) можна вводити пероральним, парентеральним, перлінгвальним, ректальним способом, у вигляді аерозолів або у формі для місцевого застосування. Даний винахід також відноситься до фармацевтичних композицій, що містять, щонайменше, одного похідне складного ефіру 2-аміно-2-феніл-алканолу загальної формули (I) і/або його солі, якщо вони існують, у чистому вигляді або в комбінованій формі з одним або більше підходящими і фармацевтично прийнятними розріджувачами або допоміжними речовинами. Дані композиції можуть бути представлені у вигляді твердих композицій, зокрема, у вигляді таблеток, таблеток, покритих оболонкою, пігулок, желатинових капсул, порошків, з яких необхідно приготувати розчин або суспензію, або гранул, або у вигляді рідких композицій, таких як розчини або суспензії для ін'єкцій, розчини або суспензії для пиття, сиропи, емульсії, еліксири, що містять розріджувачі, такі як вода або парафінова олія, або у вигляді суппозиторіїв, кремів, мазей і лосьйонів, або також у вигляді композицій для розпилення. Дані фармацевтичні форми одержують відповідно до звичайних способів. У твердих композиціях для перорального введення активний інгредієнт відповідно до даного винаходу змішують з одним або більше інертними розріджувачами або допоміжними речовинами, такими як, наприклад, сахароза, лактоза, крохмаль або його похідні, мікрокристалічна целюлоза, колоїдний окис кремнію, повідон, тальк, аравійська камедь. Дані композиції можуть містити й інші речовини, крім розріджувачів, наприклад, лубрикант, такий як стеарат магнію або покриття, призначене для контрольованого вивільнення. Рідкі композиції, рідини для перорального введення можуть містити водні або неводні середовища, такі як розріджувачі, і можуть також містити й інші речовини, такі як, наприклад, що зволожувальні речовини, підсолоджувачі або ароматизатори. Неводні композиції можуть містити жири тваринного або рослинного походження, парафінові похідні, гліколі, соєвий лецитин. Композиції, які можна вводити парентеральним способом, більш конкретно являють собою композиції, які можна вводити внутрішньом'язовим або внутрішньовенним способом. Композиції для парентерального введення можуть являти собою стерильні розчини або емульсії. Як розчинник або середовище можна застосовувати розчинник або середовище, пропіленгліколь, поліетиленгліколь, рослинні олії, зокрема, маслинову олію, органічні ефіри для ін'єкцій, наприклад, етилолеат. Дані композиції також можуть містити допоміжні речовини, зокрема, зволожувальні, ізотонічні, емульгуючі, диспергуючі і стабілізуючі агенти і/або консерванти. Стерилізацію можна здійснювати декількома способами, наприклад, за допомогою бактеріологічного фільтра, за допомогою опромінення або за допомогою нагрівання. Дані композиції також можна одержати у вигляді стерильних твердих композицій, що розчиняють у 17 UA 101013 C2 5 10 15 20 25 30 стерильній воді або будь-якому іншому стерильному середовищі для ін'єкцій безпосередньо перед застосуванням. Композиції для ректального введення являють собою суппозиторії або ректальні капсули, що містять, крім активного інгредієнта, допоміжні речовини, такі як какао олія, напівсинтетичні гліцериди або поліетиленгліколі. Композиції для місцевого застосування можуть являти собою, наприклад, пластири, що містять підходящі допоміжні речовини, такі як кремнієва олія, парафін, а також активний інгредієнт. Композиції можуть також являти собою аерозолі. Для застосування у формі рідких аерозолів даної композиції можуть являти собою стійкі стерильні розчини або тверді композиції, що розчиняються безпосередньо перед застосуванням в апірогенній стерильній воді, сироватці або будь-якому іншому фармацевтично прийнятному середовищі. Для застосування у вигляді сухих аерозолів, призначених для безпосередніх інгаляцій, активний інгредієнт тонко подрібнюють і поєднують з розріджувачем або водорозчинним твердим середовищем, що має розмір частинок від 30 до 80 пм, наприклад, декстран, маніт або лактоза. При лікуванні людини лікар-терапевт буде визначати умовний режим дозування, найбільш підходящий для лікування відповідно до віку, маси тіла й інших факторів, що відносяться до пацієнта, якого необхідно лікувати. Звичайна доза, що варіюється в залежності від пацієнта, якого лікують, і відповідного порушення, може складати, наприклад, від 50 мг до 2 г у день для дорослої людини при пероральному шляху введення. Наведений нижче приклад ілюструє композицію відповідно до даного винаходу. Приклад: Готують склад, який можна вводити пероральним способом, що містить наведену нижче композицію: (S) 2-(хлорметоксикарбонілметиламіно)-2-феніл-н-бутил-3,4,5-триметоксибензоат 100 мг лактози моногідрат, модифікований маїсовий крохмаль, гідроксипропілметилцелюлоза, натрій-карбоксиметиловий крохмаль, винна кислота, колоїдний окис кремнію, стеарат магнію, макрогол 4000, діоксид титану. 35 ФОРМУЛА ВИНАХОДУ 1. Складноефірне похідне 2-аміно-2-фенілалканолу загальної формули: R3 O CO OMe N R1 R2 OMe OMe 40 45 50 , (I) де: R1 являє собою атом водню, алкільний радикал, що містить від 1 до 4 атомів вуглецю в лінійному або розгалуженому ланцюзі, алкільний радикал, що містить від 2 до 4С у лінійному або розгалуженому ланцюзі, заміщений гідрокси, алкокси, алкілтіо, ацилокси, аміно, алкіламіно, діалкіламіно, алкілкарбамоїлокси, алкоксикарбоніламіно, уреїдо або алкілуреїдо, R2 являє собою -CO-R-радикал, у якому R являє собою атом водню, алкільний радикал, арил, гетероцикліл, бензил або гетероциклілметильний радикал, -CO-Y-R4-радикал, у якому Υ являє собою гетероатом, вибраний з -О-, -S-, -ΝΗ-, -Nalk-, де alk являє собою лінійний або розгалужений алкільний радикал, що містить від 1 до 4С, a R4 вибирають з алкільного, арильного, аралкільного або гетероциклілалкільного радикалів, що можуть бути заміщені одним або більше атомами галогену, або гідроксильного, алкільного радикалів, що містять від 1 до 4С у лінійному або розгалуженому ланцюзі, алкокси, алкілтіо, ациламіноалкілтіо, алкоксикарбонілу або ациламіно, алкільні залишки яких містять від 1 до 4С у лінійному або розгалуженому ланцюзі, або оксо, або може бути заміщений R5COO-радикалом, у якому R5 являє собою 18 UA 101013 C2 5 10 15 20 25 алкільний радикал, необов'язково заміщений бензилоксикарбоніламіно, ациламіно або амінокислотним залишком, або являє собою гетероциклільний радикал, або R2 являє собою алкільний радикал, що містить від 2 до 4С, заміщений гідрокси, алкокси, алкілтіо, ацилокси, аміно, алкіламіно, діалкіламіно, алкільні залишки якого можуть утворювати з атомом азоту, до якого вони приєднані, гетероцикл, що має 5 або 6 членів, що необов'язково несе ще один гетероатом, вибраний з кисню або азоту, або заміщений алкілкарбамоїлокси, алкоксикарбоніламіно, уреїдо або алкілуреїдо, при цьому варто розуміти, що вищезгаданий заміщений алкільний радикал являє собою лінійний або розгалужений ланцюг і містить щонайменше 2 атоми вуглецю між атомом азоту, що несе R2 і замісник; R3 являє собою алкільний радикал, що містить від 1 до 4 атомів вуглецю в лінійному або розгалуженому ланцюзі, у їх R- або S-формах або їх суміші, а також його фармацевтично прийнятні солі. 2. Похідне складного ефіру 2-аміно-2-фенілалканолу за п. 1, яке відрізняється тим, що воно відповідає або формулі (Іа), що відповідає загальній формулі (І), у якій R1 і R3 визначені в п. 1, a R2 у -NR1R2 являє собою -CO-O-R4-радикал, у якому R4 має структуру: C(alk)-O-CO-R 5 , (X) причому alk являє собою алкільний радикал, що містить від 1 до 6 атомів вуглецю в лінійному або розгалуженому ланцюзі, a R5 визначений у п. 1; або відповідає формулі (Іа'), що відповідає загальній формулі (І), у якій R3 визначений у п. 1, і в -NR1R2 R1 являє собою атом водню, a R2 являє собою -CO-R-радикал, що визначений у п. 1. 3. Похідне складного ефіру 2-аміно-2-фенілалканолу за п. 2, яке відрізняється тим, що воно відповідає загальній формулі (Іа), у якій R1 являє собою атом водню, алкільний радикал, що містить від 1 до 4 атомів вуглецю, переважно метильний або 2-метоксіетильний радикал, a R2 і R3 визначені в п. 2. 4. Похідне складного ефіру 2-аміно-2-фенілалканолу за п. 1, яке відрізняється тим, що воно відповідає формулі (Іb) загальної формули (І), у якій R1 і R3 визначені в п. 1, a R2 у -NR1R2 являє собою заміщений алкільний радикал, як визначено для R2 у п. 1. 5. Спосіб одержання похідного за п. 1, який відрізняється тим, що на похідне загальної формули: Z CO OMe OMe 30 OMe , (II) у якій Ζ являє собою атом галогену, гідроксильний радикал або залишок реакційноздатного складного ефіру, діють 2-аміно-2-фенілалканолом загальної формули: R3 OH N R' 2 R1 35 , (III) у якій R1 і R3 визначені вище, a R'2 являє собою атом водню або визначений вище як R2 у п. 1, після чого здійснюють, за необхідності, якщо один з R'2 або R1 являє собою атом водню, заміщення аміногрупи одержаного похідного складного ефіру 2-аміно-2-фенілалканолу загальної формули: R3 O CO OMe N R1 R' 2 OMe OMe 40 , (IV) у якій R1, R'2 і R3 визначені вище; або, якщо R'2 являє собою Н і якщо необхідно одержати похідні, у яких R2 являє собою -CO-R, за допомогою дії реакційноздатного похідного кислоти загальної формули: R-COOH , (V) 19 UA 101013 C2 5 у якій R визначено в п. 1; або, якщо R'2 являє собою Н і необхідно одержати похідні, у яких R2 являє собою -CO-Y-R4, при цьому Υ являє собою О, S, NH або Nalk, або за допомогою дії фосгену, після чого здійснюють реакцію зі спиртом або тіолом загальної формули: R4-YH , (VI) 10 15 20 у якій R4 являє собою необов'язково заміщений алкільний радикал і, у якому, за необхідності, функціональні групи, що можуть заміщатися в ході реакції, попередньо захищають, або арил, аралкіл або гетероциклілалкільний радикал, a Y являє собою атом кисню або сірки, або ΝΗ- або Nalk-радикал, - або за допомогою дії галоїду загальної формули: R4-Y-COHal ,(VII) у якій R4, визначений у п. 1, являє собою переважно розгалужений арил або алкіл, Υ являє собою атом кисню або сірки, a Hal являє собою атом галогену, переважно хлор, або, якщо необхідно одержати радикал R4, що несе замісник -C(alk)-O-CO-R5, у якому alk визначений у п. 2, a R5 визначений у п. 1, за допомогою дії хлоралкілхлорформіату, після чого здійснюють реакцію одержаного продукту із сіллю лужного металу відповідної кислоти R5COOH або, як альтернатива, срібною сіллю або сіллю четвертинного амонію вищезгаданої кислоти; або, якщо R'2 являє собою Н і якщо необхідно одержати похідні, у яких R2 являє собою заміщений алкіл, або було одержане похідне загальної формули (IV), у якому R1 являє собою атом водню, a R'2 визначено як R2 у п. 1, і якщо необхідно одержати продукт загальної формули (І), у якому R1 являє собою необов'язково заміщений алкіл, за допомогою ацилування галогенангідридом або реакційноздатним ефіром зі структурою: 25 R2-CO-Z (VIIIa) або R1-CO-Z , (VIIIb) 30 у якій R1 або R2 визначені вище, a Z являє собою атом галогену або залишок реакційноздатного складного ефіру, після чого здійснюють відновлення аміду, що утворився, до аміну; або також, якщо було одержане похідне загальної формули (IV), у якій R1 являє собою атом водню, a R'2 визначено як R2 у п. 1, і якщо необхідно одержати продукт загальної формули (І), у якій R1 являє собою алкіл, за допомогою дії галогенованого похідного формули: R1-X , (IX) 35 у якій R1 являє собою алкільний радикал, а X являє собою атом галогену або сульфоновий радикал, у присутності основи, потім одержаний продукт необов'язково перетворюють у фармацевтично прийнятну сіль. 6. Фармацевтична композиція, що містить щонайменше один продукт за п. 1 в комбінації з одним або більше придатними і фармацевтично прийнятними розріджувачами або допоміжними речовинами. Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійською2-amino-2-phenylalkanol derivatives, preparation thereof and pharmaceutical compositions containing same
Автори англійськоюDenis, Alexis, Pachot, Jean, Dini, Christophe
Назва патенту російськоюПроизводные 2-амино-2-фенилалканола, их получение и фармацевтические композиции, которые их содержат
Автори російськоюДени Алексис, Пашо Жан, Дини Кристоф
МПК / Мітки
МПК: C07C 217/48, C07C 219/00, A61K 31/135, A61K 31/24
Мітки: 2-аміно-2-фенілалканолу, композиції, одержання, похідні, містять, фармацевтичні
Код посилання
<a href="https://ua.patents.su/22-101013-pokhidni-2-amino-2-fenilalkanolu-kh-oderzhannya-ta-farmacevtichni-kompozici-shho-mistyat-kh.html" target="_blank" rel="follow" title="База патентів України">Похідні 2-аміно-2-фенілалканолу, їх одержання та фармацевтичні композиції, що містять їх</a>












