Біологічно активні пептидні комплекси
Номер патенту: 109760
Опубліковано: 25.09.2015
Формула / Реферат
1. Пептидні комплекси, в яких пептид організований у тривимірну структуру і які характеризуються загальною структурною формулою:
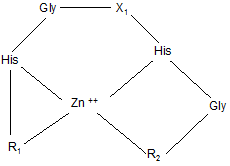 ,
,
де: X1 вибраний з Gln, Ser, Asn, Val, Ala, Phe, Asp або відсутній;
R1 та R2 - пептидні ланцюги, які містять амінокислотні залишки His- або Cys-, здатні взаємодіяти з іонами перехідних металів, при цьому R1 вибраний з: His-Gly-Val-Ser-Gly-, Cys-Val-Val-Thr-Gly-, Cys-Gly-, His-Gly-Ser-Asp-Gly-, Gly-, His-Gly-Asp-Ser-Gly-, Val-Ser-Gly-, His-Gly- або відсутній; R2 вибраний з: -Val-His-Gly, -Val-Phe-Val, -Val-His, -Val-Asp або відсутній.
2. Пептидні комплекси за п. 1, що мають властивості індукторів синтезу інтерферону.
3. Пептидні комплекси за п. 1, що мають противірусну активність.
Текст
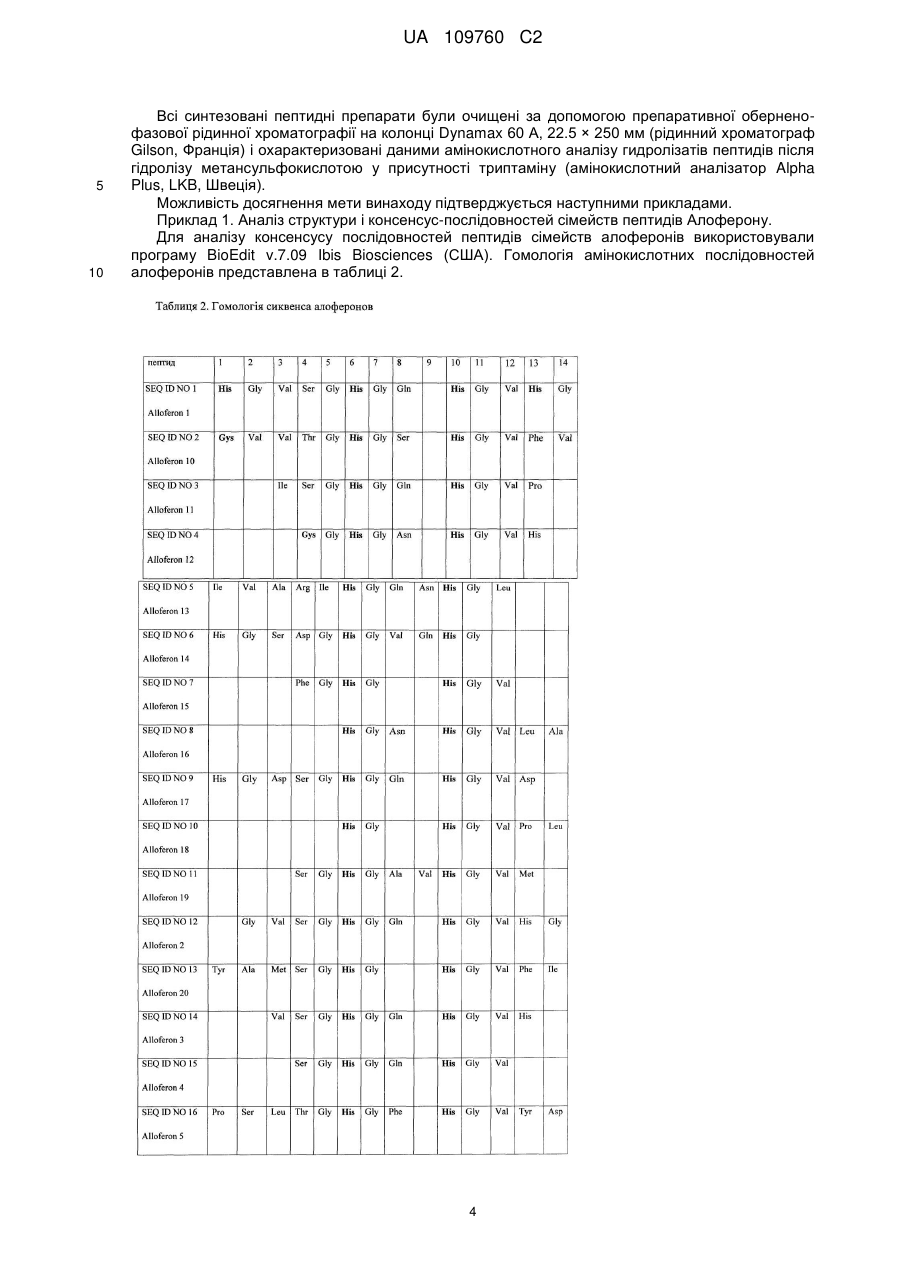
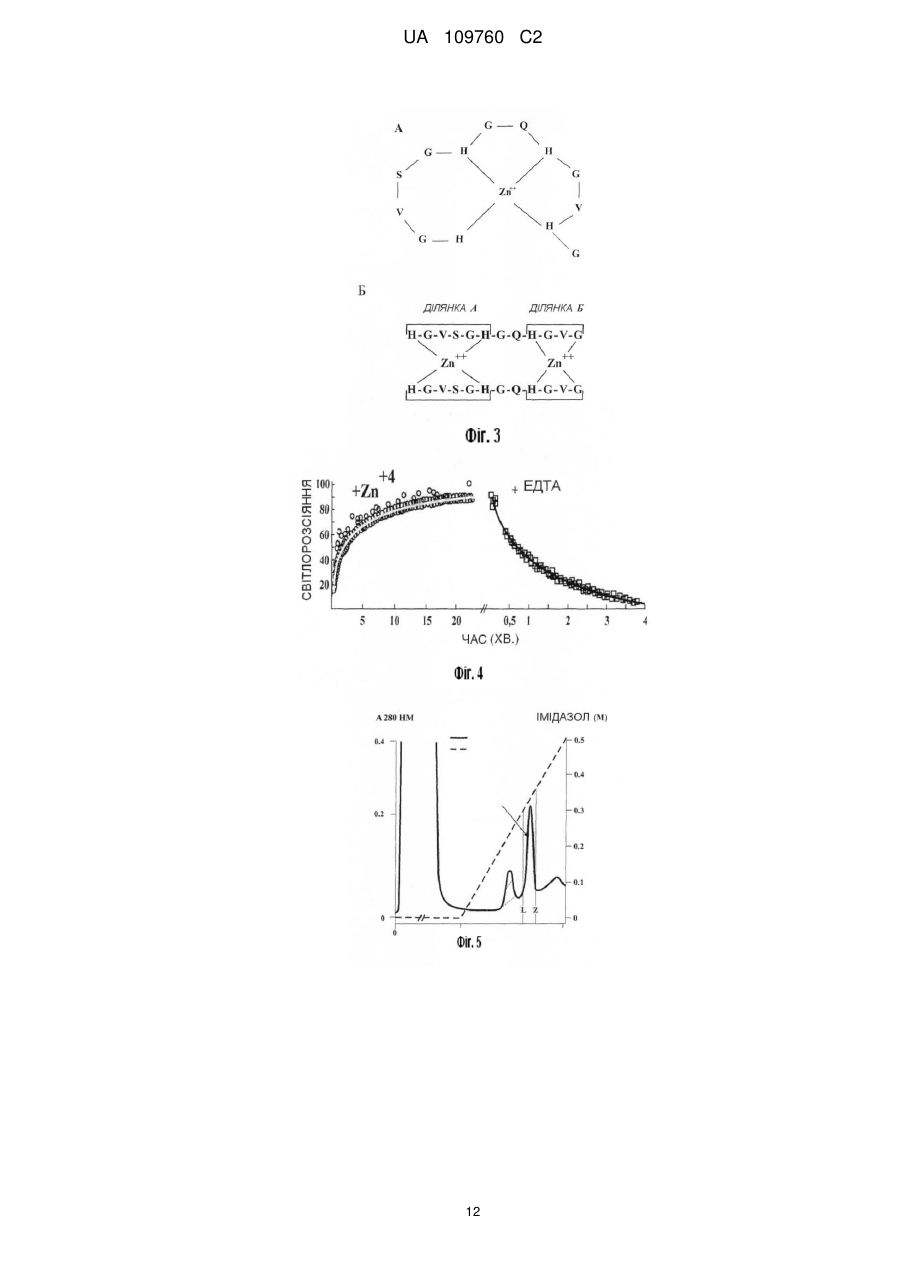
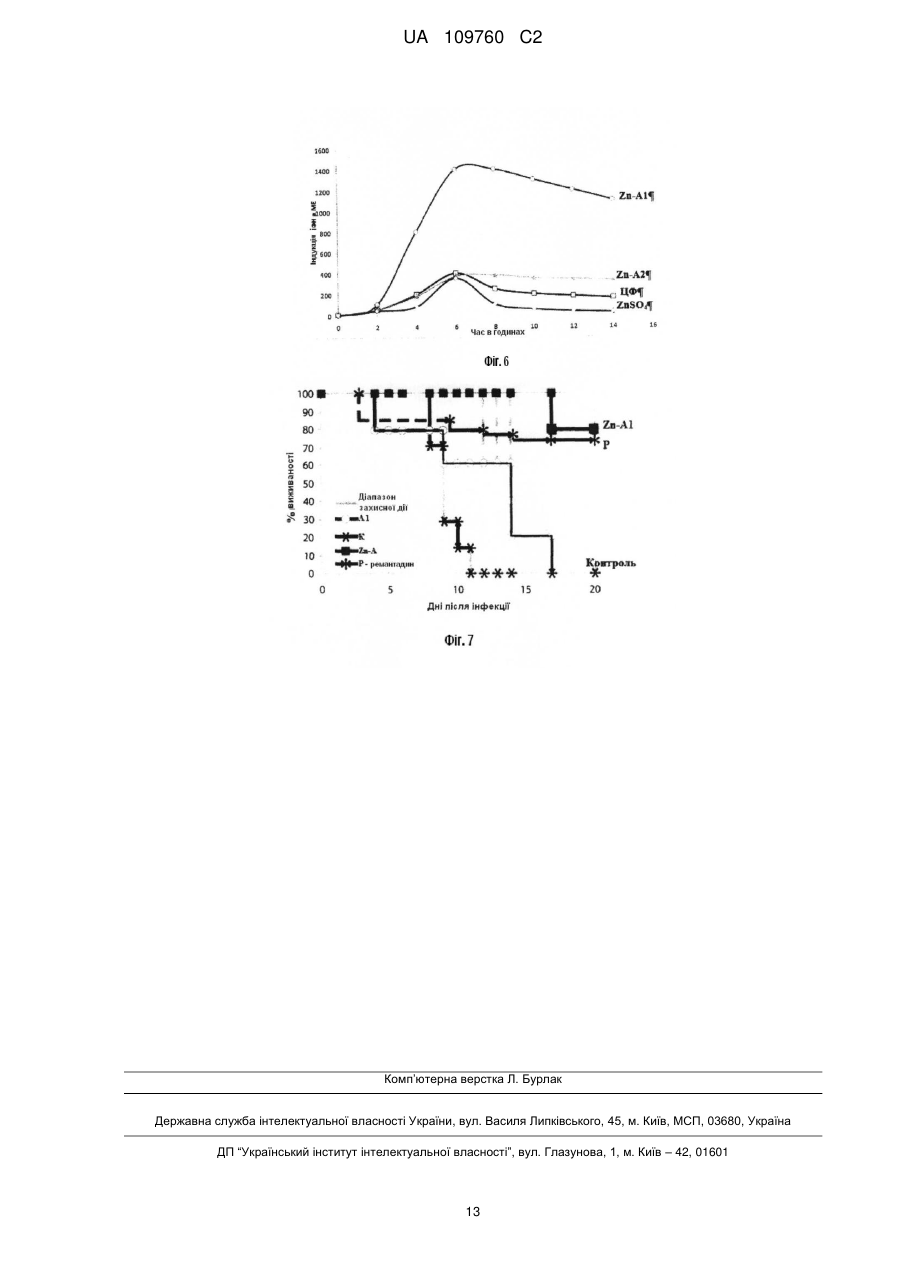
Реферат: Винахід належить до пептидних комплексів з імуномодулюючою і противірусною активністю, що мають тривимірну структуру й описуються наступною структурною формулою: X1 Gly His His Zn ++ R1 Gly R2 , UA 109760 C2 (12) UA 109760 C2 де: X1 відсутній або містить не менш 1 амінокислоти; R1 і R2 - пептидні ланцюги, що містять амінокислотні залишки, His- або Cys-, здатні взаємодіяти з іонами перехідних металів, причому R1 містить до 5 амінокислотних залишків або відсутній; R2 містить до 3 амінокислотних залишків або відсутній. Комплекси пептидів сімейства алоферонів, збагачених гістидином, з іонами Zn, дозволяють створити препарати із спрямованим механізмом дії і здійснювати їх дизайн відповідно до розуміння структури лікарської мішені. UA 109760 C2 5 10 15 20 25 30 35 40 45 50 55 Запропонований винахід відноситься до білків і біологічно активних пептидів з імуномодулюючою і противірусною активністю. Відомими є сполуки пептидної, поліпептидної й білкової природи, які застосовуються в медицині як антивірусні засоби. Серед препаратів-індукторів інтерферонів (ІФН) 1-го типу відомі як високомолекулярні сполуки [Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы от молекулы до лекарства -, М.: изд. Геотар - Медиа, 2005 - стор. 356], [Berg К., Bolt G., Andersen H., Owen ТС. Zink potentiates the antiviral action of human IFN-alpha tenfold. J.Interferon Cytokine Res, 2001, Jul; 21(7): 471-4], так і низькомолекулярні індуктори. Серед останніх, насамперед, слід зазначити вітчизняний препарат циклоферон і американський препарат - іміквімод. Ці засоби відносяться до похідних акридонів і бензимідазолів, відповідно. Для іміквімода й близьких похідних відомий тип Toll-like рецепторів, з якими взаємодіє ця група препаратів, викликаючи індукцію синтезу ІФН-α у різних клітинах [Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекулы до лекарства) М: "Изд. Геотар - Медиа", 2005.- стор. 356]. Широко відома біологічна активність низькомолекулярних пептидів. У першу чергу, це стосується пептидів тваринного й рослинного походження з антибактеріальною активністю [Boman H. Peptide antibiotics and their role in innate immunity. Anu. Rev. of Immunol., 1995, Vol.13, p.61-92]. Разом з тим, описано ряд пептидів, які мають пряму противірусну або протипухлинну дію [Akiyama N., Hijikata M., Kobayashi Α., Yamori Т., Tsuruo Т., Natori S. Anti-tumor effect of N-Palanyl-5-S-glutathionyl dihydroxyphenylalanine (5-S-GAD) a novel anti-bacterial substance from an insect. Anticancer Research, 2000, Vol. 20, p. 357-362]. Особливе місце в цьому ряду займають пептиди земноводних і комах [Bulet P., Hetru С, Diamarcq J., Hoffmann D. Antimicrobial peptides in insects: structure and function. Devel. Сотр. Immunol., 1999, Vol.23, p.329-344, Chinchar V.G., Wang J., Murti G., Carey C, Rolling-Smith L. Inactivation of frog virus 3 and channel catfish virus by esculentin-2P and ranatuerin-2P, two antimicrobial peptides isolated from frog skin. Virology, 2001, Vol.288, p.351-357]. Відомими є імуномоделюючі пептиди - алоферони (патент РФ № 2172322). Основним застосуванням алоферонів є лікування вірусних інфекцій. Алоферони є найбільш близькими аналогами запропонованого винаходу за хімічною структурою та механізмом дії. Слід зазначити, що автори винаходу за патентом № 2172322 розглядають варіації тільки первинної структури алоферонів і не надають ключового значення розподілу залишків гістидину. Крім того, алоферони слід віднести до досить "слабких" індукторів інтерферону, що є очевидним із порівняння їхньої активності з циклофероном. Разом з тим, структура алоферонів звертає на себе увагу регулярністю розташування залишків гістидину й залишками гліцину, які повторюються. Вдосконалювання структури алоферонів можливо в напрямку надання їм елементів третинної структури, наприклад, шляхом введення іонів металів. Відомим є також гемінпептид та його фармацевтично прийнятні солі, який має вірулецидну та противірусну дію, і містить іони метала, в якості якого може застосовуватися Zn, Cu, Fe, Μn. (патент РФ 2296131). Однак зазначена сполука відноситься до іншого класу пептидів і не є імуномодулятором. ++ Комплекси пептидів з іоном Ζn , що мають елементи організованої третинної структури й активність індукторів інтерферону першого типу, в літературі не описані. ++ Необхідність модифікації гістидин-вмісних пептидів іоном Ζn зумовлена наступними причинами: 1. Біологічно активні короткі пептиди мають неорганізований тип вторинної структури, що неминуче знижує їхню біологічну активність, здатність до взаємодії з іншими макромолекулами, метаболічну стабільність. 2. Біологічна й фармакологічна активність пептидів значною мірою залежить від ефективності транспорту в клітини. Надання пептидам компактної структури підвищує ефективність їх транслокації через мембрани та, відповідно, їх фармакологічну активність [Leng Q., Mixson J. Modified branched peptides with histidine-rich tail enhance in vitro gene transfection. Nucl. Acids. Res., 2005, Vol. 33, e40]. ++ 3. Утворення комплексів гістидин-вмісних пептидів з іоном Ζn призводить до принципової зміни властивостей пептидів, роблячи їх ідентичними з доменами транскрипційних активаторів вірусів і клітин. Завданням зазначеного винаходу є розробка комплексів пептидів, організованих у тривимірну структуру. Розроблені комплекси мають високу здатність до зв'язування з іншими групами молекул, проявляють широкий спектр фармакологічної дії, враховуючи індукцію ІФН 1 1 UA 109760 C2 5 10 15 20 25 30 35 40 45 го типу, і діють на різних рівнях клітинних функцій, що дозволить на їх основі створювати нові засоби для профілактики й лікування вірусних інфекцій. Нове сімейство біологічно активних пептидів розроблене на основі відомих пептидів, збагачених залишками Гістидину, алоферонів та їхніх гомологів з застосуванням в якості прототипу Zn-фінгер доменів білків з відомими функціями. Алоферони застосовані в якості матриці пептидів довжиною від 6 до 35 амінокислотних залишків. Сконструйовані таким чином ++ пептиди мають здатність до утворення комплексів з іоном Ζn , що утворюють олігомери й агрегати, а за структурними і біологічними властивостями задовольняють вимогам до імуномодуляторів. Запропоновані пептидні комплекси мають тривимірну структуру й описуються наступною структурною формулою: де: Х1 - відсутній або містить не менше 1 амінокислоти; R1 і R2 - пептидні ланцюги, що містять амінокислотні залишки, здатні взаємодіяти з іонами перехідних металів; причому R1 містить до 5 амінокислотних залишків або відсутній, R2 містить до 3 амінокислотних залишків або відсутній. Здатність природних пептидів, збагачених залишками гістидину до зв'язування з іонами металів, підтверджена низкою досліджень [Hua Zhao H., and Waite J. H. Proteins in Load-Bearing Junctions: The Histidine-Rich Metal-Binding Protein of Mussel Byssus, Biochemistry. 2006, 45(47): 14223-14231]. Суть винаходу пояснюється даними, наведеними на схемах та малюнках: Фіг. 1. Аналіз консенсус - послідовностей пептидів сімейства алоферонів. Фіг. 2. Комп'ютерна модель поліпептиду А1. ++ Фіг. 3. Теоретично можливі варіанти структури комплексів А1 з іоном Zn . ++ Фіг. 4. Кінетика зв'язування алоферону А1 з Zn методом світлорозсіювання. ++ Фіг.5. Аналіз зв'язування пептиду Α1 із сорбентом НіТrар урівноваженого Ni . Фіг. 6. Індукція Інтерферонів І -го типу. Фіг. 7. Протективний ефект досліджуваних препаратів при смертельній грипозній інфекції в мишей. При розробці цього винаходу в якості базової структури був використаний пептид, представлений у таблиці 2 під назвою Alloferon I (SEQ ID NO 1). Alloferon 1 був синтезований методом твердофазного синтезу й застосований для вивчення біологічної активності запропонованих пептидів. Дослідження, результати яких наведені нижче в прикладах, показали, що даний пептид має здатність до утворення комплексів з перехідними металами, є індуктором інтерферону й має противірусну активність. Комп'ютерний аналіз баз даних за структурою й властивостями білків і пептидів встановив, що дана сполука відноситься до нового невідомого раніше сімейства біологічно активних пептидів. Поліпептиди, збагачені гістидином і гліцином, з уведеними іонами металів, мають імуномодулюючу та противірусну активність і, при цьому, іони цинку потенціюють їхню біологічну активність. Синтез пептидів заданої послідовності проводився твердофазним методом синтезу пептидів з застосуванням Boc/Bzl стратегії на фенілацетамідометилполімері (РАМ). Пептиди були одержані на синтезаторах пептидів Coupler-250 і Applied Biosystems 430Α. Для тимчасового захисту α-аміногруп застосовувалась трет.-бутилоксикарбонільна група, що видалялася трифтороцтовою кислотою. Для блокування бічних радикалів трифункціональних амінокислот застосовувались захисні угруповання бензильного та ацильного типу: 2 UA 109760 C2 5 10 15 20 динітрофенильна для гістидину, мезитиленсульфонільна для аргініну, 2хлорбензилоксикарбонільна для лізину, формільна для триптофану, 2,6-дихлорбензильна для тирозину, О-бензилові ефіри для треоніну і серину. Метіонін вводили в конденсацію у вигляді сульфоксидного похідного. Видалення тимчасових захисних груп проводили нерозбавленою трифтороцтовою кислотою, а нейтралізацію - за методикою "in situ", додаючи Ν,Ν -диізопропілетиламін на стадії конденсації прямо в реакційну суміш. Програма приєднання одного амінокислотного залишку при нарощуванні ланцюга пептидилполімеру з розрахунку загального вмісту ациламінокислоти на полімері 0.2 ммол наведена в таблиці. Попереднє активування карбоксильної компоненти проводили протягом 30 хвилин, застосовуючи оксибензотріазол і диізопропілкарбодиімід. У цих умовах синтезу у всіх випадках після приєднання необхідної кількості амінокислотних залишків, які відповідають послідовності пептидного фрагменту, був отриманий задовільний приріст ваги пептидил-полімеру. Видалення бічних захисних угруповань і відщіплення пептиду від смоли здійснювалось під дією безводного фтористого водню у присутності скавенджерів, в основному м-крезолу. При такій обробці видалялися всі бічні захисні угруповання, і пептид відщеплювався від високомолекулярної матриці, час деблокування коливався від однієї до півтора годин. Для запобігання небажаних побічних реакцій при синтезі пептидів, що містять метіонін, (зокрема, алкілування сірки третбутильним радикалом, а також її часткове окислювання в ході нарощування пептидного ланцюга) залишок метіоніну гладко вводиться в послідовність пептидилполімеру у вигляді сульфоксидного похідного, яке на кінцевих стадіях деблокування пептиду відновлювалося до метіоніну. Ця реакція відновлення проходила із задовільним результатом при дії йодистого амонію або на повністю деблокованому пептиді, або на етапі, коли пептид ще перебував на смолі. 25 3 UA 109760 C2 5 10 Всі синтезовані пептидні препарати були очищені за допомогою препаративної оберненофазової рідинної хроматографії на колонці Dynamax 60 А, 22.5 × 250 мм (рідинний хроматограф Gilson, Франція) і охарактеризовані даними амінокислотного аналізу гидролізатів пептидів після гідролізу метансульфокислотою у присутності триптаміну (амінокислотний аналізатор Alpha Plus, LKB, Швеція). Можливість досягнення мети винаходу підтверджується наступними прикладами. Приклад 1. Аналіз структури і консенсус-послідовностей сімейств пептидів Алоферону. Для аналізу консенсусу послідовностей пептидів сімейств алоферонів використовували програму BioEdit v.7.09 Ibis Biosciences (США). Гомологія амінокислотних послідовностей алоферонів представлена в таблиці 2. 4 UA 109760 C2 5 10 15 20 25 30 35 40 У патенті РФ № 2172322 наводиться послідовність алоферонів без надання консенсус послідовності, що не дозволяє точно оцінити «корову»-серцевинну частину пептидів і відокремити суттєві модифікації від несуттєвих. В результаті аналізу сімейства алоферонів представляється можливим розділити на 3 сімейства з консенсус - послідовностями: SGHGQ-HGV, VSGHGQ-HGV, SGHGQ-HGV, що обґрунтовується наведеними комп'ютерними розрахунками (мал.1) послідовностей пептидів сімейства алоферонів. Приклад 2. Комп'ютерне моделювання пептиду А1 (аналіз третинної структури) Для розуміння структури коротких пептидів можна використовувати комп'ютерне моделювання, що дозволяє оцінити структуру пептиду, в цілому, і окремих його доменів. Зокрема, також було необхідно оцінити можливості утворення комплексів даних пептидів з ++ іоном Zn . Для цього проводили комп'ютерне моделювання пептиду Α1, що має наступну структуру: His-Val-Ser-His-Gly-Gin-His-Gly-Val-His-Gly (A1). Побудова простого комплексу A1 з ++ іоном Ζn дозволяє продемонструвати формування пептидної петлі, стабілізованої координатними зв'язками залишків гістидина з іоном Ζn. Комп'ютерне моделювання пептиду А1 (Фіг. 2) показало, що короткий пептид утворює ++ релаксовану петлю, у якій іон Ζn може взаємодіяти із залишками гістидину, доступними для взаємодії. При цьому загальна структура поліпептиду відповідає можливостям утворення ++ комплексу іона Ζn як мінімум із трьома залишками гістидину в положеннях 1,6 і 9. На спрощеній моделі (Фіг. 3) Ζn -Α1 видно, що значна частка залишків гліцину перебувають в N - кінцевій половині молекули. Це відповідає вторинній структурі типу бета - шарів. С -кінцева частина має альфа-спіральну структуру з експонованими всередину імідазольними кільцями ++ гістидину, доступними для взаємодії з іоном Zn . ++ ++ На фігурі наведений приклад з Zn . Zn може бути розміщений практично в будь-якому положенні. А - внутрішньомолекулярний комплекс Ζn – A1, організований у вигляді петлі. Б - міжмолекулярний комплекс Ζn – A1, організований у димер. Агрегація може здійснюватися шляхом приєднання нових молекул А1 за рахунок міжмолекулярного ++ вбудовування іона Zn у ділянках "а" і "б" або по центру лінійного поліпептиду при взаємодії ++ іона Zn із залишками Гістидина в положеннях 6 і 9. При аналізі структури А1 звертає на себе увагу високий вміст і регулярне розташування залишків гістидину. На фігурі 2 видно, що поліпептид А 1 утворює майже ідеальну сідлоподібну ++ структуру. У такій конфірмації максимально доступні для взаємодії з іоном Zn залишки Гіс - 1, 6 і 9. При цьому важливим висновком може бути висновок про те, що комплексоутворення при ++ надлишку пептиду відносно Zn здатне призводити до утворення міжмолекулярних агрегатів (фіг. 2- Б). Цей структурний перехід принципово змінює властивості пептидів, надаючи їм компактність структури, необхідну для біологічної активності, що продемонстровано в низці 5 UA 109760 C2 5 10 15 20 25 30 35 40 45 50 55 60 досліджень [Rydengard V., Nordahl Ε. Α., Schmidtchen A. Zinc potentiates the antibacterial effects of histidine-rich peptides against Enterococcus faecalis. FEBS Lett., 2006, Vol. 273, p. 2399-2406]. ++ Приклад 3. Алоферон і його найближчі аналоги є Zn -зв'язуючими пептидами. ++ Вивчення зв'язування іона Zn 3 алофероном 1 (А1) і його гомологами проводили за методом, описаним [Shi Y., Beger R.D., Berg J.M. Metal binding properties of single amino acid deletion mutants of zinc finger peptides: studies using cobalt(II) as a spectroscopic prob. Biophys.J., ++ 1993, Vol.64, p. 749-753]. Зв'язування іона Zn з пептидом Al досліджували методом світлорозсіювання з використанням флюориметра ISS, Campaign, IL при 400 нм і збудливому світлі 398 нм. ++ На фігурі 4 представлені графіки взаємодії іона Zn з пептидом А1. Умови аналізу див. Shi Y. з співавторами (1993) ++ А - (відкриті кружки) взаємодія А1 з Ζn(Ν03)2. Молярний надлишок іону Ζn по відношенню + до пептиду складав 1:10. Суцільна лінія - насичення пептиду іоном Ζn . При повному насиченні основна маса пептиду переходила в агрегати. До агрегатів додавалась ЕДТА. В результаті додавання ЕДТА комплекс швидко дисоціював і пептид (алоферон) переходив у розчинну фазу. ++ На фігурі 4 видно, що Ζn (Ζn(Ν03)2 взаємодіє з пептидом А1, що призводить до експоненціального росту світлорозсіювання й наступної агрегації пептиду у вигляді полідисперсних наночастинок до 50-60 нм у діаметрі з наступним утворенням завись крупних агрегатів. При додаванні хелатного агента ЕДТА агрегати і комплекси пептиду А1 розчиняються. ++ Таким чином, пептид А1 здатний взаємодіяти з іоном Ζn з утворенням на першій фазі розчинних комплексів. ++ Приклад 4. Пептиди, взаємодіють із Ζn , проявляючи високу спорідненість до нікелевих сорбентів. Хроматографія на колонках НіТrap показала, що А1 поводиться, як олігогістидин і має досить високу спорідненість до даного сорбенту і повністю елюрується розчином Імідазола. Елюція проведена градинентом фосфатний буфер/0,5М імідазол (мал.5). Приклад 5. Індукція інтерферонів 1-го типу Індукцію інтерферонів 1-го типу досліджували за методом, опублікованим раніше [Ершов Ф.И., Киселев О.И. Интерфероні и их индукторі (от молекулы до лекарств) ». Μ.: "Изд. Геотар Медиа, 2005- стор. 356, Chemysh із соавт. 2002]. На малюнку 6 представлені результати тестування препаратів на здатність до індукції інтерферонів І - го типу. Як видно з отриманих даних, максимальну активність в індукції інтерферонів мав пептид Zn – Α1. Трохи поступався йому пептид Zn - А2. Немодифікований пептид А1 проявляв досить високий рівень здатності до ++ індукції інтерферонів, але однак істотно поступався похідним у комплексі з іоном Zn і відповідав активності циклоферону. З прикладу 6 буде видно, що ці дані корелюють із захисною дією препаратів при летальній грипозній інфекції на мишах. Приклад 6. Противірусна активність на моделі експериментальної летальної грипозної пневмонії в білих мишей, викликаної вірусом грипу А. Для тестування противірусної активності комплексів пептидів використовували модель летальної грипозної інфекції на білих безпородних мишах обох статей масою 10-12 г, отриманих з розплідника "Рапполово". У роботі використовували штам вірусу грипу A/Aichi/2/68 (H3N2), адаптований до білих мишей у лабораторних умовах і який виявляв високу патогенність, викликаючи інфекцію з розвитком пневмонії та смертельним результатом у плині 5-10 днів залежно від дози вірусу. Пептиди і їх похідні вводили тваринам однократно за 6 і 12 год. до інфікування в кількості 12 мкг/кг ваги тварин внутрішньобрюшинно. Плацебо в контрольній групі тварин служив фізіологічний розчин або фосфатний буфер у рівному об'ємі. Вірус попередньо титрували на тваринах і визначали його концентрацію по летальності мишей. Для експерименту вірус вводили тваринам інтраназально під легким ефірним наркозом у дозі 0,2 і 5 LD50. У кожну групу спостереження брали по 10 мишей. Спостереження за тваринами здійснювали до 15 днів, тобто строку, протягом якого при експериментальному грипі відзначається 100 % смертність тварин. Щодня фіксували вагу й смертність тварин у контрольних і дослідних групах. На підставі отриманих показників смертності розраховували відсоток смертності в кожній групі (відношення числа полеглих за 15 днів тварин до загального числа заражених тварин у групі), індекс захисту. Отримані дані наведені на малюнку 5. Аналіз отриманих результатів показав, що дія досліджених препаратів А1 відносно вірусу грипу А, патогенного для мишей було порівняно з ефективністю захисного ефекту референс -препарату Ремантадину (80-87 % - при дозі вірусу 1 LD50). Високий захисний ефект комплексів Zn-A1 ++ свідчить про те, що утворення комплексу Ζn з Α1 сильно потенціює активність пептидів типу 6 UA 109760 C2 5 10 А1. Спосіб тестування, застосований у цьому випадку, свідчить про те, що захисний ефект варто віднести, головним чином, за рахунок індукції інтерферонів. Препарат проявляв максимальну активність при застосуванні в профілактичній схемі. На Фіг. 7 показаний протективний ефект досліджуваних препаратів при смертельній грипозній інфекції в мишей. На підставі вищевикладеного можна стверджувати, що розроблений пептид має всі заявлені властивості. Комплекси пептидів, збагачені гістидином, і, в першу чергу пептидів сімейства алоферонів з ++ іоном Ζn , дозволять створити препарати зі спрямованим механізмом дії та здійснювати їхній дизайн відповідно до розуміння властивостей і будови пептидів, а також природи лікарської мішені. 7 UA 109760 C2 8 UA 109760 C2 9 UA 109760 C2 ФОРМУЛА ВИНАХОДУ 5 1. Пептидні комплекси, в яких пептид організований характеризуються загальною структурною формулою: і які His His Zn ++ 10 структуру X1 Gly R1 у тривимірну Gly R2 , де: X1 вибраний з Gln, Ser, Asn, Val, Ala, Phe, Asp або відсутній; R1 та R2 - пептидні ланцюги, які містять амінокислотні залишки His- або Cys-, здатні взаємодіяти з іонами перехідних металів, при цьому R1 вибраний з: His-Gly-Val-Ser-Gly-, Cys-Val-Val-Thr-Gly-, Cys-Gly-, His-Gly-Ser-Asp-Gly-, Gly-, His-Gly-Asp-Ser-Gly-, Val-Ser-Gly-, His-Gly- або відсутній; R2 вибраний з: -Val-His-Gly, -Val-Phe-Val, -Val-His, -Val-Asp або відсутній. 2. Пептидні комплекси за п. 1, що мають властивості індукторів синтезу інтерферону. 3. Пептидні комплекси за п. 1, що мають противірусну активність. 10 UA 109760 C2 11 UA 109760 C2 12 UA 109760 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюBiologically active peptide complexes
Автори англійськоюKiselev, Oleg Ivanovich, Ershov, Feliks Ivanovich
Назва патенту російськоюБиологически активные пептидные комплексы
Автори російськоюКиселёв Олег Иванович, Ершов Феликс Иванович
МПК / Мітки
МПК: A61K 38/08, A61P 35/00, C07K 7/06, A61K 38/10, A61P 31/12, A61P 37/02, C07K 7/08
Мітки: пептидні, комплекси, активні, біологічно
Код посилання
<a href="https://ua.patents.su/15-109760-biologichno-aktivni-peptidni-kompleksi.html" target="_blank" rel="follow" title="База патентів України">Біологічно активні пептидні комплекси</a>
Попередній патент: Спосіб оцінки тяжкості хвороби у віл-інфікованих осіб
Наступний патент: Електроліт для електрохімічного нанесення нанокомпозиційних покриттів нікель-цирконію діоксид
Випадковий патент: Маса для одержання склоемалевих покриттів салатних тонів