Модифікований циклоспорин, який можна використовувати як проліки, і його застосування
Номер патенту: 75136
Опубліковано: 15.03.2006
Автори: Амель Арно, Венгер Роланд, Юблер Франсіс, Муттер Манфред
Формула / Реферат
1. Проліки, що являють собою циклічний ундекапептид, в якому пептидний ланцюг включає щонайменше один амінокислотний залишок загальної формули (І):
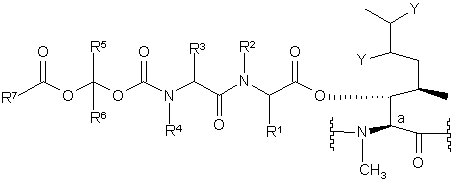 , (І)
, (І)
в якій:
- атом вуглецю Сa утворює один із зв'язків в кільці ундекапептиду;
- кожний із замісників Y являє собою атом водню, або разом вони утворюють зв'язок;
- замісники R1 і R3, незалежно один від одного, являють собою атом водню, групу аралкіл, алкарил, гетероалкіл, гетероцикл, алкілгетероцикл, гетероциклоалкіл або нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю, де вказані групи необов'язково заміщені щонайменше однією групою, вибраною з -СООН, -CONHR8, NHC=NH(NH2), -NHC=NR8(NH2), -NH2, -NHR8, -NR82, -N+R83, -ОН, OPO(OR8)2 -OPO(OH) (OR8), -ОРО(ОН)2, -OSO(OR8)2, -OSO(OH)(OR8), -OSO(OH)2 і різних сольових форм цих груп, де кожний із замісників R8, незалежно один від одного, являє собою нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю;
- замісники R2 і R4, незалежно один від одного, являють собою атом водню, групу алкарил або нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю;
- замісники R5 і R6, незалежно один від одного, являють собою атом водню, групу аралкіл або нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю; і
- замісник R7 являє собою групу аралкіл, алкарил, гетероалкіл, гетероцикл, алкілгетероцикл, гетероциклоалкіл або нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю, де вказані групи необов'язково заміщені щонайменше однією групою, вибраною з -СООН, -CONHR8, -NHC=NH(NH2), -NHC=NR8(NH2), -NH2, -NHR8, -NR82, -N+R83, -ОН, -OPO(OR8)2, -OPO(OH)(OR8), -ОРО(ОН)2, -OSO(OR8)2, -OSO(OH)(OR8), -OSO(OH)2 і різних сольових форм цих груп, де кожний із замісників R8 має значення, визначені вище.
2. Проліки за п. 1, які відрізняються тим, що в загальній формулі (І), що визначає вказаний амінокислотний залишок щонайменше один із замісників R1 і R3 являє собою групу аралкіл, алкарил, гетероалкіл, гетероцикл, алкілгетероцикл, гетероциклоалкіл або нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю, де кожна з вказаних груп заміщена щонайменше однією групою, вибраною з -СООН, -CONHR8, -NHC=NH(NH2), -NHC=NR8(NH2), -NH2, -NHR8, -NR82, -N+R83, -ОН, -OPO(OR8)2, -OPO(OH)(OR8), -ОРО(ОН)2, -OSO(OR8)2, -OSO(OH)(OR8), -OSO(OH)2 і різних сольових форм даних груп, де кожний із замісників R8 має значення, визначені вище.
3. Проліки за п. 2, які відрізняються тим, що вказані групи аралкіл, алкарил, гетероалкіл, гетероцикл, алкілгетероцикл, гетероциклоалкіл або алкіл заміщені щонайменше однією з груп, вибраних з –NR82, -N+R83, -OPO(OH)2, або різних сольових форм цих груп, де кожний із замісників R8 має значення, визначені вище.
4. Проліки за п. 3, які відрізняються тим, що щонайменше один з вказаних замісників R1 і R3 являє собою нормальний алкіл, що містить 1-6 атомів вуглецю, заміщений щонайменше однією з груп, вибраних з –NR82, -N+R83, -OPO(OH)2 або, різних сольових форм даних груп, де кожний із замісників R8 має значення, визначені вище.
5. Проліки за п. 1, які відрізняються тим, що в загальній формулі (І), що визначає вказаний амінокислотний залишок, замісники R5 і R6 не можуть одночасно являти собою атом водню.
6. Проліки за п. 1, які відрізняються тим, що в загальній формулі (І), що визначає вказаний амінокислотний залишок щонайменше один з вказаних замісників R5 і R6 являє собою нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю, і замісник R7 являє собою аралкіл, або нормальний, або розгалужений алкіл, що містить 1-6 атомів вуглецю.
7. Проліки за п. 6, які відрізняються тим, що щонайменше один з вказаних замісників R5 і R6, незалежно один від одного, являє собою атом водню або метил.
8. Проліки за п. 1, які відрізняються тим, що вказаний пептидний ланцюг включає один амінокислотний залишок загальної формули (І), утворюючий кільце ундекапептиду з лінійною послідовністю з 10 амінокислот загальної формули (II):
-T-U-V-W-MeLeu-Ala-X-MeLeu-Z-MeVal- (II),
в якій:
- Т вибраний з амінокислот Ala, Abu, Nval, Val і Thr;
- U вибраний з амінокислот Sar, (D)MeSer, (D)MeAla i (D) MeSer(OCOR9),
причому R9 являє собою атом водню, алкарил або нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю;
- V являє собою амінокислоту загальної формули (N-R10)aa, де аа вибрана з амінокислот Val, Leu, Ile, Thr, Phe, Туr і Thr, і R10 являє собою нормальний або розгалужений алкіл, що містить 1-6 атомів вуглецю;
- W вибраний з амінокислот Val, Nval і Leu;
- Х вибраний з амінокислот (D)Ala, (D)Ser, (D)Hiv, (D)Val i (D)Thr;
- Z вибраний з амінокислот Leu i MeLeu.
9. Проліки за п. 8, які відрізняються тим, що вказана лінійна послідовність з десяти амінокислот вибрана з наступних послідовностей формул (III)-(XIV):
- Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal- (III);
-Abu-(D)MeAla-EtVal-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal- (IV);
- Thr-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal- (V);
- Val-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal- (VI);
- Nval-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal- (VII);
-Val-(D)MeAla-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal- (VIII);
- Val-Sar-MeLeu-Val-MeLeu-Ala-(D)Val-MeLeu-Leu-MeVal- (IX);
- Val-Sar-MeLeu-Val-MeLeu-Ala-(D)Thr-MeLeu-Leu-MeVal- (X);
-Abu-(D)MeSer(OAc)-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-Leu-MeVal- (XI);
- Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Ser-MeLeu-MeLeu-MeVal- (XII);
- Thr-Sar-MeLeu-Leu-MeLeu-Ala-(D)-Hiv-MeLeu-Leu-MeVal- (XIII);
- Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)-Val-MeLeu-Leu-MeVal- (XIV).
10. Проліки за будь-яким з попередніх пунктів, що мають відповідно формули (XV) і (XVI):
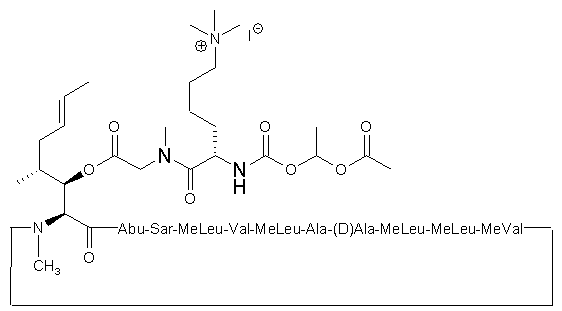 (XV);
(XV);
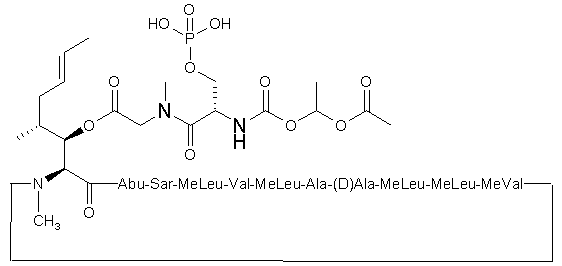 (XVI).
(XVI).
11. Застосування проліків за п. 1 як лікарського засобу.
12. Застосування проліків за п. 1 для одержання лікарського засобу, призначеного для лікування патологічних станів слизових мембран.
13. Застосування проліків за п. 1 для одержання лікарського засобу, призначеного для місцевого лікування патологічних станів очей.
14. Застосування за п. 13, яке відрізняється тим, що вказані патологічні стани включають сухий кератокон'юнктивіт (сухий кератит) очей, синдром Шегрена, форми алергічного кератокон'юнктивіту, зокрема стійкі до дії кортикостероїдів, кон'юнктивіт зі слизом і синехією, герпетичний стромальний кератит, пов'язаний з імунною системою лімбічний кератит і кератит Тігесона, і профілактику відторгнення трансплантата рогівки, і застосування як допоміжного лікування при хірургічних операціях з метою видалення.
15. Застосування проліків за п. 1 для одержання лікарського засобу, призначеного для забезпечення тривалої приживаності алотрансплантатів органів.
16. Застосування за п. 15, яке відрізняється тим, що вказані органи, що несуть трансплантат, вибрані з нирок, серця, печінки, підшлункової залози, легенів, тонкого кишечнику і кісткового мозку.
17. Застосування проліків за п. 1 для одержання лікарського засобу, призначеного для пригнічення реплікації вірусу імунодефіциту людини типу І (ВІЛ-1).
Текст
1. Проліки, що являють собою циклічний ундекапептид, в якому пептидний ланцюг включає щонайменше один амінокислотний залишок загальної формули (І): C2 2 (19) 1 3 75136 4 4. Проліки за п. 3, які відрізняються тим, що що-Abu-(D)MeSer(OAc)-MeLeu-Val-MeLeu-Ala-(D)Alaнайменше один з вказаних замісників R1 і R3 являє MeLeu-Leu-MeVal- (XI); собою нормальний алкіл, що містить 1-6 атомів Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Ser-MeLeuвуглецю, заміщений щонайменше однією з груп, MeLeu-MeVal- (XII); вибраних з –NR82, -N+R83, -OPO(OH)2 або, різних - Thr-Sar-MeLeu-Leu-MeLeu-Ala-(D)-Hiv-MeLeu-Leuсольових форм даних груп, де кожний із замісників MeVal- (XIII); R8 має значення, визначені вище. - Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)-Val-MeLeu-Leu5. Проліки за п. 1, які відрізняються тим, що в MeVal- (XIV). загальній формулі (І), що визначає вказаний амі10. Проліки за будь-яким з попередніх пунктів, що нокислотний залишок, замісники R5 і R6 не можуть мають відповідно формули (XV) і (XVI): одночасно являти собою атом водню. I 6. Проліки за п. 1, які відрізняються тим, що в +N загальній формулі (І), що визначає вказаний амінокислотний залишок щонайменше один з вказаних замісників R5 і R6 являє собою нормальний O O O або розгалужений алкіл, що містить 1-6 атомів N O O O N вуглецю, і замісник R7 являє собою аралкіл, або H O нормальний, або розгалужений алкіл, що містить N Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal 1-6 атомів вуглецю. O 7. Проліки за п. 6, які відрізняються тим, що щоCH3 найменше один з вказаних замісників R5 і R6, незалежно один від одного, являє собою атом водню (XV); або метил. 8. Проліки за п. 1, які відрізняються тим, що вкаO HO OH заний пептидний ланцюг включає один амінокисP лотний залишок загальної формули (І), утворююO O O O чий кільце ундекапептиду з лінійною послідовністю з 10 амінокислот загальної формули (II): N O O O N -T-U-V-W-MeLeu-Ala-X-MeLeu-Z-MeVal- (II), H O в якій: N Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal - Т вибраний з амінокислот Ala, Abu, Nval, Val і Thr; O - U вибраний з амінокислот Sar, (D)MeSer, CH3 9 (D)MeAla i (D) MeSer(OCOR ), причому R9 являє собою атом водню, алкарил або (XVI). нормальний або розгалужений алкіл, що містить 111. Застосування проліків за п. 1 як лікарського 6 атомів вуглецю; засобу. - V являє собою амінокислоту загальної формули 12. Застосування проліків за п. 1 для одержання 10 (N-R )aa, де аа вибрана з амінокислот Val, Leu, лікарського засобу, призначеного для лікування Ile, Thr, Phe, Туr і Thr, і R10 являє собою нормальпатологічних станів слизових мембран. ний або розгалужений алкіл, що містить 1-6 атомів 13. Застосування проліків за п. 1 для одержання вуглецю; лікарського засобу, призначеного для місцевого - W вибраний з амінокислот Val, Nval і Leu; лікування патологічних станів очей. - Х вибраний з амінокислот (D)Ala, (D)Ser, (D)Hiv, 14. Застосування за п. 13, яке відрізняється тим, (D)Val i (D)Thr; що вказані патологічні стани включають сухий ке- Z вибраний з амінокислот Leu i MeLeu. ратокон'юнктивіт (сухий кератит) очей, синдром 9. Проліки за п. 8, які відрізняються тим, що вкаШегрена, форми алергічного кератокон'юнктивіту, зана лінійна послідовність з десяти амінокислот зокрема стійкі до дії кортикостероїдів, кон'юнктивіт вибрана з наступних послідовностей формул (III)зі слизом і синехією, герпетичний стромальний (XIV): кератит, пов'язаний з імунною системою лімбічний Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeuкератит і кератит Тігесона, і профілактику відторгMeLeu-MeVal- (III); нення трансплантата рогівки, і застосування як -Abu-(D)MeAla-EtVal-Val-MeLeu-Ala-(D)Ala-MeLeuдопоміжного лікування при хірургічних операціях з MeLeu-MeVal- (IV); метою видалення. Thr-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu15. Застосування проліків за п. 1 для одержання MeLeu-MeVal- (V); лікарського засобу, призначеного для забезпеченVal-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeuня тривалої приживаності алотрансплантатів оргаMeLeu-MeVal- (VI); нів. Nval-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu16. Застосування за п. 15, яке відрізняється тим, MeLeu-MeVal- (VII); що вказані органи, що несуть трансплантат, виб-Val-(D)MeAla-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeuрані з нирок, серця, печінки, підшлункової залози, MeLeu-MeVal- (VIII); легенів, тонкого кишечнику і кісткового мозку. - Val-Sar-MeLeu-Val-MeLeu-Ala-(D)Val-MeLeu-Leu17. Застосування проліків за п. 1 для одержання MeVal- (IX); лікарського засобу, призначеного для пригнічення - Val-Sar-MeLeu-Val-MeLeu-Ala-(D)Thr-MeLeu-Leuреплікації вірусу імунодефіциту людини типу І MeVal- (X); (ВІЛ-1). 5 Даний винахід відноситься до проліків, які являють собою циклічний ундекапептид і їхнього застосування як лікувального продукту, зокрема, призначеного для лікування патологічних станів ока. Циклоспорини являють собою в структурному відношенні особливу групу циклічних пептидів, загальним для яких є той факт, що вони складаються з ланцюжка з одинадцяти амінокислот, деякі з яких є атиповими або за рахунок їх Dконфігурації, або за рахунок складної хімічної структури їх бічного ланцюга, або за рахунок того, що їх аміногрупа алкілована. До теперішнього часу з грибів виділено приблизно тридцять циклоспоринів, і напівсинтетичним шляхом або повним синтезом одержано багато циклічних ундекапептидів, подібних до цих натуральних продуктів. У число цих аналогів циклічних ундекапептидів входять пептоліди або депсипептиди, тобто циклічні поліпептиди, що містять в їх ланцюгу також складноефірні зв'язки. Надалі в даному описі, якщо не вказано інакше, термін "циклоспорин" призначений для позначення як циклічних ундекапептидів, одержаних з природних джерел, так і їх аналогів, одержаних ніпвсинтезом або повним синтезом, включаючи пептоліди, одержані з природних джерел або їх аналоги, одержані напівсинтезом або повним синтезом. Перший член даного сімейства циклоспоринів був виділений і ідентифікований як циклоспорин А. Пептидний ланцюг, що складає його ундекапептидне кільце, є наступним: -MeBmt-Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)AlaMeLeu-MeLeu-MeValЙого більш повна хімічна структура є наступною: Серед атипових амінокислот, які включає даний циклічний ундекапептид в 1-ому положенні, особливо потрібно згадати N-метил-(4R)-4-((Е)-2бутеніл)-4-метил-L-треонін, позначений MeBmt. Дана амінокислота є специфічною для циклоспоринів, і допускається, щоб етиленова група була необов'язково відновленою. Він має аміногрупу, яка метильована. Крім того, гідроксильна група, яку вона включає, дуже примітна в тому значенні, що вона є єдиною групою у всьому даному циклічному ундекапептиді, яка здатна хімічно 75136 6 модифікуватися. Також можна зазначити, що вона знаходиться у значною мірою ускладненому просторовому оточенні, що робить будь-який підхід реагенту дуже ускладненим. Дані циклічні ундекапептиди, чи походять вони з природних джерел або одержані синтетично, виявляють широкий спектр видів біологічної активності, серед яких найбільш добре відома імуносупресорна, протизапальна або антипаразитарна дія або активність, яка робить можливим боротися зі злоякісними пухлинами або зменшувати їх резистентність до інших видів лікування. Було встановлено, що деякі з цих циклічних ундекапептидів володіють обіцяючою противірусною дією, зокрема, при лікуванні СНІДу шляхом придушення реплікації вірусу імунодефіциту людини типу 1 (ВІЛ-1). У цьому відношенні в заявці на патент WO 00/01715, поданій заявниками даної заявки, описаний певний ряд напівсинтетичних циклічних ундекапептидів, що володіють структурою, близькою до такої для циклоспорину А, але в яких змінена природа амінокислот в 4-ому положенні, або в 3ому і 4-ому положеннях відносно амінокислоти MeBmt. Недавні розробки в області фармакології зробили можливим сподіватися, що імуносупресорний ефект циклоспоринів, зокрема, циклоспорину А, чия дія є оборотною і немієлотоксичною і для якого відмічені незначні побічні ефекти, можна з успіхом використовувати, зокрема, в області офтальмології для місцевого лікування, зокрема, поверхневих патологічних станів ока і оточуючих його придатків. Дані патологічні стани включають сухий кератокон'юнктивіт, який також називається сухим кератитом очей, синдром Шегрена, форми алергічного кератокон'юнктивіту, зокрема, стійкі до дії кортикостероїдів, кон'юнктивіт зі слизом і синехією, герпетичний стромальний кератит, пов'язаний з імунною системою лімбічний кератит і кератит Тігесона, і профілактику відторгнення трансплантата рогівки, і як допоміжне лікування при хірургічних операціях з метою видалення. Циклічні ундекапептиди сімейства циклоспоринів за своєю природою є дуже гідрофобними сполуками, що тим більше знижує їх розчинність у воді. Дана властивість пов'язана з природою бічного ланцюга більшості амінокислот, що входять в їх склад, і також з тим чинником, що аміногрупа деяких амінокислот метильована, що обмежує можливість утворення міжмолекулярних водневих зв'язків між циклічним ундекапептидом і, наприклад, водним солюбілізуючим середовищем. У результаті для внутрішньовенного (в/в) введення даних циклоспоринів потрібна розробка дуже складних фармацевтичних композицій в основному у вигляді емульсій, які в деяких випадках володіють низькою стабільністю і вимагають обережного поводження з ними і які є причиною вияву небажаних побічних ефектів. Як приклад, один з препаратів для в/в інфузії циклоспорину А, що промислово випускається під 7 75136 8 торговою назвою сандиммун, являє собою мікроеДля того, щоб уникнути зміни фармакологічних мульсію, яку одержують при використанні як наповластивостей такої фармакологічно активної мовнювача поліоксіетилінованої касторової олії, вілекули, дана хімічна модифікація може полягати в домої під торговою назвою кремофор. Даний одержанні попередника, по можливості, неактивпрепарат зберігається у вигляді концентрату і поного попередника, даної фармакологічно активної винен бути розбавлений безпосередньо перед молекули, який при введенні під впливом фізіоловведенням. гічних умов, що є в організмі, буде модифікуватися Через застосування даної касторової олії, яка, хімічно або під дією ферментів з утворенням фаряк відомо, солюбілізує деякі компоненти синтетичмакологічно активної молекули, якщо можливо, них речовин, виробник рекомендує використовуабо в місці вияву її фармакологічної дії, або в кровати при роботі з даним препаратом тільки матеві, яка буде доставляти дану фармакологічно акріали з скла або синтетичних матеріалів, що тивну молекулу, що утворилася таким чином, до відповідають "стандартам Європейської фармакомісця її дії, відповідаючи поняттю "проліки". Надалі пеї для резервуарів, призначених для крові", всі ці в даному описі попередник вказаної фармакологіматеріали не повинні містити силіконову олію і чно активної молекули називається "проліки". жири. Вже відома практика хімічної модифікації струКрім того, лікарі попереджаються про те, що ктури циклоспорину А з метою придания одержудана касторова олія здатна викликати анафілактованому продукту гідрофільних властивостей. їдні реакції, і в результаті їм дають рекомендації Так Rothbard et al. описали в заявці на патент про те, що вдаватися до внутрішньовенного ввеWO 01/13957 спосіб поліпшення введення фармадення слід тільки в тих випадках, коли неможливе кологічно активних молекул і полегшення їх пронипероральне застосування. кнення через дерму і епітеліальні мембрани, що Розробка обіцяючих застосувань циклоспорискладається з оборотного введення в дані молекунів місцевим введенням в області офтальмології ли бічного ланцюга, яка складається з фрагментів розвивається повільно також через труднощі в ланцюга поліаргініну. Серед цих фармакологічно створенні відповідних фармацевтичних композиактивних молекул знаходяться молекули гідрофоцій, зокрема, які виявляють хорошу місцеву перебної природи такі, як циклоспорин А. носимість і не спричиняють затьмареного зору Однак подібні кон'югати вимагають дуже обевнаслідок присутності в'язких агентів. режного поводження з ними і їх зберігання, як вкаТак, як приклад, нещодавно в журналі J. Fr. зується в заявці, що цитується, через те, що фарOpthalmol., 2001, 24(5), 527, Robert et al. привели в макологічно активна молекула утворюється, якщо своєму огляді всі технічні труднощі, які необхідно рН середовища більше за 7. Крім того, при утвоподолати, внаслідок ліпофільної природи фармаренні даної фармакологічно активної молекули цевтичних композицій для місцевого застосування фрагменти ланцюга поліаргініну вивільняються в циклоспорину А в офтальмології і всі проблеми організмі. Оскільки відомо, що вони володіють токмісцевої переносимості, які виникають при викорисичністю і подразнюючими властивостями, дані станні таких композицій. поліаргініни будуть надавати подразливу дію, і Одним з висновків, до якого можна прийти таким чином, застосування подібних кон'югатів внаслідок даного огляду, є те, що до теперішнього циклоспоринів в області офтальмології унеможличасу відсутні композиції у вигляді розчину для влюється. промивання очей, який можна застосовувати місCrooks et al. в заявці на патент WO 00/67801 цево для лікування патологічних станів ока і отоописали одержання проліків протизапальних засочуючих його придатків. Цей висновок можна розбів таких, як флурбіпрофен, для їх місцевого заповсюдити на застосування циклоспорину для стосування при контакті з оком, одночасно уникамісцевого лікування станів слизових мембран або ючи при цьому вияву місцевої подразнювальної станів шкіри. дії. Вони досягли цього для певного ряду продуктів Отже, як і раніше є потреба в тому, щоб зровведенням оксигенованих або поліоксигенованих бити циклоспорини доступними для лікарів, незаланцюгів. лежно від того, чи походять вони з природного З іншого боку, при спробі піддати циклоспорин джерела або є синтетичними, або похідні цих цикА таким же хімічним модифікаціям вони досягли лоспоринів, які можна було б легко вводити пацієуспіху тільки в одержанні продуктів, які описують нту, зокрема, місцево або внутрішньовенно, унияк стабільні, іншими словами, які не розщеплюкаючи при цьому застосування складних ються з утворенням циклоспорину А при контакті з фармацевтичних композицій, які володіють низьсироваткою людини або вфосфатному буфері при кою стабільністю і з якими важко поводитися, і які рН 7,4. приводять до вияву небажаних побічних ефектів. Отже, задача даного винаходу полягає в тому, Ця потреба є тим більше насущною, якщо дані щоб зробити доступними для лікарів проліки цикциклоспорини, природного або синтетичного похолічних ундекапептидів сімейства циклоспоринів, дження, повинні застосовуватися місцево на око які, по-перше, можна вводити в фізіологічному або оточуючи його придатки. середовищі без необхідності створення складних Однією з можливостей, доступних для фахівця фармацевтичних композицій і, по-друге, можна при розв'язанні проблеми створення гідрофобної, було б зберігати і потім звертатися і вводити, зокфармакологічно активної молекули, що асимілюрема, не турбуючись про рН навколишнього сереється в фізіологічному середовищі, є її хімічна модовища. дифікація з метою придания їй гідрофільних власТакож задача даного винаходу полягає в тому, тивостей. щоб зробити доступними для лікарів проліки цик 9 75136 10 лічних ундекапептидів сімейства циклоспоринів, група треоніну відповідним чином етерифікована, і які можна було б застосовувати місцево взагалі і фармакологічно активна молекула, яка утворюєтьна поверхню ока або на слизові оболонки, зокреся при розщепленні проліків в організмі, буде явма, і які потім могли б утворювати протягом відполяти собою циклічний ундекапептид, в якому пепвідного часу напівжиття фармакологічно активний тидний ланцюг містить, щонайменше, один циклічний ундекапептид без вияву місцевої подразалишок N-метил-(4R)-4-((Е)-2-бутеніл)-4-метил-Lзнюючої дії. треоніну (MeBmt). Для здійснення цього даний винахід відноАналогічно, коли кожний з двох замісників Υ ситься до проліків, що являють собою циклічний являє собою атом водню, вказаний амінокислотундекапептид, в якому пептидний ланцюг включає, ний залишок загальної формули (І) є похідним защонайменше, один амінокислотний залишок загалишку Ν-метил-(4R)-4-бутил-4-метил-L-треоніну, в льної формули (І) нижче: якому гідроксильна група треоніну відповідним чином етерифікована, і фармакологічно активна молекула, яка утворюється при розщепленні проліків в організмі, буде являти собою циклічний ундекапептид, в якому пептидний ланцюг містить, щонайменше, один залишок N-метил-(4R)-4-бутил4-метил-L-треоніну (Dh-MeBmt). Переважно в загальній формулі (І), що визначає вказаний амінокислотний залишок, щонайменше, один із замісників R1 і R3 являє собою аралкіл, алкарил, гетероалкіл, гетероцикл, алкілгетероцикл, гетероциклоалкіл або нормальв якій: ний або розгалужений алкіл, що містить 1-6 атомів - атом вуглецю Са утворює один із зв'язків в ківуглецю, де вказані групи необов'язково заміщені, льці ундекапептиду; щонайменше, однією групою, вибраною з -СООН, - кожний із замісників Υ являє собою атом воCONHR8, -NHC=NH(NH2), -NHC=NR8(NH2), -NH2, дню або разом вони утворюють зв'язок; NHR8, -NR82, -N+R83, -OH, -OPO(OR8)2, - замісники R1 і R3, незалежно один від одного, OPO(OH)(OR8), -OPO(OH)2, -OSO(OR8)2, являють собою атом водню, аралкіл, алкарил, геOSO(OH)(OR8), -OSO(OH)2 і різних сольових форм тероалкіл, гетероцикл, алкілгетероцикл, гетероциданих груп, де кожний із замісників R8 має значенклоалкіл або нормальний або розгалужений алкіл, ня, визначені вище. Дані групи, відомі як полярні що містить 1-6 атомів вуглецю, причому вказані за своєю природою, значно підвищують гідрофільгрупи необов'язково заміщені, щонайменше, одніні властивості вказаних проліків. 8 єю групою, вибраною з -СООН, -CONHR , Більш переважно, коли вищезгадані аралкіл, 8 8 8 NHC=NH(NH2), -NHONR (NH2), -NH2, -NHR , -NR 2, алкарил, гетероалкіл, гетероцикл, алкілгетеро+ 8 8 8 -N R 3, -OH, -OPO(OR )2, -OPO(OH)(OR ), цикл, гетероциклоалкіл або алкіл заміщені, щоOPO(OH)2, -OSO(OR8)2, -OSO(OH)(OR8), найменше, однією з груп, вибраних з -NR82, -N+R3, OSO(OH)2 і різних сольових форм цих груп, де -OPO(OH)2 або різних сольових форм цих груп, де кожний із замісників R8, незалежно один від однокожний із замісників R має значення, визначені го, являє собою нормальний або розгалужений вище. алкіл, що містить 1-6 атомів вуглецю; Більш переважно, коли один з вказаних заміс2 4 - замісники R і R , незалежно один від одного, ників R1 і R3 являє собою нормальний алкіл, що являють собою атом водню, алкарил або нормамістить 1-6 атомів вуглецю, заміщений, щонаймельний або розгалужений алкіл, що містить 1-6 нше, однією з груп, вибраних з -NR82, -Ν+R83, атомів вуглецю; ΟΡΟ(ΟΗ)2 або різних сольових форм даних груп, - замісники R5 і R6, незалежно один від одного, де кожний із замісників R8 має значення, визначені являють собою атом водню, аралкіл, або нормавище. льний або розгалужений алкіл, що містить 1-6 Коли вказані замісники R1 і R3 являють собою атомів вуглецю; і нормальний алкіл, що містить 1-6 атомів вуглецю, - замісник R7 являє собою аралкіл, алкарил, заміщений, щонайменше, однією з груп, вибраних гетероалкіл, гетероцикл, алкілгетероцикл, гетероз -NR82, -Ν+R83, -ΟΡΟ(ΟΗ)2 або різних сольових циклоалкіл або нормальний або розгалужений форм даних груп, де кожний із замісників R8 має алкіл, що містить 1-6 атомів вуглецю, причому вказначення, визначені вище, тоді відповідні амінокизані групи необов'язково заміщені, щонайменше, слотні залишки переважно є похідними: однією групою, вибраною з -СООН, -CONHR, - або залишків серину, гомосерину, треоніну, 9 8 NHC=NH(NH2), -NHC=NR (NH2), -NH2, -NHR , алотреоніну, N-метилсерину, Ν-метилтреоніну або 8 + 8 8 8 NR 2, -N R 3, -OH, -OPO(OR )2, -OPO(OH)(OR ), N-метилгомосерину, в будь-якій одній з (D) або (L) OPO(OH)2, -OSO(OR8)2, -OSO(OH)(OR8), конфігурацій, переважно (L) конфігурації, і в яких OSO(OH)2 і різних сольових форм цих груп, де гідроксильна група відповідним чином функціонакожний із замісників R8 має значення, визначені лізована так, що бічний ланцюг даних амінокисловище. тних залишків включає полярні і/або солюбілізуючі Коли два замісники Υ утворюють зв'язок, то групи; вказаний амінокислотний залишок загальної форабо залишків лізину, орнітину, аргініну, Nмули (І) є похідним залишку N-метил-(4R)-4-((E)-2дельта-метиларгініну, N-альфа-метиларгініну або бутеніл)-4-метил-L-треоніну, в якому гідроксильна N-метиллізину в будь-якій одній з (D) або (L) кон 11 75136 12 фігурацій, переважно (L) конфігурації, і в яких від-T-U-V-W-MeLeu-Ala-X-MeLeu-Z-MeVal(II), повідно аміно- або іміногрупа відповідним чином функціоналізована так, що бічний ланцюг даних в якій: амінокислотних залишків включає полярні і/або - Τ вибраний з амінокислот Ala, Abu, Nval, Val i солюбілізуючі групи. Thr; 1 2 3 4 Коли замісники R , R і/або R і R , утворюючі - U вибраний з амінокислот Sar, (D)MeSer, 1 2 3 4 пари (R , R ) і/або (R , R ), являють собою алкіл, (D)MeAla і (D) MeSer (OCOR9), де R9 являє собою що містить 1-6 атомів вуглецю, то вони можуть атом водню, алкарил або нормальний або розгаутворити всередині кожної пари алкіленовий ланлужений алкіл, що містить 1-6 атомів вуглецю; цюг, який утворює з атомом вуглецю і атомом азо- V являє собою амінокислоту загальної форту, з якими вони пов'язані, кільце. Переважно вони мули (N-R10)aa, де аа вибрана з амінокислот Val, являють собою бічний ланцюг залишку проліну. Leu, He, Thr, Phe, Туr і Thr, i R10 являє собою норКоли замісники R1 і R3, незалежно один від одмальний або розгалужений алкіл, що містить 1-6 ного, являють собою атом водню, аралкіл, алкаатомів вуглецю; рил, гетероалкіл, гетероцикл, алкілгетероцикл, - W вибраний з амінокислот Val, Nval і Leu; гетероциклоалкіл або нормальний або розгалуже- X вибраний з амінокислот (D)Ala, (D)Ser, ний алкіл, що містить 1-6 атомів вуглецю, але вка(D)Hiv, (D)Val i (D)Thr при (D)Hiv, що являє собою зані групи не заміщені, щонайменше, однією грузалишок D-2-гідроксіізовалеріанової кислоти; і пою, вибраною з -СООН, -CONHR8, - Ζ вибраний з амінокислот Leu і MeLeu. NHC=NH(NH2), -NHC=NR8(NH2), -NH2, -NHR8, Таким чином, якщо у вказаному амінокислотNR82, -N+R83, -OH, -OPO(OR8)2, -OPO(OH)(OR8), ному залишку загальної формули (І) кожний з двох OPO(OH)2, -OSO(OR8)2, -OSO(OH) (OR8), замісників Υ являє собою атом водню, то фармаOSO(OH)2 і різних сольових форм даних груп, тоді кологічно активна молекула, яка буде утворювативони переважно являють собою бічні ланцюги аміся під час розщеплення проліків в організмі, буде нокислотних залишків в (D) або (L) конфігураціях, являти циклічний ундекапептид сімейства циклоспереважно (L) конфігурації, або залишків вказаних поринів, в якому пептидний ланцюг містить залиамінокислот в захищених і/або активованих форшок N-метил-(4R)-4-бутил-4-метил-L-треоніну (Dhмах, що необов'язково мають алкіловану аміногMeBmt). рупу, які, як правило, є такими, що випускаються Аналогічним чином, якщо у вказаному амінопромислово. Більш переважно, коли амінокислотні кислотному залишку загальної формули (І) два залишки вибрані з 20 амінокислот, які звичайно замісники Υ разом утворюють зв'язок, то фарманазиваються натуральними (природними) амінокикологічно активна молекула, яка буде утворюватислотами. ся під час розщеплення проліків в організмі, буде Також є переважним, коли в загальній формулі являти собою циклічний ундекапептид сімейства (І) замісники R5 і R6 не можуть одночасно являти циклоспоринів, в якому пептидний ланцюг містить собою атом водню. Також переважно, коли, щозалишок N-метил-(4R)-4-((E)-2-бутеніл)-4-метил-Lнайменше, один з вказаних замісників R5 і R6 явтреоніну (MeBmt). ляє собою нормальний або розгалужений алкіл, Переважно, щоб дані циклічні ундекапептиди що містить 1-6 атомів вуглецю, а замісник R7 являє відповідали циклоспоринам, які вже описані в лісобою аралкіл або нормальний або розгалужений тературі як такі, що мають фармакологічні властиалкіл, що містить 1-6 атомів вуглецю. вості і які всі містять в їхньому пептидному ланцюзі Більш переважно, коли замісники R5 і R6, неабо залишок N-метил-(4R)-4-((E)-2-бутеніл)-4залежно один від одного, являють собою атом метил-L-треоніну (MeBmt), або залишок N-метилводню або метил. (4R)-4-бутил-4-метил-L-треоніну (Dh-MeBmt). Переважно, вказані проліки являють собою Більш переважно, коли лінійна послідовність з циклічний ундекапептид, в якому пептидний ландесяти інших амінокислотних залишків, утворююча цюг включає один амінокислотний залишок загаз вказаним амінокислотним залишком загальної льної формули (І) і таким чином утворює кільце формули (І) вказаний циклічний ундекапептид, ундекапептиду з лінійною послідовністю з 10 амібула вибрана з наступних послідовностей формул нокислот загальної формули (II) нижче: (III)-(XIV): -Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal-Abu-(D)MeAla-EtVal-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal-Thr-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal-Val-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal-Nval-Sar-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal-Val-(D)MeAla-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-MeLeu-MeVal-Val-Sar-MeLeu-Val-MeLeu-Ala-(D)Val-MeLeu-Leu-MeVal- Val-Sar-MeLeu-Val-MeLeu-Ala-(D)Thr-MeLeu-Leu-MeVal-Abu-(D)MeSer(OAc)-MeLeu-Val-MeLeu-Ala-(D)Ala-MeLeu-Leu-MeVal- Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Ser-MeLeu-MeLeu-MeVal-Thr-Sar-MeLeu-Leu-MeLeu-Ala-(D)-Hiv-MeLeu-Leu-MeVali -Abu-Sar-MeLeu-Val-MeLeu-Ala-(D)Val-MeLeu-Leu-MeVal (lll); (IV); (V); (VI); (VII); (VIII); (lX); (X); (XI); (XII); (XIII); (XIV). 13 Фармакологічно активна молекула, яка буде утворюватися під час розщеплення проліків в організмі, буде відповідно являти собою один з наступних циклоспоринів із залишком який, в залежності від ситуації, є похідним треоніну, з бутеніловим (MeBmt) або бутиловим (Dh-MeBmt) ланцюгом: циклоспорин A (CsA); (D) MeAla3EtVal4CsA (WO 00/01715); циклоспорин С (CsC); циклоспорин D (CsD); циклоспорин G (CsG); (D)MeAla3CsD; (D)Val8Csl; (D)ThR8Csl; 3 8 (D)MeSer(Oac) CsT; (D)SeR CsA (Progress in Medicinal Chemistry, Vol. 25, ed. Ellis and West, Elsevier Science Publ., Biomedical Division, 1998, pp. 1-33); ThR2Leu5(D)Hiv8Leu'°CsC (The Journal of Biological Chemistry, 1991, 266(24), 15570); (D) Val8Leu10CsA; де циклоспорини А, С, D, G, І і Τ описані в Progress in the Chemistry of Organic Natural Products, 1986, 50, 124, і інші циклоспорини одержані аналогічно до способу, описаного в Helvetica Chimica Acta, 1984, 67, 502. Більш переважно, проліки згідно з даним винаходом мають, відповідно, формули (XV) і (XVI) нижче: і Проліки згідно з даним винаходом можна одержати способами хімічного синтезу, що використовуються, добре відомими фахівцям в області хімії пептидів, і особливо в області хімії циклоспоринів. Внаслідок відповідного вибору різних замісників, що визначають амінокислотний залишок загальної формули (І), було встановлено, що проліки згідно з даним винаходом володіють особливо значно кращими гідрофільними властивостями в порівнянні з фармакологічно активною молекулою, що утворюється під час розщеплення вказаних проліків. Як приклад, розчинність деяких проліків згідно з даним винаходом, які утворюють циклоспорин А після розщеплення, щонайменше, в 3000 разів вище, ніж у циклоспорину А. Отже, проліки згідно з даним винаходом легко включати до складу водної фармацевтичної композиції. Також примітно, що, як було встановлено, 75136 14 проліки згідно з даним винаходом не чутливі до значень рН, що звичайно є при даному типі застосування, коли вони знаходяться у водному розчині. Крім того, проліки згідно з даним винаходом повністю здійснюють свою роль, утворюючи протягом періоду напівжиття, відповідного для терапевтичного застосування, фармакологічно активну молекулу при контакті з ферментами, що знаходяться в біологічних рідинах. Також даний винахід відноситься до застосування проліків, як описано вище, як лікувального засобу. Подібний лікувальний засіб переважно застосовують для лікування патологічних станів або фізіологічних станів, для яких заздалегідь потрібне застосування циклоспорину, зокрема, всіх патологічних станів, для яких необхідне застосування циклоспорину А, місцево або системно при внутрішньовенному введенні. Такий лікувальний засіб, зокрема, призначений для забезпечення тривалої приживлюваності алотрансплантатів органів таких, як нирки, серце, печінка, підшлункова залоза, легені, тонкий кишечник або кістковий мозок. Також він може бути призначений для придушення реплікації вірусу імунодефіциту людини типу (ВІЛ-1). При таких застосуваннях дозування проліків згідно з даним винаходом при системному введенні за допомогою внутрішньовенної ін'єкції є таким, щоб концентрація циклоспорину, що утворюється під час розщеплення, наприклад, циклоспорину А, відповідала терапевтичним концентраціям, що звичайно рекомендуються. Більш переважно, якщо такий лікувальний засіб застосовують в області офтальмології і призначений він, зокрема, для лікування патологічних станів ока і оточуючих його придатків. Даними патологічними станами є, в числі іншого, сухий кератокон'юнктивіт, який також називається сухим кератитом очей, синдром Шегрена, форми алергічного кератокон'юнктивіту, зокрема, стійкі до дії кортикостероїдів, кон'юнктивіт зі слизом і синехією, герпетичний стромальний кератит, пов'язаний з імунною системою лімбічний кератит і кератит Тігесона, і профілактику відторгнення трансплантата рогівки, і як допоміжне лікування при хірургічних операціях з метою видалення. Більш переважно лікувальний продукт згідно з даним винаходом використовується для лікування сухого кератокон'юнктивіту. При таких застосуваннях дозування проліків згідно з даним винаходом є таким, щоб концентрація в слізній рідині циклоспорину, що утворюється під час розщеплення проліків, наприклад, циклоспорину А, була вище за 0,5мкг/л при місцевому застосуванні. Лікувальний засіб згідно з даним винаходом можна застосовувати місцево, зокрема, для місцевого лікування станів слизових мембран або станів шкіри, або парентерально, зокрема, внутрішньовенно. Його також можна вводити перорально з метою підвищення біодоступності циклоспорину, наприклад, циклоспорину А. Коли лікувальний засіб згідно з даним винахо 15 75136 16 дом вводять парентерально, то відповідні фарманітрофенілкарбонату (1) цевтичні препарати можуть являти собою стери2,6мл (23,7ммоль, 1,1екв.) льні, концентровані водні розчини або порошки хлоретилхлорформіату додають при 0°С до роздля ін'єкційних препаратів. чину 3г (21,6ммоль, 1екв.) п-нітрофенолу і 1,7мл Переважно лікувальний засіб згідно з даним (21,7ммоль, 1екв.) піридину в 108мл хлороформу. винаходом вводять внутрішньовенно. Відповідні Реакційну суміш перемішують протягом 30 хвилин фармацевтичні препарати для подібного введення при 0°С і потім протягом 16 годин при температурі являють собою водні розчини для ін'єкції або іннавколишнього середовища. Реакційну суміш ексфузії, які добре відомі фахівцям в даній області. трагують водою, 0,5% розчином NaOH і потім воБільш переважно лікувальний засіб згідно з дою. Органічну фазу висушують над Na2SO4, фіданим винаходом застосовують місцево. Відповідльтрують і упарюють при зниженому тиску з ними фармацевтичними препаратами для такого одержанням жовтої олії, яка після кристалізації з введення, зокрема, для застосування в області гексану дає чисту білу тверду речовину (5,8г). 1 офтальмології, є розчини для промивання і лікуH-ЯМР (400МГц, CDCl3); δ: 8,32 (д, 2Н), 7,44 вання очей у вигляді водних стерильних розчинів, (д, 2Н), 6,52 (кв, 1H), 1,95 (с, 3Н). офтальмологічних мазей, офтальмологічних гелів і 1.1.2. Одержання -ацетоксіетил-параофтальмологічних вставок. нітрофенілкарбонату (2) Даний винахід, а також його переважні влас7,8г (24,4ммоль, 1,5екв.) ацетату ртуті додативості, детально представлені, однак, не є обмеють до розчину 4г (16,3ммоль, 1екв.) сполуки (І), женими, в прикладах і за допомогою фігур, на розчиненої в 100мл оцтової кислоти. Реакційну яких: суміш перемішують протягом 1 доби при темпера- на Фіг.1 представлена крива кінетики переттурі навколишнього середовища і потім додають ворення в умовах in vitro проліків згідно з винахоще 1г (3,13ммоль, 0,2екв.) ацетату ртуті. Після дом в результаті гідролізу естеразами і крива кінеперемішування ще протягом 1 доби при температики появи циклоспорину А; турі навколишнього середовища реакцію закінчу- на Фіг.2а представлена концентрація циклосють. Оцтову кислоту випаровують в глибокому порину А в крові після в/в введення циклоспорину вакуумі, і залишок переводять в ефір. Органічну А у вигляді масляного розчину щурам; фазу екстрагують розчином солі і потім сушать - на Фіг.2b і 2с представлена концентрація цинад Na2SO4, фільтрують і упарюють при зниженоклоспорину А в крові після в/в введення водного му тиску з одержанням жовтої олії. Сирий продукт розчину, відповідно, двох проліків згідно з винахохроматографують на силікагелі з одержанням бездом щурам; і барвної олії (4,4г). 1 - на Фіг.3 відповідно представлена концентраН-ЯМР (400МГц, CDCl3); δ: 8,31 (д, 2Н), 7,43 ція у часі циклоспорину А і проліків згідно з вина(д, 2Н), 6,87 (кв, 1H), 2,16 (с, 3Н), 1,64 (с, 3Н). ходом в слізній рідині кроликів. 1.2. Одержання У номенклатурі, використаній в прикладах, для ацетоксіетоксикарбоніллізину (N (Fmoc)) (5) опису одержаних продуктів залишок циклоспорину 1.2.1. Одержання бензилового складного ефіА скорочено позначений CsA, залишок протилежру -ацетоксіетоксикарбоніллізину (Νε(Ζ)) (3) ного фрагмента, пов'язаного з єдиною функціона500мг (1,23ммоль, 1екв.) H-Lys(Z)Obn HCl сульною групою даного циклічного ундекапептиду, а спендують в 2,5мл діоксану. 231мкл (1,35ммоль, саме гідроксильною групою амінокислоти, що має 1,1екв.), Ν,Ν-діізопропілетиламіну (DIPEA) і 396мг 1-е положення, позначається як N-метил-(4R)-4(1,47ммоль, 1,2екв.) сполуки (2) додають при тем((Е)-2-бутеніл)-4-метил-L-треонін (MeBmt). У струкпературі навколишнього середовища. Після перетурних хімічних формулах проміжних продуктів, мішування протягом 1 доби при температурі наодержаних з циклоспорину А, буде представлений вколишнього середовища реакцію закінчують. тільки амінокислотний залишок в 1-ому положенні Діоксан випаровують при зниженому тиску, і зализ відповідним бічним ланцюгом. шок переводять в 20мл етилацетату. Органічну Приклад 1 фазу екстрагують тричі 6% розчином лимонної Одержання циклічного ундекапептиду формукислоти (20 мл), насиченим розчином NaHCO3 ли (XV) (20мл) і насиченим розчином NaCl (20мл), висушують над безводним Na2SO4, фільтрують і розчинник випаровують при зниженому тиску. Одержаний сирий продукт хроматографують на силікагелі з одержанням світлої прозорої олії (576мг). ESI-MC m/z: 501,34 [М+H+]'518,28 (М+Н2О+Н+]. 1.2.2. Одержання ацетоксіетоксикарбоніллізину (4) 50мг паладію на активованому деревному вугіллі додають до розчину 509мг (1,02ммоль) сполуки (3) в 10мл етанолу. Після перемішування 1. Одержання MeBmt (O-Sar-Lys ((N +Me3)протягом 3 годин при температурі навколишнього 1 COOCH(CH3)OCOCH3)) -CsA (XV) середовища в атмосфері водню реакцію закінчу1.1. Одержання -ацетоксіетил-парають. Реакційну суміш фільтрують через целіт і нітрофенілкарбонату (2) фільтрат упарюють при зниженому тиску з одер1.1.1. Одержання -хлоретил-паражанням сирої речовини у вигляді коричнюватих 17 75136 18 кристалів, яке безпосередньо використовують на ють в 2,3мл етанолу. 95мкл (0,68ммоль, 3екв.) наступній стадії (254мг). триетиламіну (TEA) і 31мг (0,45ммоль, 2екв.) хлоES-MC m/z: 276,87 [М+Н+]. риду метиламонію додають при температурі навколишнього середовища. Після перемішування 1.2.3. Одержання протягом 3 діб при температурі навколишнього ацетоксіетоксикарбоніллізину (N (Fmoc)) (5) середовища рН доводять до 12 додаванням TEA і 1,11мл Ν,Ν-діізопропілетиламіну (DIPEA) додаванням 15мг (0,23ммоль, 1екв.) хлориду ме(6,53ммоль, 1,7екв.) і 1,555г (4,61ммоль, 1,2екв.) тиламонію, реакцію закінчують через 1 годину. Fmoc-O-Suc додають до розчину 1,062 Етанол випаровують при зниженому тиску і зали(3,84ммоль, 1екв.) сполуки (4), розчиненої в 38мл шок переводять в етилацетат. Органічну фазу ексдіоксану. Після перемішування протягом 1 години трагують водою і насиченим розчином NaCl, висупри температурі навколишнього середовища реашують над безводним Na2SO4, фільтрують і кцію закінчують. Діоксан випаровують при знижерозчинник випаровують при зниженому тиску. ному тиску і залишок переводять в 20мл ЕtOАс. Одержаний сирий продукт хроматографують на Органічну фазу промивають один раз 6% розчисилікагелі з одержанням білої піни (200мг). ном лимонної кислоти (20мл) і насиченим розчиESI-MC m/z: 1273,7 [М+Н+]. ном NaCl (20мл), висушують над безводним 1.3.3. Одержання MeBmt(O-Sar-Lys (N (FMOCNa2SO4, фільтрують і розчинник випаровують при COOCH(CH3)OCOCH3))1-CsA (8)) зниженому тиску. Одержаний сирий продукт хроматографують на силікагелі з одержанням білої піни (1,026г). ES-MC m/z: 499,37 [М+H+], 516,29 [М+Н20+Н+]. 1.3. Одержання MeBmt (O-Sar-Lvs (N +Me3)COOCH(CH3)OCOCH3))1-CsA.l- (XV) 1 1.3.1. Одержання MeBmt (О-СОСН2Вr) -СsА (6) 4г (3,33ммоль, 1екв.) сухого CsA розчиняють в атмосфері аргону в 66мл (0,76моль) бромацетилброміду. 2г (16,64ммоль, 5екв.) диметиламінопіридину додають невеликими порціями і реакційну суміш перемішують при температурі навколишнього середовища протягом 40 хвилин. Потім реакцію закінчують. Реакційну суміш обережно і при енергійному перемішуванні виливають в суміш гідрокарбонату (77г, 0,91моль), води (500мл) і розмолотого льоду. Можливе додання ще декількох порцій NaHCO3 робить можливим довести рН розчину до 7-8. Відділену водну фазу двічі екстрагують дихлорметаном, і об'єднані органічні фази тричі екстрагують насиченим розчином NaHCO3 і насиченим розчином NaCl, висушують над безводним Na2SO4, фільтрують і розчинник випаровують при зниженому тиску. Одержаний сирий продукт хроматографують на силікагелі з одержанням білої піни (3,2г). ESI-MC m/z: 622,6 [М+2Н+], 673,9 [M+Na++H+]. 1.3.2. Одержання MeBmt(O-Sar-H)1-CsA (7) 300мг (0,23ммоль, 1екв.) сполуки (6) розчиня 79мг (0,06ммоль, 1екв.) сполуки (7) розчиняють в 0,5мл дихлорметану (DCM) в атмосфері аргону. 31,6мкл (0,18ммоль, 3екв.) DIPEA, 35мг (0,09ммоль, 1,5екв.) гексафторфосфату О-(7азабензотриазол-1-іл)-1,1,3,3-тетраметилуронію (НАTU) і 40мг (0,08ммоль, 1,3екв.) сполуки (5), розчиненої в 0,8мл DCM, додають послідовно в атмосфері аргону. Після перемішування протягом 3 годин при температурі навколишнього середовища реакцію закінчують. DCM випаровують при зниженому тиску і залишок переводять в 20мл EtOAc. Органічну фазу промивають один раз 6% розчином лимонної кислоти (20мл), насиченим розчином NaHCO3 (20мл) і насиченим розчином NaCl (20мл), висушують над безводним Na2SO4, фільтрують і розчинник випаровують при зниженому тиску. Сирий продукт хроматографують на силікагелі з одержанням білої піни (59мг). ESI-MC m/z: 1754,36 [М+Н+], 877,86 [М+2Н+]. 1.3.4. Одержання MeBmt (O-Sar-Lys (NaCOOCH(CH3)OCOCH3))1-CsA (9) 90мкл (0,86ммоль, 10екв.) діетиламіну додають до розчину 150мг (0,09ммоль, 1екв.) сполуки (8), розчиненої в 900мкл ацетонітрилу. Після перемішування протягом 3 годин при температурі навколишнього середовища реакцію закінчують. Розчинник випаровують при зниженому тиску і 19 75136 20 сирий продукт хроматографують на силікагелі з 1.1.2. Одержання одержанням білої піни (52мг). ацетоксіетоксикарбонілсерину (11) + + ESI-MC m/z: 1532,79 [М+Н ], 766,79 [М+2Н ]. 40мг паладію на активованому деревному ву1.3.5. Одержання MeBmt(O-Sar-Lys(N +Me3)гіллі додають до розчину 400мг (1,23ммоль) споCOOCH(CH3)OCOCH3))1-CsA.l- (XV) луки (10) в 13мл етанолу. Після перемішування протягом 4 годин при температурі навколишнього середовища в атмосфері водню реакцію закінчують. Реакційну суміш фільтрують через целіт і фільтрат упарюють при зниженому тиску з одержанням сирої речовини у вигляді прозорого осаду, який безпосередньо використовують на подальшій стадії (328мг). 1 Н-ЯМР (400МГц, CDCl3); δ: 6,3-6,8 (м, 1H), 5,8-6,3 (м, 1Н), 4,3-4,4 (м, 1Н), 3,7-4,1 (м, 2Н), 2,08 (с), 1,49 і 1,50 (д, 3Н). 1.2. Одержання MeBmt (O-Sаr-Sеr(OРО(OН)2)СООСН(СH3)ОСОСH3)1-СsА (XVl) 49мг (0,03ммоль, 1екв.) сполуки (9) розчиняють в 640мкл безводного DCM і потім додають 30мкл (0,48ммоль, 15екв.) МеІ з подальшим додаванням 14мкл (0,08ммоль, 2,5екв.) DIPEA. Після перемішування протягом 1 години при температурі навколишнього середовища реакцію закінчують. DCM випаровують при зниженому тиску і сирий продукт очищають напівпрепаративною ВЕРХ для виділення чистої речовини у вигляді ліофілізату (30мг). ESI-MC m/z: 1574,37 [М+Н+], 787,83 [М+2H+]. 170мг (0,13ммоль) сполуки (7), одержаної в Приклад 2 прикладі 1, розчиняють в 3мл дихлорметану в атОдержання циклічного ундекапептиду формумосфері аргону. Послідовно в атмосфері аргону ли (XVI) додають 92мкл (0,53ммоль, 4екв.) DIEA, 51мг (0,26ммоль, 2екв.) НАTU і 60мг сполуки (11) (0,25ммоль, 2екв.). Після перемішування протягом 5 годин при температурі навколишнього середовища реакцію закінчують. Дихлорметан випаровують при зниженому тиску, і залишок переводять в етилацетат. Органічну фазу тричі екстрагують 6% розчином лимонної кислоти, насиченим розчином NaHCO3 і насиченим розчином NaCl, висушують над безводним Na2SO4, фільтрують і розчинник випаровують при зниженому тиску. Одержаний 1. Одержання MeBmt (О-Sаr-Sеr(ОРО(ОН2))сирий продукт хроматографують на силікагелі з 1 СООСН(СН3)OСОСН2)) -СsА (XVI) одержанням білої піни (143мг). 1.1. Одержання ESI-MC m/z: 1513,22 [M+Na+], 1508,34 ацетоксіетоксикарбонілсерину (11) [М+Н2О+Н+], 1491,36 [М+Н+], 746,36 [М+2Н+]. 1.1.1. Одержання бензилового складного ефі1.2.2. Одержання MeBmt(O-Sarру -ацетоксіетоксикарбонілсерину (10) Ser(OPO(Oall)2)-COOCH(CH3)-OCOCH3)1-CsA (13) 1,4г (6,04ммоль, 1екв.) H-Ser-Obn HCl суспендують в 12мл діоксану. 1,14мл (6,6 ммоль, 1,1екв.) DIEA і 2,1г (7,85ммоль, 1,3екв.) сполуки (2), одержаної в прикладі 1 додають при температурі навколишнього середовища. Після перемішування протягом ночі при температурі навколишнього середовища реакцію закінчують. Діоксан випаровують при зниженому тиску, і залишок переводять в етилацетат. Органічну фазу тричі екстрагують 6% розчином лимонної кислоти, насиченим розчи130мг (0,09ммоль, 1екв.) сполуки (12) розчином NaHCO3 і насиченим розчином NaCl, висушуняють в 880мкл безводного СН2Сl2. Потім додають ють над безводним Na2SO4, фільтрують і розчин20мг (0,27ммоль, 3екв.) 1Н-тетразолу з подальник випаровують при зниженому тиску. Одержаний шим додаванням 52мкл (0,17ммоль, 2екв.) сирий продукт хроматографують на силікагелі з (AllO)2PN(iPr)2. Після перемішування протягом 4 одержанням білої піни (1,1г). годин при температурі навколишнього середови1 Н-ЯМР (400МГц, CDCl3); δ: 7,34-7,41 (м, 5Н), ща реакційну суміш охолоджують до -60°С, дода6,79-6,85 (м, 1H), 5,72-5,82 (м, 1Н), 5,24 (с, 2Н), ють 44мг (0,17ммоль, 2екв.) м-хлорпербензойної 4,47 (м, 1H), 3,94-4,05 (м, 2Н), 2,06 і 2,08 (с, 3Н), кислоти і продовжують перемішування при -60°С 1,49 і 1,50 (д, 3Н). 21 75136 22 протягом 30 хвилин, при 0°С -протягом 15 хвилин і при температурі навколишнього середовища допри температурі навколишнього середовища дають до розчину 184мг (0,58ммоль, 3екв.) Bu4N+Fпротягом 45 хвилин. 0,5мл 10% розчину Na2S2O5 H2O в 2мл СН2Сl2. Після перемішування при темвносять в реакційне середовище при 0°С для руйпературі навколишнього середовища протягом 10 нування надлишку окислювача і потім проводять хвилин додають 320мг (0,19ммоль, 1екв.) сполуки екстракцію дихлорметаном. Органічну фазу про(13) і реакційну суміш перемішують при темперамивають 10%розчином Na2S2O5 і потім дихлорметурі навколишнього середовища протягом 30 хвитан випаровують при зниженому тиску. Залишок лин. Потім реакцію закінчують. Реакційну суміш переводять в метил-трет-бутиловий ефір і дану гідролізують додаванням 6% розчину лимонної органічну фазу екстрагують 6% розчином лимонкислоти і дихлорметан випаровують при зниженоної кислоти і насиченим розчином NaCl, висушуму тиску. Залишок переводять в етилацетат і одеють над безводним Na2SO4, фільтрують і розчинржану органічну фазу тричі екстрагують 6% розчиник випаровують при зниженому тиску. Одержаний ном лимонної кислоти і насиченим розчином NaCl, продукт хроматографують на силікагелі з одервисушують над безводним Na2SO4, фільтрують і жанням білої піни (98мг). розчинник випаровують при зниженому тиску. ESI-MC m/z: 1651,38 [М+H+], 826,35 [М+2Н+]. Одержаний сирий продукт хроматографують на 1.2.3. Одержання MeBmt(O-Sarкартриджі Sep-Pack® і потім піддають препаративSer(OPO(OH)2)-COOCH(CH3)-OCOCH3)1-CsA (XVI) ній ВЕРХ для виділення чистої сполуки у вигляді ліофілізату (342мг). ESI-MCm/z: 1593,32 [M+Na+]; 1571,81 [М+Н+]. Приклад 3 Фізико-хімічні властивості циклічних ундекапептидів формул (XV) і (XVI) 1. Розчинність у воді циклічних ундекапептидів формул (XV) і (XVI) Розчинність у воді визначали візуально при температурі лабораторної кімнати безпосереднім розчиненням зваженої кількості циклічного ундекапептиду в 67мМ фосфатом буфері типу Соренсену. Значення представлені в таблиці 1. 206мкл (1,55ммоль, 8екв.) Me3SiN3 і 1,12г (0,97ммоль, 5екв.) (PPh3)4Pd° в атмосфері аргону Таблиця 1 Циклічний ундекапептид рН=5 (XV) (XVI) >20мМ Для зведення: описано, що циклоспорин А володіє максимальною розчинністю у воді, яка дорівнює 33мкг/мл, при температурі 20°С і рН 7, що відповідає максимальній концентрації 0,027мМ. 2. Хімічна і ферментативна стабільність циклічних ундекапептидів формул (XV) і (XVI) Первинне визначення хімічної стабільності ци Розчинність у воді при рН=6 рН=7 >7мМ >20мМ >20мМ рН=8 >20мМ клічного ундекапептиду формули (XV) протягом часу проводили спочатку в ізотонічному розчині маніту, а потім в фосфатному буфері (PBS) при рН 7 і температурі 4, 20 і 37°С. Процентний вміст виявленого циклоспорину А представлений в таблиці 2 нижче. Таблиця 2 4°С, маніт 30 діб 90 діб 20°С, маніт 37°С, маніт 3,5% 5,0% 17,0% 38,0% 25,0% Як можна бачити з даних таблиці, циклічний пептид був стабільний в розчині маніту протягом, щонайменше, 90 діб при температурі 4°С. Друге визначення стабільності як хімічної, так і ферментативної, проводили з двома циклічними ундекапептидами формул (XV) і (XVI), розчиненими в 50мМ буфері Hepes при рН 7,4, при 37°С в присутності і за відсутності естераз. Під час інкубації при 37°С відбирали аліквотні порції об'ємом 40мкл у відповідні періоди часу і аналізували ВЕРХ і ESI-MC. 37°С, забуферений фосфатом фізіологічний розчин 90,0% За відсутності ферменту протягом більше 3 діб спостерігали хімічну стабільність для обох циклічних ундекапептидів. Результати, одержані під час гідролізу в присутності естераз, подані на Фіг.1. Крива кінетики перетворення циклічного ундекапептиду (XVI) представлена значками у вигляді ромбів в той час, як крива кінетики появи циклоспорину А представлена значками у вигляді квадратів. Як можна відмітити з представлених на фігурі даних, в присутності естераз циклічний ундекапептид (XVI) 23 75136 24 швидко руйнується з утворенням циклоспорину А. чинів оцінювали на можливість внутрішньовенного Аналогічне спостереження було зроблене для цизастосування. клічного ундекапептиду (XV). Так, два циклічних ундекапептиду (XV) і (XVI) в Циклічні ундекапептиди (XV) і (XVT) інкубуварозчині фосфатного буфера вводили внутрішньоли в бичачій сироватці при 37°С. Визначали періовенно щурам в дозі, еквівалентній 10мг/кг циклосди напівперетворення циклічних ундекапептидів в порину А. циклоспорин А, які складали відповідно 3,66 і 3,50 Як стандарт використали пробу ін'єкційного чача. розчину промислово доступного циклоспорину під Приклад 4 торговою назвою сандиммун після відповідного Застосування внутрішньовенного введення у розведення. вигляді водного розчину Через регулярні інтервали часу відбирали Вивчення фармакокінетики циклічних ундекапроби крові і потім піддавали аналізу на вміст цикпептидів формул (XV) і (ХVІ) лоспорину А. Для того, щоб зробити доступним для лікарів Концентрації циклоспорину А в крові після в/в засіб, який являє собою альтернативу фармацеввведення циклоспорину А представлені на Фіг.2а. тичним композиціям циклоспорину А, що звичайно Концентрації циклоспорину А в крові, одержана використовується у вигляді мікроемульсії в поліокпісля в/в введення водного розчину двох проліків сіетиленованій касторовій олії, яка володіє низь(XV) і (XVl), представлені на Фіг.2b і 2с, відповідно. кою стабільністю, з нею відносно важко поводитиДані, одержані з кривих на Фіг.2а, 2b і 2с, предстася, і вона викликає побічні ефекти, проліки згідно з влені в таблиці 3 нижче. даним винаходом у вигляді звичайних водних розТаблиця 3 Ундекапептід AUCo-inf, мкг год. л-1 CL, л/год./кг MRT, год. Vss, л/кг Т1/21, год. Т1/22, год. У даній таблиці скорочення мають наступні значення: - AUC: площа під кривою концентрації; - CL: кліренс; - MRT: середній час втримання; - Vss: об'єм розподілу в стаціонарній фазі; - Т1/21: первинний період напіврозпаду; - Т1/22: кінцевий період напіврозпаду. Як можна відмітити з даних Фіг.2 і таблиці 3, фармакокінетичні параметри, встановлені в контрольному досліді з циклоспорином А, були порівнянні з тими, що є в літературі. Площа під кривою концентрації для циклоспорину А, що утворився під час розщеплення циклічного ундекапептиду (XV), була порівнянна з такою для циклоспорину А в контрольному досліді в той час, як даний показник для циклоспорину А, що утворився в результаті розщеплення циклічного ундекапептиду (XVI), був нижче на 25% в порівнянні з таким для циклоспорину А в контрольному досліді. Два циклічних ундекапептиди (XV) і (XVI) показували однакові профілі утворення циклоспорину А. Дані профілі схожі з таким для циклоспорину А при його введенні у вигляді фармацевтичної форми на основі поліоксіетилінованої касторової олії. Виходячи з цих даних, можна дійти висновку, що проліки згідно з даним винаходом дають еквівалентний профіль утворення циклоспорину А при наступних важливих перевагах в порівнянні з існуючими фармацевтичними композиціями циклоспорину А: - простота застосування при простому розчиненні у воді; і - відсутність необхідності використовувати на Циклоспорин А 69229 0,14 15,2 2,2 0,31 11,1 (XV) 66626 0,15 15,3 2,2 0,55 11,8 (XVI) 44699 0,22 14,9 3,4 0,20 11,8 повнювачі, які є токсичними; і - відсутність необхідності використовувати специфічні речовини при роботі з ними. Приклад 5 Застосування для місцевого введення в око у вигляді водного розчину Вивчення фармакокінетики циклічного ундекапептиду формули (XV) Для того, щоб зробити доступним для лікаря засіб для місцевого застосування в оці на основі циклоспорину А, що не спричиняє подразнення або неприємних відчуттів, або розпливчатого зору, оцінювали проліки згідно з даним винаходом у вигляді звичайних водних розчинів. 1. Приготування розчинів Готували ізотонічні водні розчини циклічного ундекапептиду (XV), що містять 5% маніту і з рН 7,0. Концентрація циклоспорину А була рівна 1% (мас/об.). Розчини стерилізували пропущенням їх через фільтри з нітроцелюлози з розміром пір 0,22мкм. Готували стандартну композицію циклоспорину А у вигляді 1% розчину на оливковій олії. 2. Визначення переносимості циклічного ундекапептиду формули (XV) Визначали переносимість для очей двома методами, а саме, тестом Драйза в модифікації і з використанням співфокусного лазерного скануючого офтальмоскопа. 2.1. Модифікований тест Драйза (тест по гострій переносимості) Дане дослідження проводили на шести самцях-альбіносах кроликів. Кожній тварині в одне око закапували 50мкл розчину, описаного вище, інше око не обробляли, і воно служило контролем. 25 75136 26 Клінічну оцінку можливої подразнювальної дії кон'юнктиви згідно з класифікацією, представлепроводили візуально за допомогою оцінки витоків ною в таблиці 4. з ока, наявності хемозу кон'юнктиви і почервоніння Таблиця 4 Витоки з очей У нормі Незначні витоки Сильні витоки, що покривають невелику поверхню роговиці Сильні витоки, що покривають велику частину поверхні рогівки Хемоз У нормі Незначний хемоз, що включає віко Виражений хемоз з частковим закриттям ока Виражений хемоз із закриттям ока 0 1 2 3 0 1 2 3 Почервоніння Кровоносні судини в нормі Гіперемія деяких судин Дифузне почервоніння, окремі судини важко розрізнити Виражене дифузне почервоніння 0 1 2 3 У кожної тварини досліджували можливу подразнювальну дію по показниках, представлених вище, в певні періоди часу протягом 48 годин після закапування і розраховували загальний індекс подразнювальної дії (Іirr) по загальній сумі встановлених показників. Результати представлені в таблиці 4 в п. 2.3. нижче. 2.2. Співфокусний лазерний скануючий офтальмоскоп (тест для оцінки підгострої токсичності протягом 4-денного періоду введення) Даний тест проводили на тому ж виді тварин, як описано раніше. 25мкл розчину, описаного вище, закапували на рогівку правого ока три рази на день на протязі чотирьох діб, і потім один раз на четверту добу безпосередньо перед обстеженням. Після останнього закапування кроликів усипляли введенням кетаміну гідрохлориду і ксилазину. В око вносили 25мкл (усього) розчину натрієвої солі флуоресцеїну з концентрацією 0,5% у відношенні маса/об'єм для вибіркового мічення, можливо, пошкоджених поверхонь ока. Потім око промивали протягом однієї хвилини фізіологічним розчином при 37°С. Нарешті, око обстежували за допомогою співфокусного лазерного скануючого офтальмоскопа по методу, описаному Furrer et al., J. Ocular Pharmacol., 1997, 13, 559. Офтальмоскоп був сполучений з системою аналізу зображень для одержання зображення в трьох напрямах і для оцінки пошкоджених поверхонь. Міру переносимості оцінювали в залежності від процента дільниць поразки рогівки і по наступних показниках: - від 0% до 25%: хороша переносимість; - від 25% до 40%: прийнятна переносимість; - від 40% до 60%: низька переносимість; - вище за 60%: неприйнятна переносимість. Потрібно відмітити, і це загалом є загальновизнаним, що процент дільниць поразки, менший або рівний 5%, відповідає звичайному показнику загибелі клітин в організмі, що не зазнавав якогонебудь впливу. Одержані результати представлені в таблиці 5 в п. 2.3. нижче. 2.3. Результати оцінки переносимості для очей циклічного ундекапептида формули (XV) Таблиця 5 Тест Драйза, Ііrr CLSO, % дільниць пошкодження З даних таблиці 5 слідує, що в тесті Драйза для циклічного ундекапептиду формули (XV) був одержаний загальний індекс подразнювальної дії, що дорівнює 1,8, і що 7% рогівки зазнавало пошкодження при введенні даного продукту. Два цих результати свідчить про дуже хорошу переносимість циклічного ундекапептиду, ця переносимість виявляється явно поліпшеною в порівнянні з циклоспорином А при введенні останнього в оливковій олії. З очевидних причин на тваринах не оцінювали суб'єктивне поліпшення якості зору при використанні водного розчину в порівнянні з масляним розчином. 3. Стабільність циклічного ундекапептиду фо Ундекапептід (XV) 1,8 7 Циклоспорин А 1,9 23 рмули (XV) Проби розчинів, описаних вище, зберігали відповідно при 4°С і 20°С. Регулярно протягом 3 місяців проводили аналіз методом ВЕРХ. Було встановлено, що дані проби володіють хорошою стабільністю при зберіганні в таких умовах. 4. Кінетика перетворення циклічного ундекапептиду формули (XV) в умовах ex vivo Даний тест по кінетиці перетворення проводили при інкубуванні при 37°С 25мкл проби розчину, описаного вище, при м'якому перемішуванні з 8мкл свіжої слізної рідини кроликів. Через 1, 2, 3 і 30 хвилин відбирали проби об'ємом 2мкл і потім аналізували методом ВЕРХ. Одержані результати показують, що циклічний 27 75136 28 ундекапептид формули (XV) грає свою роль пролідовжується протягом подальших 20 хвилин. Через ків з першої хвилини контакту зі слізною рідиною, 1 хвилину концентрація циклоспорину А в слізній утворюючи циклоспорин А. Через 3 хвилини перерідині дорівнювала 0,025мг/мл. творення зазнавало 3% проліків, і потім через 30 6. Висновки хвилин - 4,7%. На основі даних результатів можна дійти ви5. Кінетика перетворення циклічного ундекасновку, що проліки згідно з даним винаходом напептиду формули (XV) в умовах in vivo дають наступні переваги при місцевому застосуДаний тест по кінетиці перетворення проводиванні для очей: ли при закапуванні 25мкл проби розчину, описано- простота приготування фармацевтичної комго вище, в праве око самців-альбіносів кроликів позиції, такої як рідина для очей, простим розчи(масою 4кг). Через 1, 2, 3, 4 і 20 хвилин відбирали ненням у водному розчині без необхідності застопроби слізної рідини і потім аналізували методом сування масляних ад'ювантів; ВЕРХ. - хороша гостра переносимість і дуже хороша Одержані результати подані на Фіг.3. Як можпідгостра переносимість, яка вище в порівнянні з на відмітити, результати даного тесту підтверджувстановленими для фармацевтичної композиції ють результати, вже одержані в досліді в умовах циклоспорину в масляній формі; ex vivo. Циклічний ундекапептид формули (XV) - хороша стабільність; і (квадрати) явно виконує роль проліків з першої - час напівжиття, відповідний для застосуванхвилини контакту зі слізною рідиною кроликів, виня в офтальмології. діляючи циклоспорин А (кола), і це виділення про 29 Комп’ютерна верстка Л. Купенко 75136 Підписне 30 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA modified cyclosporine which can be used as prodrugs. and application thereof
Назва патенту російськоюМодифицированный циклоспорин, который можно использовать как пролекарства, и его применение
Автори російськоюWenger, Roland
МПК / Мітки
МПК: A61P 43/00, A61K 38/00, C07K 7/64, A61P 27/02, A61P 31/18
Мітки: проліки, можна, використовувати, модифікований, застосування, циклоспорин
Код посилання
<a href="https://ua.patents.su/15-75136-modifikovanijj-ciklosporin-yakijj-mozhna-vikoristovuvati-yak-proliki-i-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Модифікований циклоспорин, який можна використовувати як проліки, і його застосування</a>
Попередній патент: Інтерференційне покриття (варіанти) та матеріал для його виготовлення (варіанти)
Наступний патент: Електростимулювальний зубний протез
Випадковий патент: Пластинчастий калорифер












