Система доставки ліків
Формула / Реферат
1. Система доставки лікарських засобів для введення щонайменше однієї фармацевтично активної речовини, яка сама по собі є катіонною амфіфільною речовиною, при цьому фармацевтично активна речовина перебуває в системі доставки лікарських засобів у вигляді частинок комплексу зазначеної фармацевтично активної речовини і натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації, причому зазначені частинки зазначеного комплексу мають ефективний середній розмір менший, ніж приблизно 100 нм,
при цьому
- частинки зазначеного комплексу є по суті аморфними;
- частинки зазначеного комплексу укладені до наночастинок, утворених натрієвою сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньою комбінацією; і
- відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації до маси зазначеного комплексу знаходиться в діапазоні, що становить від приблизно 1:1 до приблизно 5:1.
2. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що зазначена фармацевтично активна речовина має розчинність per se у воді щонайменше 4 мг/мл, і зазначений комплекс являє собою нековалентний комплекс, який має розчинність у воді меншу за 0,1 мг/мл.
3. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що зазначений комплекс має ефективний середній розмір частинок менший, ніж приблизно 50 нм.
4. Система доставки лікарських засобів за п. 1, яка містить щонайменше одну іншу фармацевтично активну речовину, яка має розчинність per se у воді меншу, ніж приблизно 100 мкг/мл, причому зазначена інша фармацевтично активна речовина перебуває в формі частинок із ефективним середнім розміром меншим, ніж приблизно 100 нм,
при цьому
- частинки зазначеної іншої фармацевтично активної речовини є по суті аморфними;
- частинки зазначеної іншої фармацевтично активної речовини укладені разом із частинками зазначеного комплексу до зазначених наночастинок; і
- відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації до загальної маси зазначеної іншої фармацевтично активної речовини і зазначеного комплексу знаходиться в діапазоні, що становить від приблизно 1:1 до приблизно 5:1.
5. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що щонайменше одна із зазначених фармацевтично активних речовин являє собою цитотоксичну або цитостатичну сполуку.
Текст
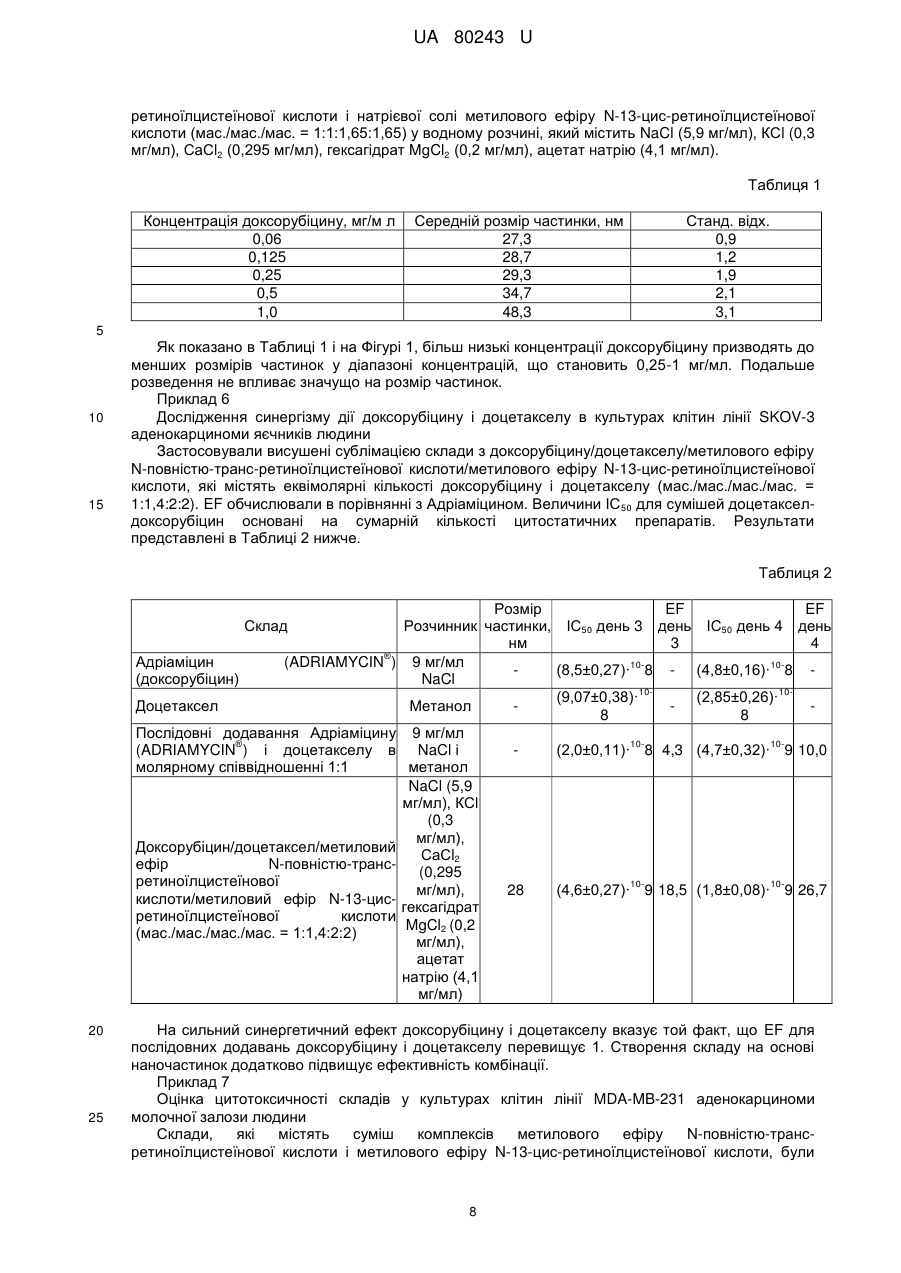
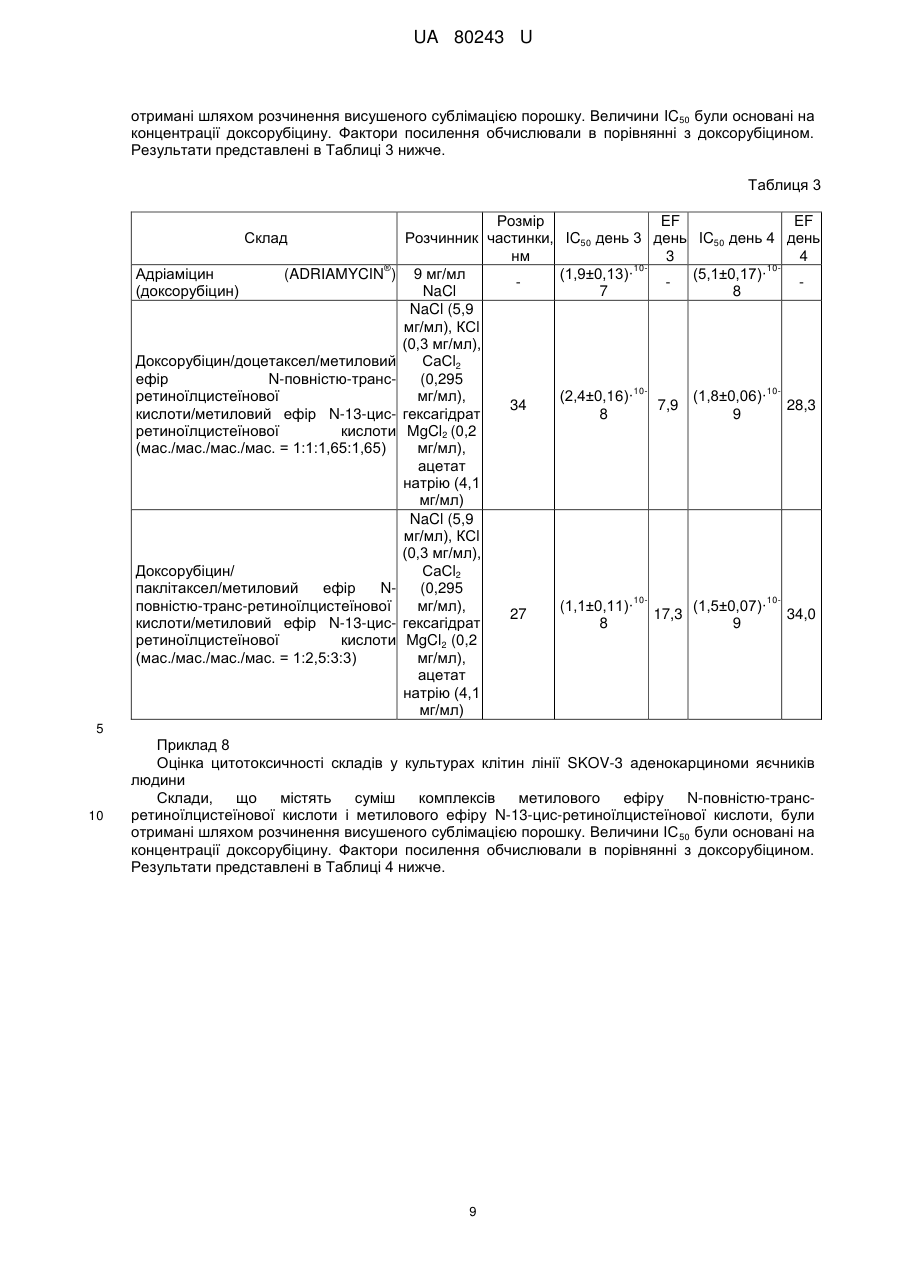
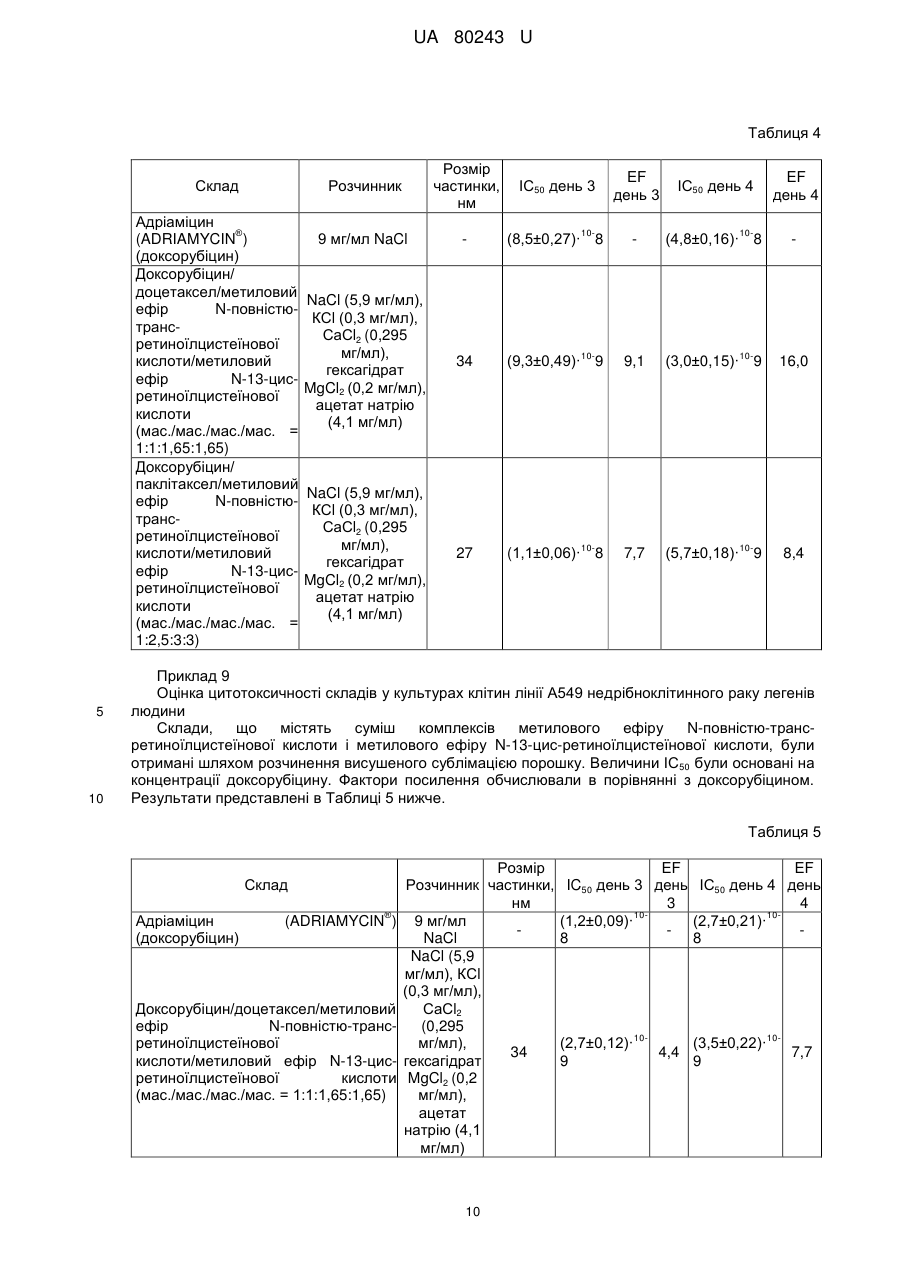
Реферат: Система доставки лікарських засобів (СДЛЗ) для введення розчинної у воді, катіонної та амфіфільної фармацевтично активної речовини (АФІ, активного фармацевтичного інгредієнта) містить аморфні частинки з розмірами меншими за 100 нм малорозчинного у воді комплексу АФІ з натрієвою сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти і/або натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти. Частинки зазначеного комплексу включені до наночастинок, утворених натрієвою сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти і/або натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти. Відношення маси натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти і/або натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти до маси комплексу становить від приблизно 1:1 до приблизно 5:1. UA 80243 U (54) СИСТЕМА ДОСТАВКИ ЛІКІВ UA 80243 U UA 80243 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до системи доставки лікарських засобів для введення фармацевтично активних речовин, фармацевтичної композиції, яка містить таку систему доставки лікарських засобів, і до способів одержання такої системи доставки лікарських засобів. Крім того, корисна модель також належить до застосування такої системи доставки лікарських засобів для одержання лікарського препарату для лікування раку. Лікарські засоби з вузькими терапевтичними індексами мають недолік, який полягає в тому, що невеликі зміни дозування можуть викликати токсичні ефекти. Пацієнти, що приймають такі лікарські засоби, часто мають потребу в обширному моніторингу, щоб інтенсивність лікарської терапії могла бути скоректована для забезпечення постійних і безпечних результатів. Наполегливо потрібно усунути необхідність такого моніторингу, не ставлячи при цьому під загрозу одержання постійних і безпечних результатів. Ця необхідність стає особливо чіткою, коли такі лікарські засоби застосовують у комбінованій терапії. Комбіновану терапію, яка являє собою одночасне введення двох або більше лікарських препаратів для лікування єдиного захворювання, застосовують для лікування великої кількості станів, таких як, наприклад, туберкульоз, проказа, рак, малярія та ВІЛ/СНІД. У багатьох випадках комбінована терапія має ряд переваг, таких як більш низький відсоток неефективності лікування, менші коефіцієнти смертності, більш повільний розвиток резистентності - і також менша необхідність у розробці нових лікарських засобів. Однак комбінована терапія також характеризується рядом потенційних недоліків, таких як антагонізм об'єднаних лікарських засобів, який призводить до зниження їхньої індивідуальної активності; підвищений ризик взаємодій лікарських засобів, що приносять шкоду; більш висока вартість у порівнянні з монотерапією; і збільшення ймовірності виникнення пов'язаної з лікарськими засобами токсичності. Комбіновану хіміотерапію широко застосовують для лікування різних типів раку, оскільки вона покращує профіль виживаності в порівнянні з монотерапією. Кращий результат може бути отриманий за рахунок об'єднання протипухлинних агентів із різними механізмами дії, яке забезпечує синергетичні або адитивні ефекти під час терапії. Основна проблема, пов'язана із застосуванням комбінованої хіміотерапії, полягає в збільшенні токсичності в порівнянні з послідовним введенням єдиного агента. Дана проблема може не бути компенсованою шляхом обмеження доз, оскільки це призвело б до застосування доз, менших за терапевтичні. Різні агенти також характеризуються різними фармакокінетичними властивостями, що ускладнює підтримку концентрацій кожного з них у тканинах-мішенях на оптимальних синергетичних рівнях. Доксорубіцин являє собою лікарський засіб, який широко застосовується в комбінованій хіміотерапії. Він має відмінну протипухлинну активність, але, на жаль, також і порівняно низький терапевтичний індекс поряд із широким спектром побічних ефектів, що обмежує застосування даного препарату. Одним таким побічним ефектом є кардіотоксичність, яка зазвичай розвивається у вигляді гострого або підгострого синдрому. При більшій експозиції препарату може відбутися пошкодження міокарда, і тому рекомендується, щоб сумарна доза 2 доксорубіцину, отримана протягом життя, не перевищувала 450-550 мг/м . Зазначена кардіотоксичність являє собою головну причину, яка перешкоджає застосуванню доксорубіцину у літніх пацієнтів і у пацієнтів із захворюванням серця, яке існує від початку. Було здійснено кілька спроб забезпечення комбінацій на основі антрациклінів/таксанів, наприклад, доксорубіцину і доцетакселу, із застосуванням традиційних складів. Ці сполуки демонструють високу активність при застосуванні у вигляді монотерапії, маючи різні механізми дії: доксорубіцин інгібує активність ферменту топоізомерази II протягом усього клітинного циклу, у той час як доцетаксел ускладнює мітотичний поділ клітин у проміжку між метафазою та анафазою, перешкоджаючи фізіологічній деполімеризації/розбиранню мікротрубочок. Як було показано, запропоновані комбінації були більш ефективними, ніж відповідні варіанти монотерапії, але також передбачали більш високу токсичність. Остання обставина перешкоджає тому, щоб комбінована терапія стала стандартним способом для лікування різних типів раку, особливо у випадку конкретних станів, таких як фебрильна нейтропенія. Було б бажаним мати можливість створити систему доставки лікарських засобів, яка зменшила б потребу в обширному моніторингу пацієнтів, що приймають лікарські засоби з вузькими терапевтичними індексами. Одною задачею даної корисної моделі є забезпечення такої системи доставки лікарських засобів. Іншою задачею даної корисної моделі є забезпечення системи доставки лікарських засобів, яка знизила або усунула б пов'язану з лікарськими засобами токсичність, обумовлену комбінованою терапією. 1 UA 80243 U 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, один варіант реалізації корисної моделі належить до системи доставки лікарських засобів для введення щонайменше однієї фармацевтично активної речовини, яка сама по собі є катіонною амфіфільною речовиною, при цьому фармацевтично активна речовина знаходиться в системі доставки лікарських засобів у вигляді частинок комплексу зазначеної фармацевтично активної речовини та натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації, причому зазначені частинки зазначеного комплексу мають ефективний середній розмір менший, ніж приблизно 100 нм, при цьому - частинки зазначеного комплексу є по суті аморфними; - частинки зазначеного комплексу включені до наночастинок, утворених натрієвою сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньою комбінацією; і - відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації до маси зазначеного комплексу знаходиться в діапазоні, що становить від приблизно 1:1 до приблизно 5:1. Терапевтичні індекси різних фармацевтичних препаратів значно покращені за допомогою системи доставки лікарських засобів згідно з даною корисною моделлю. Побічні ефекти, які головним чином викликаються високими концентраціями лікарських засобів після інфузій, значно зменшені за допомогою системи доставки лікарських засобів згідно з даною корисною моделлю, оскільки остання імітує тривалу інфузію. Інкапсульовані речовини захищені від метаболічних перетворень, і вони вивільняються поступово шляхом розчинення/руйнування частинок, що сприяє підтримуванню концентрації лікарських засобів усередині терапевтичного вікна. Слід зазначити, що поряд із токсичними концентраціями, згідно з даною корисною моделлю також уникають застосування субтерапевтичних концентрацій, які інакше могли б призвести до розвитку стійкості до лікарських засобів. Інкапсулювання різних типів фармацевтичних речовин до наночастинок, які одержують за допомогою системи доставки лікарських засобів згідно з даною корисною моделлю, забезпечує одночасний перенос цих речовин до мішеней їхньої дії, їх синхронізацію у інших випадках різних фармакокінетичних профілів (наприклад, період напіввиведення доцетакселу в п'ять разів перевищує період напіввиведення доксорубіцину), стимулюючи, таким чином, розвиток синергічної дії складових комбінації. Дана корисна модель підходить для створення комбінованих складів із двох або більше видів фармацевтично активних речовин, таких як, наприклад, протипухлинні речовини. Серед лікарських засобів, які можуть бути застосовані в системах доставки лікарських засобів згідно з даною корисною моделлю, присутні розчинні у воді протипухлинні агенти, наприклад, агенти, що містять одну або більше аміногруп, наприклад, гідрохлориди антрациклінів. Згідно з одним аспектом даної корисної моделі, розчинність таких солей антрациклінів значно зменшена шляхом заміщення хлорид-аніону на аніон метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти, метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації. Отримані нерозчинні комплекси допускають завантаження цих антрациклінових похідних до наночастинок системи доставки лікарських засобів згідно з даною корисною моделлю, забезпечуючи повільне вивільнення лікарських засобів. Прикладами таких антрациклінів є доксорубіцин, даунорубіцин, епірубіцин, ідарубіцин, мітоксантрон та їхні природні, синтетичні й напівсинтетичні аналоги. Серед інших видів речовин, які можуть бути застосовані в комбінаціях, запропонованих згідно з даною корисною моделлю, присутні: - Нерозчинні у воді протипухлинні агенти, такі як таксани, наприклад, паклітаксел, доцетаксел та їхні природні, синтетичні й напівсинтетичні аналоги; - Алкалоїди барвінку, такі як, наприклад, вінкристин, вінбластин, вінорелбін, віндезин та їхні природні, синтетичні й напівсинтетичні аналоги; - Інгібітори топоізомерази, такі як, наприклад, іринотекан, топотекан, етопозид, теніпозид та їхні природні, синтетичні й напівсинтетичні аналоги; і - Алкілуючі агенти, такі як, наприклад, амсакрин, прокарбазин, біс-хлорнітрозосечовина та їхні аналоги. Комбіновані склади згідно з корисною моделлю можуть бути отримані в різних водних розчинах. Вони можуть бути прямо введені або висушені сублімацією для наступного застосування. Розмір частинок у отриманих системах доставки лікарських засобів згідно з корисною моделлю лежить у діапазоні, що становить приблизно 8-100 нм. 2 UA 80243 U 5 10 15 20 25 30 35 40 45 50 55 Як було показано за допомогою кріогенної просвічуючої електронної мікроскопії, системи доставки лікарських засобів згідно з даною корисною моделлю, які містять таксани і доксорубіцин, складаються з ниткоподібних частинок з розмірами приблизно 20 нм, які іноді залучені до більших агрегатів. Розведення складів призводить до зменшення розміру агрегатів. Дана корисна модель буде описана більш докладно в наступному описі, прикладах і доданих кресленнях, де Фіг. 1 ілюструє розмір частинок, утворених із доксорубіцину, доцетакселу, натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти і натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (мас./мас./мас. = 1:1:1,65:1,65) при різних розведеннях. Розчинник: водний розчин, що містить NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл). Фіг. 2 ілюструє розподіл об'єму частинок за розмірами для складу, отриманого шляхом відновлення висушеної сублімацією суміші доксорубіцину, доцетакселу, натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти і натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (мас./мас./мас. = 1:1:1,65:1,65). Розчинник: водний розчин, що містить NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл). Концентрація доксорубіцину становить 0,5 мг/мл. Фіг. 3 ілюструє розподіл об'єму частинок за розмірами для складу, отриманого шляхом відновлення висушеної сублімацією суміші доксорубіцину, паклітакселу, натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти і натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (мас./мас./мас. = 1:2,5:3:3). Розчинник: водний розчин, що містить NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл). Концентрація паклітакселу становить 1 мг/мл. Опис варіантів реалізації корисної моделі Перш ніж дана корисна модель буде розкрита й описана, варто розуміти, що дана корисна модель не обмежується конкретними формами, стадіями процесів і речовинами, запропонованими в даній заявці, оскільки такі форми, стадії процесів і речовини можуть дещо змінюватися. Також варто розуміти, що застосовувана в даній заявці термінологія використовується для цілей опису лише конкретних варіантів реалізації та не є обмежуючою, оскільки рамки даної корисної моделі будуть обмежені винятково доданою формулою корисної моделі і її еквівалентами. Слід зазначити, що в даному описі та формулі корисної моделі невизначена та визначена форми однини включають об'єкти, що визначаються, в множині, якщо контекст ясно не приписує інше. У даному описі, якщо не зазначено інше, термін "приблизно", який змінює кількість інгредієнта в системах доставки лікарських засобів або композиціях згідно з корисною моделлю чи застосовується в способах згідно з корисною моделлю, належить до варіювання чисельної величини, яке може зустрічатися, наприклад, при виконанні типових процедур вимірювання та поводження з рідинами, які застосовуються для одержання концентратів, або застосуванні розчинів на практиці; внаслідок неминучої помилки в цих процедурах; внаслідок відмінностей у отриманні, джерелі або чистоті інгредієнтів, які застосовуються для одержання систем доставки лікарських засобів чи композицій, або виконанні способів; і т.п. Термін "приблизно" також охоплює кількості, які відрізняються через різні рівноважні стани для композиції, яка утворюється в результаті з конкретної початкової суміші. Незалежно від того, чи модифікована формула корисної моделі терміном "приблизно", вона включає еквіваленти зазначених кількостей. У даному описі, якщо не зазначено інше, термін "система доставки лікарських засобів" належить до складу або пристрою, що доставляє терапевтичний агент(и) до бажаної ділянки (ділянок) тіла і/або забезпечує своєчасне вивільнення терапевтичного агента (агентів). У даному описі, якщо не зазначено інше, термін "розмір частинки" належить до Z-середнього діаметра, виміряного за допомогою динамічного розсіювання світла із застосуванням червоного лазера з довжиною хвилі 633 нм. Під виразом "ефективний середній розмір частинки менший, ніж приблизно 100 нм" розуміють, що щонайменше 90 % частинок мають розмір менший, ніж приблизно 100 нм, при вимірюванні за допомогою вищезгаданого способу. У даному описі, якщо не зазначено інше, термін "наночастинка" належить до мікроскопічної частинки, розмір якої вимірюється в нанометрах. Діаметр наночастинок згідно з корисною моделлю знаходиться, як правило, в діапазоні від приблизно 1 до приблизно 999 нм, і наночастинки можуть містити включену, інкапсульовану або вкладену біологічно активну молекулу. 3 UA 80243 U 5 10 15 20 25 30 35 40 45 50 55 60 У даному описі, якщо не зазначено інше, термін "розчинність" речовини належить до здатності цієї речовини бути розчиненою в зазначеному розчиннику при приблизно кімнатній температурі, під якою розуміють температуру від приблизно 15 °C до приблизно 38 °C. У даному описі, якщо не зазначено інше, термін "аморфний" указує на тверду структуру, яка або є некристалічною, або складається з дуже маленьких кристалів, що мають розмір частинок, який становить приблизно 10 нм або менше. У даному описі, якщо не зазначено інше, термін "цитотоксична сполука" належить до сполуки, яка має здатність придушувати ріст клітин або убивати клітини. У даному описі, якщо не зазначено інше, термін "цитостатична сполука" належить до сполуки, яка має здатність приводити клітини, хоча і необов'язково лізовані або убиті, у перманентний непроліферативний стан. У даному описі, якщо не зазначено інше, термін "похідна" належить до сполуки, утвореної з початкової структури або прямо, шляхом піддавання початкової структури хімічній реакції, або шляхом "модифікації", яка являє собою часткове заміщення початкової структури, або за допомогою дизайну й синтезу de novo. Похідні можуть бути синтетичними або можуть бути продуктами метаболізму клітини чи ферментативної реакції in vitro. У одному варіанті реалізації системи доставки лікарських засобів згідно з корисною моделлю, фармацевтично активна речовина має розчинність per se у воді щонайменше 4 мг/мл, і цей зазначений комплекс являє собою нековалентний комплекс, який має розчинність у воді менше 0,1 мг/мл. У іншому варіанті реалізації системи доставки лікарських засобів згідно з корисною моделлю, зазначений комплекс має ефективний середній розмір частинки менший, ніж приблизно 50 нм. Більш дрібні частинки з меншою ймовірністю будуть помічені ретикулоендотеліальною системою, яка захищає організм від інвазивних мікроорганізмів, таких як віруси та бактерії. У іншому варіанті реалізації даної корисної моделі, система доставки лікарських засобів містить щонайменше одну іншу фармацевтично активну речовину, яка має розчинність per se у воді меншу, ніж приблизно 100 мкг/мл, причому зазначена інша фармацевтично активна речовина перебуває в формі частинок із ефективним середнім розміром, меншим, ніж приблизно 100 нм, при цьому частинки зазначеної іншої фармацевтично активної речовини є по суті аморфними; частинки зазначеної іншої фармацевтично активної речовини включені разом із частинками зазначеного комплексу до зазначених наночастинок; і відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації до загальної маси зазначеної іншої фармацевтично активної речовини і зазначеного комплексу знаходиться в діапазоні, що становить від приблизно 1:1 до приблизно 5:1. У одному аспекті цього варіанта реалізації, зазначений комплекс має ефективний середній розмір частинки менший, ніж приблизно 50 нм. Згідно з додатковим аспектом цього варіанта реалізації, зазначена інша фармацевтично активна речовина має ефективний середній розмір частинки менший, ніж приблизно 50 нм, і/або зазначений комплекс має ефективний середній розмір частинки менший, ніж приблизно 50 нм. У іншому варіанті реалізації даної корисної моделі, щонайменше одна із зазначених фармацевтично активних речовин являє собою цитотоксичну або цитостатичну сполуку. У додатковому варіанті реалізації даної корисної моделі, зазначена щонайменше одна фармацевтично активна речовина являє собою цитотоксичну або цитостатичну сполуку. У одному аспекті цього варіанта реалізації, зазначена цитотоксична або цитостатична сполука являє собою протоновану форму доксорубіцину, мітоксантрону, епірубіцину, даунорубіцину, ідарубіцину, топотекану, іринотекану, вінбластину, вінкристину, вінорелбіну, амсакрину, прокарбазину, мехлоретаміну або їхньої комбінації. У більш конкретному аспекті цього варіанта реалізації, зазначена сполука являє собою протоновану форму доксорубіцину; в іншому більш конкретному аспекті цього варіанта реалізації, зазначена сполука являє собою протоновану форму мітоксантрону. У іншому аспекті варіанта реалізації даної корисної моделі, згідно з яким система доставки лікарських засобів містить щонайменше одну іншу фармацевтично активну речовину, яка має розчинність per se у воді меншу, ніж приблизно 100 мкг/мл, зазначена інша фармацевтично активна речовина являє собою цитотоксичну або цитостатичну сполуку. У додатковому аспекті цього варіанта реалізації, зазначена цитотоксична або цитостатична сполука являє собою таксан. У ще одному додатковому аспекті цього варіанта реалізації, зазначений таксан вибраний із паклітакселу, доцетакселу і їхніх похідних. У іншому аспекті цього варіанта реалізації, зазначена щонайменше одна фармацевтично активна речовина і зазначена інша 4 UA 80243 U 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично активна речовина являють собою цитотоксичні або цитостатичні сполуки; в одному аспекті цього варіанта реалізації, зазначена щонайменше одна фармацевтично активна речовина являє собою протоновану форму доксорубіцину, мітоксантрону, епірубіцину, даунорубіцину, ідарубіцину, топотекану, іринотекану, вінбластину, вінкристину, вінорелбіну, амсакрину, прокарбазину, мехлоретаміну або їхньої комбінації; у конкретному аспекті цього варіанта реалізації, зазначена сполука являє собою протоновану форму доксорубіцину; у додатковому конкретному аспекті цього варіанта реалізації, зазначена сполука являє собою протоновану форму мітоксантрону; в іншому конкретному аспекті цього варіанта реалізації, зазначена інша фармацевтично активна речовина являє собою таксан; у додатковому конкретному аспекті цього варіанта реалізації, зазначений таксан вибраний із паклітакселу, доцетакселу та їхніх похідних. Система доставки лікарських засобів згідно з корисною моделлю може бути отримана за допомогою способу, згідно з яким розмір зазначеного комплексу контролюють так, щоб ефективний середній розмір частинки становив менше, ніж приблизно 100 нм, шляхом підведення відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації до маси зазначеного комплексу, яке повинно знаходитися в діапазоні, що становить від приблизно 1:1 до приблизно 5:1. Коли - як обговорювали вище - система доставки лікарських засобів згідно з корисною моделлю містить щонайменше одну іншу фармацевтично активну речовину, яка має розчинність per se у воді меншу, ніж приблизно 100 мкг/мл, розмір зазначеної іншої фармацевтично активної речовини й частинок зазначеного комплексу може бути проконтрольований так, щоб ефективний середній розмір частинки становив менше, ніж приблизно 100 нм, шляхом підведення відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їхньої комбінації до загальної маси зазначеної іншої фармацевтично активної речовини і зазначеного комплексу, яке повинно знаходитися в діапазоні, що становить від приблизно 1:1 до приблизно 5:1. Система доставки лікарських засобів згідно з корисною моделлю може також бути отримана за допомогою способу, згідно з яким зазначену щонайменше одну фармацевтично активну речовину обробляють першим водним розчином натрієвої солі метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їхньої комбінації з утворенням частинок зазначеного комплексу; і утворені частинки зазначеного комплексу далі обробляють у другому водному розчині натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації доти, доки зазначені частинки зазначеного комплексу не розчиняться в зазначеному другому водному розчині. Зазначений перший водний розчин і зазначений другий водний розчин можуть являти собою той самий водний розчин, у якому загальна кількість натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їхньої комбінації є достатньою для утворення частинок зазначеного комплексу; і розчинення зазначеного комплексу. Коли система доставки лікарських засобів згідно з корисною моделлю містить щонайменше одну іншу фармацевтично активну речовину, яка має розчинність per se у воді меншу, ніж приблизно 100 мкг/мл, зазначена інша фармацевтично активна речовина може бути оброблена першим водним розчином натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації доти, доки зазначена інша фармацевтично активна речовина не розчиниться в зазначеному першому водному розчині; і зазначена щонайменше одна фармацевтично активна речовина може бути оброблена другим водним розчином натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації з утворенням частинок зазначеного комплексу; і утворені частинки зазначеного комплексу обробляють у зазначеному другому водному розчині з натрієвою сіллю метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньою комбінацією доти, доки зазначені частинки зазначеного комплексу не розчиняться в зазначеному другому водному розчині. Зазначений перший водний розчин і зазначений другий водний розчин можуть являти собою той самий водний розчин, у якому загальна кількість натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис 5 UA 80243 U 5 10 15 20 25 30 35 40 45 50 55 ретиноїлцистеїнової кислоти або їхньої комбінації є достатньою для розчинення іншої фармацевтично активної речовини; утворення частинок зазначеного комплексу; і розчинення зазначеного комплексу. Корисна модель буде проілюстрована більш докладно в наступних необмежуючих прикладах. Приклади Матеріали і методи Застосовувані склади були або свіжоприготовленими, або отриманими шляхом відновлення висушених сублімацією сумішей фармацевтично активних речовин із натрієвою сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньою комбінацією спеціалізованим розчином для відновлення. Доксорубіцин придбали в Mercian Corporation, Japan. Паклітаксел придбали в Sigma-Aldrich Sweden AB. Доцетаксел придбали в ScinoPharm Taiwan, Ltd. Мітоксантрон і Топотекан придбали в Chemtronica KB, Sweden. Адріаміцин придбали в аптеці й відновили відповідно до вказівок виробника із застосування препарату. Розмір частинок складів вимірювали за допомогою методу динамічного розсіювання світла із застосуванням червоного лазера (633 нм, аналізатор Nano-ZS, Malvern Instruments Ltd). Обчислювали середні значення трьох незалежних вимірювань для нанесення розмірів частинок на графік. Планки похибки по осі Y отримані шляхом додавання та віднімання величини стандартного відхилення вимірювань. Для оцінки цитотоксичності in vitro клітини різних ліній клітин пухлин людини придбали в American Type Culture Collection (Rockville, Md., USA): лінія клітин MDA-MB-231 аденокарциноми молочної залози людини (АТСС-НТВ-26, Lot 3576799), лінія клітин SKOV-3 аденокарциноми яєчників людини (АТСС-НТВ-77, Lot 3038337) і лінія клітин А549 недрібноклітинного раку легенів людини (АТСС-CCL-185, Lot 3244171). Клітини MDA-MB-231 культивували в культуральному середовищі MEM (модифіковане середовище Ігла) з додаванням 2 мМ L-глутаміну, 10 % фетальної бичачої сироватки (FBS) і антибіотиків. Клітини SKOV-3 культивували в культуральному середовищі McCoy's 5A (середовище Маккоя 5А) з додаванням 1,5 мМ Lглутаміну, 10 % FBS і антибіотиків. Усі середовища й добавки придбали в Sigma-Aldrich Co. (St. Louis, Mi., USA). Культивування клітин усіх ліній проводили в культуральних флаконах BD 2 Falcon™ площею 25 або 75 см (Becton Dickinson Labware). Клітини А549 культивували в культуральному середовищі Ham's F-12 (середовище Хема F-12) з додаванням 1 мМ Lглутаміну, 10 % FBS і антибіотиків. Культивування клітин усіх ліній проводили в культуральних 2 флаконах BD Falcon™ площею 25 або 75 см . Перевірку цитотоксичності лікарських препаратів виконували із застосуванням 96-лункових культуральних планшетів BD Falcon для адгезивних клітин (Becton Dickinson Labware). У ці 3 3 планшети висівали клітини в концентрації 8×10 клітин/лунка для клітин MDA-MB-231, 10×10 3 клітин/лунка для клітин SKOV-3 або 6×10 клітин/лунка для клітин А549 в об'ємі 200 мкл/лунка. І флакони, і культуральні планшети інкубували для росту клітин при 37 °C у зволоженій атмосфері, яка складається на 95 % з повітря й на 5 % з СО2. Клітинні культури в культуральних планшетах залишали прикріплюватися до поверхні протягом 24-годинної інкубації. На 1 день після посіву клітин 4 мкл розчинів складів, що підлягають перевірці, з різними концентраціями в підходящих розчинниках додавали до лунок з культурами (експерименти зі встановлення залежності між дозою та ефектом). До контрольних культур додавали 4 мкл розчинників як контроль ефекту розчинника. Клітини інкубували протягом 2-4 послідовних днів. Наприкінці періоду інкубації адгезивні клітини відокремлювали від поверхні обробкою трипсином, і число життєздатних клітин підраховували із застосуванням тесту, основаного на офарбленні клітин барвником трипановим синім, і гемоцитометра. Усі експерименти проводили щонайменше три рази і дані одержували з середнього значення трьох визначень, кожне з яких виконували в чотирьох повторностях. Результати виражали як середнє число клітин ± середньоквадратична помилка (SE), і відмінності між контрольними та дослідними серіями оцінювали за допомогою t-тесту Стьюдента. Цитотоксичність лікарських препаратів оцінювали на основі ступеня інгібування росту клітин. Інгібування росту клітин дослідними лікарськими препаратами розраховували із застосуванням наступної формули: Контроль Дослідна серія Інгібуванн я росту клітин % 100 Контроль У контрольних серіях 4 мкл різних розчинників, які застосовуються для перевірки лікарських препаратів, додавали до культур як негативні контролі розчинників. Відмінності між цими 6 UA 80243 U 5 10 15 20 25 30 35 40 45 50 55 60 контрольними серіями були незначущими; таким чином, середню величину для негативних контролів застосовували для розрахунків. ® Водні розчини Адріаміцину (ADRIAMYCIN ) (гідрохлориду доксорубіцину) і метанольні розчини доцетакселу застосовували як позитивні контролі. Відмінності в інгібуванні росту цими лікарськими препаратами в різних розчинниках були незначущими; таким чином, середню величину інгібування позитивними контролями застосовували для розрахунків. Середні значення концентрацій препаратів, що викликають 50 %-е інгібування росту клітин, (ІС50) ± SE, обчислювали на основі результатів щонайменше трьох незалежних експериментів. Фактори посилення (EF) розраховували шляхом ділення ІС50 контрольного лікарського препарату порівняння на ІС50 складу згідно з корисною моделлю. Приклад 1 Утворення нерозчинної у воді солі доксорубіцину та метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти Водний розчин натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти (2 мл, 5 мг/мл) і гідрохлориду доксорубіцину (6 мл, 2 мг/мл) одержували шляхом змішування в пробірці об'ємом 10 мл. Під час перемішування з'явився дрібнодисперсний осад. Осад відокремили за допомогою центрифугування пробірки при 3000 об/хв. протягом 10 хв. Супернатант видалили і осад перемішали шляхом струшування з 10 мл води зі ще одним наступним центрифугуванням. Після трьох додаткових процедур промивання, описаних вище, супернатант профільтрували через фільтр із діаметром пор 0,2 мкм для видалення можливих великих агрегатів продукту. Розчинність комплексу доксорубіцину, виміряна за допомогою методу УФ-спектроскопії при довжині хвилі 350 нм, становила 0,0002 мг/мл. Приклад 2 Приготування доксорубіцину, паклітакселу і натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти в співвідношенні мас./мас./мас, що становить 1:2,5:7 Метанольний розчин паклітакселу (200 мл, 1,2 мг/мл) і натрієвої солі метилового ефіру N-13цис-ретиноїлцистеїнової кислоти (134,4 мл, 5 мг/мл) одержували шляхом змішування в круглодонній колбі об'ємом 1000 мл і отриманий розчин упарили під вакуумом. Залишок розчинили у воді (120 мл) і до отриманого розчину додали краплями при перемішуванні водний розчин гідрохлориду доксорубіцину (48 мл, 2 мг/мл). Об'єднаний розчин перемішували протягом додаткових 30 хв., профільтрували через фільтр із діаметром пор 0,2 мкм і висушили сублімацією. Приклад 3 Приготування доксорубіцину, доцетакселу і натрієвої солі метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти в співвідношенні мас./мас./мас… що становить 1:1:4 Метанольний розчин доцетакселу (100 мл, 1 мг/мл) і натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти (80 мл, 5 мг/мл) одержували шляхом змішування в круглодонній колбі об'ємом 1000 мл і отриманий розчин упарили під вакуумом. Залишок розчинили у воді (100 мл) і до отриманого розчину додали краплями при перемішуванні водний розчин гідрохлориду доксорубіцину (50 мл, 2 мг/мл). Об'єднаний розчин перемішували протягом додаткових 30 хв., профільтрували через фільтр із діаметром пор 0,2 мкм і висушили сублімацією. Приклад 4 Приготування мітоксантрону, топотекану, паклітакселу і натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти в співвідношенні мас./мас./мас. що становить 2:1:20:40 Метанольний розчин паклітакселу (200 мл, 1,2 мг/мл) і натрієвої солі метилового ефіру Nповністю-транс-ретиноїлцистеїнової кислоти (96 мл, 5 мг/мл) одержували шляхом змішування в круглодонній колбі об'ємом 1000 мл і отриманий розчин упарили під вакуумом. Залишок розчинили у воді (120 мл) і до отриманого розчину додали краплями при перемішуванні водний розчин дигідрохлориду мітоксантрону (12 мл, 2 мг/мл) та водний розчин гідрохлориду топотекану (6 мл, 2 мг/мл). Об'єднаний розчин перемішували протягом додаткових 30 хв., профільтрували через фільтр із діаметром пор 0,2 мкм і висушили сублімацією. Приклад 5 Дослідження залежності розміру частинок від концентрації доксорубіцину в складі, утвореному доксорубіцином, доцетакселом, натрієвою сіллю метилового ефіру N-повністютранс-ретиноїлцистеїнової кислоти і натрієвою сіллю метилового ефіру N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас. = 1:1:1.65:1.65) Розчини одержували шляхом відновлення висушених сублімацією зразків сумішей доксорубіцину, доцетакселу, натрієвої солі метилового ефіру N-повністю-транс 7 UA 80243 U ретиноїлцистеїнової кислоти і натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти (мас./мас./мас. = 1:1:1,65:1,65) у водному розчині, який містить NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл). Таблиця 1 Концентрація доксорубіцину, мг/м л 0,06 0,125 0,25 0,5 1,0 Середній розмір частинки, нм 27,3 28,7 29,3 34,7 48,3 Станд. відх. 0,9 1,2 1,9 2,1 3,1 5 10 15 Як показано в Таблиці 1 і на Фігурі 1, більш низькі концентрації доксорубіцину призводять до менших розмірів частинок у діапазоні концентрацій, що становить 0,25-1 мг/мл. Подальше розведення не впливає значущо на розмір частинок. Приклад 6 Дослідження синергізму дії доксорубіцину і доцетакселу в культурах клітин лінії SKOV-3 аденокарциноми яєчників людини Застосовували висушені сублімацією склади з доксорубіцину/доцетакселу/метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти/метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти, які містять еквімолярні кількості доксорубіцину і доцетакселу (мас./мас./мас./мас. = 1:1,4:2:2). EF обчислювали в порівнянні з Адріаміцином. Величини ІС 50 для сумішей доцетакселдоксорубіцин основані на сумарній кількості цитостатичних препаратів. Результати представлені в Таблиці 2 нижче. Таблиця 2 Розмір Розчинник частинки, ІС50 день 3 нм ® Адріаміцин (ADRIAMYCIN ) 9 мг/мл 10(8,5±0,27)· 8 (доксорубіцин) NaCl 10(9,07±0,38)· Доцетаксел Метанол 8 Послідовні додавання Адріаміцину 9 мг/мл ® 10(ADRIAMYCIN ) і доцетакселу в NaCl і (2,0±0,11)· 8 молярному співвідношенні 1:1 метанол NaCl (5,9 мг/мл), КСl (0,3 мг/мл), Доксорубіцин/доцетаксел/метиловий СаСl2 ефір N-повністю-транс(0,295 ретиноїлцистеїнової 10мг/мл), 28 (4,6±0,27)· 9 кислоти/метиловий ефір N-13-цисгексагідрат ретиноїлцистеїнової кислоти MgCl2 (0,2 (мас./мас./мас./мас. = 1:1,4:2:2) мг/мл), ацетат натрію (4,1 мг/мл) Склад 20 25 EF день 3 ІС50 день 4 (4,8±0,16)· 8 10 (2,85±0,26)· 8 EF день 4 10 10 4,3 (4,7±0,32)· 9 10,0 10 18,5 (1,8±0,08)· 9 26,7 На сильний синергетичний ефект доксорубіцину і доцетакселу вказує той факт, що EF для послідовних додавань доксорубіцину і доцетакселу перевищує 1. Створення складу на основі наночастинок додатково підвищує ефективність комбінації. Приклад 7 Оцінка цитотоксичності складів у культурах клітин лінії MDA-MB-231 аденокарциноми молочної залози людини Склади, які містять суміш комплексів метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти і метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти, були 8 UA 80243 U отримані шляхом розчинення висушеного сублімацією порошку. Величини IC50 були основані на концентрації доксорубіцину. Фактори посилення обчислювали в порівнянні з доксорубіцином. Результати представлені в Таблиці 3 нижче. Таблиця 3 Склад Адріаміцин (доксорубіцин) ® (ADRIAMYCIN ) Доксорубіцин/доцетаксел/метиловий ефір N-повністю-трансретиноїлцистеїнової кислоти/метиловий ефір N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас./мас. = 1:1:1,65:1,65) Доксорубіцин/ паклітаксел/метиловий ефір Nповністю-транс-ретиноїлцистеїнової кислоти/метиловий ефір N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас./мас. = 1:2,5:3:3) Розмір Розчинник частинки, нм 9 мг/мл NaCl NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), 34 гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл) NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), 27 гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл) EF EF IC50 день 3 день IC50 день 4 день 3 4 1010(1,9±0,13)· (5,1±0,17)· 7 8 (2,4±0,16)· 8 10 (1,1±0,11)· 8 (1,8±0,06)· 9 10 7,9 10 (1,5±0,07)· 9 10 17,3 28,3 34,0 5 10 Приклад 8 Оцінка цитотоксичності складів у культурах клітин лінії SKOV-3 аденокарциноми яєчників людини Склади, що містять суміш комплексів метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти і метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти, були отримані шляхом розчинення висушеного сублімацією порошку. Величини ІС 50 були основані на концентрації доксорубіцину. Фактори посилення обчислювали в порівнянні з доксорубіцином. Результати представлені в Таблиці 4 нижче. 9 UA 80243 U Таблиця 4 Розчинник Склад Адріаміцин ® (ADRIAMYCIN ) (доксорубіцин) Доксорубіцин/ доцетаксел/метиловий ефір N-повністютрансретиноїлцистеїнової кислоти/метиловий ефір N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас./мас. = 1:1:1,65:1,65) Доксорубіцин/ паклітаксел/метиловий ефір N-повністютрансретиноїлцистеїнової кислоти/метиловий ефір N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас./мас. = 1:2,5:3:3) 5 10 Розмір частинки, нм ІС50 день 3 9 мг/мл NaCl (8,5±0,27)· 8 NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл) 34 (9,3±0,49)· 9 NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл) 27 (1,1±0,06)· 8 EF день 3 ІС50 день 4 10 (4,8±0,16)· 8 10 9,1 (3,0±0,15)· 9 10 7,7 EF день 4 (5,7±0,18)· 9 10 10 16,0 10 8,4 Приклад 9 Оцінка цитотоксичності складів у культурах клітин лінії А549 недрібноклітинного раку легенів людини Склади, що містять суміш комплексів метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти і метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти, були отримані шляхом розчинення висушеного сублімацією порошку. Величини ІС50 були основані на концентрації доксорубіцину. Фактори посилення обчислювали в порівнянні з доксорубіцином. Результати представлені в Таблиці 5 нижче. Таблиця 5 Склад Адріаміцин (доксорубіцин) ® (ADRIAMYCIN ) Доксорубіцин/доцетаксел/метиловий ефір N-повністю-трансретиноїлцистеїнової кислоти/метиловий ефір N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас./мас. = 1:1:1,65:1,65) Розмір Розчинник частинки, нм 9 мг/мл NaCl NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), 34 гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл) 10 EF EF IC50 день 3 день ІС50 день 4 день 3 4 1010(1,2±0,09)· (2,7±0,21)· 8 8 (2,7±0,12)· 9 10 4,4 (3,5±0,22)· 9 10 7,7 UA 80243 U Продовження таблиці 5 Доксорубіцин/паклітаксел/метиловий ефір N-повністю-трансретиноїлцистеїнової кислоти/метиловий ефір N-13-цисретиноїлцистеїнової кислоти (мас./мас./мас./мас. = 1:2,5:3:3) 5 NaCl (5,9 мг/мл), КСl (0,3 мг/мл), СаСl2 (0,295 мг/мл), гексагідрат MgCl2 (0,2 мг/мл), ацетат натрію (4,1 мг/мл) 27 (3,6±0,11)· 9 10 3,3 (1,9±0,14)· 9 10 14,2 Незважаючи на те, що корисна модель була описана стосовно деяких варіантів реалізації, включаючи кращий варіант, відомий у даний час винахідникам, варто розуміти, що різні зміни й модифікації, як повинно бути очевидним для середнього фахівця в даній області техніки, можуть бути здійснені без виходу за рамки корисної моделі, зазначені в доданій до даної заявки формулі корисної моделі. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 10 15 20 25 30 35 40 45 1. Система доставки лікарських засобів для введення щонайменше однієї фармацевтично активної речовини, яка сама по собі є катіонною амфіфільною речовиною, при цьому фармацевтично активна речовина перебуває в системі доставки лікарських засобів у вигляді частинок комплексу зазначеної фармацевтично активної речовини і натрієвої солі метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цисретиноїлцистеїнової кислоти або їхньої комбінації, причому зазначені частинки зазначеного комплексу мають ефективний середній розмір менший, ніж приблизно 100 нм, при цьому - частинки зазначеного комплексу є по суті аморфними; - частинки зазначеного комплексу укладені до наночастинок, утворених натрієвою сіллю метилового ефіру N-повністю-транс-ретиноїлцистеїнової кислоти, натрієвою сіллю метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньою комбінацією; і - відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації до маси зазначеного комплексу знаходиться в діапазоні, що становить від приблизно 1:1 до приблизно 5:1. 2. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що зазначена фармацевтично активна речовина має розчинність per se у воді щонайменше 4 мг/мл, і зазначений комплекс являє собою нековалентний комплекс, який має розчинність у воді меншу за 0,1 мг/мл. 3. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що зазначений комплекс має ефективний середній розмір частинок менший, ніж приблизно 50 нм. 4. Система доставки лікарських засобів за п. 1, яка містить щонайменше одну іншу фармацевтично активну речовину, яка має розчинність per se у воді меншу, ніж приблизно 100 мкг/мл, причому зазначена інша фармацевтично активна речовина перебуває в формі частинок із ефективним середнім розміром меншим, ніж приблизно 100 нм, при цьому - частинки зазначеної іншої фармацевтично активної речовини є по суті аморфними; - частинки зазначеної іншої фармацевтично активної речовини укладені разом із частинками зазначеного комплексу до зазначених наночастинок; і - відношення маси зазначеної натрієвої солі метилового ефіру N-повністю-трансретиноїлцистеїнової кислоти, натрієвої солі метилового ефіру N-13-цис-ретиноїлцистеїнової кислоти або їхньої комбінації до загальної маси зазначеної іншої фармацевтично активної речовини і зазначеного комплексу знаходиться в діапазоні, що становить від приблизно 1:1 до приблизно 5:1. 11 UA 80243 U 5. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що щонайменше одна із зазначених фармацевтично активних речовин являє собою цитотоксичну або цитостатичну сполуку. 12 UA 80243 U Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюDrug delivery system
Автори англійськоюAleksov Julian, Lokot Igor
Назва патенту російськоюСистема доставки лекарств
Автори російськоюАлексов Джулиан, Локот Игор
МПК / Мітки
МПК: C11D 1/38, C07D 311/72
Мітки: доставки, система, ліків
Код посилання
<a href="https://ua.patents.su/15-80243-sistema-dostavki-likiv.html" target="_blank" rel="follow" title="База патентів України">Система доставки ліків</a>
Попередній патент: Пристрій перетворення зворотно-поступального руху у зворотно-обертальний
Наступний патент: Система профілів зовнішніх світлопрозорих огороджувальних будівельних конструкцій будівель та споруд
Випадковий патент: Ведена зірочка нижньої опори демонстраційної установки